-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úloha ukazatelů kostního metabolismu v hodnocení myelomové kostní nemoci
The role of bone metabolism parameters in the assessment of myeloma bone disease
The aim of this contribution is to present up to date information regarding bone metabolism in multiple myeloma (MM). Special attention is dedicated to the general role of bone remodellation markers in the assessment of myeloma bone disease (MBD), and the parameters of bone resorption and osteogenesis from the point of their significance in clinical practice. Individual chapters aim at the relationship of bone resorption and osteogenesis markers to the severity of MBD, and to the stage, grade, activity and prognosis of multiple myeloma, and differences between monoclonal gammopathy of undetermined significance (MGUS) and MM. Interest is dedicated to the contribution of monitoring of bone resorption markers, i.e. S-ICTP and U-NTX, and not very satisfactory significance of osteogenesis markers, i.e. S-bALP and S-osteocalcin in the course of MM treatment including anti-resorption treatment with bisphosphonates. We present information about new and perspective molecules involved in bone remodellation process in MM, i.e. RANKL/osteoprotegerin index, Dickkopf-1 (Dkk-1), activin-A and osteosclerostin. The outcome of the paper is the summary of convenient markers of bone metabolism, recommended for the use in standard clinical practice by International Myeloma Working Group.
Keywords:
multiple myeloma, myeloma bone disease, bone resorption markers (S-ICTP, U-NTX, S-TRACP-5b), osteogenesis markers (S-bALP, S-osteocalcin), RANKL/osteoprotegerin, DKK-1, therapy.
Autoři: V. Ščudla 1; P. Petrová 2; P. Lochman 2; J. Minařík 1; T. Pika 1; J. Bačovský 1
Působiště autorů: III. interní klinika-nefrologická, revmatologická a endokrinologická FN a LF UP Olomouc 1; Oddělení klinické biochemie FN a LF UP Olomouc 2
Vyšlo v časopise: Klin. Biochem. Metab., 21 (42), 2013, No. 2, p. 71-78
Souhrn
Náplní sdělení je podání aktuální informace o významu vyšetřování ukazatelů kostního metabolismu u mnohočetného myelomu (MM). Hlubší pozornost je věnována obecnému postavení markerů kostní remodelace v hodnocení myelomové kostní nemoci (MKN) a ukazatelů kostní resorpce i novotvorby z hlediska jejich významu pro klinickou praxi. Samostatné kapitoly jsou věnovány vztahu markerů kostní resorpce a kostní novotvorby k tíži MKN, stupni pokročilosti, aktivity a prognózy MM a odlišnostem mezi monoklonální gamapatií nejistého významu a MM. Zvláštní pozornost je věnována nepochybnému přínosu monitorování markerů osteoresorpce, zejména S-ICTP a U-NTX a neuspokojivému významu ukazatelů kostní novotvorby, tj. S-bALP a S-osteokalcinu v průběhu léčby MM a antiresorpční terapie bisfosfonáty. Stranou nezůstala ani informace o nových, perspektivních molekulách, majících vztah k procesu kostních změn u MM, tj. indexu RANKL/osteo-protegerin, Dickkopf-1 (DKK-1), activinu-A a osteosklerostinu. Vyústěním sdělení je přehled vhodných markerů kostního obratu, doporučených pro potřeby standardní klinické praxe International Myeloma Working Group.
Klíčová slova:
mnohočetný myelom, myelomová kostní choroba, markery kostní resorpce ( S-ICTP, U-NTX, S-TRACP-5b), markery kostní novotvorby (S-bALP, S-osteokalcin), RANKL/osteoprotegerin, DKK-1, terapie.Úvod
Mnohočetný myelom (MM) je zhoubné onemocnění krvetvorného systému, vyznačující se nekontrolovanou proliferací a akumulací nádorově transformovaných plazmocytů, provázených produkcí monoklonálního imunoglobulinu (MIg) a projevy orgánové dysfunkce charakteru CRAB (C-hyperkalcémie, R-renální postižení, A-anémie, B-postižení skeletu tj. „bone disease“) [1]. U MM nejde o samostatné postižení krvetvorného systému, ale o současné pestré, vcelku patognomonické postižení skeletu, označované jako myelomová kostní nemoc (MKN). MM je onemocnění s nejvyšší, 80% incidencí kostního postihu ze všech zhoubných onemocnění v období manifestace nemoci [2]. Různě výrazné postižení skeletu u MM, vyznačující se především přítomností kostních bolestí, osteolytickým postižením skeletu, často i patologických zlomenin a hyperkalcémie, přináší výrazné snížení kvality života a je nejvýznamnější příčinou vysoké morbidity a mortality se zkrácením celkového přežití [2]. MKN je výsledkem disharmonie kostní homeostázy, vyznačující se rozpřažením procesů osteoresorpce a osteoformace v důsledku vystupňované osteoklastické (OKL) kostní resorpce a omezené, případně zcela potlačené osteo-blastické (OBL) novotvorby, navozené modulujícím účinkem mnoha specifických cytokinů a chemokinů [3 - 7]. V případě MKN se výsledný kostní deficit projevuje přítomností osteoporózy (OSP), mnohočetných osteo-lytických lézí osového skeletu a patologických kostních zlomenin. Vlastní osteoklastogenní efekt, vyvolaný zásahem do proliferace, diferenciace, aktivace a apoptózy prekurzorů OKL je indukován především myelomovými plazmocyty, jejichž interakce se stromálními a dalšími elementy mikroprostředí kostní dřeně vede k nekontrolované produkci osteoklastogenních působků [8]. Stěžejní úlohu v rozvoji MKN hraje imbalance klíčových signálních drah, především osy RANKL (liganda aktivátoru receptoru NF-κB), OPG (osteoprotegerin) a RANK i systému CCL3/CCR1, uplatňující se v aktivaci OKL-resorpce, z opačné strany ale Wnt-signální dráhy, jejíž inhibice, např. působků DKK-1 (Dickkopf-1), FRP-2 (freezle related protein) ale i osteosklerostinu a activinu-A) vede k útlumu OBL-osteoformace [9, 10]. Rozsah kostní destrukce u rozvinuté, symptomatické fáze MM je v období progrese či relapsu nemoci provázen vysokou produkcí RANKL, RANK, DKK-1, sklerostinu, activinu-A, CCL-3, MIP-1α aj. v mikroprostředí kostní dřeně a vysokými hladinami v krvi [11]. Kostní remodelace se v případě MKN vymyká přirozeným mechanismům, přestává reagovat na běžné osteotropní působky, např. na hladinu ionizovaného vápníku, vitaminu D a/nebo kalcitoninu a parathormonu, takže i v případě dosažení remise myelomu dochází k hojení kostních lézí pouze vzácně [12]. Podrobnější popis patofyziologie, klinického obrazu a diagnostiky MKN, včetně použití moderních zobrazovacích metod a současných přístupů k léčbě postižení skeletu u MM byl náplní předchozích sdělení [4, 5, 11-13].
Předložené sdělení se zaměřilo na shrnutí významu vyšetřování sérových hladin, případně močového odbytu nejdůležitějších markerů kostního metabolismu v různých fázích průběhu MM, resp. v různých stupních pokročilosti MKN, a to především z hlediska využití v běžné klinické praxi.
Ukazatelé kostní remodelace
V průběhu posledních 20 let byly izolovány buněčné a extracelulární komponenty kostní matrix, což umožnilo vyvinutí řady biochemických metodik, umožňujících vyšetření dnes již široké plejády specifických markerů kostní resorpce (OR) a kostní formace (OF) [14, 15]. Většina ukazatelů OR, avšak v mnohem menší míře OF je v pokročilé fázi MKN abnormální a umožňuje neinvazivním a ekonomicky nenáročným způsobem kontinuální monitorování dynamiky, tj. aktivity nebo vyhasnutí kostního procesu v průběhu nádorového stavu. Jejich vyšetření přispívá k brzké diagnostice MKN, k hodnocení tíže osteodestrukce, k časnému rozpoznání hrozící progrese MKN a vývinu kostních fraktur, ale i progrese MM, odhadu jeho prognózy a monitoraci účinku antimyelomové a antiresorpční léčby včetně perspektivní terapie působky inhibujícími RANKL a DKK-1 [11-13, 15-17]. Jejich širšímu využití v klinické praxi však prozatím brání jednak interpretační omezení, ztěžující korektní hodnocení naměřených hodnot v důsledku vlivu cirkadiánního rytmu, věku, pohlaví, stravy, stavu renální funkce a/nebo použitých léků, ale i absence standardizace vyšetřovacích technik na různých biochemických pracovištích. Nutno uvést, že výsledky vyšetření markerů kostního obratu jsou výrazem celotělového kostního procesu a poskytují proto omezenou informaci o charakteru a tíži lokálních změn [14]. Z těchto důvodů nebyl doposud sestaven všeobecně platný konsenzus, a proto i v současnosti není analýza kostních markerů součástí současných diagnostických a stážovacích algoritmů u MM. Přesto IMWG (International Myeloma Working Group) zpracovala „IMWG report 2010“, shrnující současný stav znalostí, včetně výběru vhodných markerů OR a OF pro potřeby běžné klinické praxe [14].
Ukazatelé kostní resorpce
Většina ukazatelů OR jsou degradační produkty kolagenu kostní matrix, vznikající v důsledku zvýšené aktivity OKL. Pouze TRACP-5b (tartrát-rezistentní kyselá fosfatáza-5b) je enzym, vytvářený přímo aktivovanými OKL a je využíván jako indikátor celkového počtu aktivovaných OKL [15, 18, 19]. Bylo zjištěno, že zvýšené hladiny markerů OR v séru, nebo odpad močí převyšující normální stav, mají významný vztah k tíži MKN, k výskytu patologických fraktur, stupni pokročilosti, (klinickému stádiu), zvýšené aktivitě (progresi nebo relapsu) MM [13, 14, 18, 20]. Nejvýznamnější ukazatelé OR včetně specifikace příslušné analytické metody byly shrnuty Commitee of Scientific Advisors of the International Osteoporosis Foundation (Tabulka 1) [21]. Z dosavadních zkušeností vyplývá, že u MM má největší přínos vyšetření a monitorování odpadu NTX močí (U-NTX) a sérové hladiny ICTP (S-ICTP), případně i S-CTX a S-TRACP-5b. Vzhledem ke specifitě NTX, ICTP a CTX ke kolagenu typu I a jejich unikátním charakteristikám nahradily tyto markery dříve používané vyšetřování odpadu hydroxyprolinu, hydroxylyzinu, galaktozyl-hydrolyzinu a pyridinolinu močí a deoxypyridinolinu v séru/plazmě a/nebo v moči [14, 22]. Při analýze U-NTX se používá přepočet na hodnotu S - kreatininu.
Tab. 1. Myeloma bone disease – markers of bone resorption (According to „Commitee of Scientific Advisors of the International Osteoporosis Foundation“, 21) 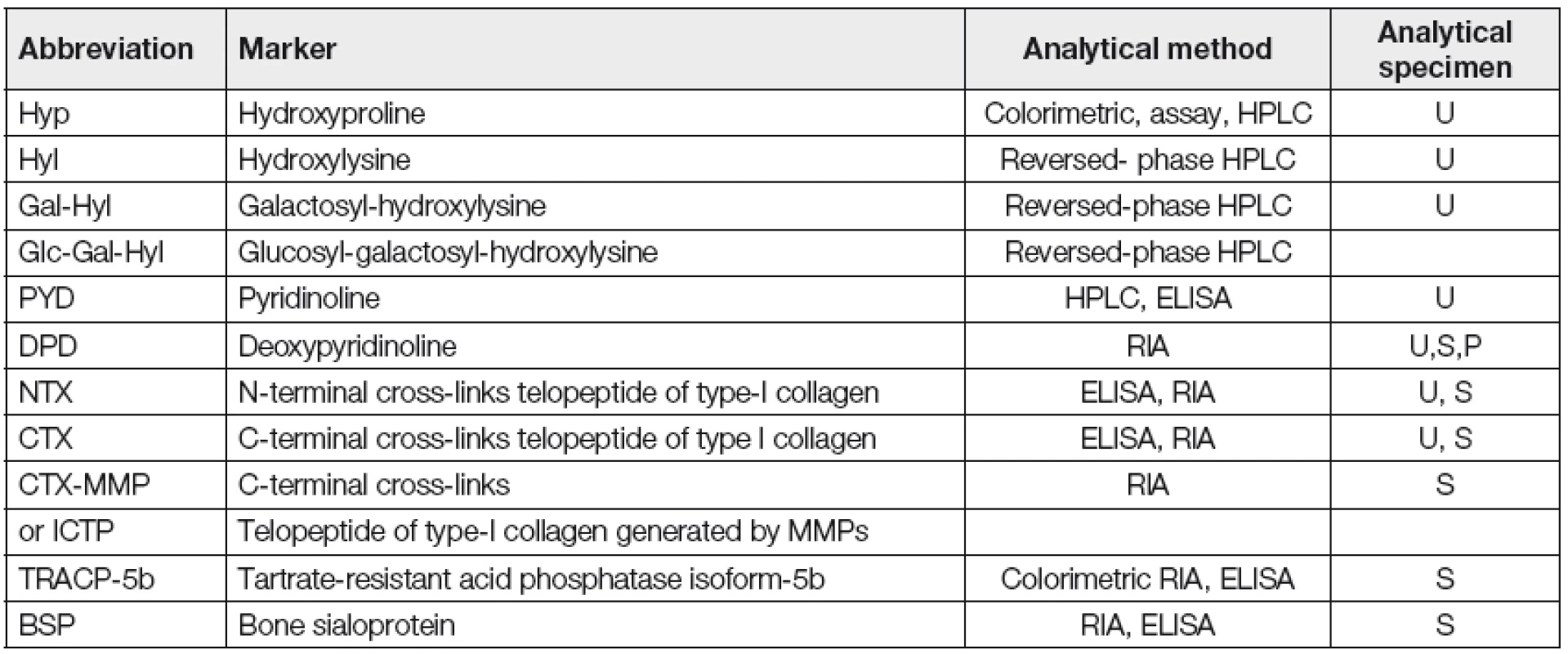
ELISA-enzyme-linked immunosorbent assay; HPLC-high performance liquid chromatography; MMP-matrix metalloproteinase; RIA-radioimmunoassay; U-urine; S-serum; P-plasma Stručný rozbor srovnání výsledků vyšetření nejvýznamnějších markerů OR u MM a u normálních jedinců, vyhodnocení jejich vztahu k tíži MKN a k prognóze MM vyplývá z analýzy 16 studií z období 1996-2008 provedených E.Terposem (Tabulka 2) [14, 23-26]. Je zřejmé, že hodnoty markerů OR jsou u nemocných s MM oproti zdravým jedincům vesměs zvýšeny. U všech markerů OR byl prokázán těsný vztah k závažnosti MKN, v případě S-ICTP a U-NTX ke klinickému stádiu MM, tj. významně vyšší hladiny ve stádiu II-III vs. I, vyhodnoceném podle Durieho-Salmona (D-S) a k predikci časné progrese MM a v případě S-ICTP i úzký vztah k celkové délce přežití. Markery OR rovněž přispívají k odlišení MGNV (monoklonální gamapatie nejistého významu) od MM, neboť zvýšené hladiny S-ICTP umožnily rozpoznání přítomnosti MKN přes negativitu konvenční radiografie skeletu, zatímco při použití mnohem citlivější MRI byla prokázána shoda v 79 % [27]. Bylo zjištěno, že výše odpadu NTX močí/24 hod. významně korelovala s výsledkem Tc99m-MIBI, s procentuálním zastoupením myelomových plazmocytů v kostní dřeni a s výskytem patologických kostních fraktur [28]. V široce koncipované prospektivní studii, založené na analýze souboru 210 nemocných s MM léčených konvenční chemoterapií a kyselinou zoledronovou (ZA) byl prokázán významný rozdíl střední (50-99 nM/nM kreatininu) a vysoké hodnoty U-NTX (< 100 nM/BCE kreatininu) oproti hodnotě nízké (< 50 nmol/l) z hlediska rizika vývinu první (p=0,008) a všech patologických zlomenin (0,016) a k délce celkového přežití [29]. Sérové hladiny ICTP byly použity rovněž k prohloubení prognostické senzitivity ISS (International Staging System) u jedinců léčených chemoterapií: pětileté přežití nemocných s MM, rozčleněných do čtyř prognostických skupin činilo 95, 65, 46 a 22 % [30]. Nutno ale poznamenat, že vztah S-ICTP k prognóze MM není jednoznačný, neboť přes předchozí pozitivní zprávy vyzněla námi provedená separátní prognostická analýza v souboru MM léčeném transplantací autologních kmenových krvetvorných buněk nevýznamně [31, 32]. Je zřejmé, že případný prognostický potenciál klíčových markerů OR je nutno aktuálně vyhodnotit v současném období velmi účinné biologické léčby.
Tab. 2. Myeloma bone disease- eleven publication analysis (1996-2010) of markers of bone resorption (14) 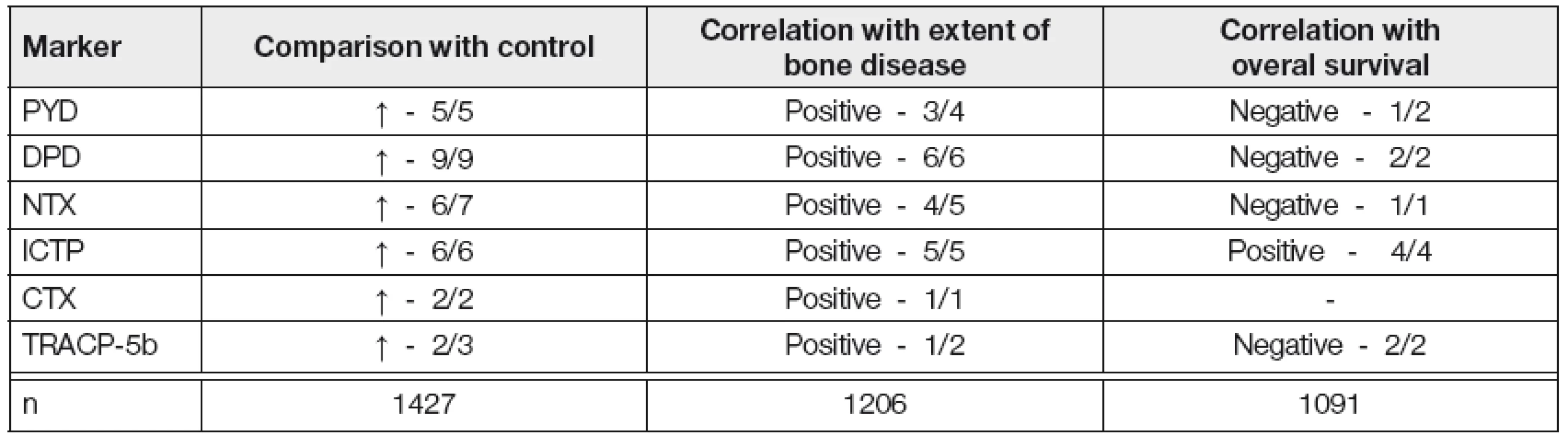
PYD-pyridinoline; DPD-deoxypyridinoline; NTX-N-terminal cross links telopeptide of type-1 collagen; ICTP-C-terminal cross-links telopeptide of type-I collagen generated by metalloproteinase; CTX-C terminal cross-links telopeptide of type-I collagen; TRACP 5b-tartrate-resistant acid phosphatase isoform-5b; n-number of analysed multiple myeloma patients. Sekvenční vyšetřování markerů OR je vhodné i pro monitorování průběhu MM, neboť byla prokázána dobrá korelace s ukazateli aktivity MM, např. s hladinami IL-6 a β2-mikroglobulinu v séru [26]. V případě S-ICTP a U-NTX byl rozpoznán dobrý vztah k predikci časné progrese MKN, k detekci stabilní a aktivní fáze MM, k rozpoznání podskupiny nemocných s AMM (asymptomatická fáze MM) s přechodem do aktivní, symptomatické fáze MM (SMM) [33]. Vysoké hodnoty S-ICTP a U-NTX jsou některými autory považovány za jeden z indikátorů časného nasazení antimyelomové a antiresorpční léčby bisfosfonáty (BFN) [14, 34, 35].
Ukazatelé kostní novotvorby
Markery kostní novotvorby, považované za indikátory OBL osteoformace jsou přímé nebo nepřímé produkty OBL kolující v krvi. Jejich hladiny mohou být v různých fázích MM normální, občasně ale i sníženy nebo zvýšeny. Jejich klinický přínos pro hodnocení vývoje MKN, stejně jako průběhu MM je omezený, neboť četné studie odhalily vysokou variabilitu, resp. rozporuplnost zjištěných nálezů [13, 14]. Z klinického hlediska jsou nejupotřebitelnější markery OF, vytypované Commitee of Scientific Advisors of the International Osteoporosis Foundation a shrnutých včetně doporučených analytických metod tabelárně (Tabulka 3) [14, 21]. Za relativně nejvhodnější indikátor celkové aktivity OF u MM je považována sérová hladina kostní formy alkalické fosfatázy (S-bALP). Hladina tohoto membránového enzymu OBL dobře koreluje s histologickým obrazem zvýšené kostní novotvorby. Zvýšené hodnoty provázejí čerstvě vzniklou frakturu a její reparaci, nebyl ale zjištěn vztah ke klinickému obrazu, rozsahu a stádiu MKN i k celkové délce přežití nemocných s MM. Dalším používaným markerem OF je S-osteokalcin (S-OC), tj. nekolagenní protein kostní matrix vážící vápník, vytvářený převážně OBL. Jeho hladiny bývají v iniciální, asymptomatické fázi MM zvýšeny, zatímco v rozvinuté, symptomatické fázi jsou hladiny S-OC a S-bALP v důsledku inhibice OBL v aktivní fázi SMM nízké, dokonce i nižší nežli u MGNV. Rovněž v případě sérových hladin S-OC, tedy obdobně jako u S-bALP nebyl zjištěn vztah k rozsahu kostní destrukce u MKN, stádiu MM a k celkovému přežití (Tabulka 4) [13, 14]. Vyšetřování hladin PICP a PINP, považovaných za indikátory syntézy kolagenu OBL se u MM neosvědčily. Analýza souboru 268 nemocných s MM a MGNV provedená na našem pracovišti, zaměřená na diagnostický přínos vyšetření vybraných markerů OR a OF prokázala statisticky významné rozdíly sérových hladin ICTP (p < 0,9991), PINP (p=0,001) a osteoprotegerinu (p=0,00001) mezi jedinci s MGUS a nemocnými s MM (stádium 1-3 dle D-S), zatímco srovnání MGNV oproti stádiu-1 vyznělo nevýznamně [31]. Příčina proměnlivosti a diskrepance naměřených hodnot markerů OF není zcela jasná a přínos pro vlastní klinickou praxi sporný.
Tab. 3. Myeloma bone disease- markers of bone formation (According to „Commitee of Scientific Advisors of the International Osteoporosis Foundation“, 21) 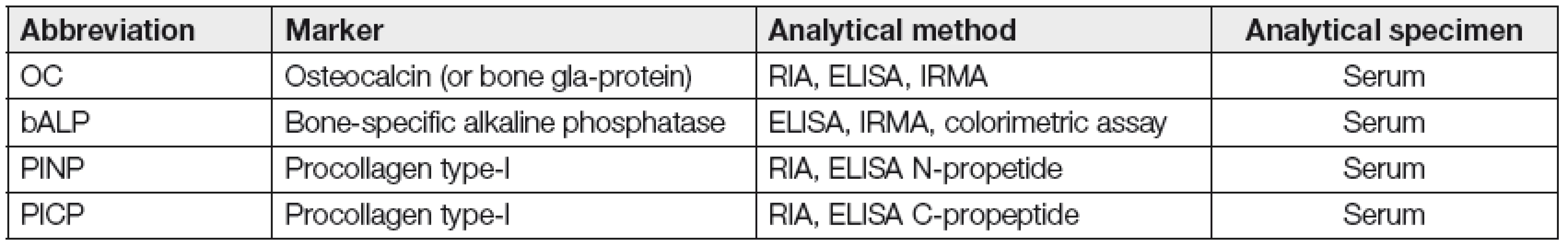
ELISA- enzyme –linked immunosorbent assay; RIA-radioimmunoassay; IRMA-immunoradiometric assay. Tab. 4. Myeloma bone disease- eleven publication analysis (1996-2010) of markers of bone formation (14) 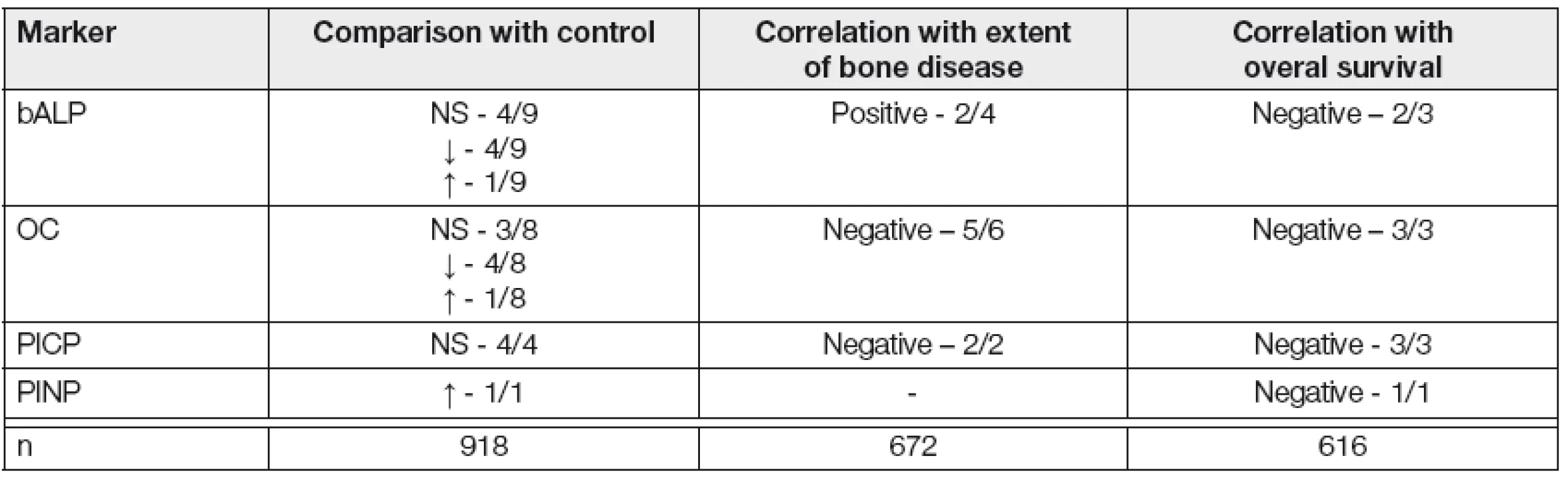
bALP-bone-specific alkaline phosphatase; OC-osteocalcin; PICP-procollagen type I C-propeptide; PINP-procollagen type I N-propetide; NS-not significicant; n-number of analysed multiple myeloma patients Význam ukazatelů kostního obratu v hodnocení antiresorpční léčby bisfosfonáty
Dosavadní výsledky jednoznačně dokládají nepochybný přínos ukazatelů OR v monitorování účinnosti terapie BFN a především v rozpoznání nemocných s příznivým léčebným účinkem [14, 17, 19]. Řada studií prokázala v případě terapie SMM s přítomností osteolytických lézí chemo-imunoterapií a antiresorpční léčbou klodronátem (CLO), pamidronátem (PAM) a kyselinou zoledronovou (ZA) pozitivní léčebnou odezvu dokumentovanou různě výrazným poklesem ukazatelů OR, tj. ICTP, NTX, CTX a/nebo TRACP-5b [25]. Zejména úprava původně zvýšených ukazatelů OR v odstupu tří měsíců od zahájení antiresorpční léčby PAM a ZA je považována za indikátor dobré prognózy nemoci a snížení nebezpečí SRE (skeletal related event) [33, 35]. Rovněž po antiresorpční terapii monoklonální protilátkou proti RANKL (denosumab) byl zaznamenán rychlý a hluboký pokles odbytu U - NTX, předběžné výsledky pilotní studie u MM ale prokázala zkrácení celkového přežití [36]. Bylo zjištěno, že persistence vysokých hodnot markerů OR v odstupu tří měsíců od zahájení antiresorpční léčby PAM a ZA umožňuje rozpoznání nemocných refrakterních na terapii BFN, ohrožených vysokým rizikem progrese osteodestrukce včetně patologických zlomenin a dokonce i časné smrti. V případě odhalení rezistence na terapii BFN je nutno pomýšlet možnost OKL-independentní formy osteoresorpce a přistoupit ke změně terapie [33, 35]. Za nepříznivý prognostický faktor v rámci terapie BFN je některými autory považována rovněž perzistence zvýšených hodnot PINP a bALP, tedy markerů OF [33, 36, 37].
Vliv antimyelomové léčby biologickými působky a BFN na ukazatele kostní remodelace
Některé studie posledních let prokázaly, že moderní léčba MM biologickými působky tj. thalidomidem a bortezomibem v kombinaci s BFN, a to i v relabující, či refrakterní fázi MM je provázena významným poklesem markerů OR včetně hladin sRANKL, indexu RANKL/OPG, DKK-1 a MIP-1α a dle některých studií bez ohledu na dosažení celkové léčebné odezvy (Tabulka 5) [38 - 43]. Pouze v případě terapie inhibitorem proteozomu bortezomibem byl zaznamenán osteo-anabolický efekt, dokumentovaný zmnožením OBL v kostní tkáni a vzestupem hladiny S-bALP a S-OC [19, 20, 41, 42, 44]. Ověření ovšem vyžaduje sporadické pozorování, že benefiční efekt na populaci OBL v kostní tkáni, pozorovaný po terapii bortezomibem potlačuje současná chemoterapie, např. režimem VMDT (velcade, melfalan, dexametazon, thalidomid) [43].
Tab. 5. Myeloma bone disease – clinical studies for the effect of novel biological anti-myeloma agents on bone metabolism (14) 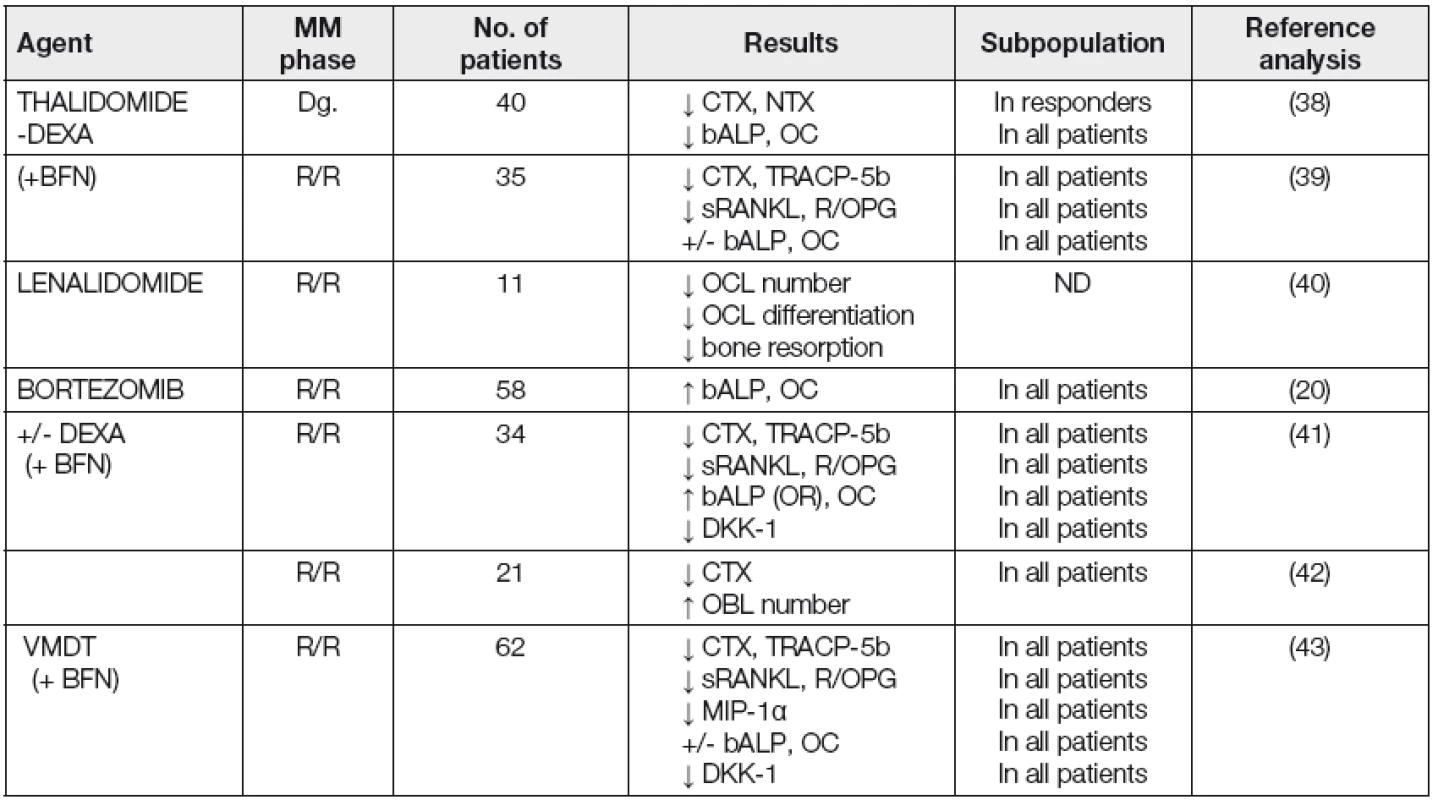
bALP- bone alkaline phosphatase; CTX- carboxy-terminal cross-links telopeptide of type I collagen; DKK-1- Dickkopf-1; MIP-1α- macrophage inflammatory protein-1α; NTX- amino-terminal cross-links telopeptide of type I collagen; OC- osteocalcin; OPG- osteoprotegerin; RANKLreceptor activator of nuclear factor-кB ligand; TRACP-5b-tartrate resistant acid phosphatase isoform type-5b; DEXA- dexamethasone; Dgnewly diagnosed; R/R- refractory/relapsed; VMDT- velcade, melphalan, dexamethasone, thalidomide; BFN- bisphosphonate; OCL- osteoclast; OBL- osteoblast Nové potenciální ukazatele kostního obratu u myelomové kostní nemoci
Experimentální, ale i některé práce klinického charakteru nabídly řadu nových zajímavých molekul, které by již v brzké budoucnosti mohly rozšířit dosavadní spektrum ukazatelů kostního obratu, především markerů OR. Ve velmi slibném světle se jeví stanovení indexu RANKL/OPG v plazmě kostní dřeně nebo v krevním séru, vyjadřující stupeň osteoklastogeneze [45]. Z dosavadních šetření vyplývá jeho významný vztah ke klinickému stádiu a aktivitě MM, k tíži MKN a k celkovému přežití. Byl rovněž prokázán úzký vztah tohoto indexu k výši odbytu NTX močí a k hladině S-TRAP-5b a jeho poklesu po úspěšné antiresorpční terapii PAM a ZA provázené snížením OKL v kostní dřeni. V nadějném světle se jeví i vyšetřování hladin DKK-1 v krevním séru a /nebo v plazmě kostní dřeně, případně i stupně exprese DKK-1 v myelomových buňkách [46, 47]. Předběžné výsledky nasvědčují dobré korelaci se stupněm pokročilosti MM, vyhodnoceném s pomocí ISS a k rozsahu MKN včetně počtu osteolytických lézí vyhodnocených s pomocí konvenční radiografie skeletu a MRI i významné rozdílnosti jak buněčné exprese, tak i sérových hladin mezi MGNV a MM. V současnosti je v řešení zhodnocení klinického přínosu vyšetřování sérových hladin FRP-2, osteosklerostinu, activinu-A a dalších nadějných molekul [14, 37, 46, 48, 49]. Je nasnadě, že přínos nových molekul s úzkým vztahem ke stavu kostního obratu pro reálnou klinickou praxi přinesou teprve výsledky probíhajících randomizovaných klinických studií.
Přehled ukazatelů kostního obratu včetně klinického využití u MM
Je nasnadě, že v podmínkách standardní klinické praxe není účelné a ekonomicky zdůvodnitelné vyšetřování palety všech ukazatelů kostního obratu, diskutovaných v předloženém přehledu. Přehled vhodných, klinickými studiemi ověřených markerů doporučených IMWG, včetně vztahu k rozsahu MKN, predikci patologických kostních zlomenin, významu pro předpověď celkového přežití a specifických vlastností z hlediska jejich individuálního využití v klinické praxi je soustředěn tabelárně (Tabulka 6) [14]. Je zřejmé, že v nejúčelnějším světle se z hlediska obohacení stávající klinické praxe jeví vyšetřování sérových hladin ukazatelů OR, jmenovitě ICTP a/nebo odbytu NTX močí/24 hodin.
Tab. 6. Myeloma bone disease- summary of bone metabolism markers („IMWG report“, 14) 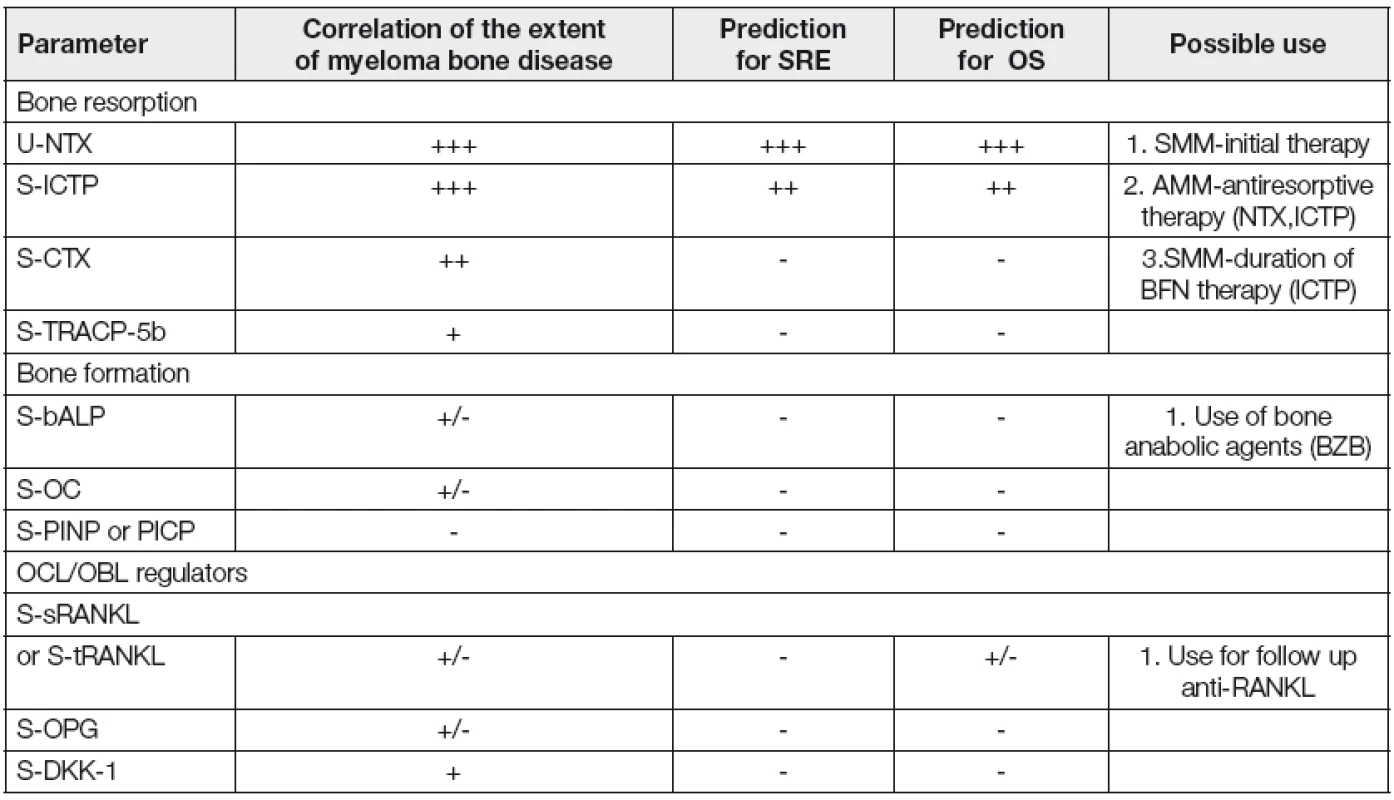
IMWG –International Myeloma Working Group; OS –overal survival; SRE – skeletal related event.; SMM- symptomatic multiple myeloma; AMM –asymptomatic multiple myeloma; (-) -no evidence; (+/-) -conflicting evidence; (+) -low evidence; (++) -intermediate evidence; (+++) –strong evidence; bALP –bone alkaline phosphatase; CTX –carboxy-terminal cross-linking telopeptide I collagen; DKK-1 –Dickkopf-1; ICTP –carboxy-terminal cross-links telopeptide of type I collagene generated by matrix metalloproteinases; NTX –amino terminal cross-linking telopeptide of type I collagen; OC- osteocalcin; OPG –osteoprotegerin; PICP –procolagen type I carboxy propeptide; PINP –procollagen type I amino-propeptide; sRANKL –soluble receptor activator of nuclear factor-кB ligand; TRACP-5b –tartrate resistant acid phosphatase isoform-5b; tRANKL –total RANKL; OCL –osteoclast; OBL –osteoblast; BZB –bortezomib; BFN -bisphosphonate Závěr
Současné období se vyznačuje explozí poznatků, zvyšujících naše znalosti o patogenezi, klasifikaci a léčbě MKN, této dominantní klinické manifestaci MM. Je zřejmé, že především ukazatelé OR, přestože nejsou v současnosti integrální součástí diagnostických a stratifikačních kritérií MM, obohacují pohled na průběh MKN a vnášejí do hodnocení individuální, dynamický pohled. Je nasnadě, že jejich účelné začlenění do dosavadního standardního spektra diagnostických a stratifikačních testů a kvalifikované hodnocení zvyšuje možnosti individuálního přístupu k hodnocení tíže a aktivity MKN, predikce vývinu patologických kostních příhod a účelné antiresorpční i antimyelomové terapie s individuálním výběrem a modulací intenzity i délky léčby. Lze očekávat, že poznání nových molekul, hrajících klíčovou roli v patogenezi MKN se stane východiskem nové, perspektivní „terčově zacílené“ terapie (např. inhibice RANKL, DKK-1, FRP-2 , osteosklerostinu, activinu-A aj.). Je na snadě, že individuální výběr markerů kostního obratu v rámci vyšetřovacího algoritmu MKN v různých fázích MM vyžaduje kvalifikovaný přístup a hodnocení v kontextu výsledků klíčových laboratorních testů a zobrazovacích metod [3].
Předneseno v rámci XI. Pracovní konference na téma monoklonálních gamapatií, 16. 10. 2012,Hradec Králové.
Sdělení bylo zpracováno s podporou grantů IGA MZČR NT/12451-5 a IGA MZČR NT/14400.
Do redakce došlo 11. 1. 2013
Adresa pro korespondenci:
Prof. MUDr. Vlastimil Ščudla, CSc.,
3. interní klinika-NRE
LF UP a FN v Olomouci,
I. P. Pavlova 6, 775 20 Olomouc
e-mail:vlastimil.scudla@fnol.cz
Zdroje
1. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit. J. Haematol., 2003, 12, p. 749-757.
2. Sezer, O. Myeloma bone disease: recent advances in biology, diagnosis, and treatment. Oncologist, 2009, 14, p. 276-283.
3. Dimopoulos, M., Terpos, E., Comenzo, R. L. et al. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple myeloma. Leukemia, 2009, 23, p. 1545-1556.
4. Ščudla, V. Postižení skeletu u mnohočetného myelomu. Postgr. Med., 2011, 13, p. 728-736.
5. Ščudla, V., Adam, Z. Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi. Vnitř. Lék., 2012, 58, CD164 - CD174.
6. Adam, Z., Ševčík P., Vorlíček, J. et al. Kostní nádorová choroba. Praha: Grada Publishing, 2005, p. 296, ISBN 80-247-1357-8.
7. Roodman, G. D. Pathogenesis of myeloma bone di-sease. Leukemia, 2009, 23, p. 435-441.
8. Mundy, G. R., Raisz, L. G., Cooper, R. A. et al. Evidence for secretion of an osteoclast stimulating factor in myeloma. N. Engl. Med., 1974, 291, s.1041-1046.
9. Li, Z-W., Chen, H., Campbell, R. A. et al. NF-κB in the pathogenesis and treatment of multiple myeloma. Curr. Opinion Hematol., 2008, 15, p. 391-399.
10. Andrews, N. A. Multiple myeloma bone diseases: targeting osteoclasts and osteoblasts. IBMS BoneKEy 9, 50(2012)/ doi:10.1038/bonekey, 2012.50
11. Roodman, G. D. New potential targets for treating myeloma bone disease. Clin. Cancer Res., 2006, 12, Suppl. 20, p. 6270-6273.
12. Roodman, G. D. Pathogenesis of myeloma bone di-sease. Leukemia, 2009, 23, p. 435-441.
13. Roodman, G. D. Myeloma bone disease. New York: Human Press, 2010, 252 p. ISBN 978-1-60761-553-8.
14. Terpos, E., Dimopoulos, M. A., Sezer, O. et al. The use of biochemical markers of bone remodeling in multiple myeloma: a report of the International Myeloma Working Group. Leukemia, 2010, 24, p. 1700-1712.
15. Terpos, E., Dimopoulos, M. A. Myeloma bone di-sease: pathophysiology and management. Ann. Oncol., 2005, 16, p. 1223-1231.
16. Terpos, E., Sezer, O., Croucher, P. et al. Myeloma bone disease and proteosome inhibition therapy. doi:10.1182/blood-2007-03-067710.
17. Coleman, R. E., Major, P., Lipton, A. et al. Predictive value of bone resorption and formation markers in cancer patients with bone metastases receiving the bisphosphonate zoledronic acid. J. Clin. Oncol., 2005, 23, p. 4925-4935.
18. Janckila, A. J., Takahashi, K., Sun, S. Z. et al. Tartrate-resistant acid phosphatase isoform-5b as serum marker for osteoclastic activity. Clin. Chem., 2001, 47, p. 4-80.
19. Terpos, E. Biochemical markers of bone metabolism in multiple myeloma. Cancer Treat. Reviews, 2006, 32, Suppl.1, p. 15-19.
20. Heider, U., Kaiser, M., Muller, C. et al. Bortezomib increases osteoblast activity in myeloma patients irrespective of response to treatment. Eur. J. Haematol., 2006, 77, p. 233-238.
21. Delmas, P. D. Bone marker nomenclature. Bone, 2001, 28, p. 575-576.
22. Carlson, K., Larson, A., Simonsson, B. et al. Evaluation of bone disease in multiple myeloma: a comparison between the resorption marker urinary deoxypyrolidine/creatinine (DPD) and serum ICTP, and evaluation of the DPD/osteocalcin and ICTP/osteocalcin ratios. Eur. J. Haematol., 1999, 62, p. 300-306.
23. Abildgaard, N., Bentzen, S. M., Nielsen, J. L. for the Nordic Myeloma Study Group (NMSG). Serum markers of bone metabolism in multiple myeloma: Prognostic va-lue of the carboxy-terminal telopeptide of type I collagen (ICTP). Brit. J. Haematol., 1997, 96, p. 103-110.
24. Abildgaard, N., Brixen, K., Kristensen, J. E. et al. Comparison of five biochemical markers of bone resorption in multiple myeloma: elevated pre-treatment levels of S-ICTP and U-NTX are predictive for early progression of the bone disease during standard chemotherapy. Brit. J. Haematol., 2003, 120, p. 235-242.
25. Abildgaard N., Brixen, K., Eriksen, E. F. et al. Sequential analysis of biochemical markers of bone resorption and bone densitometry in multiple myeloma. Haematologica, 2004, 89, p. 567-577.
26. Fonseca, R., Trendle, M. C., Leong, T. et al. Prognostic value of serum markers of bone metabolism in untreated multiple myeloma patients. Brit. J. Haematol., 2000, 109, p. 24-29.
27. Jakob, C., Zavrski, I., Heider, U. et al. Serum levels of carboxy-terminal telopeptide of type-I collagen are elevated in patients with multiple myeloma showing skeletal manifesttations in magnetic resonance imaging but lacking lytic bone lesions in conventional radiography. Clin. Cancer. Res., 2003, 9, s.3047-3051.
28. Alexandrakis, M. G., Kyriakou, D. S., Passam, F. H. et al. Urinary N-telopeptide levels in multiple myeloma patients, correlation with Tc-99m-sestaMIBI scintigraphy and other biochemical markers of disease activity. Hematol. Oncol., 2003, 21, s.17-24.
29. Coleman, R. E., Major, P., Lipton, A. et al. Predictive value of bone resorption and formation markers in cancer patients with bone metastases receiving the bisphosphonate zoledronic acid. J. Clin. Oncol., 2005, 23, p. 4925-4935.
30. Jakob, C., Sterz, J., Liebisch, P. et al. Incorporation of the bone marker carboxy-terminal telopetide of type-1 collagen improves prognostic information of the International Staging System in newly diagnosed symptomatic multiple myeloma. Leukemia, 2008, 22, p. 1767-1772.
31. Ščudla, V., Budíková, M., Pika, T. et al. Srovnání sérových hladin vybraných biologických působků u mono-klonální gamapatie nejistého významu a mnohočetného myelomu. Čas. Lék. Čes., 2009, 148, p. 315-322.
32. Scudla, V., Pika, T., Budikova, M. et al. The importance of serum levels of selected biological parameters in the diagnosis, staging and prognosis of multiple myeloma. Neoplasma, 2010, 57, p. 102-110.
33. Terpos, E., Berenson, J., Lipton, A. et al. High baseline NTX predicts for inferior survival and shorter time to first SRE in multiple myeloma. Clin. Lymphoma Myeloma, 2009, 9,(Suppl 1), p. 50-51.
34. Raje, N., Roodman, D. Advances in the biology and treatment of bone disease in multiple myeloma. Clin. Cancer Res., 2011, 17, p. 1278-1286.
35. Berenson, J. R. The use of bisphosphonates in patients with multiple myeloma. UP To Date 2012. www.uptodate.com.
36. Henry, D., Moss, R., Vadhan-Raj, S. et al. A double-blind, randomized study of denosumab versus zoledro-nic acid for the treatment of bone metastases in patients with advances cancer or multiple myeloma. Eur. J. Cancer, 2009, 12, Suppl.3, abstract 20LBA.
37. Lipton, A., Cook, R. J., Coleman, R. E. et al. Clinical utility of biochemical markers of bone metabolism for improving the management of patients with advanced multiple myeloma. Clin. Lymphoma Myeloma, 2007, 7, p. 346-353.
38. Tosi, P., Zamagni, E., Cellini, C. et al. First-line therapy with thalidomide, dexamethasone and zoledronic acid decreas bone resorption markers in patients with multiple myeloma. Eur. J. Haematol., 2006, 76, p. 399-404.
39. Terpos, E., Mihou, D., Szydlo, R. et al. The combination of intermediate doses of thalidomide with dexamethasone is an effective treatment for patients with refractory/relapsed multiple myeloma and normalizes abnormal bone remodeling, through the reduction of sRANKL/osteoprotegerin ratio. Leukemia, 2005, 19, p. 1969-1976.
40. Breitkreutz, I., Raab, M. S., Vallet, S. et al. Lenalidomide inhibits osteoclastogenesis, survival factors and bone-remodeling markers in multiple myeloma. Leukemia, 2008, 22, p. 1925-1932.
41. Terpos, E., Heath, D. J., Rahemtulla, A. et al. Borte-zomib reduces serum Dickkopf-1 and receptor activator of nuclear factor –κB ligand concentrations and normalises indices of bone remodeling in patients with relapsed multiple myeloma. Brit. J. Haematol., 2006, 135, p. 688-692.
42. Giuliani, N., Morandi, F., Tagliaferri, S. et al. The proteasome inhibitor bortezomib effects osteoblast differentiation in vitro and in vivo in multiple myeloma patients. Blood, 2007, 110, p. 334-338.
43. Terpos, E., Kastritis, E., Roussou, M. et al. The combination of bortezomib, melphalan, dexamethasone and intermittent thalidomide is an effective regimen for relapsed/refractory myeloma and is associated with improvement of abnormal bone metabolism and angioge-nesis. Leukemia, 2008, 22, p. 2247-2256.
44. Zangari, M., Esseltine, D., Cavallo, F. et al. Predictive value of alkaline phosphatase for response and time to progression in bortezomib-treated multiple myeloma patients. Am. J. Hematol., 2007, 82, p. 197-198.
45. Corso, A., Dovio, A., Rusconi, C. et al. Osteoprotegerin serum levels in multiple myeloma and MGUS patients compared with age and sex-matched healthy controls. Leukemia, 2004, 18, p. 1555 - 1557.
46. Tian, E., Zhan, F., Walker, R. et al. The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma. N. Engl. J. Med., 2003, 349, p. 2483-2494.
47. Heider, U., Kaiser, M., Mieth, M. et al. Serum concentrations of DKK-1 decrease in patients with multiple myeloma responding to anti-myeloma treatment. Eur. J. Haematol., 2009, 82, p. 31-38
48. Zangari, M., Terpos, E., Zhan, F., Tricot, G. Impact of bortezomib on bone health in myeloma: a review of current evidence. doi:10.1016/j.ctrv.2011.12.007.
49. Yacoby, S., Ling, W., Zhan, F. et al. Antibody-based inhibition of DKK-1 suppresses tumor-induced bone resorption and multiple myeloma growth in vivo. doi:10.1182/blood-2006-09-047712.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2013 Číslo 2
-
Všetky články tohto čísla
- Významné snížení plumbémie při dodržování preventivních opatření u pracovníků vystavených zvýšené zátěži olovem
- Životní jubileum prof. MUDr. Antonína Jabora, CSc.
- Antonín Jabor (Tonda) šedesátiletý
- Prim. MUDr. Miroslav Kosek
- Zemřel prim. MUDr. Miroslav Kosek
- Identifikace a zohlednění podstatných zdrojů nejistoty jsou důležitější, než samotný způsob výpočtu
- Monoklonální gamapatie v Hradci Králové již pojedenácté
- Úloha ukazatelů kostního metabolismu v hodnocení myelomové kostní nemoci
- Význam stanovení vybraných laboratorních parametrů v diagnostice, stratifikaci a sledování nemocných s AL amyloidózou
- Klinicko-laboratorní aspekty biklonální gamapatie nejistého významu - BGUS
- Hemodialýza s použitím „high cut-off“ membrán při selhání ledvin u mnohočetného myelomu – první zkušenosti
- Riziko přechodu monoklonální gamapatie nejasného významu do maligní monoklonální gamapatie
- „Za hranice nejistoty“ – použití techniky one-way ANOVA současně pro odhad nejistoty měření a k verifikaci preciznosti měřicího postupu
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinicko-laboratorní aspekty biklonální gamapatie nejistého významu - BGUS
- Antonín Jabor (Tonda) šedesátiletý
- Úloha ukazatelů kostního metabolismu v hodnocení myelomové kostní nemoci
- Významné snížení plumbémie při dodržování preventivních opatření u pracovníků vystavených zvýšené zátěži olovem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



