IGF1 (insulin-like growth factor 1), základní charakteristika, signální dráha, závislost na věku a pohlaví
IGF1 (insulin-like growth factor 1), basic characteristics, biological effect, age and gender dependence
Signaling pathway of IGF1 (insulin-like growth factor 1) belongs to the most important growth pathways in the organism. This pathway has been studied for many years in connection with the growth and survival of cells and in recent years also in connection with the cancer development.
Over time, the step from IGF1 serum levels to the mapping of the occurrence of IGF1 in tissues was done, further, we observed that the effect is mediated by a specific receptor, which is located on the cell surface. Finally, we found location of genes which encoded IGF1, its binding protein and its receptor. The entire way of IGF1 in human body was described, from its synthesis, transport in serum and receptor binding. Also the individual components of cellular signaling pathways were identified starting IGF1 receptor till the individual effectors within the cell. These findings allow us to give an idea about the functioning of IGF1 and its role in the growth, differentiation and cell surviving. IGF1 depends on age and gender, which must be respected when reference ranges are established.
Keywords:
Insulin-like growth factors, binding proteins, receptors, age and gender dependence.
Autori:
R. Kučera; O. Topolčan; L. Pecen; V. Šimánek
Pôsobisko autorov:
Oddělení nukleární medicíny, Imunoanalytická laboratoř, FN a LF v Plzni, Univerzita Karlova v Praze
Vyšlo v časopise:
Klin. Biochem. Metab., 24, 2016, No. 1, p. 14-19
Súhrn
Signální dráha IGF1 (insulin-like growth factor 1) patří k nejdůležitějším růstovým drahám v organismu. Tato dráha byla studována řadu let v souvislosti s růstem a přežíváním buněk a v posledních letech též v souvislosti se vznikem a rozvojem nádorových onemocnění. Z úrovně séra se postupem času podařilo postoupit na mapování výskytu IGF1 ve tkáních. Podařilo se zjistit, že na buněčné úrovni je účinek zprostředkován povrchovým specifickým receptorem. Je popsána lokace genů, které kódují IGF1, jeho vazebné proteiny a receptor. Podařilo se podrobně zmapovat celou cestu IGF1 lidským tělem od jeho syntézy, přes transport v séru či vazbu na receptor. Interakce IGF1 s receptorem spouští kaskádu dějů v celé signální dráze uvnitř buňky. Dnes jsou známy jednotlivé složky buněčné signální dráhy IGF1 receptorovými kinázami počínaje a efektory zajišťujícími účinky uvnitř buňky konče. Tyto poznatky nám umožnily pochopit fungování systému IGF1 a jeho roli v růstu, diferenciaci a přežívání buněk. Sérové hladiny IGF1 jsou závislé na věku a pohlaví, což je nutné respektovat při tvorbě referenčních rozmezí a hodnocení výsledků.
Klíčová slova:
IGF1, vazebné proteiny, receptory, závislost na věku a pohlaví.
Úvod
Signální dráha inzulinu podobného růstového faktoru 1 (IGF1, insulin-like growth factor 1, somatomedin) patří k nejdůležitějším růstovým drahám v organismu. Tato dráha byla intenzivně studována od počátku 80. let minulého století. Z úrovně séra se postupem času podařilo postoupit na mapování výskytu IGF1 ve tkáních. Podařilo se zjistit, že na buněčné úrovni je účinek zprostředkován povrchovým specifickým receptorem. Je popsána lokace genů, které kódují IGF1, jeho vazebné proteiny a specifické receptory. Tyto poznatky umožňují pochopit fungování systému IGF1 a jeho roli v růstu, diferenciaci a přežívání buněk. Na zvířecích modelech byl dokonce prokázán přímý vliv funkce signální dráhy na délku života daného organismu.
Cílem článku je přehled působení jednotlivých složek systému IGF1 doplněný o poznatky se stanovováním referenčních rozmezí IGF1, IGFBP3, a poměru IGF/IGFBP3 v závislosti na věku a pohlaví.
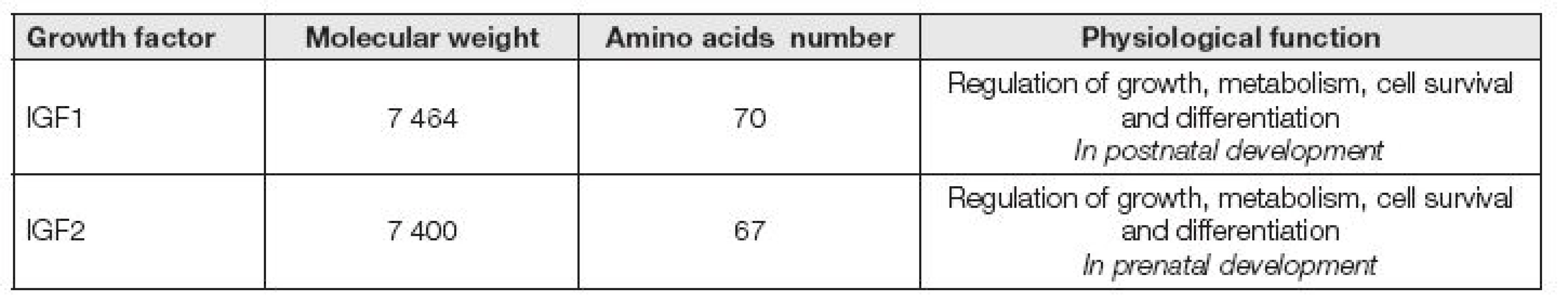
IGF1 základní charakteristika
IGF1 společně též s inzulinu podobným růstovým faktorem 2 (IGF2, insulin-like growth factor 2) jsou peptidy, které se fyziologicky podílejí na řízení růstu, metabolismu, přežívání a diferenciaci buněk a jsou regulovány růstovým hormonem (GH, growth hormone). IGF2 se uplatňuje především v prenatálním období a IGF1 v období postnatálním (Tabulka 1). IGF1 a IGF2 se skládají z malých peptidů, které jsou z 50 % homologní s proinzulinem [1]. Oba typy IGF jsou syntetizovány v mnoha fetálních a dospělých tkáních a jsou obsažené dokonce i v mateřském mléce.
Až 95 % obou typů IGF cirkuluje v krvi vázáno na vazebné proteiny. IGF1 a IGF2 mají své specifické vazebné proteiny (IGFBP, insulin-like growth factor binding proteins). Biologický poločas volných frakcí IGF1 a IGF2 se odhaduje na méně než 10 minut. Komplex IGF1/IGFBP3 či IGF2/IGFBP3 má biologický poločas asi 12 hodin.
IGF1 je bazický peptid s nízkou molekulovou hmotností 7 649. Je tvořen jednoduchým řetězcem o 70 aminokyselinách. IGF1 je produkován ve velkém množství v játrech (přibližně 10 mg/den). Tato produkce je pevně řízena růstovým hormonem. IGF1 je produkován lokálně i v mnoha jiných tkáních např. ledvin, srdce, plic, tukové tkáni a tkáních různých žláz. IGF1 je produkován také chondroblasty, fibroblasty a osteoklasty. Na orgánové úrovni IGF1 účinkuje autokrinním i parakrinním mechanizmem a je schopen komunikovat s ostatními místně produkovanými růstovými faktory a steroidními hormony [2]. Účinek v buňkách je zprostředkován vlastním IGF1 receptorem. Syntézu IGF1 zvyšují hormony štítné žlázy a mírně též prolaktin. Estrogeny a kortikoidy naopak omezují produkci IGF1. Sekrece IGF1 nezávisí jenom na účinku GH, ale také na výživě. Po dobu hladovění hladina IGF1 klesá a nereaguje ani na podání GH. Hladina IGF1 je vhodným ukazatelem realimentace při malnutričních stavech. Snížené hladiny IGF1 jsou pozorovány po odstranění hypofýzy.
Z diagnostického hlediska je IGF1 přínosným vyšetřením zejména při sledování akromegalií a deficitu růstového hormonu. Jeho výhodou je to, že na rozdíl od sekrece GH, která probíhá pulzně, je jeho hladina v séru dlouhodobě konstantní. U akromegalie jsou hladiny zvýšené a u deficitu GH jsou hladiny IGF1 snížené. Důležitost IGF1 pro růst a vývoj organismu byla zkoumána na zvířecích modelech narušením genu pro IGF1 tzv. knock out (K.O.) metodou. IGF1 K.O. myši vykazovaly ve srovnání s normálními jedinci o 40 % sníženou porodní hmotnost, velmi vysokou perinatální úmrtnost, opožděnou osifikaci, málo rozvinuté svalstvo a plicní tkáň, stejně jako neplodnost [3].
IGF2 je neutrální peptid o molekulové hmotnosti 7400 Da, jehož řetězec je tvořený 67 aminokyselinami. IGF2 je strukturálně blízký IGF1, ale je méně závislý na regulaci GH. Účinek je zprostředkován specifickým IGF2 receptorem. IGF2 byl dlouho považován za plodovou formu IGF1. Dnes již víme, že je toto rozdělení překonané, avšak přesto je nesporné, že IGF2 hraje velmi důležitou roli během embryogeneze. Normální hladiny v séru u zdravých lidí se pohybují od 400 do 900 μg/l.
Byly prováděny studie s cíleným narušením genu pro IGF2. IGF2 K.O. myši měly o 40 % nižší porodní hmotnost ve srovnání s normálními jedinci [4]. Tyto myši se na rozdíl od IGF1 K.O. myší vyvinuly v normální jedince s trpasličím vzrůstem.
IGF1 vazebné proteiny
IGFBP se nacházejí v různých tělních tekutinách a tkáních. IGFBP jsou syntetizovány v játrech a mohou být regulovány mimo jiné i tím, že IGF1 přímo podporuje proteolytickou degradaci některých IGFBP (IGFBP4) do fragmentů, které nevážou IGF1, a tím IGF1 vlastně zvyšuje svojí vlastní biologickou dostupnost v tělních tekutinách.
IGFBP zvyšují poločas IGF1 v séru a inhibují nebo podporují působení IGF1 vazbou na receptory cílových buněk. Navíc tyto vazebné proteiny fungují jako zásobárna IGF1 v mezibuněčném prostoru. Některé IGFBP brání in vitro růstu buněk. Buňky malobuněčného karcinomu plic produkují vazebné proteiny pro IGF1, které se liší od těch nalezených v játrech. To podporuje teorii, že by mohly fungovat jako prostředníci v autokrinní nebo parakrinní regulaci růstu těchto nádorových buněk. V současné době je známo nejméně šest různých IGFBP, které se liší ve své vazebné účinnosti (Tabulka 2). Všeobecně vžitá je řada IGFBP1 až IGFBP6, přičemž v literatuře můžeme dále najít i IGFBP7 a IGFBP8, které vznikly přejmenováním již objevených proteinů, když bylo zjištěno, že tyto váží IGF1 popř. IGF2 [5].
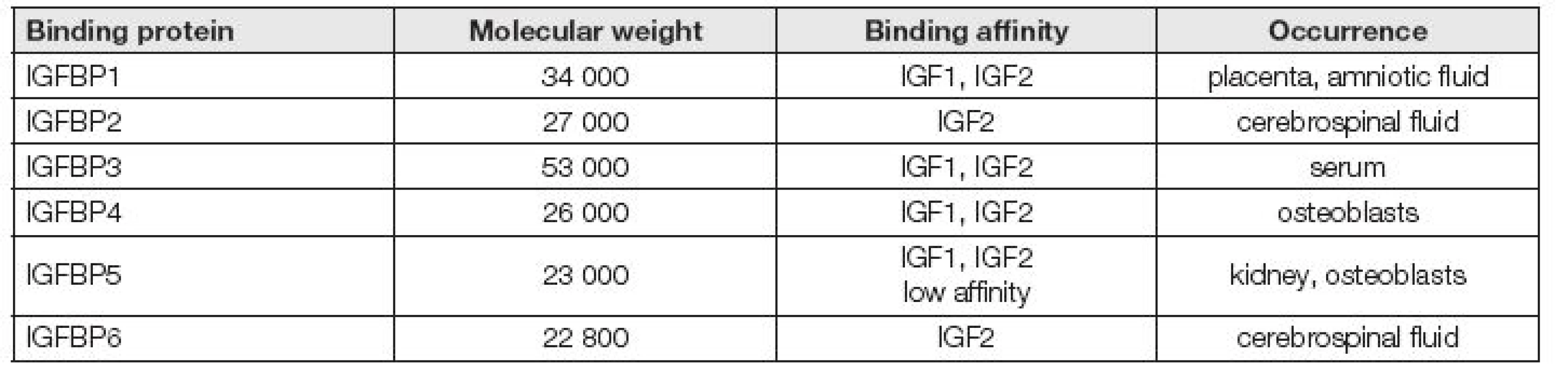
Dominantní vazebný protein v séru je IGFBP3, který vykazuje podobnou afinitu k IGF1 a IGF2. IGFBP3 inhibuje sekreci folikuly stimulujícího hormonu (FSH). Výrazně snížené hladiny IGFBP3 jsou pozorovány u pacientů s nedostatkem GH, zatímco výrazně zvýšené hladiny jsou pozorovány u pacientů s vysokými hladinami GH (např. akromegalie).
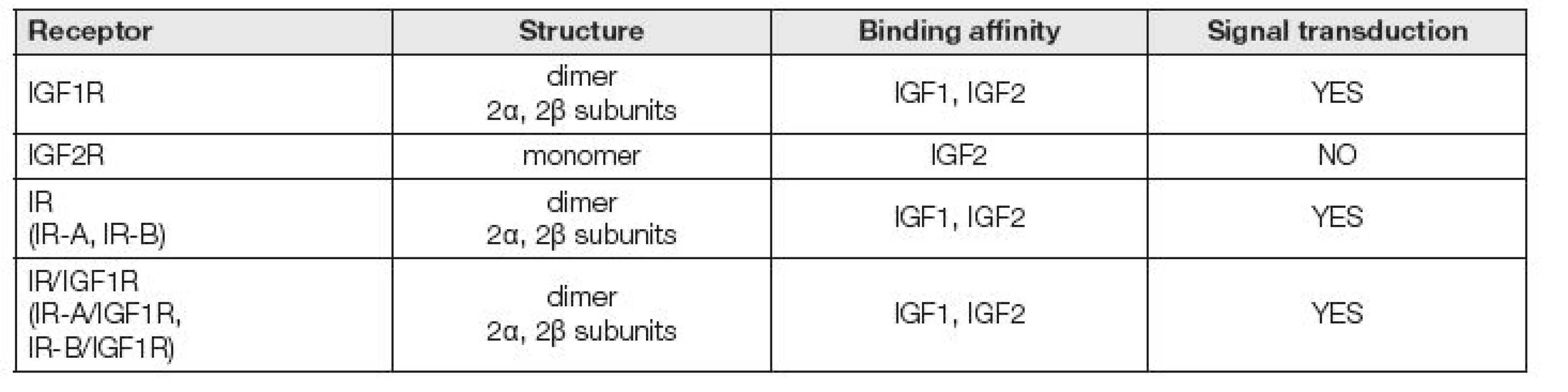
IGF1 receptory
Účinek IGF1 (IGF2) na buňku se odehrává prostřednictvím specifických receptorů (Tabulka 3). IGF1 se také váže s receptorem pro inzulin (IR) a naopak. Heterologní ligand má však k receptoru 100x nižší afinitu. Dále se IGF1 může vázat na hybridní receptory tvořené z poloviny IR a z poloviny IGF1R podjednotkou [6]. Receptory IGF1 patří do skupiny receptorových protein tyrosinkináz (PTK), které fosforylují své substrátové bílkoviny na tyrosinových zbytcích. Patří sem receptory pro většinu peptidických růstových faktorů, které se uplatňují v regulaci růstu a diferenciace buněk.
IGF1 receptor (IGF1R, CD221) je transmembránový glykoprotein o molekulové hmotnosti 350 000. Skládá se ze dvou α-podjednotek a dvou β-podjednotek. Zatímco α-řetězce jsou lokalizovány extracelulárně a váží IGF1, β-řetězce procházejí membránou do buňky. IGF1R je ze 60 % homologní s receptorem pro inzulin. Po vazbě ligandu na receptor dojde k autofosforylaci tyrozinu na β-podjednotce [7]. IGF1R je životně důležitý pro přežití buněk, což dokládá IGF1R K.O. fenotyp u myší. Narušení IGF1R genu vyústilo ve více než 50 % snížení hmotnosti K.O. zvířat oproti normální populaci. Tato zvířata zemřela v bezprostředním poporodním období na respirační selhání a byly zjištěny generalizované vývojové abnormality, hypoplazie, abnormální kožní formace, opožděný vývoj kostí a abnormální morfologie centrálního nervového systému [8].
IGF2 receptor (IGF2R, CD222) je monomerní protein o molekulové hmotnosti 250000. Jedná se o vazebný protein s vysokou afinitou pro IGF2 a velmi nízkou afinitou k IGF1 a nulovou afinitou k inzulinu. Cytoplazmatická doména receptoru nemá vlastní tyrosinkinázovou aktivitu a nemá schopnost přenášet signál. IGF2R není zapojen do vnitrobuněčné signalizace. IGF2 receptor cíleně váže IGF2, a tím snižuje biologickou dostupnost vysoce mitogenního IGF2. Některé z účinků IGF2 jsou zprostředkovány především izoformním inzulinovým receptorem IR-A. IGF2R je shodný s kation nezávislým manóza-6-fosfát (M6P) receptorem. Je to vlastně multifunkční proteinový receptor, který váže IGF2 na povrchu buněk a manózou-6-fosfátem (M6P) označené proteiny v Golgiho aparátu uvnitř buňky. IGF2/M6PR jsou zmutované nebo úplně chybí v buňkách několika druhů rakoviny, což vede k názoru, že IGF2/M6PR má roli nádorového supresoru [9].
Inzulinový receptor existuje ve dvou izoformách IR-A a IR-B. IR-A je vyjádřen především v centrálním nervovém systému, krvetvorných buňkách, plodové tkáni a různých nádorových buňkách. IR-B je přítomen především v tukové tkáni, játrech a svalech. Hybridní receptory vázající IGF1 jsou složeny z jedné poloviny z IR a z druhé poloviny z IGF1R. Vzhledem k izoformám IR mohou tedy existovat IR-A/IGF1R a IR-B/IGF1R [10].
Signální dráha IGF1
Po úspěšném navázání na receptor pokračuje přenos signálu uvnitř buňky po signální dráze, což je vlastně kaskáda enzymů a jejich substrátů.
Po aktivaci IGFIR dochází prostřednictvím adaptorového proteinu inzulin receptorový substrát (IRS1) k aktivaci dvou hlavních kaskád. První je signální dráha PI3K/PKB (fosfatidylinositol-3-kináza/ proteinkináza B) a druhá kaskáda je signální dráha ERK (extracellular signal regulated kinases), která patří mezi několik MAP kinázových drah (MAPK, mitogen activated protein kinases).
Signální dráha PI3K/PKB je mimořádně důležitá intracelulární signální dráha, která je zapojena do řady normálních buněčných procesů podílejících se na proliferaci, metabolismu, růstu a přežití buněk. Abnormality této dráhy, způsobené izoformami a mutacemi různých regulačních komponent, vedou k některým formám nádorových onemocnění [11]. Aktivace PI3K vede ke zrušení inhibičního účinku regulační podjednotky, která obratem přeměňuje membránový fosfatidylinositol-3,5-bisfosfát (PIP2) na trisfosfátovou formu (PIP3). PIP3 následně indukuje fosforylaci PKB prostřednictvím proteinu PDK1. Komplex PI3K je za normálních okolností negativně regulován specifickou fosfatázou - phosphatase and tensin homolog (PTEN). PTEN působí jako negativní regulátor PI3K dráhy tím, že hydrolyzuje PIP3 na PIP2.
V důsledku ztráty funkce PTEN mutací nebo epigenetickou modifikací se ale mohou vyskytnout alterace vedoucí k hyperaktivaci PI3K. Ztráta funkce PTEN podporuje akumulaci PIP3, která vede k deregulaci přenosu signálu přes kaskádu PI3K/PKB.
PKB se účastní ještě řady dalších signálních kaskád a zasahuje tedy do celé řady buněčných dějů (proteosyntéza, přežívání, proliferace, glukózový metabolismus apod.) [12]. Aktivace deregulované signální dráhy PI3K/PKB poskytuje buňce signály pro neomezený růst a přežití.
Druhá signální dráha je kaskáda ERK (extracellular signal regulated kinases). Po aktivaci IRS1 se signál přenáší přes GTPasu Ras a kinázy Raf a MEK, které konečně vedou k aktivaci MAP kináz (mitogen activated protein kinases), konkrétně ERK. Skupina enzymů nazývaných MAP kinázy reguluje expresi genu a případně proliferaci a diferenciaci buňky [13].
Složitost IGF1 signalizace dokládá fenotyp myší s chybějícím genem pro IGF1R. Například chybění tohoto genu v buňkách prostaty vedlo k aktivaci ERK dráhy a způsobilo buněčné proliferace a hyperplazie. Toto zjištění dokazuje, že MAP kinázové dráhy jsou aktivovány dalšími IGF1R nezávislými mechanizmy. Dále přítomnost IGF1R signální dráhy usnadnila růst nádorů s poruchou činnosti enzymu p53 (enzym regulující apoptózu) [14].
Poznatky o komplexním působení signální dráhy v živých organismech vedly ke studiím ovlivnění dlouhověkosti prováděných na zvířecích modelech. Cílenými mutacemi v signální dráze IGF1 se povedlo docílit zvýšení průměrné délky života o 20 – 70 % [15]. Podobná zjištění byla učiněna i u nižších živočišných druhů než jsou obratlovci, což znamená, že signální dráha IGF1 je vývojově jednou z nejstarších růstových drah v živých organismech vůbec [16].
Můžeme se tedy domnívat, že důkladné poznání signální dráhy IGF1 by mohlo vést k odhalení mechanizmů stárnutí a možnosti ovlivnění délky lidského života, avšak údaje o studiu podobných mutací ve vztahu k délce života u lidí prozatím chybí.
IGF1, IGFBP3 - změny hladin v závislosti na věku a pohlaví
Sérové hladiny IGF1 a IGFBP3 se mění s věkem. Jejich hladiny se začínají zvyšovat ihned po narození. Nejvyšší koncentrace nacházíme u dětí v pubertě. V pozdějších letech hladiny IGF1 klesají, přibližně o 10 procent za každých 10 let. Nejnižší hladiny se vyskytují ve stáří. K nejvýraznějšímu poklesu IGF1 dochází ve věku 70 let a výše [17]. Hladiny IGFBP3 víceméně kopírují vývoj hladin IGF1 v průběhu života. Pokles IGFBP3 s věkem je ale výrazně menší než u IGF1 [18]. V odborné literatuře se ještě kromě IGF1 a IGFBP3 objevuje též vypočítávaný parametr, a to poměr IGF1/IGFBP3. Tento poměr je využíván především u nádorových onemocnění jako index biologické dostupnosti IGF1 v séru, kdy se předpokládá, že vyšší dostupnost IGF1 spíše zvyšuje riziko nádorové transformace a nižší dostupnost IGF1 způsobená zvýšenou přítomností IGFBP3 působí spíše protektivním způsobem [19]. Poměr IGF1/IGFBP3 s věkem též klesá, což je dáno výraznějším poklesem IGF1 oproti poklesu IGFBP3, jak již bylo zmíněno výše.
Hladiny IGF1 jsou dobře zmapovány od narození až po nejvyšší věkové skupiny. Existují práce, které se věnují pouze hladinám IGF1 u dětí a navrhují referenční hladiny měnící se každý rok, což je pro období, kdy se produkce sledovaného biomarkeru dynamicky mění, samozřejmě vhodné [20]. Hladiny IGF1 dosahují svého vrcholu kolem 15. roku života. Přibližně ve věku 18 - 20 let nastává období, kdy hladiny IGF1 začínají pomalu klesat a není nutné ani účelné uvádět referenční hodnoty, které se mění každý rok. Řada prací navrhuje normální hodnoty se změnou v intervalu 5 let [21].
V imunoanalytické laboratoři ve FN v Plzni jsme též provedli studii na souboru 1022 zdravých osob s cílem navrhnout referenční rozmezí pro IGF1, IGFBP3 a poměr IGF1/IGFBP3 [22]. Došli jsme k závěru, že od 20 let věku je robustnějším modelem změna referenčních hodnot v intervalu 10 let, vzhledem k poměrně značné individuální variabilitě v poklesu hladin IGF1 s věkem. Při tvorbě modelů poklesu IGF1 s věkem záleží též na statistickém přístupu. Pokud zvolíme nelineární model regrese (obr. 1), můžeme detailněji postihnout určité rozdíly v rychlosti poklesu hladin v jednotlivých dekádách života. Lineární modely jsou však, dle našich zkušeností, robustnější co se týká individuální variability poklesu IGF1 (obr. 2). Míra nelinearity poklesu IGF1 s věkem je ale poměrně malá, až na výraznější pokles po 70. roce věku. Něco jiného je IGFBP3, kde můžeme vysledovat nelineární pokles, a to především u žen. Pokles IGFBP3 u žen se stává mnohem výraznější až kolem 60 let věku. Co se týká závislosti hladin IGF1 na pohlaví, studie provedené v tomto ohledu nedošly k úplně jednotným závěrům. Zajímavé je, že studie prováděné v posledních letech se spíše přiklánějí k rozdělení referenčních hodnot podle pohlaví [23, 24] v porovnání se staršími studiemi, které závislost na pohlaví neuvádějí [25]. V našem případě hladiny IGF1 byly statisticky významně vyšší u mužů než u žen a rozdíly v IGF1 mezí pohlavími klesaly s věkem. U IGFBP3 jsou rozdíly mezi pohlavími mnohem menší než u IGF1, přičemž pokles u žen je poněkud strmější než u mužů. Pro poměr IGF1/IGFBP3 jsme zjistili podobný průběh jako u IGF1.


Na základě našich zkušeností jsme došli k závěru, že nejlépe vystihující model referenčních hodnot lze získat pomocí lineární regrese závislé na věku a pohlaví. Také výše zmíněné referenční meze po intervalech 10 let věku musí být určovány zvlášť dle pohlaví [26].
Biomarker měnící se s věkem představuje vždy tak trochu výzvu při zpracování dat z provedených studií a při tvorbě referenčních hodnot. Také při porovnávání dvou souborů pacientů s naměřenými hodnotami IGF1 je vždy nutné provádět pomocí statistických metod pečlivé srovnání věkového rozložení porovnávaných skupin. Když se věkové složení statisticky významně liší, je nutné vždy provést věkovou adjustaci naměřených hodnot. Pokud se takový přístup neuplatňuje, je možné se u takových biomarkerů, jakým je IGF1, snadno dobrat nesprávných závěrů na správně naměřených výsledcích [27].
Závěr
V posledních letech byly prozkoumány a detailně popsány funkce signální dráhy IGF1. Byly také popsány mnohé interakce s dalšími signálními drahami. Přímo na klonech nádorových buněk byly demonstrovány prorůstové a antiapoptotické účinky IGF1.
Sérové hladiny IGF1, IGFBP3 a poměru IGF1/IGFBP3 jsou závislé na věku a pohlaví, což je nutné respektovat při tvorbě referenčních rozmezí a hodnocení výsledků.
Tato studie byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 - FN Plzeň a Projektem Ministerstva školství OPVK č. CZ (1.07/2.3.00/20.0040).
Do redakce došlo 4. 1. 2016
Adresa pro korespondenci:
PharmDr. Radek Kučera, Ph.D.
Imunoanalytická laboratoř, Oddělení nukleární medicíny, FN Plzeň
Dr. E. Beneše 13,
305 99 Plzeň
e-mail: kucerar@fnplzen.cz
Zdroje
1. Ketha, H., Singh, R. J. Clinical assays for quantitation of insulin-like-growth-factor-1 (IGF1). Methods. 2015 Jun 15, 81, p. 93-8.
2. Dupont, J., LeRoith, D. Insulin and insulin-like growth factor I receptors: similarities and differences in signal transduction, Horm. Res., 55 Suppl. 2, p. 22-6.
3. Powell-Braxton, L., Hollingshead, P., Warburton, C., Dowd, M., Pitts-Meek, S., Dalton, D., Gillett, N., Ste-wart, T. A. IGF-I is required for normal embryonic growth in mice, Genes Dev., Dec. 1993, 7 (12B), p. 2609-17.
4. DeChiara, T. M., Efstratiadis, A., Robertson, E. J. A growth-deficiency phenotype in heterozygous mice carrying an insulin-like growth factor II gene disrupted by targeting, Nature, 1990, 345 (6270), p. 78-80.
5. Bach, L. A. Endothelial cells and the IGF system. J. Mol. Endocrinol., 2015, Feb 54 (1), R1-13.
6. Nakae, J., Kido, Y., Accili, D. Distinct and overlapping functions of insulin and IGF-I receptors, Endocrine Rev., 2001, 22, p. 818-35.
7. Riedemann, J., Macaulay, V. M. IGFIR signaling and its inhibition, Endocrine Related Cancer, 2006, Suppl.1, p. 33-43.
8. Hishiya, A., Ito, M., Aburatani, H., Motoyama, N., Ikeda, K., Watanabe, K. Ataxia telangiectasia mutated (Atm) knockout mice as a model of osteopenia due to impaired bone formation. Bone, 2005 Oct. 37 (4), p. 497-503.
9. Renehan, A. G., Zwahlen, M., Minder, C., O’Dwyer, S. T., Shalet, S. M., Egger, M. Insulin-like growth factor (IGF)-I, IGF binding protein-3, and cancer risk: syste-matic review and meta-regression analysis. Lancet, 2004, 363, p. 1346-1353.
10. Bruchim, I., Sarfstein, R., Werner, H. The IGF Hormonal Network in Endometrial Cancer: Functions, Regulation, and Targeting Approaches. Front Endocrinol., 2014, May 19, 5, p. 76.
11. McCampbell, A. S., Broaddus, R. R., Loose, D. S., Davies, P. J. Overexpression of the insulin-like growth factor I receptor and activation of the AKT pathway in hyperplastic endometrium. Clin. Cancer. Res., 2006, Nov 1, 12 (21), p. 6373-8.
12. Monti, S., Proietti-Pannunzi, L., Sciarra, A., Lolli, F., Falasca, P., Poggi, M., Celi, F. S., Toscano, V. The IGF axis in prostate cancer. 2007, Curr. Pharm. Des., 13, p. 719-27. In: Samani, A. A., Yakar, S., LeRoith, D., Brodt, P. The role of the IGF system in cancer growth and metastasis: overview and recent insights. Endocr. Rev., 2007, 28, p. 20-47.
13. Vorwerk, P., Wex, H., Hohmann, B., Mohnike, K., Schmidt, U., Mittler, U. Expression of components of the IGF signalling system in childhood acute lymphoblastic leukaemia. Mol. Pathol. 2002.
14. Sutherland, B. W., Knoblaugh, S. E., Kaplan-Lefko, P. J., Wang, F., Holzenberger, M., Greenberg, N. M. Conditional deletion of insulin-like growth factor-I receptor in prostate epithelium. Cancer Res., 2008, May 1, 68 (9), p. 3495-504.
15. Mari, D. Role of the IGF/insulin system in longevity. Minerva Endocrinol., 2011, 36, p. 181-5.
16. Bartke, A., Brown-Borg, H. Life extension in the dwarf mouse. Curr. Top Dev. Biol., 2004, 63, p. 189-225.
17. Leite, D. B., Meirelles, R. M. Mandarim-de-Lacerda, C. A., Matos, H. J., Bernardo-Filho, M. Serum insulin-like growth factor-I adult reference values for an automated chemiluminescence immunoassay system. Afr. J Biotechnol. 2011, 10, p. 18027-33.
18. Friedrich, N., Alte, D., Völzke, H., Spilcke-Liss, E., Lüdemann, J., Lerch, M. M. et al. Reference ranges of serum IGF-1 and IGFBP-3 levels in a general adult population: Results of the Study of Health in Pomerania (SHIP). Growth Horm. IGF Res., 2008, 18, p. 228-37.
19. Sandhu, M. S., Dunger, D. B., Giovannucci, E. L. Insulin, insulin-like growth factor-I (IGF-I), IGF binding proteins, their biologic interactions, and colorectal cancer. J Natl. Cancer Inst., 2002, Jul 3, 94 (13), p. 972-80.
20. Alberti, C., Chevenne, D., Mercat, I., Josserand, E., Armoogum-Boizeau, P., Tichet, J., Léger, J. Serum concentrations of insulin-like growth factor (IGF)-1 and IGF binding protein-3 (IGFBP-3), IGF-1/IGFBP-3 ratio, and markers of bone turnover: reference values for French children and adolescents and z-score comparability with other references. Clin. Chem., 2011, Oct 57 (10), p. 1424-35.
21. Rosario, P. W. Normal values of serum IGF-1 in adults: results from a Brazilian population. Arq. Bras. Endocrinol. Metabol., 2010, 54 (5), p. 477-81.
22. Kucera, R., Topolcan, O., Pecen, L., Kinkorova, J., Svobodova, S., Windrichova, J., Fuchsova, R. Re-ference values of IGF1, IGFBP3 and IGF1/IGFBP3 ratio in adult population in the Czech Republic. Clin. Chim. Acta., 2015 Apr 15, p. 444:271.
23. Friedrich, N., Wolthers, O. D., Arafat, A. M., Emeny, R. T., Spranger, J., Roswall, J., Kratzsch, J., Grabe, H. J., Hübener, C., Pfeiffer, A. F., Döring, A., Bielohuby, M., Dahlgren, J., Frystyk, J., Wallaschofski, H., Bidlingmaier, M. Age- and sex-specific reference intervals across life span for insulin-like growth factor binding protein 3 (IGFBP-3) and the IGF-I to IGFBP-3 ratio measured by new automated chemiluminescence assays. J. Clin. Endocrinol. Metab., 2014, 99, p. 1675-86.
24. Guven, B., Can, M., Mungan, G., Acikgoz, S. Refe-rence values for serum levels of insulin-like growth factor 1 (IGF-1) and IGF-binding protein 3 (IGFBP-3) in the West Black Sea region of Turkey. Scand. J Clin. Lab. Invest., 2013, 73, p. 135-40.
25. Lin, C. M., Huang, Y. L., Lin, Z. Y. Influence of gender on serum growth hormone, insulin-like growth factor-I and its binding protein-3 during aging. Yonsei Med. J., 2009, 50, p. 407-13.
26. Wright, E. M., Royston, P. Simplified estimation of age-specific reference interval for skewed data. Stat. Med., 1997, 16, p. 2785-803.
27. Kucera, R., Cerna, M., Narsanska, A., Svobodova, S., Strakova, M., Vrzalova, J., Fuchsova, R., Treskova, I., Kydlicek, T., Treska, V., Pecen, L., Topolcan, O., Pazdiora, P. Growth factors and breast tumors, comparison of selected growth factors with traditional tumor markers. Anticancer Res., 2011, Dec 31(12), p. 4653-6.
Štítky
Biochémia Nukleárna medicína Nutričný terapeutČlánok vyšiel v časopise
Klinická biochemie a metabolismus

2016 Číslo 1
Najčítanejšie v tomto čísle
- Struktura protilátek a jejich reaktivita
- Kritéria analytické kvality měření v klinické biochemii. Současný mezinárodní konsensus a jeho důsledky pro rutinní činnost klinických laboratoří.
- Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů
- Účinky signální dráhy IGF1 (insulin-like growth factor 1) na vznik a rozvoj nádorových onemocnění