-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kritéria analytické kvality měření v klinické biochemii. Současný mezinárodní konsensus a jeho důsledky pro rutinní činnost klinických laboratoří.
Criteria of analytical quality measurement in clinical biochemistry. Current international consensus and its implications for routine action of clinical laboratories.
Objective:
Review of current opinions on the analytical quality indicators in the clinical laboratoriem.Method:
In Stockholm Declaration from 1999 are described ways of creating the indicator quality the analytical. These principles are discussed, proposed and recommended for use by the working Group EFLM for specification of requirement on the analytical quality of measurement in clinical laboratories.Results and discussion:
Relationship between analytical quality parameters and biological variation values. Problems concerned with determination of biological variation values. Total analytical error, bias, measurement of uncertainty-differences, advantages and disadvantages. Necessity in harmonization of tolerance limit values for external quality assessment programs. Relationship between analytical quality and international clinical guidelines is documented.Conclusions:
Harmonization of indicator quality values in clinical laboratories is necessary for assurance of objective classification in quality of different laboratories and different methods produced by different manufacturers.Keywords:
quality indicators, EFLM, bias, error, uncertainty, biological variation.
Autoři: B. Friedecký 1,2; J. Kratochvíla 2
Působiště autorů: ÚKBD Fakultní nemocnice Hradec Králové 1; SEKK s. r. o. Pardubice 2
Vyšlo v časopise: Klin. Biochem. Metab., 24, 2016, No. 1, p. 32-38
Souhrn
Cíl sdělení:
Přehled současných názorů na indikátory kvality analytické fáze měření v klinických laboratoříchMetody:
Zásady Stockholmské deklarace hodnocení analytické kvality v klinických laboratořích z roku 1999. Rozpracování, návrhy, diskuse a závěry pracovní komise EFLM pro specifikaci požadavků na analytickou kvalitu měření z roku 2014.Výsledky a diskuse:
V práci je pojednáno o souvislosti analytické kvality s hodnotami biologických variací. Jsou uvedeny problémy určení hodnot biologických variací. Součástí sdělení jsou údaje o celkových chybách měření, bias a nejistotě - jak se liší a co preferovat. Je dokumentována akutní potřeba harmonizace kontrolních limitů v programech externího hodnocení kvality. Také souvislost analytické kvality a účinnosti mezinárodních klinických doporučení.Závěr:
Nutnost harmonizace způsobu stanovení a z toho následně plynoucích druhů a hodnot indikátorů analytické kvality je podmínkou objektivního hodnocení kvality laboratoří v programech jejich externího hodnocení, objektivního hodnocení kvality různých metod různých výrobců a nezbytnou zárukou efektivní diagnostiky a managementu chorob bez ohledu na lokalizaci laboratoře a použité analytické metodologie.Klíčová slova:
indikátory kvality, EFLM, bias, nejistota, chyba, biologické variace.Stockholmská deklarace a pracovní skupina EFLM pro specifikaci požadavků na analytickou úroveň měření
V roce 1999 vytvořili experti zabývající se kontrolou kvality a metrologií, na setkání ve Stockholmu souhrn zásad, kterými by se měly řídit procesy řízení analytické kvality v klinických laboratořích. Tyto zásady vešly do vědomí jako „Stockholmská deklarace 1999“. Publikace autorů, na jejichž základě se deklarace vytvářela a shrnutí zásad deklarace byly uvedeny ve speciálním čísle časopisu Scandinavian Journal of Clinical and Laboratory Investigation ještě téhož roku [1].
Kritéria analytické kvality jsou podle zásad stockholmské deklarace definovaná jako maximální přípustné hodnoty preciznosti, bias a celkové chyby měření, určené jedním ze tří způsobů
- odvozením z klinických (diagnostických, terapeutických) potřeb
- odvozením z biologických variabilit
- odvozením ze současné úrovně analytické technologie a konsenzu expertů (state-of-the-art).
Při příležitosti 15 let výročí stockholmské deklarace byla v listopadu 2014 na téma kritérií analytické kvality uspořádána v Miláně „První strategická konference s tématem definice indikátorů analytické kvality“. Přednesené práce a závěry z nich učiněné byly ihned publikovány ve speciálním čísle časopisu Clinical Chemistry Laboratory Medicine [2].
Řešení problémů indikátorů analytické kvality měření v klinických laboratořích je oficiálně koordinováno Pracovní skupinou EFLM pro specifikaci požadavků na analytickou úroveň měření (EFLM task force on performance specification in laboratory medicine).
Tato pracovní skupina (task force) EFLM (Evropská federace laboratorní medicíny) je složena z pracovních podskupin pro určení:
- Hodnot celkové chyby (TE)
- Hodnot akceptovatelných limitů programů EHK
- Specifikace požadavků na extraanalytickou fázi
- Databáze biologických variabilit.
Významnou novinkou, která ještě v původní Stockholmské deklaraci 1999 nebyla uvedena, je i nově věnovaná pozornost extraanalytickým indikátorům kvality a možností kombinace výše uvedených způsobů.
Analytika a klinické požadavky
Přístup, formulující požadavky na kvalitu analytiky prismatem klinických potřeb, je velmi užitečný, logický. Může definovat pro klinické laboratoře potřebnou analytickou kvalitu objektivně tak, aby byly produkované výsledky měření jednotlivých analytů a parametrů nejen dostatečně kvalitní a díky tomu pro pacienty užitečné, ale i tak, aby nebyl vyvíjen přílišný tlak na zlepšování hodnot indikátorů kvality v míře, která není klinicky nutná, a přitom je zbytečně ekonomicky nákladná. Širší aplikaci přístupu brání nedostatek studií (zejména randomizovaných kontrolovaných studií), a obtížnost určit vazbu analytických výsledků ke klinickému stavu pa-cienta a cíli jeho léčby, která nebývá často zdaleka jasná a jednoduchá [3].
K ilustraci souvislosti mezi analytickou kvalitou výsledků měření a klinickými požadavky může posloužit souhrn aktuálně existujících požadavků na analytickou kvalitu, které jsou uvedeny v několika základních mezinárodních Doporučeních, týkajících se diagnózy a monitorování diabetu mellitu [4], infarktu myokardu [5], chronické ledvinové choroby [6], selfmonitoringu diabetiků [7] a rizika kardiálních a oběhových chorob [8], uvedený v Tabulce 1. Ale zatím je počet explicitně vyjádřených požadavků na hodnoty indikátorů kvality v odborných doporučeních nízký.
Tab. 1. Analytical requirements selected from important clinical guidelines 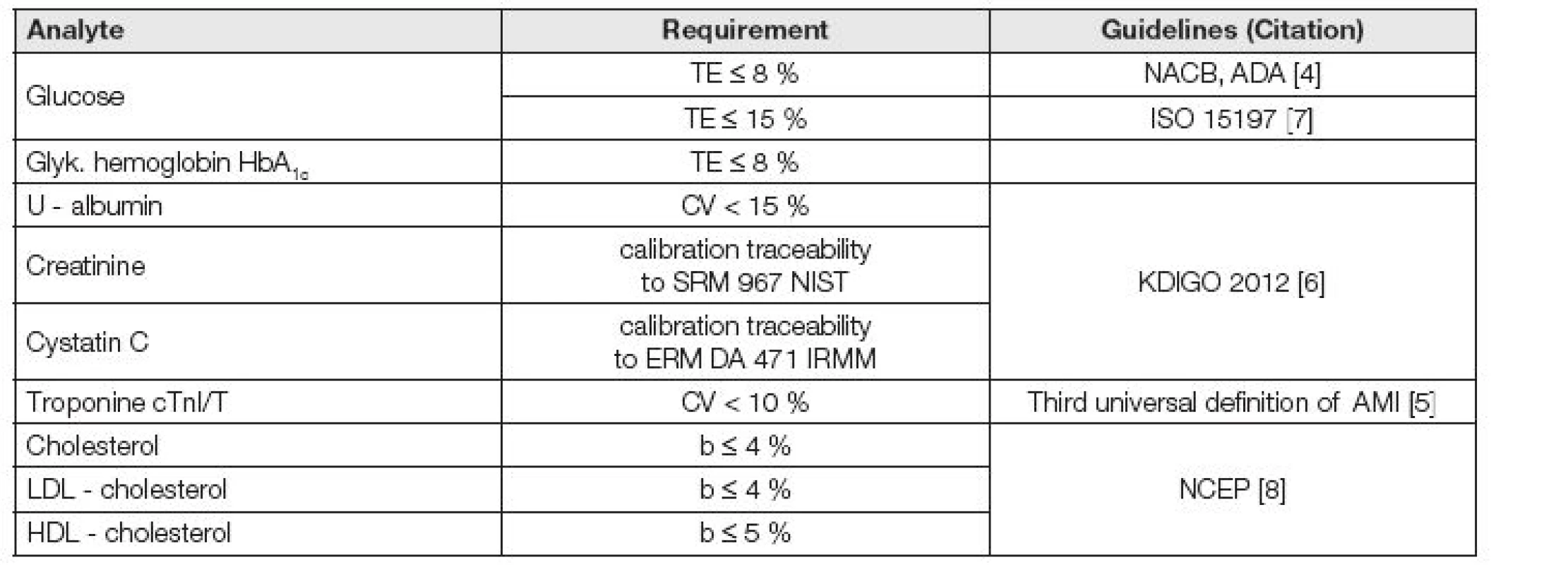
ADA - American Association of Diabetes (US) IRMM - Institute for Reference Materials and Measurements (BE) KDIGO - Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease (2012) NACB - National Academy of Clinical Biochemistry (US) NCEP – National Cholesterol Education Program (US) NIST - National Institute of Standards and Technology (US) Bias a jeho stanovení
Zatímco ke zjištění hodnot preciznosti často postačí statisticky zpracovat replikáty měření běžných biologických i kontrolních materiálů, ke stanovení hodnot bias je nezbytná existence referenčních materiálů s hodnotami, metrologicky návaznými na referenční metodu a s dostatečným stupněm komutability. Získání požadovaných hodnot bias je podmíněno dosažením potřebné úrovně standardizace a harmonizace analytických postupů a ta pak právě jen realizací metrologické návaznosti (řetězec). Omezený stupeň standardizace má za následek i omezenou znalost hodnot bias - vychýlení a z toho plynoucí omezení možností plně hodnověrných výpočtů hodnot kombinované nejistoty. To je i příčina, proč jsou dosud vztahy mezi analytickou kvalitou a klinickou utilitou převážně hodnoceny parametry náhodných chyb měření, i když by měly být rovnocenně brány v úvahu jak náhodné, tak i systematické složky chyb a odhady nejistot. To demonstroval recentně Petersen [9] na příkladu stanovení glykovaného hemoglobinu HbA1c, kdy dvě existující a tolerované kalibrace (dle DCCT a dle IFCC) významně ovlivňují i hodnoty preciznosti měření. Stejně tak se v důsledku neznalosti hodnot bias při stanovení troponinů cTnI a cTnT (které nejsou dosud standardizované), musíme spoléhat pouze na preciznost (a její cílovou hodnotu CV ≤ 10 %).
Znalost systematických složek chyb je u mnoha analytů bez patřičné standardizace a bez metrologické návaznosti iluzorní.
Proto převažují při hodnocení výsledků EHK a při ustanovování kontrolních limitů (Dmax) pro hodnocení klinických laboratoří rozdělení do metodických skupin (přesněji řečeno do stejnorodých skupin podle jednotlivých výrobců). Tím je dána závislost hodnocení analytické kvality na komerčních zájmech a vytvářeno falešné povědomí, že každá skupina metod je (zvláště u globálních výrobců) sama sobě standardem pravdivosti.
Recentně bylo tomuto problému v posledních letech věnováno několik obsáhlých prací, zabývajících se standardizačním a harmonizačním úsilím a shrnujících řadu výsledků zjištěných hodnot bias pro různé metody u teoreticky standardizovaných analytů s existujícím referenčním systémem a metrologickou návazností na něj. V nedávno uveřejněné práci je o nich pojednáno v českém jazyce [10].
Souhrn základních závěrů těchto studií uvádíme zde:
- diference mezi rutinními metodami (analytickými měřícími systémy, testovacími soupravami), dané patrně nedostatečnou úrovní kalibrací jsou podstatným zdrojem bias a jsou velmi podobné u různých kontrolních materiálů s odlišným složením a typem matrice pokud jsou tyto kvalitně vyrobeny a vybrány
- většina hodnot bias u základních elektrolytů a substrátů krevního séra má hodnotu b < ±4 % s výjimkou některých metod – testovacích souprav, patrně ne dostatečně správně kalibrovaných na referenci
- při měření katalytických koncentrací enzymů jsou navzdory dlouhodobě existujícím referenčním systémům pozorovány významně vysoké hodnoty bias vlivem nedůsledné aplikace reference (příkladem je běžná absence přídavku pyridoxal-5-fosfátu při stanovení ALT a AST; nedůsledná aplikace referenční metody IFCC pro měření LD v rutinní analýze, nedůsledná kalibrace některých metod měření α-amylázy na referenční metodu IFCC).
Je otázkou, jak důsledně aplikovat dosaženou úroveň standardizace měření enzymů v podmínkách, kdy jsou na trh dodávané standardními výrobci metody nestandardizované vedle standardizovaných metod IFCC, i když rozdíly mezi nimi občas překračují i hodnotu 200 % (jako je tomu při stanovení kat. k. LD).
Velké problémy se stanovením bias jsou i u lipidových analytů LDL a HDL cholesterolu [8]. Výsledky uvedené v této práci v podstatě nemohou rozhodnout, zda a v jakém poměru odpovídá za velmi neuspokojivé hodnoty bias kvalita samotných metod a/nebo komutabilita kontrolních vzorků (všechny použité byly nativního, nearteficiálního charakteru).
Komutabilita
S dostatečnou komutabilitou referenčních (jak kalibračních, tak i kontrolních) materiálů jsou velké problémy. Nedostatečně komutabilní kalibrátory jsou příčinou zvýšení systematických chyb o složku, způsobenou vlivy matrice, nedostatečně komutabilní kontrolní materiály zase poskytují zkreslený obraz hodnocení bias.
Nejjednodušším měřítkem komutability je dosažení požadované, dostatečně nízké hodnoty bias, zjištěné pomocí referenčních materiálů a metod [11].
Kvalitní kalibrační a kontrolní materiály s nativní matrici a s arteficiální matricí (umělou, často stabilizovanou lyofilizací), poskytující srovnatelné hodnoty bias vůči stejné referenci, a disponují také srovnatelnou úrovní komutability (Tabulka 2a). Stupeň komutability je možné verifikovat použitím stejných materiálů v konvenčních programech EHK a v programech EHK pro referenční laboratoře (RELA). Tak jsou čas od času i ověřovány kontrolní materiály programu SEKK, u nichž jsou předem k dispozici výsledky z programu EHK RELA IFCC (http://www.dgkl-rfb.de:81/4Daction/g_search_RELA/RELA2014/0000000000000000000) jak je uvedeno v Tabulce 2b.
Tab. 2. a. Dependency of bias on the matrix of control materials 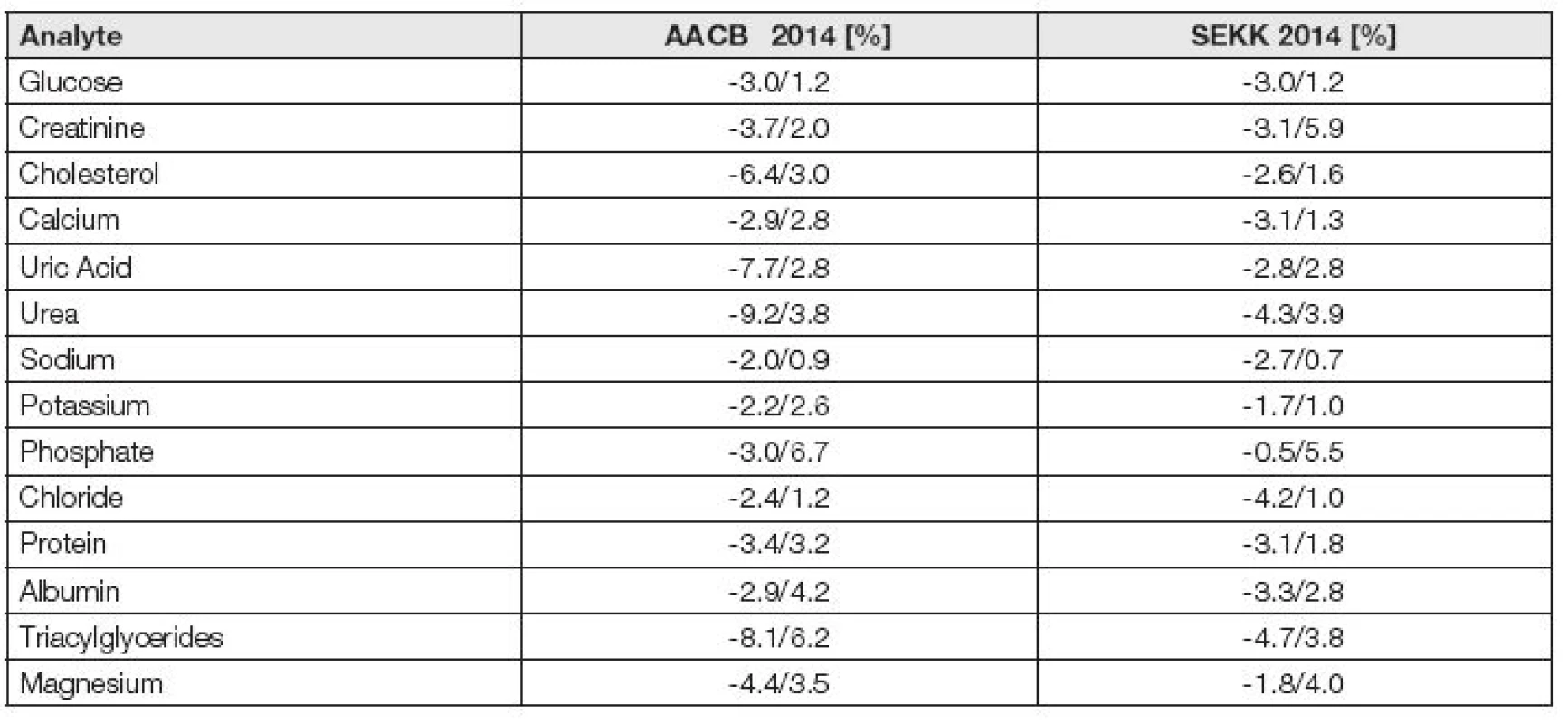

AACB - samples with mixed individual donors and pools with cetrified commutability (Australian Association of Clinical Biochemistry) SEKK - selected lyophilized samples without certified commutability, tested in program EQA RELA IFCC *large differences in standardized (IFCC 2011) and nonstandardized method High levels of bias in AACB results (25) - possible reasons: GGT - large difference between Abbott Architect and Beckman DxC Uric acid - only group Vitros (not used in SEKK) Bilirubin - probably not finished world recalibration from 2010? Table 2 b. Bias values in control material used in routine program SEKK and in IFCC EQA program RELA in 2014 
Ke stanovení hodnot bias lze v indikovaných případech při použití kvalitních a dobře vybraných a ověřených materiálů použít nejen speciálních komutabilních, nativních materiálů, které jsou ideální, ale i empiricky ověřených a důsledně v čase sledovaných lyofilizovaných arteficiálních materiálů programů EHK. Data Tabulek 2a a 2b jsou průkazem, že kontrolní materiály, použité v letech 2014 až 2015 v programech EHK RfB Německo a SEKK splňují výše uvedené podmínky pro stanovení hodnot bias.
Biologická variabilita (BV) a indikátory analytické kvality
Nejčastěji používané výpočty hodnot analytických indikátorů kvality vycházejí z použití biologických variabilit analytů a to navzdory faktu, že jejich určení vykazuje mnoho problémů [12]. Přes řadu námitek je použití biologických variací široce akceptované. Hlavní námitkou použití BV jsou velké rozdíly hodnot variabilit, zjištěné v různých publikovaných studiích, nebo často i v jejich odvození z nedostatečného počtu studií, které bývají navíc často ještě nespolehlivé. Tyto rozdíly v určení BV často plynou z nestandardních a obsoletních způsobů volby souborů probandů a následného výpočtu jejich statistik a metrologických dat [13]. Archiv hodnot biologických variabilit je uložen a průběžně aktualizován ve Westgardově databázi (http://www.westgard.com). Tam jsou také uvedeny z nich vypočtené a odvozené hodnoty preciznosti a bias.
Vztah mezi hodnotami biologické variability a hodnotami analytických indikátorů kvality je obecně používaný již řadu let ve tvaru:
CVa ≤ 0,5 × CVi [%]
b ≤ 0,25 × (CVi2 + CVg2)1/2 [%]
kde CVa je požadovaná analytická preciznost, CVi intraindividuální biologická variabilita, CVg interindividuální biologická variabilita a b požadovaný analytický bias.
A pro maximální přípustnou hodnotu celkové chyby TE pak ve tvaru:
TE = Z × CVa + b = 1,65 × CVa + b [%]
zde se volí často hodnota Z = 1,65 (dvoustranný test pro α = 10 %) a soudí se, že hodnoty TE by měly a mohly sloužit jako kontrolní limity programů EHK.
Celková chyba, nejistota měření a Sigmametrie jako indikátory analytické kvality
Použití Sigmametrie pro klinické laboratoře formuloval poprvé J. O. Westgard [14]. Při výpočtu celkové chyby měření pomocí výše uvedeného vztahu pak Sigmametrie spojuje hodnoty TE, bias a preciznosti do jediného jednoduchého vztahu σ = (TE-bias) / SD v absolutních jednotkách měření a v procentech pak (TE-bias / CV), kde všechny veličiny jsou uvedeny v %.
Sigmametrie není specifická pro použití v klinické laboratoři, ale slouží jako obecný indikátor kvality všech procesů (soubor prostředků a nástrojů ke zlepšení kvality). Právě Westgard inicioval její přenos z dlouhodobého použití v průmyslu do oblasti laboratorní medicíny. K jejímu využití se stále vedou diskuse, a to zejména z důvodů nekritického přenosu zásad průmyslové technologie do laboratorní medicíny [15]. Je založena na vyhodnocení počtu chybných výsledků (produktů) při formulování indikátorů kvality analytických měření a zejména procesů extraanalytických [16]. Protože je k určení hodnot sigma zapotřebí spolehlivě rozpoznat chybný výsledek, a nezbytnou podmínkou k její racio-nální aplikaci je správné, objektivní a harmonizované nastavení požadavků na kvalitu (zejména pak správně nastavené hodnoty požadované TE, tedy povoleného vychýlení Dmax).
Celková chyba, nebo nejistota?
Nejistota měření je indikátor analytické kvality, jejíž hodnoty jsou obecně vyžadovány normami kvality (ISO 17025 a ISO 15189) i v rutinních klinických laboratořích. Navzdory tomu není ve skutečnosti tento indikátor intenzivně využíván ani laboratořemi, ani programy EHK a ani výrobci v datech metrologické návaznosti jejich kalibrace/kalibrátorů.
Autoři, kteří se zabývají problémy stanovení nejistot v laboratorní medicíně, doporučují převážně použití postupu top-down. Data dílčích nejistot jsou získávána z dat:
- laboratorních statistik (obvykle z dat vnitřní kontroly kvality)
- z EHK programů (nejistoty, bias)
- z dat certifikátů referenčních materiálů (kontrolních vzorků, kalibrátorů).
Jde tedy o kombinaci dat reference a laboratorní variability. Podle Bragové a spol. [17] je rozpočet (budget) celkové kombinované nejistoty zhruba tvořen z jedné poloviny složkami dílčích nejistot reference (kalibrátory a transfer hodnot z reference do rutinní metodologie) a složkami laboratorní variability (precizností). Prvořadým předpokladem regulérního využívání hodnot nejistot jako primárního indikátoru analytické kvality je spolehlivý přístup laboratoří k datům dílčích nejistot reference. Ty by měly být dostupné v dokumentaci výrobců laboratorních testovacích souprav a analytických platforem formou nejistot hodnot kalibrátorů. Uvedená práce [17] tedy tvrdí, že zodpovědnost za analytickou kvalitu měření je rozdělena zhruba v poměru 1 : 1 mezi klinické laboratoře a výrobce analytických měřících systémů a testovacích souprav.
V Německu jsou regulovány hodnoty analytických indikátorů kvality formou Spolkového zákonného předpisu Německé lékařské komory RILIBÄK [18], který je organickou součástí německého zákona Medizinische Produkt-Gesetz. Rilibäk vypočítává požadované limity pro interní kontrolu kvality jako hodnoty RMSMD - root mean square of measurement deviation (odmocnina součtu druhých mocnin diferencí), zatímco jako maximální povolené odchylky od referenčních hodnot definuje méně přísné hodnoty MAD-maximum allowable differences (maximální povolená odchylka v EHK) a odpovídají našim hodnotám odchylek Dmax. Hodnoty MAD pak vycházejí z dat typu state-of-art [19]. Je však pociťována nutnost posunu těchto hodnot k přísnějším, které by více motivovaly laboratoře k zlepšování kvality a lépe vyhovovaly potřebám lékařů a jejich pacientů [20]. Přístupu RMSMD jako nástroje použitého v programu Rilibäku k vytváření limitů analytické kvality pro vnitřní kontrolu kvality bere na rozdíl od Westgardových pravidel v úvahu kombinaci náhodné i systematické složky nejistoty, a tak je v souladu se zásadami Stockholmské deklarace a Pracovní komise EFLM pro indikátory analytické kvality významně více, než vlastní Westgardova pravidla [21]. V dnes, často vyostřeným způsobem, diskutované otázce, zda dát jakožto indikátorům kvality přednost hodnotám TE (celkové chyby), nebo nejistoty nejspíš platí názor, že indikátor TE je dobrým prozatímním řešením problému, nicméně tam, kde platí nebo v budoucnu platit bude metrologická návaznost na referenci (traceability world) je perspektivním indikátorem kvality rozhodně nejistota a její odhad [22].
Harmonizace mezí/limitů EHK
Její potřeba je zřejmá, její úroveň v současnosti nedostatečná. Variabilita hodnot kontrolních mezí v různých programech EHK byla poprvé sumarizována v roce 1996 a hodnoty limitů se lišily zcela běžně až o 300 % [23]. V roce 2015 konstatuje australský autor [24], že po cca 20 letech se situace nízké úrovně harmonizace příliš neposunula k lepšímu. Toto tvrzení lze snadno demonstrovat s pomocí dat Tabulky 3, v níž jsou uvedeny intervaly mezí tří programů EHK (RCPA-QAP Austrálie, RfB Bonn Německo a SEKK Pardubice ČR).
Tab. 3. Intervals of acceptable values used in EQA programs RCPA-QAP Australia.RfB Bonn Germany. SEKK Czech Republic in analytes with calibration traceable to reference systems or harmonized by international clinical guidelines. 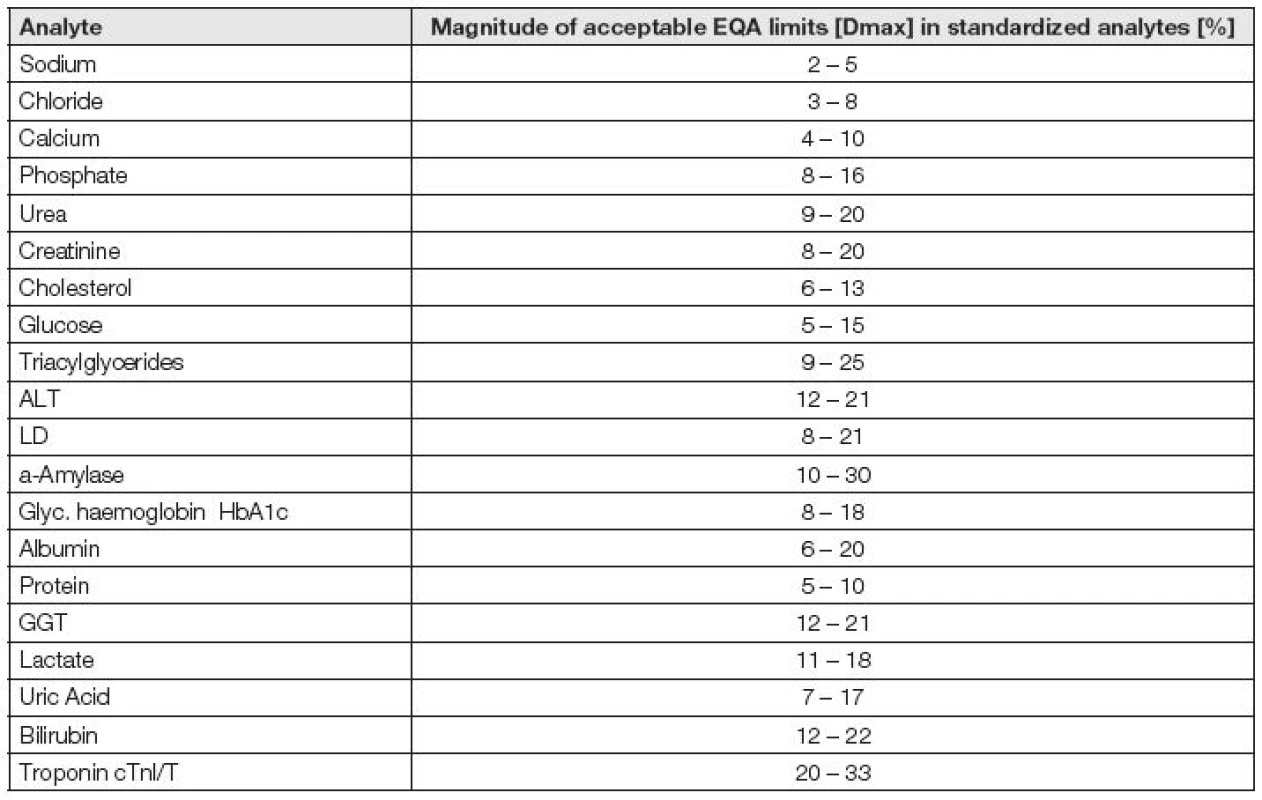
Zatímco jak ve Stockholmu (v roce 1999), tak v Miláně (v roce 2014) byly obecné zásady tvorby limitů pro EHK podrobně probrány, konkrétní postupy tvorby kontrolních mezí EHK zatím navrženy nebyly a nejsou. Přitom tyto meze jsou rozhodujícím nástrojem, jak analytickou kvalitu laboratoří a také analytických měřících systémů, testovacích souprav a metod hodnotit. Je pravděpodobné, že rozhodující roli v budoucnosti tvorby limitů EHK sehrají aplikace odhadu nejistoty výsledků měření, celkové chyby měření s přihlédnutím k exaktně určeným biologickým variabilitám [16]. Za ukázku relativní propracovanosti systému kontrolních limitů EHK je považován australský program RCPA-QAP [25].
Jsou údaje o četnosti chyb analytické fáze důvěryhodné?
Velmi oblíbeným zaříkávadlem, objevujícím se v posledních letech od publikace k publikaci je tvrzení, že četnost analytických chyb se pohybuje v intervalu 8 až 15 %. Odkud takové tvrzení pochází a jak asi vzniklo? Nápovědou může být publikovaný návrh indikátorů kvality analytické fáze, obsažený například v práci pracovní skupiny IFCC LEPS (Laboratory errors and pacient safety) o bezpečnosti pacientů [26, 27]. Za indikátory analytické kvality jsou v něm považovány:
- počty vyhovujících výsledků v EHK
- počty vyhovujících výsledků ve vnitřní kontrole kvality
- počet výsledků s CV nad limit.
Počty vyhovujících výsledků jak v programech EHK, tak i v systémech vnitřní kontroly kvality jsou však při absenci celosvětové harmonizace limitů kvality objektivně nevyhodnotitelné.
Četnost chyb analytické fáze při kvantifikaci celkového počtu chyb, udávaná řadou autorů nemá v současné době již z toho prostého důvodu žádnou výpovědní hodnotu a slouží jako okrasa sdělení a nástroj falešného pocitu uspokojení na nesprávném místě. Navíc svědčí o nízkém stupni koordinací pracovních skupin, řešících podobné problémy.
Do redakce došlo 12. 1. 2016
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
ÚKBD FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: friedecky@sekk.cz
Zdroje
1. Kallner, A., McQuenn, M., Heuck, C. Ed. The Stockholm consensus conference on quality specifications in laboratory medicine. Scand. J Clin. Lab. Invest, 1999, 59, p. 475-476.
2. Special Issue CCLM: 1st EFLM Strategic Conference/“Defining analytical performance goals – 15 years after Stockholm conference“. 2015.53 : 6.available 7.1.2016 on: http://www.degruyter.com/view/j/ccclm.2015.53.issue-6/issue-files/cclm.2015.53.issue-6.xml
3. Horvath, A. R., Bossuyt, P. M. M., Sandberg, S., John, A. S., Monaghan, P. J. at al.: Setting analytical performance specifications based on outcome studies-is it possible? Clin. Chem. Lab. Med., 2015, 53, p. 841-848.
4. Sacks, D. B. Ed.: Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus. 2011. NACB Laboratory medicine practice guidelines. Available 7. 1. 2016 on: https://www.aacc.org/~/media/practice-guidelines/diabetes-mellitus/diabetesmellitusentirelmpg.pdf?la=en.
5. Thygessen, K., Alpert, J. S., Jaffe, A. S., Simons, M. L., Chaitman, B. R., White, H. S. et al.: Third universal definition of myocadial infarction. Circulation, 2012, 126, p. 2020-2035.
6. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. J. Int. Soc. Nephrol. 2013.1/3 : 1-163. Available 7.1.2016 on: http:/www.kidney-international.org.
7. Friedecký, B., Springer, D. Kratochvíla, J., Škrha, J., Zima, T. Doporučení k použití.výběru a kontrole glukometrů. Klin. Biochem. Metab. 2014.22.155-164 Available 7.1.2016 on: http://www.cskb.cz.
8. Vesper, H. W., Wilson, P. W. F., Rifai, N. A message from the laboratory community to the National Cholesterol Education Program Adult. Treatment Panel IV. Clin. Chem., 2012, 58, p. 523-527.
9. Petersen, P. H. Performance criteria based on true and false classification and clinical outcomes. Influence of analytical performance on diagnostic outcome using a single clinical component. Clin. Chem. Lab. Med., 2015, 53(6), p. 849-856.
10. Friedecký, B., Kratochvíla, J. Bias měření základních analytů krevního séra. Výsledky a interpretace soudobých studií. Klin. Biochem. Metab., 2015, 23, p. 100-104.
11. Schimmel, H., Zegers, I. Performance criteria for refe-rence measurement procedures and reference materials. Clin. Chem. Lab. Med., 2015, 53(6), p. 899-904.
12. Ricós, C., Álvarez, V., Perich, C., Fernández-Calle, P., Minchinela, J. et al. Rationale for using data on biological variation. Clin. Chem. Lab. Med., 2015, 53(6), p. 863-870.
13. Carobene, A. Reliability of biological variation data available in an on line database: need for improvement. Clin. Chem. Lab. Med., 2015, 53(6), p. 871-877.
14. Westgard, J. O. Six Sigma Quality. Design and control. Westgard QC Inc. 2001.
15. Coskun, C., Serteser, M., Kilercik, M., Aksungar, F., Unsal, I. A new approach to calculating the Sigma Metric in clinical laboratories. Accred. Qual. Assur., 2015, 20, p. 147-152.
16. Oosterhuis, W. P., Sandberg, S. Proposal for the modification of the conventional model for establishing performance specification. Clin. Chem. Lab. Med., 2015, 53(6), p. 925-937.
17. Braga, F., Infusino, I., Panteghini, M. Performance criteria for combined uncertainty budget in the implementation of metrological traceability. Clin. Chem. Lab. Med., 2015, 53(6), p. 905-912.
18. Guideline of the German Medical Assotiation on Qua-lity Assurance in medical laboratory. Examinations-Rili-BAEK. J Lab. Med., 2015, 39, p. 26-69.
19. Haeckel, R., Wosniok, W., Streichert, T.: Optimizing the use of „state-of-the-art“ performance criteria. Clin. Chem. Lab. Med., 2015, 53(6), p. 887-891.
20. Orth, M. Are regulation-driven performance criteria still acceptable? German point of view. Clin. Chem. Lab. Med., 2015, 53(6), p. 893-899.
21. Petersmann, A., Nauck, H., Fuentés-Arderiu, X., Kallner, A. Auswertung interner Qualitätskontrollen: Vergleich zwischen der Rilibäk und den 1 : 2-s und 1 : 3-s Westgard Regeln. J. Lab. Med., 2015, 39(6), p. 403-410.
22. Panteghini, M., Sandberg, S.: Total error vs. measurement uncertainty. The Match continues. Clin. Chem. Lab. Med., 2015 DOI 10-1515/cclm-2015-1036.
23. Ricós, C., Baadenhuijsen, H., Libeer, C. J., Petersen, P. H., Stockl, D., Thienpont, L. at al. External quality assessment: currently used criteria for evaluating performance in European countries and criteria for future harmonization. Eur. J. Clin. Chem. Clin. Biochem., 1996, 34, p. 159-165.
24. Jones, G. R. D. Analytical performance specifications for EQA schemes-need for harmonization. Clin. Chem. Lab. Med., 2015, 53(6), p. 919-924.
25. Jones, G. R. D., Sikaris, K., Gill, J. Allowable Limits of performance for external quality assurance programs - an approach to application of the Stockholm criteria by the RCPA Quality Assurance Programs. Clin. Biochem. Rev., 2012, 33, p. 133-139.
26. Plebani, M., Chiozza, M. L., Sciacovelli, L. Towards harmonization of quality indicators in laboratory medicine. Clin. Chem. Lab. Med., 2013, 51, p. 187-195.
27. Plebani, M., Astion, M. L., Barth, J. R., Chen, W., de Oliveira Galoro, C. A. et al.: Harmonization of quality indicators in laboratory medicine. A preliminary consensus. Clin. Chem. Lab. Med., 2014, 52, 7, p. 951-958.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2016 Číslo 1
-
Všetky články tohto čísla
- Aktualizace poznatků o stavu měření 25-hydroxyvitaminu D v séru/plasmě. Minirewiew 2015 - 2016.
- IGF1 (insulin-like growth factor 1), základní charakteristika, signální dráha, závislost na věku a pohlaví
- Účinky signální dráhy IGF1 (insulin-like growth factor 1) na vznik a rozvoj nádorových onemocnění
- Úloha mitochondrií v patogenezi Huntingtonovy choroby
- Editorial
- Kritéria analytické kvality měření v klinické biochemii. Současný mezinárodní konsensus a jeho důsledky pro rutinní činnost klinických laboratoří.
- Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů
- Struktura protilátek a jejich reaktivita
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Struktura protilátek a jejich reaktivita
- Kritéria analytické kvality měření v klinické biochemii. Současný mezinárodní konsensus a jeho důsledky pro rutinní činnost klinických laboratoří.
- Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů
- Účinky signální dráhy IGF1 (insulin-like growth factor 1) na vznik a rozvoj nádorových onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



