-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stanovení ftalátů a bisfenolu A a jejich metabolitů v různých typech materiálů
Determination of phthalates and bisphenol A and their metabolites in different types of materials
Objective:
To apply analytical procedures for the determination of phthalates, bisphenol A and their metabolites in various matrices (urine, blood serum, adipose tissue, infusion sets) to instrumentation available in the lab and perform analysis of samples provided by the clinics. To determine the exposure to phthalates and bisphenol A in different epidemiological groups of patients and to confirm or refute the likely exposure to these substances during parenteral nutrition. To find out whether phthalates accumulate in human adipose tissue.Design:
A cross-sectional studyMaterial and Methods:
The study analyzed biological material (urine, blood serum, subcutaneous adipose tissue) and infusion sets for parenteral treatment by instrumental analytical techniques, allowing to determine the content of phthalates, bisphenol A and their metabolites.Results:
For 10 out of 16 analyzed metabolites, the resulting amounts found in the urine were in the range above the limit of quantitation in more than 50 % of the samples, e.g. monoethyl phthalate – 98.1 % and mono n butyl phthalate 78.1 % of samples. The highest amount characterized by 95th percentile was recorded for monoethyl phthalate – 192.8, mono-n-butyl phthalate – 116.7, and for mono-(2-ethyl-5-carboxypentyl) phthalate – 96.9 µg/L. In serum, the proportion of values lower than limit of quantitation was high except for mono-n-butyl phthalate. All the concentrations of analyzed phthalates and bisphenol A obtained by chromatographic analysis of materials, bags and infusion sets were below limit of quantitation as well as the concentrations in infusion solutions. In all the samples of subcutaneous adipose fat tissue the determined concentrations of selected phthalates were below limit of quantitation.Conclusion:
The concentrations of most metabolites in urine are measurable which makes possible their use in the analyses of epidemiological link to other investigated factors as obesity, or type 2 diabetes mellitus. Increased exposure to phthalates and bisphenol A for patients on total parenteral therapy has not been proven since those substances were detected neither in infusion sets materials nor in infusion solutions. Accumulation of selected phthalates in subcutaneous adipose tissue was not detected.Keywords:
phthalate metabolites, bisphenol A, urine, infusion set, high performance liquid chromatography–tandem mass spectrometry.
Autori: K. Vrbík 1; A. Vavrouš 1; J. Pavloušková 1; M. Malý 1
; Š. Svačina 2; R. Piecha 2; Z. Lacinová 2; D. Müllerová 3,4; D. Matějková 4; M. Mráz 2
Pôsobisko autorov: Státní zdravotní ústav, Praha 1; 3. interní klinika, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, Praha 2; Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Ústav hygieny a preventivní medicíny, Plzeň 3; 1. interní klinika Fakultní nemocnice, Plzeň 4
Vyšlo v časopise: Klin. Biochem. Metab., 24, 2016, No. 3, p. 153-159
Súhrn
Cíl studie:
Aplikovat analytické postupy pro stanovení ftalátů, bisfenolu A a jejich metabolitů v různých matricích (moč, krevní sérum, tuková tkáň, infuzní sety) na přístrojové vybavení laboratoře a provést analýzy vzorků poskytnutých klinickými pracovišti. Stanovit expozici ftalátům a bisfenolu A v různých epidemiologických skupinách pacientů a potvrdit či vyvrátit pravděpodobnou expozici těmto látkám při parenterální výživě. Zjistit, zda se ftaláty akumulují v lidské tukové tkáni.Typ studie:
průřezováMateriál a metody:
V rámci studie byl analyzován biologický materiál (moč, krevní sérum, podkožní tuková tkáň) a infuzní sety pro parenterální léčbu instrumentálními analytickými postupy umožňujícími stanovit obsahy ftalátů, bisfenolu A a jejich metabolitů.Výsledky:
U 10 ze 16 analyzovaných metabolitů byla jejich vyloučená množství v moči u více než 50 % vzorků nad mezí stanovitelnosti, např. monoethylftalát – 98,1 %, mono-n-butylftalát – 78,1 %. Nejvyšší koncentrace charakterizované 95. percentilem byly zjištěny u monoethylftalátu – 192,8, mono-n-butylftalátu – 116,7 a mono-(2-ethyl-5-karboxypentyl)ftalátu – 96,9 µg/l. V krevním séru bylo s výjimkou mono-n-butylftalátu zastoupení hodnot menších než mez stanovitelnosti výrazně vyšší. Chromatografické analýzy materiálů vaků a infuzních setů poskytly koncentrace vybraných ftalátů a bisfenolu A pouze v hodnotách pod mezí stanovitelnosti stejně jako v infuzních roztocích. Ve všech vzorcích podkožní tukové tkáně byly stanoveny koncentrace vybraných ftalátů pod mezí stanovitelnosti.Závěr:
Koncentrace většiny metabolitů ftalátů v moči jsou měřitelné a umožňují tak analýzy epidemiologických souvislostí s dalšími sledovanými faktory jako je obezita, či diabetes mellitus 2. typu. Zvýšená expozice ftalátům a bisfenolu A u pacientů odkázaných na úplnou parenterální léčbu nebyla prokázána, neboť nebyly tyto látky prokázány v materiálech infuzních setů a ani v infuzních roztocích. Akumulace vybraných ftalátů v podkožní tukové tkáni nebyla zjištěna.Klíčová slova:
metabolity ftalátů, bisfenol A, moč, infuzní sada, vysoce účinná kapalinová chromatografie-tandemová hmotnostní spektrometrie.Úvod
Expozice ftalátům (dialkyl–, diaryl – a alkylaryl-esterům kyseliny ftalové) a bisfenolu A (2,2’-bis(4-hydroxyfenyl)propan); BPA) je v běžné populaci významná, ale i velice variabilní z kvalitativního i kvantitativního pohledu.
Ftaláty se používají v řadě produktů jako rozpouštědla a fixativa, ale především jako změkčovadla některých typů plastů zejména polyvinylchloridu (PVC), ve kterém však nejsou chemicky vázány a proto mohou snadno migrovat do okolního prostředí. Použití ftalátů je omezeno evropskou legislativou [1,2,3,4,5].
Nejvýznamnější expoziční cesta je perorální (potraviny, pitná voda, léky). Perkutánní cesta (penetrace kůží nebo sliznicí) se může uplatnit u kosmetických výrobků a prostředků osobní hygieny. Riziko expozice intravenózní cestou se zmenšuje, neboť řada výrobců přestala používat pro infuzní sety povolený měkčený PVC [4,5]. Přímá inhalace ftalátů je vzhledem k jejich vysoké teplotě varu málo pravděpodobná, ale do dýchacího ústrojí se mohou dostat ze zvířeného prachu v interiérech či dopravních prostředcích. Byla prokázána expozice ftalátům i lidských plodů transplacentární cestou.
Ftaláty patří mezi endokrinní disruptory podílející se na rozvoji metabolických onemocnění např. obezity, diabetu mellitu 2. typu, arteriální hypertenze a dyslipidemie. V mnoha epidemiologických studiích byly při pokusech na zvířatech prokázány reprotoxické a karcinogenní účinky [6]. Ftaláty také pravděpodobně zvyšují riziko vzniku alergií, astmatu a vývojových vad.
V poslední době byla zaznamenána snaha nahradit nejrizikovější ftaláty v PVC jako dibutyftalát (DBP) a di-(2-ethylhexyl)ftalát (DEHP) diisononylftalátem (DINP), diisodecylftalátem (DIDP) příp. „neftalátovými“ změkčovadly [7].
Metabolismus ftalátů je popisován jako dvoustupňová biotransformace [8]. V první fázi dochází k poloviční hydrolýze ftalátu za vzniku příslušného monoalkylftalátu, načež monoestery s delším řetězcem vzápětí podléhají druhému stupni biotransformace – oxidaci za vzniku postupně hydroxy-, oxo - a karboxy-derivátů, nebo může dojít až ke zkrácení alkylového řetězce. Monoestery většinou nezůstávají volné, ale vytvářejí glukuronidové konjugáty (glukuronidy). Metabolismus ftalátů je rychlý, neboť v moči byla nalezena maxima koncentrací metabolitů DEHP již po cca 4 hodinách od expozice, po 24 hodinách je koncentrace na zlomku původní hodnoty [9]. Problém rychlého metabolismu lze řešit provedením 24hodinového sběru moči. Obsah metabolitů v moči se často standardizuje vztažením na hmotnost kreatininu.
V laboratoři se ze vzorku moči i séra odfiltrují pevné částice, stabilizuje pH, přidají isotopicky značené vnitřní standardy (analogy metabolitů) a rozštěpí glukuronidy enzymem v inkubovaném prostředí. Vzorek se koncentruje extrakcí na pevnou fázi (SPE) nebo SPME napojenou na plynovou chromatografii a hmotnostní detekcí (GC-MS) [10]). Častěji se používá koncentrační modul (SPE RAM phase) spojený s vysoce účinným kapalinovým chromatografem a tandemovým hmotnostním spektrometrem (HPLC-MS/MS) [11,12,13].
Ročně se objevuje několik prací popisujících biomonitoringové studie prováděné u různých skupin populace po celém světě. SZÚ zastupoval ČR v celoevropském projektu DEMOCOPHES [14,15].
BPA se používá hlavně při výrobě polykarbonátových plastů a epoxidových pryskyřic. Je součástí konzervových laků, hraček, nádob na vodu, očních čoček, sportovního vybavení, CD a DVD nosičů a spotřební elektroniky [16]. Může se uvolňovat při hydrolýze zdravotnických prostředků (implantáty, katetry, trubičky, dentální materiály). Jeho využití je omezeno evropskou legislativou [2,17,18]. BPA je jedním z nejznámějších endokrinních disruptorů, který může vyvolávat řadu hormonálních poruch vč. obezity a diabetes mellitus. Byly u něho prokázány hepatotoxické, neurotoxické, mutagenní, karcinogenní a teratogenní účinky [19]. BPA je konjugován do glukuronidů nebo sulfátů, které umožňují jeho rychlé vyloučení z organismu. Maximum koncentrace konjugátu v krevní plazmě bylo zjištěno v 80. min [20], po 24 h byl neidentifikovatelný.
V laboratoři byla pro stanovení BPA i metabolitů ftalátů použita společná příprava vzorků vycházející z běžných postupů [21,22]. Vzorek byl po inkubaci zředěn a přímo nastříknut do HPLC-MS/MS systému. Laboratoř SZÚ se s tímto postupem úspěšně zúčastnila mezilaboratorních zkoušek v roce 2012 [23].
Měkčené PVC se využívá při řadě medicínských výkonů. Z vaků a kanyl mohou být pacienti exponováni aditivům, které migrují do transportovaných kapalin [7]. Pacienti jsou při parenterální léčbě zásobováni všemi nezbytnými látkami – aminokyselinami, lipidy a glukózou. S použitím vaků a hadiček z PVC a s 10 % lipidů v infuzi může být pacient exponován až 130 µg DEHP/kg/den [24], přitom tolerovatelný denní příjem (TDI) dle EFSA z potravy je pouze 50 µg DEHP/kg.
Pro spolehlivé stanovení druhu a množství změkčovadla se musí vzorek materiálu plastu nejprve rozpustit v tetrahydrofuranu a PVC zpětně vysrážet ethylalkoholem [25]. Supernatant se analyzuje pomocí techniky GC-MS. Pro stanovení BPA v materiálu vaků resp. hadiček byl v laboratoři připraven výluh do 95 % etanolu, který byl analyzován HPLC-MS/MS technikou.
Ftaláty i BPA se mohou objevit i ve výživových emulzích. Proto byly aminokyselinové a glukózové náplně vaků analyzovány přímým nástřikem do HPLC-MS/MS systému. Lipidové roztoky musely být nejdříve extrahovány acetonitrilem a čištěny na SPE kolonce.
V dřívějších studiích bylo konstatováno, že ftaláty i BPA opouští lidský organismus převážně v moči a stolici a že se v tkáních neakumulují [26,27]. Pro ověření této informace byla vyvinuta metoda využívající HPLC–MS/MS.
Materiál a metody
Etická komise ve VFN v Praze souhlasila na základě předložených návrhů informovaných souhlasů pacientů s realizací projektu NT14182-3/2013 dne 29. 6. 2012.
Stanovení ftalátů a BPA v moči a krevním séru
Vytipovaní pacienti (probandi) ze všech klinických pracovišť byli požádáni, aby sbírali veškerou moč po celých 24 h do jediné předem prověřené třílitrové nádoby z PE (Sarstedt). Následující den v ranních hodinách byl zjištěn na příslušném klinickém pracovišti celkový objem nasbírané moči a z něho odebrán 10ml vzorek do skleněné šroubovací vialky (Chromservis) a vzápětí uchován při -18 °C do zahájení laboratorní analýzy. Vybraným pacientům byly na klinických pracovištích jednorázově odebrány v ranních hodinách vzorky krve a z nich připraven následujícím způsobem vzorek krevního séra: Plná krev (5 ml) byla nabrána do kyvety bez antikoagulantu a poté odložena ve svislé pozici při pokojové teplotě na 30-45 min. Centrifugace probíhala při -5 °C na odstředivce po dobu 5 minut při 10000 rpm. Poté byla opatrně odebrána horní čirá vrstva a převedena do čisté 2ml mikrozkumavky z PE (Eppendorf). Vzorek byl ihned uložen při teplotě -18°C do zahájení laboratorní analýzy.
V den provádění analýz byly vzorky moči i séra ponechány při laboratorní teplotě, dokud samovolně neroztály. K 500 µl vzorku bylo přidáno 25 μl roztoku vnitřních standardů isotopicky značených analogů metabolitů ftalátů a BPA (Sigma-Aldrich, Dr. Ehrenstorfer, Cambridge Isotope Laboratories, Institut für Dünnschichttechnologie und Mikrosensorik, dar Prof. Jürgena Angerera z University v Erlangenu; viz Tabulka 1) o jednotné koncentraci 800 µg/l, 100 µl vodného roztoku octanu amonného (Sigma-Aldrich) o koncentraci 1 mol/l a 5 µl roztoku β-glukuronidázy/arylsulfatázy (30 j/ml / 60 j/ml, Merck). Vzorky byly inkubovány 90 min při 37 °C. Přídavkem 655 μl acetonitrilu (Sigma-Aldrich) a 20 μl bezvodé kyseliny octové (Sigma-Aldrich) byla zastavena enzymatická reakce a zároveň došlo k precipitaci přítomných bílkovin. Po centrifugaci (5 min při 10000 rpm a -5 °C) na odstředivce (Universal 320R, Hettich) byla ze vzorku odebrána čirá kapalná fáze k analýze pomocí HPLC–MS/MS techniky sestávající z kapalinového chromatografu Infinity 1290 s tandemovým hmotnostním spektrometrem Agilent 6490A, vybaveným iontovým zdrojem Jetstream (ovládací a kvantifikační software MassHunter Workstation, ver. B.05, vše Agilent Technologies). Separace analytů probíhala na koloně Kinetex 2,6 µm Phenyl-hexyl 100A, 150×3,0 mm (Phenomenex) pomocí mobilní fáze s gradientem (A) demineralizovanou vodou s 0,1 % (v/v) kyseliny mravenčí (Sigma-Aldrich) a (B) metanolem (Sigma-Aldrich) s 0,1 % (v/v) kyseliny mravenčí. Systém byl dále vybaven kolonou Kinetex 5 µm Phenyl-hexyl 100A, 50×2,1 mm (Phenomenex) instalovanou mezi pumpu mobilní fáze a injektor, aby bylo zamezeno kontaminaci z mobilní fáze.
Tab. 1. Overview of phthalates, their metabolites and corresponding isotopically labeled analogues 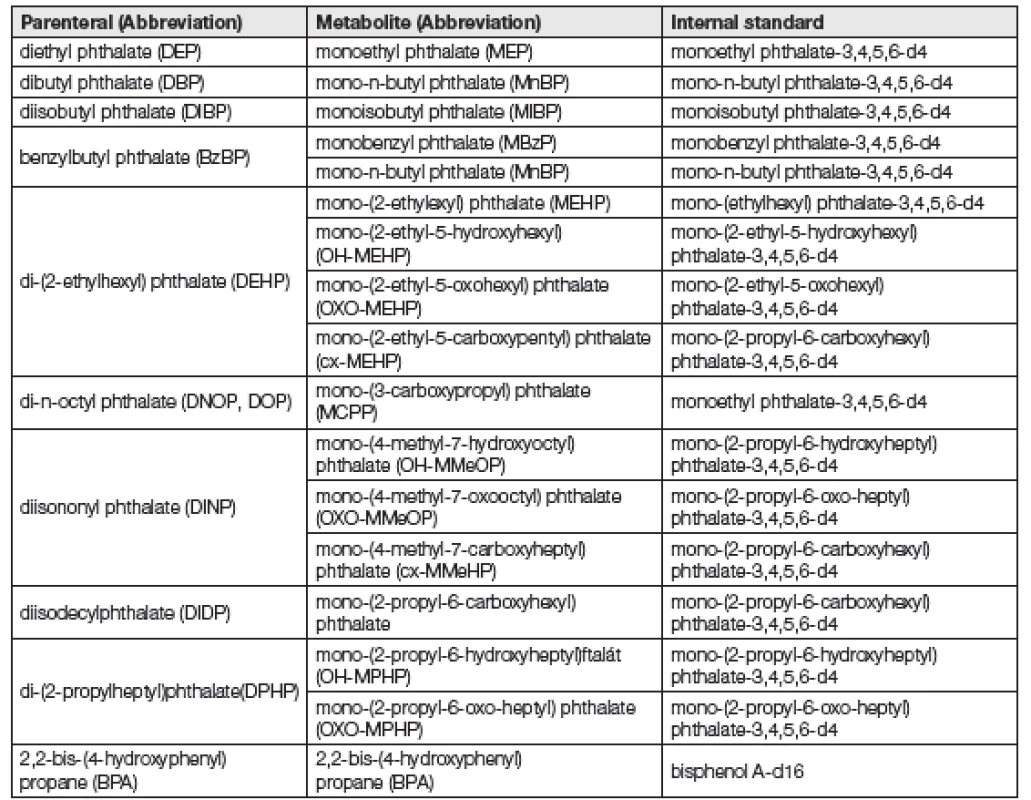
Jako kalibrační standardy, seznam viz Tabulka 1, sloužily vodné roztoky standardních látek analytů o koncentrací 1 až 1000 µg/l, které byly zpracovány stejně jako vzorky moči nebo séra (procesní kalibrace). Kvantifikace analytů byla provedena pomocí kalibrace využívající isotopicky značené analogy analytů. Základní validační parametry metody jsou uvedeny v Tabulce 2.
Tab. 2. Validation parameters of BPA and phthalate metabolites for HPLC-MS/MS method in urine and blood serum and characterization of obtained results by proportion of values below limit of quantification and 95th percentile 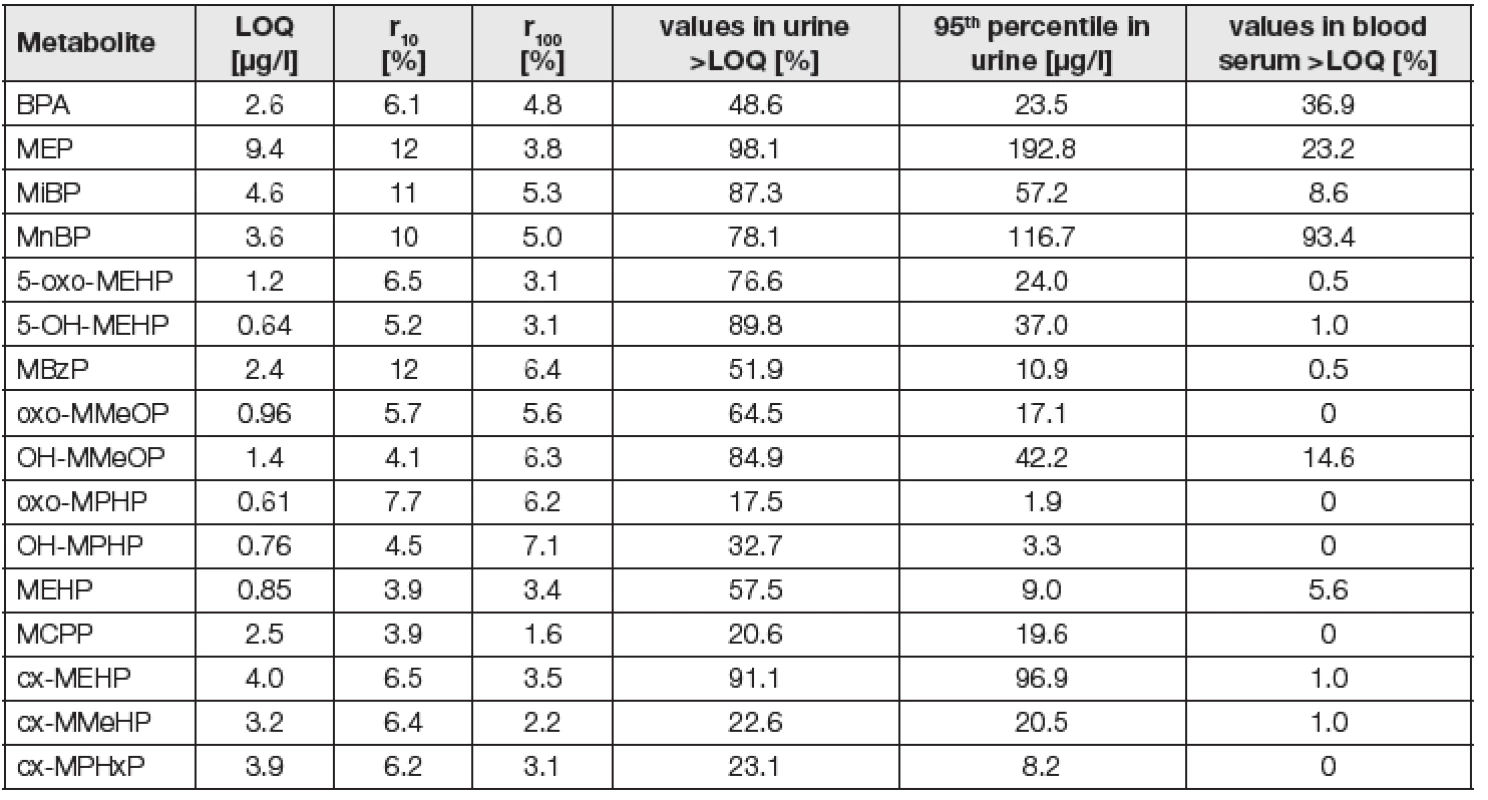
LOQ = 10 sa/b, where sa is standard deviation of intercept and b is average slope r10, r100: Inter-series repeability at concentration level, expressed as relative standard deviation (RSD) at metabolite concentration level 10 and 100 ng/L. Ve stejných vzorcích moči prováděla analýzy kreatininu jiná laboratoř v SZÚ akreditovanou chromatografickou metodou [30]. Také ona uspěla v mezilaboratorních porovnávacích zkouškách organizovaných EQUAS [23].
Stanovení expozice ftalátům a BPA při parenterální léčbě
Z klinického pracoviště VFN Praha obdržela laboratoř sedm kompletních, ale již vyprázdněných sad pro parenterální léčbu. Komplety vznikly kombinací tří komerčně plněných vaků různých výrobců a jedné emulze all-in-one připravené ve VFN. Pro transport emulze z vaku do žíly pacienta byla ve všech kompletech použita stejná infuzní sada (set), viz přehled v Tabulce 3.
Tab. 3. Overview of materials of bags and intravenous sets used in VFN, Prague; phthalate and BPA concentration in plastic parts 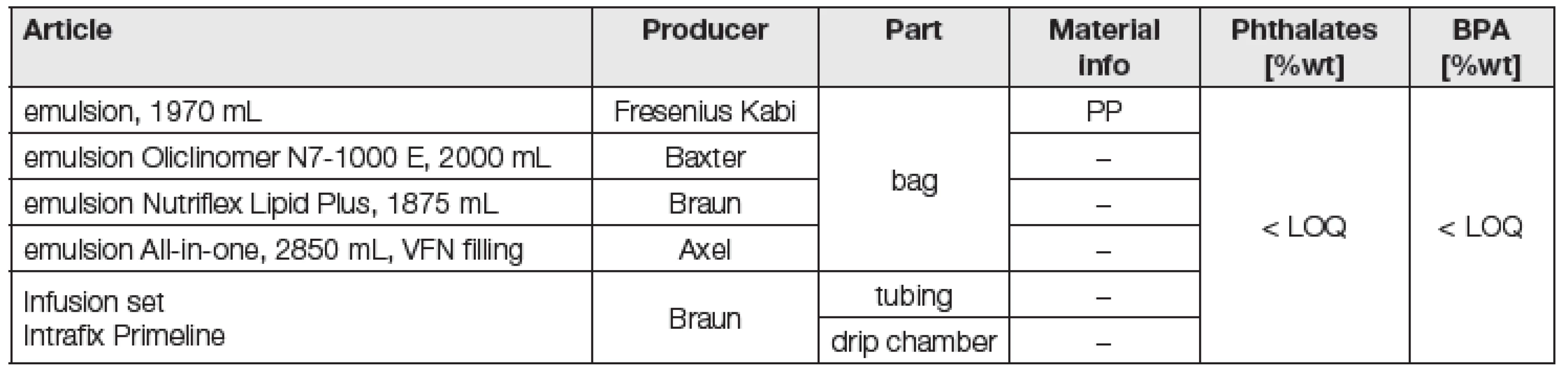
Pro stanovení ftalátů byla použita akreditovaná zkouška, při které bylo do vialky naváženo přibližně 0,05 g vzorku plastu, přidáno standardní množství interního standardu (IS) difenylftalátu (Sigma-Aldrich) a 2,5 ml tetrahydrofuranu (Sigma-Aldrich). Obsah vialky byl ponechán v ultrazvukové lázni, dokud se vzorek nerozpustil nebo minimálně 30 min. Bylo přidáno 5 ml bezvodého etanolu (Sigma-Aldrich), který vysrážel PVC. Teprve z vyčeřeného supernatantu byl odebrán vzorek pro GC MS analýzu, která probíhala na plynovém chromatografu (7890A) s hmotnostním detektorem (5975C, obojí ovládáno softwarem MSD Chemstation, ver. E02, vše Agilent Technologies) na koloně DB-5MS UI (30 m, 0,25 mm, 0,25 µm, Agilent Technologies) při průtoku 1,5 ml He/min, nástřik splitless (300 °C), se standardním teplotním programem. Byly zaznamenávány intenzity kvantifikačních a kvalifikačních iontů v režimu single ion monitoring (SIM). Kvantifikace byla prováděna metodou IS s pomocí kalibrační závislosti získané analýzou směsných roztoků výše jmenovaných ftalátů o koncentracích 0,2–20 mg/l. Při předchozí validaci byly stanoveny následující hodnoty mezí stanovitelnosti (LOQ) v hm. %: DBP – 0,005, BzBP – 0,003, DEHP – 0,004, DOP – 0,003, DINP – 0,03 a DIDP – 0,02.
Případná přítomnost BPA v materiálu vaků a hadičce byla prověřena analýzou extraktu, připraveného z 0,5 g vzorku do 10 ml 95 % etanolu po 24 h při 40 °C, pomocí dříve popsané HPLC–MS/MS techniky. Separace analytů probíhala na koloně Kinetex Phenyl-hexyl 100A (150 × 3,0 mm, 2,6 µm, Phenomenex) při průtoku mobilní fáze 0,3 ml/min s gradientem: roztok (A) 2 mmol octanu amonného (Sigma-Aldrich)/l demineralizované vody a roztok (B) 2 mmol octanu amonného/l metanolu. LOQ metody činila 1,5·10-5 hm. % BPA.
Podle mnohých studií je populace nejvíce exponována ftalátům konzumací kontaminovaných potravin a pitné vody. Proto jsme se pokusili stanovit BPA a ftaláty přímo v náplních infuzních vaků. VFN Praha nabídla dva takové nepoužité výrobky, viz Tabulka 4, které standardně poskytují svým pacientům odkázaným na parenterální léčbu. Pro stanovení BPA i ftalátů opět posloužila výše popsaná HPLC-MS/MS technika. Separace analytů probíhala na koloně Poroshell 120 EC-C18 (150 × 3,0 mm s velikostí částic 2,7 µm, Agilent Technologies) při průtoku mobilní fáze 0,4 ml/min s gradientem: roztok (A) 2 mmol octanu amonného/l demineralizované vody a roztok (B) 2 mmol octanu amonného/l metanolu. Zatímco vodné roztoky aminokyselin a glukózy byly analyzovány přímým nástřikem (bez úpravy vzorku) 5 µl do HPLC systému, lipidová emulze před stanovením procházela následující úpravou: 2 ml lipidové emulze byly extrahovány pomocí 6 ml acetonitrilu (Sigma-Aldrich) po dobu 10 min za intenzivního třepání. Po centrifugaci (30 min, 9000 rpm) byla horní acetonitrilová vrstva přenesena na metanolem (Sigma-Aldrich) aktivovanou SPE kolonku DSC–18 (6 ml, 500 mg, Sigma-Aldrich). Další 4 ml metanolu byly použity k eluci analytů z SPE kolonky, čímž bylo získáno celkem 10 ml přečištěného extraktu, který byl následně analyzován HPLC–MS/MS metodou popsanou výše. Kvantifikace byla provedena metodou standardního přídavku.
Tab. 4. Concentrations of phthalates in the filling of two intravenous sets 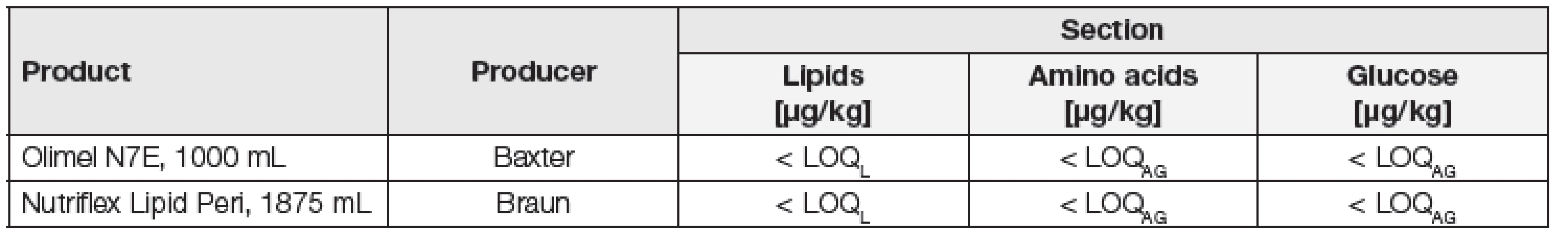
LOQL – LOQ in lipid matrix; LOQAG – LOQ in amino acid and glucose matrix Meze stanovitelnosti této metody v mg/kg v lipidické matrici (LOQL) mají následující hodnoty: BPA – 0,05, BzBP – 0,004, DBP – 0,1, DEHP – 0,2, DEP – 0,1, DIBP – 0,08, DIDP – 0,04, DINP – 0,3 a DOP – 0,05. Meze stanovitelnosti v mg/kg v aminokyselinové a glukózové matrici (LOQAG) mají následující shodné hodnoty: BPA – 0,01, BzBP – 0,005, DBP – 0,09, DEHP – 0,09, DEP – 0,01, DIBP – 0,02, DIDP – 0,008, DINP – 0,015 a DOP – 0,005.
Stanovení ftalátů v tukové tkáni
Pro studii byli získáni dobrovolníci z řad pacientů VFN, Praha, kterým byl odebrán cca 1 g vzorku podkožní tukové tkáně v oblasti břicha v lokální mesocainové anestézii (biopsie) a uchován při -18 °C do laboratorní analýzy.
Před analýzou v laboratoři SZÚ byly zmrzlé vzorky ponechány při laboratorní teplotě cca 2 hodiny. 1 g vzorku byl extrahován 6 ml acetonitrilu (Sigma-Aldrich) s použitím vysokoobrátkového homogenizátoru (VWR). Po odstředění byl extrakt přenesen na SPE kolonku DSC–18 (6 ml, 500 mg, Sigma-Aldrich) předem aktivovanou 2 ml methanolu (Sigma-Aldrich) a eluován 4 ml metanolu. K analýze byla použita opět HPLC–MS/MS technika. Separace analytů probíhala na koloně Poroshell 120 EC-C18 (150 × 3,0 mm, 2,7 µm, Agilent Technologies) při průtoku mobilní fáze 0,4 ml/min s gradientem: roztok (A) 2 mmol octanu amonného/l demineralizované vody a roztok (B) 2 mmol octanu amonného/l metanolu. Pro kalibraci byly použity matriční standardy v rozsahu 1–300 µg/l.
U navržené a částečně validované metody byly stanoveny následující LOQ v mg/kg tukové tkáně: DEP – 0,057, DIBP – 0,051, DBP – 0,043, BzBP – 0,010, di-n-pentylftalát (DNPP) – 0,028, di-n-heptylftalát (DHpP) – 0,010, DEHP – 0,20, dioktylftalát (DNOP) – 0,010, DINP – 0,25 a DIDP – 0,053.
Pro statistické hodnocení všech dat byl použit software Stata, verze 9.2 (StataCorp LP, College Station, TX, USA).
Výsledky a diskuse
Stanovení ftalátů a BPA v moči a krevním séru
Výsledky stanovení metabolitů ftalátů a BPA byly uváděny v µg/l moči nebo séra a pro další zpracování byly u moči standardizovány vztažením na obsah kreatininu (µg/g), případně vyjádřeny jako hmotnost metabolitů vyloučených v moči za 24 h (µg/den).
Celkem bylo analyzováno 912 vzorků moči a 198 vzorků krevního séra. U vzorků moči se zastoupení vzorků nad LOQ pohybovalo v rozsahu od 17,5 % u mono-(2-propyl-6-oxo-heptyl)ftalátu (OXO-MPHP) po 98,1 % u MEP a u 10 ze 16 sledovaných látek bylo nad 50 %, viz Tabulka 2. Při analýzách krevního séra bylo s výjimkou MnBP zastoupení vzorků pod LOQ velmi vysoké, což lze vysvětlit jednorázovým ranním odběrem vzorků krve probandů (moč sbírána 24 h), kteří nejsou v nočních hodinách běžně exponováni ftalátům. Obdobně nízké koncentrace v séru pod LOQ byly zjištěny i v dánské studii [32].
Pro vzorky moči je v Tabulce 2 uveden 95. percentil jako charakteristika nejvyšších zjištěných množství. Hodnota 95. percentilu byla pro sledované metabolity ftalátů 3–10krát vyšší než příslušný medián, u BPA to bylo 18krát vyšší, což svědčí o vysoké variabilitě expozice.
Laboratorní výsledky měření byly propojeny s informacemi v dotaznících a s výsledky vyšetření provedenými na všech klinických pracovištích, a následně statisticky zpracovány. Podrobnější výsledky byly publikovány v odborné stati [31].
Stanovení expozice ftalátům a BPA při parenterální léčbě
Výsledky analýz BPA a ftalátů v materiálech vaků a hadiček určených pro parenterální léčbu jsou uvedeny v posledních dvou sloupcích Tabulky 3. U všech měřených ftalátů i BPA byly zjištěny koncentrace < LOQ.
V žádném oddílu vaků nebyly nalezeny koncentrace BPA a ani ftalátů v koncentracích vyšších než jsou LOQ ve všech typech matric, viz Tabulka 4. Budeme-li např. předpokládat expozici 60kg lidského organismu ze 2 kg náplně vaků na úrovni LOQ naší metody, pak je teoreticky exponován maximálně 3 µg DEHP/kg/den, což je mnohokrát méně než TDI (50 µg DEHP/kg/den). Neprokázalo se tedy, že by pacienti odkázaní na parenterální výživu poskytovanou VFN Praha byli za použití běžně tam používaných vaků, infuzních sad a výživových emulzí exponováni BPA a ftalátům.
Z výše uvedených důvodů, tedy prakticky nezjistitelné expozice BPA a ftalátům během parenterální léčby (pravděpodobně hluboce pod TDI), nemělo smysl testovat přítomnost metabolitů BPA a ftalátů z tohoto zdroje v moči pacientů. Z druhé strany je pozitivní, že pacienti odkázaní na parenterální léčbu nejsou zatěžováni touto cestou BPA a ftaláty.
Stanovení ftalátů v tukové tkáni
Popsanou metodou bylo analyzováno celkem 15 vzorků lidské tukové tkáně. U všech vzorků byly zjištěny obsahy pod LOQ u všech stanovovaných ftalátů, což mohlo být způsobeno mimo jiné i převážně nízkými reálnými navážkami vzorků (0,15-0,96 g) oproti optimalizovanému 1 g. Pokud porovnáme hodnoty LOQ námi použité metody DBP – 0,043, BzBP – 0,010, DEHP – 0,20 se zjištěnými obsahy ftalátů v dřívější studii [28] DBP 0,10 0,79, DEHP 0,3 1,0 a nedávné studii [29] se středními hodnotami obsahu DBP, BzBP a DEHP v rozpětí mezi 0,0398 a 0,333 mg/kg, pak lze konstatovat, že akumulace ftalátů u námi testované skupiny probandů není vyšší než u srovnávaných studií.
Výsledky budou ještě prokazatelnější, až se nám podaří zlepšit citlivost metody použitím zvýšené navážky vzorku a úpravami současného postupu.
Závěr
Dnes již existují mnohokrát epidemiologicky doložené hypotézy, podle kterých se expozice ftalátům a bisfenolu A může podílet na rozvoji metabolických onemocnění např. obezity, diabetu mellitu 2. typu, arteriální hypertenze a dyslipidemie. V laboratoři SZÚ byly aplikovány v odborné literatuře popsané analytické postupy případně vyvinuty vlastní pro stanovení BPA, ftalátů a jejich metabolitů v různých matricích jako moč, krevní sérum, tuková tkáň, infuzní sety a emulze určené pro výživu pacientů odkázaných na parenterální léčbu.
Analýzou vzorků a jejich statistickým zpracováním bylo zjištěno, že u 10 ze 16 sledovaných látek (metabolitů ftalátů a BPA) bylo v případě moči nad příslušnou mezí stanovitelnosti více než 50 % výsledků analýz, zatímco v krevním séru byla taková látka pouze jedna. Pro další analýzy epidemiologických souvislostí je tudíž možné a vhodné využít výsledků stanovení v moči, ale koncentrace v krevním séru jsou pro tento účel příliš nízké.
Zvýšená expozice ftalátům a BPA u pacientů VFN Praha odkázaných na úplnou parenterální léčbu nebyla prokázána, neboť plastové součásti infuzních setů i samotné infuzní roztoky obsahovaly ftaláty a BPA v množstvích pod LOQ.
Na základě výsledků stanovení obsahu ftalátů v podkožní tkáni dobrovolníků (vše pod LOQ) pravděpodobně nedochází k akumulaci ftalátů v lidském organismu. Úkolem do budoucna je vyvinout citlivější analytický postup a vzápětí prověřit obsah ftalátů v dalších typech tukových tkání.
Podporováno Interní grantovou agenturou Ministerstva zdravotnictví České republiky (NT14182-3/2013)
Do redakce došlo 26. 4. 2016
Adresa pro korespondenci:
Ing. Karel Vrbík
Státní zdravotní ústav
Šrobárova 48,
100 42 Praha 10
e-mail: karel.vrbik@szu.cz
Zdroje
1. Nařízení Evropského parlamentu a Rady (ES) č. 1907/2006 ve znění nařízení Komise (ES) č. 552/2009 (REACH)
2. Nařízení Komise (EU) č. 10/2011 ve znění nařízení Komise (EU) č. 321/2011, 1282/2011 a 1183/2012
3. Nařízení Evropského parlamentu a Rady (ES) č. 1223/2009
4. Nařízení Evropského parlamentu a Rady COM (2012) 542, o zdravotnických prostředcích a změně směrnice 2001/83/ES, nařízení (ES) č. 178/2002 a nařízení (ES) č. 1223/2009, 2012
5. European Pharmacopoeia (2014). The European Pharmacopoeia, Ph. Eur. 8th Edition, 2014
6. Babich, M. A. Overwiew of phthalate toxi-city, 2010, ISSN 1098-6596. Dostupné z: doi:10.1017/CBO9781107415324.004
7. SCENIHR Scientific Opinion on the safety of medical devices containing DEHP-plasticized PVC or other plasticizers on neonates and other groups possibly at risk [online], 2015, ISBN 9789279356063. Dostupné z: doi:10.2772/45179
8. Koch, H. M., Preuss, R., Angerer, J., Foster, P., Sharpe, R., Toparri, J. Di(2-ethylhexyl)phthalate (DEHP): Human metabolism and internal exposure - An update and latest results. International Journal of Andrology [online], 2006, roč. 29, č. 1, s. 155–165. ISSN 01056263. Dostupné z: doi:10.1111/j.1365-2605.2005.00607.x
9. Koch H. M., Bolt H. M., Angerer J. Di(2-ethylhexyl)phthalate (DEHP) metabolites in human urine and serum after a single oral dose of deuterium-labelled DEHP. Archives of Toxicology [online], 2004, roč. 78, č. 3, s. 123 130. ISSN 03405761. Dostupné z: doi:10.1007/s00204-003-0522-3
10. Alzaga, R. Determination of phthalic monoesters in aqueous and urine samples by solid-phase microextraction – diazomethane on-fibre derivatization – gas chromatography – mass spectrometry. Biodegradation, 2003, s. 87–96.
11. Preuss, R., Koch, H. M., Angerer, J. Biological monitoring of the five major metabolites of di-(2-ethylhexyl)phthalate (DEHP) in human urine using co-lumn-switching liquid chromatography-tandem mass spectrometry. Journal of chromatography. B, Analytical technologies in the biomedical and life sciences [online], 2005, roč. 816, č. 1-2, s. 269–280. ISSN 15700232. Dostupné z: doi:10.1016/j.jchromb.2004.11.048
12. Jeong, J. Y., Lee, J. H., Kim, E. Y., Kim, P. G., Kho, Y. L. Determination of Phthalate Metabolites in Human Serum and Urine as Biomarkers for Phthalate Exposure Using Column-Switching LC-MS/MS. Safety and Health at Work [online], 2011, roč. 2, č. 1, s. 57. ISSN 2093-7911. Dostupné z: doi:10.5491/SHAW.2011.2.1.57
13. Kato, K., Shoda, S., Takahashi, M., Doi, N., Yoshimura, Y., Nakazawa, H. Determination of three phthalate metabolites in human urine using on-line solid-phase extraction–liquid chromatography–tandem mass spectrometry. Journal of Chromatography B [online], 2003, roč. 788, č. 2, s. 407–411. ISSN 15700232. Dostupné z: doi:10.1016/S1570-0232(03)00041-2
14. Černá, M., Krsková, A., Malý, M., Tomášková, L., Spěváčková, V. National report on the implementation of the project including data analysis and integrated interpretation Czech Republic – Methods, Version final II, National Institute of Public Health, 2013.
15. Černá, M., Malý, M., Rudnai, P. et al. Case study: Possible differences in phthalates exposure among the Czech, Hungarian, and Slovak populations identified based on the DEMOCOPHES pilot study results. Environmental Research [online], 2015, roč. 141, s. 118–124. ISSN 10960953. Dostupné z: doi:10.1016/j.envres.2014.10.025
16. Vanderberg, L. N., Hauser, R., Marcus, M., Olea, N., Wade, V. Human exposure to BPA. Reproductive Toxicology, 2006, s. 1–86.
17. Směrnice Evropského parlamentu a Rady 2009/48/ES a Směrnice Komise 2014/81/ES
18. Prováděcí Nařízení Komise (EU) č. 321/2011
19. Michałowicz, J. Bisphenol A - Sources, toxicity and biotransformation. Environmental Toxicology and Pharmacology [online], B.m.: Elsevier B.V., 2014, roč. 37, č. 2, s. 738–758. ISSN 18727077. Dostupné z: doi:10.1016/j.etap.2014.02.003
20. Völkel, W., Colnot, T., Csanády, A. G. , Filser, J., Dekant, W. Metabolism and Kinetics of Bisphenol A in Humans at Low Doses Following Oral Administration. Chem. Res. Toxicol., 2002, č. 15 (10), s.1281–1287
21. Blount, B. C., Milgram, K. E., Silva, M. J. et al. Quantitative detection of eight phthalate metabolites in human urine using HPLC-APCI-MS/MS. Analytical chemistry [online], 2000, roč. 72, č. 17, s. 4127–4134. ISSN 0003-2700. Dostupné z: doi:10.1289/ehp.6663
22. Koch, H. M., Gonzales-Reche, L. M., Angerer, J. On-line clean-up by multidimensional liquid chromatography – electrospray ionization tandem mass spectrometry for high throughput quantification of primary and secondary phthalate metabolites in human urine. Journal of Chromatography B., 2003, roč. 784, s. 169–182.
23. Schindler, B. K., Esteban, M., Holger Martin Koch, H. M. et al. The European COPHES/DEMOCOPHES project: Towards transnational comparability and reliabi-lity of human biomonitoring results. International Journal of Hygiene and Environmental Health [online], 2014, roč. 217, č. 6, s. 653–661. ISSN 1618131X. Dostupné z: doi:10.1016/j.ijheh.2013.12.002
24. US Food and Drug Administration Safety assessment of Di-(2-ethylhexyl) phthalate (DEHP) released from PVC medical devices. Center for Devices and Radiological Health, 2001, s. 119.
25. Biedermann-Brem, S., Biedermann, M., Fiselier, K., Grob, K. Compositional GC-FID analysis of the additives to PVC, focusing on the gaskets of lids for glass jars, Food Additives and Contaminants, 2005, roč. 22 (12), 1274-84
26. Hauser, R. Phthalates and Human Health. Occupational and Environmental Medicine [online], 2005, roč. 62, č. 11, s. 806–818. ISSN 1351-0711. Dostupné z: doi:10.1136/oem.2004.017590
27. Krotz, S. P., Carson, S. A., Tomey, C., Buster, E. J. Phthalates and bisphenol do not accumulate in human follicular fluid. Journal of Assisted Reproduction and Genetics [online], 2012, roč. 29, č. 8, s. 773–777. ISSN 10580468. Dostupné z: doi:10.1007/s10815-012-9775-1
28. Mes, J., Coffin, D.E., Campbell, D.S. Di-n-butyl - and di-2-ethylhexyl phthalate in human adipose tissue. Bull Environ Contam Toxicol, 1974, č. 12, s. 721-725
29. Wang, N., Kong, D., Shan, Z. et al. Simultaneous determination of pesticides, polycyclic aromatic hydrocarbons, polychlorinated biphenyls and phthalate esters in human adipose tissue by gas chromatography-tandem mass spectrometry. Journal of Chromatography B, 2012, č. 898, s. 38–52
30. Schneiderka, P., Pacáková, V., Stulík, K., Kloudová, M., Jelínková, K. High-performance liquid chromatographic determination of creatinine in serum, and a correlation of the results with those of the Jaffé and enzymic methods. Journal of Chromatography, 1993, č. 614 (2), s. 221–6.
31. Piecha, R., Svačina, Š., Malý, M. et al. Urine level of phthalate metabolites and bisphenol A in relation to main metabolic syndrome components: dyslipidaemia, hypertension and type 2 diabetes (pilot study) Cent. Eur. J. Public Health, 2016, č. 24. Dostupné z http://dx.doi.org/10.21101/cejph.a4704
32. Frederiksen, H., Jørgensen, N., Andersson, A. M. Correlations between phthalate metabolites in urine, serum, and seminal plasma from young Danish men determined by isotope dilution liquid chromatography tandem mass spectrometry. Journal of analytical toxicology [online]. 2010, roč. 34, č. 7, s. 400–410. ISSN 1945-2403. Dostupné z: doi:10.1038/jes.2010.6
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článek Editorial
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2016 Číslo 3
-
Všetky články tohto čísla
- Editorial
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
- Vztah hladin molekul BAFF a APRIL k vybraným ukazatelům mnohočetného myelomu
- Výsledky léčby nemocných s mnohočetným myelomem a současným renálním postižením
- Analýza parametrů signálních drah myelomové kostní nemoci u mnohočetného myelomu
- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Stanovení ftalátů a bisfenolu A a jejich metabolitů v různých typech materiálů
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



