-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Česká diabetologická společnost ČLS JEP, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP
Doporučené postupy při diabetickém onemocnění ledvin
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 1, p. 43-54
Za výbory odborných společností: Pelikánová T., Viklický O., Rychlík I., Saudek, F., Kvapil M., Tesař V., Zima T., Racek J., Bouček P.
1. Charakteristika předmětu doporučených postupů (definice)
Diabetické onemocnění ledvin (Diabetic Kidney Disease) je chronické onemocnění ledvin (Chronic Kidney Disease, CKD) vznikající na podkladě specifických morfologických a funkčních změn ledvin u nemocných s diabetem 1. i 2. typu, případně s ostatními typy diabetu. Termín „diabetické onemocnění ledvin“ je v současné době považován za vhodnější než dosud obvyklé označení diabetická nefropatie. Při výskytu atypických anamnestických či klinicko-laboratorních údajů je však vždy nezbytné – zvláště u nemocných s diabetem 2. typu – zvážit i možnost postižení ledvin z jiných příčin. Onemocnění ledvin vzniká v důsledku diabetické metabolické poruchy a dosud nepřesně definované genetické predispozice. Trias hlavních klinických projevů obvykle tvoří narůstající albuminurie až trvalá proteinurie, hypertenze a progredující porucha renální funkce. Vyvíjí se typicky až po alespoň 10letém trvání diabetu 1. typu, výjimečně již po 5 letech, ale u diabetiků 2. typu může být přítomno již při stanovení diagnózy diabetu. Ve svém vývoji je téměř vždy provázeno diabetickou retinopatií a neuropatií a zvýšeným výskytem kardiovaskulárních komplikací. V řadě rozvinutých zemí (Evropa, USA, Japonsko) představuje diabetické onemocnění ledvin v současné době hlavní příčinu vzniku jejich chronického selhání [1].
2. Epidemiologická charakteristika
Diabetickým onemocněním ledvin bylo v minulosti postiženo až 30 % nemocných s diabetem 1. typu, i když údaje z řady zemí ukazují na snižování jeho výskytu a rychlosti progrese jako nepochybný důsledek zlepšení preventivní a léčebné péče. Data o výskytu CKD u nemocných s diabetem 2. typu jsou méně spolehlivá. Existují značné rozdíly v různých etnických skupinách, vzhledem k vysoké prevalenci tohoto typu diabetu jsou však absolutní počty postižených vysoké. Podle pravděpodobně neúplných statistických dat bylo v roce 2015 diabetické onemocnění ledvin v České republice přítomno u více než 104 tisíc (asi 12 %) nemocných s diabetem, z nichž 38 tisíc mělo glomerulární filtraci (GFR, glomerular filtration rate) <1,0 ml/s, tj. bylo ve stádiu CKD G3-5 a více (www.uzis.cz). V stejném roce tvořili nemocní s diabetem 41 % pacientů zařazených v ČR do pravidelného hemodialyzačního léčení. Nutno ovšem zdůraznit, že ne všechny případy selhání ledvin u nemocných s diabetem jsou podmíněny diabetickým onemocněním ledvin.
3. Morfologická charakteristika a patofyziologický princip
Počáteční morfologické změny spočívají ve ztlušťování glomerulární a tubulární bazální membrány a expanzi mezangiálního prostoru glomerulů v důsledku akumulace mezangiální matrix. Mezi iniciální změny patří také úbytek a poškození podocytů. Postupně dochází k útlaku glomerulárních kapilár, který vede k úbytku filtrační plochy, a nakonec k difúzní skleróze glomerulů, které v terminální fázi zanikají. V pokročilých stadiích bývá přítomna hyalinóza arteriol a ateromatózní změny větších arterií spolu s tubulární atrofií a fibrózou intersticia ledvin.
Vznik diabetického onemocnění ledvin je pravděpodobně výsledkem interakce metabolických a hemodynamických faktorů. Hlavním metabolickým faktorem je dlouhodobá hyperglykémie s navazujícími zčásti dosud hypotetickými patogenetickými mechanismy (mj. oxidační stres, glykace proteinů, polyolová cesta metabolismu glukózy aj.). K hemodynamickým faktorům vedoucím k poškození ledvin patří především systémová a intraglomerulární hypertenze, které rovněž působí na lokální produkci cytokinů a růstových faktorů jako aktivních činitelů proliferativních změn [2].
4. Klinická charakteristika
Diabetické onemocnění ledvin se projevuje postupně narůstající albuminurií a/nebo postupně se snižující renální funkcí při nepřítomnosti známek jiného onemocnění jako příčiny poškození ledvin.
Klinický průběh onemocnění je lépe charakterizován u diabetu 1. typu [3]. Krátce po vzniku diabetu může být u části diabetických pacientů zachycena klinicky němá fáze hypertrofie a hyperfiltrace ledvin, na jejíž vztah k dalšímu vývoji diabetické nefropatie se dosud názory různí. Část změn je reverzibilní po zahájení léčby diabetu a zlepšení metabolické kompenzace. Prvním prokazatelným projevem bývá nejčastěji zvýšené vylučování albuminu do moči (albuminurie), které však nedosahuje detekovatelné hranice manifestní proteinurie. Dříve bylo malé množství albuminu v moči označováno jako mikroalbuminurie a pro toto stadium vývoje diabetické nefropatie jsme užívali termín incipientní diabetická nefropatie. Albuminurie signalizuje možnost vzniku trvalého poškození ledvin a predikuje vývoj cévních změn. Jednorázový záchyt albuminurie nelze považovat za jednoznačný důkaz přítomnosti počínajícího diabetického onemocnění ledvin, protože zejména albuminurie nižší úrovně může být i spontánně reverzibilní. Úroveň albuminurie také nemusí vždy korelovat s morfologickými změnami ledvin. Malá nebo střední albuminurie může být spojena pouze s nefrosklerózou při hypertenzi a je markerem vyššího kardiovaskulárního rizika. Bez cílené terapie dochází u značné části nemocných s diabetem 1. typu k postupnému nárůstu albuminurie a současně ke zvyšování krevního tlaku. Po dalším několikaletém období je již přítomna trvalá proteinurie, hypertenze a postupně klesá renální funkce. Proteinurie dříve převážně selektivní, omezená na nízkomolekulární bílkoviny typu albuminu, přechází v proteinurii neselektivní. Nezřídka se rozvíjí proteinurie nefrotické úrovně (> 3,5 g/24 hod), případně až nefrotického syndromu s jeho klasickými projevy a významně zhoršenou prognózou. V minulosti bylo stadium charakterizované proteinurií označované jako manifestní diabetická nefropatie. Dnes bychom označili jako diabetické onemocnění ledvin G1-2 (pokud by byla GFR>1 ml/s), A2-3 (s albuminurií nebo proteinurií).
V průběhu onemocnění klesá GFR. Její pokles však může být i prvním projevem diabetického onemocnění ledvin a v rychlosti poklesu existují značné interindividuální rozdíly (0,03-0,3 ml/s/rok). CKD postupně progreduje a je provázeno projevy obvyklými i u jiných renálních onemocnění včetně rozvoje terminálního stadia chronického selhání ledvin s nezbytným zahájením náhrady jejich funkce. U nemocných s diabetem však často dochází i ke zhoršování metabolické kompenzace se značnou labilitou diabetu a rizikem hypoglykémií při porušeném renálním metabolismu inzulinu a snížení renální glukoneogeneze. Rychle progreduje retinopatie a další mikro - i makroangiopatické komplikace.
Vývoj diabetického onemocnění ledvin u pacientů s diabetem 2. typu je pravděpodobně obdobný, je však modifikován vyšším věkem nemocných, opožděným zjištěním diagnózy diabetu a přítomnými aterosklerotickými komplikacemi, včetně nefrosklerózy. Pokles renální funkce je nezřídka první známkou postižení ledvin. Albuminurie zde představuje především významný ukazatel rizika vzniku kardiovaskulárních komplikací a albuminurie nebo proteinurie bývá častěji než u diabetu 1. typu podmíněna i nediabetickým postižením ledvin.
Protože diabetické onemocnění ledvin může mít různý klinický průběh, u části nemocných se zpočátku projevuje pouze albuminurií, jindy zase pouze poklesem renální funkce, event. mohou být přítomny obě abnormity současně, dáváme v současné době přednost klasifikaci diabetického onemocnění ledvin, která kopíruje klasifikaci CKD a zohledňuje úroveň GFR a míru albuminurie (viz dále). Tato klasifikace nahrazuje dříve používané hodnocení stadií diabetické nefropatie.
5. Diagnostika
Diagnostika diabetického onemocnění ledvin se opírá o nález zvýšeného vylučování albuminu či proteinu do moči, pokles renální funkce či průkaz jiných známek poškození ledvin. Definici CKD a známky poškození ledvin uvádí Tabulka 1.
Tab. 1. Definice chronického onemocnění ledvin (CKD) 
Diagnózu diabetického onemocnění ledvin podporuje údaj o delším trvání diabetu, nález albuminurie či proteinurie bez přítomnosti erytrocytů v močovém sedimentu, pomalý postupný pokles renálních funkcí a přítomnost diabetické retinopatie. Je třeba uvést, že řada nemocných s diabetickým onemocněním ledvin, zejména v jeho pokročilé fázi, má navíc nález mikrohematurie a diagnostické rozpaky vyřeší až renální biopsie.
Screening diabetického onemocnění ledvin (tj. vyšetření albuminurie/proteinurie a odhad GFR by měly být provedeny minimálně 1x ročně u všech nemocných s diabetem 1. typu od 5. roku po vzniku diabetu (u dětského diabetu již od pubertálního období). Vzhledem k obvykle iniciálně dlouhodobě klinicky skrytému průběhu renálního onemocnění by v případě diabetu 2. typu měl být screening výskytu prováděn ihned při stanovení diagnózy diabetu a dále 1x za rok.
Poznámka: Frekvenci vyšetření ledvin minimalisticky řeší v současnosti Vyhláška MZd o preventivních prohlídkách, která určuje čtyřletý interval vyšetření eGFR u nemocných starších 50 let s diabetem nebo kardiovaskulárními komplikacemi jinak bez známek CKD.
Vyšetření albuminurie/proteinurie
Podle doporučení KDIGO 2012 [4] přichází v úvahu následující stanovení:
- kvantitativní stanovení albuminu a albumin-kreatininového kvocientu (ACR) v moči,
- kvantitativní stanovení celkového proteinu a protein-kreatininového kvocientu (PCR) v moči,
- event. orientační semikvantitativní stanovení proteinu testovacími proužky v moči.
Tyto tři základní uvedené testy jsou seřazeny podle klesající výpovědní schopnosti.
Několik základních pravidel k používání těchto vyšetření:
- Výsledky albuminurie je doporučeno uvádět ve vztahu ke koncentraci kratininu ve vzorku ranní moče jako poměr ACR (mg albuminu / mmol kreatininu), eventuálně jako koncentrace v ranní moči (mg/l)
- Výsledky celkové proteinurie je doporučeno uvádět ve vztahu ke koncentraci kratininu ve vzorku ranní moče jako PCR (g/mmol), eventuálně jako koncentrace proteinu ve vzorku ranní moči (g/l). U nemocných s nefrotickým syndromem a dobrou spoluprací stále vyšetřujeme kvantitativní proteinurii za 24 hodin (g/den) viz Tabulka 2.
- Preferují se vyšetření jednorázového vzorku ranní moče před sběry za časové údobí, protože sběry moče jsou zatíženy velkými chybami na straně pa-cienta.
- Pozitivní výsledky semikvantitativních stanovení albuminu a celkového proteinu je nezbytné potvrdit opakovanou kvantitativní analýzou v klinické laboratoři.
- Pokud se u náhodného vzorku stanoví hodnota ACR ≥ 3 mg/mmol, je zapotřebí vyšetření opakovat s použitím vzorku první ranní moče.
Tab. 2. Klasifikace proteinurie a albuminurie. 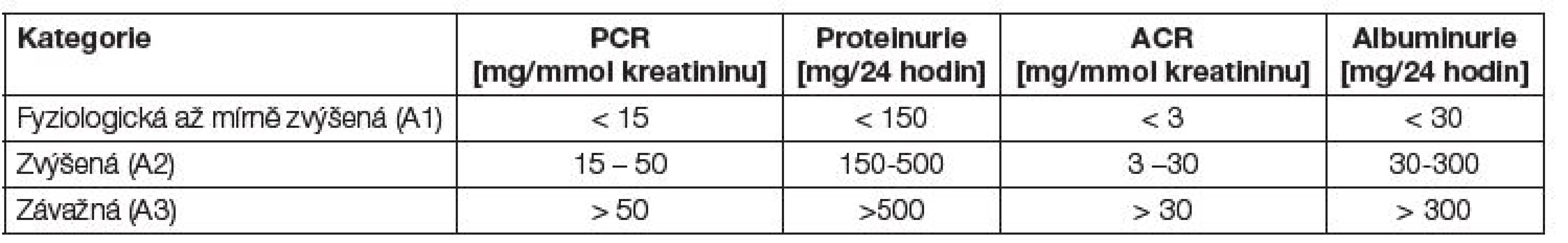
Screening zahrnuje stanovení poměru albumin/kreatinin v prvním ranním vzorku moči. Vyšetření albuminu v moči sbírané 24 hodin ani ve vzorku moči sbíraném během klidu na lůžku v noci se k běžnému screeningu nedoporučují. V praxi se však dává přednost vyšetření v jednorázovém vzorku moči, výsledek se vztahuje ke koncentraci kreatininu v moči (mg/mmol kreatininu). Vzhledem k vysoké intraindividuální variabilitě (až 30 %) by pro diagnózu albuminurie měly být pozitivní alespoň 2 ze 3 vzorků moče vyšetřených v průběhu 3 až 6 měsíců; vyšetření by nemělo být prováděno při současné infekci močových cest, po zvýšené fyzické námaze a při menstruaci [5-7].
Normální albuminurie je obvykle definovaná hodnotou ACR do 3 mg/mmol kreatininu. Počínající diabetické onemocnění ledvin je přítomno, je-li prokázána albuminurie A2 (ACR 3-30 mg/mmol kreatininu) (dříve mikroalbuminurie). Zlepšení metabolické kompenzace diabetu, uspokojivá korekce hypertenze a léčba inhibitory angiotenzin konvertujícího enzymu (ACEi) výrazně snižují riziko progrese postižení ledvin. Pacienti s albuminurií (i nediabetici) mají výrazně zvýšené kardiovaskulární riziko. Albuminurie je u těchto nemocných zřejmě markerem generalizované endotelové dysfunkce. V poslední době se ukazuje, že zvýšené renální i kardio-vaskulární riziko mají i osoby s tzv. vysokou normální albuminurií.
Na jiné než diabetické onemocnění ledvin by mělo být pomýšleno, pokud je výrazně snížená nebo rychle klesá GFR, u refrakterní hypertenze, mikrohematurie nebo při známkách systémového onemocnění a detaily o této problematice jsou uvedeny níže.
K orientačnímu vyšetření albuminurie jsou vhodné i testační proužky či tablety (hranicí citlivosti bývá koncentrace albuminu 20 mg/l), pozitivní nález by však měl být ověřen standardním postupem. Základním vyšetřením k zachycení proteinurie je semikvantitativní chemické vyšetření moči. Nutné je opakované vyšetřování.
Hodnocení albuminurie a proteinurie uvádí Tabulka 2.
Vyšetření funkce ledvin
Vzhledem k možnosti atypického průběhu diabetického onemocnění ledvin je vyšetření renální funkce pomocí stanovení sérového kreatininu a odhad glomerulární filtrace (eGFR, estimated GFR) od počátku nezbytnou součástí screeningu.
V současné době měříme GFR pomocí clearance endogenního nebo exogenního markeru filtrace [5, 6]. Všechny metody pro clearance jsou dosti složité, hlavním limitujícím faktorem je správný sběr moče. Proto je v klinické praxi GFR nejčastěji odhadována ze sérové koncentrace kreatininu, popřípadě sérové koncentrace cystatinu C. Samotná hodnota sérového kreatininu není pro odhad funkce ledvin dostačující. Je ovlivněna množstvím svalové hmoty (např. vliv pohlaví a věku) a příjmem proteinů. Hodnot sérového kreatininu využíváme ve výpočtových vzorcích pro stanovení GFR či Ckr. Cílem všech výpočtových vzorců je odhad GFR bez sběru moči. Přesný sběr moči představuje největší zdroj chyb u clearance kreatininu. Další možnou chybou je nesprávné stanovení kreatininu. Obecně platí, že malá chyba ve stanovení koncentrace kreatininu se projeví velkou chybou odhadu GFR. Hodnota eGFR (estimated – odhadnutá GFR) podléhá stejným analytickým a biologickým (neadekvátní svalová hmota, malnutrice, jaterní postižení) limitům jako stanovení sérového kreatininu. Vzorce pro eGFR vycházející ze stanovení sérového kreatininu je možno užít jen za podmínek stabilizované plazmatické koncentrace kreatininu. V akutních stavech jsou vzorce nepoužitelné.
V minulosti bylo doporučováno používat pro odhad GFR vzorec vypracovaný na podkladě velké multicentrické studie (MDRD, Modification of Diet in Renal Disease), která sledovala vliv příjmu bílkovin v potravě na rychlost progrese renálních onemocnění. MDRD rovnice ovšem zahrnovala pouze pacienty s chronickým onemocněním ledvin a měla i další nevýhody. Proto byla zavedena nová rovnice, která je použitelná i pro zdravou populaci. Rovnice CKD-EPI poskytuje výsledky nejbližší reálné GFR a je doporučené ji v současnosti preferovat před rovnicí MDRD. V současnosti je již používána ve většině biochemických laboratoří. Odhad GFR pomocí vzorců MDRD a CKD-EPI není vhodné používat u dětí a těhotných. Pro odhad GFR ze sérového kreatininu u dětí a mladistvých je doporučeno používat rovnici podle Schwartze z roku 1987 a 2009.
V iniciálních fázích diabetického onemocnění ledvin bez výraznějšího snížení renální funkce je možno použít k odhadu GFR i hodnotu cystatinu C. Cystatin C je neglykosylovaný bazický inhibitor proteáz, který je z oběhu odstraňován glomerulární filtrací a je zcela metabolizován tubulárními buňkami. V závislosti na metodě stanovení se pro odhad hodnoty GFR použije příslušná přepočítávací rovnice.
Všechny hodnoty GFR je vhodné udávat v přepočtu na ideální tělesný povrch (1,73 m2). Pro detailnější výklad metod měření renální funkce viz Doporučení České nefrologické společnosti a České společnosti klinické biochemie k vyšetřování GFR [7] (www.nefrol.cz – Doporučené postupy ČNS; www.cskb.cz – Doporučení a Kalkulátory) z roku 2014.
Kategorie CKD podle úrovně eGFR uvádí Tabulka 3.
Tab. 3. Kategorie CKD podle eGFR - podle (1) 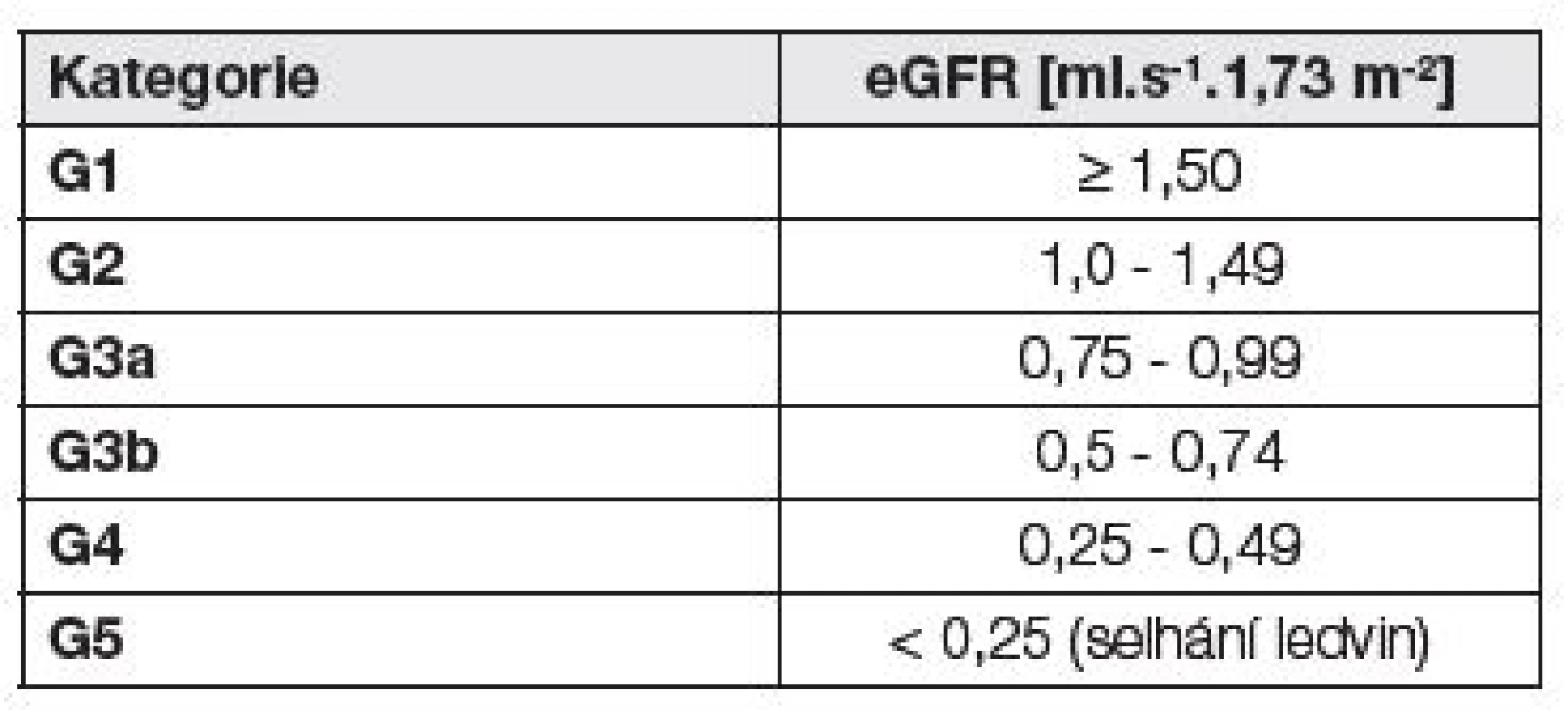
Není-li přítomno poškození ledvin, kategorie G1a G2 nesplňují kritéria CKD. 6. Diferenciální diagnostika
Na jiné než diabetické onemocnění ledvin bychom měli pomýšlet, pokud není přítomna diabetická retinopatie, je výrazně snížená nebo rychle klesá GFR, rychle roste proteinurie a/nebo se rozvíjí nefrotický syndrom, dále v přítomnosti u refrakterní hypertenze, patologického močového sedimentu, při známkách systémového onemocnění a při poklesu GFR o více než 30 % do 3 měsíců po zahájení léčby inhibitorem ACE. Za přítomnosti některé z okolností uvedených v tabulce 4A nutno zvažovat možnost nediabetického postižení ledvin (Tabulka 4B), případně kombinace diabetického onemocnění ledvin s jiným renálním onemocněním [8].
Tabulka 4A: Diferenciální diagnostika postižení ledvin u diabetu 
Tabulka 4B: Základní rozčlenění postižení ledvin u nemocných s diabetem 
7. Klasifikace (staging) diabetického onemocnění ledvin
Pacient by měl být klasifikován podle:
- Kategorie GFR (G1, G2, G3a, G3b, G4, G5) (Tabulka 2)
- Kategorie albuminurie (A1, A2, A3) (Tabulka 3)
Příklad diagnózy: diabetické onemocnění ledvin G3/A2
8. Průběžné sledování
Kromě albuminurie/proteinurie a eGFR je v celém průběhu diabetického onemocnění ledvin nutno pečlivě monitorovat parametry kompenzace diabetu (glykovaný hemoglobin, výsledky samostatného monitorování glykémií), krevní tlak, lipidové spektrum, nález na očním pozadí a ukazatele možné močové infekce (moč chemicky a močový sediment, bakteriologický nález).
Kontroly ve stadiu pokročilého CKD se v zásadě neliší od sledování nemocných s jinými typy postižení ledvin (renální funkce, ionty, zejména hladiny kalia při obvyklé léčbě inhibitory systému renin-angiotensin a vyšším riziku hyperkalémie u diabetických nemocných, parametry kalcium-fosfátového metabolismu, urikémie, albuminémie a stav nutrice, krevní obraz, jaterní enzymy a další). Vzhledem ke sklonu k retenci natria je u diabetických nemocných velmi důležité kontrolovat bilanci tekutin (pravidelné stanovení hmotnosti pacienta, sledování výskytu otoků při hypalbuminémii u nefrotického syndromu). Frekvence sledování v závislosti na hodnotách albuminurie a eGFR uvádí Tabulka 5. Doporučený harmonogram vyšetření v renální insuficienci je uveden v Tabulce 6.
Tabulka 5: Doporučená frekvence sledování nemocného podle hodnoty eGFR a albuminurie 
Tabulka 6: Vyšetření při diabetické CKD G3-5* 
*Při progresi CKD častější kontroly Nemocní s eGFR < 0,5 ml/s musí být rovněž vyšetřeni a ideálně i sledováni v ambulanci nefrologa.
9. Léčebný postup
Hlavními cíli léčby jsou v iniciálních stadiích diabetického onemocnění ledvin snížení, případně až normalizace albuminurie či proteinurie, zpomalení progrese renální insuficience a snížení vysoké vaskulární morbidity a mortality nemocných [2,9,10].
Léčba hyperglykémie
Úprava zvýšených hodnot glykémie na lačno i postprandiálně má zásadní význam pro prevenci onemocnění a zpomalení jeho progrese. Prokazatelně brání vzniku a progresi albuminurie i poklesu GFR u nemocných s diabetem 1. typu (studie DCCT/EDIC [11]) i 2. typu (UKPDS [12], ADVANCE-ON [13]). Důsledná kontrola metabolické kompenzace [1,2] pomocí úrovně glykovaného hemoglobinu HbA1c; cílové hodnoty méně než 53 mmol/mol zůstávají v celém průběhu diabetického onemocnění ledvin obligátním požadavkem. Cílové hodnoty HbA1c stanovujeme INDIVIDUÁLNĚ, v počátečních stadiích diabetu jsou přísnější a blíží se normálním hodnotám. Naopak u osob s pokročilým CKD 4-5 a vyšším rizikem hypoglykémie a kardiovaskulárních komplikací jsou bezpečnější hladiny HbA1c nad 53 mmol/mol [1,9,14]. Kromě vlivu na progresi onemocnění ledvin působí úroveň glykémie i na vývoj dalších přidružených komplikací. Inzulinová terapie je však u diabetu 1. typu komplikována vyšší metabolickou labilitou a poruchami kontraregulačních mechanismů při hypoglykémii, a proto je důsledné a časté monitorování hladin glykémie zcela nezbytné. V současné době jsou k tomuto účelu k dispozici osobní glukometry, kontinuální senzory pro sledování hladiny glukózy v podkožní intersticiální tekutině a nově i inzulinové pumpy dovolující změnu rychlosti podávání inzulinu v závislosti na hodnotách naměřených senzorem. Důsledně prováděná intenzivní léčba diabetu s pomocí technologických prostředků prokazatelně zlepšuje vyrovnání diabetu bez zvýšení rizika hypoglykemických epizod.
U nemocných s diabetem 2. typu jsou ve stadiu renální insuficience kontraindikovány některé typy perorálních antidiabetik. Lékem první volby u nemocných s diabetem je metformin. Při eGFR > 1 ml/s podáváme metformin bez omezení dávky. Při eGFR 0,5-1 ml/s (CKD G3) léčbu metforminem nově nezahajujeme, u již léčených nemocných snížíme dávku metforminu na polovinu. Metformin je kontraindikován při těžké renální insuficienci (eGFR <0,5 ml/s). Možnosti použití jednotlivých antidiabetik v různých fázích CKD udává Tabulka 7.
Tabulka 7: Základní antidiabetika – možnost použití při chronickém poškození ledvin (podle SPC k datu 1. 1. 2017) 
x (barva) – je možné podat, bez redukce dávky
x/- (světlejší barva) – je možné podat v redukované dávce
- (bez barvy) – lék je kontraindikován nebo pro nedostatek zkušeností není podávání doporučeno
*s modifikací SPC podle ČDS
** při GFR >0,75 ml/s (>45 ml/min)Některá antidiabetika mohou mít přímý příznivý vliv na progresi renálního onemocnění, který není zprostředkován změnou hladiny glykémie. V intervenčních studiích bylo prokázáno, že progresi chronického onemocnění ledviny u diabetiků 2. typu zpomaluje léčba glifloziny. Empagliflozin redukoval ve studii EMPAREG-RENAL riziko progrese renálního onemocnění (o 39 %) a nutnost náhrady funkce ledvin (o 55 %) [15]. Podobný renoprotektivní efekt byl popsán u canagliflozinu, který ve studii CANVAS-R snížil riziko progrese albuminurie (o 27 %) a renálního kompozitního endpointu definovaného poklesem eGF, nutností náhrady funkce ledvin a úmrtím z renálních příčin (o 40 %) [16]. S přihlédnutím k výsledkům výše uvedených studií by léčba glifloziny měla být zvážena u všech diabetiků s diabetickým onemocněním ledvin s albuminurií vyšší než 300 mg/24 hodin a glomerulární filtrací vyšší než 0,5 ml/s/1,73 m2. S definitivním doporučením bude nutno vyčkat na výsledky studií s glifloziny u pacientů s vyšším renálním rizikem a s primárně renálními endpointy.
Snížení renálního kompozitního endpointu o 22 % bylo prokázáno také při léčbě liraglutidem ve studii LEADER, byť renoprotektivní efekt byl vázaný zejména na nový vznik albuminurie [17].
Hypertenze
Hypertenze je nejvýznamnějším faktorem progrese diabetického onemocnění ledvin a její důsledná korekce má klíčový význam i pro redukci počtu vaskulárních komplikací [2]. U nemocných s diabetem 1. typu obvykle dochází ke zvyšování krevního tlaku od nástupu albuminurie a je sekundárním důsledkem vznikajícího postižení ledvin. U diabetu 2. typu však může mít hypertenze i charakter hypertenze primární, často předchází vzniku diabetického onemocnění ledvin nebo dokonce vzniku diabetu. V této skupině se rovněž velmi často vyskytuje izolovaná systolická hypertenze, jejíž prognostický význam byl v minulosti mylně podceňován. Z hlediska volby antihypertenzivní terapie je významné, že u obou typů diabetu má v důsledku sklonu k retenci natria hypertenze i volum-dependentní charakter.
Detailní návod jakým způsobem snižovat krevní tlak u nemocných s chronickým onemocněním ledvin je uveden v doporučeních KDIGO 2012 pro léčby hypertenze či doporučeních ESH/ESC 2013 [18]. Cílová hodnota krevního tlaku pro nemocné s CKD (diabetiky i nediabetiky) a ACR<3 mg/mmol kreatininu je 140/90 mmHg. Cílová hodnota krevního tlaku pro nemocné s CKD (diabetiky i nediabetiky) a ACR>3 mg/ mg/mmol kreatininu je 130/80 mmHg.
Pro léčbu hypertenze u nemocných s chronickým onemocněním ledvin jsou nejvhodnějším lékem blokátory RAAS. Nemocní, kteří mají ACR>30 mg/ mg/mmol kreatininu, mají být jednoznačně léčeni buď inhibitory angiotensin konvertujícího enzymu (ACEi) nebo blokátory receptoru typu 1 pro angiotensin II (AT1-blokátory) s tím, že tato léčba musí být zahájena u diabetiků dříve, pokud mají albuminurii 30-300 mg/den (kategorie CKD A2). U těchto nemocných je léčba blokátory RAAS indikována bez ohledu na výši krevního tlaku. Naopak z důvodu prevence vzniku a rozvoje CKD u nemocných s diabetem bez albuminurie a s normálním krevním tlakem není podávání ACEi a AT1-blokátorů indikováno.
Při léčbě blokátory RAAS je možným závažným nežádoucím účinkem hyperkalémie a iniciální pokles renální funkce po nasazení. Zvláštní obezřetnosti je třeba v případech podezření na renovaskulární hypertenzi. Velkou pozornost je třeba věnovat léčbě starších nemocných, u kterých může léčba hypertenze způsobit ortostatickou hypotenzi, elektrolytové abnormality, akutní snížení renální funkce a další vedlejší účinky antihypertenziv. U nemocných vyššího věku je nutné přizpůsobit cílové hodnoty krevního tlaku stavu jejich cirkulace, komorbiditám a jejich schopnosti tolerovat léčbu. Nemocný by měl být motivován k domácímu měření krevního tlaku.
U nemocných s diabetickým onemocněním ledvin je nutno počítat s potřebou kombinační terapie několika různými typy antihypertenziv. Vhodnou iniciální kombinaci k ACE-inhibitorům nebo k AT1 - blokátorům tvoří diuretika, která snižují riziko hyperkalémie a působí proti retenci tekutin. V pokročilejších fázích postižení ledvin (cca od CKD stadia 3) se již nelze obejít bez kličkových diuretik. Při nedostatečném efektu může být dalším krokem přidání blokátorů kalciového kanálu, u rezistentní hypertenze pak ještě selektivních beta-1 blokátorů, centrálních nebo kombinovaných sympatolytik a α-1 blokátorů, dnes již zcela výjimečně i přímých vazodilatancií. Naopak kombinace ACEi a AT1-blokátorů není již doporučena pro časté závažné vedlejší účinky.
U všech preparátů je nutno vycházet z individuálního posouzení vhodnosti pro daného pacienta, přes deklarované možné nežádoucí metabolické účinky některých tříd antihypertenziv (diuretika, beta-blokátory) však neexistuje u žádné skupiny pro nemocné s diabetem absolutní kontraindikace. Zásadní součástí léčení hypertenze je omezení příjmu kuchyňské soli ve stravě (nejlépe pod 5 g/den), snížení hmotnosti u obézních, omezení příjmu alkoholu a zanechání kouření. Podrobná aktuální doporučení pro diagnostiku a léčbu hypertenze jsou uvedena na webové stránce České společnosti pro hypertenzi www.hypertension.cz.
Dietní opatření
Dospělí nemocní s eGFR< 0,5 ml/s/1,73 m2 by měli snížit příjem bílkovin na 0,8 g/kg/den. Rozhodně by se měli vyvarovat příjmu bílkovin >1,3 g/kg/den z důvodů zvýšení rizika progrese CKD. Nadbytek přijímaných proteinů může vést ke zvýšení koncentrace uremických toxinů, na druhou stranu neadekvátně nízký příjem bílkovin může vést ke ztrátě svalové hmoty a malnutrici. Podmínkou úspěšné diety s omezením bílkovin je správná edukace nemocných. Problémem všech studií s dietní intervencí u CKD je špatná compliance nemocných znemožňující zobecnění pozorování. Největší dosud provedenou studií byla MDRD studie, která porovnávala dietu s redukovaným příjmem bílkovin 0,58 g/kg/den a dietu s velmi redukovaným příjmem bílkovin 0,28 g/kg/den. Bylo zjištěno, že progrese chronického onemocnění ledvin je stejná v obou skupinách, ale mortalita je vyšší ve skupině s velmi nízkým příjmem bílkovin. Větší redukce příjmu bílkovin než je 0,8 g/kg/den tedy nemá žádný smysl. Každé dietní opatření vyžaduje pečlivou monitoraci klinických a biochemických parametrů a markerů malnutrice. Omezení bílkovin u dětských pacientů může ovlivnit jejich růst. Součástí týmu, poskytujícího léčbu nemocných s CKD, by měl být také nutriční terapeut. Doporučení diety často vyvolává řadu otázek a je výhodné, pokud je zodpoví profesionál.
Léčba dyslipidémie
Také hyperlipoproteinémie je na základě epidemio-logických dat zvažována jako samostatný rizikový faktor vzniku a progrese diabetického onemocnění ledvin. Nicméně žádná studie neprokázala zpomalení progrese CKD při léčbě statiny. Hlavním cílem hypolipidemické léčby u nemocných s diabetickým onemocněním ledvin zůstává snížení vysoké kardiovaskulární morbidity a mortality těchto pacientů. U nemocných s diabetem by tak měly být statin nebo kombinace statinu a ezetimibu obligatorní součástí terapie ve všech fázích CKD včetně nemocných po transplantaci ledvin. Výjimku z tohoto pravidla tvoří nemocní s CKD 5 v dialyzačním léčení. Nově by u nich neměla být hypolipidemická léčba vůbec zahajována, jedině v případě, že je indikována pro sekundární prevenci nebo pro zjevnou hyperlipidémii. Hypolipidemika a úpravy jejich dávkování při CKD uvádí Tabulka 8.
Tabulka 8: Hypolipidemika – úprava dávkování při CKD 
Upraveno podle KDOQI 2012 [9]
*Není dostupný v ČRDalší léčebné postupy
Při přidružené infekci močových cest je nezbytná antibiotická či chemoterapeutická léčba indikovaná na základě kultivace moči a vyšetření citlivosti na antibiotika až do vymizení bakteriurie. Je nutno ovšem uvážit i častý výskyt asymptomatické bakteriurie v diabetické populaci, kde paušální antibiotická terapie, zejména u chybějícího zánětlivého nálezu při vyšetření moči chemicky a močového sedimentu, není na místě.
Konzervativní léčba chronické renální insuficience
Základní opatření v této fázi představují:
- kontrola krevního tlaku a udržování vyrovnané bilance tekutin
- udržování uspokojivé metabolické kompenzace diabetu a úrovně krevních lipidů
- omezení příjmu proteinů
- korekce těžší acidózy - závažnější acidóza je indikací k alkalizační léčbě (podávání natrium-bikarbonátu s cílovou hodnotou plazmatického HCO3 - > 22 mmol/l)
- prevence vzniku sekundární anémie, která u nemocných s DKD obvykle bývá těžšího stupně; podáváme preparáty železa a případně již v predialyzačním období zahajujeme léčbu látkami stimulujícími erytropoézu (ESA)
- prevence vzniku a progrese minerálové a kostní nemoci (MBD, mineral bone disease) s hypokalcémií, hyperfosfatémií a sekundární hyperparathyreózou bráníme podáváním derivátů vitaminu D a vazačů fosfátů, které snižuje resorpci fosfátů ve střevě. Tuto léčbu indikuje většinou nefrolog a lze ji zahájit již ve stádiu CKD G3. Je známo, že řada nevratných cévních a mimokostních kalcifikací při hyperparathyreóze vzniká právě v tomto stadiu CKD.
Nemocný by měl být v pravidelných zhruba půlročních intervalech kontrolován oftalmologem k včasnému zajištění příslušné intervence – především preventivní laserové fotokoagulace. Velmi důležitá je také pravidelná podiatrická péče nejlépe ve specializovaných ambulancích. Pro kuřáky navíc platí zásadní doporučení přestat kouřit, a to mj. i proto, že pokračující kouření se podílí na progresi diabetického onemocnění ledvin.
Snaha o vyloučení nežádoucích efektů některých vyšetření či léků ve fázi renální insuficience (jodové kontrastní látky, nefrotoxická antibiotika, nesteroidní antirevmatika aj.) nesmí být důvodem k odmítnutí nezbytných opatření (důsledná léčba infekce, revaskularizační operace na koronárním a periferním cévním řečišti apod.), která lze po adekvátní přípravě obvykle provést bez nežádoucích důsledků pro funkci ledvin.
Nejpozději od úrovně eGFR 0,5 ml/s musí být nemocný dispenzarizován v nefrologické poradně, která zajistí předpis medikace vázané na nefrologickou odbornost, přípravu a posléze i zahájení programu náhrady funkce ledvin, včetně transplantace ledviny u nemocných, kteří jsou schopni transplantaci podstoupit.
Přípravná opatření pro období chronického selhání ledvin u diabetických nemocných
U nemocných s diabetem je někdy nutné časnější zahájení dialyzační léčby pro výraznou retenci tekutin při nefrotickém syndromu, obtížnou korekci hypertenze, rychlý nástup projevů urémie, výrazné známky neuropatie somatické i vegetativní, častou metabolickou labilitu a zhoršování nutričního stavu. Ještě v predialyzačním období by měla být posouzena možnost budoucí transplantace ledviny (u diabetu 1. typu s výhodou kombinované transplantace pankreatu a ledviny), která v případě úspěchu zajišťuje nemocným vyšší kvalitu života a délku přežití. V tomto ohledu je důležité nezapomínat na možnost transplantace ledviny od žijícího dárce, kterou lze uskutečnit již v predialyzační fázi onemocnění (preemptivně).
Výhoda kombinované transplantace ledviny a pankreatu u pacientů s diabetem 1. typu v konečném stádiu diabetického onemocnění ledvin (a ve výjimečných případech i při diabetu 2. typu) spočívá v tom, že se v převážné většině případů bez použití inzulinu normalizují glykémie, a tím se odstraní hlavní patofyziologická příčina vzniku diabetických komplikací. Tím je možné předejít rekurenci diabetické nefropatie ve štěpu ledviny, ale současně se zpravidla stabilizuje již rozvinutá diabetická retinopatie a zlepšují subjektivní projevy diabetické polyneuropatie. Zároveň se vyřeší obtížná metabolická kompenzace diabetu po nasazení imunosupresivní léčby a eliminuje se riziko těžkých hypoglykémií, které se často vyskytují u nemocných s dlouho trvajícím diabetem v důsledku jejich porušeného rozpoznávání (tzv. syndrom porušeného vnímání hypoglykémie).
Syndrom porušeného vnímání hypoglykémie je způsoben zejména chybějící kontraregulační reakcí adrenalinu při nastupující hypoglykémii. Tím je nejen porušeno uvolňování glukózy z jaterního glykogenu, ale současně chybějí typické varovné příznaky způsobené aktivací sympatického systému. Pokud selhávají konzervativní léčebné postupy založené na edukaci a využití moderní technologie monitorování glykémií, připadá v úvahu léčba transplantací samotného pankreatu nebo izolovaných Langerhansových ostrůvků [19]. Pro indikace takové léčby je ovšem rozhodující úroveň funkce ledvin, jež jsou v tomto stadiu většinou již postiženy určitým stadiem diabetického onemocnění a po nasazení imunosupresívní léčby, zejména takrolimu, hrozí pokles eGFR. Izolovaná transplantace pankreatu či ostrůvků se proto zpravidla podmiňuje hodnotou eGFR >1,0 ml/s. U pacientů s nižší hodnotou se zavádějí všechny dostupné edukační a technologické postupy (včetně použití inzulinových pump, kontinuálního monitorování glukózy v podkoží či možnosti automatického přerušení infúze glukózy při nízkých hodnotách glykémie), a teprve klesne-li hodnota eGFR pod 0,5 ml/s, přichází v úvahu kombinovaná transplantace ledviny a pankreatu (případně ostrůvků) nebo izolovaná transplantace ledviny od žijícího či zemřelého dárce s možností následné transplantace pankreatu v dalším období [20].
Orientační hranici pro zahájení přípravných opatření představuje CKD stadia 4 (eGFR 0,25-0,5 ml/s), kdy by měl být nemocný poučen o možnostech náhrady funkce ledvin a měla by být zvolena nejvhodnější metoda. Volba dialyzační metody (hemodialýza nebo peritoneální dialýza) je individuální; primárně rozhodují event. přítomné limitace medicínského charakteru, ale jinak závisí na preferenci nemocného, jeho domácím zázemí a možnostech příslušného střediska. V každém případě je však nutná podrobná a opakovaná edukace nemocného o podstatě příslušné metody a nezbytných režimových opatřeních. V této době je vhodné vyšetřit i případné živé dárce ledviny.
Příprava cévního přístupu pro hemodialyzační léčbu (arterio-venózní píštěle) bývá u nemocných s diabetem často obtížná pro přítomnost mediokalcinózy a aterosklerózy tepenného řečiště. Nezbytné je posouzení rizika vzniku steal-syndromu a ischémie ruky (vyšetření Allenova testu). Screeningovou metodou na přítomnost (pokročilé) mediokalcinózy je provedení nativního RTG předloktí s průkazem kalcifikací cév. Při předpokládaném problematickém založení a-v píštěle je vhodné nejdříve provést dopplerovské mapování cév ultrazvukem. Rovněž doba potřebná k rozvinutí a-v píštěle bývá při špatném stavu cév delší než v jiných případech. Někdy je nutné pro zajištění cévního přístupu použít k přípravě a-v shuntu cévní protézu nebo zavést permanentní centrální katétr.
Dialyzační léčba se zahajuje individuálně, obvykle v rozvinuté fázi CKD stadia 5. Především je nutné zabránit malnutrici v souvislosti s upravenou dietou, a to nezávisle na hodnotě eGFR. Byly opuštěny v minulosti udávané absolutní biochemické hodnoty renální funkce (S-kreatinin, S-urea či GFR udaná ať pomocí clearance kreatininu či jako odhadovaná pomocí rovnic – např. MDRD), protože klinické studie (např. IDEAL) neprokázaly rozdíl mezi tzv. časným a pozdním zahájením dialyzační léčby. V principu lze uzavřít, že při hodnotách GFR < 0,15 ml/s je nutné zahájit dialyzační léčení při přítomnosti klinických uremických příznaků, při neschopnosti kontrolovat hydrataci či hypertenzi či při zhoršování nutričního stavu. Nemocný má být současně seznámen se změnou diety a pitného režimu při zahájení léčby (přechod na dietu s vyšším podílem proteinu, cca 1-1,2 g/kg/den, omezení příjmu tekutin dle výše reziduální diurézy). Po zahájení dialýzy se rovněž obvykle zvyšuje potřeba inzulinu při zlepšeném příjmu potravy.
Zvláštnosti dialyzační léčby u nemocných s diabetem
Diabetičtí nemocní obvykle tolerují dialyzační léčbu hůře než nemocní s jinými příčinami chronického selhání ledvin. Jejich léčba je provázena vyšším počtem komplikací a zatížena vyšší mortalitou. Jde o důsledek současného výskytu dalších sekundárních komplikací, které ve fázi chronického selhání ledvin rychle progredují. Rychlý rozvoj komplikací je do značné míry přisuzován mj. i akumulaci pokročilých produktů glykace (AGE, advance glycation end-products) při selhání ledvin, které jsou dialyzačními metodami odstraňovány jen v omezené míře.
Hlavní příčiny mortality představují vaskulární příhody a infekce. Značný podíl mezi úmrtími z kardiovaskulárních příčin mají případy náhlé smrti, u nichž byl v nedávné rozsáhlé studii hemodialyzovaných nemocných s diabetem 2. typu prokázán významný vztah k nedostatečné dlouhodobé kontrole úrovně glykémie. Vlastní průběh hemodialýz komplikuje zejména špatná tolerance ultrafiltrace při autonomní neuropatii s rizikem náhlého rozvoje hypotenze. Častější než u nemocných bez diabetu jsou i větší mezidialyzační hmotnostní přírůstky při vyšší retenci tekutin mj. v důsledku žízně při hyperglykémii. Výsledkem metabolické dekompenzace diabetu s hyperglykémií, případně i ketoacidózou je i vyšší riziko hyperkalémie. Peritoneální dialýza je obdobně jako u nemocných bez diabetu zatížena rizikem peritonitid, poklesu účinnosti při změnách funkce a morfologie peritoneální membrány a po delší době u některých pacientů i vznikem únavy z nutnosti trvalého provádění léčby. Ztráty proteinů a naopak resorpce glukózy z peritoneálního roztoku zhoršují nutriční stav a glukózo-lipidový metabolismus nemocných. Při dialýze je častý vznik komplikací typu diabetické nohy jako důsledek ischemické choroby dolních končetin, neuropatie a infekce. U části nemocných dochází k progresi diabetické retinopatie s rizikem sekundárních komplikací jako nitroočního krvácení, glaukomu či odchlípení sítnice, jež mohou vést k náhlé ztrátě zraku.
Postupy při dialyzační léčbě se u diabetických pacientů zásadně neliší od léčby nemocných bez diabetu. K nejčastěji diskutovaným otázkám patří volba dialyzační metody a dávky, rizika heparinizace při hemodialýze a prevence a léčba kostní choroby. V minulosti byla někdy diabetickým pacientům doporučována peritoneální dialýza jako metoda první volby pro jednodušší přístup nezávislý na stavu cév, větší hemodynamickou stabilitu a déle zachovalou reziduální diurézu. Přes určité rozdíly ve výsledcích dlouhodobých studií však lze konstatovat, že při trvalém uplatňování nových poznatků a technologií (například intradialyzační monitorování intravaskulárního objemu, stanovení podialyzační „suché váhy“ pomocí bioimpedance, užití konvektivních metod dialýzy typu hemodiafiltrace apod.) se zajištěním dostatečné dialyzační dávky vykazují aktuálně obě hlavní dialyzační metody u diabetických pacientů srovnatelné výsledky.
Na rozdíl od minulosti se dnes také méně zdůrazňuje problematika heparinizace v průběhu hemodialýzy zejména ve vztahu k rizikovým formám proliferativní retinopatie časté u nemocných se selháním ledvin. Nebezpečí nitroočního krvácení by mělo být do značné míry eliminováno důslednou preventivní oftalmologickou péčí, zejména včasnou laserovou fotokoagulací. Určitým rozdílem oproti ostatním skupinám dialyzovaných pacientů je u diabetických nemocných výskyt adynamické kostní léze jako převažující formy renální osteopatie. Je proto třeba se vyvarovat příliš agresivní prevence a léčby sekundární hyperparathyreózy, kdy vzniká riziko zablokování kostního obratu. Korekce renální anemie u dialyzovaných diabetických pacientů často vyžaduje vyšší intenzitu léčby ESA než je tomu u jiných nemocných.
10. Prognóza a prevence
Vznik trvalé významné albuminurie (A3) je velmi závažným negativním prognostickým faktorem. Optimalizace metabolické kompenzace diabetu incidenci diabetického onemocnění ledvin významně snižuje. Výsledky řady studií rovněž ukazují, že dodržování výše uvedených zásad terapie – zejména důsledná korekce hypertenze – dramaticky zpomaluje progresi diabetického onemocnění ledvin a oddaluje vznik chronického selhání ledvin.
11. Organizace péče
Screening diabetického onemocnění ledvin provádí ošetřující lékař (diabetolog, internista, u nemocných s diabetem 2. typu i praktický lékař s příslušnou kvalifikací). Od fáze trvale zvýšené albuminurie (A2) nebo úrovně eGFR < 1 ml/s (G3) by měla být léčba již vedena diabetologem nebo internistou s příslušnou erudicí. Při podezření na nediabetické onemocnění ledvin je nutná konzultace nefrologa, který rovněž dispenzarizuje nemocné s diabetickým onemocněním ledvin nejpozději od úrovně eGFR 0,5 ml/s. Jeho úkolem je rovněž zajištění přípravy a posléze zahájení programu náhrady funkce ledvin. V případě, že jde o nemocného s diabetem 1. typu, měla by být zvážena možnost kombinované transplantace ledviny a pankreatu (ev. Langerhansových ostrůvků) a nemocný odeslán k vyšetření do Centra diabetologie IKEM Praha (při GFR 0,5 ml/s). Podobně i v predialyzační péči o nemocné s diabetem 2. typu by měla být zvážena možnost preemptivní transplantace ledviny od živého dárce. Pro vybranou skupinu pacientů s diabetem 2. typu, kteří jsou plně závislí na inzulinové léčbě v přiměřené dávce a nejeví známky inzulinové rezistence, připadá kombinovaná transplantace ledviny a pankreatu rovněž v úvahu. Diabetické onemocnění ledvin má dlouhodobý průběh a blížící se stadium konečného selhání lze zpravidla odhadnout. Vzhledem k vysokému riziku progrese přidružených mikroangiopatických a makroangiopatických komplikací je nutné přípravu pro náhradu funkce ledvin zahájit s předstihem tak, aby pokud možno nekolidovala s dalšími často nezbytnými zákroky, jako jsou laserové či operační nitrooční zákroky, invazivní radiologické vaskulární intervence či invazivní podiatrické výkony.
12. Posudková hlediska
Posuzování případné dlouhodobě snížené pracovní schopnosti u nemocných s incipientní fází diabetického onemocnění ledvin by se mělo opírat o přítomnost dalších komplikujících faktorů (závažná forma retinopatie, metabolická labilita podmíněná poruchami kontraregulace při hypoglykémii, syndrom diabetické nohy aj.). Pokročilá stadia diabetického onemocnění ledvin jsou indikací k přiznání částečné či plné invalidity s přihlédnutím k specifickým okolnostem u jednotlivých nemocných.
Zdroje
1. American Diabetes Association. Microvascular Complications and Foot Care. Diabetes Care., 2017, 40, S88-S98.
2. Bouček, P. Diabetická nefropatie. Praha Maxdorf 2011.
3. Pelikánová, T. and Bartoš, V. Praktická diabetologie. 5 ed. Prague: Maxdorf; 2011.
4. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney International, 2013, Suppl 3, p. 1-150.
5. Viklický, O., Tesař, V., Dusilová-Sulková, S. et al. Doporučené postupy a algoritmy v nefrologii. Praha: Grada Publishing; 2010.
6. Viklický, O., Dusilová-Sulková, S. and Rychlík, I. Vyšetřovací metody v nefrologii a jejich klinická aplikace Praha, Tigis, 2007.
7. Zima, T., Racek, J., Tesař, V., Viklický, O., Teplan, V., Schück, O., Janda J, Friedecký B, Kubíček Z, Kratochvíla J, Rajdl D, Šálek T, Kalousová, M. and Granátová, J. Doporučení České nefrologické společnosti a České společnosti klinické biochemie ČLS JEP 2014 . Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie) http://www.nefrol.cz/odbornici/doporucene-postupy-cns. 2014.
8. Rychlík, I., Tesař, V. et al. Onemocnění ledvin u diabetes mellitus. Praha Tigis 2005.
9. National Kidney F. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am. J Kidney Dis., 2012, 60, p. 850-86.
10. Guideline development g. Clinical Practice Guideline on management of patients with diabetes and chronic kidney disease stage 3b or higher (eGFR <45 mL/min). Nephrol. Dial. Transplant., 2015, 30 Suppl 2, ii1-142.
11. Dcct Edic research group. Effect of intensive diabetes treatment on albuminuria in type 1 diabetes: long-term follow-up of the Diabetes Control and Complications Trial and Epidemiology of Diabetes Interventions and Complications study. Lancet Diabetes Endocrinol., 2014, 2, p. 793-800.
12. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998, 352, p. 837-53.
13. Wong, M. G., Perkovic, V., Chalmers, J., Woodward, M., Li, Q., Cooper, M. E., Hamet, P., Harrap, S., Heller, S., MacMahon, S., Mancia, G., Marre, M., Matthews, D., Neal, B., Poulter, N., Rodgers, A., Williams, B., Zoungas, S. and Group A-OC. Long-term Benefits of Intensive Glucose Control for Preventing End-Stage Kidney Disease: ADVANCE-ON. Diabetes Care, 2016, 39, p. 694-700.
14. Papademetriou, V., Lovato, L., Doumas, M., Nylen, E., Mottl, A., Cohen, R. M., Applegate, W. B., Puntakee, Z., Yale, J. F., Cushman, W. C. and Group AS. Chronic kidney disease and intensive glycemic control increase cardiovascular risk in patients with type 2 diabetes. Kidney Int., 2015, 87, p. 649-59.
15. Wanner, C., Inzucchi, S. E., Lachin, J. M., Fitchett, D., von Eynatten, M., Mattheus, M., Johansen, O. E., Woerle, H. J., Broedl, U. C., Zinman, B. and Investigators E-RO. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl. J Med., 2016, 375, p. 323-34.
16. Neal, B., Perkovic, V., Mahaffey, K. W., de Zeeuw, D., Fulcher, G., Erondu, N., Shaw, W., Law, G., Desai, M., Matthews, D. R. and Group CPC. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl. J Med., 2017.
17. Marso, S. P., Daniels, G. H., Brown-Frandsen, K., Kristensen, P., Mann, J. F., Nauck, M. A., Nissen, S. E., Pocock, S., Poulter, N. R., Ravn, L. S., Steinberg, W. M., Stockner, M., Zinman, B., Bergenstal, R. M., Buse, J. B., Committee, L. S. and Investigators LT. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med., 2016, 375, p. 311-22.
18. Mancia, G., Fagard, R., Narkiewicz, K., Redon, J., Zanchetti, A., Bohm, M., Christiaens, T., Cifkova, R., De Backer, G., Dominiczak, A., Galderisi, M., Grobbee, D. E., Jaarsma, T., Kirchhof, P., Kjeldsen, S. E., Laurent, S., Manolis, A. J., Nilsson, P. M., Ruilope, L. M., Schmieder, R. E., Sirnes, P. A., Sleight, P., Viigimaa, M., Waeber, B., Zannad, F. and Task Force, M. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens., 2013, 31, p. 1281-357.
19. Saudek, F. Transplantační léčba diabetu. Praha: Maxdorf; 2010.
20. Choudhary, P., Rickels, M. R., Senior, P. A., Vantyghem, M. C., Maffi, P., Kay, T. W., Keymeulen, B., Inagaki, N., Saudek, F., Lehmann, R. and Hering, B. J. Evidence-informed clinical practice recommendations for treatment of type 1 diabetes complicated by problematic hypoglycemia. Diabetes Care. 2015, 38, p.1016-29.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článek Odešel doc. Kollár
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2018 Číslo 1
-
Všetky články tohto čísla
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
- Úvodní studie měření FGF 23 metodou LIAISON FGF 23
- Limitácie využitia sliny ako diagnostickej tekutiny v klinickej praxi
- Vitamin K a jeho význam v laboratorní medicíně
- Pár řádků o problémech a záhadách hodnocení kvality vědecké práce
- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
-
Česká diabetologická společnost ČLS JEP, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP
Doporučené postupy při diabetickém onemocnění ledvin - Odešel doc. Kollár
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Těhotenská hypercholesterolemie - málo známý fenomén způsobený zvýšenou endogenní syntézou cholesterolu
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
- Vitamin K a jeho význam v laboratorní medicíně
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



