-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Placentární růstový faktor u pacientek s komplikacemi v těhotenství ve třetím trimestru gravidity
Placental Growth Factor in Patients with pregnancy complications in the third trimester of pregnancy
Objective:
The aim of the study was to investigate placental growth factor (PLGF) plasma levels in patients with pathological states in pregnancy.
Design:
Case-control study.
Settings:
Institute of Medical Biochemistry and Laboratory Diagnostics, First Faculty of Medicine, Charles University in Prague and General University Hospital in Prague, Kateřinská 32, 121 08 Prague, Czech Republic.
Material and Methods:
The studied group consisted of together 151 women in the third trimester of pregnancy (35 patients with threatening preterm labor, 32 patients with hypertensive disorder, 30 patients with intrauterine growth restriction (IUGR), 13 patients with pregnancy intrahepatic cholestasis (ICP) and 41 healthy pregnant controls). PLGF was measured by ELISA.
Results:
Patients with preeclampsia and IUGR had significantly decreased PLGF levels compared to controls, (90.6 (IQR 49.9 – 122.4) pg/ml; resp. 56.0 (IQR 39.6 – 143.1) pg/ml vs. 183.9 (IQR 114.0 – 302.2) pg/ml, p < 0.0001), whereas PLGF levels in patients with preterm labor and ICP did not differ from control group. After gestational age adjustment, all groups of patients significantly differ from control group. PLGF correlates negatively with both erythrocyte count and hemoglobin levels in patients with preterm labor (r = –0.46 p = 0.0058 resp. r = – 0.53, p = 0.0013) and with uric acid in patients with IUGR (r = – 0.4237, p = 0.0196).
Conclusion:
Results of the study contribute to better understanding of the pathological mechanisms in risk pregnancy.
Keywords:
intrahepatic cholestasis of pregnancy, intrauterine growth restriction, PLGF, preeclampsia, preterm labor.
Autori: A. Muravská 1; A. Germanová 2; M. Jáchymová 1; A. Kuběna 1; Z. Hájek 2; A. Pařízek 2; T. Zima 1; M. Kalousová 1
Pôsobisko autorov: Ústav lékařské biochemie a laboratorní diagnostiky, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, Praha, Česká republika 1; Gynekologicko-porodnická klinika, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, Praha, Česká republika 2
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 3, p. 114-118
Súhrn
Cíl studie:
Cílem této práce bylo popsat plazmatické hladiny placentárního růstového faktoru (PLGF) u pacientek s patologickými stavy v těhotenství.
Typ studie:
Case-control studie.
Název a sídlo pracoviště:
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN, Kateřinská 32, 121 08 Praha 2.
Materiál a metody:
Sledovaná skupina byla složena ze 151 žen ve třetím trimestru těhotenství (35 pacientek s příznaky předčasného porodu, 32 pacientek s gestační hypertenzí, 30 pacientek s růstovou retardací plodu (IUGR), 13 pacientek s intrahepatickou cholestázou v těhotenství (ICP) a 41 zdravých těhotných žen sloužících jako kontroly). PLGF byl měřen metodou ELISA.
Výsledky:
U pacientek s gestační hypertenzí a IUGR byly zjištěny signifikantně snížené hladiny PLGF ve srovnání s kontrolami (90,6 (IQR 49,9 – 122,4) pg/ml, resp. 56,0 (IQR 39,6 – 143,1) pg/ml vs. 183,9 (IQR 114,0 – 302,2) pg/ml, p < 0,0001), přičemž hladiny PLGF u pacientek s předčasným porodem a ICP se od kontrolní skupiny nelišily. Po adjustaci na gestační věk se od kontrol signifikantně lišily všechny skupiny pacientek. Byla prokázána negativní korelace hladiny PLGF jak s počtem erytrocytů, tak i s hladinou hemoglobinu u pacientek s hrozícím předčasným porodem (r = – 0,46 p = 0,0058, resp. r = –0,53, p = 0,0013) a dále pak s hladinou kyseliny močové u pacientek s IUGR (r = – 0,4237, p = 0,0196).
Závěr:
Výsledky studie přispívají k lepšímu porozumění patologických mechanizmů u rizikového těhotenství.
Klíčova slova:
intrahepatální cholestáza těhotných, růstová retardace plodu, PLGF, preeklampsie, hrozící předčasný porod.
Úvod
Placentární růstový faktor, PLGF, patří do rodiny vaskulárních endoteliálních růstových faktorů (VEGF), které se podílejí na procesu angiogeneze a lymfangiogeneze [1]. Primárně je exprimován placentárními trofoblastickými buňkami během těhotenství [2]. Dále je exprimován také v tkáních, jako jsou srdce, plíce, štítná žláza, a významně se uplatňuje v procesu hojení ran či v regulaci růstu a angiogenezi v nádorech [3].
Angiogeneze je jedním z klíčových mechanismů tvorby placenty, a proto je rozhodující pro vývoj zdravé placenty a plodu prostřednictvím různých faktorů, které buď podporují nebo omezují tvorbu cév. Několik studií zabývajících se různými vaskulárními onemocněními ukázalo, že PLGF má jak angiogenní, tak antiangiogenní funkci v závislosti na patofyziologických stavech. Když je vázán na receptor VEGFR-1, může PLGF směrovat vaskulární endoteliální faktor VEGF na receptor VEGFR-2, čímž podporuje angiogenezi [4]. Naopak, heterodimery VEGF/PLGF mohou angiogenezi potlačit [5].
Ve fyziologickém těhotenství se hladiny PLGF postupně zvyšují až do konce druhého trimestru a následně klesají až do období porodu [6]. Referenční interval placentárního růstového faktoru PLGF v prvním trimestru fyziologického jednočetného těhotenství se pohybuje v rozmezí 28,8–122,0 pg/ml (metoda ECLIA – elektrochemiluminiscence) [7]. Snížení hladin PLGF v krvi matky během těhotenství je považováno za důležitý prediktor preeklampsie a dalších komplikací souvisejících s dysfunkcí placenty [8,9]. Snížené hladiny PLGF byly popsány i u těhotných žen s trisomií 21 [10]. Jako marker se tento protein uplatňuje i v dalších oborech, především v kardiologii, hematologii nebo nefrologii. PLGF slouží také jako nezávislý prediktor kardiovaskulární morbidity a mortality u pacientů s diabetes mellitus 1. typu [11].
Cílem studie bylo popsat hladiny PLGF u vybraných patologických stavů v těhotenství, nezávisle na jejich etiopatogenezi, a srovnat je mezi sebou, k potvrzení, jestli se hladina PLGF u těhotných žen mění pouze u patologií spojených s dysfunkcí placenty.
Materiál a metody
Studované skupiny
Studie byla provedena s ohledem na principy Helsinské deklarace WMA a schválena institucionální etickou komisí. Všechny účastnice studie podepsaly informovaný souhlas.
Výzkumný projekt zahrnoval celkem 151 žen ve třetím trimestru jednočetného těhotenství vybraných z dříve publikované studie [12] na základě dostupnosti studijních materiálů. 110 pacientek trpělo patologickým těhotenstvím (průměrný věk 31±4 let), zbývajících 41 žen (průměrný věk 31±4 let) sloužilo jako kontroly.
Do studie bylo zařazeno 35 žen (průměrný věk 31 ±4 let) s příznaky předčasného porodu, jako je krvácení, kontrakce, pokročilý vaginální nález nebo předčasný odtok plodové vody. Další skupinu tvořilo 30 žen (průměrný věk 31±5 let) se známkami růstové retardace plodu (IUGR). IUGR bylo klasifikováno jako vypočtená plodová hmotnost pod 3. percentil růstové křivky pro daný gestační věk. 13 žen (průměrný věk 32±3 roky) trpělo intrahepatální cholestázou v těhotenství (ICP) s následujícími příznaky: zvýšené hladiny sérových hodnot AST (nad 0,72 μkat/l) a ALT (nad 0,78 μkat/l) v krvi matky bez jiných zjevných příčin zvýšení jaterních enzymů a intenzivní pruritus. Poslední skupina 32 pa-cientek (průměrný věk 31±4 let) trpěla gestační hypertenzí. Gestační hypertenze byla charakterizována jako zvýšený arteriální krevní tlak vyšší než 140/90 mm Hg naměřený alespoň dvakrát u dříve normotenzních žen. V této skupině mělo 21 žen preeklampsii, tedy gestační hypertenzi i s proteinurií (nad 300 mg denně). U zbývajících 11 žen se proteinurie vyvinula až během jejich sledování nebo měly zvýšené hladiny kyseliny močové v séru nad 320 μmol/l.
Čtyřicet jedna zdravých těhotných žen ve třetím trimestru těhotenství sloužily jako kontroly. Všechny byly mezi 36. a 39. týdnem těhotenství.
U žádné ze sledovaných žen nebyly diagnostikovány další jiné patologie nesouvisející s touto studií.
Laboratorní parametry a statistická analýza
Vzorky krve byly odebrány z kubitální žíly současně s odběrem pro běžná laboratorní vyšetření. Rutinní biochemické testy byly provedeny bezprostředně po odebrání krve přístroji LH750 Hematology analyzer (Beckman Coulter, USA) a Modular Analyzer (Roche Diagnostics GmbH, Německo) za použití standardních biochemických metod a komerčně dostupných kitů, jak bylo popsáno [9]. Pro speciální biochemickou analýzu byly získané vzorky plazmy uschovány při –80 °C až do doby jejich dalšího zpracování. Plazmatické hladiny PLGF byly v rámci výzkumu měřeny metodou ELISA (Enzyme Linked ImmunoSorbent Assay) kity Quantikine (RD Systems, Minneapolis, MN, USA) dle protokolu výrobce. Výsledky jsou vyjádřeny v jednotkách pg/ml.
Výsledky biochemických parametrů jsou vyjádřeny jako medián s interkvartilním rozsahem (IQR). Hladina významnosti byla nastavena na 0,05 (p < 0,05). K otestování rozdílů mezi studovanými skupinami byl použit Kruskal-Wallisův test s post-hoc testem (Dunnova procedura), zatímco vztahy mezi parametry byly vyjádřeny Spearmanovým korelačním koeficientem. Adjustace na gestační věk byla vypočtena obecným lineárním modelem (GLM) s bootstrapovou korekcí. Statistické analýzy byly provedeny pomocí statistického softwaru „GraphPad Prism 5“ (GraphPad Software, Inc.) a „SPSS“ v. 16 (SPSS, Inc.).
Výsledky
Základní laboratorní parametry a plazmatické hladiny PLGF u pacientek rozdělených na základě klinické charakteristiky a u zdravých těhotných žen ve třetím trimestru těhotenství jsou uvedeny v Tabulce 1. Pacientky s gestační hypertenzí a IUGR měly významně sníženou plazmatickou hladinu PLGF ve srovnání s kontrolní skupinou, zatímco pacientky s příznaky předčasného porodu a ICP se od kontrol neodlišovaly.
Tab. 1. Basic laboratory parameters and PLGF plasma levels in patients with pathological pregnancy and healthy pregnant women in the third trimester of pregnancy. 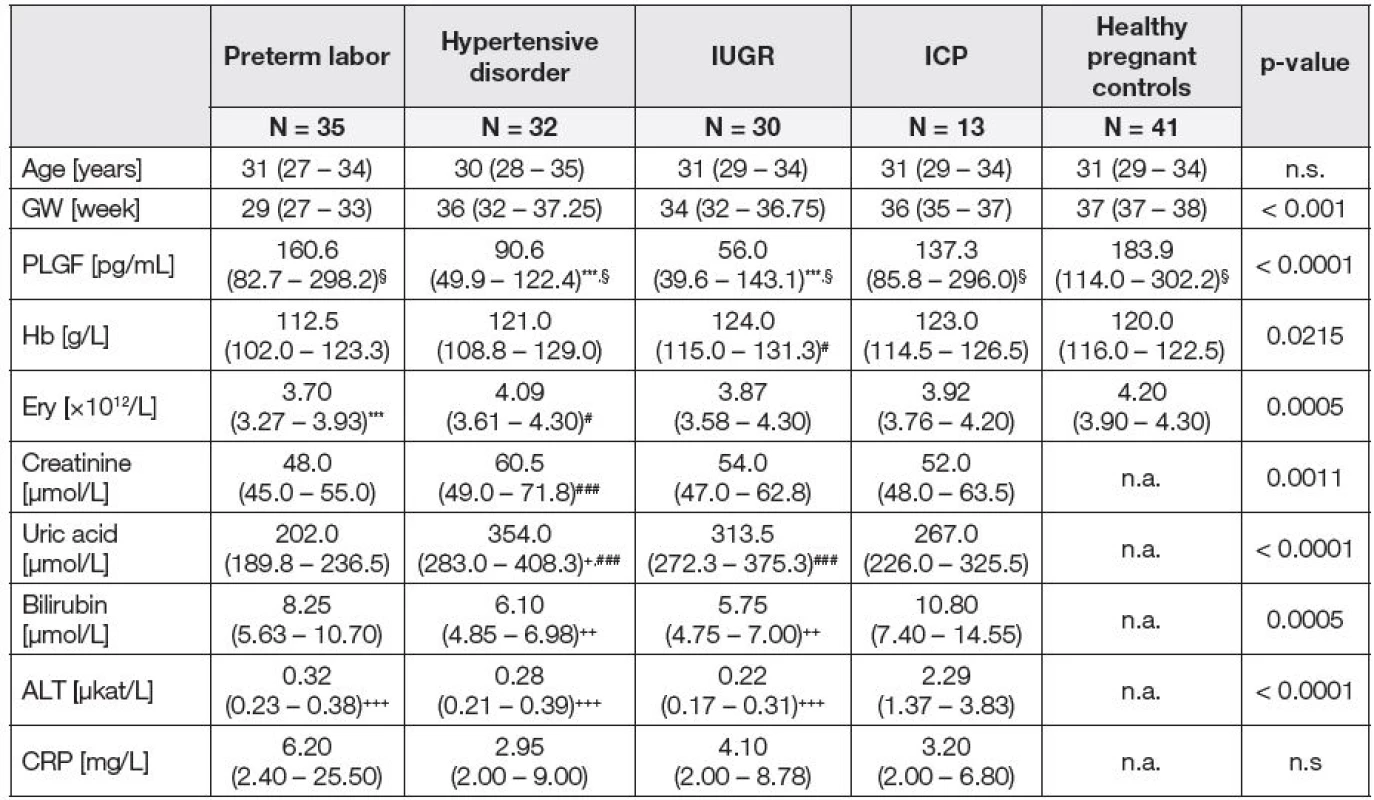
Results are expressed as median and interquartile range. Kruskal–Wallis test was performed followed by Dunn’s Multiple Comparison Test. n.a. – not assessed, n.s. – not significant, GW – gestational week of pregnancy
***p < 0.0001 vs. controls,
#p < 0.05 vs. preterm labor, ###p < 0.0001 vs. preterm labor,
+p < 0.05 vs. ICP, ++p < 0.001 vs. ICP, +++p < 0.001 vs. ICP,
§p < 0.05 vs. controls, after gestational age adjustment.Podskupina pacientek s preeklampsií (s gestační hypertenzí a proteinurií v době odběru) (N = 21, PLGF: 80,5 (IQR 47,0 – 114,0) pg/ml) měla snížené plazmatické hladiny PLGF ve srovnání s hypertenzními pacientkami, u kterých se proteinurie vyvinula později, nebo měly zvýšenou hladinu kyseliny močové nad 320 μmol/l (N = 11, PLGF: 102,7 (IQR 68,6 – 185,6) pg/ml). Rozdíl mezi pacientkami s preeklampsií a kontrolní skupinou (N = 41, PLGF: 183,9 (IQR 114,0 – 302,2) pg/ml) byl ještě významnější (p < 0,0001 – pacientky s preeklampsií oproti kontrolním skupinám, p < 0,0001 – Kruskal-Wallisův test pro všechny tři skupiny). Podskupina hypertenzních pacientek bez proteinurie v době odběru krve se významně nelišila od kontrolní skupiny. Po adjustaci plazmatických hladin PLGF na gestační věk se signifikantně proti kontrolní skupině lišily všechny skupiny pacientek, tedy i pacientky s příznaky předčasného porodu, i pacientky s ICP (viz Tabulka 1).
U pacientek s příznaky předčasného porodu byla prokázána negativní korelace mezi hladinami PLGF a erytrocyty (r = – 0,4633, p = 0,0058) a hladinami hemoglobinu (r = – 0,5293, p = 0,0013) (obr. 1). Plazmatické hladiny PLGF u pacientek s gestační hypertenzí s proteinurií nebo bez ní negativně korelovaly s hladinami kreatininu (r = – 0,3582, p = 0,0441). Navíc byla zjištěna signifikantní negativní korelace PLGF s hladinou kyseliny močové (r = – 0,4237, p = 0,0196), stejně jako s hladinou CRP (r = – 0,3695, p = 0,0444) ve skupině s IUGR.
Obr. 1. PLGF correlation graphs. Associations between parameters were determined by Spearman´s coefficient. Legend:
A: r = – 0.4633, p = 0.0058
B: r = – 0.5293, p = 0.0013
C: r = – 0.3695, p = 0.0444
D: r = – 0.4237, p = 0.0196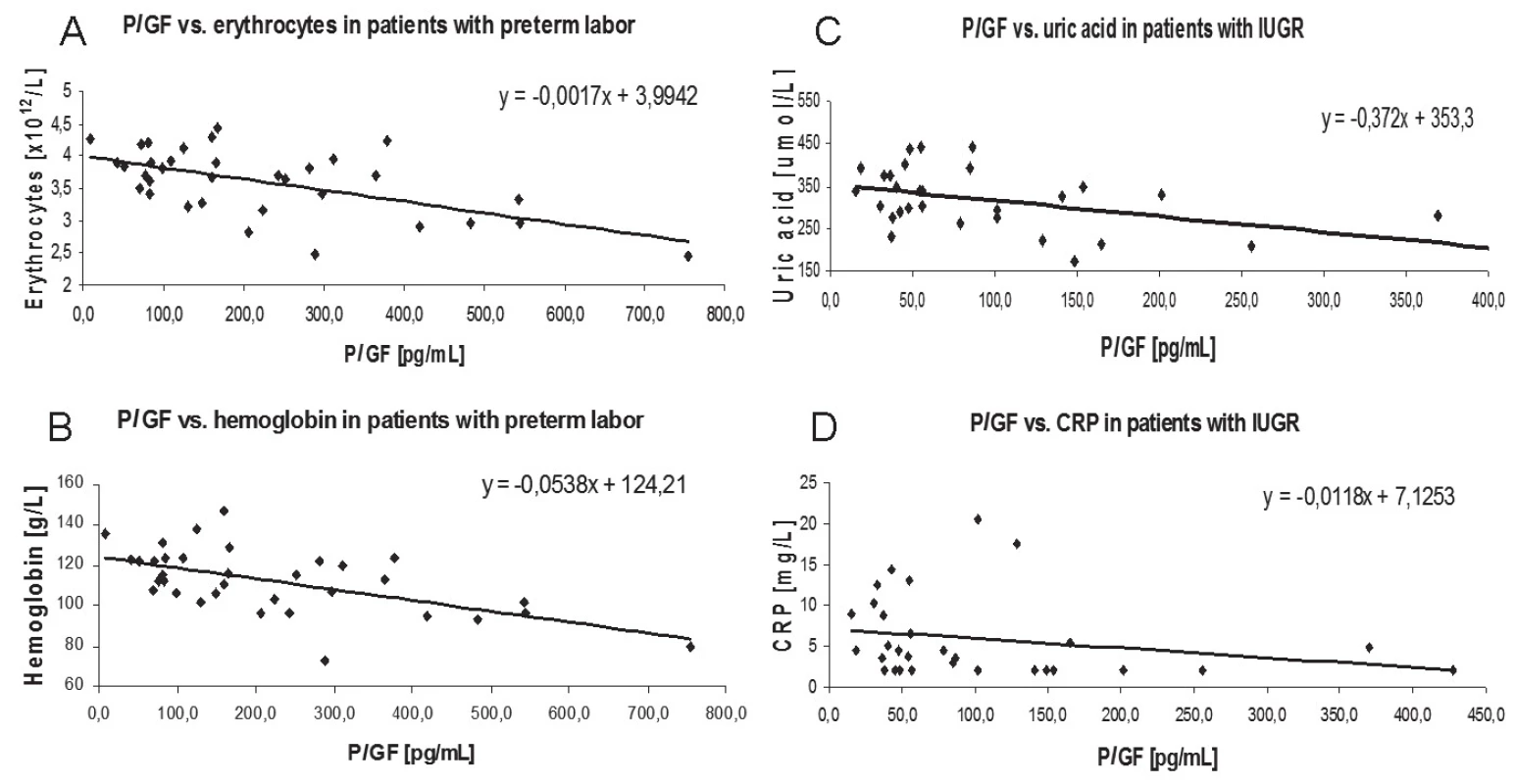
Můžeme shrnout, že hladiny PLGF se významně lišily u pacientek s patologickým těhotenstvím na podkladě placentární dysfunkce (gestační hypertenze, preeklampsie, IUGR) a také byly zjištěny významné korelace s některými biochemickými parametry.
Diskuse
V této studii jsme měřili plazmatické hladiny placentárního růstového faktoru PLGF u čtyř skupin pacientek s patologickým těhotenstvím a u skupiny zdravých těhotných kontrol.
U pacientek s gestační hypertenzí a IUGR jsme potvrdili snížené hladiny PLGF ve třetím trimestru těhotenství a stejně tak negativní korelaci mezi PLGF a kreatininem u preeklampsie. Poprvé jsme prokázali negativní korelaci mezi PLGF a hladinami erytrocytů i hemoglobinu u pacientek s příznaky předčasného porodu a také u pacientek s IUGR hladiny PLGF negativně korelovaly s CRP a kyselinou močovou.
Patologické stavy, jako je preeklampsie a IUGR, jsou úzce spjaty s dysfunkcí placenty, která ovlivňuje hladiny PLGF u matky. Několik studií potvrdilo snížení hladin PLGF u pacientek s preeklampsií během těhotenství [9,13–15]. U pacientek s preeklampsií a s diagnózou IUGR bylo zjištěno, že mají dokonce ještě nižší hodnoty PLGF v krvi než pacientky s preeklampsií bez diagnózy IUGR [16]. Naše studie potvrdila snížení hladin PLGF u pacientek s gestační hypertenzí i u pacientek s IUGR ve třetím trimestru těhotenství. Snížené hladiny PLGF byly popsány u pacientek s IUGR způsobených dysfunkcí placenty po 20. týdnu těhotenství, stejně jako u pacientek a plodů s IUGR v době bezprostředně před porodem [8,17].
Placentární dysfunkce může mít důležitou roli také v patofyziologii spontánního předčasného porodu, jelikož změny hladin PLGF u matky byly popsány bezprostředně před začátkem předčasného porodu i před porodem v termínu [18,19]. Koncentrace PLGF v naší skupině pacientek s příznaky předčasného porodu se nelišily od kontrolní skupiny zdravých těhotných žen, přestože všechny pacientky porodily do 24 hodin po odběru krve pro biochemické analýzy. Naše kontrolní skupina byla ale složena ze žen, které byly také těsně před termínem porodu (39. až 41. t. t.), což mohlo způsobit, že jsme rozdíly v hladinách PLGF u těchto dvou skupin nenalezli. Navíc se po korekci výsledků na gestační týden i tato skupina pacientek signifikantně lišila od kontrolní skupiny, což je pravděpodobně způsobeno právě rozdílem v gestačních týdnech u těchto skupin.
Stejně tak u pacientek s intrahepatální těhotenskou cholestázou ve třetím trimestru těhotenství se před korekcí na gestační týden plazmatické hladiny PLGF nelišily od hodnot u kontrolní skupiny, po korekci však rozdíly byly signifikantní. Patogeneze intrahepatální cholestázy v těhotenství není v současnosti zcela popsána a jeví se jako multifaktoriální. Vedle vlivu prostředí byly dosud popsány změny v gestačním endokrinním systému i mutace genů zodpovědných za transport žlučových kyselin či změny v methylaci DNA u pacientek s ICP [20]. Studie Patela et al. [21] ukázala, že u této nemoci není rozdíl v histopatologii placenty ve srovnání s fyziologickým těhotenstvím. Tyto výsledky podporují hypotézu, že placentární dysfunkce zřejmě není zásadním způsobem zahrnuta do etiopatogeneze onemocnění.
Plazmatické hladiny PLGF nebyly korigovány na hmotnost pacientek, což je limitem této práce. Dále se po korekci hladin PLGF na gestační týden od skupiny zdravých těhotných kontrol lišily také skupiny pacientek s příznaky předčasného porodu a ICP. Tyto výsledky by mohly naznačovat vliv placenty i na tyto patologické stavy v těhotenství, je však zapotřebí provést další studii s větším souborem pacientek a zdravých těhotných žen s odpovídajícím gestačním stářím.
Naše studie také ukázala významný vztah mezi hladinou PLGF a hladinou erytrocytů a hemoglobinu u pacientek s hrozícím předčasným porodem. Tato skupina měla významně sníženou jak hladinu erytrocytů, tak hladinu hemoglobinu ve srovnání s kontrolní skupinou. Stejná negativní korelace byla popsána u pacientů se srpkovitou anémií, u kterých se vyvinula plicní hypertenze [22]. Studie předpokládá, že hemolýza je důležitým faktorem vývoje hypertenze u pacientů se srpkovitou anémií. Pokud jde o naše výsledky, prostá anémie může stimulovat produkci angiogenního faktoru PLGF ke zlepšení oxygenace tkání. Vysvětlení vztahu ale vyžaduje další analýzu.
Negativní korelace mezi PLGF s kreatininem byla zjištěna u pacientek s preeklampsií. Tyto výsledky jsou v souladu s předchozími poznatky Molvarce et al. [16] Navíc studie popisuje negativní korelaci mezi PLGF a CRP u zdravých těhotných žen. My jsme nalezli stejnou souvislost mezi PLGF a CRP ve skupině IUGR. Význam není jednoznačný a vyžaduje další vyšetření.
U pacientek s IUGR byla nalezena negativní korelace PLGF s kyselinou močovou. Jedním z hlavních znaků IUGR je oxidační stres [23] centralizovaný v placentě [24]. Vzhledem k tomu, že kyselina močová se jeví jako nový potencionální marker oxidačního stresu [25], snížené hladiny PLGF by mohly přirozeně odrážet zvýšené sérové hladiny kyseliny močové u pacientek s IUGR.
V souhrnu naše studie potvrdila, že k změnám v hladinách placentárního růstového faktoru dochází pouze u patologií spojených s dysfunkcí placenty, což přispívá k prohloubení znalostí o patologickém mechanizmu rizikového těhotenství.
Podpořeno výzkumnými záměry MZ ČR VFN64165 a Progres Q25. Autoři děkují paní Hudcové a Dr. Švarcové za technickou asistenci.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 16. 4. 2018
Adresa pro korespondenci:
prof. MUDr. Marta Kalousová, Ph.D.
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN
Kateřinská 32
121 08 Praha 2
E-mail: marta.kalousova@lf1.cuni.cz
Zdroje
1. McColl, B. K., Stacker, S. A., Achen, M. G. Molecular regulation of the VEGF family – inducers of angiogenesis and lymphangiogenesis. APMIS, 2004, 112, s. 463–80.
2. Makrydimas, G., Sotiriadis, A., Savvidou, M. D., Spencer, K., Nicolaides, K. H. Physiological distribution of placental growth factor and soluble Flt-1 in early pregnancy. Prenat. Diagn., 2008, 28, s. 175–9.
3. Ribatti, D. The discovery of the placental growth factor and its role in angiogenesis: a historical review. Angiogenesis 2008, 11, s. 215–21.
4. Park, J. E., Chen, H. H., Winer, J., Houck, K. A., Ferrara, N. Placenta growth factor. Potentiation of vascular endothelial growth factor bioactivity, in vitro and in vivo, and high affinity binding to Flt-1 but not to Flk-1/KDR. J. Biol. Chem., 1994, 269, s. 25646–54.
5. Eriksson, A., Cao, R., Pawliuk, R., et al. Placenta Growth Factor-1 antagonizes VEGF-induced angioge-nesis and tumor growth by the formation of functionally inactive PIGF-1/VEGF heterodimers. Cancer Cell., 2002, 1, s. 99–108.
6. Clark, D. E., Smith, S. K., Licence, D., Evans, A. L., Charnock-Jones, D. S. Comparison of expression patterns for placenta growth factor, vascular endothelial growth factor (VEGF), VEGF-B and VEGF-C in the human placenta throughout gestation. J. Endocrinol., 1998, 159, s. 459–67.
7. Metoda – Lidský placentární růstový hormon (PlGF, marker preeklampsie). [online]. Ústav klinické biochemie a diagnostiky FN v Hradci Králové, 31. 5. 2017. [cit. 12. 6. 2018]. Dostupné z: http://ukbd.fnhk.eu/metoda-lidsky-placentarni-rustovy-hormon-plgf-marker-preeklampsie.html
8. Benton, S. J., McCowan, L. M., Heazell, A. E., et al. Placental growth factor as a marker of fetal growth restriction caused by placental dysfunction. Placenta, 2016, 42, s. 1–8.
9. Tarasevičienė, V., Grybauskienė, R., Mačiulevičienė, R. sFlt-1, PlGF, sFlt-1/PlGF ratio and uterine artery Doppler for preeclampsia diagnostics. Medicina (Kaunas), 2016, 52, s. 349–53.
10. Kagan, K. O., Hoopmann, M., Abele, H., Alkier, R., Luthgens K. First-trimester combined screening for trisomy 21 with different combinations of placental growth factor, free β-human chorionic gonadotropin and pregnancy-associated plasma protein-A. Ultrasound. Obstet. Gynecol., 2012, 40, s. 530–5.
11. Theilade, S., Lajer, S., Jorsal, M., Tarnow, L., Par-ving H. H., Rossing, P. Evaluation of placental growth factor and soluble Fms-like tyrosine kinase 1 as predictors of all-cause and cardiovascular mortality in patients with Type 1 diabetes with and without diabetic nephropathy. Diabet. Med., 2012, 29, s. 337–44.
12. Muravská, A., Germanová, A., Jáchymová, M., et al. Association of Pregnancy-associated plasma protein A polymorphism with preeclampsia – A pilot study. Clin. Biochem., 2011, 44, s. 1380–4.
13. Erez, O., Romero, R., Espinoza, J., et al. The change in concentrations of angiogenic and anti-angiogenic factors in maternal plasma between the first and second trimesters in risk assessment for the subsequent deve-lopment of preeclampsia and small-for-gestational age. J. Matern. Fetal. Neonatal. Med., 2008, 21, s. 279–87.
14. Hanita, O., Alia, N. N., Zaleha, A. M., Nor Azlin, M. I. Serum soluble FMS-like tyrosine kinase 1 and placental growth factor concetration as predictors of preeclampsia in high risk pregnant women. Malays. J. Pathol., 2014, 36, s. 19-26.
15. Gurnadi, J. I., Mose, J., Handono, B., et al. Difference of concentration of placental soluble fms-like tyrosine kinase-1(sFlt-1), placental growth factor (PlGF), and sFlt-1/PlGF ratio in severe preeclampsia and normal pregnancy. BMC Res. Notes., 2015, 4, s. 534.
16. Molvarec, A., Szarka, A., Walentin, S., Szucs, E., Nagy, B., Rigó, J. Jr. Circulating angiogenic factors determined by electrochemiluminescence immunoassay in relation to the clinical features and laboratory parameters in women with pre-eclampsia. Hypertens. Res., 2010, 33, s. 892–8.
17. Wallner, W., Sengenberger, R., Strick, R., et al. Angiogenic growth factors in maternal and fetal serum in pregnancies complicated by intrauterine growth restriction. Clin. Sci. (Lond.), 2007, 112, s. 51–7.
18. Chaiworapongsa, T., Romero, R., Tarca, A., et al. A subset of patients destined to develop spontaneous preterm labor has an abnormal angiogenic/anti-angiogenic profile in maternal plasma: evidence in support of pathophysiologic heterogeneity of preterm labor derived from a longitudinal study. J. Matern. Fetal. Neonatal. Med., 2009, 22, s. 1122–39.
19. Patrelli, T. S., Gizzo, S., Plebani, M., et al. The trend of VEGF-A and PlGF in pregnant patients: a perspective case-control study on 214 women. Clin. Exp. Obstet. Gynecol., 2012, 39, s. 57–64.
20. Ovadia, C., Williamson, C. Intrahepatic cholestasis of pregnancy: Recent advances. Clin. Dermatol., 2016, 34, s. 327-34.
21. Patel, S., Pinheiro, M., Felix, J. C., Opper, N., Ouzounian, J. G., Lee, R. H. A case-control review of placentas from patients with intrahepatic cholestasis of pregnancy. Fetal. Pediatr. Pathol., 2014, 33, s. 210–5.
22. Sundaram, N., Tailor, A., Mendelsohn, L., et al. High levels of placenta growth factor in sickle cell disease promote pulmonary hypertension. Blood, 2010, 116, s. 109–12.
23. Karowicz-Bilinska, A., Kedziora-Kornatowska, K., Bartosz, G. Indices of oxidative stress in pregnancy with fetalgrowth restriction. Free Radic. Res., 2007, 41, s. 870–3.
24. Takagi, Y., Nikaido, T., Toki, T., et al. Levels of oxidative stress and redox-related molecules in the placenta in preeclampsia and fetal growth restriction. Virchows Arch., 2004, 444, s. 49–55.
25. Glantzounis, G. K., Tsimoyiannis, E. C., Kappas, A. M., Galaris, D. A. Uric acid and oxidative stress. Curr. Pharm. Des., 2005, 11, s. 4145–51.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2018 Číslo 3
-
Všetky články tohto čísla
- Hvězdné hodiny a vodní tišiny. Klinická biochemie horkého dne.
- Placentární růstový faktor u pacientek s komplikacemi v těhotenství ve třetím trimestru gravidity
- Výhody stanovení protilátek proti myeloperoxidáze a proteináze-3 chemiluminiscenční metodou u pacientů s ANCA asociovanou vaskulitidou
- Prohloubení oxidačního stresu u karcinomu pankreatu vlivem malnutrice
- Soudobé metody a problémy sledování glukózy u diabetiků
- Doporučení o laboratorním screeningu vrozených vývojových vad v prvním a druhém trimestru těhotenství
- Laudatio - čestné členství ČSKB 2018
- Laudatio - čestné členství ČSKB 2018
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výhody stanovení protilátek proti myeloperoxidáze a proteináze-3 chemiluminiscenční metodou u pacientů s ANCA asociovanou vaskulitidou
- Placentární růstový faktor u pacientek s komplikacemi v těhotenství ve třetím trimestru gravidity
- Doporučení o laboratorním screeningu vrozených vývojových vad v prvním a druhém trimestru těhotenství
- Soudobé metody a problémy sledování glukózy u diabetiků
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



