-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prekancerózy tlustého střeva
Premalignancies of Colon
The most common premalignant lesions of colorectal carcinoma include sporadic adenomas. Tubular and tubulovillous adenomas with mild dysplasia are considered benign lesions, while villous adenomas represent tumors with uncertain biological behavior. In recent years, demonstrable growth of flat lesions in the proximal intestine has been seen. Precision and yield of colonoscopy depends to some extent on good preparation, careful screening of intestine and use of new instruments of better quality. As an indicator of screening colonoscopy quality, the so ‑ called adenoma detection rate is used. The text briefly describes options of endoscopic and surgical resolving of premalignancies. In the Czech Republic, attendance in the screening program is low, which could be changed by prepared addressed invitations of clients. The population with a genetic or familiar risk is examined according to recommended procedures intended for increased ‑ risk persons.
Key words:
adenomatous polyp – screening – clinical practice
The author declares she has no potential conflicts of interest concerning drugs, pruducts, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
26. 8. 2013Accepted:
13. 10. 2013
Autori: M. Šachlová
Pôsobisko autorov: Gastroenterologické oddělení, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2013; 26(Supplementum): 38-43
Súhrn
Nejčastější prekancerózní léze kolorektálního karcinomu představují sporadické adenomy. Tubulární a tubulovilózní s mírnou dysplazií jsou považovány za benigní léze, adenomy vilózní představují již nádory s nejistým biologickým chováním. V posledních letech je pozorován prokazatelný nárůst plochých lézí v proximálním střevu. Přesnost a výtěžnost kolonoskopie do značné míry závisí na dobré přípravě, pečlivém prohlížení střeva a také na použití nových a kvalitnějších přístrojů. Jako indikátor kvality screeningové kolonoskopie se používá tzv. adenoma detection rate. V textu jsou ve stručnosti popsány možnosti endoskopického a chirurgického řešení prekanceróz. V ČR je účast ve screeningovém programu nízká. Tato situace by se mohla změnit připravovaným adresným zvaním klientů. Populace s genetickým nebo familiárním rizikem je vyšetřována podle doporučených postupů pro osoby se zvýšeným rizikem.
Klíčová slova:
adenomatózní polyp – screening – klinická praxePod pojmem prekancerózní stav rozumí současná literatura patologický proces, který se projevuje chronickou iritací tkáně a nevykazuje přítomnost větších strukturálních a cytologických nepravidelností. Prekancerózní stav představují idiopatické střevní záněty (inflammatory bowel disease – IBD). Jak u pacientů s Crohnovou nemocí, tak u pacientů s ulcerózní kolitidou je známo zvýšené riziko nádorů, které roste s délkou trvání nemoci a s jejím anatomickým rozsahem. V případě Crohnovy nemoci se nádory vyskytují predilekčně v tlustém střevu a terminálním ileu. U pacientů s ulcerózní kolitidou se nádory vyvíjejí v tlustém střevu. Jako zvlášť rizikový faktor se uvádí kombinace ulcerózní kolitidy a primární sklerotizující cholangitidy. Pacienti s IBD mají i vyšší riziko extraintestinálních malignit.
Prekancerózní léze naproti tomu představují ohraničená ložiska tkáňových změn, jejichž základem jsou známky nádorové transformace buněk, které je možné mikroskopicky zachytit jako cytologické a strukturální nepravidelnosti. Cytologické nepravidelnosti značí jednak změněný nukleo/ cytoplazmatický poměr se zvětšením buněčného jádra a redukcí cytoplazmy, jednak změny na úrovni buněčného jádra, kam patří změna tvaru buněčných jader, celkové zvětšení velikosti jádra a zhrubnutí jeho heterochromatinové kresby. Jako spolehlivý znak nádorové transformace je přijímán nález atypických mitóz [1]. Z reprezentativního vzorku tkáně je možné hodnotit strukturální nepravidelnosti. Kombinace cytologických a strukturálních změn je obvykle závažný stav a označuje se termínem intraepiteliální neoplazie (dysplazie). Za určitých okolností je možné zachytit zmnožení určitého typu buněk bez cytologických nepravidelností. Pak hovoříme o hyperplazii. V současné době se používá Vídeňská klasifikace neoplazií (tab. 1) [1,2].
Tab. 1. Vídeňská klasifikace neoplazií gastrointestinálního traktu [1,2]. ![Vídeňská klasifikace neoplazií gastrointestinálního traktu [1,2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/72904f5706430016f1da0a9f3b89994a.png)
Zdaleka nejčastější prekancerózní lézi kolorektálního karcinomu (colorectal cancer – CRC) představují sporadické adenomy. Makroskopicky se jedná o stopkaté, přisedlé (sesilní) a plošné až vhloubené léze, které se manifestují jako různě rozsáhlé slizniční nerovnosti. Mikroskopicky vykazují buňky adenomů vždy obraz dysplazie, histologicky se adenomy dělí podle převažující komponenty na tubulární, vilózní a tubulovilózní. Zvláštní jednotku představuje tzv. pilovitý adenom (serrated adenoma), který svým uspořádáním připomíná hyperplastický polyp, cytologicky však jeho výstelka vykazuje přítomnost rozsáhlých dysplastických změn. Zatímco adenomy, tubulární a tubulovilózní s mírnou dysplazií představují benigní léze, adenomy vilózní, které mají obsahovat nejméně 80 % vilózní komponenty, představují již nádory s nejistým biologickým chováním. Léze vykazující těžké dysplastické změny jsou v TNM klasifikaci hodnoceny jako in situ karcinomy, v kategorii T se kódují jako pTis. V mikroskopickém obraze je dobře znám pojem tzv. pseudoinvaze do stopky polypů, která se od pravé invaze odlišuje absencí stromální reakce. V případě plošných lézí je vzácně možné zachytit dysplastické změny i v jediné kryptě (tzv. unikryptální adenom), jehož záchyt bývá častější u pacientů s familiární polypózou [1].
Odhaduje se, že 85 % kolorektálních karcinomů jsou sporadické nádory a přibližně 25 % jsou nádory familiární nebo hereditární. Pojem familiární znamená opakovaný výskyt nádoru v rodině způsobený většinou environmentálními faktory nebo dosud neznámými genetickými faktory. V případě hereditárních nádorových onemocnění je genetická příčina známa. Tradičně se ve vývoji kolorektálního karcinomu uznává sekvence adenom ‑ karcinom. Sporadické CRC se vyvíjejí jako následek akumulace získaných somatických mutací v několika genech, stejných jako u hereditárních CRC. Frekvence mutací však sama o sobě nemůže vysvětlit množství genetických alterací v tumoru. Proto se předpokládá, že prerekvizitou v časné karcinogenezi je destabilizace genomu, ke které může dojít několika způsoby. Dále je známo, že ne všechny adenomy se vyvinou v karcinom. Zároveň ne vždy jsou u postižených detekovány mutace v genech s vysokou penetrací. Hlavní výzkumný úkol je tedy nalézt definici adenomu s vysokým rizikem transformace. Identifikací kauzálních genů však celý proces nekončí, neboť je nutné definovat nejen jejich funkci, ale i jejich interakce v rámci signálních drah a zapojení do mechanizmů transformace buňky v buňku nádorovou [3].
Podezření na hereditární formu nádorového onemocnění by mělo vzniknout, jestliže je v rodině zaznamenán opakovaný výskyt nádoru v několika generacích, více nádorů u jedince nebo jedinců či výskyt nádoru v mladém věku. Takové rodiny by měly být odeslány na oddělení lékařské genetiky. Pro diagnostiku a indikaci k vyšetření zodpovědných genů jsou u některých hereditárních forem nádorů definována specifická kritéria, např. pro familiární adenomatózní polypózu (familial adenomatous polyposis – FAP) nebo hereditární nepolypózní kolorektální karcinom (hereditary non‑polyposis colorectal cancer – HNPCC) [4,5]. Odhadovaná empirická rizika dle rodinné anamnézy ukazuje tab. 2 [6].
Tab. 2. Odhadovaná empirická rizika dle rodinné anamnézy. 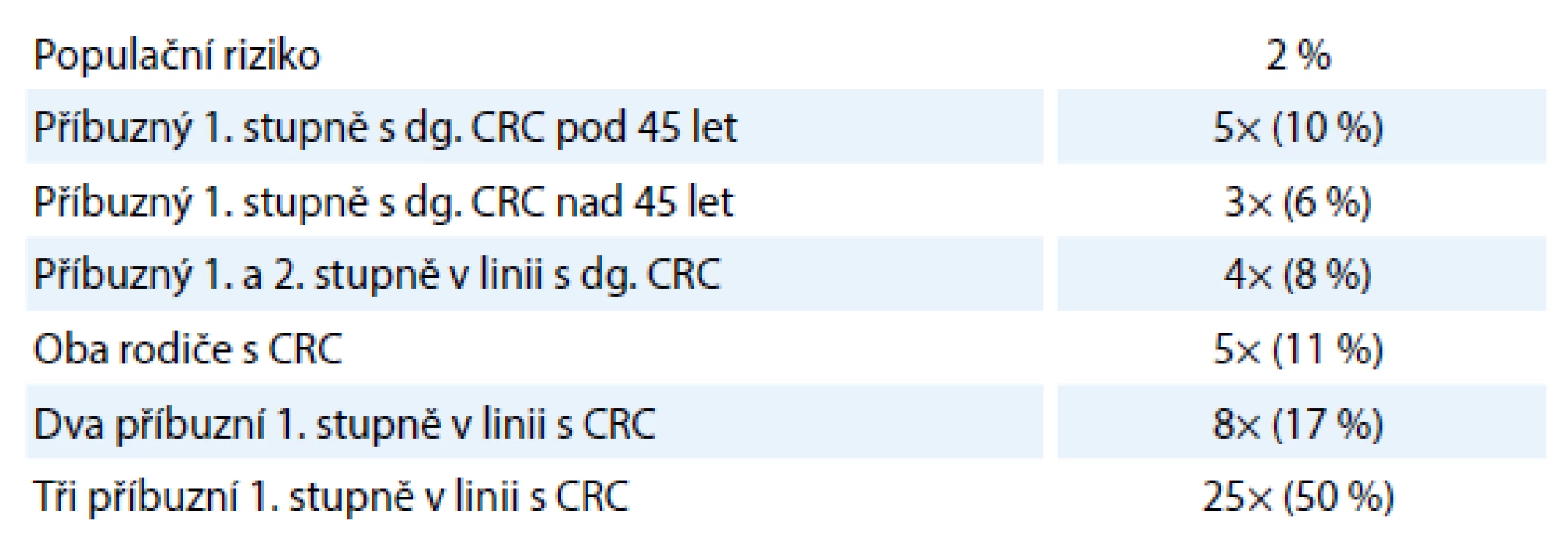
Ze současných poznatků vyplývá, že jsou rozdíly mezi výskytem prekanceróz v proximální či distální části tlustého střeva. Za rozmezí je pokládána lienální flexura. Vžily se termíny distální a proximální, pravostranná a levostranná část tlustého střeva. Rozdíly jsou podmíněny jednak anatomií, rozdílným cévním zásobením, ale také rozdíly v genetické výbavě střevních buněk. Vnitřní prostředí proximální části kolon je zásadně jiné než v distální části. Fermentativní a následně mutagenní procesy probíhající v lumen proximální části tlustého střeva jsou významně ovlivněny metabolizmem žlučových kyselin, produkcí mastných kyselin o krátkém řetězci a odlišnými enzymatickými systémy kolonizujících bakterií. V proximální polovině jsou častější velké hladké a pilovité nepolyploidní léze a velké hyperplastické polypy a do stran se šířící neoplazie. V distální části kolon jsou častější polypoidní pilovité léze a adenomy. Zatímco vpravo je střevní obsah řídký, sliznice je často překryta tekutým ulpívajícím povlakem, v distální části je střevní obsah většinou konzistentní a snadno odstranitelný z povrchu. To činí nepolypoidní ploché proximální léze snadno přehlédnutelné, naopak častější polypoidní léze v distální části jsou nápadné.
Dle literárních údajů se až 90 % karcinomů vzniklých z plochých lézí nevyvíjelo přes adenom. Předpokládá se až 3krát rychlejší růst a schopnost rychlého vývoje metastáz i při velmi malém primárním tumoru. Z plochých pilovitých lézí vzniká 15 – 20 % proximálních karcinomů. V současné době je pozorován v ekonomicky vyspělých zemích prokazatelný nárůst výskytu plochých lézí v proximálním střevě, zatímco v rozvojových zemích přibývá distálních karcinomů. Proto narůstá význam kolonoskopie jako metody schopné odhalit karcinomy v časném stadiu a rozpoznat prekancerózy [7].
Efektivita kolonoskopie je závislá na dokonalé přípravě k vyšetření a velký význam má zkušenost i pečlivost vyšetřujícího. Hledáme změny barvy, změny cévní kresby (vascular pattern), nerovnost sliznice.
Změny architektury slizničního epitelu (pit pattern) jsou všeobecně hodnoceny dle klasifikace navržené prof. Kudo z Japonska. Smyslem je rozlišit mezi non‑neoplastickou a neoplastickou lézí a posoudit rizika malignity před vlastní léčbou [8].
Za hlavní indikátor kvality detekce neoplazií je v současnosti považována dostatečná detekce adenomů při screeningové kolonoskopii. Používá se termín adenoma detection rate, což znamená při screeningové kolonoskopii detekovat 25 % adenomů u mužů a 15 % u žen nad 50 let [9].
Je známo, že po odstranění všech polypů může vzniknout karcinom dříve, než by odpovídalo představám o rychlosti kancerogeneze. Vžil se termín intervalový karcinom. Některé z nich vznikají z endoskopicky přehlédnutých lézí, jiné mohou vznikat de novo kancerogenezí bez stadia adenomu, případně zrychlenou kancerogenezí u geneticky predisponovaných jedinců. Největší riziko intervalového karcinomu mají pacienti vyšetření endoskopistou s nejnižším adenoma detection rate [10]. Záchyt adenomů také zvyšuje pečlivé prohlížení sliznice střeva při vytahování přístroje. Optimální se jeví vytahovací čas kolem 10 min, neboť endoskopující s průměrným časem prohlížení střeva 10 min má až o 11 % vyšší adenoma detection rate než endoskopující s prohlížecím časem 6 min. Prodlužování prohlížecího času nad 10 min již nevede k dalšímu zlepšení [11]. Přínosné může být také polohování pacienta během výkonu. Dnes máme k dispozici stále nové a kvalitnější přístroje, např. kolonoskop s tzv. NBI zobrazením (Narrow Band Imaging) zvyšuje adenoma detection rate a detekuje více plochých a pravostranných lézí [12]. Nezbytná je však kvalitní očista střeva – viz dále.
V posledních letech se také často diskutuje o tom, zda je nutné histologicky vyšetřit všechny polypy. To je možné za předpokladu přesného makroskopického zhodnocení ze strany endoskopujícího lékaře. K rozlišení neoplastické a hyperplastické léze slouží autofluorescence i NBI zobrazení [13].
Před zahájením kolonoskopie musí pacient projít přípravou k vyprázdnění tlustého střeva, která může být pro někoho nepříjemná. U nemocných užívajících preparáty železa je doporučeno jejich vynechání sedm dní před výkonem. Tři dny před kolonoskopií je potřeba vyloučit zbytkovou stravu (zrníčka, šlupky) a nemocní trpící zácpou by měli mít 2 – 3 dny tekutou stravu. Existuje množství preparátů k vyprázdnění střev, ale žádný není ideální pro všechny nemocné. Nejčastěji se používá laváž 3 – 4 l izoosmolárního elektrolytového roztoku s polyetylenglykolem (Fortrans), který je osmoticky vyvážený, a proto bezpečný i u nemocných s kardiálním, jaterním a renálním onemocněním. Přípravek lze vypít nebo podávat nazogastrickou sondou v předvečer vyšetření rychlostí asi 1 l za hod. U nemocných, kteří přípravek netolerují, lze použít makrogolový roztok s askorbátovou komponentou (Moviprep), ale roztok je hyperosmolární. Hyperosmolární je i roztok picosulfátu sodného. Výhodou použití fosfátového roztoku je jeho malé množství, takže je lépe tolerován, nevýhodou je větší riziko dehydratace a elektrolytové dysbalance. Je kontraindikován u nemocných s renální nebo kardiální insuficiencí, jaterním onemocněním s ascitem, kde je riziko arytmií. Dále jeho rizikem je vznik aftózních slizničních lézí, které mohou způsobit chybnou diagnózu [14]. Jinou možností je vyprázdnění s roztokem MgSO4. K sigmoideoskopii je možno použít mikroklyzma např. hypertonickým roztokem sorbitolu a docusatu s laxativním účinkem (Yal).
Základní endoskopickou terapii představuje polypektomie, stopkaté polypy jsou odstraněny tak, že je stopka polypu zachycena diatermickou kličkou a prořezaná aplikací proudu. Snesený polyp je vytažen na histologické zpracování. Ve vybraných případech je možné místo po polypektomii označit tetováží, což má význam pro případné další chirurgické řešení. Velké polypy je možné odstranit pomocí naložení smyčky tzv. endoloop. Pokud po polypektomii nastane krvácení, je možné naložit klipy. U velkých polypů a rizikových pacientů je vhodné chirurgické zázemí. Odstraněný polyp se histologicky vyšetří, důležitý je popis případné neoplastické infiltrace a vzdálenost řezu, hodnotí se hloubka invaze a vztah k muscularis mucosae. Nejsou‑li tzv. Morsonova kritéria splněna, je indikována následná chirurgická resekce.
Správné technické provedení polypektomie je nezbytné ke snížení incidence intervalových karcinomů a recidiv polypů. Často používané snesení polypů bioptickými kleštěmi je někdy neadekvátní [15].
Endoskopická mukózní resekce (EMR)
EMR se provádí tak, že se aplikuje injekce speciálního obarveného roztoku do submukózy a tím se vytvoří kolekce tekutiny oddělující lézi od lamina muscularis propria. Pokud není přítomna hluboká submukózní invaze, je léze vyzdvižena do tvaru pseudopolypu, označuje se jako lifting. Nepřítomnost „liftingu“ je považováno za kontraindikaci EMR. Je snaha vše odstranit najednou en bloc, protože dochází k nižšímu procentu recidiv a umožňuje to lépe zhodnotit radikalitu výkonu. Takto je možné kličkou odstranit léze, které mají až 20 mm v průměru. Větší léze je nutné odstranit po částech tzv. piece-meal technikou, kdy je však riziko recidiv až ve 23 %. Proto jsou nezbytné endoskopické kontroly, případně ošetření recidivy argonovou plazmakoagulací [16,17].
Komplikace
Při diagnostické kolonoskopii jsou vzácné. Po polypektomii se vyskytuje až v 2,9 % krvácení, v 1,1 % jsou krvácení závažná, vyžadující krevní transfuze, hospitalizaci nebo chirurgický zákrok. Asi v 1,5 % dochází ke krvácení bezprostředně po výkonu, ale může nastat i pozdní krvácení až za dva týdny po polypektomii, příčinou je nejčastěji odlučování koagul [18]. Riziko krvácení zvyšuje věk nad 65 let, antikoagulační terapie, kardiovaskulární onemocnění a velikost polypu [19,20]. Polypektomie pacientů s antikoagulační léčbou je považována za vysoce rizikový výkon. Doporučuje se přerušit užívání warfarinu 3 – 5 dní před výkonem bez podávání heparinu. Toto opatření se týká pacientů po žilní trombóze, s fibrilací síní bez onemocnění chlopní, náhradou chlopně bioprotézou a mechanickou náhradou chlopně. Pacientům s vysokým rizikem trombembolické nemoci (fibrilace síní s mechanickou náhradou chlopně, mechanická náhrada mitrální chlopně, mechanická náhrada u pacientů s trombembolií) je možné vysazení warfarinu za současného podávání heparinu [18]. Salicyláty je vhodné vysadit týden před zákrokem. V důsledku hypoxemie mohou nastat kardiorespirační komplikace, bakteriemie je až v 10 %. Pneumatická perforace v pravém tračníku je popisována při enormní insuflaci, perforace nejčastěji užitím nepřiměřené síly během zavádění. Výrazně rizikovější z hlediska perforace jsou pacienti s pokročilou divertikulózou, adhezemi po operacích, floridními střevními záněty. Perforace je popisována u 0,04 – 2,1 % polypektomií a je způsobena poškozením střevní stěny polypektomickou kličkou nebo tepelnou nekrózou v místě polypektomie.
Syndrom koagulovaného střeva se projevuje obvykle za 6 hod až 5 dní a vyznačuje se bolestí břicha, někdy teplotou, leukocytózou, tachykardií, projevy lokalizovaného peritoneálního dráždění.
Po polypektomii velkých, vícečetných nebo složitě odstranitelných polypů a u starších a rizikových nemocných je vhodná 24hodinová hospitalizace.
Chirurgická léčba prekanceróz tlustého střeva a konečníku je závislá na vzdálenosti patologického procesu od anu a na velikosti postižení. Léze postihující tračník a orální část konečníku se operuje laparotomickým, event. laparoskopicky asistovaným přístupem. Lokalizace se značí předoperačně tetováží Spot®, peroperačně palpací, případně peroperačně provedenou kolonoskopií randez ‑ vous technikou. V úvahu přichází klínovitá excize patologického procesu ve zdravé sliznici s následnou suturou defektu, event. segmentální resekce části tlustého střeva s následným obnovením pasáže sešitím tračníku konec ke konci. Léze postihující aborální část rekta je možné řešit endoskopicky metodou transrektální endoskopické mikrochirurgie (TEM). Limitující pro operační rektoskop jako nástroj pro transrektální endoskopickou mikrochirurgii je vzdálenost od anodermální linie, průměr rekta, tvar exkavace kosti svaté a výraznost rektálních řas a samozřejmě velikost postižení. Za příznivých anatomických podmínek lze 4 cm silným tubusem tvořícím pracovní kanál pro optiku a nástroje dosáhnout do 20 cm od anodermální linie. Pomocí operačního rektoskopu je možné odstranit i cirkulární polyp s následnou endoskopicky provedenou suturou konečníku koncem ke konci. Technická proveditelnost zákroku operačním rektoskopem v závislosti na velikosti postižení je nutné hodnotit individuálně a nelze stanovit paušálně hraniční velikost. Je rozdíl mezi endoluminálně rostoucími polypy a plošně přisedlými polypy. Jedná‑li se o prekancerózu, tedy stadium Tis s vyloučením angioinvaze, je dostatečně radikálním výkonem transmurální resekce postižené části rekta ve zdravé tkáni [21].
Po odstranění polypů je pacient dispenzarizován. Nyní je tendence spíše k prodloužení dispenzárního intervalu u pacientů s nízkým rizikem. Zvýšené riziko rekurence je při nálezu pokročilého adenomu, více než tří adenomů a věku nad 60 let [22]. Každé doporučení však musí být přísně individuální s přihlédnutím k biologickému věku, komorbiditám, rodinné anamnéze. Ani mezi experty není shoda, zda po kolonoskopii s nedostatečným vyprázdněním se má vyšetření zopakovat nebo zkrátit dispenzární interval. Lebwohl et al uvádějí 42 % přehlédnutých adenomů a 27 % přehlédnutých pokročilých adenomů při kolonoskopii se suboptimální přípravou, proto doporučuje do jednoho roku vyšetření zopakovat [23]. Návrh doporučení je předložen v tab. 3 [24,25].
Tab. 3. Doporučené dispenzární kontroly [24,25]. ![Doporučené dispenzární kontroly [24,25].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/04683fdb67753fb9de0af8a5c5b678bf.png)
Závěr
Záchyt onkologického onemocnění v časném klinickém stadiu nebo ještě lépe ve fázi prekancerózy výrazně zvyšuje naději na dobrý výsledek léčby a na dlouhodobé přežití. Dostupná data o kolorektálním karcinomu nejsou zatím příliš povzbudivá. Většina pacientů přichází ve stadiu III nebo IV. Národní program screeningu byl v ČR zahájen v roce 2000, iniciálně s využitím guajakového testu na okultní krvácení. Od té doby prošel program významnými změnami, máme k dispozici anonymizovaný registr, byla zavedena primárně screeningová kolonoskopie od 55 let, používají se nové typy imunologických testů na okultní krvácení. Endoskopická pracoviště zapojená do screeningu musí splňovat kritéria kvality. V současné době je účast obyvatel ve screenigovém programu 25 %, k významnému snížení mortality na kolorektální karcinom je potřeba účast alespoň zdvojnásobit [26]. V letošním roce má být zahájena masivní mediální kampaň a zejména adresné zvaní [27]. Navzdory standardizovaným postupům existují v ČR velké regionální rozdíly v pokrytí populace screeningovým vyšetřením. Velké rezervy tedy existují i v organizaci péče. Nesmíme také opomíjet primární prevenci. ČR vykazuje vysokou spotřebu alkoholu na jednoho obyvatele, výrazně narůstá prevalence obezity a též roste počet kuřáků. Pokud nedojde k razantní změně, lze očekávat nárůst počtu onkologických pacientů se všemi společenskými i finančními důsledky.
Doporučení pro praxi
Screening
- Klient ve věku od 50 – 54 let má právo na bezplatný test na okultní krvácení 1krát ročně, test dostane u svého praktického lékaře nebo gynekologa. Při pozitivitě následuje kolonoskopie.
- V 55 letech si může klient zvolit test na okultní krvácení 1krát za dva roky nebo primární screeningovou kolonoskopii. V případě negativní kolonoskopie je další vyšetření provedeno za 10 let (www.kolorektum.cz).
Vyšetření osob s familiárním rizikem [28]
- Při postižení jednoho příbuzného kolorektálním karcinomem (CRC) 1. stupně nebo adenomovými polypy ve věku pod 60 let nebo dvou příbuzných CRC 1. stupně jakéhokoliv věku – kolonoskopie v 5letém intervalu od 40 let věku či od věku o 10 let nižšího, v němž byla stanovena diagnóza nejčasnějšího CRC v rodině.
- Při postižení jednoho příbuzného CRC 1. stupně ve věku 60 let a vyšším nebo dvou příbuzných CRC 2. stupně – program průměrného rizika od věku 40 let.
- Při postižení jednoho příbuzného CRC 2. stupně nebo jakéhokoliv počtu příbuzných CRC 3. stupně (prarodiče, bratranci a sestřenice) – program jako u osob s průměrným rizikem.
Indikace ke konzultaci na oddělení lékařské genetiky [4,5]
- Jestliže je v rodině zaznamenán opakovaný výskyt nádoru v několika generacích, více nádorů u jedince nebo jedinců či výskyt nádoru v mladém věku.
- Pro diagnostiku a indikaci k vyšetření odpovědných genů jsou u některých hereditárních forem nádorů definována specifická kritéria, např. FAP nebo HNPCC.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Milana Šachlová, Ph.D., CSc.
vedoucí lékař Gastroenterologické oddělení
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: sachlova@mou.cz
Obdrženo: 26. 8. 2013
Přijato: 13. 10. 2013
Zdroje
1. Jirásek T. Histomorfologický obraz prekanceróz. In: Černoch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 45 – 70.
2. Schlemper RJ, Riddell R, Kato Y et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47(2): 251 – 255.
3. Kohoutová M. Genové změny v prekancerózách. In: Čer-noch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 27 – 40.
4. Plevová P, Novotný J, Šachlová M et al. Hereditární nepolypózní kolorektální karcinom. Klin Onkol 2009; 22 (Suppl): S12 – S15.
5. Plevová P, Štekrtová J, Kohoutová M et al. Familiární adenomatózní polypóza. Klin Onkol 2009; 22 (Suppl): S16 – S19.
6. Hodgson SV, Foulkes WD, Eng Ch et al. A Practical Guide to Human Cancer Genetics. Cambridge University Press 2007.
7. Černoch J. Klasifikace slizničních změn. In: Černoch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 125 – 147.
8. Kudo SE, Lambert R, Allen JI et al. Nonpolypoid neoplastic lesion of colorectal mucosa. Gastrointest Endosc 2008; 68 (4 Suppl): S3 – S47.
9. Rex DK, Bond JH, Winawer S et al. Quality in the technical performance of colonoscopy and the continous quality improvement process of colonoscopy: recomendations of the U.S.Multi‑Society Task Force on Colorectal Cancer. Am J Gastroenterol 2002; 97(6): 1296 – 1308.
10. Kaminski MF, Regula J, Kraszewska E et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362(19): 1795 – 1803.
11. Barclay RL, Vicari JJ, Doughty AS et al. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy. N Engl J Med 2006; 355(24): 2533 – 2541.
12. Rastogi A, Early DS, Gupta N et al. Randomized, controlled trial of standard ‑ definition white‑light, high‑definition white‑light and narrow ‑ band imaging colonoscopy for the detection of colon polyps and prediction of polyp histology. Gastrointest Endosc 2011; 74(3): 593 – 602.
13. Sato R, Fujiya M, Watari J et al. The diagnostic accuracy of high‑resolution endoskopy, eutofluorescence paging and narrow band paging for differentially diagnosing colon adenoma. Endoscopy 2011; 43(10): 862 – 868.
14. Zádorová Z. Kolonoskopie. Doporučený postup endoskopického vyšetření tlustého střeva. Čes a Slov Gastroent a Hepatol 2005; 59(1): 26 – 30.
15. Efthymiou M, Taylor AC, Desmond PV et al. Biopsy forceps is inadequate for the resection of diminutive polyps. Endoscopy 2011; 43(4): 312 – 316.
16. Urban O, Falt P. Endoskopická léčba prekanceróz a časných neoplazií trávicí trubice. In: Černoch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 151 – 186.
17. Martínek J. Endoskopická resekce. In: Špičák J et al (eds). Novinky v gastroenterologii a hepatologii. Praha: Grada 2008 : 189 – 227.
18. Zádorová Z. Gastrointestinální endoskopie u nemocných s antikoagulační a antiagregační terapií. Čes a Slov Gastroent a Hepatol 2007; 61(6): 314 – 317.
19. Boustière C, Veitch A, Vanbiervliet G et al. Endoscopy and antiplatelet agents. ESGE Guideline. Endoscopy 2011; 43(5): 445 – 461.
20. Heldwein W, Dollhopf M, Rösch T et al. The Munich Polypectomy Study: Prospective analysis of complications and risk factors in 4000 colonic snare polypectomies. Endoscopy 2005; 37(11): 1116 – 1122.
21. Ondrák M, Šefr R, Eber Z. Transanální endoskopická mikrochirurgie a její postavení v chirurgii rekta – přehled. Rozhl Chir 2011; 90(8): 450 – 456.
22. de Jonge V, Sint Nicolaas J, van Leerdam ME et al. Systematic literature review and pooled analyses of risk factors for finding adenomas at surveillance colonoscopy. Endoscopy 2011; 43(7): 560 – 572.
23. Lebwohl B, Kastrinos F, Glick M et al. The impact of suboptimal bowel preparation on adenoma miss rates and the factors associated with early repeat colonoscopy. Gastrointest Endosc 2011; 73(6): 1207 – 1214.
24. Winawer SJ, Zauber AG, Fletcher RH et al. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi‑Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006; 130(6): 1872 – 1885.
25. Mikoviny Kajzrlíková I, Vítek P. Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012? Gastroent Hepatol 2012; 66(4): 294 – 297.
26. Dušek L. II. Evropské dny kolorektálního karcinomu, 26. – 27. dubna 2013, Brno.
27. Zavoral J. II. Evropské dny kolorektálního karcinomu, 26. – 27. dubna 2013, Brno.
28. Šachlová M, Foretová L. Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu. Klin Onkol 2009; 22(6): 296 – 297.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Prekancerózy v ORL oblastiČlánek Prekancerózy jícnuČlánek Prekancerózy žaludkuČlánek EditorialČlánek Prekurzory karcinomu prsu
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Prekancerózy v ORL oblasti
- Prekancerózy jícnu
- Prekancerózy žaludku
- Prekancerózní stavy a rizikové faktory karcinomu pankreatu a žlučových cest
- Editorial
- Premaligní stavy tenkého střeva
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v gynekologii – pochva
- Prekancerózy v gynekologii – děložní hrdlo
- Prekancerózy v gynekologii – ovarium
- Prekurzory karcinomu prsu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prekancerózy žaludku
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v ORL oblasti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



