-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Potenciál vitamínu D v adjuvantnej liečbe malígneho melanómu kože
Potential of Using Vitamin D as an Adjuvant Treatment of Malignant Melanoma
The incidence of malignant melanoma worldwide continues to grow despite the enormous advances in topical and systemic therapy. This increase is recorded regularly even in countries where, as a result of public health campaigns, dermatological examination and subsequent treatment have become more frequent. However, there have been reports of a stable or even decreasing mortality rate that seem to contradict the objective increase in its incidence. The well-known risk factors for malignant melanoma include sunburns and occasional sunbathing, whereas regular sunbathing is associated with a lower incidence. Besides DNA damage, exposure to the sun also results in the synthesis of vitamin D (cholecalciferol) in the skin, which contributes to over 90% of circulating Calcidiol (25 (OH) D) in serum. Current cultural norms (dressing, working indoors, avoiding sun exposure, and dietary choices) affect the serum vitamin D level, resulting in severely low serum levels of vitamin D in some sectors of today’s society. Emerging data suggests that mild, unprotected exposure to UV radiation or dietary supplementation with oral vitamin D can reduce cancer mortality. Supplementation with vitamin D or alternatively UV exposure may be regarded as an adjuvant for the treatment of many types of tumors (e. g. tumors of the colon, prostate, and breast). The effect of vitamin D on malignant melanoma may be due to its non-calcemic systemic effects. Additionally, vitamin D may have more pronounced effects locally in the skin because of the unique ability of keratinocytes to synthesize the active form of vitamin D.
Key words:
malignant melanoma – vitamin D – adjuvant treatment therapy – clinical oncology
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
7. 10. 2016Accepted:
26. 7. 2017
Autori: B. Bolerázska 1,2; E. Ďurovcová 1,2; M. Mareková 1
Pôsobisko autorov: Ústav lekárskej a klinickej biochémie, LF UPJŠ v Košiciach, Slovenská republika 1; Oddelenie klinickej biochémie, Medirex, a. s., Košice, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2017; 30(5): 327-336
Kategória: Přehled
doi: https://doi.org/10.14735/amko2017327Súhrn
Výskyt malígneho melanómu celosvetovo neustále rastie, a to aj napriek obrovskému pokroku v lokálnej a systémovej terapii. Objektívny nárast výskytu spochybňuje stabilná až relatívne klesajúca úmrtnosť na toto ochorenie a skutočnosť, že tento nárast je pravidelne zaznamenávaný v krajinách, v ktorých na podnet verejných kampaní dochádza častejšie k dermatologickému vyšetreniu a následnému ošetreniu. K dobre známym rizikovým faktorom pre vznik malígneho melanómu patrí spálenie a občasné nepravidelné slnenie, avšak pri pravidelnom slnení bol zaznamenávaný výskyt práve naopak nižší. Expozícia slnečnému žiareniu má za následok okrem možného poškodenia DNA buniek aj syntézu vitamínu D (cholekalciferol) v koži a tá je zodpovedná za viac ako 90 % z hodnoty sérovej hladiny cirkulujúceho kalcidiolu (25 (OH) D). Súčasné kultúrne normy (obliekanie, práca v interiéri, vyhýbanie sa slnku, výber stravy) túto hladinu ovplyvňujú, čo má za následok značné ochudobnenie dnešnej modernej spoločnosti o tento vitamín. Neustále sa objavujú údaje o tom, že mortalita v dôsledku nádorových ochorení môže byť znížená miernou nechránenou expozíciou UV žiarenia alebo orálnou substitúciou vitamínom D. U viacerých typov nádorov (napr. nádory hrubého čreva, prostaty, prsníka) sa preukázalo, že suplementácia vitamínom D alebo alternatíva vo forme expozície UV žiarenia môže byť považovaná za adjuvans v liečbe nádorového ochorena. Východiskom pre predpoklad účinku vitamínu D taktiež u malígneho melanómu sú jeho nekalcemické účinky, ktoré sa uplatňujú systémovo a v koži navyše vďaka jedinečnej schopnosti keratinocytov syntetizovať aktívnu formu vitamínu D aj lokálne.
Kľúčové slová:
malígny melanóm – vitamín D – adjuvantná liečba – klinická onkológiaÚvod
Doteraz najúčinnejšou liečbou malígneho melanómu (MM) je jednoznačne chirurgické odstránenie neoplastických lézií. Konzervatívna liečba u tohto ochorenia prešla v priebehu 30 rokov výraznými zmenami od jedného cytotoxického chemoterapeutika k imunoterapii a až k cielenej molekulovej liečbe signálnymi inhibítormi, na ktoré sú kladené v súčasnosti najväčšie očakávania. Najvýraznejšie pokroky boli zaznamenané v liečbe pokročilejších štádií MM, predovšetkým ako dôsledok pokroku v oblasti nádorovej bunkovej biológie, imunológie, chirurgických techník, rádiochirurgie, ale aj zobrazovacích metód [1]. Vedecko-výskumné výsledky dosiahnuté pri štúdiu MM nielen vo vyššie spomínaných oblastiach budú pravdepodobne aj ďalej prispievať k pozitívnym zmenám v diagnostike i liečbe MM.
Adjuvantná liečba slúži vo všeobecnosti na redukciu rizika relapsu u pacientov, u ktorých po chirurgickej liečbe je už ochorenie dostupnými prostriedkami nedetegovateľné. Táto forma liečby je vykonávaná u MM, ale aj u iných solídnych nádorových ochorení u pacientov po chirurgickej terapii bez príznakov ochorenia a jej cieľom sú možné mikrometastázy. Napriek rapídnym zmenám v liečebných postupoch zostáva toto ochorenie stále pre mnohých pacientov neliečiteľné, a preto je MM stále v pozornosti vedecko-výskumných kolektívov na celom svete. Veľa nedávnych štúdií poukazuje na vzťah medzi nedostatkom vitamínu D a vznikom i priebehom nádorových ochorení. Mnohé štúdie analyzujú aj jeho vplyv na mortalitu [2,3]. Nie je teda prekvapujúce, že pribúdajú tiež štúdie poukazujúce na to, že vývoj MM môže byť spojený s nedostatkom vitamínu D alebo poruchami jeho signálnej cesty [4,5]. Vysvetlenie sa hľadá v stále sa rozširujúcich poznatkoch o nekalcemických účinkoch vitamínu D, ku ktorým patrí napr. regulácia rastu, opráv DNA, diferenciácie, apoptózy, membránového transportu, bunkovej adhézie či oxidačného stresu. V kontexte s non-kalcemickými účinkami vitamínu D sa v súčasnej dobe zvažuje aj adjuvantná liečba vitamínom D u pacientov s diagnózou MM, od ktorej sa očakáva zníženie nádorovej invazívnosti a mikrometastázovania, a tým zlepšenie prognózy pacienta a zníženie rizika recidívy [6]. Základná terminológia vitamínu D je uvedená v tab. 1.
Tab. 1. Terminológia vitamínu D, ekvivalenty, skratky a synonymá. 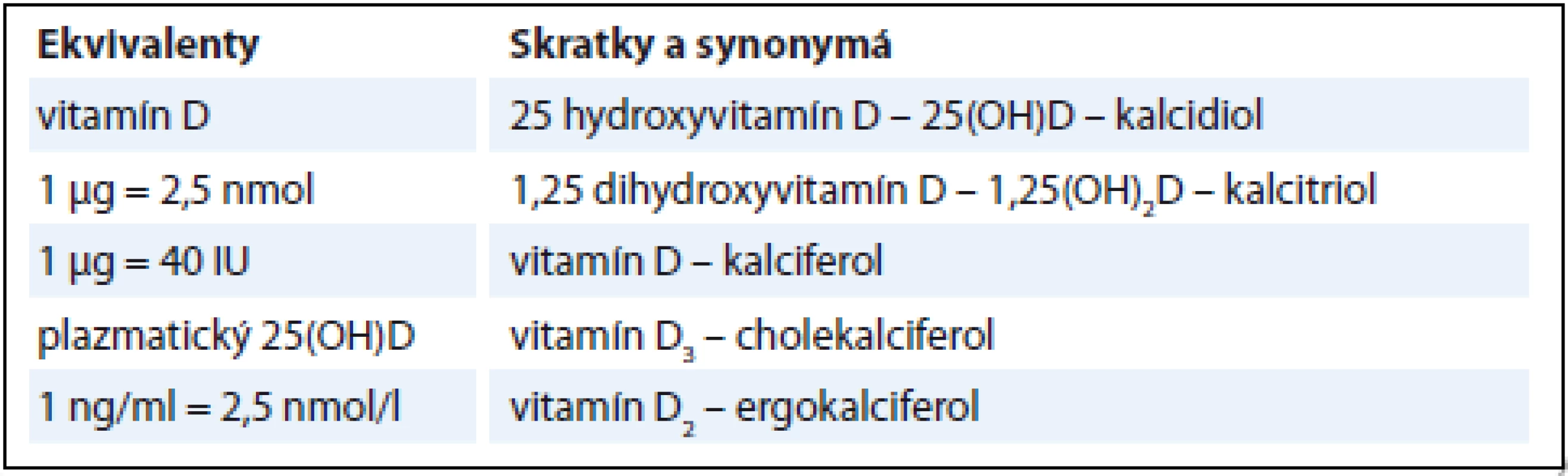
Upravené podľa [94]. Malígny melanóm
Najrozšírenejšou aktuálnou hypotézou vzniku MM je vývoj v dôsledku spálenia u ľudí, ktorí prevažnú väčšinu času trávia v interiéri a počas dovolenky sú vystavení nadmernému slneniu [7–9]. To má za následok lokálne poškodenie DNA a imunosupresiu, čo vedie s odstupom času k zvýšeniu rizika vzniku MM na intermitentne zakrytých častiach tela [10,11]. Väčšina MM vzniká ako nová lézia (z rezidentných melanocytov v koži), aj keď významný podiel (25–40 %) majú MM vznikajúce z už existujúcich névov. Základný komplex interakcií uplatňujúcich sa pri vzniku MM zobrazuje schéma 1. Najvyšší prínos pre včasné odhalenie choroby prináša klinické celotelové vyšetrenie pleti.
Schéma 1. Komplex interakcií uplatňujúcich sa v etiológii malígneho melanómu. 
Upravené podľa [95]. Výsledkom diferenciácie a migrácie melanocytov, ktoré sú podmienené pohlavím, je častejší výskyt névov u mužov na trupe a u žien na nohách a túto distribúciu névov je možné pozorovať už u malých detí [12]. Podobne aj rozloženie typov névov nie je náhodné. Napr. zrelé intradermálne névy majúce nízky potenciál pre malígnu transformáciu sa vo všeobecnosti nachádzajú bežne napr. na tvári, ale zriedkavo na končatinách. Na druhej strane junkčné a atypické névy, ktoré sú viac nestabilné, čo sa týka rizika vzniku MM, sa veľmi zriedkavo nachádzajú na tvári, ale pravidelne na tele a proximálnych častiach končatín [13]. Špecifická génová expresia v melanocytoch v rôznych častiach tela je pravdepodobne kľúčom k vysvetleniu týchto pozorovaní. Podobne aj lokalizácia melanómových lézii je u mužov častejšia na trupe a u žien na nohách a takto je konštantne zaznamenávaná celosvetovo [14]. Pozorované je tiež signifikantne dlhšie prežívanie žien v porovnaní s mužmi s diagnostikovaným MM, čo opäť potvrdzuje vplyv pohlavia ako jedného z kľúčových faktorov tohto ochorenia. Podobný nárast v prežívaní žien bol zaznamenaný aj u nádorov mozgu a vzhľadom na spoločný pôvod melanocytov a neurónov by pravdepodobne mohla poskytnúť vysvetlenie práve pohlavím ovplyvnená diferenciácia buniek neurálnej lišty [15,16]. Rastúci dopyt po podrobnejšom preskúmaní rozdielov v chovaní névov a MM v súvislosti s ich histologickými subtypmi a pohlavím by nám v blízkej budúcnosti mohli objasniť štúdie na molekulovej úrovni.
Antikancerogénne účinky vitamínu D aplikovateľné u MM
Biologické účinky vitamínu D sa v súvislosti s nádorovými ochoreniami, najmä MM, môžu uplatniť lokálne, teda v mieste primárneho nádoru a po uvoľnení do systémovej cirkulácie ovplyvniť schopnosť mikrometastázovania. Všeobecne známy proces ľudskej endogénnej syntézy vitamínu D začína v koži účinkom UV žiarenia a k jeho premene na aktívnu formu dochádza hydroxyláciou v pečeni a obličkách. Menej je známe, že táto endogénna syntéza súčasne a dokonca kompletne prebieha aj v keratinocytoch [17]. Keratinocyty, ako jediné bunky v ľudskom tele, syntetizujú enzýmy pre úplný priebeh syntézy vitamínu D provitamínom (7-dehydrocholesterol) počínajúc a aktívnou formou, 1,25-dihydroxyvitamín D3 (1,25 (OH) 2D3, kalcitriol) končiac (obr. 1). Kožnej syntéze kalcitriolu sa pripisuje intrakrinný a/alebo autokrinný účinok na samotné keratinocyty a aj parakrinný na susediace bunky, ktorými môžu byť aj melanocyty, event. bunky MM [18]. Keratinocyty interagujú s okolitými, a teda aj melanocytárnymi bunkami, doteraz však tieto vzájomné interakcie medzi nimi neboli detailne popísané. Podobne ako v keratinocytoch aj v melanocytoch bola dokázaná nielen lokálna syntéza aktívnej formy vitamínu D (1,25 (OH) 2D3) z prekurzora 25 (OH) D3, ale aj expresia receptora pre vitamín D (vitamin D receptor – VDR) [19]. Schopnosť syntézy 1,25 (OH) 2D3 z 25 (OH) D3 sa potvrdila aj v bunkách MM, vrátane expresie VDR [20]. Avšak v oboch typoch buniek (melanocyty, bunky MM) absentuje kompletné enzymatické vybavenie pre úplnú syntézu vitamínu D od 7-dehydrocholesterolu (7-DHC, provitamín D3) cez previtamín (PreD3, pre-cholekalciferol) na vitamín D3 (cholekalciferol), ktorý je postupnou dvojitou hydroxyláciou v polohe 1 a 25 aktivovaný na 1,25-dihydroxyvitamín D3 (1,25 (OH) 2D3, kalcitriol), a preto sú tieto bunky závisle od intermediátov alebo priamo od aktívneho produktu zo svojho okolia.
Obr. 1. Priebeh syntézy vitamínu D v keratinocytoch. 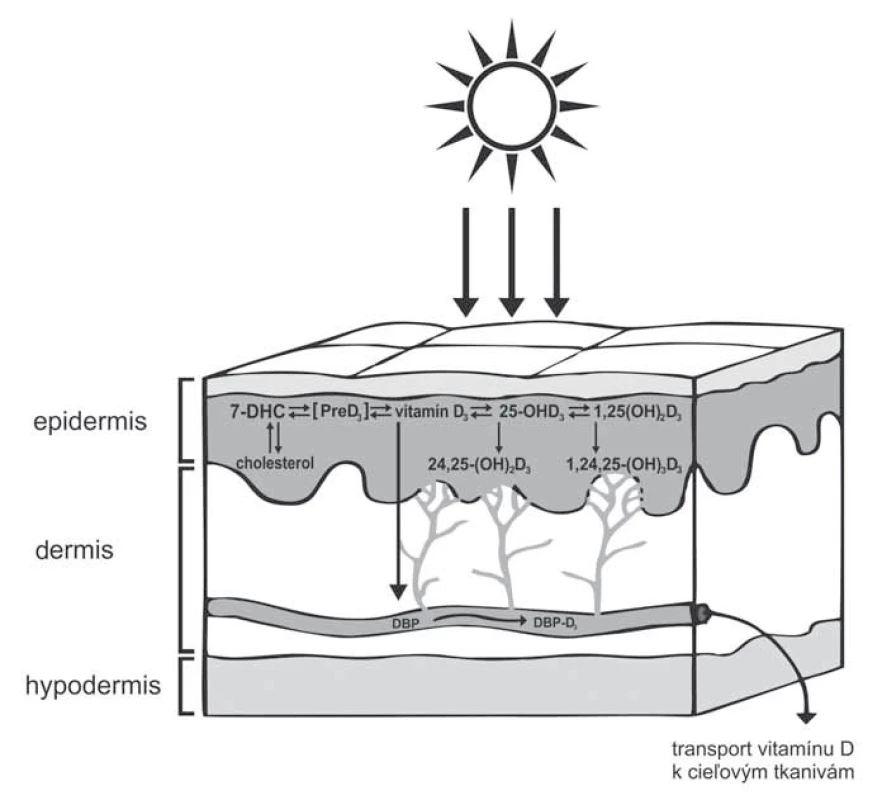
Najvyšší potenciál pre tvorbu vitamínu D majú vrstvy epidermy stratum basale a spinosum, pretože obsahujú najvyššiu koncentráciu 7-dehydrocholesterolu (7-DHC, provitamín D3). Účinkom ultrafialového žiarenia dochádza k rozštiepeniu B-kruhu medzi 9. a 10. uhlíkom (s-ciskonformácia) a vzniká menej stabilná forma s-cisprevitamín D3 (PreD3, pre-cholekalciferol). Následná rotácia okolo 5. a 6. uhlíka dáva vznik termodynamicky viac stabilnej s-transkonformácii (cholekalciferol, vitamín D3). Tento sa viaže na DBP (vitamin D3 binding protein – VDBP) a v takejto forme je transportovaný v systémovej cirkulácii. Hydroxyláciou v pečeni z neho vzniká 25-hydroxyvitamín D3 (25(OH)D3, kalcifediol, všeobecne kalcidiol), ktorý je následne v obličkách hydroxylovaný na 1,25-dihydroxyvitamín D3 (1,25(OH)2D3, kalcitriol, aktívna forma vitamínu D). Kompletný enzymatický aparát pre syntézu aktívnej formy vitamínu D obsahujú ako jediné bunky v ľudskom tele keratinocyty. Vzdialené aj lokálne účinky vitamínu D sprostredkúva prevažne VDR. Je to predominantne jadrová bielkovina viažuca aktívnu formu vitamínu D s vysokou afinitou a špecificitou. Najvyššia expresia tohto receptora bola zaznamenaná v metabolicky aktívnych tkanivách, akými sú koža, črevo, obličky a štítna žľaza. Exprimovaný je aj nádorovými tkanivami [21]. Na základe imunohistochemických analýz kožného tkaniva bolo preukázané, že expresia VDR klesá v následujúcom poradí – normálna koža, melanocytárne név, MM bez prítomnosti metastáz, s prítomnosťou metastáz. Expresia VDR klesá tiež s rastúcou progresiou štádia tumoru [22]. U ľudí má VDR viacero variant, ktoré môžu ovplyvniť expresiu proteínu a aktivitu VDR. Detegovaných bolo viac ako 1 000 polymorfných lokalít génu pre VDR, z ktorých niektoré korelovali so zvýšeným rizikom MM. Analýza expresie VDR a jeho polymorfizmov môže v budúcnosti slúžiť ako dôležitý prognostický faktor pre liečbu MM vitamínom D alebo jeho analógmi. Jedným z dôvodov je predpoklad, že 1,25 (OH) 2D3 ovplyvňuje transkripciu najmenej 3 000 génov ľudského genómu, čo je pravdepodobne výsledkom vývoja života na Zemi v harmónii so Slnkom [23]. Naviac citlivosť MM k pridanému 1,25-dihydroxyvitamínu D3 (1,25 (OH) 2D3) koreluje s mierou stimulácie génovej expresie. Príkladom je citlivosť melanómových kultúr MeWo a SK Mel-28 k 1,25 (OH) 2D3, ktorá má za následok alteráciu expresie génov závislých od vitamínu D. U ďalších typov MM, akými sú napr. SK Mel 5 a SK Mel 25, pridanie 1,25-(OH) 2D3 viedlo k narušeniu génovej expresie a inhibícii bunkového rastu [24].
Medzi najdôležitejšie protinádorové účinky vitamínu D patrí indukcia zastavenia bunkového cyklu, stimulácia apoptózy a inhibícia angiogenézy [25]. Najväčší antiproliferačný účinok má indukcia zastavenia bunkového cyklu založená na blokáde G1 fázy [26], ktorú je možné dosiahnúť navodením zvýšenej tvorby proteínov p21 a p27. Navyše 1,25 (OH) 2D3 preukázal tiež schopnosť zastaviť bunkový cyklus v nádorových bunkových líniách aj vo faze G2/M [27]. Vitamín D je schopný navodiť apoptózu nádorových buniek už na génovej úrovni prostredníctvom inhibície známeho anti-apoptotického génu Bcl-2 [28], indukciou pro-apoptotických génov, ako sú DAP, CFKAR a FADD [29] a dokáže dokonca aktivovať aj pro-autofagický gén beclin-1 [30]. Navyše kalcitriol zvyšuje aj aktivitu pro-apoptotických proteínov Bax a μ-calpain [27,31–33]. Schopnosť navodenia apoptózy je jednoznačne jednou z najdôležitejších funkcií proteínu p53, známeho hlavného regulátora apoptózy a produktu tumor supresorového génu TP53. U viacerých nádorových bunkových línií bolo zistené, že mechanizmus indukcie apoptózy prostredníctvom vitamínu D varíruje v závislosti od typu bunky a môže byť sprostredkovaný cestou proteínu p53, ale aj bez jeho prítomnosti [34,35]. Funkčná konvergencia medzi rodinou proteínu p53 a signalizáciou vitamínu D cez VDR, ktorá nastáva v dermis kože, znamená pravdepodobne evolučnú adaptáciu za účelom vyváženia medzi fyziologickou potrebou syntézy vitamínu D a ochranou genómu pred genotoxickými inzultami z okolitého prostredia alebo lokálnej zápalovej reakcie [36]. Podpora nádorovej angiogenézy, invázie a metastázovania môže byť dôsledkom aktivácie tzv. spínačov angiogenézy, ktorých aktiváciu kontroluje predovšetkým endoteliálny rastový factor (vascular endothelial growth factor – VEGF) [37]. Bolo preukázané, že vitamín D dokáže znižovať expresiu VEGF v nádorových bunkách a tiež znižuje odpoveď endoteliálnych buniek na tento faktor [38]. Zákonito je hypoxia výrazný induktor tvorby VEGF a počas jej pôsobenia, za súčasnej aplikácie vitamínu D dochádzalo k signifikantnému zníženiu tvorby VEGF [39]. K potvrdeným účinkom vitamínu D taktiež patrí schopnosť znižovať tvorbu prozápalových cytokínov a aj ich biologickú aktivitu, čo má významný protizápalový efekt [40]. Zápalová reakcia sprevádzajúca rast nádoru, tiež aj MM, je vo všeobecnosti charakterizovaná prítomnosťou zápalových buniek, mediátorov zápalovej reakcie, akými sú cytokíny, chemokíny, prostaglandíny a kyslíkové radikály [41]. A práve aktivita VEGF významne závisí aj od mediátorov zápalu. Schopnosťou znížiť zápalovú reakciu môže teda vitamín D prostredníctvom VEGF zasahovať aj do nádorovej angiogenézy. V literatúre sa popisuje tiež vznik nádorových ochorení v dôsledku chronického zápalového procesu. So vznikom nádorových ochorení, obzvlášť s procesom, ktorý vedie od zápalu ku kancerogenéze, sa opakovane spája skupina transkripčných faktorov známych pod označením NF-κB (nuclear factor kappa B), ktoré sa podieľajú na kontrole transkripcie DNA, produkcie cytokínov a bunkového prežívania [42]. V porovnaní so zdravými bunkami mali mnohé nádorové bunky zvýšené hodnoty NF-κB. Potvrdilo sa, že kalcitriol je schopný blokovať aktiváciu NF-κB [43], a táto inhibícia sa javí ako veľmi sľubná možnosť protinádorovej liečby, vrátane liečby MM [44].
In vitro a in vivo výskum MM
Prevažná väčšina štúdií MM je vykonávaná in vitro s použitím bunkových kultúr melanómových buniek v podmienkach, ktoré ale nedokážu presne imitovať prirodzené mikroprostredie nádoru [45]. Napríklad aktivita buniek MM závisí okrem iných faktorov aj od zápalových buniek infiltrujúcich nádor, keratinocytov a fibroblastov. A naopak, melanómové bunky sú schopné ovplyvniť diferenciáciu keratinocytov produkciou napr. FGF-2 (fibroblast growth factor 2), VEGF A (vascular endothelial growth factor A), IL-8 (interleukin 8) a CXCL-1 (chemokín C-X-C motif ligand 1) [46]. Na objasnenie významu keratinocytov aktivovaných bunkami MM v procese kancerogenézy je potrebné vykonanie ďalších štúdií.
V niektorých melanómových bunkových kultúrach sa preukázal anti-proliferačný a pro-diferenciačný účinok vitamínu D a jeho prekurzorov, avšak nie vo všetkých [47]. Aktívna forma vitamínu D dokázala potlačiť invazívne správanie nádoru a s tým spojenú angiogenézu v bunkových kultúrach MM [48], a dokonca tiež potláčala rast ľudských MM prenesených vo forme xenotransplantátu na imunosuprimované myši s potvrdenou expresiou VDR. Tieto výsledky sa nepotvrdili v bunkových líniách MM, ktoré mali zablokovanú expresiu VDR [49]. Následne sa ukázalo, že niektoré melanómové bunkovej línie boli rezistentné voči účinkom vitamínu D. Tieto bunkové línie vykazovali zníženú expresiu mRNA pre gén kódujúci VDR alebo zvýšenú aktivitu 24-hydroxylázy (CYP24A1), čiže kľúčového enzýmu, ktorý mení aktívnu formu vitamínu D (1,25 (OH) 2D3) na neaktívny 24,25 (OH) 2D3 [19,47].
Nedávno boli účinky 1,25 (OH) 2D3 rozšírené o vplyv na opravy poškodenej DNA prostredníctvom excízie nukleotidov (nucleotide excision repair – NER), ktorý sa aktivuje po expozícii UV žiarením. Rozpoznanie poškodenia za pomoci špecifických (tzv. damage sensing) proteínov vedie k odstráneniu krátkeho jednoreťazcového úseku DNA, v ktorom je obsiahnuté poškodenie. Súčasťou procesu vykonávaného NER systémom je syntéza komplementárneho reťazca a následná ligácia. Je veľmi pravdepodobné, že 1,25-dihydroxyvitamín D3 dokáže systém NER stimulovať, čo vedie k efektívnejšiemu odstraňovaniu karcinogénnych, UV žiarením spôsobených fotoproduktov a iných poškodení, ktoré sa podieľajú na kožnej neoplastickej transformácii [50]. Výsledky štúdie realizované in vivo na bezsrstých myšiach s UV žiarením indukovanými nádormi kože ukázali, že lokálna aplikácia 1,25 (OH) 2D3 po ožiarení znižovala rozsah poškodenia DNA meraný na základe množstva vytvorených cyklobutánových pyrimidínových dimérov (CPDs) [51]. Vo svete, ktorý sa snaží orientovať na personalizovanú medicínu, sa objavil už aj návrh individualizovaného podávania vitamínu D na základe analýzy NER systému za účelom prevencie/liečby kožných nádorov. Podľa Pawlovskej et al by takéto vyšetrenie bolo založené na izolácii keratinocytov od pacienta a následnom hodnotení NER systému (funkčné testy), na základe ktorých by sa stanovila odporúčaná dávka vitamínu D [50].
Výsledky epidemiologických štúdii o účinkoch slnečného žiarenia na MM
Signifikantný rozdiel v incidencii MM medzi Austráliou a Európou je dôvodom pre považovanie slnečného žiarenia za jednu z príčin vzniku MM. Avšak podrobnejšie preskúmanie epidemiologických údajov neukazuje na slnko ako na hlavnú príčinu. Napríklad rýchly celosvetový nárast výskytu MM bol predovšetkým u veľmi tenkých MM (nádory s hrúbkou ≤ 1 mm podľa Breslowovej klasifikácie), ktoré nemajú vplyv na úmrtnosť za to isté obdobie zostávajúcej bez zmeny. Poskytovanie dermatologickej starostlivosti je značne odlišné v Austrálii oproti európskym krajinám, hlavne oproti Veľkej Británii. Dermatológovia a aj praktickí lekári v Austrálii ponúkajú skríning tohto ochorenia prostredníctvom mnohých kampaní v záujme verejného zdravia a v rámci nich je veľké množstvo nádorov odstránených. A práve tieto skríningové kampane viedli k rýchlemu nárastu počtu týchto veľmi tenkých a diagnosticky hraničných MM, čo v podstate zvyšuje celkový výskyt. Napriek tomu, že neexistujú žiadne návrhy pre nerealizovanie skorého záchytu MM, vplyv aktívneho skríningu a kampaní v záujme verejného zdravia na incidenciu MM je evidentný. Epidemiologické údaje týkajúce sa MM podľa Medzinárodnej agentúry pre výskum rakoviny (IARC, WHO) z vybraných európskych krajín za rok 2012 zobrazuje graf 1. V západnej Európe sa eviduje viac ako 70 % novo diagnostikovaných MM s hrúbkou < 1 mm a incidencia tu významne narastá v ostrom kontraste napr. ku Bulharsku a Rumunsku, kde sa približne 25 % novo diagnostikovaných pacientov nachádza už v III. alebo až IV. štádiu ochorenia, zatiaľ čo zachytených MM s hrúbkou < 1 mm je tu < 10 %. Tiež v rámci východoeurópskych krajín (vrátane ČR) je omnoho vyšší trend nárastu incidencie v mestách, kde sú súčasne častejšie diagnostikované tenšie nádory (nádory s hrúbkou ≤ 1 mm podľa Breslowovej klasifikácie). Naproti tomu údaje o mortalite, ktorých zber je menej ovplyvnený vonkajšími faktormi, ukazujú minimálne rozdiely medzi západnou a východnou Európou. Prevažujúci nález MM odstránených počas skríningových kampaní, ktoré môžeme zaradiť medzi veľmi tenké podľa Breslowovej klasifikácie, podporuje tieto výsledky epidemiologických ukazovateľov. Mohlo by to znamenať, že zmeny v správaní voči slnečnému žiareniu (napr. nárast sezónnych dovoleniek pri mori, užívanie solárií) nemusia byť jednou z hlavných príčin zvýšenia výskytu tohto ochorenia. Ďalším argumentom, ktorý oslabuje škodlivý účinok UV žiarenia v súvislosti s MM, je prítomnosť podobného sa správania MM v rámci podobných etnických skupín po celom svete, a to aj napriek rôznej intenzite UV žiarenia. Priemerný vek, v ktorom je ochorenie diagnostikované, je 50 rokov a ten je konštantný vo Veľkej Británii aj v Austrálii. Ak by slnečné žiarenie bolo spúšťačom ochorenia v Austrálii, to by teoreticky mohlo znižovať vek začiatku ochorenia. Avšak v krajinách s vysokou intenzitou UV žiarenia sa so stúpajúcou incidenciou nepreukázalo predpokladané zníženie priemerného veku nástupu ochorenia a ani nedošlo k žiadnym zmenám v najčastejších lokalizáciách MM [52,53]. Vo východoeurópskych krajinách bol nárast výskytu MM zaznamenaný iba v krajinách s dobrou dostupnosťou dermatologického vyšetrenia a kde prebiehali takéto kampane. V ostatných krajinách bola zaznamenaná nižšia incidencia a vyššia hrúbka MM [54,55]. Údaje boli porovnateľné s údajmi vo Veľkej Británii spred 30 rokov. Vplyv skríningu na incidenciu nádorových ochorení bol už v minulosti dobre zdokumentovaný, napr. u rakoviny prsníka a prostaty [56,57].
Graf 1. Incidencia a mortalita malígneho melanómu u oboch pohlaví vo vybraných európskych krajinách. 
Upravené podľa [96]. Incidencia MM na koži intermitentne vystavenej slnečnému žiareniu je signifikantne menej častá u ľudí pracujúcich v exteriéri ako u ľudí pracujúcich v interiéri [58]. Tento poznatok môže znamenať nižšiu pravdepodobnosť spálenia sa u ľudí, ktorí sú častejšie vystavení slnečnému žiareniu, ale alternatívnou hypotézou je aj to, že títo ľudia majú menej pravdepodobne deficienciu vitamínu D. Do úvahy prichádza aj odlišná patogenéza MM, ktoré vznikajú u ľudí s vyšším rizikom aktinického poškodenia kože (kožný fototyp). V roku 2005 bola prezentovaná štúdia, v ktorej sa sledovala prítomnosť elastózy (dermálne post-solárne poškodenie kože) vo vzorkách MM. Výsledky naznačovali, že prítomnosť tohto dermálneho poškodenia kože v excíziach MM znamená pre pacientov lepšiu prognózu [59]. Jedným z vysvetlení tohto zistenia je, že chronické poškodenie slnkom môže spôsobiť menej agresívnu formu MM. Ďalším možným vysvetlením je prítomnosť vyššej hladiny vitamínu D u jedincov vystavených častejšie slnečnému žiareniu, ktorá môže chrániť pred vznikom recidívy, napriek súvislosti UV žiarenia s etiológiou tohto ochorenia [60]. Zaznamenaná bola redukcia poškodenia kože v dôsledku UVA žiarenia účinkom vitamínu D a tiež zníženie UV žiarením indukovanej imunosupresie v štúdiách in vitro, na myšacích modeloch a aj v ľudskej koži [61]. Taktiež boli tieto účinky vitamínu D preukázané aj pri lokálnej aplikácii analógov vitamínu D na ožiarenú kožu [62].
Ak teda predpokladáme, že anti-proliferačný účinok vitamínu D je dôležitý pre modifikáciu vývoja ochorenia pacientov s MM, potom by prognóza týchto pacientov mala byť priaznivejšia v krajinách s vyššou intenzitou slnečného žiarenia ako v krajinách, kde je nižšia. Skutočnosťou je, že vyhliadky pacientov diagnostikovaných v Austrálii sú lepšie ako tých, ktorí boli diagnostikovaní vo Veľkej Británii. Obe skupiny pacientov sú si geneticky podobné, keďže obyvateľstvo Austrálie je z veľkej časti britského pôvodu [63]. Rozsiahla retrospektívna štúdia dát z rokov 1993–2003 porovnávajúca 5-ročné prežívanie pacientov v Yorkshire (n = 4 170) a Novom Južnom Walese (n = 30 520) ukázala relatívne nižšie riziko úmrtia v Novom Južnom Walese. Pripisovalo sa to predovšetkým častejšie sa vyskytujúcim tenším typom nádorov podľa Breslowovej klasifikácie v tejto lokalite, ktoré sú prítomné vďaka detekcii tumoru v skorších štádiách. Austrálsky pacienti mali súčasne aj vyššie priemerné hodnoty vitamínu D [64]. Analýzou dát pacientov len z Veľkej Británie sa preukázalo, že vyššie sérové koncentrácie 25-hydoxyvitamínu D v čase stanovenia diagnózy sa vyskytovali častejšie u tenších typov nádorov. Záverom týchto dvoch štúdii bol poznatok, že rozdiel medzi týmito krajinami spočíval v rozdielnej hrúbke nádorov podľa Breslowa v čase stanovenia diagnózy, pričom táto hrúbka súvisela so sérovou hladinou vitamínu D [63]. Porovnanie týchto dvoch skupín s podobným genetickým pozadím, ale s odlišným životným prostredím je predmetom stále prebiehajúcich vedeckých výskumov venujúcich sa objasneniu okolností vzniku ochorenia MM.
Hodnotenie úrovne vitamínu D
V dôsledku prítomnosti viacerých foriem a ich rôznej sile väzby k VDBP (vitamin D binding protein) je vitamín D zložitým analytom na stanovenie. Za najlepší indikátor úrovne hladiny vitamínu D v ľudskom tele je momentálne doporučený tzv. total vitamín D (25-OHD2 + 25OHD3) v sére pre jeho dlhý polčas – viac ako 250 hod (2–3 týždne) [65]. V prípade posúdenia účinkov vitamínu D na kožné tkanivá sa vychádza z predpokladu, že sérová hodnota odráža produkciu v koži [66]. Podiel stravy ako zdroja vitamínu D stúpa na významne v zimných mesiacoch. Časť kožnej produkcie je uvoľnená do systémovej cirkulácie, ale vždy určitá časť podlieha reakciám vedúcim k vzniku aktívnej formy vitamínu D priamo v kožnom tkanive. Na základe tohto vzťahu sa predpokladá, že sérová hladina je obrazom predovšetkým kožnej tvorby vitamínu D v miestach vystavených UV žiareniu, a teda aj lokálnej kožnej tvorby aktívnej formy.
Čo sa týka pacientov so stanovenou diagnózou MM alebo rizikovej skupiny pre toto ochorenie, v súčasnosti nemáme definitívne určenú optimálnu sérovú hladinu vitamínu D [67]. Field a Newton-Bishop navrhli hodnotu medzi 70 a 100 nmol/l (28–40 ng/ml; nmol/l × 0,40 = ng/ml) pre pacientov s už stanovenou diagnózou, pretože štúdie ukazujú, že vyššia sérová hladina vitamínu D môže vo všeobecnosti ovplyvniť proliferáciu nádorových buniek. V prospektívnej kohortovej štúdii realizovanej na 872 pacientoch sa vyššie sérové hodnoty vitamínu D v čase stanovenia diagnózy spájali s nižšou hodnotou v Breslowovej klasifikácii hrúbky MM [4]. Taktiež sa objavili výsledky, ktoré ukazovali nižšie riziko relapsu MM u pacientov cielene suplementovaných vitamínom D oproti kontrolnej skupine [8]. Navyše progresia tohto ochorenia sa spája so štatisticky významným znížením sérovej hladiny vitamínu D [68].
Nürnberg et al vo svojej štúdii sledovali sérovú hladinu celkového vitamínu D (total vitamín D) u pacientov s diagnózou MM a zaznamenali signifikantné zníženie u pacientov v IV. štádiu MM v porovnaní s pacientmi v I. štádiu, pričom pacienti s hodnotou < 10 ng/ml mali tendenciu mať skôr vzdialené metastázy v porovnaní s pacientmi s hodnotou > 20 ng/ml. Keďže prezentované sérové hladiny vitamínu D sú pravdepodobne obrazom stavu pred skorým vývojom MM a počas neho, zdá sa, že vitamín D by mohol inhibovať lokálnu inváziu a mikrometastázovanie počas skorej tumorogenézy MM.
Terapia vitamínom D u MM – potenciálna adjuvantná terapia
Donedávna sa odporúčané dávky vitamínu D týkali účinkov, ktoré má na kosti a metabolizmus vápnika a fosforu. V súčasnosti sa na základe metaanalýz stanovujú aj možné dávky a doporučené hodnoty pre pacientov trpiacich alebo vystavených riziku vzniku rakoviny [69]. Odhadovaná minimálna sérová hladina 25 (OH) D pre prevenciu nádorových ochorení ≥ 30 ng/ml bola stanovená už pred vyše 10 rokmi na sympóziu venovanom vitamínu D a rakovine realizovanom za podpory Národného inštitútu zdravia v USA (National Institute of Health – NIH), ktorý sa radí medzi popredné svetové výskumné centrá [70,71]. Otázka dávky je stále diskutovanou témou [69]. Predpokladá sa, že meranie a možno v budúcnosti aj zmierňovanie (modulácia) zápalových reakcií prostredníctvom vitamínu D a iných metód môže byť dôležitý spôsob, ktorým by sa mohla zvýšiť miera odpovede na imunoterapiu a iné liečby MM, prípadne aj iných druhov rakoviny [72].
K teoretickým možnostiam liečby MM vitamínom D patrí indukcia tvorby UV žiarením, lokálna aplikácia a celkové, čiže perorálne podanie vo forme suplementov. Špecifické potravinové zdroje limitujú takmer úplne prirodzenú alimentárnu formu [73]. V prípade prvej možnosti sa zároveň uskutoční aj kožná syntéza aktívnej formy vitamínu D a jeho účinky sú v tomto prípade najviac komplexné. Stále zostáva nezodpovedaná otázka optimálnej časovej dĺžky expozície UV žiarenia, ktorá by minimalizovala poškodenie DNA a znamenala maximálny benefit v podobe syntézy vitamínu D. Vzhľadom na to je stále považované za najbezpečnejšie perorálne užívanie, od ktorého možno však očakávať aj systémové účinky [74]. Je známe, že deficiencia vitamínu D je bežnejšia v pokročilom štádiu MM a koreluje s nepriaznivou prognózou [75,68]. Nedávna retrospektívna štúdia [76] zaznamenala účinky podávaného vitamínu D práve u pacientov s metastázujúcim MM a ukázala obzvlášť zaujímavé výsledky. Skupine pacientov s počiatočne deficientnou sérovou hladinou 25 (OH) D3 (< 20 ng/ml) bola podávaná dávka 50 000 IU v týždňových intervaloch po dobu 8 týždňov a následne dávka 4 000 IU týždenne. U pacientov, u ktorých došlo k nárastu hladiny vitamínu D > 20 ng/ml, sa zaznamenala lepšia prognóza a dokonca podobne aj u pacientov s dobrou počiatočnou hladinou vitamínu D, ktorí mali aj v neskoršom meraní hladinu vitamínu D > 20 ng/ml. Horšiu prognózu mali pacienti, ktorí mali hladiny vitamínu D v oboch meraniach deficientné, ale aj s počiatočne dostatočnou a v neskoršom meraní s hladinou vitamínu D < 20 ng/ml. Závery tejto štúdie naznačujú, že počiatočná deficiencia vitamínu D ako aj nedostatočné dopĺňanie predpovedajú horšiu prognózu u pacientov s MM. Ďalšia nedávna štúdia tiež ukázala, že zmena v hladine vitamínu D vrátane veľkých vzrastov aj poklesov bola nezávislým markerom u pacientov s MM [77]. Protinádorové účinky vitamínu D3 slúžili aj ako zdôvodnenie pre pokračovanie austrálskej klinickej štúdie ANZMTG (Australia and New Zeland Melanoma Trials Group) 02.09 Mel-D, ktorá hodnotila využitie vitamínu D ako adjuvans pre pacientov s vysokým rizikom rekurencie MM [78]. Táto placebom kontrolovaná randomizovaná štúdia v aktuálne prebiehajúcej fáze II sleduje bezpečnosť a možnú toxicitu veľkej orálnej dávky vitamínu D (500 000 IU) podanej po pravidelnej mesačnej dávke 50 000 IU užívanej počas 2 rokov pacientmi, ktorí podstúpili chirurgické odstránenie primárneho kožného MM. Zistenia tejto štúdie by mali byť prínosom pre možné použitie vitamínu D podávaného orálne v liečbe tohto ťažko liečiteľného nádorového ochorenia.
Dopĺňaním vitamínu D v štandardnej dennej dávke 25 alebo 50 µg (1 000 alebo 2 000 IU) dôjde k dosiahnutiu stabilnej hladiny koncentrácie vitamínu D približne po 3 mesiacoch [79], pričom sa vie, že denné podávanie liečiv je problematické, čo sa týka dodržiavania [80]. Podanie jednorázovej vysokej dávky s cieľom čo najskôr dosiahnúť nárast sérovej koncentrácie vitamínu D so sebou nesie aj riziko vzniku nežiadúcich následkov. Intoxikácia vitamínom D je vo všeobecnosti extrémne zriedkavá a môže byť zapríčinená neúmyselným alebo úmyselným požitím príliš vysokých dávok. Bola pozorovaná pri sérových hladinách 25 (OH) D > 150 ng/ml (374 nmol/l). Dávky vitamínu D > 50 000 IU/d zvyšujú hladinu 25 (OH) D na > 150 ng/ml (374 nmol/l) a sú v literatúre spojené s hyperkalcémiou a hyperfosfatémiou. Za najnižšie hodnoty spôsobujúce už nežiadúce účinky (lowest observed adverse effect level – LOAL) sú považované v publikovaných prácach o toxicite vitamínu D s presvedčivými dôkazmi hyperkalcémie sérové koncentrácie 25 (OH) D > 200 nmol/l, čo si vyžaduje denný príjem > 40 000 IU [81,82,83]. Bacon et al vo svojej štúdii navrhli dávkovací protokol s počiatočnou dávkou vitamínu D 12,5 mg (500 000 IU) vitamínu D3 nasledovanou mesačným podávaním dávky 1,25 mg (50 000 IU) ako spôsobu pre skoré dosiahnutie nárastu sérovej hladiny vitamínu D s dobrou udržateľnosťou bez zapríčinenia hyperkalcémie [84]. Napriek tomu, že sa primeraná suplementácia samotným vitamínom D považuje za všeobecne bezpečnú, hľadajú sa aj analógy, ktoré by vykazovali podobné účinky ako podávanie vitamínu D vo vysokých dávkach a za súčasnej minimalizácie výskytu nežiadúcich účinkov. Nižšiu hyperkalcemickú aktivitu vykazujú analógy vitamínu D s krátkym postranným reťazcom alebo úplne bez neho [85,86]. Tieto analógy preukázali účinnejšiu inhibíciu proliferácie buniek MM v porovnaní s normálnymi keratinocytmi a melanocytmi [87].
Pre verifikáciu vyššie uvedených výsledkov klinických štúdii sa opakovane odporúča vykonať sledovanie suplementovaných pacientov v omnoho širšom meradle [69,76]. Podľa NIH je aktuálne zaevidovaných 142 prebiehajúcich klinických štúdii sledujúcich súvislosť medzi vitamínom D a nádorovými ochoreniami, avšak iba dve sú zamerané na MM (NCT01264874 [88], NCT01748448 [89]). Súdiac podľa rastúceho záujmu o vitamín D a jeho deriváty sa predpovedá výbuch animálnych, predklinických a klinických štúdii zacielených na ich využitie ako potenciálnych antimelanómových faktorov. Samotnej liečbe založenej na vitamíne D by v budúcnosti mohla predchádzať analýza signálnej cesty, čiže napr. VDR expresie a polymorfizmov, a táto analýza by sa mohla stať dôležitým prognostickým faktorom pred začatím liečby vitamínom D a jeho analógmi [90].
V najnovších prácach už nachádzame odporúčanie pre adjuvantnú liečbu vitamínom D v III. a IV. štádiu ochorenia MM súčasne s akoukoľvek onkologickou liečbou. Vychádzajú z dôkazov o častejšom výskyte pokročilých štádií ochorenia a progresie ochorenia u pacientov s deficitom vitamínu D. V I. a II. štádiu ochorenia doporučujú profylaktické užívanie veľmi vysokých dávok vitamínu D (50 000–100 000 IU denne) pri nízkej hladine vitamínu D (30 ng/ml). Po dosiahnutí sérovej hladiny medzi 50–100 ng/ml sa dávka znižuje na 4 000–6 000 IU, pričom sú súčasne sledované aj hladiny sérového vápnika. Tento postup by mohol byť obzvlášť prospešný pre pacientov s vysokým rizikom vzniku metastáz (mitoticky aktívne MM vo vertikálnej rastovej fáze, ktoré sú relatívne hrubé, alebo je súčasne pozitívna biopsia sentinelovej uzliny) [91].
Na objasnenie vzťahov medzi vitamínom D a MM je potrebné dôkladnejšie porozumieť komplexným a pleiotropným účinkom vitamínu D na živé bunky. Je zrejmé, že hladina 25-hydroxyvitamínu D v sére nie je v žiadnom prípade jediným determinantom povahy a veľkosti aktivity vitamínu D. Väzbový proteín vitamínu D, polymorfizmus receptora vitamínu D, užívanie vápnika, renálna aktivácia vitamínu D a ďalšie zložky signálnej cesty vitamínu D a metabolizmu tiež ovplyvňujú jeho účinky a zasluhujú si ďalšie štúdium možnej úlohy vitamínu D pri vzniku a progresii MM, a preto je potrebné brať do úvahy aj názor, že plošná suplementácia vitamínom D v praxi je zatiaľ ešte stále predčasná [92].
Záver
V súčasnosti sa na vitamín D nahliada ako na steroidný hormón rozpustný v tukoch, ktorého genómové účinky sú sprostredkované po naviazaní sa na špecifický receptor. K potvrdeným účinkom vitamínu D dnes okrem uchovania zdravých kostí (tzv. klasické účinky) radíme aj tzv. neklasické, pleiotropné účinky. Tieto neklasické účinky sú aktuálne sledované u autoimunitných a kardiovaskulárnych ochorení, precitlivenosti voči infekciám, pri vzniku nádorový ochorení, ale aj v súvislosti s priebehom fyziologického starnutia [93]. Ich uplatnenie u MM je omnoho kontroverznejšie. Dôvodom je predovšetkým schopnosť kožnej samotvorby aktívnej formy vitamínu D (1,25 (OH) 2D3) keratinocytmi a jeho lokálne parakrinné účinky na okolité bunky, a teda aj melanocyty alebo bunky MM. Epidemiologické štúdie opakovane poukazujú na vzťah medzi slnečným žiarením a rizikom vzniku MM, avšak povaha tohto vzťahu je zložitejšia. Klasický vzťah dávky a rizika – čím vyššia dávka, tým vyššie riziko – tu ale neplatí. Dominantným rizikovým faktorom je spálenie a nie kumulatívna slnečná expozícia. Proces spálenia pravdepodobne spôsobuje potlačenie imunitných reakcií, čo sa následne podieľa na priebehu kancerogenézy u MM.
Doterajšie uskutočnené predklinické a klinické štúdie potvrdili schopnosť vitamínu D ovplyvniť proces kancerogenézy aj u MM, kde pravdepodobne zasahuje do invazívnosti a schopnosti nádoru tvoriť metastázy. Navrhovanou optimálnou sérovou hladinou 25 (OH) D pre pacientov so stanovenou diagnózou MM je hodnota medzi 70–100 nmol/l (28–40 ng/ml), pretože vyššie sérové hladiny vitamínu D boli zaznamenané u pacientov s tenšími typmi MM a taktiež ich nález v čase stanovenia diagnózy súvisel s lepšou prognózou a nižším rizikom relapsu. Z týchto dôvodov sa na základe výsledkov súčasných štúdii odporúčajú vyššie sérové hladiny a k ich dosiahnutiu v I. a II. štádiu tohto ochorenia je potrebné užitie veľmi vysokých dávok vitamínu D (50 000–100 000 IU denne) za súčasnej kontroly metabolizmu vápnika a hladiny vitamínu D a následne po dosiahnutí sérovej hladiny medzi 50–100 ng/ml je možné dávku znížiť na 4 000–6 000 IU. Suplementácia vitamínom D je doporučená aj v pokročilejších štádiách ochorenia. Pre úplnú verifikáciu týchto predbežných doporučení prebieha aj v súčasnosti niekoľko vyššie spomenutých prospektívnych štúdií. Každopádne sa dnes vo všeobecnosti odporúča u onkologických pacientov stanovovať hodnotu vitamínu D a v prípade zistenia jeho nedostatku ho dopĺňať za súčasnej kontroly. Pravdepodobne ďalšie závery ešte neukončených prebiehajúcich výskumov nám rozšíria poznatky o možnostiach využitia vitamínu D ako adjuvantnej liečby pre pacientov s MM a podrobnejšie zhodnotia očakávania spočívajúce v znížení nádorovej invazívnosti a mikrometastázovania, a tým v znížení rizika recidívy a zlepšení prognózy aj u týchto onkologických pacientov.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Beáta Bolerázska
Ústav lekárskej a klinickej biochémie LF UPJŠ v Košiciach
Trieda SNP 1
040 01 Košice
Slovenská republika
e-mail: beata@moly.sk
Obdržané: 7. 10. 2016
Prijaté: 26. 7. 2017
Zdroje
1. Garbe C, Peris K, Hauschild A et al. Diagnosis and treatment of melanoma: European consensus-based interdisciplinary guideline. Eur J Cancer 2010; 46 (2): 270–283. doi: 10.1016/j.ejca.2009.10.032.
2. Tomíška M, Novotná Š, Klvačová L et al. Vitamin D during cancer treatment. Klin Onkol 2015; 28 (2): 99–104. doi: 10.14735/amko201599.
3. Jacobs ET, Kohler LN, Kunihiro AG et al. Vitamin D and Colorectal, Breast, and Prostate Cancers: A Review of the Epidemiological Evidence. J Cancer 2016; 7 (3): 232–240. doi: 10.7150/jca.13403.
4. Newton-Bishop JA, Beswick S, Randerson-Moor J et al. Serum 25-hydroxyvitamin D3 levels are associated with breslow thickness at presentation and survival from melanoma. J Clin Oncol 2009; 27 (32): 5439–5444. doi: 10.1200/JCO.2009.22.1135.
5. Wyatt C, Lucas RM, Hurst C et al. Vitamin D deficiency at melanoma diagnosis is associated with higher Breslow thickness. PLoS One 2015; 10 (5): e0126394. doi: 10.1371/journal.pone.0126394.
6. Slominski AT, Brozyna A, Jozwicki W et al. Vitamin D as an adjuvant in melanoma therapy. Melanoma Manag 2015; 2 (1): 1–4. doi: 10.2217/mmt.14.36.
7. Nelemans PJ, Groenendal H, Kiemeney LA et al. Effect of intermittent exposure to sunlight on melanoma risk among indoor workers and sun-sensitive individuals. Environ Health Perspect 1993; 101 (3): 252–255.
8. Gandini S, Raimondi S, Gnagnarella P et al. Vitamin D and skin cancer: a meta-analysis. Eur J Cancer 2009; 45 (4): 634–641. doi: 10.1016/j.ejca.2008.10.003.
9. Newton-Bishop JA, Chang, YM, Elliott F et al. Relationship between sun exposure and melanoma risk for tumours in different body sites in a large case-control study in a temperate climate. Eur J Cancer 2011; 47 (5): 732–741. doi: 10.1016/j.ejca.2010.10.008.
10. Bataille V, de Vries E. Melanoma – part 1: epidemiology, risk factors, and prevention. BMJ 2008; 337: a2249. doi: 10.1136/bmj.a2249.
11. Brożyna AA, Jozwicki W, Janjetovic Z et al. Expression of vitamin D receptor decreases during progression of pigmented skin lessions. Hum Pathol 2011; 42 (5): 618–631. doi: 10.1016/j.humpath.2010.09.014.
12. MacLennand R, Kelly JW, Rivers JK et al. The Eastern Australian Childhood Naevus Study: site differences in density and size of melanocytic nevi in relation to latitude and phenotype. J Am Acad Dermatol 2003; 48 : 367–375. doi: 10.1067/mjd.2003.30.
13. Larue L, de Vuyst F, Delmas V. Modeling melanoblast development. Cell Mol Life Sci 2013; 70 (6): 1067–1079. doi: 10.1007/s00018-012-1112-4.
14. Bulliard JD, De Weck D, Fisch T et al. Detailed distribution of melanoma and sunlight exposure: aetiological patterns from a Swiss series. Ann Oncol 2007; 18 : 789–794. doi: 10.1093/annonc/mdl490.
15. Joosse A, de Vries E, Eckel R et al. Gender differences in melanoma survival: female patients have a decreased risk of metastasis. J Invest Dermatol 2011; 131 (3): 719–726. doi: 10.1038/jid.2010.354.
16. O’Hara C, Birch J, McCabe M et al. Gender differences in survival among teenagers and young adults with CNS tumours. Cancer Outcomes Conference. [online]. Available from: www.ncin.org.uk/conference.
17. Lehmann B, Rudolph T, Pietzsch J et al. Conversion of vitamin D3 to 1alpha, 25-dihydroxyvitamin D3 in human skin equivalents. Exp Dermatol 2000; 9 (2): 97–103.
18. Morris HA, Anderson PH. Autocrine and paracrine actions of vitamin D. Clin Biochem Rev 2010; 31 (4): 129–138.
19. Seifert M, Rech M, Meineke V et al. Differential biological effects of 1,25-dihydroxyvitamin D3 on melanoma cell lines in vitro. J Steroid Biochem Mol Biol 2004; 89–90 (1–5): 375–379. doi: 10.1016/j.jsbmb.2004.03.002.
20. Colston K, Colston MJ, Feldman D. 1,25-dihydroxyvita-min D3 and malignant melanoma: the presence of receptors and inhibition of cell growth in culture. Endocrinology 1981; 108 (3): 1083–1086. doi: 10.1210/endo-108-3-1083.
21. Norman AW. Minireview: vitamin D receptor: new assignments for an already busy receptor. Endocrinology 2006; 147 : 5542–5448. doi: 10.1210/en.2006-0946.
22. Brozyna A, Zbytek B, Granese J et al. Mechanism of UV-related carcinogenesis and its contribution to nevi/melanoma. Expert Rev Dermatol 2007; 2 (4): 451–469.
23. Haussler MR, Jurutka PW, Mizwicki M et al. Vitamin D receptor (VDR) -mediated actions of 1α,25 (OH) 2vitamin D3: Genomic and non-genomic mechanisms. Best Pract Res Clin Endocrinol Metab 2011; 25 : 543–559. doi: 10.1016/j.beem.2011.05.010.
24. Szyszka P, Zmijewski MA, Slominski AT. New vitamin D analogs as potential therapeutics in melanoma. Expert Rev Anticancer Ther 2012; 12 (5): 585–599. doi: 10.1586/era.12.40.
25. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357 (3): 266–281. doi: 10.1056/NEJMra070553.
26. Jensen SS, Madsen MW, Lukas J et al. Inhibitory effects of 1alpha, 25-dihydroxyvitamin D (3) on the G (1) -S phase-controlling machinery. Mol Endocrinol 2001; 15 : 1370–1380. doi: 10.1210/mend.15.8.0673.
27. Jiang F, Li P, Fornace AJ Jr et al. G2/M arrest by 1,25-di-hydroxyvitamin D3 in ovarian cancer cells mediated through the induction of GADD45 via an exonic enhancer. J Biol Chem 2003; 278 (48): 48030–48040. doi: 10.1074/jbc.M308430200.
28. Blutt SE, McDonnell TJ, Polek TC et al. Calcitriol-induced apoptosis in LNCaP cells is blocked by overexpression of Bcl-2. Endocrinology 2000; 141 (1): 10–17. doi: 10.1210/endo.141.1.7289.
29. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol 2014; 21 (3): 319–329. doi: 10.1016/j.chembiol.2013.12.016.
30. Høyer–Hansen M, Bastholm L, Mathiasen IS et al. Vitamin D analog EB1089 triggers dramatic lysosomal changes and Beclin 1-mediated autophagic cell death. Cell Death Differ 2005; 12 (10): 1297–1309. doi: 10.1038/sj.cdd.4401651.
31. James SY, Mackay AG, Colston KW. Effects of 1,25 dihydroxyvitamin D3 and its analogues on induction of apoptosis in breast cancer cells. J Steroid Biochem Mol Biol 1996; 58 (4): 395–401. doi: 10.1016/0960-0760 (96) 00048-9.
32. Diaz GD, Paraskeva C, Thomas MG et al. Apoptosis is induced by the active metabolite of vitamin D3 and its analogue EB1089 in colorectal adenoma and carcinoma cells: possible implications for prevention and therapy. Cancer Res 2000; 60 (8): 2304–2312.
33. Kumagai T, Shih LY, Hughes SV et al. 19-Nor-l,25 (OH) 2D2 (a novel, noncalcemic vitamin D analogue), combined with arsenic trioxide, has potent antitumor activity against myeloid leukemia. Cancer Res 2005; 65 (6): 2488–2497. doi: 10.1158/0008-5472.CAN-04-2800.
34. Fridman JS, Lowe SW. Control of apoptosis by p53. Oncogene 2003; 22 (56): 9030–9040. doi: 10.1038/sj.onc.1207116.
35. Chakraborti CK. Vitamin D as a promising anticancer agent. Indian J Pharmacol 2011; 43 (2): 113–120. doi: 10.4103/0253-7613.77335.
36. Gupta R, Dixon KM, Deo SS et al. Photoprotection by 1,25 dihydroxyvitamin D3 is associated with an increase in p53 and a decreasein nitric oxide products. J Invest Dermatol 2007; 127 (3): 707–715. doi: 10.1038/sj.jid.5700597.
37. Kundu JK, Surh YJ. Inflammation: gearing the journey to cancer. Mutat Res 2008; 659 (1–2): 15–30. doi: 10.1016/j.mrrev.2008.03.002.
38. Mantell DJ, Owens PE, Bundred NJ et al. 1 alpha, 25-dihydroxyvitamin D (3) inhibits angiogenesis in vitro and in vivo. Circ Res 2000; 87 (3): 214–220. doi: 10.1161/01.RES.87.3.214.
39. Ben-Shoshan M, Amir S, Dang DT et al. 1 alpha, 25-dihydroxyvitamin D3 (calcitriol) inhibits hypoxia-inducible factor-1/vascular endothelial growth factor pathway in human cancer cells. Mol Cancer Ther 2007; 6 (4): 1433–1439. doi: 10.1158/1535-7163.MCT-06-0677.
40. Moreno J, Krishnan AV, Swami S et al. Regulation of prostaglandin metabolism by calcitriol attenuates growth stimulation in prostate cancer cells. Cancer Res 2005; 65 (17): 7917–7925. doi: 10.1158/0008-5472.CAN-05-1435.
41. Mantovani A, Allavena P, Sica A et al. Cancer-related inflammation. Nature 2008; 454 (7203): 436–444. doi: 0.1038/nature07205.
42. Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer. Mol Cancer 2013; 12 : 86. doi: 10.1186/1476-4598-12-86.
43. Cohen-Lahav M, Shany S, Tobvin D et al. Vitamin D decreases NFkappaB activity by increasing IkappaBalpha levels. Nephrol Dial Transplant 2006; 21 (4): 889–897. doi: 10.1093/ndt/gfi254.
44. Madonna G, Ullman CD, Gentilcore G et al. NF-κB as potential target in the treatment of melanoma. J Transl Med 2012; 10 : 53. doi: 10.1186/1479-5876-10-53.
45. Villanueva J, Herlyn M. Melanoma and the tumor microenvironment. Curr Oncol Rep 2008; 10 (5): 439–446.
46. Kodet O, Lacina L, Krejčí E et al. Melanoma cells influence the differentiation pattern of human epidermal keratinocytes. Mol Cancer 2015; 14 : 1. doi: 10.1186/1476-4598-14-1.
47. Reichrath J, Rech M, Moeini M et al. In vitro comparison of the vitamin D endocrine system in 1,25 (OH) 2D3-responsive and -resistant melanoma cells. Cancer Biol Ther 2007; 6 (1): 48–55.
48. Osborne JE, Hutchinson PE. Vitamin D and systemic cancer: is this relevant to malignant melanoma? Br J Dermatol 2002; 147 (2): 197–213. doi: 10.1046/j.1365-2133.2002.04960.x.
49. Eisman JA, Barkla DH, Tutton PJ. Suppression of in vivo growth of human cancer solid tumor xenografts by 1,25-dihydroxyvitamin D3. Cancer Res 1987; 47 (1): 21–25.
50. Pawlowska E, Wysokinski D, Blasiak J. Nucleotide Excision Repair and Vitamin D-Relevance for Skin Cancer Therapy. Int J Mol Sci 2016; 17 (4): 372. doi: 10.3390/ijms17040372.
51. Dixon KM, Deo SS, Wong G et al. Skin cancer prevention: a possible role of 1,25dihydroxyvitamin D3 and its analogs. J Steroid Biochem Mol Biol 2005; 97 (1–2): 137–143. doi: 10.1016/j.jsbmb.2005.06.006.
52. Bataille V, Grulich A, Sasieni P et al. The association between naevi and melanoma in populations with different sun exposure: a joint case-control study of melanoma in the UK and Australia. Br J Cancer 1998; 77 (3): 505–510.
53. Erdei E, Torres SM. A new understanding in the epidemiology of melanoma. Expert Rev Anticancer Ther 2010; 10 (11): 1811–1823. doi: 10.1586/era.10.170.
54. Garbe C, Leiter U. Melanoma epidemiology and trends. Clin Dermatol 2009; 27 : 3–9. doi: 10.1016/j.clindermatol.2008.09.001.
55. Welch HG, Black WC. Overdiagnosis in cancer. J Natl Cancer Inst 2010; 102 (9): 605–613. doi: 10.1093/jnci/djq099.
56. Bleyer A, Welch HG. Effectof three decades of screening mammography on breast-cancer incidence. N Engl J Med 2012; 367 (21): 1998–2005. doi: 10.1056/NEJMoa1206809.
57. Esserman L, Shieh Y, Thompson I. Rethinking Screening for Breast Cancer and Prostate Cancer JAMA 2009; 302 (15): 1685–1692. doi: 10.1001/jama.2009. 1498.
58. Godar DE, Landry RJ, Lucas AD: Increases UVA exposures and decreases cutaneous Vitamin D (3) may be responsible for the increasing incidence of melanoma. Med Hypotheses 2009; 72 (4): 434–443. doi: 10.1016/j.mehy.2008.09.056.
59. Berwick M, Armstrong BK, Ben-Porat L et al. Sun exposure and mortality from melanoma. J Natl Cancer Inst 2005; 97 (3): 195–199. doi: 10.1093/jnci/dji019.
60. Field S, Newton-Bishop JA. Melanoma and vitamin D. Mol Oncol 2011; 5 (2): 197–214. doi: 10.1016/j.molonc.2011.01.007.
61. Mason RS, Sequeira VB, Dixon KM et al. Photoprotection by 1 alpha,25-dihydroxyvitamin D and analogs: further studies on mechanisms andimplications for UV-damage. J Steroid Biochem Mol Biol 2010; 121 (1–2): 164–168. doi: 10.1016/j.jsbmb.2010.03.082.
62. Damian DL, Kim YJ, Dixon KM et al. Topical calcitriol protects from UV-induced genetic damage but sup-presses cutaneous immunity in humans. Exp Dermatol 2010; 19 (8): e23–e30. doi: 10.1111/j.1600-0625.2009. 00955.x.
63. Bishop DT, Demenais F, Iles MM et al. Genome-wide association study identifies three loci associated with melanoma risk. Nat Genet 2009; 41 (8): 920–925. doi: 10.1038/ng.411.
64. Downing, A, Yu XQ, Newton-Bishop JA et al. Trends in prognostic factors and survival from cutaneous melanoma in Yorkshire, UK and New South Wales, Australia between 1993 and 2003. Int J Cancer 2008; 123 (4): 861–866. doi: 10.1002/ijc.23495.
65. de Luca HF. Evolution of our understanding of vitamin D. Nutr Rev 2008; 66 (10 Suppl 2), 73–87. doi: 10.1111/j.1753-4887.2008.00105.x.
66. Webb AR, DeCosta BR, Holick MF. Sunlight regulates the cutaneous production of vitamin D3 by causing its photodegradation. J Clin Endocrinol Metab 1989; 68 (5): 882–887. doi: 10.1210/jcem-68-5-882.
67. Tang JY, Fu T, Lau C et al. Vitamin D in cutaneous carcinogenesis: part II. J Am Acad Dermatol 2012; 67 (5): 817.e1–e11; quiz 827–828. doi: 10.1016/j.jaad.2012.07.022.
68. Nürnberg B, Gräber S, Gärtner B et al. Reduced serum 25-hydroxyvitamin D levels in stage IV melanoma patients. Anticancer Res 2009; 29 (9): 3669–3674.
69. Gandini S, Francesco F, Johanson H et al. Why vitamin D for cancer patients? Ecancermedicalscience 2009; 3 : 160. doi: 10.3332/ecancer.2009.160.
70. Gorham ED, Garland CF, Garland FC, et al. Vitamin D and prevention of colorectal cancer. J Steroid Biochem Mol Biol 2005; 97 (1–2): 179–194. doi: 10.1016/j.jsbmb.2005.06.018.
71. Bischoff-Ferrari HA, Giovannucci E, Willett WC et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr 2006; 84 (1): 18–28.
72. Coyne health care. Vitamin D: A New Intervention for Melanoma? [online]. Available from: https: //coynehealthcare.co.za/vitamin-d-a-new-intervention-for-melanoma/.
73. Flynn A, Hirvonen T, Mensink GB et al. Intake of selected nutrients from foods, from fortification and from supplements in various European countries. Food Nutr Res 2009; 53. doi: 10.3402/fnr.v53i0.2038.
74. Balvers MG, Brouwer-Brolsma EM, Endenburg S et al. Recommended intakes of vitamin D to optimise health, associated circulating 25-hydroxyvitamin D concentrations, and dosing regimens to treat deficiency: workshop report and overview of current literature. J Nutr Sci 2015; 4: e23. doi: 10.1017/jns.2015.10.
75. Bade B, Zdebik A, Wagenpfeil S et al. Low serum 25-hydroxyvitamin D concentrations are associated with increased risk for melanoma and unfavourable prognosis. PloS One 2014; 9: e112863. doi: 10.1371/journal.pone.0112863.
76. Timerman D, McEnery-Stonelake M, Joyce CJ et al. Vitamin D deficiency is associated with a worse prognosis in metastatic melanoma, Oncotarget 2017; 8 (4): 6873–6882. doi: 10.18632/oncotarget.14316.
77. Saiag P, Aegerter P, Vitoux D et al. Prognostic Value of 25-hydroxyvitamin D3 Levels at Diagnosis and During Follow-up in Melanoma Patients. J Natl Cancer Inst 2015 : 107 (12). djv264. doi: 10.1093/jnci/djv264.
78. Saw RP, Armstrong BK, Mason RS et al. Adjuvant therapy with high dose vitamin D following primary treatment of melanoma at high risk of recurrence: a placebo controlled randomised phase II trial (ANZMTG 02.09 Mel-D). BMC Cancer 2014; 14 : 780. doi: 10.1186/1471-2407-14-780.
79. Heaney RP, Davies KM, Chen TC et al. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr 2003; 77 (1): 204–210.
80. Sambrook P. Vitamin D and fractures: quo vadis? Lancet 2005; 365 (9471): 1599–1600. doi: 10.1016/S0140-6736 (05) 66385-4.
81. Adams JS, Lee G. Gains in bone mineral density with resolution of vitamin D intoxication. Ann Intern Med 1997; 127 (3): 203–206. doi: 10.7326/0003-4819-127-3-199708010-00004.
82. Koutkia P, Chen TC, Holick MF. Vitamin D intoxication associated with an over-the-counter supplement. N Engl J Med 2001; 345 (1): 66–67. doi: 10.1056/NEJM200107053450114.
83. Hathcock JN, Shao A, Vieth R et al. Risk assessment for vitamin D. Am J Clin Nutr 2007; 85 (1): 6–18.
84. Bacon CJ, Gamble GD, Horne AM et al. High-dose oral vitamin D3 supplementation in the elderly. Osteoporos Int 2009; 20 (8): 1407–1415. doi: 10.1007/s00198-008-0814-9.
85. Plum LA, Prahl JM, Ma X et al. Biologically active noncalcemic analogs of 1alpha, 25dihydroxyvitamin D with an abbreviated side chain containing no hydroxyl. Proc Natl Acad Sci U S A 2004; 101 (18): 6900–6904. doi: 10.1073/pnas.0401656101.
86. Holick MF, Garabedian M, Schnoes HK et al. Relationship of 25-hydroxyvitamin D3 side chain structure to biological activity. J Biol Chem 1975; 250 (1): 226–230.
87. Zmijewski MA, Li W, Chen J et al. Synthesis and photochemical transformation of 3β,21-dihydroxypregna-5,7-dien-20-one to novel secosteroids that show anti-melanoma activity. Steroids 2011; 76 (1–2): 193–203. doi: 10.1016/j.steroids.2010.10.009.
88. ClinicalTrials.gov. MelaViD: A Trial on Vitamin D Supplementation for Resected Stage II Melanoma Patients. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01264874.
89. ClinicalTrials.gov. Vitamin D Supplementation in Cutaneous Malignant Melanoma Outcome (ViDMe). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01748448.
90. Szyszka P, Zmijewski MA, Slominski AT. New vitamin D analogs as potential therapeutics in melanoma. Expert Rev Anticancer Ther 2012; 12 (5): 585–599. doi: 10.1586/era.12.40.
91. Slominski AT, Brozyna A, Jozwicki W et al. Vitamin D as an adjuvant in melanoma therapy. Melanoma Manag 2015; 2 (1): 1–4. doi: 10.2217/mmt.14.36.
92. Sondak VK, McIver B, Kanetsky PA. Vitamin D and Melanoma: What Do We Tell Our Patients? J Clin Oncol 2016; 34 (15): 1713–1714. doi: 10.1200/JCO.2016.66.5240.
93. Kubešová Matějovská H, Tůmová J, Polcarová V et al. Vitamin D – remarks of known and overwiev of new facts. Vnitr Lek 2012; 58 (3): 196–201.
94. Vidailhet M, Mallet E, Bocquet A et al. Vitamin D: still a topical matter in children and adolescents. A position paper by the Committee on Nutrition of the French Society of Paediatrics. Arch Pediatr 2012; 19 (3): 316–328. doi: 10.1016/j.arcped.2011.12.015.
95. Erdei E, Torres SM. A new understanding in the epidemiology of melanoma. Expert Rev Anticancer Ther 2010; 10 (11): 1811–1823. doi: 10.1586/era.10.170.
96. 99. EUCAN/WHO. Malignant melanoma of skin: Estimated incidence, mortality and prevalence of both sexes. [online]. Available from: http: //eco.iarc.fr/eucan/Cancer.aspx?Cancer=20.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Soutěž o nejlepší práciČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Odmítnutí léčby v dětské onkologii
- Soutěž o nejlepší práci
- Potenciál vitamínu D v adjuvantnej liečbe malígneho melanómu kože
- Kontroverze v pooperační léčbě low-grade gliomů
- Postavení chemoterapie v pooperační léčbě low-grade gliomů
- Hodnocení klinického benefitu protinádorových léků limitovaných na komplexní onkologická centra podle metodiky ESMO-MCBS
- Mutace isocitrátdehydrogenázy jsou lepší prognostický marker než metylace promotoru O6-metylguanin-DNA-metyltransferázy u glioblastomů – retrospektivní molekulárně genetická studie gliomů z jednoho centra
- Anti-apoptotický mechanizmus metforminu proti apoptóze indukované ionizujícím zářením v mononukleárních buňkách lidské periferní krve
- Odmietnutie liečby v detskej onkológii
- Informace z České onkologické společnosti
- Aktuality z odborného tisku
- Vznik postradiační reakce a její preventivní ošetřování během radioterapie
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vznik postradiační reakce a její preventivní ošetřování během radioterapie
- Kontroverze v pooperační léčbě low-grade gliomů
- Postavení chemoterapie v pooperační léčbě low-grade gliomů
- Mutace isocitrátdehydrogenázy jsou lepší prognostický marker než metylace promotoru O6-metylguanin-DNA-metyltransferázy u glioblastomů – retrospektivní molekulárně genetická studie gliomů z jednoho centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



