-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Selhání adjuvantní léčby maligního melanomu – a co dál?
Failure of adjuvant treatment for malignant melanoma – what next?
Background: The possibilities of adjuvant therapy of malignant melanoma have significantly expanded in recent years. Based on the results of clinical studies, immunotherapy represented by checkpoint inhibitors (ipilimumab, pembrolizumab, nivolumab) and targeted therapies (dabrafenib plus trametinib) in patients with a proven mutation in the BRAF gene were included in the treatment protocols. In the Czech Republic, nivolumab and combination therapy of dabrafenib with trametinib are currently available for clinical practice. However, the question remains how to proceed if relapse or generalization occurs after the adjuvant treatment. The following case study describes one of possible solutions.
Case report: The article presents the failure of adjuvant nivolumab immunotherapy in a patient with locally advanced stage IIIC malignant melanoma. Ipilimumab has been selected as a treatment choice and demonstrated its efficacy. However, its administration was associated with immune-related side effects. These were diagnosed and successfully treated in the internal department in close cooperation with our department of oncology.
Conclusion: Although adjuvant therapy has significantly reduced a risk of disease relapse, there is a cohort of patients in whom adjuvant therapy fails. Failure may occur after the end of the therapy or, as in our case, during the therapy. Based on currently available data, it is not possible to unambiguously choose the optimal procedure after adjuvant therapy failure. Currently, there is no other way than following clinical experience and reimbursement regulations, or enrolling the patient in a clinical trial. Immune-related adverse effects require particular attention as they are unique due to their mechanism of origin and often require a multidisciplinary approach.
Keywords:
malignant melanoma – adjuvant therapy – nivolumab – ipilimumab
Autori: MUDr. Žiaran Miroslav 1; MUDr. Dvořák Petr 2; MUDr. Hoffmann Petr 2; MUDr. Kopecký Jindřich 1
Pôsobisko autorov: Klinika onkologie a radioterapie FN Hradec Králové 1; Radiologická klinika FN Hradec Králové 2
Vyšlo v časopise: Klin Onkol 2021; 34(1): 73-77
Kategória: Kazuistika
doi: https://doi.org/10.48095/ccko202173Súhrn
Východiska: Možnosti adjuvantní léčby maligního melanomu se v posledních letech významně rozšířily. Na základě výsledků klinických studií byla do léčebných postupů postupně zařazena jak imunoterapie zastoupená checkpoint inhibitory (ipilimumab, pembrolizumab, nivolumab), tak u pacientů s prokázanou mutací v BRAF genu i cílená terapie (dabrafenib plus trametinib). V ČR je v současné době pro klinickou praxi reálně dostupný nivolumab a kombinovaná terapie dabrafenibu s trametinibem. Nicméně otázkou zůstává, jakým způsobem postupovat, pokud po adjuvantní léčbě dojde k relapsu či generalizaci. Touto otázkou se zabývá následující kazuistika.
Kazuistika: Článek prezentuje selhání adjuvantní imunoterapie nivolumabem u pacienta s lokálně pokročilým maligním melanomem stadia IIIC. V paliativní léčbě generalizovaného onemocnění byl zvolen ipilimumab, který prokázal svoji účinnost. Jeho podání se však neobešlo bez imunitně podmíněných nežádoucích účinků. Ty byly diagnostikovány a úspěšně léčeny na spádovém interním oddělení v úzké spolupráci s naším onkologickým centrem.
Závěr: I přesto, že adjuvantní léčba významně snížila riziko relapsu onemocnění, existuje kohorta pacientů, u kterých se setkáváme se selháním adjuvantní léčby. K selhání může dojít po ukončení terapie, anebo jako v případě našeho pacienta v průběhu adjuvantní léčby. Na základě aktuálně dostupných dat nelze jednoznačně zvolit optimální postup po selhání adjuvance. U maligního melanomu jsme teprve na začátku tvorby těchto doporučení a nezbývá než se řídit klinickou zkušeností a úhradovou vyhláškou, příp. zařadit pacienta do klinické studie. Zvláštní pozornost bude nutné věnovat i nežádoucím účinkům, které jsou při imunoterapii vzhledem k mechanizmu vzniku unikátní a často vyžadují multidisciplinární přístup.
Klíčová slova:
maligní melanom – adjuvantní léčba – nivolumab – ipilimumab
Úvod
Incidence melanomu má za posledních 20 let v ČR dlouhodobě vzestupnou tendenci. Navzdory této skutečnosti můžeme současně sledovat nezměněnou či mírně klesající mortalitu [1]. Důvody tohoto příznivého vývoje jsou zřejmě multifaktoriální, nepochybně k nim ale přispívá i zlepšení léčebných výsledků v případě generalizovaného onemocnění za posledních 10 let díky cílené léčbě a imunoterapii. Vzhledem k těmto úspěchům byla u metastatického melanomu snaha posunout jejich indikaci i do časnější fáze stadia onemocnění. V současnosti účinnost v adjuvantním podání prokázaly tři checkpoint inhibitory – ipilimumab [2], pembrolizumab [3], nivolumab [4] a kombinovaná cílená terapie dabrafenib + trametinib pro pacienty s prokázanou mutací genu BRAF [5]. Jednotlivé preparáty mají své výhody a nevýhody. Ipilimumab nenašel své místo v adjuvantní léčbě vzhledem k nižší účinnosti ve srovnání s nivolumabem či pembrolizumabem, a naopak vyššímu zatížení nežádoucími účinky. Léčba cílenou terapií dabrafenib plus trametinib je indikována pouze u pacientů nesoucích nádorovou mutaci v genu BRAF. Anti-PD1 terapie má relativně vyvážený profil, což se týká jak účinnosti, tak nežádoucích účinků, kdy jednou z možných dlouhodobých komplikací je endokrinopatie a nutnost doživotní hormonální substituce.
S postupným rozšířením použití adjuvantní léčby v běžné klinické praxi vyvstává jedna základní otázka: co dělat v případě selhání léčby časně po skončení, či dokonce v průběhu adjuvantní terapie? Oproti jiným nádorovým onemocněním typu nádoru ovaria, prsu či tlustého střeva, kde již existují doporučení pro volbu léčby s ohledem na dobu vzniku progrese (do půl roku po léčbě, po půl roce a déle po léčbě apod.), jsme u maligního melanomu teprve na začátku procesu tvorby těchto doporučení. A je otázkou, zda vzhledem k unikátnímu mechanizmu účinku imunoterapie je vůbec možné použít tento princip k vytvoření dalšího léčebného algoritmu. Na druhou stranu, v současné době nemáme jiné vodítko, jak k takovým případům přistupovat.
Následující kazuistika přináší jeden z možných pohledů na postup následné léčby po selhání adjuvantní terapie nivolumabem.
Kazuistika
Pacient ve věku 67 let s nevýznamnými interními komorbiditami (arteriální hypertenze na medikaci, migrenózní cefalea anamnesticky) byl v srpnu 2018 vyšetřován pro rezistenci v pravé axile. Byla provedena exstirpace dvou hmatných axilárních lymfatických uzlin s diagnostikováním solidně rostoucího maligního nádoru. Vstupní stagingová PET/CT v září 2018 potvrdila aviditu k fluorodeoxyglukóze (FDG) v oblasti pravé axily a zároveň vyloučila generalizaci onemocnění (obr. 1). Dermatologické vyšetření a ostatní komplementární vyšetření byly bez patologického nálezu. V říjnu 2018 pacient podstoupil lymfadenektomii pravé axily s lalokovou plastikou a diagnóza byla zpřesněna na maligní melanom neznámého origa, stadium IIIC dle 8. verze klasifikace American Joint Committee on Cancer (AJCC) (cTx pN3b (16+/26) cM0). U pacienta nebyla prokázána mutace genu BRAF. S pacientem proběhla domluva stran následného řešení. V úvahu připadaly tři možnosti: aktivní sledování, léčba interferonem alfa-2b (jediný lék mající úhradu) nebo použití inovativní terapie. S pacientem jsme se nakonec domluvili, že vzhledem k tomu, že v ČR dosud nemá ani jeden z inovativních léků úhradu z veřejného zdravotního pojištění, požádáme pacientovu pojišťovnu o schválení terapie cestou mimořádné úhrady. Nakonec i přes opakovaná odvolání pro zamítavý postoj pojišťovny k navýšení úhrady léčby se pacient rozhodl léčbu hradit z vlastních prostředků. Od ledna do července 2019 bylo podáno celkem 15 cyklů nivolumabu v dávce 3 mg/kg à 14 dní. Léčba probíhala bez jakýchkoliv nežádoucích účinků.
Obr. 1. Vstupní PET/CT vyšetření ze září 2018. Šipky značí nádorovou lymfadenopatii v pravé axile. 
V červenci 2019 si pacient opět nahmatal rezistenci v oblasti pravé axily a podstoupil na spádovém pracovišti exstirpaci dvou lymfatických uzlin (v rámci dokreslení anamnézy je nutné doplnit, že se jednalo o pacienta-lékaře, který si zajišťoval chirurgickou intervenci nezávisle na našem doporučení). V obou uzlinách byla potvrzena recidiva maligního melanomu, kde navíc v případě jedné uzliny byla exstirpace hodnocena jako inkompletní. Na kontrolním PET/CT v srpnu 2019 byla prokázána generalizace v oblasti pravé axily, plic a mediastina (obr. 2).
Obr. 2. Kontrolní PET/CT vyšetření ze srpna 2019. Šipky značí relaps nádorového onemocnění v oblasti pravé axily, plic a mediastina. 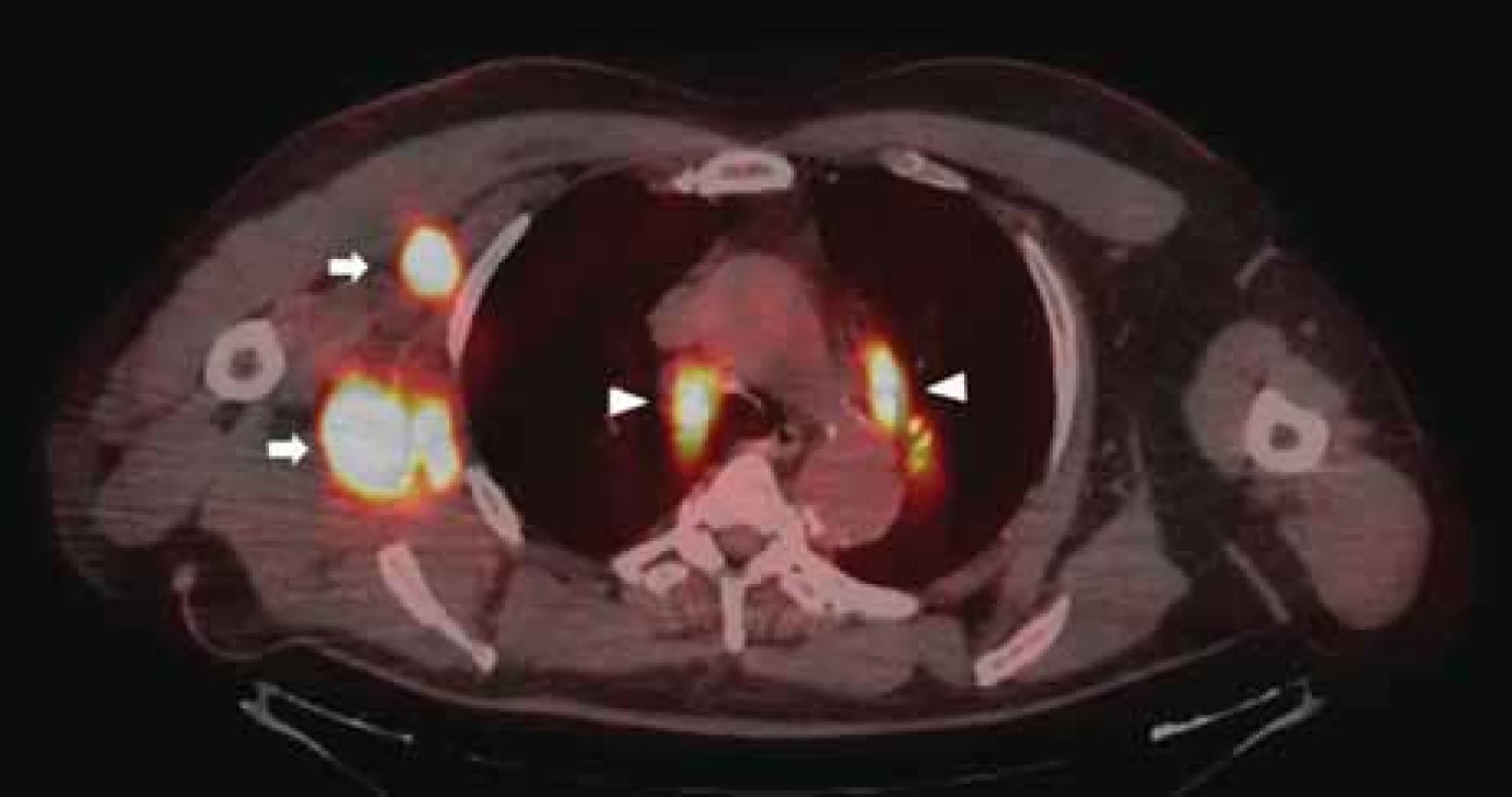
V rámci zajištění lokální kontroly a bolesti byl pacient indikován k paliativní léčbě ve formě radioterapie pravé axily (35 Gy/5 frakcí 1× týdně) a současně byla od října 2019 zahájena imunoterapie ipilimumabem v dávce 3 mg/kg à 3 týdny. Léčba byla dokončena v listopadu 2019. Po podání 4 cyklů ipilimumabu bylo na prvním poléčebném vyšetření dosaženo parciální odpovědi ve všech původních lokalizacích nádorového postižení (obr. 3).
Obr. 3. CT vyšetření z prosince 2019. Šipky značí reziduální nádorovou tkáň v oblasti pravé axily a pooperační/postiradiační změny (hroty). (Poznámka: CT řez je zaměřen na původní ložiska uložená v měkkých tkáních; vzhledem k odlišné technice řez není ve stejné úrovni jako PET/CT). 
V listopadu 2019, přibližně 2 týdny od poslední dávky ipilimumabu, byl pacient pro bolesti hlavy vyšetřen spádovým neurologem. Vzhledem k anamnestickému údaji migrenózní cefaley byl nasazen triptan – bez efektu. Za 3 dny po neurologickém vyšetření, kdy byl neurologický nález bez pozoruhodností, se přidala zmatenost a lehká levostranná lateralizace. Po opakovaném neurologickém vyšetření byla doplněna CT mozku a následně MRI mozku s vyloučením metastatického postižení a bez známek grafické encefalopatie. Pro subfebrilní stav bylo provedeno laboratorní vyšetření, kde dominovala patologická elevace N-katabolitů (kreatinin 506 μmol/l) a C-reaktivní protein (CRP) (174,4 mmol/l). Pro tento nález v kombinaci s neurologickou symptomatikou byl pacient hospitalizován na spádovém interním oddělení a jeho další vyšetření a léčba byly řízeny ve spolupráci s naší klinikou onkologie a radioterapie.
Na základě laboratorních anomálií a vzhledem k tomu, že byla vyloučena infekční příčina po kompletním mikrobiologickém screeningu (moč, stěry sliznic) vč. transezofageální echokardiografie, byla doporučena aplikace kortikosteroidů (Solu-Medrol 125 mg/den) vzhledem k možnosti rozvoje autoimunitní encefalitidy a nefritidy. Lumbální punkce ani biopsie z ledviny provedeny nebyly.
Hospitalizace byly opakovaně předčasně ukončeny na žádost pacienta a po podepsání negativního reversu. Pacient souhlasil s ambulantním podáváním antibiotik (meropenem na 7 dní) a kortikosteroidů po dobu 4 dnů (další podání pacient opět odmítl) a současně docházel 4 dny k parenterální hydrataci. Při této intervenci došlo k mírnému zlepšení klinického stavu a laboratorních hodnot. Pacient byl vyšetřen na naší klinice krátce po vysazení kortikoidů. Po rozmluvě s ním a vysvětlením možných dopadů z nenasazení kortikoidů byla zahájena léčba prednisonem 20 mg/den po dobu 14 dnů s následným postupným snižováním dávky až na prednison 5 mg/den v průběhu 2 měsíců. Po opětovném znovuzahájení kortikoterapie došlo postupně k normalizaci renálních funkcí, zánětlivých parametrů i neurologického nálezu.
Diskuze
Přes vynikající prognózu pacientů s lokalizovaným onemocněním, u kterých se podaří radikálně odstranit primární tumor v iniciálních stadiích, se prognóza rapidně zhoršuje s narůstající hloubkou invaze (dle Breslowa) a zejména při postižení regionálních lymfatických uzlin. Pětileté přežití u maligního melanomu stadia IA dosahuje 97 %, zatímco u stadia IIIC, tedy chirurgicky stále řešitelného onemocnění, je pětileté přežití pouze 40 % [6]. Jako racionální se tedy jeví snaha o zlepšení prognózy pacientů s vysokým rizikem relapsu využitím adjuvantní léčby.
Etablováním checkpoint inhibitorů u pacientů s generalizovaným maligním melanomem došlo ke zvýšení zájmu o tyto léky i v adjuvantní léčbě. Jedním z checkpoint inhibitorů používaných v této indikaci je nivolumab. Ve studii fáze III (CheckMate 238) byl porovnáván nivolumab a ipilimumab u pacientů po kompletní resekci maligního melanomu stadia IIIB–IV. Terapie nivolumabem vedla ke snížení rizika úmrtí či recidivy onemocnění o 35 % (HR 0,65; 97,56% CI 0,51–0,83; p < 0,001) [4].
Ačkoliv léčba checkpoint inhibitory přinesla v adjuvantním podání zlepšení v podobě oddálení relapsu a přeneseně i přežívání pacientů podobně jako u pacientů s generalizovaným maligním melanomem, je zde stále skupina pacientů, u kterých tato terapie nepřináší benefit. V současné době nemáme k dispozici žádná data z klinických studií, které by se touto problematikou zabývaly. Zůstává tedy nevyřešená otázka, co dělat v případě relapsu onemocnění po adjuvantní léčbě.
V případě selhání adjuvantní terapie je dobré si na začátek odpovědět na základní otázku, zda došlo k relapsu, protože se u pacienta vyvinula rezistence na terapii? Klinicky odlišná situace je, pokud dochází k relapsu po skončení adjuvantní terapie. Jistě zde bude hrát roli to, za jak dlouho po skončení adjuvantní terapie dojde k relapsu. Čím dříve dojde k relapsu, tím je pravděpodobnější, že se zabýváme skutečně rezistentní situací, a je na místě změnit, či eskalovat terapii.
A jakou léčbu tedy zvolit v případě relapsu? Za současné situace, pokud pacient není vhodným kandidátem pro klinické hodnocení a kdy máme možnost použít kombinovanou terapii ipilimumabu a nivolumabu, se zdá, že tato eskalace má největší potenciál překonat primární rezistenci a dosáhnout léčebného efektu. Pokud by se jednalo o pacienta nesoucího mutaci v genu BRAF, jistě je na místě pomýšlet na použití kombinace BRAF a MEK inhibitorů. Existuje zde ještě další možnost v podobě podání monoterapie ipilimumabem, především tam, kde riziko nežádoucích účinků kombinované terapie je neúměrné přínosu, a to ať z důvodů horší spolupráce s pacientem, či vzhledem ke klinickému stavu pacienta. Samozřejmě nesmíme zapomínat na to, že v současné době, kdy upouštíme od provádění disekcí uzlin, dochází k relapsu nejčastěji v regionálních lymfatických uzlinách. V tomto případě musíme myslet na možnost chirurgické intervence.
A právě protože neexistují klinická data, jak postupovat u pacientů s relabujícím onemocněním na adjuvantní terapii, mají být tyto komplexní případy a klinické situace řešeny v rámci mezioborové týmové spolupráce.
V našem případě byl ipilimumab volen z pragmatického hlediska. V době relapsu nebyla možnost léčby kombinovanou imunoterapií a vzhledem k zamítnutí úhrady nivolumabu v adjuvanci jsme již ani nežádali o možnost kombinované imunoterapie. U našeho pacienta byla maximální snaha zahájit léčbu co nejdříve po poslední dávce nivolumabu. Důvodem byla naše představa o tom, že vzhledem k terminálnímu biologickému poločasu nivolumabu kolem 25 dnů [7] by při podání ipilimumabu mohl být využit efekt obdobný kombinované imunoterapii. Dalším nástrojem, kterým jsme chtěli dosáhnout podpoření účinnosti imunoterapie, byla radioterapie, kterou jsme volili v časné fázi a částečně v konkomitantním postavení.
Druhou důležitou kapitolou, která je spojena s imunoterapií, je její toxicita. Jedná se o účinky podobné autoimunitním onemocněním, označované jako imunitně podmíněné nežádoucí účinky (immune-related adverse events – irAE). Výskyt nežádoucích účinků je pro jednotlivé checkpoint inhibitory odlišný a úzce souvisí s mechanizmem inhibice CTLA-4, PD-1 a PD-L1 dráhy. CTLA-4 řídí amplitudu imunologické odpovědi v časných stadiích aktivace T lymfocytů. Cesty PD-1 a PD-L1 působí v pozdějších stadiích, což omezuje aktivitu T lymfocytů především na periferní tkáně. Výskyt závažných irAE se pohybuje okolo 30 % při použití anti-CTLA-4 protilátek ve srovnání s 16 % u anti-PD-1 protilátek. Výskyt závažných irAE stupně 3 a více se zvyšuje v případě použití kombinace anti-CTLA-4 s anti-PD-1 protilátkami až na 50 % [8].
Tak jako v našem případě se jedná ve většině případů o zvládnutelné nežádoucí účinky. V některých případech či při opožděné intervenci však mohou mít i fatální dopad [9,10]. Podstatné je, že při správném managementu a pozitivní motivaci pacientů je možné těmto situacím předcházet.
Závěr
Imunoterapie představuje velký přínos pro onkologické pacienty napříč širokým spektrem nádorových onemocnění. S účinností této léčby jsou však úzce spojeny nežádoucí účinky. U pacientů léčených v rámci adjuvantního režimu je proto nutná vyšší obezřetnost i co se týká toxicity.
Bohužel klinické studie nemohou obsáhnout situace z reálného života, a tak pro některé případy, jako například otázka časného selhání adjuvantní terapie, nemáme jasné výsledky, které by nám říkaly, jak se zachovat. Naše kazuistika ukazuje jedno z možných řešení, která mohou mít klinický benefit pro konkrétního pacienta. Teprve čas a další zkušenosti ukážou, jak k pacientům s časnou recidivou po adjuvantní léčbě maligního melanomu přistupovat.
Práce byla realizována za podpory Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace (FNHK) – RVO (FNHK, 00179906).
This study was supported by the research programme of Ministry of Health of the Czech Republic – RVO (FNHK, 00179906).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Jindřich Kopecký, Ph.D.
Klinika onkologie a radioterapie
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: jindrich.kopecky@fnhk.cz
Obdrženo/Submitted: 14. 9. 2020
Přijato/Accepted: 21. 10. 2020
Zdroje
1. Krejci D, Zapletalova M, Svobodova I et al. Epidemiological trends for childhood and adolescent cancers in the period 1994–2016 in the Czech Republic. Klin Onkol 2019; 32 (6): 426–435. doi: 10.14735/amko2019426.
2. Eggermont AMM, Chiarion-Sileni V, Grob JJ et al. Adjuvant ipilimumab versus placebo after complete resection of stage III melanoma: long-term follow-up results of the European Organisation for Research and Treatment of Cancer 18071 double-blind phase 3 randomised trial. Eur J Cancer 2019; 119 : 1–10. doi: 10.1016/j.ejca.2019.07. 001.
3. Eggermont AM, Blank CU, Mandala M et al. Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med 2018; 378 (19): 1789–1801. doi: 10.1056/NEJMoa1802357.
4. Weber J, Mandala M, Del Vecchio M et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. N Engl J Med 2017; 377 (19): 1824–1835. doi: 10.1056/NEJMoa1709030.
5. Long GV, Hauschild A, Santinami M et al. Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. N Engl J Med 2017; 377 (19): 1813–1823. doi: 10.1056/NEJMoa1708539.
6. Balch CM, Gershenwald JE, Soong SJ et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009; 27 (36): 6199–6206. doi: 10.1200/JCO.2009.23.4799.
7. Centanni M, Moes DJAR, Trocóniz IF et al. Clinical pharmacokinetics and pharmacodynamics of immune checkpoint inhibitors. Clin Pharmacokinet 2019; 58 (7): 835–857. doi: 10.1007/s40262-019-00748-2.
8. Larkin J, Chiarion-Sileni V, Gonzalez R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373 (1): 23–34. doi: 10.1056/NEJMc1509660.
9. Kopecky J, Kubecek O, Geryk T et al. Nivolumab induced encephalopathy in a man with metastatic renal cell cancer: a case report. J Med Case Rep 2018; 12 (1): 262. doi: 10.1186/s13256-018-1786-9.
10. Kopecky J, Kubecek O, Geryk T et al. Hepatic injury induced by a single dose of nivolumab – a case report and literature review. Klin Onkol 2019; 32 (2): 133–138. doi: 10.14735/amko2019133.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tiskuČlánek Zemřela Mgr. Jana Drexlerová
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Patnáct let Národního onkologického programu České republiky a jeho vliv na výsledky u solidních nádorů dospělých v přehledu a číslech
- Rehabilitácia pri rakovine prsníka
- Vznik a význam sekvenčních variant mikroRNA v kancerogenezi
- Zárodečné mutace v genech RAD51C a RAD51D a dědičná predispozice ke vzniku karcinomu ovaria
- Droplet digital PCR as a novel diagnostic tool
- Odkládání návštěvy lékaře při podezření na karcinom prsu u žen v České republice
- Pathological response and clinical outcomes in operable triple-negative breast cancer with cisplatin added to standard neoadjuvant chemotherapy
- Post-treatment persistent alpha-fetoprotein elevation in a patient with testicular cancer
- Pembrolizumab v 1. linii terapie generalizovaného spinocelulárního karcinomu jícnu
- Skvamocelulárny karcinóm rekta u mladej ženy
- Four years of low dose enzalutamide for metastatic castration-resistant prostate cancer
- Selhání adjuvantní léčby maligního melanomu – a co dál?
- Aktuality z odborného tisku
- Král Z, Adam Z et al. Histiocytární neoplazie a další vybrané velmi vzácné krevní nemoci.
- Zemřela Mgr. Jana Drexlerová
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rehabilitácia pri rakovine prsníka
- Zárodečné mutace v genech RAD51C a RAD51D a dědičná predispozice ke vzniku karcinomu ovaria
- Droplet digital PCR as a novel diagnostic tool
- Skvamocelulárny karcinóm rekta u mladej ženy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



