-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Editorial
Vyšlo v časopise: Klin Onkol 2021; 34(Supplementum 1): 4-5
Kategória: Editorial
Léčba především nemalobuněčných plicních karcinomů (non-small cell lung cancer – NSCLC) zaznamenala snad největší pokrok mezi všemi solidními nádory. Preklinické a klinické novinky se objevují téměř „každý den“. Každá přehledná publikace se tak může jevit při svém vydání jako zastaralá. Opak je pravdou. Shrnutí a zejména názory nové generace odborníků jsou klíčem k budoucnosti. Je zásluhou Klinické onkologie jako vůdčího odborného časopisu v české onkologii, že umožnila v celé šíři prezentovat odborné názory na aktuální problematiku plicních karcinomů.
Kapitola Karcinom plic – diagnostika a včasný záchyt je klíčem k posunu léčby do časných stadií, která jsou stále v menšině. Záchyt preklinických stadií pomocí molekulární detekce i při propracované metodice tekutých biopsií je stále klinickou iluzí a je třeba zabránit předčasnému zneužití někdy falešně proklamované diagnostiky „z kapky krve“. Klíčem k časné diagnostice je i přes řadu kontroverzí adresný screening. Záchyt časných stadií přispěje k nárůstu chirurgických intervencí a v kombinaci s adjuvantní léčbou významně zvýší šanci na dlouhodobé přežití. Při předpokládaném nárůstu indikací adjuvantní léčby nemusí dojít k proklamovanému razantnímu ušetření nákladů na inovativní léčbu. Cílená terčová léčba a imunoterapie se posunou do časnějších stadií. Příkladem nových indikací adjuvantního podání jsou výsledky klinické studie ADAURA [1]. Výsledky randomizované studie fáze II NEOSTAR [2] jsou předpovědí neoadjuvantní a adjuvantní indikace check point inhibitorů.
Při rozvoji precizní genomické medicíny zasáhl klinickou onkologii exponenciální nárůst medicínských informací. Důsledky trvalého nárůstu vědeckých informací odhadl v 80. letech 20. století profesor Vladimír Vondráček: „Věda se rozrostla katastrofálně, tragicky. Nelze zvládnout všechny informace oboru, ani jejich poměrně malou část. Z toho rezultují pro některé osoby těžké výčitky. Je obtížné stanovit ideální typ moderního vědeckého pracovníka, jeho rozložení vědomostí. Svůj obor samozřejmě má znát, některé jeho části intenzivně, ale má mít i určité všeobecné vzdělání a doplňovat si je, aby mohl pochopit někdy neočekávané souvislosti a vztahy [3].“ Nárůst nových medicínských informací přináší nárůst individuálních řešení klinických situací, které vyžadují mezioborový přístup. Klíčem rozhodovacího procesu při indikaci chirurgické intervence a časové sekvence multimodalitní léčby časného a lokálně pokročilého NSCLC je proto rozhodnutí multidisciplinárního týmu (MTD), viz kapitola Role multidisciplinárního týmu a molekulárního tumor boardu v léčbě pacienta s karcinomem plic. Kapitoly Chirurgická léčba karcinomu plic a Nové možnosti léčby časného a lokálně pokročilého NSCLC jsou zpracovány ve sborníku odděleně, ale z pohledu multidisciplinarity spolu úzce souvisejí. Pokud MTD stanoví kurativní (radikální) léčebný cíl, je adekvátní využití všech léčebných modalit v předem plánované návaznosti klinickou povinností. Jedinou zárukou ukončení „necíleného podávání cílené léčby“ je klinická utilizace personalizované a precizní onkologie. Precizní onkologie se neobejde bez komprehenzivního molekulárního vyšetření zahrnujícího sekvenování nové generace (new generation sequencing – NGS), transkriptomiku a analýzu proteinů a další omické metody. Bez dostupné, adekvátně prováděné molekulární diagnostiky není možné rozhodovat o výběru cílené léčby. Výběr a zahájení léčby bez určení prediktivních biomarkerů nebudou v brzké budoucnosti možné. Neprovedení molekulárního vyšetření může nemocného poškodit. Příkladem jsou nemalobuněčné plicní karcinomy, kde se výběr správné léčby neobejde bez molekulární subklasifikace (mutace EGFR, ALK, ROS a další). Neznalost přítomné aberace může nemocnému významně snížit šanci na dlouhodobé přežití. Pro kliniky je proto kapitola Prediktivní testování u nemalobuněčného karcinomu plic povinnou četbou. Výskyt některých aberací je relativně prevalenčně omezený (např. ALK fúze < 5 %), ale efekt terčové léčby je vzhledem k její precizní definici dramaticky lepší ve srovnání s nádory, u kterých nebyla molekulární aberace detekována. Dobrou zprávou je, že paralelně s identifikací nových řídících molekulárních aberací přibývají cílené terčové léky. Postupná implementace všech inovativních terčových léků (tab. 1) do terapeutického armamentaria nemalobuněčných karcinomů plic je cestou prodlužující přežití nemocných. Tab. 1 zahrnuje léky povolené FDA a nevyjadřuje současný stav registrace a indikačních doporučení jednotlivých léků v ČR [4].
Tab. 1. Terapeutické armamentarium cílené terčové léčby nemalobuněčných karcinomů plic. 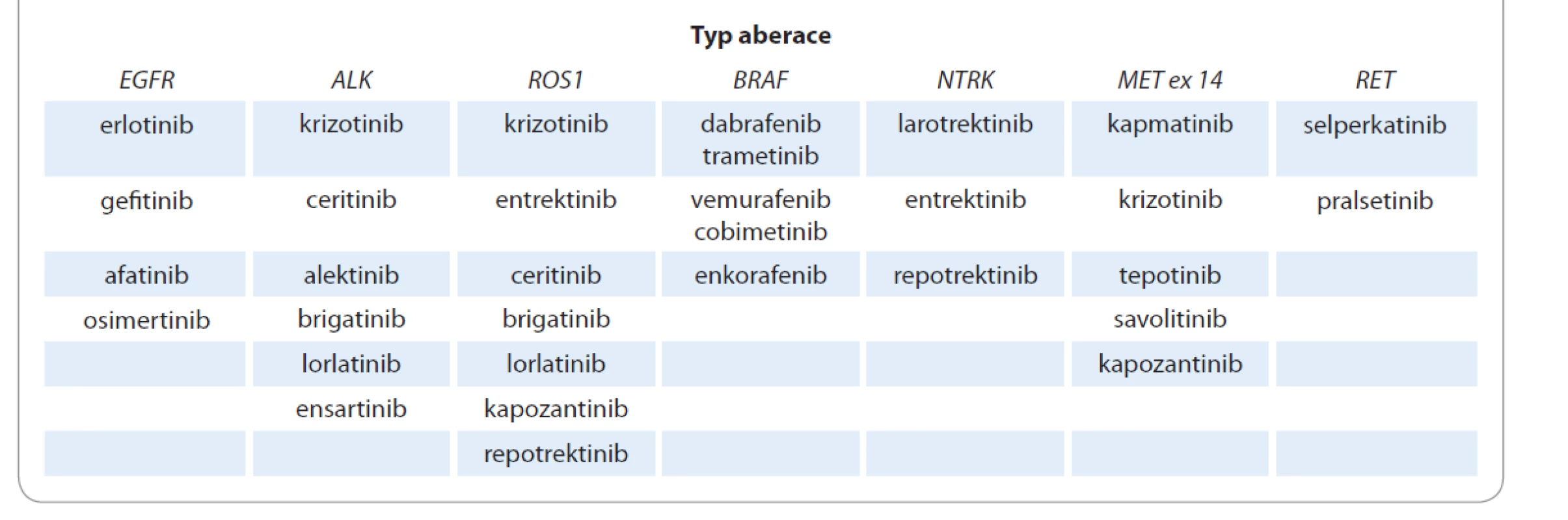
Problematice terčové léčby NSCLC je ve sborníku věnována samostatná kapitola Cílená léčba nemalobuněčného karcinomu plic.
„Znovuobrození“ imunoterapie patří mezi zásadní události poslední doby, a proto jí byla věnována samostatná kapitola, a sice Imunoterapie v léčbě nemalobuněčného karcinomu plic. Inhibitory kontrolních bodů imunitní reakce, „check point inhibitory“, se staly nepostradatelnou modalitou onkologické léčby. Jedná se o terapeutickou modalitu s odlišnými mechanizmy účinku oproti chemoterapii a cílené terčové léčbě, která má odlišný profil nežádoucích účinků a vyžaduje odlišný management. Přesná (precizní) imunoterapie je zatím iluzorní. Imunoterapie je sice účinná napříč solidními nádory, ale hrdlo účinnosti je poměrně úzké a léčebné odpovědi lze zatím dosáhnout jen u 20–35 % léčených pacientů. Širší hrdlo účinnosti je u nejvíce imunogenních nádorů, jako jsou maligní melanomy, renální a plicní karcinomy. Limitací této inovované terapeutické modality je absence širší palety prediktivních biomarkerů a imunomarkerů. Roztříštěná metodika stanovení exprese PD-L1 je příkladem nevhodným k následování. Pravděpodobnost léčebné odpovědi se zvyšuje s narůstající expresí PD-L1, ale u některých PD-L1 negativních nádorů lze navodit léčebnou odpověď. Řešením není prohlásit expresi PD-L1 za zbytečný a nepotřebný biomarker. Do doby, než budou definovány a klinicky validovány inovativní imunoprediktory, zůstane exprese PD-L1 klinickým klíčem imunopredikce pro PD-L1 inhibitory. Identifikace a validace dalších prediktorů je proto klinickou urgencí. Budoucnost imunopredikce není v izolovaném, ale naopak v kombinovaném využití prediktorů při utilizaci informací z nádoru a nádorového mikroprostředí, ale i periferního imunomu a imunologické charakteristiky hostitele nemoci, vč. jeho mikrobiomu. Úvahy o aplikaci kombinované imunochemoterapie v 1. linii bez potřeby znalosti exprese PD-L1 je cestou, jak zahubit precizní imunoterapii. Odborná lékařská veřejnost zastoupená odbornými společnostmi bude vždy nezávisle formulovat své názory a doporučení. Cílem je zúžení indikačního hrdla, zvýšení účinnosti a eliminace rizik nežádoucích projevů. Imunoterapie check point inhibitory působí bez ohledu na lokalizaci a typ tkáně. V některých indikacích je možné imunoterapii považovat za nádorově, lokalizačně a histologicky agnostickou léčbu. Aktuální kontroverzní otázky imunoterapie (primární, sekundární rezistence, hyperprogrese, hypertoxicita, doba podávání, reindukce) musejí být též urgentně řešeny. Aplikace precizní medicíny vyžaduje změnu klinického myšlení – nejedná se o výběr nejlepší léčebné modality, ale o výběr (optimální) léčby pro každého nemocného.
Většina odborných textů se zabývá problematikou NSCLC. Léčba malobuněčných karcinomů plic nezaznamenala v posledních téměř 20 letech žádné zásadní změny. Chemoterapie se prakticky nezměnila, ale stále zůstává klíčovou systémovou modalitou. Pro uplatnění cílené terčové léčby chybí targetabilní genové aberace. Výsledky kombinace chemoterapie s check point inhibitory [5,6] jsou po dlouhém čekání konečně pozitivní. Modulovaná imunoterapie, imunokonjugáty, PARP inhibice, identifikace targetabilních epigenetických struktur v kontextu NGS vyžadují větší výzkumné nasazení. Zařazení kapitoly Pokroky v léčbě malobuněčného karcinomu plic je proto víc než nutné.
Závěrem uvádím vlastní nezávislou předpověď budoucího využití chemoterapie, imunoterapie a terčové léčby v léčbě nemalobuněčných plicních karcinomů po roce 2025:
více než 70 % nemocných bude v průběhu onemocnění léčeno imunoterapií;
více než 40 % nemocných bude léčeno cílenou terčovou léčbou v 1. linii;
dojde k útlumu indikací samostatné chemoterapie v 1. linii léčby.
Vlastní predikce budoucího využití chemoterapie, imunoterapie a terčové léčby u malobuněčných plicních karcinomů po roce 2025:
více než 50 % nemocných se solidními nádory bude léčeno imunoterapií v průběhu onemocnění;
chemoterapie zůstane klíčovou modalitou léčby;
novou klinickou systémovou modalitou se stanou imunokonjugáty.
Léčba především nemalobuněčných plicních karcinomů (non-small cell lung cancer – NSCLC) zaznamenala snad největší pokrok mezi všemi solidními nádory. Preklinické a klinické novinky se objevují téměř „každý den“. Každá přehledná publikace se tak může jevit při svém vydání jako zastaralá. Opak je pravdou. Shrnutí a zejména názory nové generace odborníků jsou klíčem k budoucnosti. Je zásluhou Klinické onkologie jako vůdčího odborného časopisu v české onkologii, že umožnila v celé šíři prezentovat odborné názory na aktuální problematiku plicních karcinomů.
Kapitola Karcinom plic – diagnostika a včasný záchyt je klíčem k posunu léčby do časných stadií, která jsou stále v menšině. Záchyt preklinických stadií pomocí molekulární detekce i při propracované metodice tekutých biopsií je stále klinickou iluzí a je třeba zabránit předčasnému zneužití někdy falešně proklamované diagnostiky „z kapky krve“. Klíčem k časné diagnostice je i přes řadu kontroverzí adresný screening. Záchyt časných stadií přispěje k nárůstu chirurgických intervencí a v kombinaci s adjuvantní léčbou významně zvýší šanci na dlouhodobé přežití. Při předpokládaném nárůstu indikací adjuvantní léčby nemusí dojít k proklamovanému razantnímu ušetření nákladů na inovativní léčbu. Cílená terčová léčba a imunoterapie se posunou do časnějších stadií. Příkladem nových indikací adjuvantního podání jsou výsledky klinické studie ADAURA [1]. Výsledky randomizované studie fáze II NEOSTAR [2] jsou předpovědí neoadjuvantní a adjuvantní indikace check point inhibitorů.
Při rozvoji precizní genomické medicíny zasáhl klinickou onkologii exponenciální nárůst medicínských informací. Důsledky trvalého nárůstu vědeckých informací odhadl v 80. letech 20. století profesor Vladimír Vondráček: „Věda se rozrostla katastrofálně, tragicky. Nelze zvládnout všechny informace oboru, ani jejich poměrně malou část. Z toho rezultují pro některé osoby těžké výčitky. Je obtížné stanovit ideální typ moderního vědeckého pracovníka, jeho rozložení vědomostí. Svůj obor samozřejmě má znát, některé jeho části intenzivně, ale má mít i určité všeobecné vzdělání a doplňovat si je, aby mohl pochopit někdy neočekávané souvislosti a vztahy [3].“ Nárůst nových medicínských informací přináší nárůst individuálních řešení klinických situací, které vyžadují mezioborový přístup. Klíčem rozhodovacího procesu při indikaci chirurgické intervence a časové sekvence multimodalitní léčby časného a lokálně pokročilého NSCLC je proto rozhodnutí multidisciplinárního týmu (MTD), viz kapitola Role multidisciplinárního týmu a molekulárního tumor boardu v léčbě pacienta s karcinomem plic. Kapitoly Chirurgická léčba karcinomu plic a Nové možnosti léčby časného a lokálně pokročilého NSCLC jsou zpracovány ve sborníku odděleně, ale z pohledu multidisciplinarity spolu úzce souvisejí. Pokud MTD stanoví kurativní (radikální) léčebný cíl, je adekvátní využití všech léčebných modalit v předem plánované návaznosti klinickou povinností. Jedinou zárukou ukončení „necíleného podávání cílené léčby“ je klinická utilizace personalizované a precizní onkologie. Precizní onkologie se neobejde bez komprehenzivního molekulárního vyšetření zahrnujícího sekvenování nové generace (new generation sequencing – NGS), transkriptomiku a analýzu proteinů a další omické metody. Bez dostupné, adekvátně prováděné molekulární diagnostiky není možné rozhodovat o výběru cílené léčby. Výběr a zahájení léčby bez určení prediktivních biomarkerů nebudou v brzké budoucnosti možné. Neprovedení molekulárního vyšetření může nemocného poškodit. Příkladem jsou nemalobuněčné plicní karcinomy, kde se výběr správné léčby neobejde bez molekulární subklasifikace (mutace EGFR, ALK, ROS a další). Neznalost přítomné aberace může nemocnému významně snížit šanci na dlouhodobé přežití. Pro kliniky je proto kapitola Prediktivní testování u nemalobuněčného karcinomu plic povinnou četbou. Výskyt některých aberací je relativně prevalenčně omezený (např. ALK fúze < 5 %), ale efekt terčové léčby je vzhledem k její precizní definici dramaticky lepší ve srovnání s nádory, u kterých nebyla molekulární aberace detekována. Dobrou zprávou je, že paralelně s identifikací nových řídících molekulárních aberací přibývají cílené terčové léky. Postupná implementace všech inovativních terčových léků (tab. 1) do terapeutického armamentaria nemalobuněčných karcinomů plic je cestou prodlužující přežití nemocných. Tab. 1 zahrnuje léky povolené FDA a nevyjadřuje současný stav registrace a indikačních doporučení jednotlivých léků v ČR [4].
Problematice terčové léčby NSCLC je ve sborníku věnována samostatná kapitola Cílená léčba nemalobuněčného karcinomu plic.
„Znovuobrození“ imunoterapie patří mezi zásadní události poslední doby, a proto jí byla věnována samostatná kapitola, a sice Imunoterapie v léčbě nemalobuněčného karcinomu plic. Inhibitory kontrolních bodů imunitní reakce, „check point inhibitory“, se staly nepostradatelnou modalitou onkologické léčby. Jedná se o terapeutickou modalitu s odlišnými mechanizmy účinku oproti chemoterapii a cílené terčové léčbě, která má odlišný profil nežádoucích účinků a vyžaduje odlišný management. Přesná (precizní) imunoterapie je zatím iluzorní. Imunoterapie je sice účinná napříč solidními nádory, ale hrdlo účinnosti je poměrně úzké a léčebné odpovědi lze zatím dosáhnout jen u 20–35 % léčených pacientů. Širší hrdlo účinnosti je u nejvíce imunogenních nádorů, jako jsou maligní melanomy, renální a plicní karcinomy. Limitací této inovované terapeutické modality je absence širší palety prediktivních biomarkerů a imunomarkerů. Roztříštěná metodika stanovení exprese PD-L1 je příkladem nevhodným k následování. Pravděpodobnost léčebné odpovědi se zvyšuje s narůstající expresí PD-L1, ale u některých PD-L1 negativních nádorů lze navodit léčebnou odpověď. Řešením není prohlásit expresi PD-L1 za zbytečný a nepotřebný biomarker. Do doby, než budou definovány a klinicky validovány inovativní imunoprediktory, zůstane exprese PD-L1 klinickým klíčem imunopredikce pro PD-L1 inhibitory. Identifikace a validace dalších prediktorů je proto klinickou urgencí. Budoucnost imunopredikce není v izolovaném, ale naopak v kombinovaném využití prediktorů při utilizaci informací z nádoru a nádorového mikroprostředí, ale i periferního imunomu a imunologické charakteristiky hostitele nemoci, vč. jeho mikrobiomu. Úvahy o aplikaci kombinované imunochemoterapie v 1. linii bez potřeby znalosti exprese PD-L1 je cestou, jak zahubit precizní imunoterapii. Odborná lékařská veřejnost zastoupená odbornými společnostmi bude vždy nezávisle formulovat své názory a doporučení. Cílem je zúžení indikačního hrdla, zvýšení účinnosti a eliminace rizik nežádoucích projevů. Imunoterapie check point inhibitory působí bez ohledu na lokalizaci a typ tkáně. V některých indikacích je možné imunoterapii považovat za nádorově, lokalizačně a histologicky agnostickou léčbu. Aktuální kontroverzní otázky imunoterapie (primární, sekundární rezistence, hyperprogrese, hypertoxicita, doba podávání, reindukce) musejí být též urgentně řešeny. Aplikace precizní medicíny vyžaduje změnu klinického myšlení – nejedná se o výběr nejlepší léčebné modality, ale o výběr (optimální) léčby pro každého nemocného.
Většina odborných textů se zabývá problematikou NSCLC. Léčba malobuněčných karcinomů plic nezaznamenala v posledních téměř 20 letech žádné zásadní změny. Chemoterapie se prakticky nezměnila, ale stále zůstává klíčovou systémovou modalitou. Pro uplatnění cílené terčové léčby chybí targetabilní genové aberace. Výsledky kombinace chemoterapie s check point inhibitory [5,6] jsou po dlouhém čekání konečně pozitivní. Modulovaná imunoterapie, imunokonjugáty, PARP inhibice, identifikace targetabilních epigenetických struktur v kontextu NGS vyžadují větší výzkumné nasazení. Zařazení kapitoly Pokroky v léčbě malobuněčného karcinomu plic je proto víc než nutné.
Závěrem uvádím vlastní nezávislou předpověď budoucího využití chemoterapie, imunoterapie a terčové léčby v léčbě nemalobuněčných plicních karcinomů po roce 2025:
více než 70 % nemocných bude v průběhu onemocnění léčeno imunoterapií;
více než 40 % nemocných bude léčeno cílenou terčovou léčbou v 1. linii;
dojde k útlumu indikací samostatné chemoterapie v 1. linii léčby.
Vlastní predikce budoucího využití chemoterapie, imunoterapie a terčové léčby u malobuněčných plicních karcinomů po roce 2025:
více než 50 % nemocných se solidními nádory bude léčeno imunoterapií v průběhu onemocnění;
chemoterapie zůstane klíčovou modalitou léčby;
novou klinickou systémovou modalitou se stanou imunokonjugáty.
prof. MUDr. Luboš Petruželka, CSc.
Onkologická klinika 1. LF UK, VFN a ÚVN v Praze
Zdroje
1. Ramalingam SS, Vansteenkiste J, Planchard D et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med 2020; 382 : 41–50. doi: 10.1056/NEJMoa1913662.
2. Cascone T, William WN, Weissferdt A et al. Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial. Nat Med 2021; 27 (3): 504–514. doi: 10.1038/s41591-020-01224-2.
3. Vondráček V. Úvahy psychologicko-psychiatrické. Praha: Avicenum 1981.
4. NCCN clinical practise guidelines in oncology. [online]. Available from: https: //www.nccn.org/professionals/physician_gls/default.aspx.
5. Horn L, Mansfield AS, Szczęsna A et al. IMpower133 Study Group. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379 (23): 2220–2229. doi: 10.1056/ NEJMoa1809064.
6. Paz-Ares L, Dvorkin M, Chen Y et al. Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394 (10212): 1929–1939. doi: 10.1016/S0140-6736 (19) 32222-6.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2021 Číslo Supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial
- Karcinom plic – diagnostika a časný záchyt
- Role multidisciplinárního týmu a molekulárního tumor boardu v léčbě pacienta s karcinomem plic
- Prediktivní testování u nemalobuněčného karcinomu plic
- Chirurgická léčba karcinomu plic
- Nové možnosti léčby časného a lokálně pokročilého nemalobuněčného karcinomu plic
- Cílená terapie nemalobuněčného plicního karcinomu
- Imunoterapie v léčbě nemalobuněčného karcinomu plic
- Pokroky v léčbě malobuněčného karcinomu plic
- Budoucnost léčby karcinomu plic
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom plic – diagnostika a časný záchyt
- Chirurgická léčba karcinomu plic
- Pokroky v léčbě malobuněčného karcinomu plic
- Budoucnost léčby karcinomu plic
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



