-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Převodní systém srdeční jako nový rizikový orgán v radioterapii
Cardiac conduction system as a new organ at risk in radiotherapy
Background: Cardiovascular diseases represent the most common non-oncologic cause of death in patients following radiotherapy (RT) in the thoracic region. Radiation-induced heart disease (RIHD) can manifest as various heterogeneous clinical entities. However, the influence of RT on the cardiac conduction system has only recently gained more attention. Arrhythmogenic toxicity, i.e., conduction disorders and arrhythmias, constitutes a significant part of these adverse effects. The cardiac conduction system is not routinely monitored as an organ at risk (OaR). Its specific histological nature and function suggest different sensitivity and response to radiation. The heart is a highly heterogeneous organ, and the routinely monitored dose to the whole heart may not adequately characterize the risk of increased arrhythmogenic toxicity from RT. Cardiac structures, including the conduction system, appear to be additional OaRs for which dose distribution should be monitored. Material and methods: For the systematic selection of studies, we utilized the PubMed database with keywords derived from the analysis of existing literature. The search was limited to English-language publications, and the selection criteria included relevance to the topic and the quality of methodology. Purpose: This article summarizes the impact of RT on the cardiac conduction system. Conclusion: Radiotherapy-induced cardiotoxicity significantly affects morbidity and mortality. The heart exhibits heterogeneity in terms of radiosensitivity. Certain cardiac subregions in the dose distribution show a higher correlation with poorer overall survival than routinely monitored doses to the whole heart and derived parameters (the volumes irradiated with the doses of 5 or 30 Gy – V5 or V30, respectively). The most radiosensitive subregions appear to be the base of the heart, including the beginning of the conduction system. Higher doses to the conduction system, especially the sinoatrial (SA) node, are associated with a higher incidence of a wide range of arrhythmias and poorer overall survival. However, dose limits (Dmean and Dmax) for the conduction system have not yet been established. Dosimetric studies have identified cutoff doses to the SA node, exceeding which there is a significant increase in mortality and the occurrence of arrhythmias.
Keywords:
cardiotoxicity – heart conduction system – arrhythmias, cardiac – organs at risk – sinoatrial node – radiation injuries
Autori: M. Domanský 1,2; J. Kubeš 1
Pôsobisko autorov: Proton Therapy Center Czech s. r. o., Praha 1; Onkologická klinika 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Klin Onkol 2024; 37(1): 10-19
Kategória: Přehledy
doi: https://doi.org/10.48095/ccko202410Súhrn
Východiska: Kardiovaskulární onemocnění představují nejčastější neonkologickou příčinu úmrtí u pacientů po radioterapii (RT) v oblasti hrudníku. Onemocnění srdce indukované zářením (radiation-induced heart disease – RIHD) se může manifestovat mnoha heterogenními klinickými jednotkami. Vliv RT na převodní systém srdeční však začíná být více diskutován až v poslední době. Arytmogenní toxicita, tj. převodní poruchy a arytmie, tvoří významnou část spektra nežádoucích účinků na srdci. Převodní systém srdeční není jako rizikový (kritický) orgán (organ at risk – OaR) rutinně sledován. Jeho specifická histologická povaha a funkce naznačují jeho odlišnou citlivost a odpověď na záření. Srdce je vysoce heterogenní orgán a obvykle sledovaná dávka na celé srdce není tak výstižná v charakterizování rizika zvýšené arytmogenní toxicity RT. Srdeční substruktury (vč. převodního systému) se jeví jako další OaR, u kterých je nutné sledovat dávkovou distribuci. Materiál a metody: Pro systematický výběr studií jsme využili databázi PubMed s klíčovými slovy odvozenými z analýzy existující literatury. Vyhledávání bylo omezeno na publikace v anglickém jazyce. Kritéria výběru zahrnovala relevantnost k tématu a kvalitu metodologie. Cíl: V článku shrnujeme vliv RT na převodní systém srdeční. Závěr: Kardiotoxicita jako nežádoucí účinek RT významně ovlivňuje morbiditu a mortalitu. Srdce je heterogenní, co se týče radiosenzitivity. Určité srdeční subregiony v dávkové distribuci vykazují vyšší korelaci s horším celkovým přežitím než rutinně sledované dávky na srdce jako celek, a od nich odvozené parametry (objem ozářený dávkou 5, resp. 30 Gy – V5, V30). Jako nejradiosenzitivnější subregiony se jeví oblasti srdeční baze, tj. i oblast začátku převodního systému. Vyšší dávky na převodní systém, zejména sinoatriální (SA) uzel, jsou asociovány s vyšší incidencí širokého spektra arytmií a s horším celkovým přežitím. Dávkové limity (střední dávka Dmean a maximální dávka Dmax) na převodní systém nicméně nebyly doposud stanoveny. Existují dozimetrické studie stanovující hraniční dávky na SA uzel, při jejichž překročení signifikantně roste mortalita a výskyt arytmií.
Klíčová slova:
kardiotoxicita – převodní systém srdeční – srdeční arytmie – kritické orgány – nodus sinuatrialis – radiační poranění
Úvod
Radioterapie (RT) se řadí k základním léčebným modalitám protinádorové léčby a významně zlepšuje celkové přežití pacientů. I přes významný pokrok v ozařovacích technikách patří nežádoucí účinky RT, poradiační toxicita, k častým fenoménům. Cílem článku je zaměřit se na specifický druh kardiotoxicity: na nežádoucí účinky RT na převodní systém. Co se týče kardiotoxicity, doposud byla pozornost zaměřena spíše na onemocnění koronárních tepen, strukturální poškození myokardu, chlopenní dysfunkce aj. Recentně se začíná více zkoumat vliv RT na struktury srdečního převodního systému vedoucí k arytmogenní kardiotoxicitě. Tento vliv se ukazuje jako zásadní, co se týče následné morbidity a mortality.
Existuje mnoho studií zaměřujících se na zkoumání vlivu dávky na klasicky sledované srdeční substruktury – srdeční oddíly a koronární arterie bez zkoumání dávky na základní převodní struktury – sinoatriální (SA) a atrioventrokulární (AV) uzel [1–3]. Přitom arytmie jsou jedním z nejčastějších a mnohdy fatálních kardiálních nežádoucích účinků postihující pacienty po RT v této oblasti, konkrétněji např. z důvodu bronchogenního karcinomu plic [2–4] nebo mediastinálních lymfomů [5,6].
Navzdory těmto poznatkům v současnosti zatím neexistuje jasný návrh na dávkové limity (constraints) pro převodní systém, neboť souvislost dávek na tyto substruktury s následným vznikem arytmií nebyla dosud dostatečně studována. Může za to patrně i neexistence [7] konturačních atlasů zahrnujících převodní systém až do roku 2021, kdy byl takový atlas publikován [8]. Pro vyjasnění hodnot dávkových limitů bude potřeba ještě uskutečnit retrospektivní a prospektivní studie beroucí v potaz struktury převodního systému jako rizikové orgány (hlavně SA a AV uzel) za účelem vytvoření modelů pravděpodobnosti poškození normální tkáně (normal tissue control probability – NTCP) pro převodní systém [7].
Přestože je tato problematika nová, bylo v nedávné době zveřejněno množství prací zabývajících se touto otázkou, které uskutečnily velmi zajímavá pozorování a závěry. Jedná se např. o první studie dozimetrické na převodní systém [7,9–11], analýzy lokalizující nejvíce radiosenzitivní oblast srdce [12–18], práce popisující souvislost dávky na převodní struktury se vznikem různých arytmií či mortalitou [19,20] nebo práce objasňující vlastní patofyziologický mechanizmus [21,22]. Těmto tématům bude věnována pozornost dále v textu.
Kardiotoxicita obecně (RIHD)
Kardiovaskulární onemocnění představují nejčastější neonkologickou příčinu úmrtí u pacientů po RT v oblasti srdce [23]. Odhadovaná incidence kardiotoxicity obecně, tj. onemocnění srdce indukovaného zářením (radiation-induced heart disease – RIHD), se pohybuje mezi 10–30 % v období 5–10 let po léčbě a závisí na typu malignity [24]. Recentní pokroky v radioterapeutických technologiích sice snížily morbiditu v důsledku RIHD, riziko ovšem není zcela odstraněno [25,26]. Na riziko rozvoje těchto nežádoucích účinků by mělo být pomýšleno u pacientů podstupujících RT v oblasti hrudníku a mediastina, z čehož jako nejrelevantnější diagnózy jmenujme karcinom prsu, karcinom plic, karcinom jícnu, mediastinální lymfomy, příp. thymom [27]. Z tohoto výběru se ukazuje, že největší změny a dopad na celkové přežití bude právě u bronchogenního karcinomu, konkrétně nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC), z důvodu vysokých celkových dávek a mnohdy bezprostřední blízkosti srdce [28], a to zejména u pravostranných karcinomů [29]. Nežádoucí účinky RT se na srdci mohou manifestovat buď akutně (perikarditida, arytmie), anebo častěji s odstupem mnoha let – nejvíce v 2.–3. dekádě po RT [30,31].
Zvláštní pozornosti by se mělo dostávat pacientům, kteří mají již nějaké známé kardiovaskulární onemocnění, podstupují léčbu kardiotoxickou chemoterapií (např. antracykliny, 5-fluorouracil, kapecitabin, paklitaxel, cyklofosfamid) či imunoterapií (hlavně anti-HER2 a anti-VEGF) nebo u kterých je přítomný rizikový faktor (tab. 1) [5,23]. U těchto pacientů je vyšší riziko rozvoje kardiotoxicity. Některé z těchto rizikových faktorů v dnešní době ztrácejí na významu (relativní vážení pole, kobaltový zdroj).
V roce 2022 byly společností European Society of Cardiology publikovány první kardioonkologické guidelines [32]. Tyto guidelines poskytují definice a doporučení pro diagnostiku, léčbu, dispenzarizaci a prevenci kardiotoxicity spojené s onkologickou terapií (hlavně systémovou, ale i lokální, tj. RT). Mimoto představují i praktická doporučení, např. vhodný postup u pacientů s kardiostimulátory či implantabilními kardiovertery-defibrilátory podstupujících RT.
Tab. 1. Rizikové faktory pro rozvoj kardiotoxicity po radioterapii [5,23]. ![Rizikové faktory pro rozvoj kardiotoxicity po radioterapii [5,23].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6b1a05636af33c78bf4f512ad51cdb91.png)
Tab. 2. Pozorované převodní poruchy a arytmie následkem radioterapie [21,23,33]. ![Pozorované převodní poruchy a arytmie následkem radioterapie [21,23,33].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0bf5620027b28436a3ada4ea866709ae.png)
Typy kardiotoxicity a arytmogenní kardiotoxicita
RT může ovlivnit všechny srdeční struktury, proto se RIHD může manifestovat mnoha heterogenními klinickými jednotkami [23,33]. Řadíme mezi ně:
onemocnění koronárních tepen se vznikem akutního infarktu myokardu;
kongestivní srdeční selhání (systolické i diastolické, tj. se sníženou i se zachovalou ejekční frakcí);
strukturální onemocnění myokardu (restriktivní kardiomyopatie, myokardiální fibrózy, jizvy);
chlopenní dysfunkce (stenózy i insuficience);
onemocnění perikardu (od akutní exudativní perikarditidy po chronickou konstriktivní perikarditidu);
náhlou srdeční smrt;
arytmogenní toxicitu – převodní poruchy, arytmie.
Právě poslední zmíněné převodní poruchy a arytmie tvoří významnou část tohoto spektra nežádoucích účinků. Prevalence arytmií celkově v populaci je odhadována na 1,5–5 % [34], zatímco EKG abnormality byly reportovány u dlouhodobě přeživších po RT v oblasti mediastina až v 75 % (sledovaná skupina pacientů však byla léčena mezi lety 1970–1991) [35,36]. Tyto abnormality se začínají objevovat do 2 měsíců po ukončení RT, avšak okolo 70 % těchto abnormalit na EKG je reverzibilních do půl roku po RT [37,38]. Nicméně mnoho arytmií je potenciálně život ohrožujících, má dopad na zvýšenou morbiditu, mortalitu [2–4,5,6,19,20] či kvalitu života, např. kvůli nutnosti implantace pacemakeru [20,39].
Po RT bylo již pozorováno celé spektrum převodních poruch – od arytmií supraventrikulárních po komorové, od bradyarytmií k tachyarytmiím (tab. 2) [21,23,33]. Nejčastěji se však objevuje fibrilace síní, AV blok 2. stupně typu Mobitz II (tj. infranodální) a blokáda pravého Tawarova raménka – nejspíše kvůli anteriorní poloze Hisova svazku a raménka [35].
Co se týče incidence vzniku arytmií, tak se patrně bude uplatňovat závislost na vzrůstající dávce. Střední dávka (Dmean) nad 10 Gy pro celé srdce je asociována s vyšším rizikem jejich vzniku [40]. Je nutno ovšem podotknout, že tato klasicky sledovaná dávka na celé srdce pravděpodobně nebude tak přiléhavě sledovat tento fenomén, což vyzdvihuje roli různých srdečních substruktur (patrně i SA a AV uzlu či baze srdce) jako vhodnějších kandidátů, ve kterých je výhodnější sledovat dávkovou distribuci (viz dále) [15,23].
Anatomie a fyziologie převodního systému
Srdce si samo vytváří elektrické impulsy (vzruchy) pro svou činnost, které jsou následně vedeny převodním systémem. Převodní systém je tvořen specializovanými kardiomyocyty a začíná v sinoatriálním (SA) uzlu lokalizovaném v myokardu pravé síně mezi ústím horní duté žíly a pravého ouška na crista terminalis. Jelikož má z celého systému nejvyšší frekvenci generace impulzů (spontánní depolarizace zde probíhá nejrychleji), tak udává rytmus celému převodnímu systému. Označuje se také jako primární pacemaker. Má zakřivený tvar a jeho rozměry jsou přibližně odhadovány na délku kolem 15 mm a šířku 3–7 mm [41].
Vzruch je veden z SA uzlu mezisíňovými spojeními do levé síně a do atrioventrikulárního (AV) uzlu nacházejícího se v dolní části pravé síně na rozhraní síní a komor. AV uzel vzruch zpomaluje a předává ho do Hisova svazku. AV uzel a horní část Hisova svazku se označují jako AV junkce (atrioventrikulární junkce, spojení mezi síněmi a komorami). Hisův svazek sestupuje mezikomorovým septem a dělí se v něm na Tawarova raménka (pravé a levé), které běží k hrotu srdce (apexu). Tam se větví do Purkyňových vláken, které se rozbíhají ke všem buňkám pracovního myokardu komor. Tím je zajištěna koordinovaná kontrakce myokardu komor.
Z vnějšího pohledu na srdci rozeznáváme srdeční bazi (basis cordis, v angl. base of the heart) a srdeční hrot (apex). Baze srdce je kraniální část se síněmi, vystupují z ní tepny. Apex je uložen kaudálně, vpředu a laterálně.
Obr. 1. Anatomie převodního systému srdce, pohled zepředu, koronární řez . Upraveno podle [59]. ![Anatomie převodního systému srdce, pohled zepředu, koronární řez . Upraveno podle [59].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f6691f8725afa4b709f1f2a41b55c5c1.png)
Patofyziologie poškození a heterogenita kardiotoxicity
Hlavní a asi nejznámější konečný důsledek poradiačního poškození je tkáňová fibróza. Tento patologický mechanizmus se uplatňuje v tkáních napříč lidským tělem, srdce nevyjímaje. Můžeme ho stručně charakterizovat tak, že expozice tkáně radiaci vede k poškození endoteliálních buněk, což následně vede k mikrovaskulární dysfunkci a fibróze [21]. V rámci tohoto procesu byly objeveny různé cesty, které k onomu konečnému výsledku – fibróze – vedou. Hlavní a asi nejsilnější cesta představuje nastolení zánětlivé odpovědi: poradiační poškození endotelií vede k vazodilataci a zvýšené permeabilitě cév, což spolu se sekrecí růstových faktorů vede k atrahování buněk imunitního systému (hlavně neutrofilů). V tomto prostředí jsou v akutní fázi sekretovány prozánětlivé cytokiny (TNF a interleukiny) a v pozdější fázi v rámci hodin i cytokiny profibrotické (TGF-b, bFGF, IGF). Toto prostředí je silný iniciátor fibrózy [42], neboť vede k předčasné konečné diferenciaci progenitorových fibroblastů na fibrocyty, které jsou více aktivní v produkci kolagenu [43]. Další profibrotická cesta je chronický oxidativní stres vedoucí k produkci volných radikálů nebo chronická hypoxie kvůli mikrovaskulárnímu poškození vedoucí k up regulaci, tzv. hypoxia inducible factor a (HIFI-a) rovněž stimulující profibrotický mediátor TGF-b [42]. Jelikož tyto mechanizmy se objevují napříč tkáněmi, můžeme se domnívat, že v poškození převodního systému srdce bude hrát fibróza (a tedy tkáňová remodelace) velkou roli [21,44].
K tomu je zajímavé zmínit práce zaměřující se na RT jako experimentální metodu k léčbě komorové tachykardie [22,45]. U pacientů, kteří podstoupili stereotaktickou RT (stereotactic body radiotherapy – SBRT) v jednorázové dávce 25 Gy na oblast arytmogenního substrátu způsobujícího komorovou tachykardii, bylo pozorováno signifikantní a trvalé snížení výskytu epizod této arytmie [45]. Přesný patofyziologický mechanizmus zatím zůstává nejasný, bude ale pravděpodobně multifaktoriální a bude zahrnovat apoptózu a vaskulární poškození vedoucí k buněčné smrti z důvodu ischemie. Zhang et al. [22] ve své studii na myších modelech studovali mechanizmus, kde jednorázová dávka 25 Gy způsobila obnovení elektrického vedení v patologické srdeční tkáni, aniž by se stačila vytvořit fibrózní léze, resp. jizva. Tento proces byl označen jako přeprogramování elektrického vedení. V jeho pozadí bude stát patrně aktivace signalizační dráhy Notch, která hraje zásadní úlohu při vývoji převodního systému.
Střední dávka (Dmean) na srdce, lokalizace nejradiosenzitivnějšího srdečního regionu, srdeční baze a korelace s převodním systémem
Predikcemi kardiologické mortality a morbidity založené na Dmean se již zabývala celá řada prací [46–50]. Van Nimwegen et al. popisují lineární nárůst rizika ischemické choroby srdeční (ICHS) v závislosti na rostoucí Dmean na srdce. Dmean na srdce o hodnotě 20 Gy při RT mediastina pro Hodgkinův lymfom zde vedla k 2,5násobnému zvýšení rizika ICHS [49]. K podobným závěrům dospěla práce sledující dětské pacienty s různými nádory oproti kontrolní skupině, v níž byla zařazena jejich dvojčata. Dmean ≥ 15 Gy zvýšila relativní riziko srdečního selhání, infarktu myokardu, onemocnění perikardu či patologií chlopní 2–6× ve srovnání s přeživšími dvojčaty bez ozáření [46]. Zatím nemnoho studií zkoumalo predikci vzniku kardiotoxicity v souvislosti s dávkou na určité srdeční substruktury [51]. Van Nimwegen et al. prokázali vztah mezi vzrůstající Dmean na levou komoru a zvýšeným rizikem srdečního selhání [52]. Hahn et al. zase prokázali vztah mezi V20 ramus circumflexus levé koronární tepny a vznikem ischemických srdečních příhod [53] a Cutter et al. uvádějí spojitost vyšších dávek na mitrální chlopeň s rizikem mitrálních vad [54].
S jakou srdeční substrukturou bude Dmean na srdce korelovat, závisí na zvolené ozařovací technice. Více konformní techniky (např. protonová RT) vedou k heterogenní dávkové distribuci napříč srdcem, což vede k nízké korelaci mezi Dmean na srdce a dávkou na srdeční oddíly. Např. při RT Hodgkinova lymfomu technikou involved-site radiotherapy (ISRT) + 3D konformační RT (three-dimensional conformal radiation therapy – 3D-CRT) vykazovalo Dmean na srdce velmi silnou korelaci s levou i pravou komorou, levou síní a mitrální i trikuspidální chlopní. Oproti tomu při použití techniky ISRT + protonové RT Dmean na srdce nevykazovala tato velmi silnou korelaci s žádnou srdeční substrukturou. Vykazovala nižší (stále ale hodnoceno jako silnou) korelaci pouze s levou komorou [51].
Srdce je vysoce heterogenní orgán, co se týče struktury jeho jednotlivých podjednotek i jejich funkce. Doposud se tato skutečnost bere v potaz s tím, že vedle dávky na srdce jako celek (resp. Dmean) se sledují i dávky do těchto jednotlivých struktur jako jednotlivých rizikových orgánů (chlopně, síně, komory, koronární arterie). Nicméně převodní systém srdeční není zatím jako rizikový orgán (organ at risk) rutinně sledován [7]. Přitom jeho specifická histologická povaha (specializované kardiomyocyty) a funkce napovídají, že jeho citlivost a odpověď na záření bude pravděpodobně odlišná.
Srdeční baze – nejradiosenzitivnější oblast?
Existují studie pokoušející se najít nejradiosenzitivnější srdeční region. Velmi zajímavý přístup k vyřešení této otázky můžeme sledovat u studií a analýz McWilliama et al. [12–15], které jako nejradiosenzitivnější identifikovaly srdeční bazi. Tým pak tento region ve své nejnovější analýze přesněji lokalizoval a zúžil pomocí tzv. voxel-based analýzy a statistickými metodami [15] na oblast kolem SA uzlu a odstupu levé koronární arterie. Zmíněná oblast v srdeční bazi měla silnější asociaci s celkovým přežitím než rutinně sledované parametry V5 a V30 pro celé srdce (ty jsou však také spojeny s horším přežitím) [55]. Jejich práce je založena na analýze výsledků studie RTOG 0617, což byla otevřená randomizovaná studie fáze III sledující pacienty s neresekabilním NSCLC stadia 3. Tito pacienti byli v RTOG 0617 rozděleni do dvou ramen: rameno se standartní dávkou 60 Gy a high-dose rameno s dávkou 74 Gy. Výsledkem bylo paradoxně horší celkové přežití u high-dose ramena. Analýza McWilliama et al. dochází k závěru, že horší celkové přežití je dáno právě dávkou do regionu v srdeční bazi: po zahrnutí tohoto regionu do multivariabilní analýzy totiž vymizel „škodlivý“ efekt high-dose ramena.
Zmíněné závěry o klíčovém postavení srdeční baze potvrzují i další studie. Liu et al. [18] vyvinuli výpočetní algoritmus založený na 3D dávkové distribuci, který lokalizoval onen nejsenzitivnější region do pravé horní části srdce. Ve starší analýze Williams et al. [14] sloučili tři substruktury (pravou síň, pravou koronární arterii a vzestupnou aortu) a dohromady je identifikovali jako region s největším dopadem na přežití. Stam et al. [56] zase u pacientů s NSCLC po SBRT označili jako nejrizikovější oblast levou horní část srdce – levou síň (Dmax) a horní dutou žílu (V90 %), které byly signifikantně asociovány s mortalitou z neonkologického důvodu. Obě dvě studie se ale topicky shodují na významu srdeční baze (horní zadní části srdce), a tedy i místa začátku převodního systému.
Hypotézu ohledně citlivosti tohoto regionu dokazuje také preklinická studie Ghita et al. [16], v rámci které byla skupinám myší ozářena buď srdeční baze, střední část srdce, nebo apex. Skupina myší s ozářenou srdeční bazí vykazovala signifikantně vyšší funkční změny než zbylé dvě skupiny.
Na druhou stranu pro úplnost je třeba zmínit ojedinělou studii, která dochází k protichůdnému závěru. Wong et al. [57] odhalili v rámci multivariabilní analýzy pacientů s NSCLC po SBRT korelaci Dmax na komory a mortality z neonkologického důvodu. Připomeňme, že jednotlivé studie se liší nejen ve sledované skupině pacientů (stadium, věk, metoda RT), ale i ve své metodologii: parametry dávkového rozložení mohou být zjištěny buď po deformabilní registraci (tj. po registraci snímků pacienta na „average anatomy“ v plánovacím systému [56]), nebo manuální konturací každého pacienta [57] či rozličnými metodami pomocí specifických výpočetních algoritmů [15,18]. Z toho důvodu samozřejmě absolutní shoda mezi nimi není možná.
SA a AV uzel jako nový rizikový orgán
Výše zmíněné skutečnosti dokládají radiosenzitivitu srdeční baze. Tato anatomická oblast zahrnuje zadní horní část srdce se síněmi a nachází se v ní nebo k ní mají těsný vztah SA uzel a AV uzel – hlavní části převodního systému. Na první pohled jasná implikace, že expozice těmto dvěma převodním strukturám je asociována se signifikantním rizikem, je nicméně stále na úrovni hypotézy [9]. Jako první práce k jejímu potvrzení ale jmenujme např. studii autorů Kim et al. [19], v níž vyšší dávka na SA uzel u pacientů s karcinomem plic byla asociována s vyšší incidencí fibrilace síní a horším celkovým přežitím. Jiná alterace sinusového rytmu vycházejícího z SA uzlu byla zase zaznamenána v práci Qiana et al. [20]. Zde bylo popsáno rozvinutí symptomatického sick sinus syndromu vyžadující pacemaker u pacientky s NSCLC 6 měsíců po stereotaktické ablační RT (SABR).
S jednoduchou a názornou metodou, jak konturovat SA a AV uzel, a zařadit je tak do plánování, přišli Loap et al. ve svém Cardiac conduction node delineation atlas publikovaném v roce 2021 [8]. SA uzel se nakonturuje jako koule o průměru 2 cm, jejíž střed leží na rozhraní vena cava superior a ouška pravé síně v úrovni prvního CT řezu, kde je aorta plně oddělená od levé komory. AV uzel je zase ve výšce 1 cm nad prvním řezem, kde se objeví levá síň. Jeho kontura má opět tvar koule s průměrem 2 cm a se středem na rozhraní srdečních oddílů (obr. 2).
Obr. 2. Příklad konturace sinoatriálního (SA) a atrioventrikulárního (AV) uzlu. A, B) axiální snímky; C) frontální snímek; D) prostorové zobrazení. 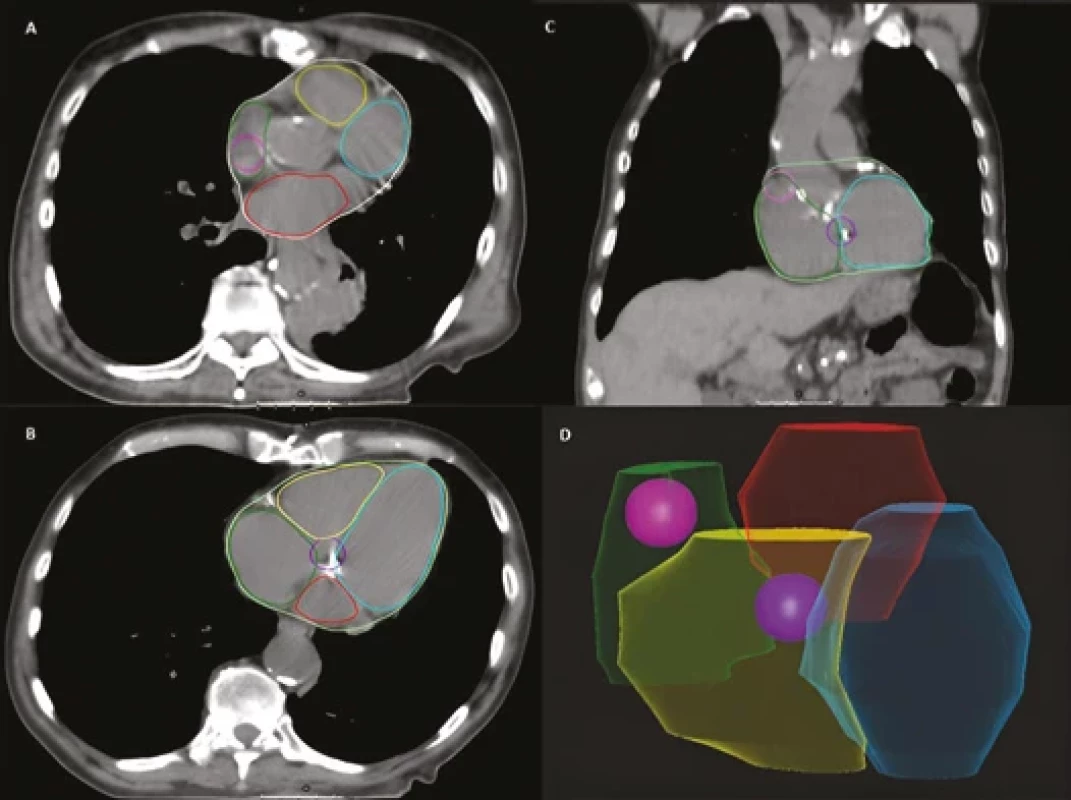
Růžová barva – SA uzel, fialová – AV uzel, modrá – levá komora, žlutá – pravá komora, zelená – pravá síň, červená – levá síň. RayStation® Clinical system (12A SP1). Pořízeno v Proton Therapy Center Czech s.r.o. 2. 12. 2023. Náhradní struktura za SA a AV uzel – pravá síň
Nejčastěji používaný dozimetrický parametr u srdce Dmean má limitace, co se týče předpovědi dávky na SA a AV uzel, a tedy pravděpodobně i co se týče arytmogenní toxicity [9]. Existují práce, které se proto snaží za SA a AV uzel najít ideální náhradní strukturu, která bude dávkově korelovat. SA uzel leží ve stěně pravé síně, a tak nepřekvapí, že právě tento srdeční oddíl by mohl být vhodným kandidátem. Na tomto závěru se shodují již citované práce ověřující tuto skutečnost u pacientů s karcinomem mammy [9] a karcinomem plic [19]. U prvně jmenované práce dávka na pravou síň dobře korelovala s dávkou na SA uzel při RT levé i pravé mammy. Za AV uzel pak byla pravá síň dobrá náhrada jen v případě RT levostranného onemocnění. Druhá studie dochází ke stejnému závěru – byla nalezena silná korelace mezi Dmax na SA uzel a Dmax na pravou síň, kdy obě dvě hodnoty byly asociovány s vyšší incidencí fibrilace síní i horším celkovým přežitím.
Dávky na převodní struktury
V současné době nejsou stanoveny a všeobecně přijaty jasné dávkové limity na převodní struktury (respektive pro SA a AV uzel) [7]. Zároveň není ani jisté, zda má v tomto případě vyšší vypovídající hodnotu Dmean, či Dmax. Hypoteticky se ale můžeme domnívat, že vhodnější bude právě Dmax, neboť převodní systém již ze své povahy vykazuje určitý charakter sériového zapojení. To naznačuje i již zmíněná práce autorů Williams et al. [14], kdy jako signifikantní hodnota pro vznik toxicity byla zjištěna právě Dmax.
Tab. 3. Porovnání naměřených dávek na SA a AV uzel u radioterapie pro karcinom prsu. 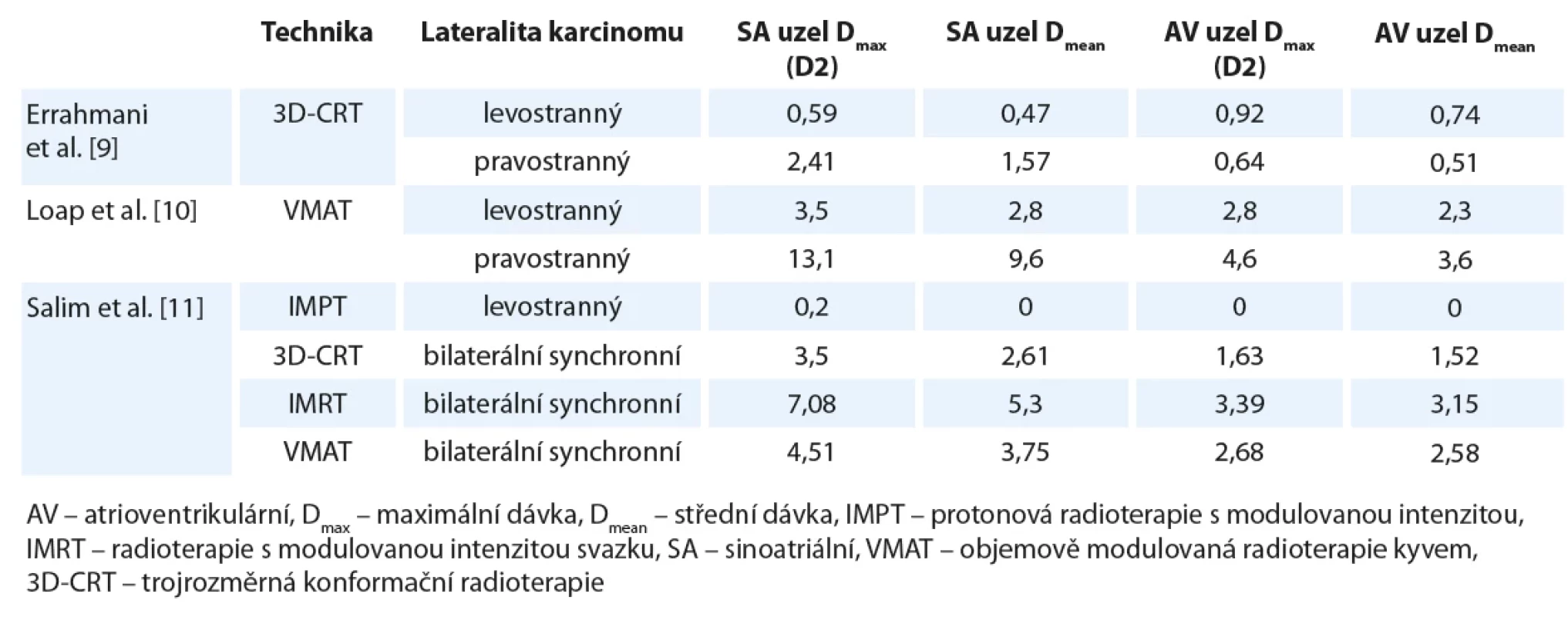
Dávky jsou uvedeny v Gy. Errahmani et al. [9] stejně jako Loap et al. [10] pozorují signifikantně vyšší dávku na SA uzel u pravostranné radioterapie. Salim et al. [11] u pacientek s bilaterálním synchronním ca mammy zase prokazuje nejvyšší dávky na převodní uzly u techniky IMRT. Druhé nejvyšší poté vykazuje technika VMAT a nejnižší dávky jsou u 3D-CRT, ačkoliv mezi těmito dvěma posledními jsou rozdíly nesignifikantní. Dle Loap et al. můžeme dále doplnit IMPT, u které se tyto dávky u radioterapie pro karcinom prsu blíží nule. Tab. 4. Porovnání techniky VMAT s technikou IMPT při radioterapii Hodgkinova lymfomu. 
Dávky jsou uvedeny v Gy. Dozimetrickou výhodu protonové terapie stran převodního systému popsala studie od Loap et al. [7], a to u 30 pacientů s Hodgkinovým lymfomem podstupujících konsolidativní radioterapii celkovou dávkou 30 Gy. Byla porovnána protonová technika IMPT s technikou VMAT, přičemž u IMPT byla dokázána signifikantně nižší dávka (téměř nulová) na SA a AV uzel. Studie vychází však z retrospektivního replanningu, kdy SA a AV uzel nebyly zahrnuty mezi kritické orgány. Není tedy jisté, zda v případě jejich zahrnutí do kritických orgánů, by se technikami IMRT/VMAT nedalo dosáhnout rovněž nízkých dávek. Tab. 5. Dávky u SABR/SBRT pro nemalobuněčný karcinom plic. 
Dávky jsou uvedeny v Gy. Qian et al. pozoroval na 47 pacientech po SABR pro nemalobuněčný karcionom plic v režimu 40–50 Gy v 4–5 frakcích průměrnou Dmax na SA uzel 26,3 Gy a Dmean 20,6 Gy. Jedna pacientka s Dmax = 44,8 Gy (třetí nejvyšší ve sledované skupině) vyvinula symptomatický sick sinus syndrom vyžadující implantaci pacemakeru. Paradoxně o jeden řád nižší dávky uvádí Wong et al. [57]. Opět se jedná o SABR (v režimu 54 Gy / 3 frakce, 48 Gy / 4 frakce, 60 Gy / 8 frakcí) na vzorku 189 pacientů s nemalobuněčným karcinomem plic. Tato diskrepance může být nejspíše vysvětlena jinou metodou konturace SA uzlu, kdy objem kontury SA uzlu se mezi pracemi významně liší. Dozimetrické studie
Pro přehled uveďme dozimetrické studie sledující dávku na převodní systém u RT pro karcinom prsu. V tab. 3 je porovnání naměřených dávek na SA a AV uzel u tří studií za použití různých ozařovacích technik. Errahmani et al. [9] stejně jako Loap et al. [10] pozorují signifikantně vyšší dávku na SA uzel u pravostranné RT. Salim et al. [11] u pacientek s bilaterálním synchronním karcinomem mammy zase prokazují nejvyšší dávky na převodní uzly u RT s modulovanou intenzitou svazku (intensity modulated radiotherapy – IMRT). Druhé nejvyšší poté vykazuje technika objemově modulované RT kyvem (volumetric modulated arc therapy – VMAT) a nejnižší dávky jsou u 3D-CRT, ačkoliv mezi těmito dvěma posledními technikami jsou rozdíly nesignifikantní. Nutno zmínit, že techniky IMRT/ VMAT nejsou ale pro RT prsu zcela standardní. Dle Loapa et al. můžeme dále do tohoto porovnání doplnit protonovou RT s modulovanou intenzitou (intensity-modulated proton therapy – IMPT), u které se tyto dávky u RT pro karcinom prsu blíží nule. Na uvedených číslech se dá pozorovat, že dávky na SA a AV uzel u RT karcinomu prsu u všech zmíněných technik nabývají relativně nízkých hodnot.
Dozimetrickou výhodu protonové terapie stran převodního systému popsala další studie od Loapa et al. [7], a to u 30 pacientů s Hodgkinovým lymfomem podstupujících konsolidativní RT celkovou dávkou 30 Gy. Byla porovnána protonová technika IMPT s technikou VMAT, přičemž u IMPT byla dokázána signifikantně nižší dávka (téměř nulová) na SA a AV uzel (tab. 4). Studie však vychází z retrospektivního replanningu, kdy SA a AV uzel nebyly zahrnuty mezi kritické orgány. Není tedy jisté, zda v případě jejich zahrnutí do kritických orgánů by se technikami IMRT/ VMAT nedalo dosáhnout rovněž nízkých dávek. Za tímto účelem by bylo potřebné prospektivní ověření. Dopad a pravý význam této dozimetrické výhody bude nutné dále ověřit v rámci komplexní léčby s kohortou pacientů, kteří RT
vynechali.Dávkové limity
Vedle RT pro karcinom prsu byly dávky na SA uzel zatím hodnoceny hlavně u RT pro plicní nádory. S hodnotou limitu (cut-off) pro maximální dávku na SA uzel přišla studie autorů Kim et al. [19]. Nejedná se primárně o studii dozimetrickou, ale o studii retrospektivně zkoumající kohortu 321 pacientů s NSCLC a 239 pacientů s malobuněčným karcinomem plic (small cell lung cancer – SCLC) po chemoradioterapii. Byla aplikována konvenční frakcionace, tj. celková dávka 60–63 Gy / 1,8–2,1 Gy na frakci. Pro obě kohorty byla vypozorována Dmax na SA uzel, při jejímž překročení signifikantně rostla incidence fibrilace síní a mortalita. Limit Dmax byl u kohorty s NSCLC stanoven na 20,0 Gy a u kohorty s SCLC na 53,5 Gy. Tento více než dvojnásobný rozdíl autoři vysvětlují rozdílným chemoterapeutickým režimem u obou kohort a vyslovují podezření na arytmogenní efekt paklitaxelu u NSCLC. Povšimněme si, že i tak jsou obě hodnoty limitu vysoce nad hodnotami z dozimetrických studií u jiných diagnóz uvedených v tab. 3 a 4. Jiná studie s NSCLC a konvenční frakcionací referuje o sedmi pacientech, kteří rozvinuli akutní arytmogenní toxicitu při hodnotách SA Dmax 32–69 Gy a SA Dmean 17–68 Gy. Byla pozorována fibrilace síní (4×), dále AV blok Mobitz Typ II, multifokální síňová tachykardie a flutter síní (každý po jednom) [58].
Dozimetrie SA uzlu byla u RT plic ovšem sledována i v rámci jiného léčebného konceptu než standartní frakcionace, a sice u pacientů po SABR v režimu 40–50 Gy v 4–5 frakcích [20]. V této studii na 47 pacientech Qian et al. pozorovali průměrnou Dmax na SA uzel 26,3 Gy a Dmean 20,6 Gy. Jedna pacientka s Dmax 44,8 Gy (třetí nejvyšší ve sledované skupině) vyvinula symptomatický sick sinus syndrom vyžadující implantaci pacemakeru. Paradoxně o jeden řád nižší dávky uvádějí Wong et al. (tab. 5) [57]. Opět se jedná o SABR (v režimu 54 Gy / 3 frakce, 48 Gy / 4 frakce, 60 Gy / 8 frakcí) na vzorku 189 pacientů s NSCLC. Tato diskrepance může být nejspíše vysvětlena jinou metodou konturace SA uzlu, kdy objem kontury SA uzlu mezi pracemi se významně liší (1,5 cm3 vs. cca 0,2–0,6 cm3). K tomu ješte dodejme, že dle nejnovějšího konturovacího altasu od Loap et al. [8] se uzly konturují jako koule o průměru 2 cm, tj. o objemu cca 4,2 cm3. Z tohoto důvodu je porovnávání naměřených dávek mezi studiemi velmi obtížné a je nutno zohlednit zvolený konturovací přístup.
Prahovou hodnotu se snažili stanovit u pacientů s NSCLC i Williams et al. v již zmíněné analýze [14], nikoliv ale u SA/ AV uzlu. Jako nejradiosenzitivnější oblast označili ve své starší práci kombinaci tří srdečních subregionů (pravá síň, pravá koronární arterie, vzestupná aorta). Právě pro tuto sloučenou oblast byl limit Dmax stanoven na 19,5 Gy (v přepočtu na ekvivalentní dávku (equivalent dose – EQD) ve frakcích po 2 Gy pak EQD2 dosahuje 23 Gy). V nejnovější studii pak Williams et al. [15] nejradiosenzitivnější region v bazi srdce (viz 4.1) ještě více zúžil a medián dávky zde dosahoval 9,5 Gy. Připoměňme, že v obou těchto deklarovaných regionech anatomicky leží SA uzel.
Závěr
Kardiotoxicita jako nežádoucí účinek RT významně ovlivňuje morbiditu a mortalitu. Největšího významu pak nabývá u pacientů po RT pro plicní nádory, mediastinální lymfomy či karcinom prsu. Doposud se pozornost zaměřovala spíše na vliv RT na koronární tepny, na strukturální poškození myokardu, chlopní aj. V poslední době se ovšem dostává do popředí zájem o vliv na převodní systém srdeční, tj. arytmogenní toxicita. Srdce je heterogenní, co se týče radiosenzitivity. Určité srdeční subregiony tak v dávkové distribuci vykazují vyšší korelaci s horším celkovým přežitím než rutinně sledované dávky na srdce jako celek a od nich odvozené parametry (V5, V30). Jako nejradiosenzitivnější subregiony byly označeny oblasti srdeční baze, tj. i oblast začátku převodního systému. Vyšší dávky na převodní systém (zejména SA uzel) jsou pak opět asociovány s vyšší incidencí širokého spektra arytmií a s horším celkovým přežitím. Tyto arytmie jsou často již ze své podstaty život ohrožující nebo vedou ke zhoršení kvality
života.Doporučené dávkové limity (Dmean a Dmax) na převodní systém nebyly doposud stanoveny, a to hlavně kvůli nedostatku dat a neexistenci NTCP modelů. Existují první dozimetrické studie a práce stanovující limity dávek na SA uzel, po kterém byl na sledovaném vzorku pacientů zaznamenán signifikantní nárůst mortality a arytmií. Stejně tak byl publikován konturační atlas pro jednotné zakreslování SA a AV uzlu jako nových rizikových orgánů při
plánování RT.Poděkování
Za poznámky a postřehy bych chtěl upřímně poděkovat panu profesoru MU Dr. Tomáši Büchlerovi, Ph.D. Jeho odborná zpětná vazba byla cenným příspěvkem k tomuto článku.
MUDr. Martin Domanský
Onkologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: martin.domansky@fnmotol.czObdrženo/Submitted: 1. 10. 2023
Přijato/Accepted: 14. 12. 2023
Zdroje
1. Atkins KM, Chaunzwa TL, Lamba N et al. Association of left anterior descending coronary artery radiation dose with major adverse cardiac events and mortality in patients with non-small cell lung cancer. JAMA Oncol 2021; 7(2): 206–219. doi: 10.1001/ jamaoncol.2020.6332.
2. Yegya-Raman N, Wang K, Kim S et al. Dosimetric predictors of symptomatic cardiac events after conventional-dose chemoradiation therapy for inoperable NSCLC. J Thorac Oncol 2018; 13(10): 1508–1518. doi: 10.1016/
j.jtho.2018.05.028.3. Jang BS, Cha MJ, Kim HJ et al. Heart substructural dosimetric parameters and risk of cardiac events after definitive chemoradiotherapy for stage III non-small cell lung cancer. Radiother Oncol 2020; 152 : 126–132. doi: 10.1016/ j.radonc.2020.09.050.
4. Atkins KM, Rawal B, Chaunzwa TL et al. Cardiac radiation dose, cardiac disease, and mortality in patients with lung cancer. J Am Coll Cardiol 2019; 73(23): 2976–2987. doi: 10.1016/ j.jacc.2019.03.500.
5. Jaworski C, Mariani JA, Wheeler G et al. Cardiac complications of thoracic irradiation. J Am Coll Cardiol 2013; 61(23): 2319–2328. doi: 10.1016/ j.jacc.2013.01.090.
6. Adams MJ, Lipshultz SE, Schwartz C et al. Radiation-associated cardiovascular disease: manifestations and management. Semin Radiat Oncol 2003; 13(3): 346–356. doi: 10.1016/ S1053-4296(03)00026-2.
7. Loap P, Mirandola A, De Marzi L et al. Cardiac conduction system exposure with modern radiotherapy techniques for mediastinal Hodgkin lymphoma irradiation. Acta Oncol 2022; 61(4): 496–499. doi: 10.1080/ 0284 186X.2021.2025265.
8. Loap P, Servois V, Dhonneur G et al. A radiation therapy contouring atlas for cardiac conduction node delineation. Pract Radiat Oncol 2021; 11(4): e434–e437. doi: 10.1016/
j.prro.2021.02.002.9. Errahmani MY, Locquet M, Broggio D et al. Supraventricular cardiac conduction system exposure in breast cancer patients treated with radiotherapy and association with heart and cardiac chambers doses. Clin Transl Radiat Oncol 2022; 38 : 62–70. doi: 10.1016/ j.ctro.2022.10.015.
10. Loap P, Fourquet A, Kirova YM. Evaluation of cardiac conduction system exposure with breast volumetric modulated arc therapy and intensity modulated proton therapy. Int J Radiat Oncol Biol Phys Volume 2021; 111(3): e224. doi: 10.1016/ j.ijrobp.2021.07.773.
11. Salim N, Popodko A, Tumanova K et al. Cardiac dose in the treatment of synchronous bilateral breast cancer patients between three different radiotherapy techniques (VMAT, IMRT, and 3D CRT). Discov Oncol 2023; 14(1): 29. doi: 10.1007/ s12672-023-00636-z.
12. McWilliam A, Kennedy J, Hodgson C et al. Radiation dose to heart base linked with poorer survival in lung cancer patients. Eur J Cancer 2017; 85 : 106–113. doi: 10.1016/ j.ejca.2017.07.053.
13. McWilliam A, Dootson C, Graham L et al. Dose surface maps of the heart can identify regions associated with worse survival for lung cancer patients treated with radiotherapy. Phys Imaging Radiat Oncol 2020; 15 : 46–51. doi: 10.1016/ j.phro.2020.07.002.
14. McWilliam A, Khalifa J, Vasquez Osorio E et al. Novel methodology to investigate the effect of radiation dose to heart substructures on overall survival. Int J Radiat Oncol Biol Phys 2020; 108(4): 1073–1081. doi: 10.1016/
j.ijrobp.2020.06.031.15. McWilliam A, Abravan A, Banfill K et al. Demystifying the tesults of RTOG 0617: identification of dose sensitive cardiac subregions associated with overall survival. J Thorac Oncol 2023; 18(5): 599–607. doi: 10.1016/
j.jtho.2023.01.085.16. Ghita M, Gill EK, Walls GM et al. Cardiac sub-volume targeting demonstrates regional radiosensitivity in the mouse heart. Radiother Oncol 2020; 152 : 216–221. doi: 10.1016/ j.radonc.2020.07.016.
17. Stam B, Peulen H, Guckenberger M et al. Dose to heart substructures is associated with non-cancer death after SBRT in stage I-II NSCLC patients. Radiother Oncol 2017; 123(3): 370–375. doi: 10.1016/ j.radonc.2017.04.017.
18. Liu X, Fatyga M, Schild SE et al. Detecting spatial susceptibility to cardiac toxicity of radiation therapy for lung cancer. IISE Trans Healthc Syst Eng 2020; 10(4): 243–250. doi: 10.1080/ 24725579.2020.1795012.
19. Kim KH, Oh J, Yang G et al. Association of sinoatrial node radiation dose with atrial fibrillation and mortality in patients with lung cancer. JAMA Oncol 2022; 8(11):
1624–1634. doi: 10.1001/ jamaoncol.2022.4202.20. Qian Y, Zhu H, Pollom EL et al. Sinoatrial node toxicity after stereotactic ablative radiation therapy to lung tumors. Pract Radiat Oncol 2017; 7(6): e525–e529. doi: 10.1016/ j.prro.2017.04.005.
21. Taunk NK, Haffty BG, Kostis JB et al. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol 2015; 5 : 39. doi: 10.3389/ fonc.2015.00039.
22. Zhang DM, Navara R, Yin T et al. Cardiac radiotherapy induces electrical conduction reprogramming in the absence of transmural fibrosis. Nat Commun 2021; 12(1): 5558. doi: 10.1038/ s41467-021-25730-0.
23. Ellahham S, Khalouf A, Elkhazendar M et al. An overview of radiation-induced heart disease. Radiat Oncol J 2022; 40(2): 89–102. doi: 10.3857/ roj.2021.00766.
24. Lancellotti P, Nkomo VT, Badano LP et al. Expert consensus for multi-modality imaging evaluation of cardiovascular complications of radiotherapy in adults: a report from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging 2013; 14(8): 721–740. doi: 10.1093/ ehjci/ jet123.
25. Boero IJ, Paravati AJ, Triplett DP et al. Modern radiation therapy and cardiac outcomes in breast cancer. Int J Radiat Oncol Biol Phys 2016; 94(4): 700–708. doi: 10.1016/ j.ijrobp.2015.12.018.
26. Boekel NB, Schaapveld M, Gietema JA et al. Cardiovascular disease risk in a large, population-based cohort of breast cancer survivors. Int J Radiat Oncol Biol Phys 2016; 94(5): 1061–1072. doi: 10.1016/ j.ijrobp.2015.11.040.
27. Yusuf SW, Venkatesulu BP, Mahadevan LS et al. Radiation-induced cardiovascular disease: a clinical perspective. Front Cardiovasc Med 2017; 4 : 66. doi: 10.3389/ fcvm.2017.00066.
28. Vivekanandan S, Landau DB, Counsell N et al. The impact of cardiac radiation dosimetry on survival after radiation therapy for non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2017; 99(1): 51–60. doi: 10.1016/
j.ijrobp.2017.04.026.29. McWilliam A, Vasquez Osorio E, Faivre-Finn C et al. Influence of tumour laterality on patient survival in non-small cell lung cancer after radiotherapy. Radiother Oncol 2019; 137 : 71–76. doi: 10.1016/ j.radonc.2019.04.
022.30. Aleman BM, van den Belt-Dusebout AW, Klokman WJ et al. Long-term cause-specific mortality of patients treated for Hodgkin‘s disease. J Clin Oncol 2003; 21(18): 3431–3439. doi: 10.1200/ JCO.2003.07.131.
31. Swerdlow AJ, Higgins CD, Smith P et al. Myocardial infarction mortality risk after treatment for Hodgkin disease: a collaborative British cohort study. J Natl Cancer Inst 2007; 99(3): 206–214. doi: 10.1093/ jnci/ djk029.
32. Lyon AR, López-Fernández T, Couch LS et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J 2022; 43(41): 4229–4361. doi: 10.1093/ eurheartj/ ehac244.
33. Yusuf SW, Sami S, Daher IN. Radiation-induced heart disease: a clinical update. Cardiol Res Pract 2011; 2011 : 317659. doi: 10.4061/ 2011/ 317659.
34. Lakshminarayan K, Anderson DC, Herzog CA et al. Clinical epidemiology of atrial fibrillation and related cerebrovascular events in the United States. Neurologist 2008; 14(3): 143–150. doi: 10.1097/ NRL.0b013e31815c
ffae.35. Koutroumpakis E, Palaskas NL, Lin SH et al. Modern radiotherapy and risk of cardiotoxicity. Chemotherapy 2020; 65(3–4): 65–76. doi: 10.1159/ 000510573.
36. Adams MJ, Lipsitz SR, Colan SD et al. Cardiovascular status in long-term survivors of Hodgkin‘s disease treated with chest radiotherapy. J Clin Oncol 2004; 22(15):
3139–3148. doi: 10.1200/ JCO.2004.09.109.37. Wang H, Wei J, Zheng Q et al. Radiation-induced heart disease: a review of classification, mechanism and prevention. Int J Biol Sci 2019; 15(10): 2128–2138. doi: 10.7150/ ijbs.35460.
38. Trapani G, Quartuccio S, Dalbeni A et al. Late radiation-induced cardiac conduction system abnormalities. Int J Cardiol 2014; 173(3): e40–e41. doi: 10.1016/ j.ijcard.2014.03.125.
39. Nakao T, Kanaya H, Namura M et al. Complete atrioventricular block following radiation therapy for malignant thymoma. Jpn J Med 1990; 29(1): 104–110. doi: 10.2169/ internalmedicine1962.29.104.
40. Bates J, Shrestha S, Liu Q et al. Cardiac substructure dosimetry and late cardiac arrhythmia in the Childhood Cancer Survivor Study. Radiot Oncol 2021; 161 (Suppl 1): S140–S141.
41. Csepe TA, Zhao J, Hansen BJ et al. Human sinoatrial node structure: 3D microanatomy of sinoatrial conduction pathways. Prog Biophys Mol Biol 2016; 120(1–3):
164–178. doi: 10.1016/ j.pbiomolbio.2015.12.011.42. Yarnold J, Brotons MC. Pathogenetic mechanisms in radiation fibrosis. Radiother Oncol 2010; 97(1): 149–161. doi: 10.1016/ j.radonc.2010.09.002.
43. Rodemann HP, Peterson HP, Schwenke K et al. Terminal differentiation of human fibroblasts is induced by radiation. Scanning Microsc 1991; 5(4): 1135–1142; discussion 1142–1143.
44. Cohen SI, Bharati S, Glass J et al. Radiotherapy as a cause of complete atrioventricular block in Hodgkin‘s disease. An electrophysiological-pathological correlation. Arch Intern Med 1981; 141(5): 676–679.
45. John RM, Shinohara ET, Price M et al. Radiotherapy for ablation of ventricular tachycardia: assessing collateral dosing. Comput Biol Med 2018; 102 : 376–380. doi: 10.1016/ j.compbiomed.2018.08.010.
46. Mulrooney DA, Yeazel MW, Kawashima T et al. Cardiac outcomes in a cohort of adult survivors of childhood and adolescent cancer: retrospective analysis of the Childhood Cancer Survivor Study cohort. BMJ 2009; 339: b4606. doi: 10.1136/ bmj.b4606.
47. Bates JE, Shrestha S, Liu Q et al. Cardiac substructure radiation dose and risk of late cardiac disease in survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Clin Oncol 2023; 41(22): 3826–3838. doi: 10.1200/ JCO.22.02320.
48. van Nimwegen FA, Ntentas G, Darby SC et al. Risk of heart failure in survivors of Hodgkin lymphoma: effects of cardiac exposure to radiation and anthracyclines. Blood 2017; 129(16): 2257–2265. doi: 10.1182/ blood-2016-09-740332.
49. van Nimwegen FA, Schaapveld M, Cutter DJ et al. Radiation dose-response relationship for risk of coronary heart disease in survivors of Hodgkin lymphoma. J Clin Oncol 2016; 34(3): 235–243. doi: 10.1200/ JCO.2015.63.4444.
50. Maraldo MV, Giusti F, Vogelius IR et al. Cardiovascular disease after treatment for Hodgkin’s lymphoma: an analysis of nine collaborative EORTC-LYSA trials. Lancet Haematol 2015; 2(11): e492–e502. doi: 10.1016/ S2352-3026(15)00153-2.
51. Hoppe BS, Bates JE, Mendenhall NP et al. The meaningless meaning of mean heart dose in mediastinal lymphoma in the modern radiation therapy era. Pract Radiat Oncol 2020; 10(3): e147–e154. doi: 10.1016/ j.prro.2019.09.015.
52. van Nimwegen FA, Ntentas G, Darby SC et al. Risk of heart failure in survivors of Hodgkin lymphoma: effects of cardiac exposure to radiation and anthracyclines. Blood 2017; 129(16): 2257–2265. doi: 10.1182/ blood-2016-09-740332.
53. Hahn E, Jiang H, Ng A et al. Late cardiac toxicity after mediastinal radiation therapy for Hodgkin lymphoma: contributions of coronary artery and whole heart dose-volume variables to risk prediction. Int J Radiat Oncol Biol Phys 2017; 98(5): 1116–1123. doi: 10.1016/ j.ijrobp.2017.03.026.
54. Cutter DJ, Schaapveld M, Darby SC et al. Risk of valvular heart disease after treatment for Hodgkin lymphoma. J Natl Cancer Inst 2015; 107(4): djv008. doi: 10.1093/ jnci/ djv008.
55. Kong FM, Zhao J, Wang J et al. Radiation dose effect in locally advanced non-small cell lung cancer. J Thorac Dis 2014; 6(4): 336–347. doi: 10.3978/ j.issn.2072-1439.2014.01.23.
56. Stam B, Peulen H, Guckenberger M et al. Dose to heart substructures is associated with non-cancer death after SBRT in stage I-II NSCLC patients. Radiother Oncol 2017; 123(3): 370–375. doi: 10.1016/ j.radonc.2017.04.
017.57. Wong OY, Yau V, Kang J et al. Survival impact of cardiac dose following lung stereotactic body radiotherapy. Clin Lung Cancer 2018; 19(2): e241–e246. doi: 10.1016/
j.cllc.2017.08.002.58. Chen V, Song A, Werner-Wasik M et al. Effect of radiation dose to cardiac substructures on the acute development of new arrhythmias following conventionally fractionated radiation treatment to the lung. Int J Radiat Oncol Biol Phys 2019; 105(1): E500. doi: 10.1016/
j.ijrobp.2019.06.1415.59. Lynch PJ, Jaffe CC. Heart anterior view coronal section. [online]. Available from: https://commons.wikimedia.org/wiki/File:Heart_anterior_view_coronal_section.jpg.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2024 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Evropský plán boje proti rakovině a Mise rakovina – co nám přináší?
- Převodní systém srdeční jako nový rizikový orgán v radioterapii
- Střevní mikrobiota a karcinom pankreatu
- Molekulární podstata mnohočetného myelomu
- Evaluation pattern within tumor microenvironment and consequent gene expression in oral cancer
- Analysis of the effect of baseline detection and early clearance of ct-DNA, on survival outcomes among patients with advanced EGFR-mutant non-small cell lung cancer
- Immunohistochemical analysis of CD9, CD29 and epithelial to mesenchymal transition in triple-negative breast cancer
- Klinická zkušenost s kabozantinibem u pacientů s metastatickým karcinomem ledviny
- Léčba závislosti na tabáku u onkologických pacientů
- Pokročilé léčebné strategie metastatického kolorektálního karcinomu a karcinomu pankreatu
- MU Dr. Libor Havel (1967–2023)
- Doc. Ing. Čestmír Altaner, DrSc. oslávil vzácne životné jubileum – 90 rokov
- Poděkování recenzentům
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Molekulární podstata mnohočetného myelomu
- Střevní mikrobiota a karcinom pankreatu
- Analysis of the effect of baseline detection and early clearance of ct-DNA, on survival outcomes among patients with advanced EGFR-mutant non-small cell lung cancer
- Převodní systém srdeční jako nový rizikový orgán v radioterapii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



