-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
ZÁVAŽNÉ NEŽÁDOUCÍ ÚČINKY BIOLOGICKÉ LÉČBY – TUBERKULÓZA
Autoři: K. Šírová
Působiště autorů: Revmatologická ambulance, Ostrava
Vyšlo v časopise: Listy rev. Lék., 11, 2007, č. 1, s. 10-12
Soudržnost buněk a jejich vzájemnou informovanost zajišťují různé buněčné interakce. Mezi nejdůležitější patří uvolňování a přenášení informačních molekul. Signály polypeptidové povahy lze zahrnout do široké skupiny cytokinů. Název cytokiny je obecnějším pojmem pro širokou škálu peptidů s převážně parakrinním a nebo autokrinním působením. Většina cytokinů byla v posledních letech na genovém základě přesně identifikována a některé z nich byly rekombinantní technikou připraveny pro klinické použití [1].
Role cytokinů je popsána v procesu kancerogeneze a s ní související angiogeneze, významnou roli hrají cytokiny i při metastazování nádorů. Cytokiny hrají také důležitou roli v patogenezi zánětlivých onemocnění ledvin, střeva, plic, kloubů, endokrinních systémů...
Proto se také v oblasti biologické léčby setkává řada medicínských oborů a řeší podobnou problematiku léčby a jejich nežádoucích účinků [2].
K nejpodrobněji prozkoumaným autoimunitním chorobám nesporně patří revmatoidní artritida, u které je možno získat s výhodou bioptický materiál v období nejvyšší aktivity zánětu. Cytokiny přítomné v postiženém místě by tak měly mít přímý vztah k aktivitě procesu.
Řada studií prokázala, že v revmatoidní synovii je možno nalézt téměř všechny známé cytokiny. Nepřekvapuje to, protože v zánětem postiženém kloubu jsou přítomny aktivované T lymfocyty, makrofágy, endotelie, fibroblasty a plasmocyty.
Množství cytokinů však nevystihuje vždy jejich význam.
Dosavadní terapie RA (revmatoidní artritidy) pomocí DMARDs (chorobu modifikující léky) má převážně nespecifický imunosupresivní nebo imunomodulační účinek.
Etiopatogenetické děje u RA jsou komplexní povahy a zahrnují aktivaci T-lymfocytů, abnormality synoviálních dendritických i fibroblastům podobných buněk, aktivaci makrofágů, B-lymfocytů a produkci solubilních faktorů. Významnou roli hraje přímý mezibuněčný kontakt, kostimulační signály a exprese povrchových molekul, které jsou nutné pro přestup buněk do zánětlivého prostoru [3].
Pozornost se proto soustředila na cílené zásahy proti jednotlivým buňkám imunitního systému a protizánětlivým mediátorům, které tyto buňky produkují.
Z hlediska patogeneze je žádoucí především ovlivnění převahy Th1 lymfocytů a zejména tvorby prozánětlivých makrofágových cytokinů, jako jsou IL-1 a TNF alfa.
Ze spuštění a udržování zánětu u RA je obviňována nerovnováha prozánětlivých a protizánětlivých cytokinů – obrázek 1.
Obr. 1. Nerovnováha mezi prozánětlivými a protizánětlivými ději u revmatoidní artritidy 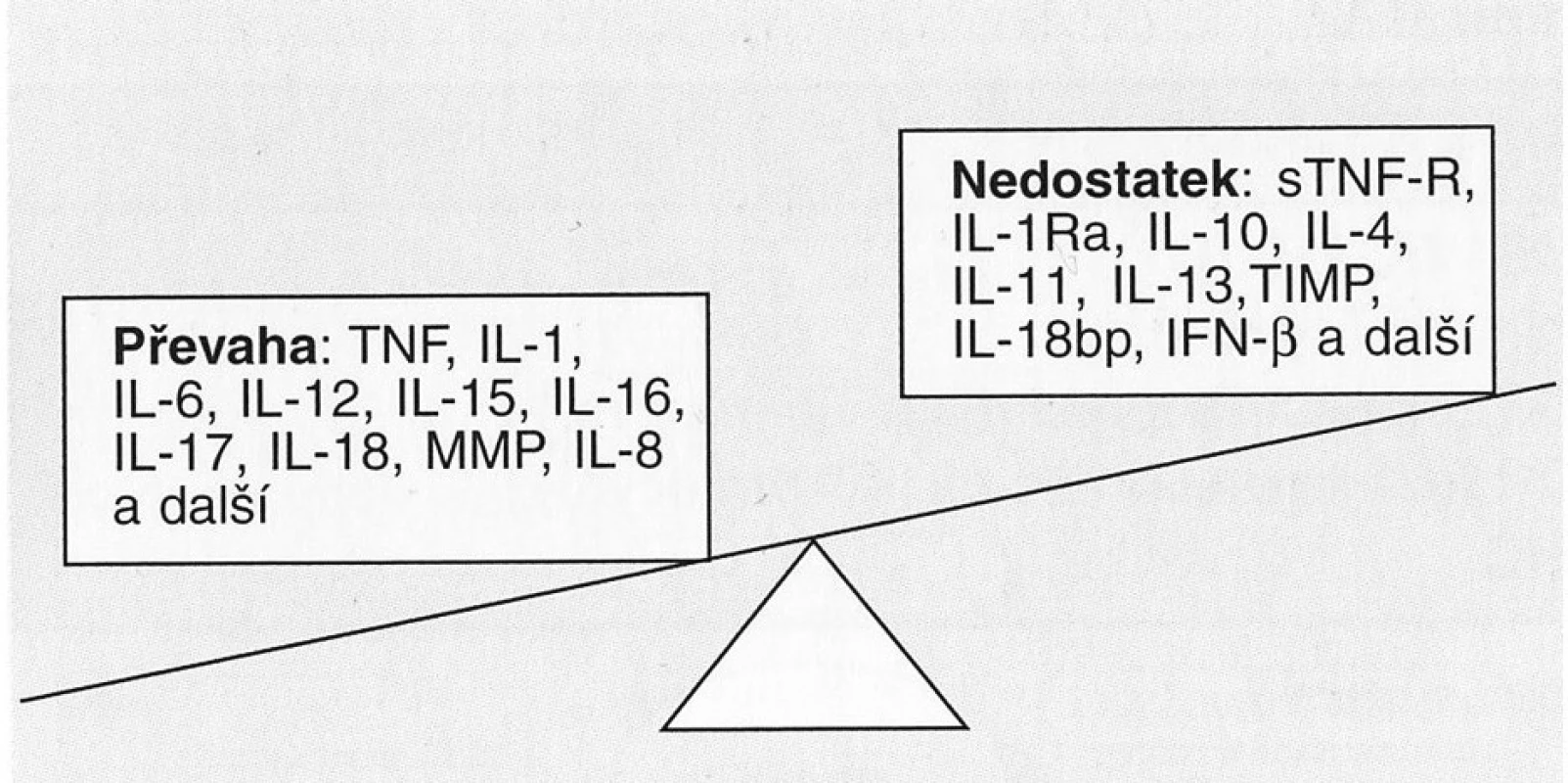
Zásah do těchto vztahů blokádou TNF alfa se ukázal zatím jako nejúspěšnější v novodobé terapii chronických zánětlivých onemocnění.
Cytokiny v pneumologii
Zdravé plíce mají schopnost odstraňovat velká množství inhalovaných partikulí a antigenů, aniž by došlo k projevům plicního zánětu.
Při porušení rovnováhy mezi množstvím antigenů a obrannými mechanismy dochází k akutnímu nebo chronickému zánětu a následné fibrotické reakci. Cytokiny a cytokinová síť hrají důležitou roli v mechanismu poškození plicní tkáně a také následné reparační fázi. Zodpovídají za mezibuněčnou komunikaci imunitního systému s jinými systémy [4].
Alveolární makrofágy – tvoří 80 % buněk v oblasti alveolů u zdravých jedinců. Reagují na stimulaci řady cytokinů, které přispívají k udržení plicní homeostázy. Produkují IL-1, TNF alfa, IL-6 a TGF beta.
Lymfocyty – tvoří cca 10 % buněk u zdravých jedinců a z větší části jsou tvořeny T lymfocyty. Th1 lymfocyty exprimují receptor pro IL-2, TNF alfa, INF gama a Th 2 lymfocyty produkují IL-4, IL-6, IL-10 a TNF alfa.
Fibroblasty – tvoří zbývajících cca 10 % buněk plicní tkáně, které produkují extracelulární matrix. Jsou efektorovými buňkami v místě zánětu a jsou výrazně stimulovány ke své činnosti TNF alfa a IL-1.
TNF alfa je produkován především monocyto/makrofágovým systémem po stimulaci bakteriálními součástmi, viry nebo některými cytokiny. Nejdůležitější v indukci TNF alfa je však mezibuněčný kontakt mezi T-lymfocytem a makrofágem. TNF alfa je především prozánětlivým mediátorem s pleiotropním účinkem, který vede k aktivaci řady buněk, ke stimulaci produkce kolagenázy, prostaglandinu E2, chemokinů, hyperexpresi adhesivních molekul či HLA molekul II. třídy. V kaskádě cytokinů je jeho postavení na počátku – je induktorem sekrece IL-1, který je asi hlavním nástrojem vedoucím k destrukci iniciované TNF alfa [6]. TNF alfase podílí na normální protizánětlivé imunitní reakci u TBC infekce. Aktivuje makrofágy, což má za následek produkci velkého množství působků, které jsou cytotoxické a detruktivní pro mykobakterie tuberkulózy a současně navozuje podmínky pro tvorbu granulomů, což je ochranná funkce plicní tkáně před invazivním šířením mykobakterií do okolí a ohraničení ložiska infektu.
Blokádou TNF alfa dochází tedy k oslabení přirozené funkce TNF alfa a zvýšení rizika vzplanutí latentní TBC [5].
Léčba biologickými přípravky je využívána v klinických oborech již přibližně 10 let.
V současné době se v České republice využívají k léčbě závažných forem zánětlivých revmatických chorob (revmatoidní artritida, seronegativní spondylartritida a psoriatická artritida) tři preparáty s účinkem na TNF alfa: Infliximab (Remicade), Adalimumab (Humira), Etanercept (Enbrel).
Jde o látky blokující účinek TNF alfa.
Blokádu TNF alfa je v současné době možné terapeuticky navodit dvěma způsoby: pomocí monoklonální protilátky proti TNF alfa anebo pomocí solubilního receptoru pro TNF alfa.
Rozdíl mezi blokádou TNF pomocí těchto dvou látek zatím není zcela zřejmý, ale pravděpodobně Infliximab je specifičtější vůči TNF, protože TNF receptor se váže i na lymfotoxin (TNF beta).
Monoklonální protilátka anti-TNF alfa může být myší, chimérická, humanizovaná nebo plně humánní.
Farmakokinetiku inhibitorů TNF alfa ukazuje tabulka 1.
Tab. 1. Farmakokinetika inhibitorů TNF-α 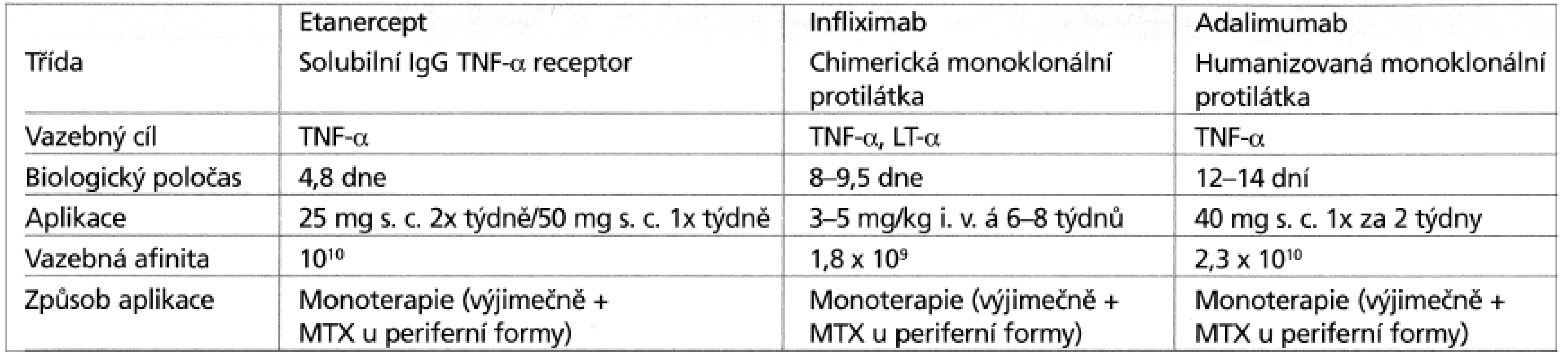
Vysvětlivky: TNF-α – tumor nekrotizující faktor-α; IgG – imunoglobulin G; MTX – metotrexát; LT-α – lymfotoxin-α V průběhu klinických testů s přípravky anti-TNF alfa byl výskyt tuberkulózy zaznamenán jen v ojedinělých případech.
Většina případů tuberkulózy se objevila v rámci klinického používání přípravků anti-TNF alfa.
Díky zavedeným a sledovaným národním registrům je možné hodnocení výskytu TBC a zavedení potřebných opatření, která brání vyššímu výskytu a cíleně vyhledávají inkriminované osoby s vyšším rizikem vývoje tuberkulózy v průběhu léčby biologickými přípravky.
Tuberkulóza se vyskytuje po všech třech přípravcích především v prvních měsících po zahájení terapie. Medián začátku je 11,5 měsíce. Až v polovině případů jde o mimoplicní formu TBC.
V ČR je hlášeno celkem 10 případů výskytu aktivní TBC na cca 3000 léčených nemocných.
Incidence výskytu TBC v běžné populaci je 1 : 6000.
Tuberkulóza je celosvětově rozšířené chronické infekční onemocnění vyvolané Mycobacterium tuberculosis přenášené z člověka na člověka kapičkami sputa obsahujícími původce nemoci. Pro člověka jsou dále patogenní mikroorganismy: Mycobacterium bovis a Mycobacterium africanum.
Podmíněnými patogeny u nás jsou Mycobacterium avium, Mycobacterium xenopi a Mycobacterium kansasii. Rezervoárem jsou půda a kontaminovaná voda.
Ročně je ve světě zjištěno 6–8 milionů nových případů aktivní TBC a ročně umírá na TBC kolem 3 milionů lidí.
Vzhledem k vysoké úmrtnosti a vysokým nákladům na léčbu TBC bylo nutno vypracovat a zaujmout stanoviska ke screeningovému vyhledávání nejvíce ohrožených skupin populace – v našem případě pacientů léčených biologickými léky.
Všichni nemocní, kteří jsou indikováni k biologické léčbě, musí mít provedeno RTG plic a Mantoux II a Quantiferon test.
Anamnesticky je nutno se zaměřit na anamnézu rodinnou, osobní a pracovní, se zaměřením na informace o možném kontaktu s osobou infikovanou či léčenou pro TBC.
Podrobná anamnéza musí obsahovat i informace o možném onemocnění v minulosti, typu léčby, datum BCG vakcinace a výsledky případných předcházejících vyšetření PPD testu.
Zvýšenému riziku jsou vystaveni také nemocní s přidruženými chorobami (diabetes mellitus, silikóza plic, závažné střevní onemocnění, malnutrice, profesionální expozice) a osoby pocházející z endemických oblastí vyššího výskytu TBC.
Tuberkulinové testy – jejich provádění umožňuje rozdělit populaci na část TBC dosud neinfikovanou a část již infikovanou. Tuberkulinem nazval R. Koch extrakt získaný v roce 1880 z kultury bacilů tuberkulózy.Tato látka umožnila v experimentu na morčeti odlišení zdravého jedince od infikovaného.
Pro zdravého jedince je tuberkulin látkou indiferentní, u nemocného vyvolává klasickou tuberkulinovou reakci. Jde o viditelné a hmatatelné projevy arteficiálního kožního zánětu se zarudnutím a indurací v místě aplikace. Změny vznikají za mnoho hodin po aplikaci tuberkulinu, proto je řadíme mezi alergické reakce opožděného typu (tuberkulinového).
Přenos opožděného typu přecitlivělosti není možno přenést sérem, ale pouze T lymfocyty senzibilizovaného jedince. Přenesení citlivosti má pouze krátké trvání, protože dárcovy T lymfocyty jsou ničeny reakcí hostitele.
Zánětlivé změny po aplikaci antigenu po tuberkulinu mohou probíhat i ve vzdálenějších orgánech a tkáních a mohou vyvolat i celkovou reakci s hemoragickým šokem a končit fatálně.
Mantoux II – PPD test – purified protein derivate je bílkovinná frakce připravená z kmene MTB označeného jako RT 23 pro intradermální aplikaci jednorázovým vpichem v dávce 0,1 ml.
Za pozitivní považujeme induraci + 6 mm a více, indurace 0–5 mm je považována za negativní. Opakování testu je možno nejdříve za 6 týdnů po předchozí aplikaci [7].
Quantiferon – TB Gold test je testem nové generace využívající buněčné imunitní odpovědi. Prokazuje kontakt s TBC (aktivní nebo latentní infekce) průkazem přítomnosti T lymfocytů aktivovaných vysoce specifickými antigeny M. tuberculosis.
Výhodou testu oproti kožnímu tuberkulinovému testu je vyšší senzitivita, zejména při aktivní TBC infekci,vyšší specificita a absence interference s postvakcinační imunitou (test neobsahuje antigeny vakcinačního kmene M. bovis a většiny dalších mykobakterií), neovlivnitelnost výsledku testu předchozím testováním (test nevyvolává ,,booster effect“), rychlost získání výsledku do druhého dne. Pravděpodobnost záchytu latentní i aktivní TBC tímto testem je kolem 90 %.
Test však není vhodné provádět u pacientů již léčených antituberkulotiky. Test sám o sobě neumožňuje rozlišit mezi aktivní a latentní infekcí, u starších lidí je nutno počítat s tím, že pozitivita testu bude spojována s latentní TBC častěji nežli s aktivní TBC.
Protilátky proti TBC – IgM, IgA, IgG tento test kombinuje specifické TBC antigeny a společné imunodominantní antigeny, což zvyšuje jeho citlivost.
Pravděpodobnost záchytu aktivní TBC na základě protilátkové odpovědi bývá kolem 70 % v závislosti na typu infekce.
Nejspolehlivějším markerem aktivní infekce u dříve neléčených jsou IgG protilátky (nejvyšší senzitivita i specificita) vzhledem k vyšší frekvenci zkřížených reaktivit u IgA a IgM protilátek [8].
Doporučení k použití obou testů
- Oba testy jsou při diagnostice TBC testy pomocnými. Definitivním laboratorním průkazem infekce je pouze kultivační průkaz TBC.
- Pro diagnostiku aktivní TBC mají tyto testy význam u mimoplicních forem TBC a tam, kde je třeba diagnostiku urychlit.
- Jsou-li testy použity k diagnostice aktivní TBC, doporučuje se požadovat a provádět oba testy souběžně.
- TB Gold test je vhodným vyhledávacím testem průkazu latentní TBC infekce u lidí, kteří přišli do kontaktu s infekcí a u lidí se zvýšeným rizikem reaktivace TBC.
- TB Gold je vhodný pro potvrzení pozitivních či hraničních výsledků Mantoux II (obsahuje jiné antigeny nežli tuberkulin).
Adresa pro korespondenci:
MUDr. Klára Šírová
Chelčického 12
701 00 Ostrava
e-mail: mudr.sirova.klara@mybox.cz
Zdroje
1. Deleuran, B. W. Cytokines in rheumatol.arthritis. Scand. J. Rheumatol., 1996, Suppl. 104. p. 1–38.
2. Tsokos, G. C. Lymfocytes, cytokines, inflammation and immune trafficking. Curr. Opin. Rheumatol., 1995, 7, 5, s. 376–383.
3. Smith, E. A., LeRoy, E. C. Rheumatol. 1st edition, St. Louis: Mosby–Year book 1994, p. 697–699.
4. Alam, R. Novel concept in allergy and asthma: interleukins and other cytokines mediators. Insight Allergy, 1991, 6, s. 1–8.
5. Homolka, J., Müller-Quernheim, J. Increased interleukin-6 production by bronchoaleveolar lavage cells in patients with active sarkoidosis. Lung, 1993, 171, s. 173–183.
6. Hyers, T. M., Tricomi, S. M., Dettenmeier, P. A. et al. Tumor necrosis faktor levels in serum and bronchoalveolar lavage fluid of patients with adversy respiratory distress syndrom. Am. Rev. Respir. Dis., 144, 1991, p. 268–271.
7. Šlosárek, M. Použití molekulárně genetických přístupů u mykobakterios. Stud. pneumol. czechoslow., 1992, 52, 3, s. 223–235.
8. Šula, L. Mikrobiologie tuberkulosy. Praha : Avicenum1970, 370 s.
Štítky
Posudkové lekárstvo Pracovné lekárstvo
Článok vyšiel v časopiseListy revizního lékařství
Najčítanejšie tento týždeň
2007 Číslo 1
Najčítanejšie v tomto čísle- ZÁVAŽNÉ NEŽÁDOUCÍ ÚČINKY BIOLOGICKÉ LÉČBY – TUBERKULÓZA
- ALERGOLOGIE V REVIZNÍM LÉKAŘSTVÍ
- PACIENT V PASTI
- PŘEHLED PRESKRIPCE ATB PRAKTICKÝMI LÉKAŘI V PRAZE 4
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



