-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biologické testování protilátky IgG M75 značené 125I
Biological testing of antibody IgG M75 labelled by 125I
Introduction:
Radioimmunotherapy belongs to rapidly developing clinical methods. It is often the best therapy option for patients with relapsing lymphoma, or for elderly patients. The development of new types of immunoconjugates has been, therefore, one of the key topics in the development of new radiopharmaceuticals.Methods:
Immunoglobulin G M75 was labelled via electrophilic iodination method with 125I, a nuclide with optimal properties for development of labelling method and also for the determination the labelled compounds properties (binding activity, immunospecificity). Major advantages of 125I are mainly its long half-life (59,40 days) and low radiation burden. The conjugates were tested for binding activity by ELISA method, the concentration was determined by modified Bradford method. The physiological distribution was tested on CD1-Foxn1nu mice.Results:
The results show an accumulation of more than 7 % of administered radioactivity in tumour tissue, the binding activity of the antibody determined one day after administration was > 90 % of the non-labelled compound binding activity.Conclusion:
The prepared radioimmunoconjugate IgG M75 labelled with 125I retains sufficient binding activity, and, therefore, it has potential in therapy of tumors expressing carbonic anhydrase. For the use in radioimunotherapy, it is necessary to test the analogous radioimmunoconjugate labelled with therapeutic radionuclide 131I.Key words:
IgG M75, antibodies, physiological distribution, 125I, ELISA, CD1-Foxn1nu
Autori: Lenka Marešová 1; Ondřej Lebeda 2; Daniel Seifert 2; Irena Sieglová 3; Vlastimil Král 3
Pôsobisko autorov: ÚJV Řež, a. s. 1; ÚJF AV ČR, v. v. i., Řež 2; ÚMG AV ČR, v. v. i., Praha 3
Vyšlo v časopise: NuklMed 2014;3:2-7
Kategória: Původní práce
Súhrn
Úvod:
Radioimunoterapie patří mezi rychle se rozvíjející klinické metody. Často je nejvhodnější možností terapie u pacientů s relabujícím lymfomem, případně u starších pacientů. Vývoj nových typů imunokonjugátů patří proto v posledních letech mezi klíčová témata ve vývoji radiofarmak.Metody:
Imunoglobulin G M75 byl značen metodou elektrofilní jodace radionuklidem 125I, který je optimální pro vývoj metody značení a také pro stanovení vlastností značeného preparátu (vazebná aktivita, imunospecifita). Výhody 125I jsou zejména jeho dlouhý poločas (59,408 dne) a nízká radiační zátěž. Zachování vazby aktivního místa na antigen bylo testováno metodou ELISA, koncentrace byla stanovena modifikovanou metodou podle Bradfordové. Fyziologická distribuce byla testována na myších CD1-Foxn1nu.Výsledky:
Stanovená kumulace značené protilátky v nádorové tkáni byla > 7 % podané radioaktivity, vazebná aktivita protilátky byla první den po značení vyšší než 90 % ve srovnání s vazebnou aktivitou neznačené protilátky.Závěr:
Připravený radioimunokonjugát IgG M75 s 125I si zachovává dostatečnou schopnost vazby antigenu, a má proto potenciál v terapii tumorů exprimujících karbonátdehydratasu. Pro použití v radioterapii je třeba otestovat analogický radioimunokonjugát značený radionuklidem 131I.Klíčová slova:
IgG M75, protilátky, fyziologická distribuce, 125I, ELISA, CD1-Foxn1nuÚvod
Radioimunoterapie je jednou z rychle se rozvíjejících strategií léčby onkologických onemocnění za posledních 20 let. V roce 1997 byla organizací Food and Drug Administration schválena první monoklonální protilátka pro adjuvantní imunoterapii lidských B-lymfomů. 1 Terapeutické užití protilátek bylo podmíněno snížením jejich imunogenicity, což umožnila konstrukce humanizovaných protilátek. Výhodou této léčby je specifická interakce s cílovou strukturou s minimálním poškozením okolní zdravé tkáně. 2 Protilátky značené terapeutickými radionuklidy se využívají k radioimunoterapii, např. chronické lymfatické leukémie (alemtuzumab) 3, metastázujícího karcinomu ledvin (girentuximab) 4, či non-Hodgkinova lymfomu (ibritumomab tiuxetan). 5
IgG M75 je monoklonální protilátka specifická k proteoglykanové oblasti lidské karbonátdehydratasy IX (EC 4.2.1.1). M75 rozeznává lineární epitop na N-konci a díky této specifitě nevykazuje žádnou křížovou reaktivitu s jinými členy ze skupiny karbonátdehydratas, které mají podobné oblasti. Epitop je složen ze šesti čtyřikrát se opakujících aminokyselin, což může být výhodné při interakci. Opakující se motiv umožňuje vazbu více než jedné protilátky do jednoho vazebného místa epitopu. Další výhodou je, že M75 se váže na epitop jak v nativním, tak i v denaturovaném stavu. 6
Karbonátdehydratasa IX (CA IX) je povrchový buněčný protein, který se normálně vyskytuje pouze ve sliznici žaludku a žlučovodů. Jeho přítomnost byla zjištěna ve vysokém procentu (téměř 100 %) u některých typů lidských karcinomů, jako je karcinom děložního hrdla, karcinom jícnu a adenokarcinom ledviny, v nižším procentu (60 %) byl nalezen u kolorektálního karcinomu a karcinomů hlavy, krku, plic a prsu. 7 Monomer proteinu CA IX je složen ze 459 aminokyselin, ale funkční je ve stavu homodimeru. Jednotlivé monomery jsou spojené disulfidovými vazbami mezi rezidui cysteinu. Každá jednotka (monomer) sestává z pěti domén: signálního peptidu, proteoglykanové domény, anhydrasové domény, transmembránové kotvy a intracytoplazmatické domény 8 CA IX se podílí na acidobazické rovnováze, intracelulární komunikaci a buněčné proliferaci. Zvýšená exprese CA IX může sloužit jako marker buněčné hypoxie 9 či zhoubného bujení, ne však pro všechny typy nádorů.
Metody
Značení IgG M75
Na problematiku jodace imunoglobulinu lze pohlížet jako na problematiku jodace na aromatické jádro a tedy problém substituce. Prakticky v každé protilátce se nacházejí aromatická jádra pocházející např. z aminokyseliny L-tyrosin. Z dobře prozkoumaných reakčních mechanismů substituce jodu na aromatická jádra se jako nejvýhodnější ukazují substituce elektrofilní. 10 Aby mohl být atom jodu elektrofilním činidlem, musí být přítomen ve formě kladného iontu I+ nebo sloučenin typu ICl.
Jde o heterolytickou reakci, kdy je vodík na aromatickém cyklu nahrazen kationtem (v našem případě I+), vodík se odštěpuje ve formě protonu H+. Elektrofilní činidlo (I+) nejdříve vytvoří s aromatickým jádrem π-komplex, jenž se přemění na σ-adukt, ten následně ztrácí proton a vzniká finální produkt.
Pro účely značení protilátky IgG M75 byla zvolena metoda oxidace chloraminem-T, tzv. homogenní chloraminová metoda.
Stanovení koncentrace proteinu
Ke stanovení koncentrace značených proteinů byla využita microassay modifikace metody podle Bradfordové. 11 Metoda Bradfordové využívá změny absorpčního maxima barviva Bio-Rad Protein Assay Dye Reagent. V kyselém roztoku má protonizovaná forma barviva absorpční maximum při vlnové délce 470 nm, resp. 650 nm (červená, resp. zelená barva roztoku). Po vazbě na protein a deprotonizaci má barvivo jasně modrou barvu a absorpční maximum při vlnové délce 595 nm. Koncentrace proteinu se stanovuje pomocí změny barvy nastávající v důsledku konformační změny molekuly barviva, k níž dojde po přidání barviva k proteinu. Nejde tedy o stechiometrickou reakci. Výpočet koncentrace proteinu se provádí odečtením z kalibrační křivky změřené při 595 nm. Kalibrační křivka byla změřena pro každý čerstvě smíchaný zásobní roztok barviva. Microassay modifikace spočívá v převedení metody na mikrotitrační destičku. Kalibrační křivka je měřena na roztocích o koncentraci 0 – 64 µg/ml proti slepému vzorku. Absorbance je měřena na přístroji Tecan Sunrise.
Stanovení vazby na antigen
Metoda nepřímé nekompetitivní ELISA je založena na interakci sekundární protilátky s komplexem antigen-primární protilátka. 12,13 96jamková destička pro ELISA test (Polysorb Nunc) byla pětkrát opláchnuta 1M roztokem fosfátového pufru (tablety PBS, Sigma Aldrich), do jamek přidáno 100 µl roztoku antigenu CA IX (ÚMG AV ČR) o koncentraci 2 ng/µl a destička byla inkubována 1 hodinu při teplotě místnosti. Po inkubaci byla destička pětkrát opláchnuta roztokem PBS a bylo přidáno 200 µl blokovacího roztoku (1% bovinní sérový albumin v PBS, Sigma Aldrich) a opět 1 hodinu inkubováno při teplotě místnosti.
Destička byla dále pětkrát opláchnuta PBS a do jamek přidány tyto roztoky: kalibrační roztok (50 µl nemodifikované IgG M75 v koncentraci 1,0 – 0,001953 µg/ml); 50 µl vzorku (modifikovaná IgG M75); 50 µl pozitivní kontrola (IgG M75, dodáno ÚMG AV ČR) a 50 µl negativní kontrola (1% bovinní sérový albumin v PBS). Vše bylo provedeno v tripletech, destička byla inkubována 2 hodiny při teplotě místnosti. Po ukončení inkubace byla destička opět pětkrát opláchnuta PBS a do každé jamky bylo přidáno 50 µl 1000× naředěné sekundární protilátky (RAM/hPx, Sigma Aldrich), inkubováno 1 hodinu. Poté byla destička pětkrát opláchnuta roztokem PBS a do každé jamky přidáno 100 µl barvícího roztoku o složení 5 ml citrátového pufru (Sigma Aldrich), 1 tableta OPD (o-Phenylenediamine dihydrochloride, Sigma Aldrich), 7 µl peroxidu vodíku 30% (Merck). Následuje inkubace ve tmě po dobu 10 minut. Poté je reakce ukončena přídavkem 100 µl 1M kyseliny sírové (Merck). Absorbance jednotlivých jamek byla měřena při 492 nm na přístroji Tecan Sunrise. Z hodnot kalibračních roztoků byla zpracována kalibrační křivka, z ní pak odečtena vazebná aktivita modifikované protilátky. Hodnoty uváděné v procentech jsou vztaženy k vazebné aktivitě původní neznačené protilátky.
Stanovení stability značené protilátky
V den značení a 24 a 48 hodin po značení bylo provedeno stanovení koncentrace a vazebné aktivity značeného proteinu M75. Značený protein byl separován na frakce o objemu 1 ml pomocí kolonky PD-10 (GE Healthcare) a sledována aktivita v každé frakci.
Fyziologická distribuce
Myší samci linie Foxn1nu (vlastní chov ÚJV Řež, a. s.), stáří 6 – 7 týdnů, byli rozděleni do pěti skupin (n = 5). První skupině byl indukován kolorektální karcinom subkutánním podáním buněčné linie SNU-C2B 1x106 v suspenzi s médiem mezi lopatky. Buněčná linie vykazuje expresi CA IX. 14 Skupina byla sledována po dobu 10 dnů, třetí den byly nádory hmatné pod kůží, desátý den nádory dosahovaly velikosti 3 - 5 cm3. (Obr. 1) Druhá až pátá skupina byly ponechány bez nádoru. V desátý den od aplikace buněčné linie bylo přistoupeno k samotnému distribučnímu experimentu. První a druhé skupině zvířat bylo injekčně do vena caudalis aplikováno 50 µl IgG M75 značené 125I. Třetí až páté skupině byl aplikován samotný radionuklid ve formě jodidu (125I-sodium iodide, high purity, Perkin-Elmer). Radioaktivita injekcí (50 µl) se pohybovala v rozmezí 150–250 kBq. Radioaktivita injekcí byla změřena ionizační komorou (BqMetr4, výrobce Empos).
Obr. 1. Myš s nádorem (z archivu autora). 
Zvířata z první, druhé a páté skupiny byla ponechána naživu 24 hodin od aplikace, třetí skupina byla humánně utracena inhalačním anestetikem 2 hodiny po aplikaci, čtvrtá skupina 6 hodin po aplikaci. Ihned po utracení byla provedena srdeční punkce a pitva. Při pitvě byly odebírány tyto orgány a tkáně: krev, štítná žláza, srdce, plíce, slezina, ledviny, sval, močový měchýř, kůže, tlusté střevo, tenké střevo, žaludek, játra, slinivka a ocas (místo vpichu), u první skupiny nádor. Radioaktivita odebrané krve a dalších orgánů a tkání byla měřena ve studni scintilačního detektoru NaI(Tl) typu NS9502E (výrobce Envinet). Všechny vzorky byly před měřením radioaktivity zváženy a radioaktivita byla vztažena na 1 g tkáně. Při výpočtech byla provedena korekce na poločas přeměny a korekce na účinnost aplikace.
Výsledky
Pro účely in vitro a in vivo testování byla optimalizována chloraminová metoda.
Postup značení IgG M75:
- Do reakční nádobky pipetováno 20 μl PBS.
- V reakční nádobce 10 μl IgG M75 (odpovídá 14 μg).
- V digestoři pipetován jód 125I o objemu 0,5 μl (av = 15,1 MBq/31 μl).
- Další krok pipetování Chloraminu-T o objemu 10 μl (odpovídá 1 μg).
- Celkový reakční čas 1,5 min. bez míchání.
- Po uplynutí 1 min. doplněno roztokem PBS na objem 1 ml a veškerý objem převeden na kolonku PD-10.
Při jodaci ani při separaci reakční směsi nebyl použit BSA. Pro účely stanovení fyziologické distribuce byla použita značená látka z experimentu č. 5, kde se podařilo dosáhnout ideálního výtěžku a počtu atomů jodu 125I na molekulu IgG M75.
Modifikace microassay metody podle Bradfordové přináší spolehlivé a přesné výsledky při stanovení koncentrace značeného IgG M75. Kalibrační křivka je lineární v rozsahu koncentrací od 0 do 35 µg/ml. Koncentrace stanovených vzorků se pohybuje v rozmezí od 5 do 25 µg/ml, rozsah metody je dostačující. Pro vyšší koncentrace lze použít standardní metodu dle Bradfordové. (Graf 1)
Graf 1. Kalibrační křivka stanovení koncentrace protilátky podle Bradfordové, modifikace microassay. 
Stanovení vazebné aktivity metodou ELISA pro značenou protilátku IgG M75 poskytuje spolehlivé a přesné výsledky. Vazebná aktivita protilátky IgG M75 modifikované značením radionuklidem 125I se sníží průměrně na 80 % původní vazebné aktivity a dále se snižuje s časem. Stabilita značené protilátky byla sledována 24 a 48, resp. 72 hodin od značení. (Tab. 1) Degradace protilátky probíhá částečně v závislosti na původní koncentraci. V případě nízké koncentrace protilátky dochází mezi 24 a 48 hodinami od značení ke skokovému snížení vazebné aktivity, u vyšší koncentrace (více než 20 µg/ml) dochází k pozvolné degradaci.
Tab. 1. Přehledová tabulka značení a stanovení imunoreaktivity protilátky IgG M75 značené <sup>125</sup>I (imunoreaktivita je vztažena k imunoreaktivitě neznačené protilátky, 1. den je dnem značení). 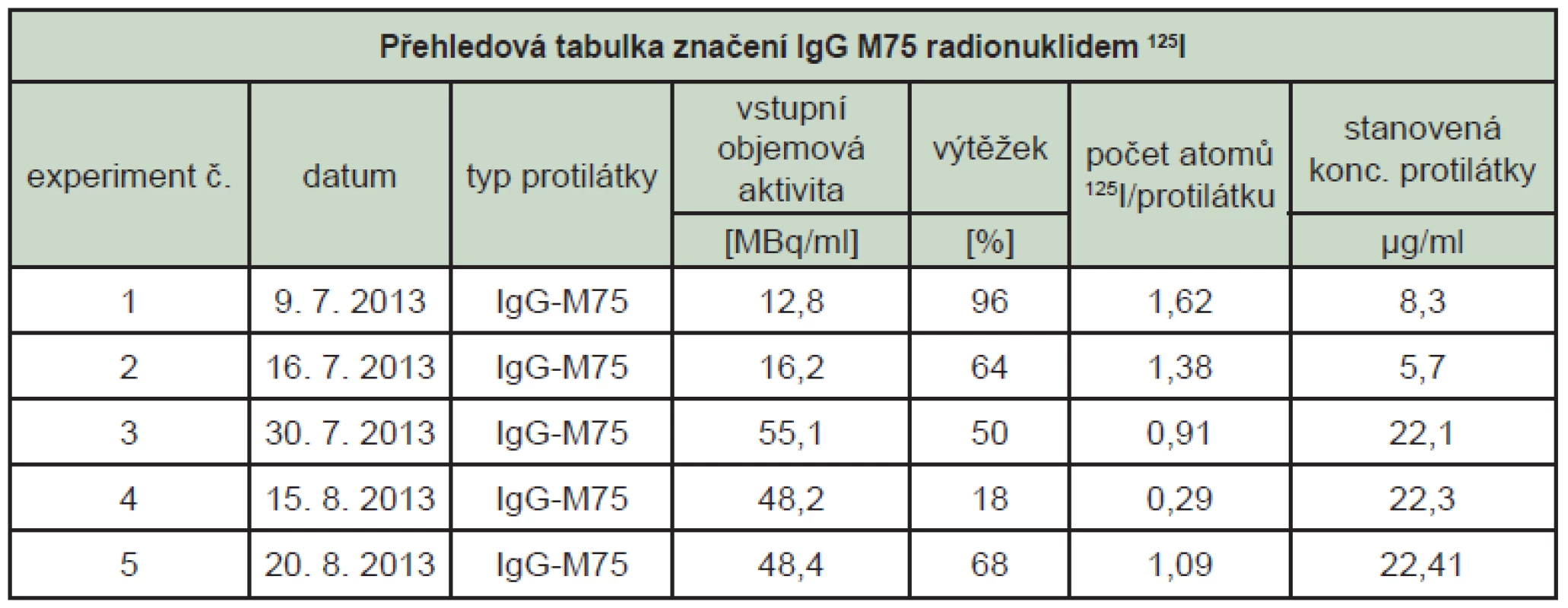
Při stanovení radioaktivity jednotlivých frakcí, separovaných pomocí kolonky PD-10, bylo zjištěno, že 24 hodin od značení je profil směsi totožný s profilem v den značení, radioaktivita byla nalezena od třetí do šesté frakce, 48 hodin od značení již dochází k fragmentaci protilátky a radioaktivita se nachází i v dalších frakcích. (Obr. 2)
Obr. 2. Porovnání radioaktivity frakcí reakční směsi 24 a 48 hodin od značení. 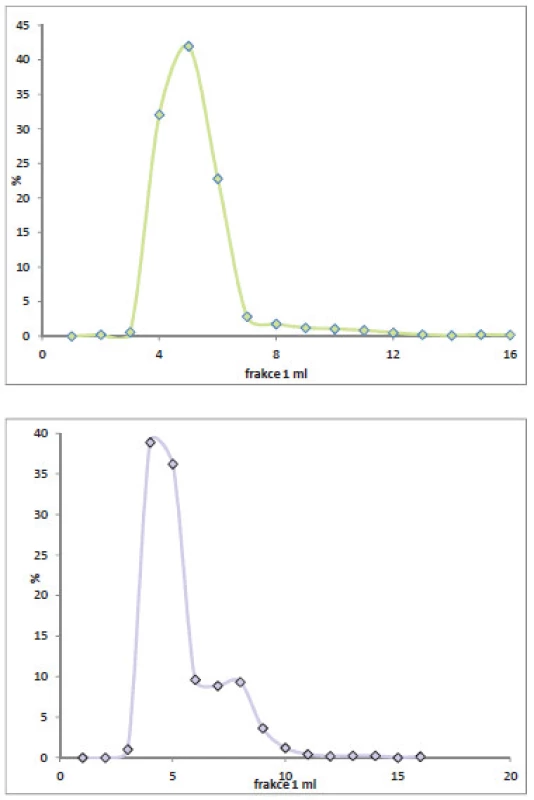
Průměrná radioaktivita po podání značené protilátky ve tkáních 24 hodin po aplikaci byla téměř totožná u zvířat s nádorem a bez nádoru, v nádoru bylo nalezeno průměrně 7,48 % skutečně podané radioaktivity, v krvi průměrně 18,29 %. Při podání volného radionuklidu byly 24 hodin po podání nalezeny v orgánech a tkáních včetně krve zanedbatelné hodnoty radioaktivity, 2 hodiny po podání bylo nejvíce radioaktivity nalezeno v žaludku (45,1 %). (Tab. 2)
Tab. 2. Fyziologická distribuce samotného radionuklidu <sup>125</sup>I aplikovaného ve formě jodidu a značené protilátky u zvířat. Uvedené hodnoty reprezentují procento skutečně podané radioaktivity vztažené na 1 g příslušné tkáně/orgánu. 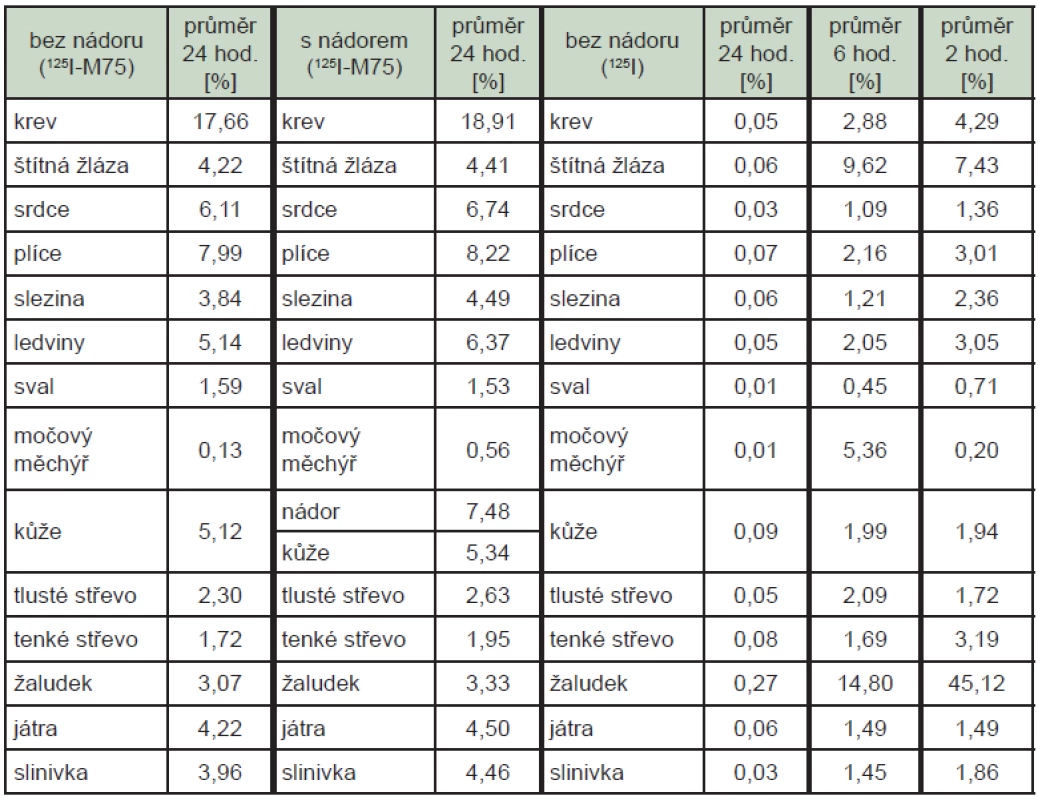
Diskuze
Výsledky značení a ELISA testů naznačují nejednoznačnost závislosti počtu atomů jodu vůči protilátce a také závislosti výtěžků reakce na měřené zachované vazebné aktivitě. Nebyla provedena robustní statisticky průkazná studie, na jejímž základě by bylo možné hledat skutečné závislosti mezi těmito parametry. Avšak studie může naznačovat, že procesy, probíhající při elektrofilní jodaci za použití chloraminu-T, nemusí být zcela reprodukovatelné vzhledem k naměřeným datům z ELISA testu. Poškození protilátky je mimo jiné dáno dobou kontaktu protilátky s oxidačním činidlem a také jeho koncentrací. Z těchto důvodů byl optimalizován čas reakce a množství použitého oxidačního činidla. Experimentálně bylo zjištěno, že protilátky IgG M75 značené po dobu 1,5 min. s koncentrací 0,025 µg/µl chloraminu-T přítomného v reakční směsi zachovávají vazebnou aktivitu v intervalu 79-97 %.
Výsledky získané testy ELISA a stabilitními studiemi ukazují, že označením IgG M75 jodem se sníží vazebná schopnost protilátky, což odpovídá dříve prováděným studiím, kde se vazebné schopnosti protilátky po označení snížily v průměru o 10-20 % původní hodnoty. 15,16 Stabilita značené protilátky je rovněž dostačující při předpokládaném vychytávání protilátky z krve do cílového orgánu 48 hodin.
Při testu fyziologické distribuce bylo prokázáno dostatečné množství radioaktivity v cílové tkáni, tedy nádoru. Radioaktivita v ostatních orgánech odpovídá jejich prokrvení a koresponduje s dříve získanými poznatky, např. při sledování fyziologické distribuce protilátek značených indiem-111. 17 Výhodou značení přímou metodou je nepřítomnost chelatačního činidla, které často směřuje molekulu do jiného orgánu než je žádoucí. 18 Farmakokinetické vlastnosti samotného radionuklidu a protilátky značené radionuklidem se významně liší. Protilátka udrží radionuklid v organismu podstatně déle, při podání značené protilátky bylo v krvi pokusných zvířat nalezeno průměrně 18,2 % aktivity ještě 24 hodin od aplikace, zatímco při podání samotného radionuklidu bylo 6 hodin od aplikace nalezeno v krvi 2,88 %.
Závěr
Výsledky získané v této studii prokázaly, že optimalizované značení protilátek radionuklidem 125I chloraminovou metodou nezpůsobuje u protilátky významnou ztrátu vazebné aktivity in vitro (stanoveno metodou ELISA) i přesto, že nebyl u značené protilátky použit ochranný protein BSA. Z vyhodnocení in vivo fyziologické distribuce je zřejmé vychytávání v nádorové tkáni ve výši 7 %. K ověření potenciálu radioimunokonjugátu je nezbytné ověřit jeho vlastnosti po značení terapeutickým radionuklidem 131I, kdy lze vzhledem k povaze emitovaného záření očekávat sníženou vazebnou aktivitu samotného IgG M75.
Poděkování:
Tato práce byla spolufinancována technologickou agenturou ČR v rámci programu Alfa jako projekt TA02010797.
Lenka Marešová
ÚJV Řež, a. s.
lenka.maresova@ujv.cz
Zdroje
1. Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975;256 : 495-497
2. Cwiertka K, Hajdúch M, Trojanec R et al. Terapeutické monoklonální protilátky v onkologii. Klin Farmakol Farm 2004;18 : 165-170
3. De Decker M, Bacher K, Thierens H et al. In vitro and in vivo evaluation of direct rhenium-188-labeled anti-CD52 monoclonal antibody alemtuzumab for radioimmunotherapy of B-cell chronic lymphocytic leukemia. Nucl Med Biol 2008;35 : 599-604
4. Stilleobrer A, Boerman O, Desar I et al. Phase 1 radioimmunotherapy study with lutetium 177-labeled anti-carbonic anhydrase IX monoclonal antibody girentuximab in patiens with advanced renal cell carcinoma. Eur Urol 2013;64 : 478-485
5. Goldsmith S. Radioimmunotherapy of lymphoma: Bexxar and Zevalin. Semin Nucl Med 2010;40 : 122-135
6. Chrastina A, Závada J, Parkkila S et al. Biodistribution and pharmacokinetics of 125I-labeled monoclonal antibody M75 specific for carbonic anhydrase IX, an intrinsic marker of hypoxia, in nude mice xenografted with human colorectal carcinoma. Int J Cancer 2003;105 : 873-881
7. Hyršl L, Závada J, Závadová Z et al. Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře. Ces Urol 2011;15 : 85-92
8. Pastoreková S, Závada J. Carbonic anhydrase IX (CA IX) as a potential target for cancer therapy. Canc Ther 2004;2 : 245-262
9. Li Y, Wang H, Oosterwijk E et al. Antibody-specific Detection of CAIX in Breast and Prostate Cancers. Biochem Biophys Res Commun 2009;386 : 488-492
10. De La Mare P. Electrophilic halogenation – 1. vydání. Cambridge Univ. Press, Cambridge, 1976, 231 p
11. Bradford MM. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal Biochem 1976;72 : 248-254
12. Ye G, Oshins R, Rouhani F et al. Development, validation and use of ELISA for antibodies to human alpha-1 antitrypsin. J Immunol Meth 2013;388 : 18-24
13. Dowall S, Richards K, Graham V et al. Development of an indirect ELISA method for the parallel measurement of IgG and IgM antibodies aganist Crimean-Congo haemorrhagic fever (CCHF) virus using recombinant nucleoprotein as antigen. J Virol Meth 2012;179 : 335-341
14. Ku J, Park J. Biology of SNU Cell Lines. Cancer Res Treat 2005;37 : 1-19
15. Huhtala T, Laakkonen P, Sallinen H at al. In vivo SPECT/CT imaging of human orthotopic ovarian carcinoma xenografts with 111In-labeled monoclonal antibodies. Nucl Med Biol 2010;37 : 957-964
16. Tinianow JN, Gill HS, Ogasawara A at al. Site-specifically 89Zr-labeled monoclonal antibodies for ImmunoPET. Nucl Med Biol 2010;37 : 289-297
17. Schneider D, Heitner T, Alicke B at al. In Vivo Biodistribution, PET Imaging, and Tumor Accumulation of 86Y - and 111In-Antimindin/ RG-1, Engineered Antibody Fragments in LNCaP Tumor-Bearing Nude Mice. J Nucl Med 2009;50 : 435-443
18. Rasaneh S, Rajabi H, Babaei M at al. Radiolabeling of trastuzumab with 177Lu via DOTA, a new radiopharmaceutical for radioimmunotherapy of breast cancer. Nucl Med Biol 2009;36 : 363-369
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2014 Číslo 1
Najčítanejšie v tomto čísle- Seminom a sarkoidóza – komplikace hodnocení léčebné odpovědi pomocí 18F-FDG PET/CT – kazuistika
- Biologické testování protilátky IgG M75 značené 125I
- Ošetřovatelské problémy u pacientů při zátěžových testech v rámci perfuzní scintigrafie myokardu
- Co je na obrázku?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




