-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pozitrónová emisná tomografia s markermi lipidového metabolizmu pri funkčnom zobrazení primárnych nádorov pečene
Positron emission tomography with lipid metabolism markers for primary liver cancers imaging
Accurate staging of HCC has a significant impact on patient management. 18F-fluorodeoxyglucose (FDG) has limitations in the functional imaging of liver tumours, in particular the detection rate of intra-hepatic well-differentiated hepatocellular carcinoma (HCC) is low. To overcome this lack of sensitivity, choline PET tracers have proposed: 11C-choline or its analogues 18F-fluorocholine (FCH) and 18F-fluoroethylcholine (FEC). They showed sensitivity compatible with an accurate staging of well-differentiated HCC and also of intermediate or poorly differentiated HCC. Actually dual tracer PET with FDG and a lipid tracer has the best performance, as some lesions in a given patients may be of a different aggressiveness and take-up only one tracer. In this aim, visualisation of HCC tumours with FDG is pejorative, whereas visualisation with a lipid tracer was indicative of a better prognosis in pilot studies. Some evidence has also been brought that the detection of distant metastasis benefit from a dual tracer approach.
Among non-HCC liver malignancies in adults, only cholangiocarcinoma has been reported to take up lipid tracers in small series; FCH uptake has been reported in a child with recurrent hepatoblastoma. Concerning benign liver tumours, adenoma is rarely visible on choline PET, whereas focal nodular hyperplasia (FNH) is visible as a hot focus in the majority of cases. To characterize a liver nodule as HCC, this uptake by FNH may be seen as a source of false-positive results. FCH could be helpful to differentiate in difficult cases between FNH and hepatocellular adenoma which has the potential to degenerate.Key Words:
choline, PET, FCH, liver tumour, hepatocellular carcinoma, focal nodular hyperplasia, hepatoblastoma
Autori: Ľudovít Lukáč 1; Branislav Kunčák 2; Marika Vereb 3; Lucia Kaliská 4; Soňa Balogová 5,6
Pôsobisko autorov: I. Interná klinika LF UK a UNB, Bratislava 1; Interné oddelenie, Nemocnica Nové Zámky 2; Nuklearmedizin, Kassel, Nemecko 3; INMM, Banská Bystrica 4; Klinika nukleárnej medicíny LF UK a OÚSA, Bratislava 5; Klinika nukleárnej medicíny nemocnice Tenon AP-HP a Univerzity Pierre et Marie Curie, Paríž, Francúzsko 6
Vyšlo v časopise: NuklMed 2014;3:22-30
Kategória: Přehledová práce
Súhrn
Správny staging hepatocelulárneho karcinómu (HCC) má zásadný význam pre optimálnu voľbu terapeutického postupu. Pomocou celotelového funkčného PET zobrazenia (vo fúzii s CT alebo MRI) možno získať dopĺňajúcu informáciu k výsledkom morfologických zobrazovacích metód. Na prekonanie nedostatočnej senzitívnosti 18F-fluórodeoxyglukózy (FDG) pri HCC boli navrhnuté markery lipidového metabolizmu, najmä cholín (11C-cholín) a jeho analógy 18F-fluórocholín (FCH) a 18F-fluóroetylcholín (FEC), pre ktoré bola potvrdená dostatočná senzitívnosť pre dobre, stredne aj zle diferencovaný HCC. Jednotlivé lézie resp. oblasti HCC však môžu vykazovať rôzny stupeň diferenciácie, z čoho vyplýva ich variabilne vyznačený glukózový a lipidový metabolizmus. V súčasnosti je tak za najvýkonnejšiu funkčnú zobrazovaciu metódu primárneho a metastatického HCC považovaná kombinácia FDG a markera lipidového metabolizmu. Funkčná informácia získaná pomocou kombinácie FDG a markera lipidového metabolizmu má tiež potenciál poskytnúť užitočnú prognostickú informáciu: vizualizácia HCC pomocou FDG je asociovaná so zlou prognózou, zatiaľ čo jeho vizualizácia pomocou markera lipidového metabolizmu indikuje priaznivú prognózu. Spomedzi non-HCC malígnych primárnych nádorov pečene u dospelých bola pozorovaná akumulácia markerov lipidového metabolizmu len v prípade cholangiokarcinómu. FCH môže byť užitočný aj pri funkčnom zobrazení hepatoblastómu u detí. Adenóm pečene je len zriedkavo vizualizovaný pomocou FDG alebo markerov lipidového metabolizmu, naopak fokálna nodulárna hyperplázia (FNH) zvyčajne akumuluje markery lipidového metabolizmu a môže byť zdrojom falošne pozitívnych nálezov pri pátraní po HCC, ale nebýva vizualizovaná pomocou FDG. Pri diferenciálnej diagnostike adenómu, ktorý potenciálne môže degenerovať do karcinómu, a FNH môže byť jeho zvýšená akumulácia markerov lipidového metabolizmu nápomocná.
Kľúčové slová:
cholín, PET, FCH, hepatocelulárny karcinóm, fokálna nodulárna hyperplázia, hepatoblastómÚvod
Podľa epidemiologických údajov je HCC celkovo piatou najčastejšou malignitou a je jednou z hlavných príčin úmrtia pacientov s cirhózou pečene. Kuratívne riešenie HCC je možné len u 30–40 % pacientov s lokálne nepokročilým HCC bez vzdialených metastáz 1 a po prípadnom HCC je u pacientov s chronickou hepatopatiou aktívne pátrané pomocou stanovenia sérovej hladiny alfa-fetoproteínu (AFP) a zobrazovacích metód (ultrasonografia-USG, počítačová tomografia-CT, magnetická rezonancia-MRI).
Každá fokálna abnormalita pečene v cirhotickom teréne je podozrivá z HCC a odlíšenie HCC od regeneračných a dysplastických uzlov či konfluentnej fibrózy predstavuje náročnú úlohu.
Pri histopatologickej analýze parenchýmu pečene po explantácii resp. post mortem je identifikovaných 30–50 % lézií HCC, zvyčajne s priemerom menej ako 2 cm, ktoré neboli diagnostikované pomocou realizovaných zobrazovacích metód. Celková senzitívnosť USG pre HCC je 60 %, ale pri detekcii uzlov s priemerom menej ako 2 cm má USG len obmedzené možnosti; senzitívnosť kontrastnej CT pre HCC je 70 % a MRI 80 %. 2-5
Podľa kritérií Európskej asociácie pre výskum pečene (EASL) každá uzlovitá lézia v pečeni s priemerom viac ako 2 cm vykazujúca zvýšené artériové prekrvenie pri kontrastnej CT pri sérovej hladine AFP viac ako 400 ng/ml svedčí pre HCC aj bez bioptickej verifikácie. Tieto kritériá sú označované aj ako Barcelonské kritériá. 6 Transplantácia pečene je kuratívny prístup, ktorý rieši problém HCC aj chronickej hepatopatie, indikovaná je však len u pacientov so solitárnym HCC menším ako 5 cm alebo s maximálne tromi ložiskami HCC menšími ako 3 cm, bez makrovaskulárnej invázie a bez vzdialených metastáz (uvedené kritériá sú označované ako Milánske kritériá). 7
Celotelové funkčné zobrazenie pomocou PET disponuje dostatočným technickým rozlíšením aj pre lézie s priemerom menším ako 1 cm. Funkčné zobrazenie umožňuje na lokálnej úrovni najmä detekciu a charakterizáciu lézií HCC, ale aj získanie užitočnej prognostickej informácie. Na lokoregionálnej a vzdialenej úrovni prispieva k efektívnemu stagingu s potenciálnym vplyvom na plánovanie terapeutického postupu.
Funkčné zobrazenie pomocou PET/CT však môže priniesť potrebnú informáciu len pri voľbe správneho rádiofarmaka na detekovanie správneho diagnostického cieľa: v súčasnosti sú pri funkčnom zobrazení HCC dokumentované FDG (marker glukózového metabolizmu) a viaceré markery lipidového metabolizmu značené 18F alebo 11C. Pre funkčnú heterogénnosť HCC (Obr. 1) je na získanie komplexnej informácie na lokálnej, lokoregionálnej a vzdialenej úrovni považovaná za optimálnu kombinácia FDG a markera lipidového metabolizmu. 8
Obr. 1. Zle diferencovaný hepatocelulárny karcinóm: časť nádoru pozitívna s FDG (A) a časť nádoru pozitívna s FCH (B). FDG pozitívne oblasti sa javia ako fotopenické v porovnaní s okolitým parenchýmom pečene pri PET/CT s FCH (B). 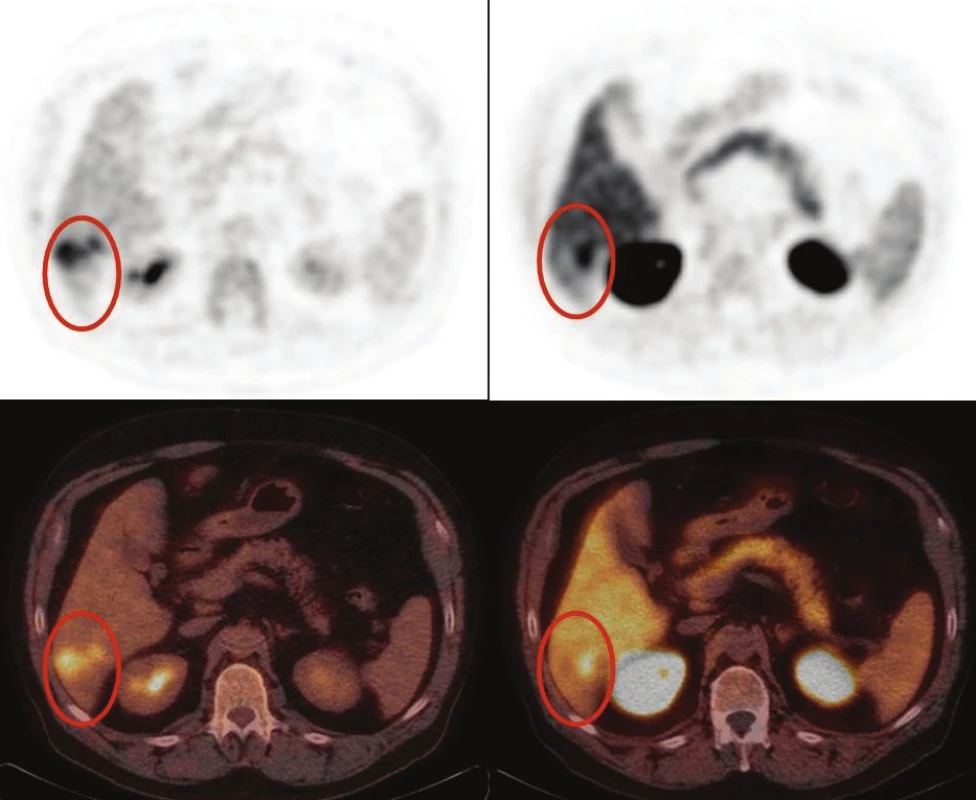
FDG je referenčným rádiofarmakom v onkologickej PET diagnostike. Hoci disponuje výbornou senzitívnosťou pre hepatálne metastázy väčšiny malignít, jej senzitívnosť je pri detekcii intrahepatálneho HCC obmedzená (50–70 %). 9-14 Nález FDG pozitívneho ložiska v pečeni nie je diagnostický pre HCC, nakoľko podobne sa môže manifestovať aj cholangiokarcinóm (CAC), sarkóm, či metastáza inej malignity resp. ich kombinácia, ktorá je možná aj u jedného pacienta. PET/CT s FDG však vykazuje dobrú špecifickosť pre benígne lézie pečene, ktorými zvyčajne akumulovaná nie je. 15
Vzdialené metastázy HCC sa vyskytujú najmä u pacientov s primárnym HCC o priemere viac ako 5 cm. 16, 17 Ich prítomnosť je kontraindikáciou na rozsiahly chirurgický výkon resp. transplantáciu pečene. S výnimkou detekcie pľúcnych metastáz s priemerom menším ako 1 cm vykazuje PET/CT s FDG celkovo dobrú senzitívnosť pre vzdialené metastatické lézie HCC. 13, 14, 18
Pri funkčnom zobrazení HCC pomocou PET/CT sú z markerov lipidového metabolizmu dokumentované 11C-acetát, 11C a 18F-cholín a 18F-fluóroetylcholín.
V roku 2003 Ho et al. 19 ako prví publikovali výsledky porovnania diagnostických parametrov FDG a 11C-acetátu pri charakterizácii uzlovitých lézií v pečeni. V skupine pacientov s menej ako 4 léziami bola zistená senzitívnosť 11C-acetátu pre HCC 87 %, ale len 47 % pri použití FDG. Žiadna z lézií nebola negatívna pri použití oboch rádiofarmák (100 % senzitívnosť). Pri porovnaní s výsledkami histopatologickej analýzy lézie dobre diferencovaného HCC akumulovali prevažne 11C-acetát a lézie zle diferencovaného HCC akumulovali prevažne FDG. Výsledky boli následne potvrdené viacerými autormi 8, 20-23 a väčšina z nich odporúča použitie kombinácie 11C-acetátu a FDG, pričom obe vyšetrenia môžu byť z dôvodu krátkeho fyzikálneho polčasu 11C (20 min.) realizované v rámci jedného dňa. 8, 20, 21, 23 Aj uvedený prístup je však zaťažený suboptimálnou senzitívnosťou pre lézie s rozmermi 1–2 cm: 32 % pre 11C-acetát a 27 % pre FDG podľa štúdie Park et al. 23
Krátky fyzikálny polčas 11C predstavuje výhodu nižšej radiačnej záťaže pre pacienta, zároveň však komplikuje logistiku 11C značených rádiofarmák, ktoré sú dostupné len v obmedzenej aktivite a len pre pracoviská v blízkosti cyklotrónu. Značenie rádiofarmák pomocou 18F s fyzikálnym polčasom 110 minút umožňuje ich hromadnú výrobu a distribúciu do jednotlivých PET zariadení pri zachovaní prijateľnej radiačnej záťaže pre pacienta.
Diagnostické parametre 18F-acetátu (FAC) v detekcii HCC neboli na zvieracích modeloch dostatočné. 24 Pri humánnej aplikácii piatim pacientom s HCC, žiadna z 11C-avídnych lézií nevykazovala akumuláciu FAC. 23
Cholín je jednou zo zložiek fosfatidylcholínu, ktorý je základným prvkom bunkových membrán. Pre nádorové bunky je pre ich akcelerovanú tvorbu bunkových membrán pri proliferácii typická schopnosť zvýšene akumulovať cholín. Signifikantne zvýšený obsah cholínu v HCC bol potvrdený pomocou magnetickej rezonančnej spektrometrie. 26
Článok prináša prehľad publikovaných údajov o použití 11C-cholínu a 18F-fluórocholínu pri funkčnom zobrazení HCC.
Funkčné zobrazenie HCC – animálne modely
Na zvieracích modeloch HCC indukovaného vírusovou hepatitídou bola pozorovaná lepšia senzitívnosť 11C-acetátu ako FDG pre HCC, najmä jeho dobre diferencované formy. 27 Na bunkovej úrovni, z dôvodu metabolických vlastností daných enzymatickou výbavou, hepatocyty aj bunky HCC akumulujú cholín, ktorý je intracelulárne fosforylovaný. Pomocou značeného cytidín 5-difosfocholínu však bolo potvrdené, že akumulácia cholínu v bunkách HCC reflektuje syntézu fosfatidylcholínu potrebného na výstavbu bunkových membrán pri ich zvýšenom obrate danom proliferáciou nádorových buniek. Naopak normálne okolité hepatocyty vykazujú dominantne oxidáciu značeného cholínu vo fosfatidyletanolamínovej ceste metylácie. 28
Pri porovnaní akumulácie 11C-cholínu a 18F-fluóroetylcholínu (FEC) zvieracím modelom HCC o priemere 1–1,6 cm bola priemerná hodnota pomeru ich akumulácie tumorom a okolitým parenchýmom (tumour/non tumour ratio, T/NTR) 50 minút po aplikácii oboch rádiofarmák 1,5 s 11C-cholínom a 1,3 s FEC, čo indikuje dobrú kontrastnosť zobrazenia. Akumulácia 11C-cholínu aj FEC sledovala rovnakú kinetiku s rýchlym nástupom a dosiahnutím plateau v 10. minúte po aplikácii bez ohľadu na príjem potravy pred aplikáciou. 29
Výsledky predklinických štúdií potvrdili dobrú kontrastnosť zobrazenia HCC (vrátane lézií menších ako 2 cm) pomocou cholínu resp. cholínových derivátov značených 11C aj 18F a to aj v teréne ich fyziologickej akumulácie normálnym parenchýmom pečene. Pozorovaná bola o niečo vyššia akumulácia značeného cholínu a jeho derivátov, ako 11C-acetátu, léziami HCC. Potvrdená rýchla kinetika markerov lipidového metabolizmu s včasným dosiahnutím plateau prináša výhodu skoršej akvizície (10–50 minút po aplikácii) ako v prípade FDG (minimálne 60 minút po aplikácii).
Funkčné zobrazenie HCC – klinické údaje
18F-fluórocholín pri detekcii HCC
18F-fluórovaný analóg cholínu (18F-fluórocholín, FCH) bol navrhnutý na funkčné zobrazenie HCC pomocou PET/CT v roku 2006, kedy Talbot et al. 30 publikovali priaznivé výsledky pilotnej komparatívnej štúdie FDG a FCH v detekcii HCC: z 9 pacientov so známym HCC bol tento vizualizovaný pomocou FCH u 9 (100 %) ale len u 5 (56 %) pomocou FDG. 30 Ako bolo potvrdené v predklinických štúdiách, z dôvodu fyziologických vlastností a enzymatickej výbavy hepatocytu je FCH akumulovaný normálnymi hepatocytmi intenzívnejšie ako FDG, čo vytvára pomerne vysoké pozadie v oblasti pečene. Lézie dobre diferencovaného HCC, ktoré majú zachované metabolické vlastnosti normálneho hepatocytu, sú pri funkčnom zobrazení pomocou FCH zobrazené ako horúce ložisko. Naopak lézie zle diferencovaného HCC, ktorý v procese dediferenciácie stratil pôvodné funkčné vlastnosti normálneho hepatocytu, sa pri funkčnom zobrazení pomocou FCH zobrazia ako hypoaktívna (fotopenická), hypometabolická lézia s tkanivovou denzitou v CT obraze.
Priaznivé výsledky pilotnej štúdie Talbot et al. 30 boli základom pre realizovanie prospektívnej porovnávacej štúdie fázy III so zaslepeným hodnotením a štandardom pravdy založenom na histologickom náleze a/alebo klinickom sledovaní v trvaní 6 mesiacov, ktorej cieľom bolo porovnanie diagnostických parametrov FDG a FCH pri detekcii HCC u pacientov s uzlovitými léziami v pečeni. 31 Analyzované boli výsledky 84 pacientov a do celkového hodnotenia boli brané do úvahy len výsledky 59 pacientov, pre ktorých bol dostupný štandard pravdy. Primárny HCC alebo hepatocholangiokarcinóm (HCAC) bol na základe histológie (u 29 pacientov) resp. Barcelonských kritérií (u 5 pacientov) potvrdený u 34/59 pacientov. U 25/59 pacientov bola potvrdená non-HCC etiológia uzlovitých hepatálnych lézií: z toho u 8/25 non-HCC malignita, u 17/25 benígna uzlovitá lézia pečene. Pri interpretácii nálezov PET/CT s FCH boli hypoaktívne lézie tkanivovej denzity na CT považované za malígne. Senzitívnosť FCH a FDG v detekcii HCC alebo HCAC bola 88 % vs 68 % (p=0,07). Na úrovni lézie bolo analyzovaných 123 lézií: 114 intrahepatálnych a 9 extrahepatálnych, v 70 prípadoch bol potvrdený HCC. Senzitívnosť pre HCC bola signifikantne lepšia s FCH ako s FDG (84 % a 67 %, p=0,01). (Obr. 1, 2) Pri histopatologickej analýze všetky FCH hypoaktívne hepatálne lézie zodpovedali malignite: zle diferencovanému HCC, cholangiokarcinómu (CAC) alebo metastáze inej malignity. Kvantitatívna analýza akumulácie FCH a FDG hepatálnymi léziami pomocou štandardizovanej hodnoty akumulácie (standardized uptake value, SUV) a stanovenia T/NTR neprinieslo pridanú hodnotu k vizuálnej interpretácii, čo bolo dané najmä skutočnosťou, že hodnota T/NTR hypoaktívnych lézií pri PET/CT s FCH bola nižšia ako 1, ale napriek tomu bol potvrdený ich malígny charakter.
Obr. 2. Dobre diferencovaný hepatocelulárny karcinóm: v typickom prípade negatívny s FDG (A) a pozitívny s FCH (B). 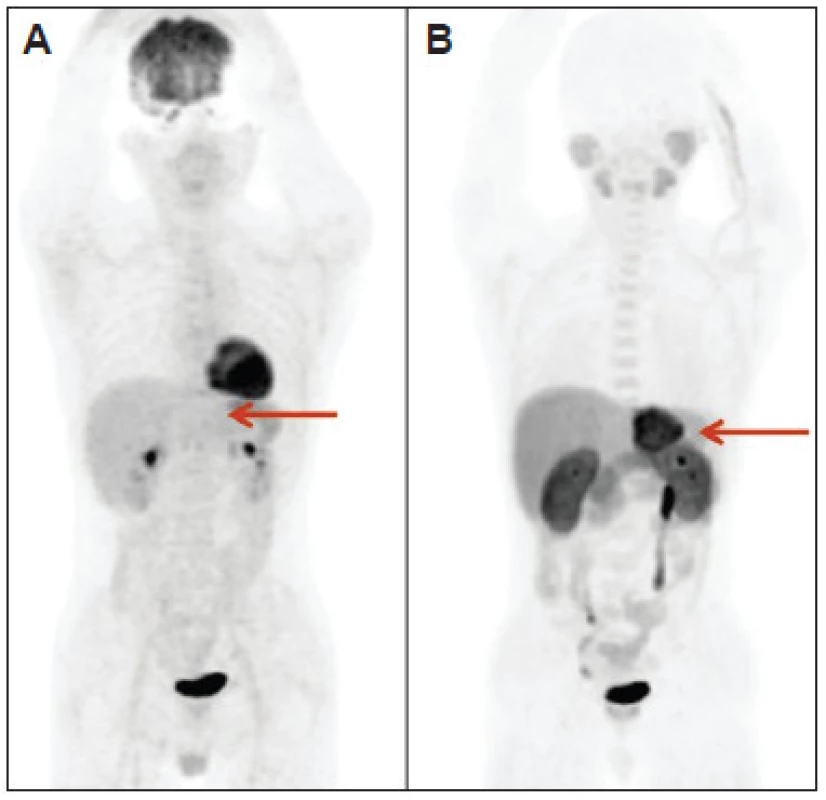
V prípade dobre diferencovaného HCC bola potvrdená signifikantne lepšia senzitívnosť FCH ako FDG na úrovni pacienta (100 % vs. 45 %, p<0,003) aj na úrovni lézie (94 % vs. 59 %, p<0,001). Funkčné zobrazenie pomocou FDG neprinieslo pridanú hodnotu k PET/CT s FCH, nakoľko žiadna z falošne negatívnych lézií s FCH nebola FDG pozitívna.
V prípade stredne a zle diferencovaného HCC nebol dokázaný štatisticky významný rozdiel v senzitívnosti FCH a FDG (na úrovni lézie senzitívnosť 76 % pre FCH vs. 74 % pre FDG).
Analyzovaný bol tiež vzťah rozmeru lézií a diagnostických parametrov FDG a FCH: spomedzi 12 lézií s rozmerom krátkej osi menším ako 1 cm, 10 (83 %) bolo pozitívnych s FCH a 8 (67 %) s FDG. 31 Pri porovnaní senzitívnosti PET/CT s 11C-acetátom a FDG pre lézie s rozmerom krátkej osi menej ako 1 cm však Park et al. 23 konštatovali významne horšie výsledky: 32 % pre 11C-acetát a 27 % pre FDG. 23 Vysvetlenia môžu byť dve: horšie výsledky 11C-acetátu v porovnaní s FCH môžu byť čiastočne dané lepším priestorovým rozlíšením PET pre 18F ako pre 11C vyplývajúcim z kratšieho doletu pozitrónov 32, rozdiel bol však pozorovaný aj pre FDG. Pri výklade tohto fenoménu možno aj na základe výsledkov predklinických testov na zvieracích modeloch HCC uvažovať o vyššej afinite malých (rozmer krátkej osi menej ako 1 cm) lézií HCC pre cholín, ako pre acetát. 27
Pri funkčnom zobrazení pľúcnych a kostných metastatických ložísk HCC bola pozorovaná lepšia kontrastnosť s nižšou aktivitou pozadia pri zobrazení s FCH ako s FDG. 30,31 Pri interpretácii nálezov s FCH je však potrebné mať na pamäti, že FCH nevykazuje špecifickosť pre HCC a umožní aj funkčné zobrazenie iných primárnych nádorov, napr. karcinómu pľúc, ale najmä karcinómu prostaty. 33, 34
Významným parametrom každej vyšetrovacej metódy je jej vplyv na diagnosticko-terapeutické rozhodovanie, ktoré bolo doposiaľ analyzované len v pivotnej štúdii Talbot et al.: identifikácia neočakávaných extrahepatálnych lézií pri PET/CT s FCH indukovala zmenu v pôvodne plánovanom postupe u 7 % pacientov, čo je však pravdepodobne významne podhodnotené z dôvodov striktných inklúznych kritérií protokolu klinického skúšania.
Výsledky štúdie Talbot et al. 31 boli základom pre registráciu FCH vo viacerých európskych krajinách. Pri hepatocelulárnom karcinóme je FCH registrovaný na lokalizáciu lézií dokázaného dobre diferencovaného HCC a ako dopĺňajúce vyšetrenie k PET s FDG pri charakterizácii pečeňových uzlov a/alebo staging dokázaného alebo vysoko pravdepodobného HCC, ak PET s FDG nepriniesla jednoznačný záver alebo ak je plánovaný chirurgický výkon alebo transplantácia.
11C-cholín pri detekcii HCC
Podľa výsledkov pilotnej štúdie Yamamoto et al. 35 u 12 pacientov dosiahla PET/CT s 11C-cholínom lepšiu frekvenciu detekcie ako s FDG pri dobre a stredne diferencovanom HCC (75 % vs. 25 %). Opačné biologické vlastnosti boli zaznamenané pri zle diferencovanom HCC, pri ktorom bola frekvencia detekcie PET/CT s 11C-cholínom 42 % a s FDG 75 %.
Podobné výsledky zaznamenali Wu et al. 36, ktorí analyzovali pridanú hodnotu PET/CT s 11C-cholínom u pacientov s FDG negatívnym HCC. Zo 76 pacientov bol FDG pozitívny nález zaznamenaný u 48 (61 %). Pozitívny nález s 11C-cholínom bol zaznamenaný u 20/28 (71 %) pacientov s FDG negatívnym nálezom. Zároveň bola pozorovaná lepšia detekcia dobre diferencovaného HCC pomocou 11C-cholínu ako pomocou FDG (67 % vs. 36 %). Pri detekcii stredne diferencovaného HCC vykazovali obe rádiofarmaká podobnú frekvenciu detekcie (86 % vs. 72 %). Pri kombinácii informácie získanej pomocou 11C-cholínu a FDG celková senzitívnosť stúpla zo 63 % pri použití samotnej PET/CT s FDG na 90 % pri kombinácii PET/CT s FDG a 11C-cholínom (p< 0,001).
Celkovo, aj pri obmedzenom počte štúdií a absencii komparatívnych štúdií markerov lipidového metabolizmu pri detekcii HCC, možno konštatovať, že cholínové PET rádiofarmaká zdieľajú viaceré vlastnosti s 11C-acetátom, ktorého využitie pri HCC bolo dobre dokumentované.
FCH, 11C-cholín a 11C-acetát vykazujú lepšie diagnostické parametre v detekcii dobre diferencovaného HCC ako FDG. 19, 23, 30, 31, 35, 36 Sú použiteľné aj pri detekcii zle diferencovaného HCC, ale ich diagnostické parametre nie sú lepšie ako pri použití FDG. 23, 31, 36 Nízka diferenciácia HCC vedie k strate pôvodných metabolických vlastností hepatocytu a lézie zle diferencovaného HCC sa pri PET/CT s markermi lipidového metabolizmu javia ako fotopenické.
Asociácia PET/CT s markerom lipidového metabolizmu a s FDG je považovaná za optimálnu a v súčasnosti dosahuje pri stagingu HCC najlepšie diagnostické parametre. 20, 21, 23, 31, 37
Prognostická informácia preterapeutického funkčného zobrazenia HCC pomocou FDG
Okrem samotnej detekcie lézií HCC poskytuje funkčné zobrazenie pomocou PET/CT aj neinvazívnu informáciu o ich gradingu: stupeň diferenciácie HCC významne ovplyvňuje akumuláciu jednotlivých typov PET rádiofarmák jeho léziami, čo môže mať význam pri voľbe optimálneho terapeutického postupu aj pri stratifikácii postterapeutického rizika recidívy HCC.
Vysoká akumulácia FDG léziami HCC je asociovaná s nízkym stupňom diferenciácie, rýchlou proliferáciou a časom zdvojenia objemu HCC. 38
Celkové prežívanie bez recidívy roky po resekcii HCC je signifikantne nižšie u pacientov s vysokou akumuláciou FDG (T/NTR ≥2) na preterapeutickej PET. 40, 41 Nepriaznivá prediktívna hodnota vysokej akumulácie FDG léziami HCC bola následne potvrdená ďalšími autormi. 41, 42 U kandidátov na transplantáciu pečene je pretransplantačná vizualizácia HCC pomocou FDG asociovaná s horšou prognózou ako u pacientov s pokročilejším HCC nezodpovedajúcim Milánskym kritériám, ale s FDG negatívnym HCC. 43-46 Funkčné zobrazenie pomocou FDG poskytuje prediktívnu informáciu o prežívaní pacientov aj v prípade nechirurgickej liečby HCC. 47-49
Prognostická informácia preterapeutického funkčného zobrazenia HCC pomocou FCH
Fartoux et al. komparatívne analyzovali prognostickú hodnotu preterapeutickej PET/CT s FDG a s FCH u 11 pacientov po resekcii unifokálneho HCC. 50
Pri PET/CT s FDG a s FCH boli pozorované tri typy zobrazenia: FDG pozitívny a FCH fotopenický HCC u 4 pacientov: u všetkých bola pozorovaná včasná recidíva HCC (menej ako 6 mesiacov po chirurgickom výkone).
V prípade FDG negatívneho a FCH pozitívneho HCC bola recidíva pozorovaná len u jedného pacienta z piatich, pričom recidíva HCC bola zistená 40 mesiacov po resekcii HCC. Z dvoch pacientov s FDG aj FCH negatívnym HCC bola u jedného pozorovaná recidíva HCC 28 mesiacov po chirurgickom výkone.
Prítomnosť FDG negatívneho a FCH fotopenického HCC pri PET/CT bola vo všetkých prípadoch okrem včasnej recidívy asociovaná aj s histologickým nálezom mikrovaskulárnej invázie a satelitných uzlov. Kombinácia funkčnej informácie o HCC získanej pomocou PET/CT s FDG a FCH umožnila presnejšiu identifikáciu pacientov so včasnou recidívnou HCC, ako keby bola použitá hodnota T/NTR 2 pri PET/CT s FDG.
Celkovo, podľa dostupných literárnych dôkazov: ak HCC akumuluje marker lipidového metabolizmu, možno pri absencii akumulácie FDG predpokladať priaznivú prognózu. Naopak intenzívna akumulácia FDG léziami HCC indikuje zlú prognózu a včasnú recidívu HCC. 22, 50 Kombinácia preterapeutickej PET/CT s FDG a s markerom lipidového metabolizmu poskytuje v detekcii HCC lepšiu senzitívnosť ako samotná PET/CT s FDG, môže viesť k zvýšeniu stagingu multinodulárneho HCC a ovplyvniť terapeutické rozhodnutia.
Vypracovanie definitívnych odporúčaní však vyžaduje spresnenie údajov v komparatívnych štúdiách na dostatočných súboroch pacientov.
Detekcia a restaging recidivujúceho alebo perzistentného HCC
Zlepšujúce sa terapeutické možnosti HCC zlepšujú prežívanie pacientov a presná lokalizácia a restaging rekurentného resp. perzistentného HCC sa tak stáva čoraz významnejšou. Výsledky funkčných zobrazovacích metód sú pri rozlíšení viabilnej nádorovej masy, reziduálnej neviabilnej masy a jazvovitého tkaniva menej ovplyvnené predchádzajúcimi terapeutickými výkonmi ako výsledky morfologických zobrazovacích metód.
Identifikácia recidívy alebo perzistencie HCC pomocou FDG je dobre dokumentovaná 14, 51-55, údaje o využití markerov lipidového metabolizmu v tejto klinickej situácii sú zatiaľ obmedzené. V komparatívnej štúdii Talbot et al. 31 neboli pozorované rozdiely v detekcii intrahepatálneho HCC u 46 pacientov s novodiagnostikovaným HCC a u 12 pacientov s podozrením na recidívu HCC. Pri recidivujúcom HCC boli lézie HCC identifikované u 5/5 pacientov pomocou FCH a u 3/5 pacientov pomocou FDG.
Akumulácia cholínu non-HCC primárnymi nádormi pečene
FCH a non-HCC malígne nádory
Spomedzi non-HCC primárnych malígnych nádorov pečene bol podľa dostupných literárnych údajov pomocou FCH vizualizovaný len cholangiokarcinóm, ktorý sa zvyčajne manifestuje ako fotopenický, ale raritne môže byť aj FCH avídny. 31 Hepatálne metastázy non-HCC primárnych malígnych nádorov sa pri zobrazení s FCH javia ako významne fotopenické a intenzívne akumulujúce FDG. 31
Hepatoblastóm je najčastejším primárnym malígnym nádorom pečene u detí a svojou incidenciou zodpovedá 1 % všetkých malígnych nádorov detského veku. Publikovaný bol jeden klinický prípad dieťaťa s hepatoblastómom, ktorý bol vizualizovaný pomocou FCH. 56
Akumulácia FCH benígnymi nádormi pečene
Akumulácia FCH fokálnou nodulárnou hyperpláziou pečene je zdrojom falošne pozitívnych nálezov pri charakterizácii uzlovitých lézií pomocou funkčného zobrazenia a viedla k nižšej špecifickosti FCH v porovnaní s FDG (62 % vs. 91 %,p<0,01) v štúdii Talbot et al. 31 (Obr. 3) Hepatocelulárny adenóm (HCA) akumuluje FDG variabilne a FCH akumuluje len veľmi zriedkavo. Doposiaľ nebola opísaná vizualizácia HCA pomocou FDG aj FCH súčasne. Žiadna fotopenická lézia pri PET/CT s FCH s tkanivovou denzitou v CT obraze nezodpovedala benígnemu nádoru. 31 (Obr. 4, 5)
Obr. 3. Fokálna nodulárna hyperplázia (FNH) je typicky negatívna s FDG (A) a pozitívna s FCH (B). FNH môže byť zdrojom falošne pozitívneho nálezu pri podozrení na hepatocelulárny karcinóm, môže však byť rozpoznaná na MRI. Typický nález FNH s FDG a s FCH môže byť nápomocný pri odlíšení FNH od hepatocelulárneho adenómu. 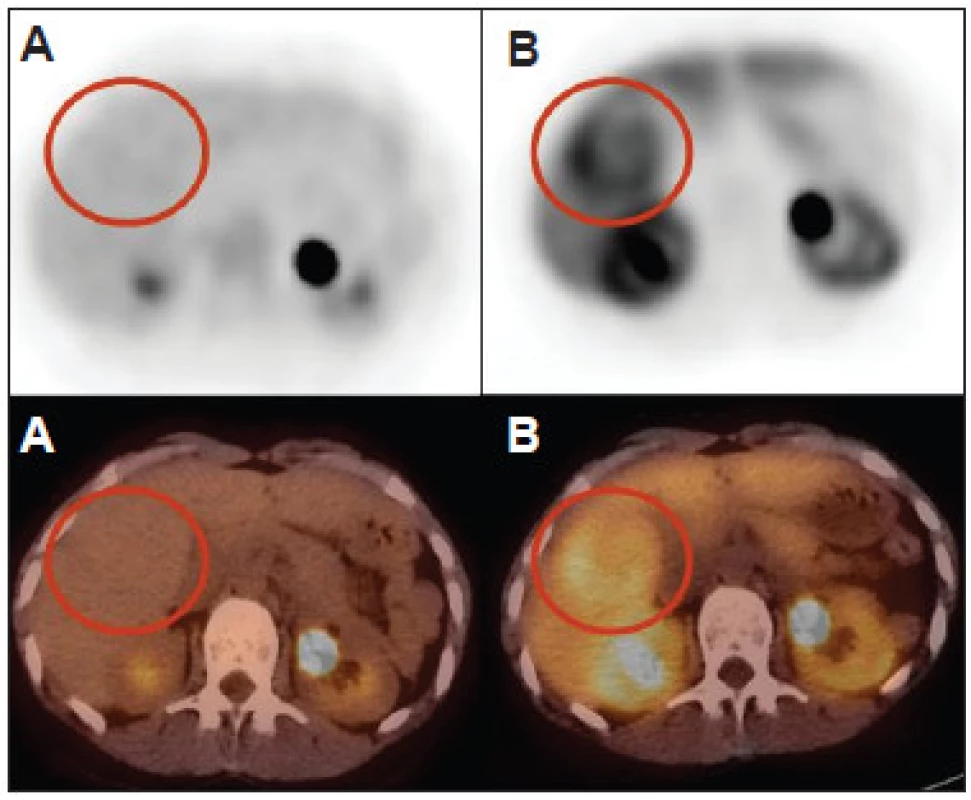
Obr. 4. Hepatocelulárny adenóm nemá typický obraz pri PET/CT s FDG a s FCH. Môže byť pozitívny s FDG (A) a nevizualizovaný s FCH (B), ako v tomto prípade pacientky s mnohopočetnou adenomatózou pečene. Hepatocelulárny adenóm je však najčastejšie negatívny s FDG aj s FCH. 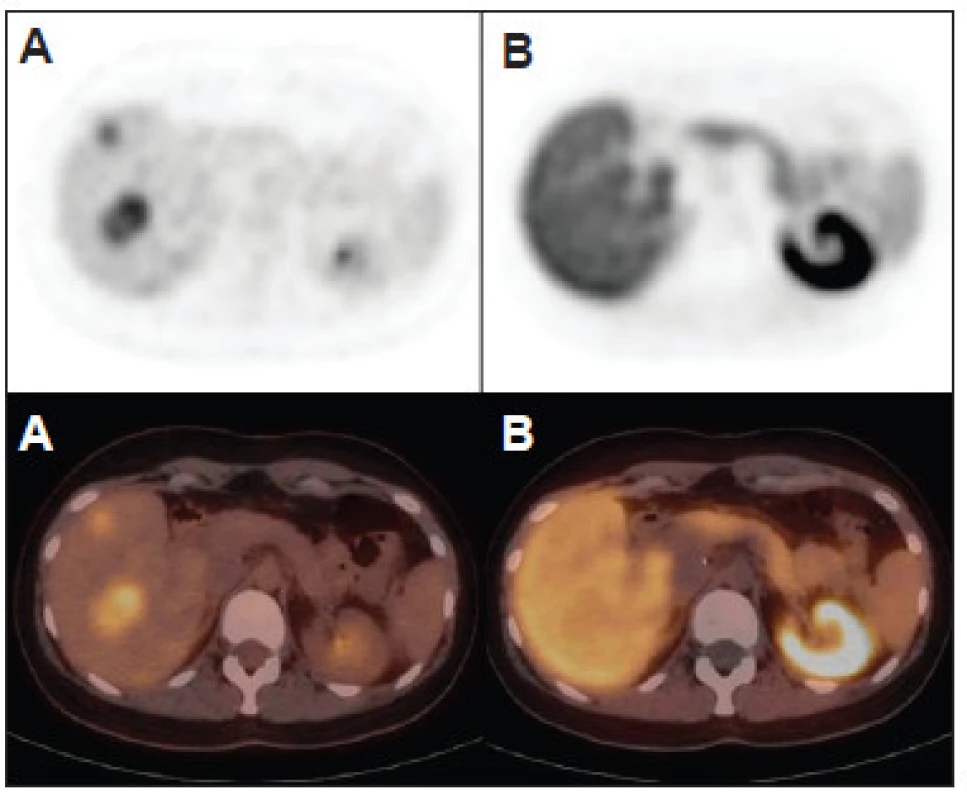
Obr. 5. Výnimočne môže byť hepatocelulárny adenóm aj FDG negatívny (A) a FCH pozitívny (B), ako v tomto prípade pacienta so solitárnym hepatocelulárnym adenómom. 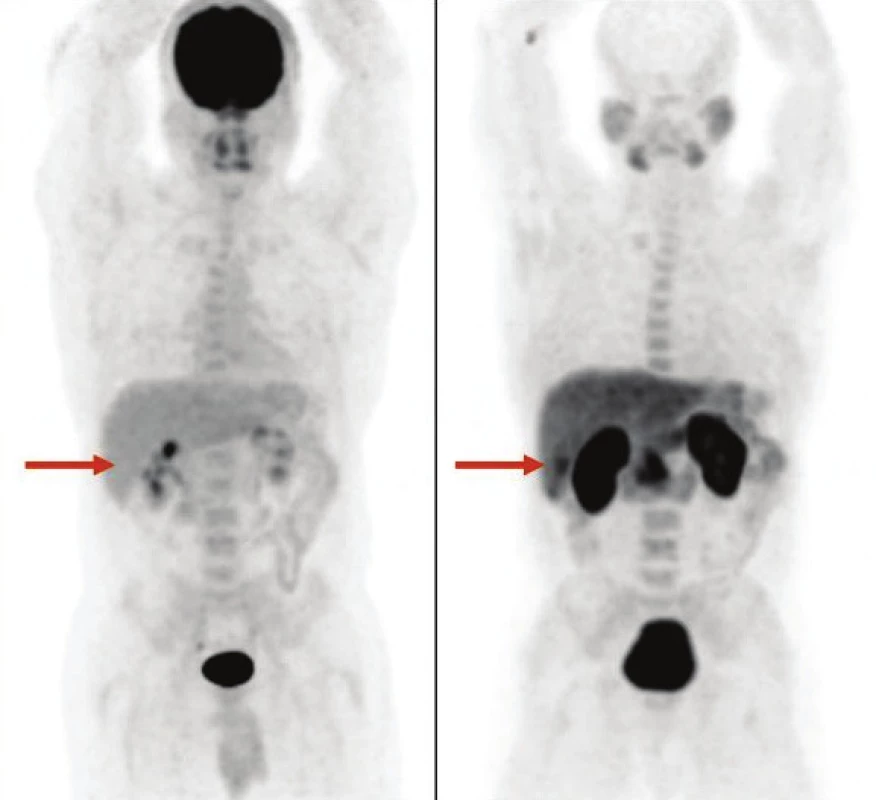
Typická akumulácia FCH léziami FNH redukuje špecifickosť detekcie HCC, môže však byť nápomocná pri odlíšení benígnej FNH od HCA, ktorý môže v asi 4 % prípadov degenerovať do karcinómu. V pilotnej štúdii van den Esschert et al. 57 boli analyzované nálezy 10 pacientov s FNH a 11 s HCA. Priemerná hodnota T/NTR pri PET/CT s FCH bola pri FNH 1,68±0,29 a pri HCA 0,88±0,18 (p<0,001). Prahová hodnota T/NTR 1,12–1,22 umožnila odlíšiť pacientov s FNH od pacientov s HCA so 100% senzitívnosťou a špecifickosťou. Bieze et al. 58 neskôr analyzovali výsledky 49 konsekutívnych pacientov s podozrením na mnohopočetný HCA resp. FNH s rozmerom viac ako 2 cm. Výsledok histopatologickej analýzy bol dostupný pre 60 lézií. Priemerná hodnota T/NTR bola pri PET/CT s FCH 1,67±0,31 pre 28 lézií FNH, z ktorých všetky boli vizualizované pomocou FCH. Pre 32 HCA bola priemerná hodnota T/NTR 0,82±0,17 a HCA bol vizualizovaný pomocou FCH len v jednom prípade. Pri použití prahovej hodnoty T/NTR 1,13 bola senzitívnosť odlíšenia FNH a HCA 100 % špecifickosť 97 %
Tab. 1. Literárne údaje o funkčnom zobrazení hepatocelulárneho karcinómu pomocou PET so značeným cholínom. <sup>11</sup>Ch: <sup>11</sup>C-cholín; Dual: kombinácia výsledkov FDG a FCH alebo <sup>11</sup>Ch; FCH: <sup>18</sup>F-fluórocholín; FDG: <sup>18</sup>F-fluórodeoxyglukóza; FNH: fokálna nodulárna hyperplázia; HCA: hepatocelulárny adenóm. *: len benígne lézie, non-HCC malignity neboli brané do úvahy 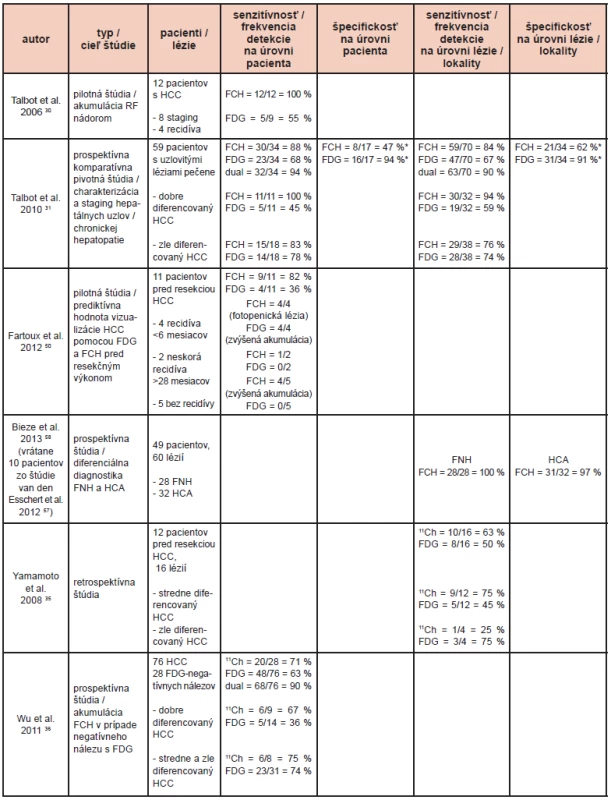
Markery lipidového metabolizmu pri non-HCC léziách
Z non-HCC malignít, hepatálne metastázy inej malignity sa manifestujú ako fotopenické pri PET/CT s FCH. 19, 31, 59 CAC se zvyčajne pri funkčnom zobrazení s markermi lipidového metabolizmu zobrazí ako fotopenický, opísaná však bola aj jeho akumulácia FCH. K jej frekvencii sa pri limitovanej dostupnosti literárnych údajov nedá vyjadriť. 19, 23, 31 Pri zobrazení s FCH každá hypoaktívna lézia s tkanivovou denzitou v CT obraze zodpovedá malignite. 31 FCH môže byť užitočný pri pátraní po recidíve hepatoblastómu u detí. 56
Z benígnych lézií pečene FNH akumuluje FCH 33 a variabilne aj 11C-acetát. 19, 59, 60 PET/CT s FCH môže byť nápomocná pri odlíšení FNH ako výsledku polyklonálnej proliferácie hepatocytov od HCA, ktorý je výsledkom monoklonálnej proliferácie hepatocytu a môže v asi 4 % prípadov degenerovať do karcinómu. 58, 61, 62 Ani kombinácia PET/CT s FDG a s markerom lipidového metabolizmu však neumožní definitívne klasifikovanie hepatálnej lézie ako benígnej či malígnej. 31, 57, 58
Záver:
Pri hepatocelulárnych nádoroch boli pri získaní komplementárnej informácie k funkčnému zobrazeniu pomocou FDG dokázané priaznivé diagnostické parametre FCH a 11C-cholínu, ktoré môžu v týchto indikáciách nahradiť doposiaľ najdlhšie používaný marker lipidového metabolizmu 11C-acetát. Pridaná hodnota kombinácie FDG a markera lipidového metabolizmu bola potvrdená pri hodnotení biologických vlastností uzlovitých lézií v pečeni a pri stagingu HCC. Z dostupných údajov vyplýva, že senzitívnosť FCH nie je redukovaná ani pre tumory malých rozmerov (0,7–2 cm), čo je významná informácia, nakoľko lézie o priemere menej ako 2 cm môžu byť zdrojom falošne negatívnych výsledkov morfologických zobrazovacích metód.
Funkčné zobrazenie primárnych nádorov pečene však stále ostáva relatívne málo preskúmanou oblasťou vyžadujúcou ďalšiu dokumentáciu pri potvrdení vzťahu diagnostických parametrov PET/CT s FDG a s markermi lipidového metabolizmu v závislosti od veľkosti lézie HCC, pri hodnotení prognózy pacientov s HCC, pri restagingu recidivujúceho alebo perzistentného HCC, ako aj pri diferenciálnej diagnostike benígnych uzlovitých lézií pečene (adenóm vs. FNH).
Zdroje
1. Bruix J, Sherman M, Practice Guidelines Committee, American Association for the Study of Liver Diseases: Management of hepatocellular carcinoma. Hepatology 2005;42 : 1208–1236
2. Bennett GL, Krinsky GA, Abitbol RJ et al. Sonographic detection of hepatocellular carcinoma and dysplastic nodules in cirrhosis: correlation of pretransplantation sonography and liver explant pathology in 200 patients. AJR 2002;179 : 75–80
3. Mazzaferro V, Regalia E, Doci R et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996;334 : 693–699
4. Yu NC, Chaudhari V, Raman SS et al. CT and MRI improve detection of hepatocellular carcinoma, compared with ultrasound alone, in pa tients with cirrhosis. Clin Gastroenterol Hepatol. 2011;9 : 161–167
5. Snowberger N, Chinnakotla S, Lepe RM et al. Alpha fetoprotein, ultrasound, computerized tomography and magnetic resonance imaging for detection of hepatocellular carcinoma in patients with advanced cirrhosis. Aliment Pharmacol Ther 2007;26 : 1187–1194
6. Bruix J, Sherman M, Llovet JM et al. Clinical management of hepatocellular carcinoma: conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35 : 421–430
7. Mazzaferro V, Bhoori S, Sposito C et al. Milan criteria in liver transplantation for hepatocellular carcinoma: an evidence-based analysis of 15 years of experience. Liver Transpl. 2011;17 (S2):S44–57
8. Larsson P, Arvidsson D, Björnstedt M et al. Adding 11C-acetate to 18F-FDG at PET examination has an incremental value in the diagnosis of hepatocellular carcinoma. Mol Imaging Radionucl Ther 2012;21 : 6–12
9. Enomoto K, Fukunaga T, Okazumi S et al. Can fluorodeoxyglucose-positron emission tomography evaluate the functional differentiation of hepatocellular carcinoma? Kaku Igaku 1991;28 : 1353–1356
10. Delbeke D, Martin WH, Sandler MP et al. Evaluation of benign vs malignant hepatic lesions with positron emission tomography. Arch Surg 1998;133 : 510–515
11. Trojan J, Schroeder O, Raedle J et al. Fluorine-18 FDG positron emission tomography for imaging of hepatocellular carcinoma. Am J Gastroenterol 1999;94 : 3314–3319
12. Khan MA, Combs CS, Brunt EM et al. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma. J Hepatol 2000;32 : 792–797
13. Teefey SA, Hildeboldt CC, Dehdashti F et al. Detection of primary hepatic malignancy in liver transplant candidates: prospective comparison of CT, MR imaging, US, and PET. Radiology 2003;226 : 533–542
14. Wudel LJ Jr, Delbeke D, Morris D et al. The role of [18F]fluorodeoxyglucose positron emission tomography imaging in the evaluation of hepatocellular carcinoma. Am Surg 2003;69 : 117–124
15. Boursier J, Aubé C, Pilette C et al. Coexistence d’un carcinome hépato-cellulaire et d’une métastase hépatique. Intérêt de la tomodensitométrie par émission de positrons dans les tumeurs du foie. Radiol 2006;87 : 1708–1710
16. Yoon KT, Kim JK, Kim do Y et al. Role of 18F-fluorodeoxyglucose positron emission tomography in detecting extrahepatic metastasis in pretreatment staging of hepatocellular carcinoma. Oncology 2007;72(S1):104–110
17. Lee JE, Jang JY, Jeong SW et al. Diagnostic value for extrahepatic metastases of hepatocellular carcinoma in positron emission tomography/computed tomography scan. World J Gastroenterol 2012;18 : 2979–2987
18. Sugiyama M, Sakahara H, Torizuka T et al. 18F-FDG PET in the detection of extrahepatic metastases from hepatocellular carcinoma. J Gastroenterol 2004;39 : 961–968
19. Ho CL, Yu SC, Yeung DW. 11C-acetate PET imaging in hepatocelluar carcinoma and other liver masses. J Nucl Med 2003;44 : 213–221
20. Ho CL, Chen S, Yeung DW et al. Dual-tracer PET/CT imaging in evaluation of metastatic hepatocellular carcinoma. J Nucl Med 2007;48 : 902–910
21. Ho CL, Chen S, Cheng TK et al. PET/CT characteristics of isolated bone metastases in hepatocellular carcinoma. Radiology 2011;258 : 515–523
22. Cheung TT, Chan SC, Ho CL et al. Can positron emission tomography with the dual tracers [11C]acetate and [18F]fludeoxyglucose predict microvascular invasion in hepatocellular carcinoma? Liver Transpl 2011;17 : 1218–1225
23. Park JW, Kim JH, Kim SK et al. A prospective evaluation of 18F-FDG and 11C-acetate PET/CT for detection of primary and metastatic hepatocellular carcinoma. J Nucl Med 2008;49 : 1912–1921
24. Lindhe O, Sun A, Ulin J et al. [18F]Fluoroacetate is not a functional analogue of [11C]acetate in normal physiology. Eur J Nucl Med Mol Imaging 2009;36 : 1453–1459
25. Ho CL, Cheung MK, Chen S et al. [18F]fluoroacetate positron emission tomography for hepatocellular carcinoma and metastases: an alternative tracer for [11C]acetate? Mol Imaging 2012;11 : 229–239
26. Li CW, Kuo YC, Chen CY et al. Quantification of choline compounds in human hepatic tumors by proton MR spectroscopy at 3 T. Magn Reson Med 2005;53 : 770–776
27. Salem N, Kuang Y, Wang F et al. PET imaging of hepatocellular carcinoma with 2-deoxy-2[18F]fluoro-D-glucose, 6-deoxy-6[18F] fluoro-D-glucose, [1-11C]-acetate and [N-methyl-11C]-choline. Q J Nucl Med Mol Imaging 2009;53 : 144–156
28. Kuang Y, Salem N, Tian H et al. Imaging lipid synthesis in hepatocellular carcinoma with [methyl-11c]choline: correlation with in vivo metabolic studies. J Nucl Med 2011;521 : 98–106
29. Kolthammer JA, Corn DJ, Tenley N et al. PET imaging of hepatocellular carcinoma with 18F-fluoroethylcholine and 11C-choline. Eur J Nucl Med Mol Imaging 2011;38 : 1248–1256
30. Talbot JN, Gutman F, Fartoux L et al. PET/CT in patients with hepatocellular carcinoma using [18F]fluorocholine: preliminary comparison with [18F]FDG PET/CT. Eur J Nucl Med Mol Imaging 2006;33 : 1285–1289
31. Talbot JN, Fartoux L, Balogova S et al. Detection of hepatocellular carcinoma with PET/CT: A prospective comparison of 18F-Fluorocholine and 18F-FDG in patients with cirrhosis or chronic liver disease. J Nucl Med 2010;51 : 1699–1706
32. Peng H, Levin CS. Study of PET intrinsic spatial resolution and contrast recovery improvement for PET/MRI systems. Phys Med Biol 2012;57:N101–115
33. Treglia G, Giovannini E, Di Franco D et al. The role of positron emission tomography using carbon-11 and fluorine-18 choline in tumors other than prostate cancer: a systematic review. Ann Nucl Med 2012;26 : 451–461
34. Balogova S, Bumsel F, Kerrou K et al. La fluorocholine (18F) a une utilité clinique dans le cancer de la prostate et le carcinome hépatocellulaire.parfois chez le même malade. Méd Nucl 2010,34 : 378–382
35. Yamamoto Y, Nishiyama Y, Kameyama R et al. Detection of hepatocellular carcinoma using 11C-choline PET: comparison with 18F-FDG PET. J Nucl Med 2008;49 : 1245–1248
36. Wu HB, Wang QS, Li BY et al. 18F-FDG in conjunction with 11C-choline PET/CT in the diagnosis of hepatocellular carcinoma. Clin Nucl Med 2011;36 : 1092–1097
37. Cheung TT, Ho CL, Lo CM et al. 11C-acetate and 18F-FDG PET/CT for clinical staging and selection of patients with hepatocellular carcinoma for liver transplantation on the basis of Milan criteria: surgeon‘s perspective. J Nucl Med 2013;54 : 192–200
38. Shiomi S, Nishiguchi S, Ishizu H et al. Usefulness of positron emission tomography with fluorine-18-fluorodeoxyglucose for predicting outcome in patients with hepatocellular carcinoma. Am J Gastroenterol 2001;96 : 1877–1880
39. Hatano E, Ikai I, Higashi T et al. Preoperative positron emission tomography with fluorine-18-fluorodeoxyglucose is predictive of prognosis in patients with hepatocellular carcinoma after resection. World J Surg 2006;30 : 1736–1741
40. Seo S, Hatano E, Higashi T et al. Fluorine-18 fluorodeoxyglucose positron emission tomography predicts tumor differentiation, P-glycoprotein expression, and outcome after resection in hepatocellular carcinoma. Clin Cancer Res 2007;13 : 427–433
41. Ahn SG, Kim SH, Jeon TJ et al. The role of preoperative [18F] fluorodeoxyglucose positron emission tomography in predicting early recurrence after curative resection of hepatocellular carcinomas. J Gastrointest Surg 2011;15 : 2044–2052
42. Kitamura K, Hatano E, Higashi T et al. Preoperative FDG-PET predicts recurrence patterns in hepatocellular carcinoma. Ann Surg Oncol 2012;19 : 156–162
43. Yang SH, Suh KS, Lee HW et al. The role of (18)F-FDG-PET imaging for the selection of liver transplantation candidates among hepatocellular carcinoma patients. Liver Transpl 2006;12 : 1655–1660
44. Lee JW, Paeng JC, Kang KW et al. Prediction of tumor recurrence by 18F-FDG PET in liver transplantation for hepatocellular carcinoma. J Nucl Med 2009;50 : 682–687
45. Kornberg A, Freesmeyer M, Bärthel E et al. 18F-FDG-uptake of hepatocellular carcinoma on PET predicts microvascular tumor invasion in liver transplant patients. Am J Transplant 2009;9 : 592–600
46. Kornberg A, Küpper B, Tannapfel A et al. Patients with 18F-FDG non-avid advanced HCC on clinical staging may achieve recurrence-free long-term survival after liver transplantation. Liver Transpl 2012;18 : 53–61
47. Kim BK, Kang WJ, Kim JK et al. 18F-fluorodeoxyglucose uptake on positron emission tomography as a prognostic predictor in locally advanced hepatocellular carcinoma. Cancer 2011;117 : 4779–4787
48. Song MJ, Bae SH, Yoo IeR et al. Predictive value of 18F-fluorodeoxyglucose PET/CT for transarterial chemolipiodolization of hepatocellular carcinoma. World J Gastroenterol 2012;18 : 3215–3222
49. Kucuk ON, Soydal C, Araz M. Prognostic importance of 18F-FDG uptake pattern of hepatocellular cancer patients who received SIRT. Clin Nucl Med 2013;38:e283–289
50. Fartoux L, Balogova S, Nataf V et al. A pilot comparison of 18F-fluorodeoxyglucose and 18F-fluorocholine PET/CT to predict early recurrence of unifocal hepatocellular carcinoma after surgical resection. Nucl Med Commun 2012;33 : 757–765
51. Torizuka T, Tamaki N, Inokuma T et al. Value of fluorine-18-FDG-PET to monitor hepatocellular carcinoma after interventional therapy. J Nucl Med 1994;35 : 1965–1969
52. Anderson GS, Brinkmann F, Soulen MC et al. FDG positron emission tomography in the surveillance of hepatic tumors treated with radiofrequency ablation. Clin Nucl Med 2003;28 : 192–197
53. Chen YK, Hsieh DS, Liao CS et al. Utility of FDG-PET for investigating unexplained serum AFP elevation in patients with suspected hepatocellular carcinoma recurrence. Anticancer Res 2005;25 : 4719–4725
54. Risse JH, Pauleit D, Bender H et al. 18F-FDG-PET and histopathology in 131I-lipiodol treatment for primary liver cancer. Cancer Biother Radiopharm 2009;24 : 445–452
55. Sun L, Guan YS, Pan WM et al. Metabolic restaging of hepatocellular carcinoma using whole-body F-FDG PET/CT. World J Hepatol 2009;1 : 90–97
56. Bieze M, van Gulik TM, Bennink R. Hepatoblastoma evaluated by 18F-fluoromethyl choline PET/CT. Clin Nucl Med 2013;38:e80–82
57. van den Esschert JW, Bieze M, Beuers UH et al. Differentiation of hepatocellular adenoma and focal nodular hyperplasia using 18F-fluorocholine PET/CT. Eur J Nucl Med Mol Imaging 2011;38 : 436–440
58. Bieze M, Bennink RJ, El-Massoudi Y et al. The use of 18F-fluoromethylcholine PET/CT in differentiating focal nodular hyperplasia from hepatocellular adenoma: a prospective study of diagnostic accuracy. Nucl Med Commun 2013;34 : 146–154
59. Roivainen A, Naum A, Nuutinen H et al. Characterization of hepatic tumors using [11C]metomidate through positron emission tomography: comparison with [11C] acetate. EJNMMI Res 2013;3 : 13
60. Magini G, Farsad M, Frigerio M et al. C-11 acetate does not enhance usefulness of F-18 FDG PET/CT in differentiating between focal nodular hyperplasia and hepatic adenoma. Clin Nucl Med 2009;34 : 659–665
61. Dokmak S, Paradis V, Vilgrain V et al. A single-center surgical experience of 122 patients with single and multiple hepatocellular adenomas. Gastroenterology 2009;137 : 1698–1705
62. Stoot JH, Coelen RJ, De Jong MC et al. Malignant transformation of hepatocellular adenomas into hepatocellular carcinomas: a systematic review including more than 1600 adenoma cases. HPB 2010;12 : 509–522
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2014 Číslo 2
Najčítanejšie v tomto čísle- Hodnocení efektivity tyreoeliminace radiojódem u diferencovaného karcinomu štítné žlázy
- Pozitrónová emisná tomografia s markermi lipidového metabolizmu pri funkčnom zobrazení primárnych nádorov pečene
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



