-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tyreoeliminace radiojódem pro diferencovaný karcinom štítné žlázy u nízce rizikových nemocných
Evaluation of the effectiveness of radioiodine ablation for differentiated thyroid carcinoma at low-risk patients
Introduction:
Postoperative radioiodine (RJ) ablation (TERJ) with a preferred use of low dose can be indicated also at low-risk patients with a differentiated thyroid carcinoma (DTC) according to current guidelines.Aim:
Assessment of TERJ effectivity used in low-risk patients with DTC after applying of 1.1 GBq of 131I.Material:
61 pts (53 females) with a DTC after declared total thyroidectomy due to a papillary or papillary-follicular cancer (60 pts) and follicular cancer (1 pt). Classification according to the tumor volume was as follows: T1a 45 pts, T1b 10 pts, and T2 6 pts.Methods:
Pts were admitted to our department at hypothyroidism; neck scintigraphy with the detection of residual thyroid tissue after surgery was assessed. Initial level of thyroglobulin (Tg) ranges from < 0.1 to 9.0 µg/l. Blood content of antibody against Tg (anti-Tg) was increased in 18 cases (0.9–333 U/ml). Radioiodine ablation dose of 1.1 GBq was applied in all pts. Rehospitalization again at hypothyroidism was performed 6 months later; whole-body scan was done after a diagnostic dose of 110 MBq 131I. Negative scintigraphy at the region of the neck together with a low level of Tg below 2 µg/l or decline of anti-Tg in pts with a low Tg <0.1 µg/l was considered as an effective TERJ.Results:
Negative follow-up scintigraphy with no detectable thyroid tissue was present in 52/61 pts. The second criterion, i.e. level of Tg below 2 µg/l or decline of anti-Tg was present in all these pts; the therapeutic effectivity of TERJ was thus 85.2 %. TERJ was not effective in 9/61 pts (14.8 %).Conclusion:
According to our experience, the efficacy of TERJ after applying of 1.1 GBq of 131I (85.2 %) is comparable to the literature and also to our previous results with a group of 131 pts after applying of 3.7 GBq of 131I form the years 2007 to 2012, when the therapeutic effectivity was 80 %.Key Words:
low-risk differentiated thyroid carcinoma, radioiodine ablation, whole-body scintigraphy, level of thyroglobulin
Autoři: Vladimír Dedek 1,2; Hana Materová 1,3
Působiště autorů: Klinika nukleární medicíny, FN Ostrava, ČR 1; Ústav zobrazovacích metod, 3 Katedra biomedicínských oborů, Lékařská fakulta, Ostravská univerzita v Ostravě, ČR 2
Vyšlo v časopise: NuklMed 2018;7:22-31
Kategorie: Původní práce
Souhrn
Úvod:
Podle aktuálních doporučení může být pooperační tyreoeliminace radiojódem (TERJ) indikována i u nízce rizikových nemocných s diferencovaným karcinomem štítné žlázy (DTC) s preferovaným použitím redukované dávky radiojódu (RJ).Cíl:
Hodnocení úspěšnosti TERJ u nízce rizikových nemocných s DTC po aplikaci 1,1 GBq 131I.Materiál:
61 nemocných (53 žen a 8 mužů) s DTC po deklarované totální tyreoidektomii pro papilární či papilárně-folikulární karcinom (60 osob) a folikulární karcinom (1 pacient). Zastoupení podle velikosti tumoru: T1a 45 pacientů, T1b 10 pacientů, T2 6 pacientů.Metodika:
Hospitalizace na KNM v hypotyreóze, provedení scintigrafie krku s hodnocením zbytků tyreoidální tkáně po operaci. Vstupní hladina tyreoglobulinu (Tg) se pohybovala v intervalu < 0,1–9,0 µg/l. Hladina protilátek anti-Tg byla zvýšena v 18 případech (0,9–333 U/ml). U 61 nemocných byla podána tyreoablační dávka 1,1 GBq 131I. Rehospitalizace za 6 měsíců po TERJ v hypotyreóze, celotělová scintigrafie po diagnostické dávce 110 MBq 131I. Kritériem úspěšné TERJ byl negativní nález v oblasti krku při scintigrafii a hladina Tg pod 2 µg/l, u nízkých hodnot Tg < 0,1 µg/l byl hodnocen pokles hladiny anti-Tg.Výsledky:
Při kontrolní celotělové scintigrafii nebyla patrná na krku žádná tyreoidální tkáň u 52/61 nemocných. Ve všech těchto případech bylo splněno i druhé kritérium hladiny Tg pod 2 µg/l, event. pokles anti-Tg, což činí efektivitu TERJ 85,2 %. V 9/61 případů (14,8 %) TERJ nebyla úspěšná.Závěr:
Podle našich zkušeností se jeví efektivita TERJ po podání 1,1 GBq 131I (85,2 %) srovnatelná s literárními údaji i s našimi výsledky u skupiny 131 pacientů z let 2007–2012 po aplikaci 3,7 GBq 131I, kdy efektivita TERJ činila 80 %.Klíčová slova:
diferencovaný karcinom štítné žlázy s nízkým rizikem, tyreoeliminace radiojódem, celotělová scintigrafie, hladina tyreoglobulinuÚvod
Diferencovaný karcinom štítné žlázy (DTC) vycházející z folikulárních buněk zahrnuje až 90 % malignit tyreoidey. 1 Incidence všech typů neoplazie štítné žlázy se ve Spojených státech amerických od roku 1975 do roku 2009 prakticky ztrojnásobila. 2 Tento prudký nárůst počtu nemocných lze vysvětlit kombinací různých faktorů. Jedná se o skutečné zvýšení počtu případů v důsledku zvýšené expozice populace ionizujícím zářením a působením dosud neznámých karcinogenů, ale také o výsledek aplikace moderních diagnostických postupů, které umožňují zachytit i subklinické fáze onemocnění. 3 Za několik posledních dekád došlo k růstu incidence zejména u karcinomu papilárního typu. 4 Rakouští autoři dokládají za období 36 let (1975–2010) progresivní zvyšování podílu papilárních mikrokarcinomů velikosti do 1 cm (T1a – dle aktuální TNM klasifikace) a to ve srovnání s ostatními klinickými klasifikacemi (T1b–T4) hlavně v poslední sledované dekádě. 5 Součástí interdisciplinárního léčebného postupu u nemocných s DTC je tyreoeliminace radiojódem (TERJ) navazující na totální tyreoidektomii (TTE). Pooperační podání radiojódu má svá obecně známá opodstatnění, kterými jsou ablace reziduální tyreoidální tkáně s dosažením nedetekovatelné hladiny tyreoglobulinu (Tg) v séru, eliminace potenciálních mikroskopických nádorových fokusů a v neposlední řadě i možnost provedení celotělové scintigrafie, která jakožto jediná zobrazovací metoda umožní detekci případných jód akumulujících ložisek a tím stanoví i aktuální restaging choroby vedoucí k restratifikaci nemocných. 6–8 Současně však nelze opomenout zejména střednědobé a dlouhodobé nežádoucí účinky spojené s paušálním prováděním TERJ v minulých desetiletích. 9 Pro snížení míry potenciálních vedlejších efektů 131I hlavně u pacientů s nízkým rizikem směřují aktuální trendy nejen k jeho individualizovanému indikování, ale také k podávání nižší dávek radioaktivity. 10
Za účelem tyreoablace reziduální tyreoidální tkáně jsme vzhledem k uvedeným skutečnostem začali na našem pracovišti u nízce rizikových pacientů s DTC od roku 2014 podávat redukovanou dávku radiojódu.
Cíl
Cílem naší práce je zhodnotit efektivitu TERJ u nízce rizikových pacientů s DTC po podání tyreoablační dávky radioaktivity 1,1 GBq 131I ve srovnání se standardně podávanou aktivitou 3,7 GBq 131I.
Materiál a metoda
Na základě indikace endokrinologa k TERJ po provedené deklarované TTE jsme na našem pracovišti od října 2014 do konce září 2017 podali uvedené redukované množství radiojódu celkem 65 pacientům s DTC. Kontrolní hospitalizaci pro celotělovou scintigrafii v myxedému jsme vždy prováděli 6 měsíců po TERJ. Pro potvrzení úspěšné TERJ bylo nutné současně splnit dvě hlavní kritéria: prvním z nich byl negativní scintigrafický nález v oblasti krku a druhým hladina Tg pod 2 µg/l. V případě neměřitelně nízké vstupní hladiny Tg (< 0,1 µg/l) bylo použito pomocné kritérium, a to pokles hladiny anti-Tg.
V době hodnocení byla kontrolní hospitalizace zrealizována u 61 (53 žen a 8 mužů) ze 65 nemocných. V 53/61 případů se jednalo o papilární karcinom, u 7 nemocných o folikulární typ papilárního karcinomu a v jednom případě byl nalezen folikulární karcinom. U 45 nemocných byla velikost primárního tumoru podle TNM klasifikace T1a, u 10 pacientů T1b, u 6 nemocných T2. V 6 případech se jednalo o multicentrický karcinom, přičemž jen 2x byla ložiska nádoru v obou lalocích. Invaze do pouzdra tumoru byla zaznamenána v pěti vzorcích. Angioinvaze ani extratyreoidální šíření nádoru nebyly popisovány. V době stanovení diagnózy nebylo zaznamenáno u žádného z nemocných postižení lymfatických uzlin (N0 resp. NX) ani vzdálené metastázy. (Tab. 1).
Tab. 1. Charakteristika souboru pacientů. Vysvětlivky: TNM (Klasifikace zhoubných nádorů, 7. vydání, 2009, česká verze 2011), N – počet nemocných, (m) – multicentrický tumor, invaze – prorůstání do pouzdra tumoru. 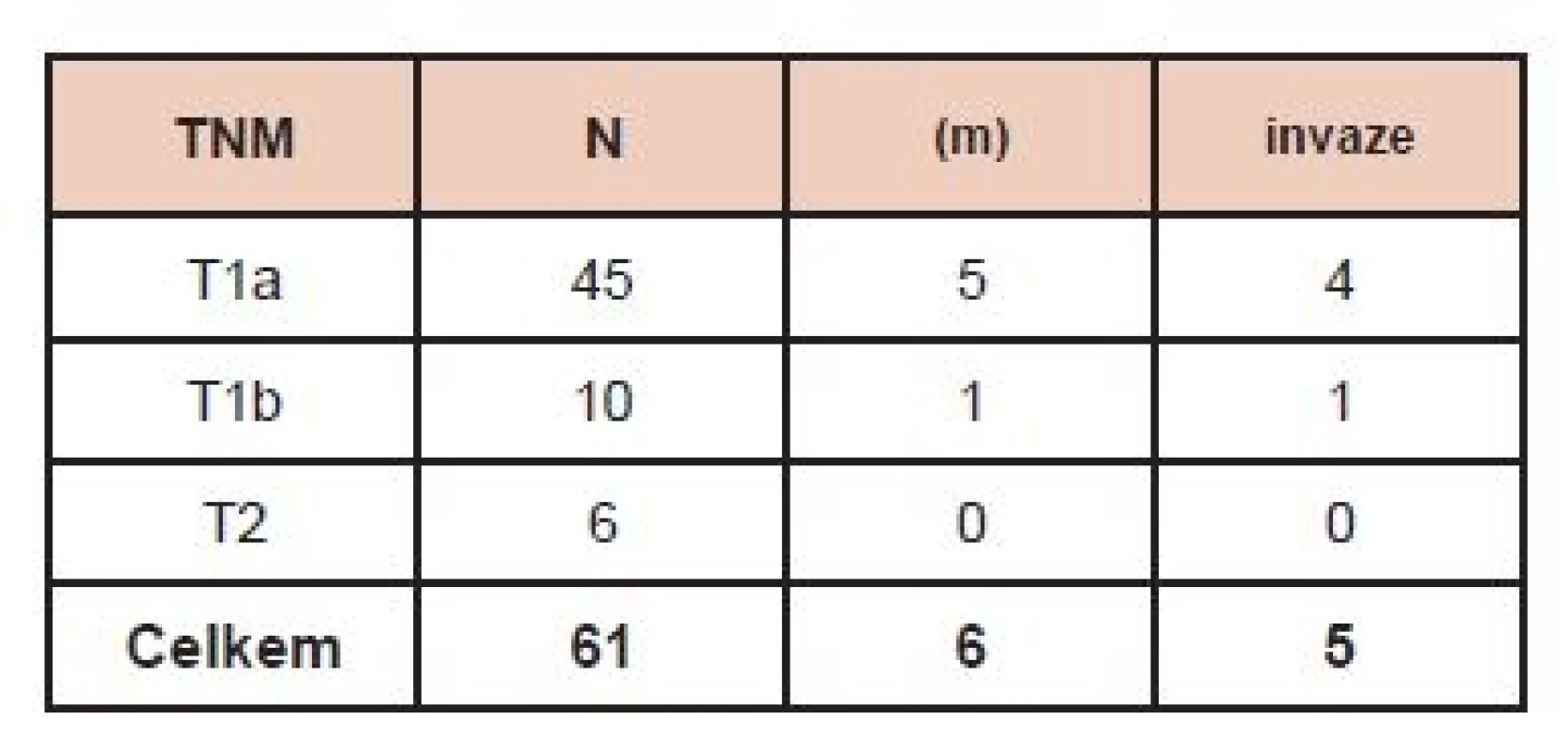
V rámci první hospitalizace na KNM jsme odebírali testy in vitro k ověření stupně hypotyreózy s požadovanou optimální hladinou TSH nad 30 mU/l. Dále jsme stanovovali koncentraci Tg a protilátek proti tyreoglobulinu (anti-Tg) v séru. U všech nemocných jsme nejprve provedli scintigrafii oblasti krku po podání 20 MBq 131I k vizuálnímu hodnocení reziduální tyreoidální tkáně. U 44/61 nemocných jsme měřili akumulaci RJ v oblasti krku v procentech za 6 a 24 hodin. V případě nezobrazení zbytků štítné žlázy nebo při akumulaci RJ mimo lůžko štítné žlázy jsme prováděli celotělovou scintigrafii (WB) a SPECT/CT krku za 3–5 dní po podání 1,1 GBq 131I. Poté jsme nasazovali hormonální substituci, po 2–3 měsících při ambulantní kontrole ověřovali její dostatečnost vyšetřením hladin FT4 a TSH a naplánovali termín kontrolní hospitalizace v myxedému s odstupem 6 měsíců od první hospitalizace. Jeden měsíc před rehospitalizací jsme hormony štítné žlázy nemocným vysadili.
V průběhu druhé hospitalizace jsme opět posuzovali hladiny TSH, Tg a anti-Tg, aplikovali diagnostickou dávku 110 MBq 131I a za 48 hodin provedli WB scintigrafii, případně SPECT/CT (CT v „low dose“ režimu) oblasti krku a hrudníku.
Výsledky
Při první hospitalizaci byla u všech 61 pacientů hladina Tg v intervalu < 0,1–9,0 µg/l. Hladina anti-Tg byla zvýšena v 18 případech (0,9–333 U/ml), přičemž u osmi z nich byla hladina Tg ≤ 0,1 µg/l. Akumulace RJ za 24 hodin byla pouze ve dvou případech nad 10 % (11 % resp. 13 %). Scintigraficky jsme u 2/61 nemocných již při první hospitalizaci neprokázali žádnou reziduální tyreoidální tkáň, a to ani při WB scintigrafii po podání tyreoablační dávky RJ. V těchto případech tak můžeme hovořit o stavu po TTE. V 59/61 případů jsme scintigraficky detekovali 1–4 drobné okrsky reziduální tyreoidální tkáně v lůžku štítné žlázy, nejčasněji v oblasti lobus pyramidalis. Ve třech případech jsme prokázali akumulaci RJ mimo lůžko štítné žlázy, což ukazovalo na možné postižení lymfatických uzlin (LU) a to v jednom případě nízko na krku za pravým sternoklavikulárním skloubením a ve dvou případech v laterální části krku vpravo. Palpační nález však byl negativní a ani USG vyšetření v těchto případech nebylo jednoznačně pozitivní.
Při kontrolní hospitalizaci jsme při WB scintigrafii u 52/61 pacientů (skupina A – úspěšná TERJ) v oblasti krku neprokázali žádnou reziduální tyreoidální tkáň. (Příklad úspěšné TERJ – Obr. 1a–1c)
Obr. 1a Scintigram krku po dg. aplikaci 20 MBq 131I – bez reziduální tyreoidální tkáně. Vysvětlivky: vlevo nativní scintigram, vpravo značení – scintigram stejné oblasti se značkou v místě jugula a nad ním značení jizvy po nTTE. 
Obr. 1b Scintigram krku 5 dní po podání 1,1 GBq 131I – reziduum v lůžku štítné žlázy vlevo (stejný pacient jako na Obr. 1a). Vysvětlivky: vlevo nativní scintigram, vpravo značení – scintigram stejné oblasti se značkou v místě jugula a nad ním značení jizvy po nTTE. 
Obr. 1c Celotělová scintigrafie po dg. aplikaci 180 MBq 131I za 6 měsíců po TERJ – bez reziduální tyreoidální tkáně (stejný pacient jako na Obr. 1a, 1b). 
U 9/61 (skupina B – neúspěšná TERJ) byly při WB scintigrafii detekovány v lůžku št. žlázy okrsky tyreoidální tkáně a ve dvou případech i okrsky ukazující na pravděpodobné postižení regionálních LU. V těchto 9 případech jsme indikovali terapii dávkou 7,4 GBq 131I.
První kritérium úspěšné TERJ bylo tedy splněno u 52/61 nemocných. Při kontrolní hospitalizaci byla hladina Tg u všech 61 pacientů < 0,1–1,5 µg/l. Druhé kritérium bylo tedy splněno u všech 61 nemocných. U 7/8 pacientů se vstupní hladinou Tg < 0,1µg/l byl potvrzen pokles hladiny anti-Tg, pouze v jednom případě scintigraficky neúspěšné TERJ byl zjištěn nárůst hladiny anti-Tg. Ve dvou případech již vstupně negativní WB scintigrafie a hladiny Tg < 0,1 µg/l jsme také použili pomocné kritérium poklesu anti-Tg. Z celkového hodnocení tak vyplývá úspěšnost TERJ u 52/61 pacientů, která tak činí 85,2 %. (Obr. 2a–2c, Obr. 3a–3d)
Obr. 2a Scintigram krku 5 dní po podání po 1,1 GBq 131I – reziduum v lůžku štítné žlázy vpravo. Vysvětlivky: vlevo nativní scintigram, vpravo značení – scintigram stejné oblasti se značkou v místě jugula kaudálně a nad ním s vyznačením jizvy po nTTE. 
Obr. 2b Celotělová scintigrafie a SPECT/CT po dg. aplikaci 180 MBq 131I za 6 měsíců po TERJ – reziduální tyreoidální tkáň v lůžku štítné žlázy vpravo (stejný pacient jako na Obr. 2a). 
Obr. 2c Celotělová scintigrafie a SPECT/CT po terapii 7,4 GBq 131I – reziduální tyreoidální tkáň v lůžku štítné žlázy vpravo (stejný pacient jako na Obr. 2a, 2b). 
Obr. 3a Scintigram krku po dg. aplikaci 20 MBq 131I – rezidua tyreoidální tkáně v lůžku štítné žlázy oboustranně a v místě lobus pyramidalis. Vysvětlivky: vlevo nativní scintigram, vpravo značení - scintigram stejné oblasti se značkou v místě jugula a nad ním značení jizvy po nTTE. 
Obr. 3b Celotělová scintigrafie a SPECT/CT po dg. aplikaci 180 MBq 131I za 6 měsíců po TERJ – reziduální tyreoidální tkáň v místě lobus pyramidalis (stejný pacient jako na Obr. 3a). 
Obr. 3c Celotělová scintigrafie a SPECT/CT 5 dní po terapii 7,4 GBq 131I – reziduální tyreoidální tkáň v místě lobus pyramidalis a v lůžku štítné žlázy vlevo – viz šipky, (stejný pacient jako na Obr. 3a, 3b). 
Obr. 3d Celotělová scintigrafie a SPECT/CT 5 dní po terapii 7,4 GBq 131I – okrsek akumulace RJ nízko na krku vpravo, viz šipka – v.s. akumulující metastáza v lymfatické uzlině (stejný pacient jako na Obr. 3a, 3b, 3c). 
Dále jsme se zabývali závislostí výsledku úspěšné TERJ na vstupní hladině Tg při první hospitalizaci. V důsledku všeobecně známé nespolehlivosti nízkých hodnot Tg při pozitivitě anti-Tg jsme z analýzy vyřadili 8/61 (6 ze skupiny A a 2 ze skupiny B) velmi nízkých vstupních hladin tyreoglobulinu (Tg ≤ 0,1µg/l) při současném pozitivním nálezu anti-Tg protilátek. U posuzovaných 46/53 nemocných (skupina A – úspěšná TERJ) se vstupní hladina Tg pohybovala v rozmezí 0,2–9 µg/l (průměr 1,83 µg/l) a u 7/53 pacientů (skupina B – neúspěšná TERJ) mezi 0,4–6 µg/l (průměr 1,87 µg/l). Uvádíme grafické znázornění hladin Tg před a po provedení TERJ u 53 nemocných – Graf 1 a 2. Rovněž nás zajímalo, kolikanásobně klesla po TERJ hladina Tg u jednotlivých osob a také průměrný koeficient tohoto poklesu, který u 53 nemocných činil 10,74.
Graf 1. Hladina Tg (tyreoglobulin) před a po tyreoeliminaci 1,1 GBq 131I. Vysvětlivky: hladina Tg (μg/l), 53 nemocných (bez 8/61 pacientů s hladinou Tg ≤ 0,1 μg/l). 
Graf 2. Hladina Tg (tyreoglobulin) před a po tyreoeliminaci 1,1 GBq 131I. Vysvětlivky: pokles hladiny Tg (μg/l) u 53 nemocných (viz Graf 1). 
Pro srovnání s výsledky po aplikaci standardní dávky radioaktivity 3,7 GBq 131I jsme použili data z naší práce z roku 2014, kdy jsme u souboru 131 nemocných zjistili efektivitu TERJ 80 %. 11 Současně předkládáme aktuálně provedené grafické znázornění dat z minulé práce, které se týká dynamiky změn hladiny Tg před a po TERJ dávkou radioaktivity 3,7 GBq 131I. Do grafů (Graf 3 a 4) jsme zaznamenali hladiny Tg 109/131 nemocných po vyřazení hodnot 22/131 pacientů s prokázaným postižením regionálních lymfatických uzlin (N1) či se vzdálenými akumulujícími metastázami (M1) a také s nízkou hladinou Tg ≤ 0,1µg/l při pozitivitě protilátek anti-Tg. Hladina Tg se u 109/131 osob pohybovala v rozmezí od 0,2 do 15,9 µg/l. Výsledný průměrný koeficient poklesu Tg před a po TERJ byl 8,37.
Graf 3. Hladina Tg (tyreoglobulin) před a po tyreoeliminaci 3,7 GBq 131I. Vysvětlivky: hladina Tg (μg/l), 109 nemocných (bez 22/131 pacientů s metastázami v lymfatických uzlinách, vzdálenými metastázami a hladinou Tg ≤ 0,1 μg/l). 
Graf 4. Hladina Tg (tyreoglobulin) před a po tyreoeliminaci 3,7 GBq 131I. Vysvětlivky: pokles hladiny Tg (μg/l) u 109 nemocných (viz Graf 3). 
Z porovnání průměrných koeficientů poklesu hladiny Tg vyplývá vícenásobný pokles vstupních hodnot Tg po redukované dávce RJ.
Diskuze
Obdobný trend ve zvyšování počtu nádorů štítné žlázy jako v zahraničí pozorujeme také v České republice. Podle statistiky českého ÚZIS došlo v letech 2000–2015 prakticky ke zdvojnásobení incidence novotvarů tyreoidey u mužů z 2,4 na 4,7 případů/100000 a u žen z 8,2 na 16,8/100000 osob. V absolutních počtech u obou pohlaví to v součtu znamená vzestup z 549 na 1143 případů za rok. 12,13
Zejména posun směrem k vysokému zastoupení mikrokarcinomů vedl k odborným diskuzím o aktualizaci stávajících doporučených léčebných postupů. Konsenzus odborníků lze spatřovat zejména v nutnosti stratifikace nemocných ve smyslu posouzení rizik perzistence, rekurence a diseminace základního onemocnění. Obsáhlý materiál vydala v roce 2015 Americká tyreologická asociace (ATA), která u nízce rizikových případů doporučuje méně radikální operační postupy a zužuje také indikace k pooperačnímu podání radiojódu. 14 Podle uvedeného dokumentu ATA spadají do skupiny nízce rizikových pacientů („low risk“) dobře diferencované papilární a folikulární karcinomy klasifikace T1–T2, N0, NX ,M0, MX. Za agresivnější histologické varianty, které již posunují nemocné do středního rizika („intermediate risk“), jsou považovány papilární karcinomy s histologií z vysokých či sloupcových buněk, onkocytární, inzulární, sklerózující a trabekulární varianty a dále známky agresivnějšího biologického chování jako extratyreoidální šíření a vaskulární invaze nádoru.
V zahraniční literatuře se objevily práce posuzující výsledky sledování nemocných po rozdílně radikálních operačních výkonech. Například podle multicentrické studie japonských autorů souboru 173 nemocných s velikostí primárního nádoru 1–5 cm nebyl zjištěn signifikantní rozdíl v četnosti rekurencí nádoru a celkovém přežití mezi skupinou 120 osob po jednostranné tyreoidální lobektomii (TL) a 53 osob po TTE. 15 Naopak byl prokázán mírně vyšší podíl recidiv nádoru u nemocných s papilárním mikrokarcinomem (PMC) menším než 1 cm (T1a) po provedené TL ve srovnání s TTE v rámci metaanalýzy dat velkého souboru téměř 3000 pacientů sledovaných v letech 2002–2013. 16
Podle pražských autorů vedla analýza souboru 1980 pacientů s PMC klasifikace T1 rozdělených podle velikosti do čtyř skupin ke zjištění zvyšujícího se podílu relapsů v rozmezí 3 % – 10 %, který byl přímo úměrný velikosti primárního nádoru. 17 Ve stejné práci autoři prováděli TERJ jen v případě přítomnosti rizikových faktorů, které se v zásadě shodují s doporučeními ATA. U skupiny nemocných T1a se prakticky nelišily počty relapsů v závislosti na podání či nepodání tyreoablační dávky RJ. Volba léčebné strategie a další sledování nemocných je tak i v České republice doporučováno a přizpůsobováno dle aktuálně zjištěné rizikovosti pacientů. 18
Otázka zařazování pooperační TERJ je prakticky celosvětově stále diskutována. V Kanadě a USA byl proveden průzkum názoru odborníků s otázkou, zdali by provedli TERJ u hypotetické 38leté pacientky po nTTE s nálezem ohraničeného unifokálního PMC. Limitovaná disekce regionálních lymfatických uzlin byla z hlediska nádoru negativní, histologicky nádor nevykazoval jiné rizikové faktory. Více než 60 % respondentů (295 ze 470) jednoznačně doporučovalo provedení TERJ z důvodu snížení pravděpodobnosti relapsu. 19 Italští autoři zkoumali klinické chování PMC menšího než 1,5 cm u 284 nemocných po nTTE a TTE v období let 1975–2001. Incidentalomy bez rizikových histologických známek vykazovaly relaps či perzistenci choroby v 5,2 % případů, nonincidentalomy bez rizikových faktorů v 10,4 % případů. Překvapivě vysoký byl výskyt šíření tumoru přes pouzdro štítné žlázy (20 % případů) a lokoregionální uzlinové metastázy (30,1 % případů). Tyreoablační dávka radiojódu byla podávána diferencovaně – 1110 MBq 131I nemocným bez rizikových histologických známek, ostatním pak 3700 MBq 131I. 20 V další práci autoři zjistili u 30 z 85 pacientů (35 %) s primárním unifokálním či multifokálním PMC klasifikace T1a při negativním ultrazvukovém nálezu metastatické postižení regionálních mízních uzlin na základě SPECT/CT vyšetření po podání tyreoablační dávky RJ. Tento příklad scintigrafické precizace pooperačního stagingu podporuje provádění TERJ i u nemocných, u nichž není RJ obecně doporučován. 21
Podávání nižších dávek radioaktivity za účelem TERJ u DTC sahá historicky až do 70. let minulého století, mimo jiné také za účelem vyhnutí se nutnosti hospitalizace. 22 Autoři v uvedené práci aplikovali po nTTE 80–100 mCi 131I 28 nemocným a 30 mCi 131I 36 nemocným. Po uplynutí více než 5 let sledování konstatovali srovnatelný efekt TERJ stran výskytu remisí onemocnění u obou skupin. Práce z 90. let 20. století dokládá úspěšné dosažení tyreoablace po aplikaci 1110 MBq 131I po nTTE u nemocných s menším povrchem těla a menším reziduem funkční tyreoidální tkáně měřeným planimetricky na celotělovém scintigramu. 23 V další zprávě je uváděna srovnatelná efektivita TERJ přes 90 % u 238 nemocných po nTTE po aplikaci dávek 30, 50, 60, 80 a 85 mCi 131I, které byly podávány diferencovaně podle procentuální akumulace RJ v oblasti lůžka tyreoidey 24 Úspěšnost TERJ mezi 63 % – 77 % při používaném širokém rozpětí používaných dávek radioaktivity 131I (od 25 mCi až po 200 mCi) dokládají dostatečnou dosaženou dávku záření 300 Gy v reziduální tyreoidální tkáni již po použití 50 mCi, přičemž další zvyšování podávané aktivity RJ již nevedlo k vyšší úspěšnosti. 25
Podle aktuálních trendů není potřeba provádět TERJ u nízce rizikových nemocných v případě kompletně provedené operace (TTE). Indičtí autoři předkládají výsledky souboru 322 osob rozdělených na dvě skupiny. V první skupině podávali tyreoablační aktivitu 30 mCi 131I 153 nemocným se scintigraficky prokázaným reziduem nebo akumulací RJ v oblasti krku nad 0,2 % nebo při Tg nad 10 ng/ml, u zbývajících 169 byla podle uvedených kritérií povrzena TTE a RJ tudíž podán nebyl. Po dobu 10letého sledování nebyl mezi oběma skupinami rozdíl ve výskytu recidiv choroby. 26
Další práce přinášejí srovnání efektivity TERJ po podání 1,1 a 3,7 GBq 131I. V první z nich je na souboru 684 nemocných doložena obdobná efektivita TERJ nad 90 % u obou použitých dávek a také nebyl rozdíl mezi přípravou endogenní stimulací TSH vysazením substituce a aplikací rekombinantního humánního TSH. 27 Ve druhém příspěvku zjistili finští autoři obdobnou efektivitu TERJ u 160 pacientů náhodně rozdělených do skupin po 1,1 a 3,7 GBq 131I a navíc zdůraznili výhodu kratší doby hospitalizace a menšího výskytu nežádoucích účinků typu nauzey a poruchy chuti u skupiny s nižší aplikovanou aktivitou RJ. 28 K obdobným závěrům došli autoři třetí práce stran shodné efektivity TERJ po 1,1 a 3,7 GBq 131I (nad 80 %) u více než 400 nízce rizikových nemocných a to exogenní i endogenní stimulací TSH. 29 Rovněž je uváděn nižší výskyt a menší závažnost vedlejších účinků po podání redukované dávky RJ (21 % vs. 33 %). Další snížení podávané dávky radioaktivity na 800 MBq 131I a její srovnatelný efekt úspěšné TERJ s obvykle podávanou aktivitou 3,7 GBq RJ dokládají autoři u skupiny 108 nemocných s karcinomem s nízkým rizikem. 30
V současnosti je také diskutována možná indukce vzniku sekundárních nádorů u pacientů s DTC léčených radiojódem. Na základě dlouhodobého sledování téměř 10 tisíc pacientů po terapii RJ bylo zjistěno signifikantní přídatné riziko až od kumulativních dávek převyšujících 40 GBq 131I. 31 Předmětem diskuzí je hlavně vzrůstající podíl nízce rizikových nemocných léčených RJ. Ve Spojených státech se podíl těchto pacientů od roku 1973 do roku 2007 zvýšil ze 3 % na 38 %. Ve sledovaném období byl u takto léčených pacientů zjištěn vyšší výskyt nádorů slinných žláz a leukemií ve srovnání se vzorkem běžné populace. 32 Aspekt možného druhotného vzniku neoplazií tak podporuje přístup uvážlivé individuální indikace podávání RJ nízce rizikovým pacientům s DTC.
Závěr
Tyreoeliminace radiojódem po chirurgem deklarované TTE je nedílnou součástí komplexního léčebného postupu u nemocných s diferencovaným karcinomem štítné žlázy. Podle naší zavedené spolupráce s klinickými partnery konzultuje pooperační indikaci k TERJ endokrinolog s lékařem nukleární medicíny a samozřejmě také se souhlasem poučeného pacienta. Prvotním cílem je chirurgická TTE. V praxi jsme si však u skupiny 131 operovaných osob v letech 2007–2012 scintigraficky ověřili, že skutečně provedené TTE byly pouze čtyři, což činí 3 %. 11 K obdobnému zjištění jsme dospěli v naší současné práci, kdy jsme scintigraficky potvrdili TTE jen u 2 ze 61 pacientů (3,2 %). Za účelem dokončení TTE a také scintigrafické precizace stagingu v rámci individualizovaného teranostického postupu považujeme provedení TERJ za indikované i u nízce rizikových nemocných.
V rámci obecného trendu snižování radiační zátěže podáváme u této skupiny pacientů dávku radiojódu 1,1 GBq. Podle našich dosavadních zkušeností se jeví efektivita TERJ po podání 1,1 GBq 131I (85,2 %) srovnatelná s literárními údaji i našimi zkušenostmi z let 2007–2012 11 po aplikaci 3,7 GBq 131I, kdy efektivita TERJ činila 80 %.
Zdroje
- Sherman SI, Thyroid carcinoma. Lancet 2003;361 : 501-511
- Davies L, Welch HG. Current thyroid cancer trends in the United States, JAMA Otolaryngol Head Neck Surg 2014;140 : 317–322
- Pellegriti G, Frasca F, Regalbuto C et al. Worldwide increasing incidence of thyroid cancer: update on epidemiology and risk factors. [online] J Cancer Epidemiol 2013. [cit. 2018-03-15]. Dostupné na: DOI: <http://dx.doi. org/10.1155/2013/965212>.
- Aschebrook-Kilfoy B, Schechter RB, Shih YC et al. The clinical and economic burden of a sustained increase in thyroid cancer incidence. Cancer Epidemiol Biomarkers Prev 2013;22 : 1252–1259
- Gschwandtner E, Klatte T, Swietek N et al. Increase of papillary thyroid microcarcinoma and a plea for restrictive treatment: A retrospective study of 1391 prospective documented patients. Surgery 2016;159 : 503-511
- Schlumberger MJ. Papillary and follicular thyroid carcinoma. N Engl J Med 1998;338 : 297-306
- Cooper DS, Doherty GM, Haugen BR et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19 : 1167-1214
- Pacini F, Schlumberger M, Dralle H et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006;154 : 787-803
- Clement SC, Peeters RP, Ronckers CM et al. Intermediate and long-term adverse effects of radioiodine therapy for differentiated thyroid carcinoma - a systematic review. Cancer Treat Rev 2015;41 : 925–934
- Ambrosetti MC, Colato C, Dardano A et al. Radioiodine ablation: when nad how. Q J Nucl Med Mol Imaging 2009;53 : 473-481
- Dedek V, Formánek M, Matoušek P. Hodnocení efektivity tyreoeliminace radiojódem u diferencovaného karcinomu štítné žlázy. NuklMed 2014;3 : 31-36
- Publikace ÚZIS, Novotvary 2000 Česká republika. [online] ISBN: 80-7280-168-6, [cit. 2018-02-10]. Dostupné na: http://www.uzis.cz/publikace/novotvary-2000
- Publikace ÚZIS, Novotvary 2015 Česká republika. [online] [cit. 2018-02-10]. Dostupné na: http://www.uzis.cz/publikace/novotvary-2015
- Haugen BR, Alexander EK, Bible KC et al., 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016;26 : 1–133
- Kuba S, Yamanouchi K, Hayashida N et al. Total thyroidectomy versus thyroid lobectomy for papillary thyroid cancer: Comparative analysis after propensity score matching: A multicenter study. International Journal of Surgery 2017;38 : 143-148
- Macedo FIB, Mittal VK. Total thyroidectomy versus lobectomy as initial operation for small unilateral papillary thyroid carcinoma: A meta-analysis. Surgical Oncolog 2015;24 : 117-122
- Vlček P, Nováková D, Vejvalka J a kol. Návrh optimálního léčebného postupu v léčbě nizkorizikového karcinomu štítné žlázy. Vnitřní Lékařství 2015;61 : 769-777
- Vlček P, Nováková D. Karcinomy štítné žlázy - současné léčebné postupy. Vnitřní Lékařství 2016;62 : 115-120
- Sawka AM, Goldestein DP, Thabane L et al. Basis for physician recommendations for adjuvant radioiodine therapy in early-stage thyroid carcinoma:principal findings of the Canadian-American thyroid cancer survey. Endocrine practice 2008;14 : 175-184
- Pellegriti G, Scollo C, Lumera G, et al. Clinical behaviour nad outcome of papillary thyroid cancers smaller than 1.5 cm in diameter: Study of 299 cases. J Clin Endocrin Metab 2004;89 : 3713-3720
- Gallicchio R, Giacomobono S, Capacchione D et al. Should patients with remnants from thyroid microcarcinoma really not be treated with iodine-131 ablation? Endocrine 2013;44 : 426-433
- Mc Cowen KD, Adler PA, Ghaed N et al. Low dose radioiodine thyroid ablation in postsurgical patients with thyroid cancer. Am J Med 1976;61 : 52-55
- Comtois R, Thériault C, Del Vecchio P. Assessment of the efficacy of iodine-131 for thyroid ablation. J Nucl Med 1993;34 : 1927-1930
- Zidan J, Hefer E, Iosilevski G et al. Efficacy of I-131 ablation therapy using different doses as determined by postoperative thyroid scan uptake in patients with differentiated thyroid cancer. Int J Radiat Oncol Biol Phys 2004;59 : 1330-1336
- Bal CH, Padhy AK, Jana S et al. Prospective randomized clinical trial to evaluate the optimal dose of 131 I for remnant ablation in patients with differentiated thyroid carcinoma. Cancer 1996;77 : 2574-2580
- Bal CH, Ballal S, Soundararajan R et al. Radioiodine remnant ablation in low-risk differentiated thyroid cancer who had R0 dissection is an over treatment. Cancer Medicine 2015;4 : 1031-1038
- Schlumberger M, Catargi B, Borget I et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med 2012;366 : 1663–1673
- Maenpaa HO, Heikkonen J, Vaalavirta L et al. Low vs. high radioiodine activity to ablate the thyroid after thyroidectomy for cancer: a randomized study. 2008, PLoS One 3:e1885
- Mallick U, Harmer C, Yap B et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med 2012;366 : 1674–1685
- Caglar M, Bozkurt FM, Akca CK et al. Comparison of 800 and 3700 MBq iodine-131 for the postoperative ablation of thyroidremnant in patients with low-risk differentiated thyroid cancer. Nucl Med Commun 2012;33 : 268-274
- Fallahi B, Adabi K, Majidi M et al. Incidence of second primary malignancies during a long-term surveillance of patients with differentiated thyroid carcinoma in relation to radioiodine treatment. Clinical Nuclear Medicine 2011;36 : 277-282
- Gopalakrishna I, Morris L, Tuttle M et. al. Rising incidence of second cancers in patients with low-risk (T1N0) thyroid cancer who receive radioactive iodine therapy. Cancer 2011;117 : 4439-4446
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2018 Číslo 2
Najčítanejšie v tomto čísle- Kostní infarkt imitující osteosarkom jako náhodný nález – kazuistika
- Tyreoeliminace radiojódem pro diferencovaný karcinom štítné žlázy u nízce rizikových nemocných
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



