-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výživa u pacientů s nádory hlavy a krku
Nutrition in Patients with Head and Neck Cancer
Introduction:
Nutrition and nutritional status assessment in head and neck cancer patients are an inseparable part of oncologic treatment and follow-up. The aim of the study was an evaluation of Nutritional Risk Screening 2002 (NRS) assessment tool use in oncologic follow-up checks, assessment of nutritional status changes in patients after head and neck cancer treatment and according to the results potential introduction of the NRS tool into the clinical practice.Methods:
The patients followed-up after oncologic and combined surgical and oncologic treatment of head and neck cancer were included into the study. By means of NRS tool and purposeful questioning by the nurse the weight loss and per cent change in food intake was assessed and the Nutritional status (NS) 0–3 points was scored. In cooperation with the physician the activity, localization of disease, type and extent of oncologic treatment were evaluated and the Risk emerging from basic disease and treatment (R) scored 0–3 points was classified. Final NRS score was counted according to formula NRS = NS + R (0–6 points). The high nutritional risk is considered to come in scores 4 and more points. As a part of NRS the Body Mass Index (BMI) was counted. Retrospectively by medical records data mining weight preceding oncologic treatment, diagnosis, date of start and type of treatment were obtained.Results:
Into the study 129 patients, 26 female and 103 male, were included. An average age was 62 years (minimum 32 years, maximum 88 years). Eighty-one patients were evaluated twice in a period 1 to 7 months, mostly after 3 and 6 months. Any weight loss occurred in 75.2% of patients, more than 5% of weight lost 62% of patients, >10% lost 41.9% of patients, >15% lost 27.1% of patients, >20% lost 17% and >25% lost 9.3% of patients. In between the follow-up checks 86.4% of patients were in range ±5% of their weight (45.7% lost up to 5% of their weight, 40.7% gained up to 5% of weight), 8.6% lost more that 5% of weight. Only 26% of patients after treatment were not in nutritional risk (NRS score 1–2), three quarters were in high and very high malnutrition risk (NRS score 3–6). Despite recommended care and nutritional intervention in 22.3% of patients worsening of NRS score 1–2 points occurred. In high risk of malnutrition (NRS score 4–6) the patients with oropharyngeal cancer (palatine tonsil and base of tongue), hypo - and epipharyngeal cancer were present, low score was found in patients with oncologic diseases of ear, parotid gland and larynx.Discussion:
The authors consider study to be a pilot one. The results are limited by small number of patients and low representation of some oncologic diagnoses. Yet inadequate monitoring and solution of nutrition and poor nutritional status of head and neck cancer patients can be presumed. Further research in the field will be necessary. The paper includes recommended guideline for monitoring and nutrition solution of those patients.Keywords:
nutrition, malnutrition, head and neck cancer, Nutritional Risk Screening, NRS 2002.
Autoři: Michal Černý 1
; H. Levová 2; R. Michálek 3; Viktor Chrobok 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku, Fakultní nemocnice Hradec Králové a Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, přednosta prof. MUDr. V. Chrobok, CSc., Ph. D. 1; Katedra ošetřovatelství, Fakulta zdravotnických studií, Univerzita Pardubice vedoucí Mgr. E. Hlaváčková, Ph. D. 2; Klinika otorinolaryngologie a chirurgie hlavy a krku, Pardubická krajská nemocnice, a. s. přednosta MUDr. J. Mejzlík, Ph. D. Souhrn 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 62, 2013, No. 1, pp. 5-13.
Kategorie: Původní práce
Souhrn
Úvod:
Sledování výživy a nutričního stavu u pacientů s nádory hlavy a krku je nedílnou součástí onkologické léčby i následné dispenzarizace. Cílem práce bylo zjistit, jaké je využití nástroje Nutritional Risk Screening 2002 (NRS) v onkologické dispenzární ORL ambulanci, zhodnotit vývoj nutričního stavu pacientů po onkologické léčbě nádorů hlavy a krku a dle výsledků provést případné doporučení zavedení NRS do klinické praxe.Metodika:
Do studie byli zařazeni pacienti dispenzarizovaní po onkochirurgické a kombinované chirurgicko-onkologické léčbě nádorů hlavy a krku. Prostřednictvím dotazníku NRS a cíleného rozhovoru zdravotní sestra zhodnotila rozsah zhubnutí a procentuální změnu množství přijímané stravy pacientem. Nutriční stav (NS) se klasifikoval 0–3 body. Ve spolupráci s dispenzarizujícím lékařem se hodnotila aktivita a lokalizace onkologického onemocnění, typ a rozsah onkologické léčby. Riziko vyplývající ze základní choroby a léčby (R) se klasifikovalo 0–3 body. Výsledné NRS skóre se vypočítalo dle rovnice NRS = NS + R (0–6 bodů). Vysoké nutriční riziko bylo podmíněno ziskem 4 a více bodů. Součástí NRS klasifikace byl výpočet Body Mass Indexu (BMI). Retrospektivně byla ze zdravotnické dokumentace zjišťována hmotnost před zahájením onkologické léčby, údaje o diagnóze, datu zahájení a typu léčby.Výsledky:
Do studie bylo zařazeno 129 pacientů, 26 žen a 103 mužů. Průměrný věk byl 62 let (minimum 32 let, maximum 88 let). Osmdesát jedna pacientů bylo hodnoceno 2krát, a to mezi 1–7 měsíci, nejčastěji po 3 a 6 měsících. K jakékoliv ztrátě hmotnosti po léčbě došlo u 75,2 % pacientů, >5 % zhublo 62 % pacientů, >10 % zhublo 41,9 % pacientů, >15 % zhublo 27,1 % pacientů, >20 % zhublo 17 % a >25 % hmotnosti ztratilo 9,3 % pacientů. Mezi kontrolami 86,4 % pacientů oscilovalo kolem hmotnosti ±5 % (45,7 % pacientů zhublo do 5 %, 40,7 % pacientů přibralo do 5 % hmotnosti), 8,6 % zhublo >5 % své hmotnosti. Pouze 26 % pacientů se po léčbě nenacházelo v nutričním riziku (NRS skóre 1–2), tři čtvrtiny pacientů byly ve vysokém a velmi vysokém riziku malnutrice (NRS skóre 3–6). I přes doporučenou péči a nutriční intervenci došlo u 22,3 % pacientů ke zhoršení nutričního rizika o 1–2 body. Ve vysokém riziku malnutrice (NRS skóre 4–6) se nacházeli především pacienti s nádory orofarnygu (patrové tonzily a kořene jazyka), hypofaryngu a nazofaryngu, nízké skóre se vyskytovalo u onkologických onemocnění ucha, příušní žlázy a hrtanu.Diskuse:
Studii je nutno považovat za pilotní, je limitována malou velikostí souboru a nízkým zastoupením některých onkologických diagnóz. Přesto lze usuzovat na nedostatečné sledování a řešení výživy a nedobrý nutriční stav pacientů s nádory hlavy a krku. Další výzkum v této oblasti bude nezbytný. Práce obsahuje doporučený postup pro sledování a řešení nutrice u těchto nemocných.Klíčová slova:
výživa, malnutrice, nádory hlavy a krku, Nutritional Risk Screening, NRS 2002.ÚVOD
Malnutrice, definovaná jako porucha výživy způsobená neadekvátním nebo nedostatečným příjmem základních energetických substrátů vzhledem k potřebě organismu (13), je významně spjata s nádorovými onemocněními hlavy a krku. Kromě orgánově nespecifického obecného působení maligního onemocnění na metabolismus (10) se právě v ORL oblasti významně uplatňuje samotné strukturální porušení integrity polykacích cest nádorem, včetně související deteriorace funkční při postižení nervového řízení. Výsledkem je vznik poruch polykání a malnutrice. Omezení perorálního příjmu a přesun organismu ke katabolismu má závažné konsekvence. Pokles hmotnosti o více jak 20 % v perioperačním období zvyšuje mortalitu pacientů o 33 %, ve vyšších věkových skupinách o 50 % a u pacientů s onkologickým onemocněním dokonce o 85 % (13). Dvacet procent pooperačních komplikací tvoří lokální nebo systémové infekce, jejichž hlavním rizikovým faktorem je malnutrice (1).
Ačkoliv podvýživa není nevyhnutelnou součástí nádorového onemocnění, proteino-energetická malnutrice se týká poloviny pacientů podstupujících protinádorovou terapii. Celkově špatný nutriční stav pacienta negativně ovlivňuje výsledek léčby pacienta, vede ke snížení tolerance protinádorové léčby, stoupá množství komplikací, klesá odpověď na protinádorovou léčbu, zhoršuje se kvalita života. Pokud je nutriční podpora zahájena včas a systematicky, zvyšuje významně přívod živin, mírní hubnutí a v důsledku umožňuje plný efekt protinádorové léčby (11). Nádorové postižení ústní dutiny, orofaryngu, hypofaryngu a hrtanu způsobuje potíže s polykáním (dysfagii), bolestivé polykání (odynofagii), až úplnou zástavu polykání (afagii) (9). Tumor může působit obstrukci polykacích cest v oblasti orofaryngu, hypofaryngu a hrtanu. Bývá přítomna porucha hybnosti částí polykacího traktu (jazyk, měkké patro, hltan, hrtan) vlivem infiltrace tumorem či postižením motorické i senzitivní inervace. Významným faktorem ovlivňujícím polykání je nádorová bolest.
Zhoršení polykání způsobuje také vlastní léčba onemocnění. Radikální chirurgická léčba nádoru přináší nemalý zásah do integrity polykacích cest, dochází ke změně anatomických podmínek a současně k ovlivnění funkce a koordinace jednotlivých struktur. Zejména je narušena orální přípravná (OP), orální transportní (OT) a faryngeální (F) fáze polykání při resekcích na jazyku, měkkém patře, laterální stěně hltanu, po parciálních laryngektomiích. Bezprostředně po chirurgickém výkonu ovlivňuje polykání bolest, otok sliznic a mnohdy i zavedená nasogastrická sonda, v delší době od výkonu často zhoršuje dysfagii jizvení a zatuhnutí operační rány.
(Chemo)radioterapie komplikuje příjem stravy vznikem mukositíd, poruchy chuti, xerostomie, nauzey se zvracením a anorexie, které současně ovlivňují kvalitu života pacienta (8). Dlouhodobějším následkem léčby je vznik postradiační fibrózy s rizikem rozvoje stenóz polykacích cest.
MOŽNOSTI ZAJIŠTĚNÍ VÝŽIVY
Preferovaným způsobem zajištění adekvátní výživy je fyziologický enterální perorální příjem pokrývající energetické nároky pacienta a obsahující všechny důležité složky, bez nutnosti přidávat nutriční doplňky (3). U pacientů v riziku podvýživy, u nichž není perorální příjem porušen, je upřednostňována normální strava. Její složení a energetickou vydatnost stanovuje nutriční specialista/dietolog. V případě, že je podvýživa závažnější a běžná strava nekryje energetické požadavky organismu, lze použít tzv. fortifikovanou stravu – normální jídlo obohacené specifickými nutrienty (energií, bílkovinami, minerály, vitamíny, stopovými prvky apod.), event. perorální nutriční doplňky (dříve sipping) s energetickou hodnotou 200–300 kcal, podávané navíc k normálnímu jídlu (3). Někteří pacienti s dysfagií jsou schopni plného perorální příjmu pouze za předpokladu úpravy konzistence jídla (zahuštění tekutin zdravotnickým zahušťovadlem, rozmixování tuhé stravy apod.) či modifikace velikosti polykaného objemu (např. rozdělení jídla do menších dávek častěji v průběhu dne).
Pokud není pacient plného perorálního příjmu schopen, nebo rozsah příjmu nekryje plně energetické požadavky, existují náhradní mechanismy enterální výživy – nasogastrická nebo nasojejunální sonda, případně gastrostomie či jejunostomie. Indikacemi k jejich zavedení jsou:
- Neschopnost pacienta přijímat stravu v uplynulých 5 dnech (dle některých doporučení pouze uplynulé 3 dny), známky podvýživy nemusí být rozvinuty, ale pacient je ve vážném riziku jejího rozvoje.
- Neschopnost přijímat stravu v následujících 5 dnech – typicky výživově normální jedinec před chirurgickým výkonem pooperačně omezujícím příjem stravy více než 5 dní.
- Pacient s rozvinutou podvýživou.
Nasogastrická sonda (NGS) je metodou volby u krátkodobých výpadků perorálního příjmu. U onkologických pacientů je preferována v případech, kdy pacient nebyl před léčbou v podvýživě, po případném chirurgickém výkonu je předpoklad rychlé obnovy polykací funkce a kdy není očekávána následná léčba (chemo)radioterapií. U části pacientů však sonda tvoří nefyziologickou překážku pro restituci normálního polykání, není pacienty tolerována a zvyšuje stres pacienta, proto je některými autory i u krátkodobějších poruch polykání doporučováno vytvoření gastrostomie (5). Využití nasojejunální sondy (NJS), jako alternativy NGS, je při řešení tumorů ORL oblasti omezené, indikováno je např. v případě náhrady jícnu tubulizovaným žaludkem.
Nejčastějším způsobem nesondového podávání enterální výživy, a při dlouhodobé nemožnosti perorálního příjmu preferovaným způsobem, je perkutánní endoskopická gastrostomie (PEG). PEG neomezuje polykací cesty a neovlivňuje rehabilitaci polykání, je uschována pod oblečením a kosmeticky nezasahuje do obličeje, přináší pacientovi komfort při používání. Alternativou při neprůchodnosti polykacích cest pro endoskop je chirurgická gastrostomie (Witzelova nebo Kaderova).
Parenterální výživa je indikována pouze k přechodnému zajištění výživy v případech, kdy nebylo možné ještě zajistit enterální způsob nutrice, neboť se nejedná o fyziologický příjem živin. Na rozdíl od enterální výživy je zatížena větším množstvím komplikací v souvislosti s centrálním žilním vstupem, do kterého musí být dlouhodobě podávána, a je ekonomicky velmi nákladná.
NUTRIČNÍ PODPORA
Realimentace před operačním výkonem či zahájením (chemo)radioterapie je v literatuře diskutována. Mnoho prací uvádí, že předléčebná nutriční podpora v případě chirurgického výkonu snižuje riziko komplikací, zlepšuje hojení rány, v případě konkomitantní chemoradioterapie snižuje toxicitu léčby. V práci Rachel Rabinovitch a kol. (7), zabývající se efektem nutriční podpory pro pacienty s lokálně pokročilým dlaždicobuněčným karcinomem oblasti hlavy a krku léčeným radioterapií, autoři uvádějí signifikantně menší pokles hmotnosti na konci léčby a menší výskyt mukositíd 3. a 4. stupně. Bertrand a kol. (1) v souhrnném článku uvádějí při podání 7–10denní předoperační nutriční podpory snížení pooperačních komplikací o 10 % u pacientů s nádory hlavy a krku se ztrátou hmotnosti více jak 10 %.
Nutriční podpora (úprava diety, sipping, enterální nebo parenterální výživa) je zahajována v případech, kdy podpůrná léčba symptomů, omezujících příjem stravy a edukace pacienta o výživě nepostačují k udržení nutričního stavu. U nemocných s vysokým vstupním rizikem podvýživy (nádory hlavy a krku s plánovanou konkomitantní chemoradioterapií, nádory horního GIT s plánovanou velkou operací) je ve většině případů indikováno profylaktické zajištění nutričního přístupu (PEG, jejunostomie) již při zahájení léčby, protože je možné téměř jistě předpokládat, že dojde k nedostatečnému příjmu stravy (11). Indikace k zahájení nutriční podpory před začátkem vlastní onkologické léčby shrnuje tabulka 1.
Tab. 1. Indikace k zahájení nutriční podpory při diagnóze nádoru před zahájením léčby. 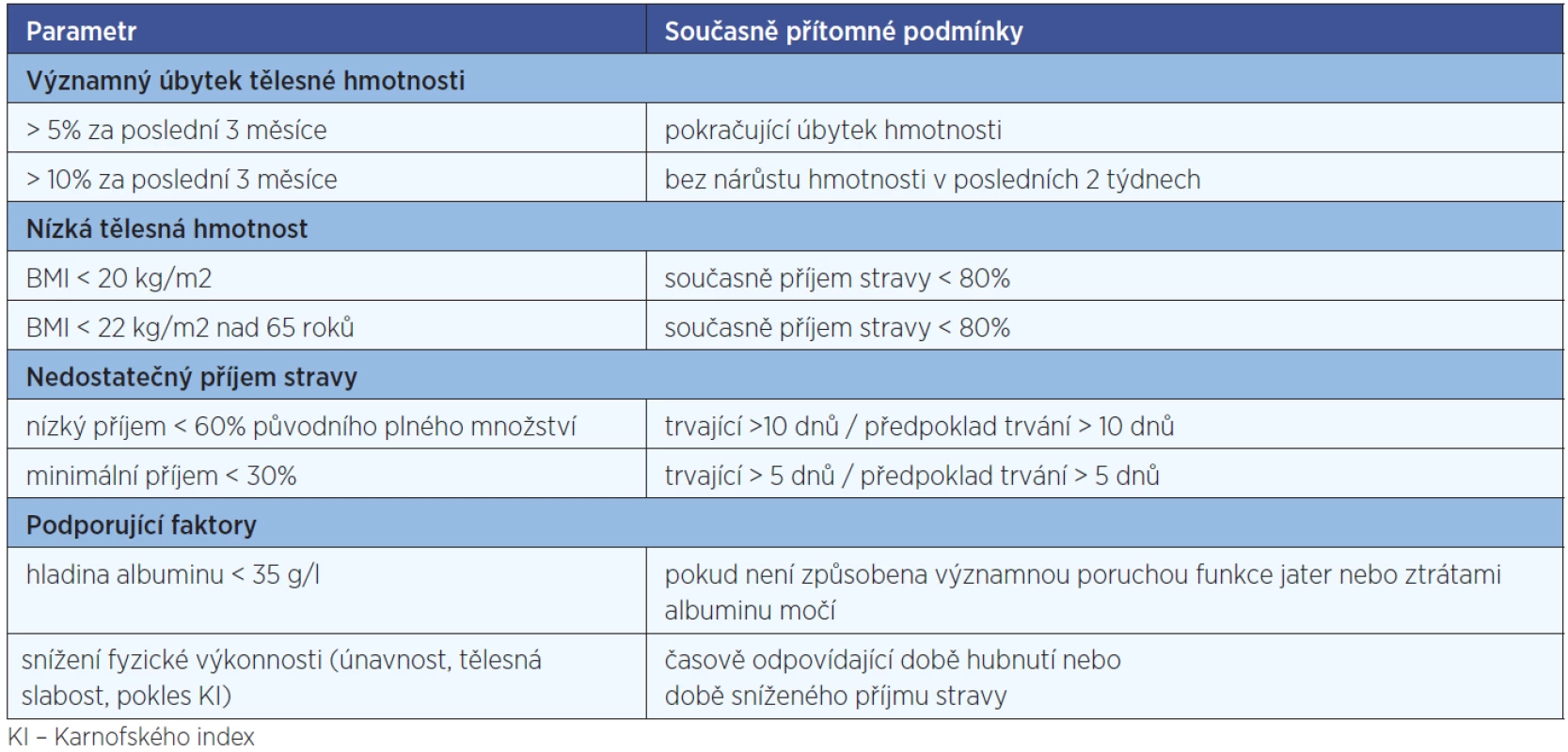
V průběhu protinádorové terapie potřebuje nutriční podporu přibližně polovina pacientů, u 40 % všech onkologických pacientů je dostatečný sipping, 10 % vyžaduje buď umělou výživu nebo sondovou enterální či parenterální (11). Indikaci k zahájení nutriční podpory v průběhu léčby shrnuje tabulka 2.
Tab. 2. Indikace k zahájení nutriční podpory v průběhu onkologické léčby. 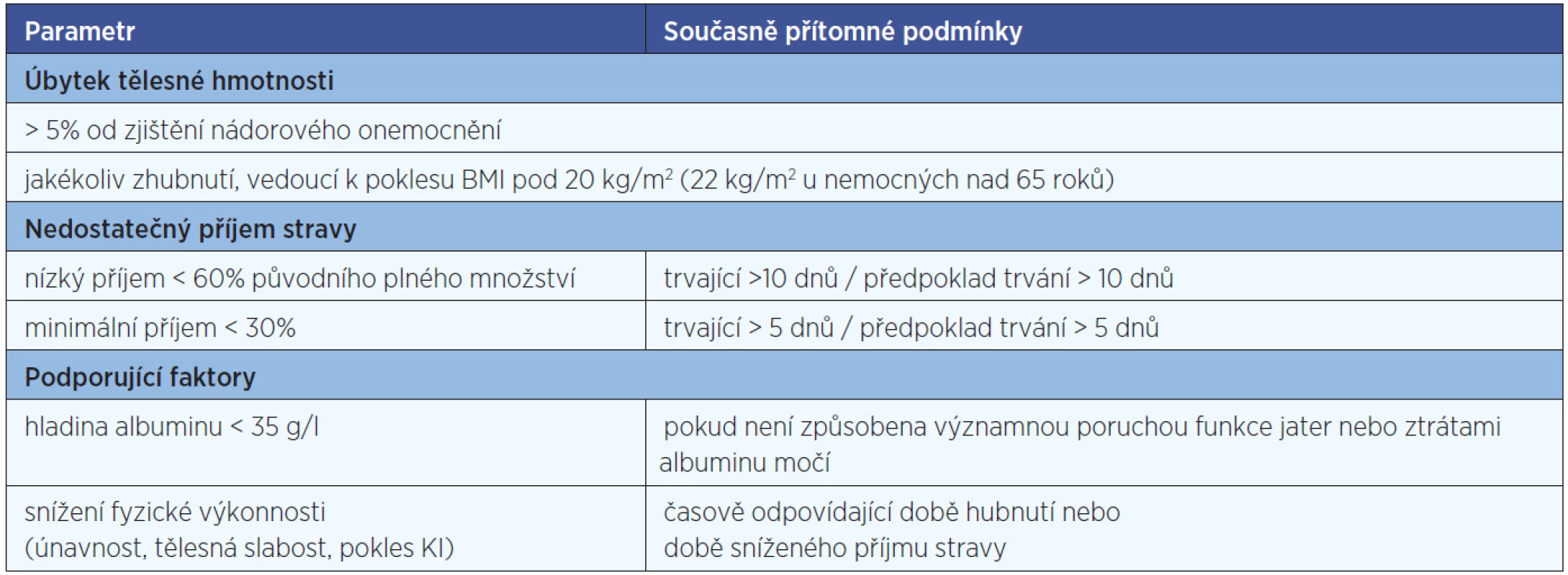
HODNOCENÍ NUTRIČNÍHO STAVU U ONKOLOGICKÝCH PACIENTŮ
Pro sledování nutrice onkologicky nemocných byl v roce 2002 Evropskou společností umělé klinické výživy a metabolické péče (ESPEN, The European Society for Clinical Nutrition and Metabolism) vyvinut a doporučen nástroj Nutritional Risk Screening NRS 2002. Poslední platná doporučení vyšla pro enterální výživu v roce 2006 a pro parenterální výživu v roce 2009 v monotematických číslech časopisu Clinical Nutrition (2006; 25 : 2 a 2009; 28 : 4).
NRS 2002 byl původně určen pro sledování nutričního stavu hospitalizovaných pacientů, následně byl modifikován pro použití v dispenzárních onkologických ambulancích a jeho použití bylo doporučeno výborem České onkologické společnosti v září 2007 (11).
NRS 2002 má dvě části – pacientský leták „Úvod do stravování při nádorovém onemocnění.” a vlastní „Nutriční rizikový screening pro ambulantní onkologické pacienty“ (obr. 1). Prostřednictvím první části se pacient seznámí s příznaky podvýživy a může pak kvalifikovaněji sestře či lékaři poskytnout podrobnější a validní informace o svém nutričním stavu a příjmu stravy. Jeho součástí je dále tabulka, do které pacient doma zaznamenává změny v příjmu jídla (4). Na základě domácího sledování se hodnotí procentuální změna množství přijímané stravy v době od předchozí kontroly.
Druhou částí je Nutriční rizikový screening NRS, umožňující hodnotit riziko malnutrice na bodové škále od 0 do 6 bodů. Využívá hodnocení nutričního stavu (NS) prostřednictvím jednoduchých údajů o hmotnosti a příjmu stravy (0–3 body) a stanovení rizika (R), vyplývajícího ze základní choroby a léčby (0–3 body), které jsou zjišťovány ve strukturované a předem definované podobě (obr. 1). Výsledné riziko je dáno součtem bodů v obou hodnocených oblastech, NS+R = NRS, 0–6 bodů. V případě skóre 3 a více bodů je pacient indikován k sestavení nutričního plánu s vhodnými nutričními intervencemi. Nemocní s vysokým rizikem podvýživy (4–6 bodů) by měli být odkazováni do péče nutriční ambulance.
Obr. 1. Nutriční rizikový screening NRS 2002. 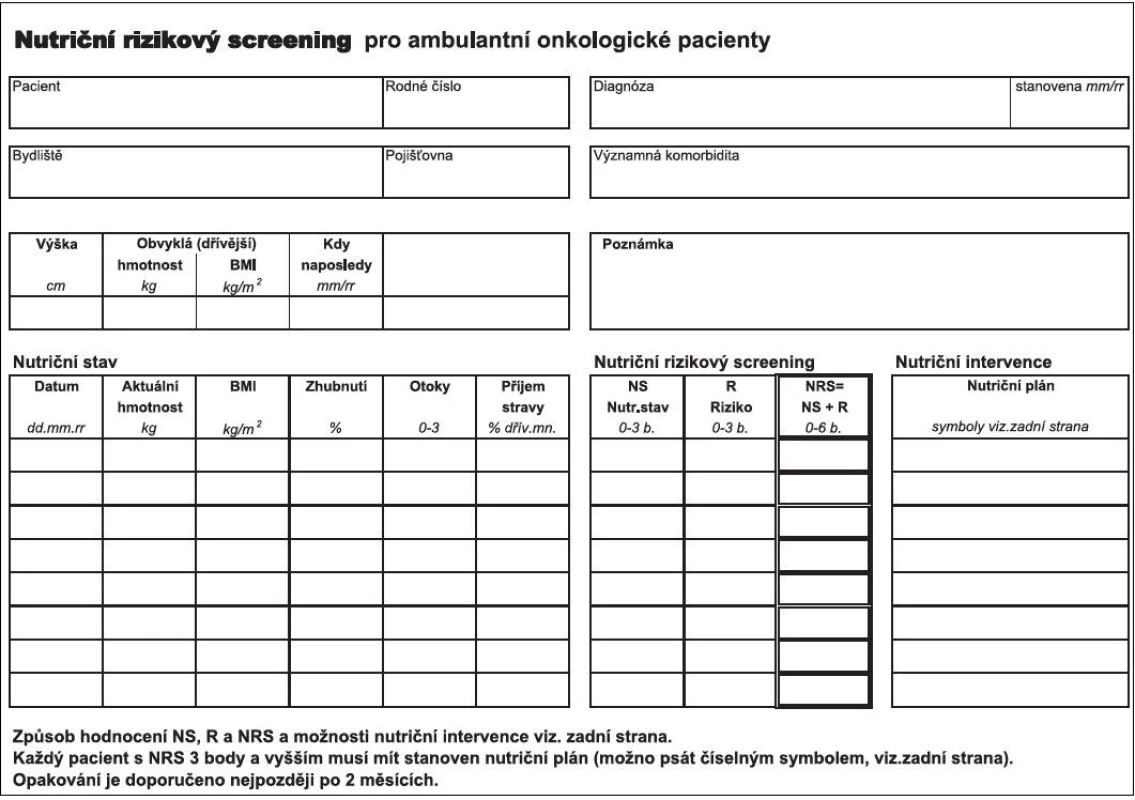
METODIKA
Studie probíhala od 9. dubna do 25. listopadu 2010 v dispenzární onkologické ambulanci Kliniky otorinolaryngologie a chirurgie hlavy a krku Pardubické krajské nemocnice, a.s. Do studie byli zařazováni pacienti s nádorovým onemocněním hlavy a krku dispenzarizovaní na ORL klinice. Každý pacient se zdravotní sestrou vyplnil dotazník NRS 2002, byl zvážen a změřen a byl vypočítán BMI. Ze zdravotnické dokumentace byly retrospektivně zjištěny údaje o diagnóze a rozsahu onemocnění, modalitě léčby, hmotnosti před léčbou. Při vlastním vyšetřením pacienta lékařem se aktualizovaly údaje o aktivitě onemocnění, současně přítomných komorbiditách a komplikacích, typu a rozsahu onkologické léčby a vypočítalo se výsledné skóre NRS (tab. 3). K vyhodnocení výsledků byly použity metody deskriptivní statistiky.
Tab. 3. Hodnotící tabulka Nutrtional Risk Screening skóre. 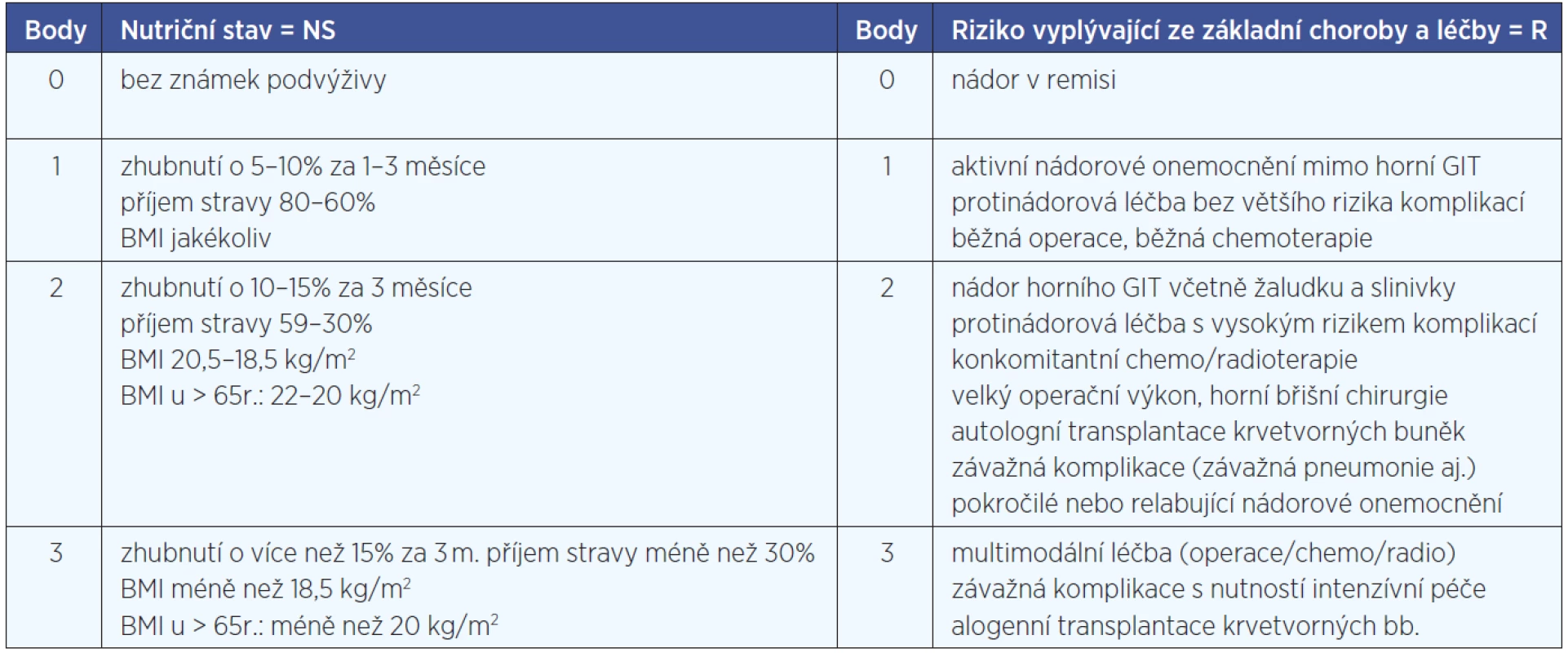
VÝSLEDKY
Do studie bylo zařazeno 129 pacientů, z toho 26 žen a 103 mužů. Průměrný věk byl 62 let (minimum 32 let, maximum 88 let) sledovaných po léčbě nádorového onemocnění ORL oblasti. Z celkového počtu pacientů bylo 81 pacientů v daném časovém období hodnoceno 2krát, a to mezi 1–7 měsíci, nejčastěji po 3 a 6 měsících.
Nejčastěji se vyskytujícími onkologickými postiženími v souboru byly nádory orofaryngu v 41,2 % (se zastoupením patrová tonzila 20,9 %, kořen jazyka 7,8 %, měkké patro 4,7 % a ostatní lokalizace orofaryngu 7,8 %), následovaly nádory hrtanu v 26,4 %, nádory rtu a ústní dutiny v 10,1 % (jazyk 5,4 %, spodina ústní dutiny 4,7 %), nádory hypofaryngu v 8,5 %, nádory nosohltanu v 5,4 %, maligní nádory příušní žlázy v 4,7 % a nádory ucha v 3,9 % případů (graf 1).
Graf 1. Zastoupení onkologických postižení jednotlivých ORL oblastí. 
Legenda: UCH – ucho, LAR – laryng, GLP – glandula parotis, RDÚ – ret a ústní dutina, ORO – orofaryng, HYP – hypofaryng, NAZ – nazofaryng. (n=129) Nejčastější léčebnou modalitou (31 %) byla chirurgická resekce primárního ložiska s blokovou krční disekcí a následnou onkologickou léčbou (aktinoterapie či konkomitantní chemoradioterapie). Primární léčba aktinoterapií či konkomitantní chemoradioterapií byla volena v 22 % případů (graf 2). Volba modality závisela na typu a rozsahu onkologického onemocnění, způsobilosti pacienta pro případnou chirurgickou léčbu a na pacientově výběru z terapeutických možností.
Graf 2. Zastoupení modality léčby onemocnění. 
Legenda: T – operace tumoru; N – operace regionálních uzlin; CHR – (chemo)radioterapie. (n=129) K jakékoliv ztrátě hmotnosti po léčbě došlo u 75,2 % pacientů, o více než 5 % zhublo 62 % pacientů, ke zhubnutí o více než 10 % došlo u 41,9 %, více než 15 % původní hmotnosti ztratilo 27,1 % pacientů, více než 20 % pak 17 % a více jako 25 % hmotnosti 9,3 % (graf 3).
Graf 3. Histogram změny hmotnosti po léčbě, hranice tříd po 5 %. (n=129) 
Graf 4 znázorňuje pacienty, u nichž byl sledován vývoj hmotnosti mezi kontrolami. Z 81 pacientů 8,6 % zhublo více než 5 % své hmotnosti, většina pacientů (86,4 %) oscilovala kolem hmotnosti ±5 % (45,7 % pacientů zhublo do 5 %, 40,7 % pacientů přibralo do 5 % hmotnosti), více než 5 % hmotnosti přibralo 4,9 % pacientů.
Graf 4. Histogram změny hmotnosti mezi kontrolami, hranice tříd po 5 %. (n=81) 
Při hodnocení NRS skóre po léčbě 26 % pacientů bylo mimo nutriční riziko (NRS ≤ 2), 74 % pacientů bylo v nutričním riziku (NRS skóre ≥ 3), z toho ve vysokém riziku (NRS = 3) se nacházelo 28 % a ve velmi vysokém riziku (NRS skóre ≥ 4) 46 % všech pacientů (graf 5).
Graf 5. NRS skóre po léčbě. (n=129) 
Vývoj skóre NRS u pacientů mezi kontrolami shrnuje graf 6. Z 81 hodnocených pacientů i přes doporučenou péči a nutriční intervenci došlo u 22,3 % pacientů ke zhoršení nutričního rizika o 1–2 body, jen u 9 % se nutriční riziko snížilo a u 69 % procent pacientů ke změně nutričního rizika nedošlo.
Graf 6. Změna NRS skóre mezi kontrolami. (n=81) 
Na základě vztažení NRS skóre k lokalizaci nádorového onemocnění bylo možno stanovit pořadí diagnóz přinášejících velmi vysoké nutriční riziko (NRS skóre ≥ 4): příušní žláza (17 %), hrtan (21 %), ret a ústní dutina (44 %), nosohltan (57 %), orofaryng (67 %) a hypofaryng (70 %) (graf 7). V případě rozlišení na sublokalizace přinášejí vůbec nejvyšší riziko nádory orofaryngu postihující kořen jazyka (80 %).
Graf 7. Zastoupení NRS skóre u onkologických postižení jednotlivých oblastí hlavy a krku, řazeno dle velmi vysokého nutričního rizika vzestupně. 
Legenda: UCH – ucho, GLP – glandula parotis, LAR – laryng, RDÚ – ret a ústní dutina, NAZ – epifaryng, ORO – orofaryng, HYP – hypofaryng DISKUSE
Pilotní výsledky potvrzují, že nutriční stav pacientů po léčbě onkologických onemocnění není uspokojivý. Je zřejmé, že zejména zajištění výživy po dobu onkologické léčby není dostatečné, k jakémukoliv zhubnutí došlo u 75,2 % pacientů, o více než 10 % hmotnost snížilo 42 % pacientů.
Na hodnotách výsledného skóre NRS se kromě neovlivnitelné části hodnocení NRS (lokalizace nádoru, multimodální léčba atd.) významně podílí nutriční stav pacienta a příjem stravy. Vysoká skóre přes 4 naznačují, že zajištění výživy u pacientů při nádorové léčbě není dostačující.
Limitací interpretace výsledků studie jsou relativně malý vzorek pacientů, krátké časové období hodnocení, retrospektivní část studie s vždy související určitou dávkou nejistoty ohledně validity získaných dat. Zejména se limitace dotýká interpretace výsledků závažnosti nutričního rizika v závislosti na lokalizaci onkologického postižení (graf 7), kde roli hrají malé počty případů u některých diagnóz, přesto však lze vysledovat naznačený trend.
Z výsledků je patrné, že nutričnímu zajištění pacientů s nádorovým onemocněním hlavy a krku je nutno věnovat velkou pozornost, zejména proto, že onemocnění postihuje přímo části účastnící se na příjmu potravy. To se dotýká především nádorů ústní dutiny (jazyk, spodina ústní dutiny), orofaryngu (patrová tonzila, kořen jazyka), nazofaryngu a hypofaryngu.
Již při zjištění nádorového onemocnění by měl být pacient nutričně zhodnocen, oklasifikován dle nutričního rizika a zahájena realimentace. Ta může probíhat již v rámci stagingu onemocnění a přípravy k léčbě, ať onkochirurgické nebo onkologické. Je-li předpoklad sníženého příjmu stravy po dobu delší než 10 dnů (což se týká většiny postupů v ORL oblasti), je indikováno „předléčebné“ zavedení náhradních mechanismů příjmu stravy. Vzhledem ke komfortu a jednoduchosti je v současné době preferováno zavedení PEG.
Výživa pomocí nasogastrické sondy připadá v úvahu při krátkodobější nutnosti zajištění náhradního mechanismu výživy, může se uplatnit například u pacientů po totální laryngektomii, kde vlivem relativně malého narušení polykacích cest se daří obnovit plný perorální příjem v krátké době (většinou již do 14 dnů). V takovém případě nasogastrická sonda překlene kritické období a ani při případném ozáření nebývají velké potíže s polykáním.
Všechny zásahy do integrity důležitých struktur při polykání (měkké patro, jazyk a kořen jazyka, patrové tonzily a oblouky, hypofaryng) přinášejí pacientovi výrazné polykací potíže s delší dobou hojení a dlouhou dobou rehabilitace polykání, v takovém případě je zavedení PEGu nezbytné. Některá pracoviště považují zajištění pacientů s aktinoterapií oblasti polykacích cest PEGem za standardní (11, 12, 14).
Informování pacienta o nezbytnosti operačního výkonu, jeho rozsahu a možných komplikacích je již zavedeným obligem. V rámci edukace je však zatím málo zdůrazňována navazující problematika týkající se příjmu stravy, sledování nutričního stavu a možnosti řešení. V zahraničí se indikačních pohovorů s pacientem účastní logoped-dysfagiolog a nutriční specialista, kteří pacienta informují o předpokládané povaze polykacích potíží v závislosti na plánovaném rozsahu chirurgické léčby, součástí je také úvodní nácvik rehabilitačních manévrů. Nutriční specialista již před výkonem hodnotí nutriční stav pacienta a případně upravuje jeho dietu tak, aby byl pacient dobře na následující léčbu připraven, součástí je tedy i indikace k předléčebnému zajištění náhradních výživových mechanismů.
Včasná rehabilitace a obnovení alespoň částečného perorálního příjmu po operačním výkonu je prioritou. Ačkoliv takový příjem není z nutričního hlediska dostatečný, nedochází k vyhasnutí příslušných reflexů a motorických vzorců a přispívá ke zlepšení kvality života pacienta. Zavedené PEG či NGS umožňují „dohradit“ nedostatečný perorální příjem, především však není pacient ze strany zdravotníků stresován nucením k jídlu, přijímá jen takovou stravu a v takovém rozsahu, jak mu vyhovuje. Za asistence logopeda-dysfagiologa probíhá rehabilitace, terapeutické krmení, nácvik kompenzačních technik. Rychlou orientaci o schopnosti pacienta polykat a o rizicích aspirace může poskytnout sestrou prováděný screening (6). Rozsah dysfagie, lokalizace, případná aspirace a efektivita kompenzačních mechanismů lze sledovat pomocí flexibilního endoskopického vyšetření polykání (FEES) (2).
Při kontrolách v dispenzární onkologické ambulanci by pacient měl být standardně hodnocen pomocí NRS dotazníku nebo obdobného screeningového nástroje, zaznamenávána hmotnost a průběžně vyhodnocován jeho nutriční stav. V případě zhoršování jsou v souladu s doporučením aplikována příslušná opatření. Důležité místo má vlastní edukace pacienta a jeho rodiny, která spadá do kompetencí zdravotní sestry, případně nutričního specialisty.
Protože nutriční stav pacienta významně ovlivňuje průběh léčby i její výsledky, musí se jeho sledování stát standardem a nedílnou součástí komplexní onkologické terapie.
ZÁVĚR
Navrhovaný postup sledování a zajištění výživy u pacienta s nádorovým onemocněním hlavy a krku:
- Zhodnocení nutričního stavu a stanovení nutričního rizika pacienta v okamžiku zjištění onemocnění, zhodnocení možností pacienta přijímat stravu, v případě malnutrice příprava nutričního plánu a časné zahájení realimentace (tab. 3).
- Konzilium odborností otorinolaryngolog, onkolog, nutriční specialista a logoped-dysfagiolog, plán léčby onkologického onemocnění, dle zvoleného typu zavedení alternativní výživové cesty:
- NGS – výpadek perorálního příjmu do 10 dnů, předpoklad rychlé restituce polykání, bez plánované (chemo)radioterapie.
- PEG – výpadek příjmu nad 10 dnů, rozsáhlý chirurgický výkon zejména v oblasti kořene jazyka, tonzil, hypofaryngu, plánovaná multimodální léčba.
- Edukační pohovor logopeda-dysfagiologa s pacientem o pravděpodobném rozsahu poruchy polykání v závislosti na zvolené léčbě a seznámení s možnostmi rehabilitačních cviků a obranných manévrů.
- Včasná rehabilitace polykání logopedem-dysfagiologem, dle možností včasné, alespoň částečné obnovení perorálního příjmu, sledování komplikací (aspirace) pomocí FEES či videofluoroskopie. Týdenní sledování hmotnosti pacienta, záznam množství přijaté stravy, aktualizace nutričního plánu.
- Aktualizace skóre nutričního rizika a nutričního plánu při propuštění do domácí péče, v případě potřeby zajištění pacienta předpisem na sondovou výživu, doporučení nutričních doplňků, vybavení pacienta letákem „Úvod do stravování při nádorovém onemocnění” a edukace pacienta a rodiny o domácím sledování hmotnosti a množství přijaté stravy.
- Součástí dispenzárních onkologických prohlídek pravidelná aktualizace NRS, aktualizace nutričního plánu (obr. 1).
Práce vznikla s podporou grantu Univerzity Pardubice SGFZS01/2010 Screeningové metody a posouzení kvality poskytované péče ve vybraných klinických oborech.
Adresa pro korespondenci:
MUDr. Michal Černý
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: michal.cerny@lfhk.cuni.cz
Zdroje
1. Bertrand, P. C., Piquet, M. A., Bordier, I., Monnier, P., Roulet, M.: Preoperative nutritional support at home in head and neck cancer patients: from nutritional benefits to the prevention of the alcohol withdrawal syndrome. Curr. Opin. Clin. Nutr. Metab. Care, 5, 2002, 4, s. 435–40.
2. Černý, M., Kotulek, M., Chrobok, V.: FEES – Flexibilní endoskopické vyšetření polykání. Endoskopie, 20, 2011, 2, s. 70–75.
3. Grofová, Z., Satinský, I.: Výživa u poruch polykání. In Tedla, M. et al.: Poruchy polykání. 1. vydání. Tobiáš, Havlíčkův Brod, 2009. s. 92–106.
4. Kozáková, R., Jarošová, D., Zeleníková, R., Bocková, S.: Nástroje k hodnocení nutričního stavu hospitalizovaných pacientů. Hygiena, 56, 2011, 1, s. 18–21.
5. Logemann, J. A.: Evaluation and treatment of swallowing disorders. Second edition. Pro-ed, Austin, 1998, 406 stran.
6. Mandysova, P., Skvrnakova, J., Ehler, E., Cerny, M.: Development of the Brief Bedside Dysphagia Screening Test in the Czech Republic. Nurs Health Sci., 13, 2011, 4, s. 388–395.
7. Rabinovitch, R., Grant, B., Berkey, B. A., Raben, D., Ang, K. K., Fu, K. K., Cooper, J. S.: Impact of nutrition support on treatment outcome in patients with locally advanced head and neck squamous cell cancer treated with definitive radiotherapy: a secondary analysis of RTOG trial 90–03. Head Neck, 28, 2006, 4, s. 287–296.
8. Ravasco, P., Monteiro-Grillo, I., Marques Vidal, P., Camilo, M. E.: Impact of nutrition on outcome: a prospective randomized controlled trial in patients with head and neck cancer undergoing radiotherapy. Head Neck, 27, 2005, 8, s. 659–668.
9. Tedla, M.: Poruchy polykání. 1. vydání. Tobiáš, Havlíčkův Brod, 2009. Medicína hlavy a krku, 298 stran.
10. Urbánková, P.: Individuálně přizpůsobená terapie u onkologických onemocnění hlavy a krku – multifaktoriální analýza nutričního stavu jako důležitá součást komplexního diagnosticko-terapeutického algoritmu. Brno, 30. 5. 2011. Dizertační práce. Lékařská fakulta, Masarykova univerzita v Brně. Vedoucí práce: Prof. MUDr. Rom Kostřica.
11. Vyzula, R.: Zásady cytostatické léčby maligních onkologických onemocnění. 13. vydání. Masarykův onkologický ústav, Brno, 2011, 230 stran.
12. Wiggenraad, R. G., Flierman, L., Goossens, A., Brand, R., Verschuur, H. P., Croll, G. A., Moser, L. E., Vriesendorp, R.: Prophylactic gastrostomy placement and early tube feeding may limit loss of weight during chemoradiotherapy for advanced head and neck cancer, a preliminary study. Clin. Otolaryngol., 32, 2007, 5, s. 384–390.
13. Zazula, R., Wohl, P., Wohl, P.: Nutriční stav pacienta a možnosti jeho hodnocení. Intern. Med., 11, 2009, 1, s. 45–47.
14. Zuercher, B. F., Grosjean, P., Monnier, P.: Percutaneous endoscopic gastrostomy in head and neck cancer patients: indications, techniques, complications and results. Eur. Arch. Otorhinolaryngol., 268, 2011, 4, s. 623–629.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2013 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Sekundárna imunodeficiencia z pohľadu hematoonkológa
-
Všetky články tohto čísla
- Zkušenosti s lokální kortikoterapií náhlých poruch sluchu kochleárního původu
- Současné možnosti magistraliter přípravy v otorinolaryngologii
- Invertovaný sinonazální papilom – současné principy chirurgické léčby
- Slovo šéfredaktora
- Dekompresia saccus endolymphaticus v liečbe Menierovej choroby
- Endoskopická transkarunkulární mediální orbitotomie jako přístup k ošetření posttraumatického krvácení z a. ethmoidalis anterior
- Prof. Dr. Emilian Kaufmann
- Radiofrekvenční elektrochirurgie v otorinolaryngologii
- Oznámení
- Doporučený diagnostický a terapeutický postup pro pracoviště zajišťující diagnostiku a chirurgickou léčbu poruch dýchání ve spánku u dospělých pacientů
- Výživa u pacientů s nádory hlavy a krku
- Doporučený diagnostický a terapeutický postup pro pracoviště zajišťující diagnostiku a chirurgickou léčbu poruch dýchání ve spánku u dětských pacientů do 15 let
- Mezioborové sympozium „Komplexní vyšetření hrtanu a hlasu v ambulantní i klinické praxi“
- XIV. kongres mladých otorinolaryngologů České společnosti otorinolaryngologie a chirurgie hlavy a krku ČLS JEP
- XVIII. beskydský ORL den „Nemoci hltanu a jícnu“ (nejen refluxní nemoc)
- Preparační kurz ORL – chirurgie ucha a spánkové kosti
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současné možnosti magistraliter přípravy v otorinolaryngologii
- Invertovaný sinonazální papilom – současné principy chirurgické léčby
- Radiofrekvenční elektrochirurgie v otorinolaryngologii
- Zkušenosti s lokální kortikoterapií náhlých poruch sluchu kochleárního původu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



