-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rhino-orbitální mukormykóza
Rhino-orbital Mucormycosis
Rhinocerebral or rhino-orbito-cerebral mucormycosis (also known as zygomycosis) is a rare invasive fungal infection. Characterised by acute onset, the condition is particularly prevalent in immunocompromised patients and can rapidly result in death. Diabetes mellitus, especially in its decompensated form, is the main predisposing factor. Primary clinical symptoms may mimic orbital complications of rhinosinusitis. Prognosis of the disease depends on the overall condition of the affected patient as well as the stage and rate at which therapy is administered. In this article, we present a case of rhino-orbital mucormycosis in a 54-year-old man with poorly controlled diabetes mellitus followed by a discussion of the clinical symptomatology, diagnosis, and therapy of this seldom-seen but very serious illness.
Keywords:
rhino-orbital – Amphotericin B – diabetes mellitus
Autori: G. Neškudlová 1; D. Kalfeřt 1; M. Grega 2; M. Kabelková 3; M. Plášková 4; J. Plzák 1
Pôsobisko autorov: Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF a FN v Motole, Praha 1; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha 2; Klinika infekčních, parazitárních a tropických nemocí, Nemocnice Na Bulovce, Praha 3; Oddělení ORL a chirurgie hlavy a krku, Oblastní nemocnice Kladno, a. s., Nemocnice Středočeského kraje, Kladno 4
Vyšlo v časopise: Otorinolaryngol Foniatr, 68, 2019, No. 3, pp. 171-177.
Kategória: Kazuistika
Súhrn
Rhino-cerebrální, či rhino-orbito-cerebrální mukormykóza, rovněž známá jako zygomykóza, je vzácné, angioinvazivní plísňové onemocnění s akutním začátkem a častou fatální progresí, zejména u imunokompromitovaných pacientů. Hlavním predisponujícím faktorem rhino-cerebrální mukormykózy je diabetes mellitus, zejména dekompenzovaný. Primární klinické příznaky mohou imitovat orbitální komplikaci rhinosunisitidy. Prognóza onemocnění závisí na celkovém stavu postiženého pacienta a rychlosti zahájení terapie. V tomto příspěvku prezentujeme případ rhino-orbitální mukormykózy u 54letého muže s nekontrolovaným diabetem mellitem. Diskutována je klinická symptomatologie, diagnostika a léčba tohoto vzácného a velmi závažného onemocnění.
Klíčová slova:
mukormykóza – rhino-orbitální – Amfotericin B
ÚVOD
Mukormykóza je vzácné, angioinvazivní plísňové onemocnění s akutním začátkem a možnou fatální progresí, zejména u imunokompromitovaných pacientů. Mukormykózu poprvé popsal Paultauf v roce (17). Celosvětově se incidence mukormykózy udává 0,4-1,7/1000000 obyvatel. Vyskytuje se bez rozdílu u obou pohlaví, bez preference věku (19). Mukormukóza je po aspergilóze druhé nejčastější invazivní onemocnění vyvolané vláknitými mikromycetami (14). Na rozdíl od aspergilózy je mukormykóza onemocnění s fulminativním průběhem s vysokou mortalitou, která se pohybuje kolem 50 – 70 % případů (21, 29). Infekce je způsobená oportunními houbami z čeledi Mucorales, zejména rodu Mucor, Rhizopus a Absidia (14). Zygomycéty nacházíme běžně v přírodě, v půdě, či v rozkládajících se rostlinách. Jsou ubikviterní. Za normálních okolností jsou tyto plísně považovány za saprofyty s nízkou virulencí. Šíří se produkcí sporangiospór, které se uvolňují do prostředí (22). Tyto plísňové organismy mají vysokou afinitu k cévám, kde adherují k jejich stěnám, šíří se jejich luminem, nebo jej můžou obturovat za vzniku jejich trombózy, následné ischemie a nekrózy tkání (22). Mukormykóza vzniká jen u výrazně oslabených osob v imunosupresi. Za jeden z hlavních rizikových faktorů je považován těžký, či nedostatečně kontrolovaný diabetes mellitus (DM). Mezi další rizikové faktory patří hematologické onemocnění, chronické renální selhání, imunosupresní terapie, posttransplantační stavy a další příčiny (maligní nádory), které vedou k imunosupresi (3, 12, 19, 21).
Onemocnění postihuje různé orgány a systémy a klinický obraz závisí na lokalizaci postižení. Nejčastější forma je rhino-cerebrální (či rhino-orbito-cerebrální), dále pulmonální, kožní, gastrointestinální a diseminovaná. Jiné formy jsou velmi vzácné.
Typicky je přítomen vztah mezi vybranými rizikovými faktory a lokalizací (formou) mukormykózy (16, 19, 21). Pacienti s diabetickou ketoacidózou jsou ohroženi vznikem rhino-cerebrální formy mukormykózy. Plicní forma je naopak častější u hematoonkologicky nemocných pacientů, při užívaní imunosupresivní terapie po transplantaci solidních orgánů, či při dlouhodobém užívaní masivních dávek antibiotik či cytostatik. Vzácná gastrointestinální forma se vyskytuje při extrémní malnutrici. Kožní forma může vzniknout při rozsáhlejších úrazech či popáleninách, kdy dochází k poruše kožní bariéry a dochází ke kontaminaci rány půdou. Velké riziko diseminované formy je u pacientů s neutropenií (16, 19, 21). V našem případě se jednalo rhino-orbitální formu mukormykózy. Diskutována je klinická symptomatologie, patofyziologie, diagnostika a léčba tohoto závažného onemocnění.
VLASTNÍ KAZUISTIKA
Muž, 54 let, diabetik na dietě, hypertonik, byl koncem srpna 2017 vyšetřován na ORL oddělení a neurologické ambulanci Krajské nemocnice Kladno pro bolesti levého oka, čelisti a necitlivost levé tváře. Byla provedena počítačová tomografie (CT) vedlejších nosních dutin s nálezem levostranné maxilární sinusitidy s etmoiditidou vlevo, byla doporučena léčba za hospitalizace, kterou pacient odmítl. Byla zahájena antibiotická terapie ambulantně. Následný den došlo k protruzi očního bulbu s rozmazaným viděním, doporučené chirurgické řešení pacient opět odmítl. Další den přišel v ranních hodinách pro opětovné zhoršení celkového stavu, pacient již s hospitalizací souhlasil a byl po provedení kontrolního zobrazovacího vyšetření indikován k endoskopické endonazální operaci v rozsahu levostranné antrostomie. Předoperačně byla zjištěna výrazná hyperglykémie s následnou postupnou kompenzací inzulinem. Vedlejším nálezem byl nekrotický defekt na tvrdém patře vlevo. Peroperačně byl proveden odběr materiálu na mikrobiologické vyšetření. Časně pooperačně došlo k progresi klinického stavu s nutností hospitalizace na jednotce intenzivní péče anesteziologicko-resuscitačního oddělení. Došlo ke ztrátě vizu, zhoršily se bolesti za levým okem a progredovala protruze levého očního bulbu. Z kultivace mikrobiologem byly diagnostikovány vláknité mikromycety rodu Mucor spp. Byla zahájena systémová cílená antimykotická terapie Abelcetem (lipidový komplex Amfotericinu B) v dávce 10 mg/kg/den. Pátý pooperační den byla provedena kontrolní magnetická rezonance (MRI) hlavy s nálezem rozšíření a patologické infiltrace měkkotkáňových struktur zánětlivého charakteru v okolí levé maxilární dutiny, v levé orbitě s rozšířením okohybných svalů, v levé fossa pterygopalatina, vlevo v nasofaryngu, v levé tváři a patologickým obsahem s hladinkou ve sfenoidální dutině. Bez propagace intakraniálně. Nález byl konzultován s Klinikou otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a Fakultní nemocnice Motol (ORL FNM). Vzhledem k významnému šíření procesu do fossa pterygopalatina byl nález hodnocen jako radikálně chirurgicky velmi nepravděpodobně řešitelný. Dvanáctý pooperační den byl pacient přeložen k další léčbě na Kliniku infekčních, parazitárních a tropických nemocí Nemocnice na Bulovce v Praze. Čtrnáctý pooperační den byly provedeny kontrolní zobrazovací vyšetření (MRI + CT) (obr. 1, obr. 2), kde byla nově popsána infiltrace v levé fossa pterygopalatina vlevo s abscesem 13 mm a popisem progrese pneumorobity vlevo. Sedmnáctý pooperační den byla změněna antimykotická terapie na Fungizon (Amfotericin B) v dávce 50 mg/den. Zároveň byla kryta nespecifická bakteriální flóra klindamycinem a meropenem. Vzhledem k nepříznivému průběhu a progresi lokálního nálezu, kdy pokračovaní v konzervativní léčbě by nemělo naději na vyléčení pacienta, byl po konzultaci s ORL FNM pacient indikován k pokusu o radikální chirurgický výkon. Vzhledem k plánovanému mutilujícímu výkonu v oblasti obličeje s resekcí tvrdého patra byla před výkonem zajištěna výživa cestou perkutánní gastrostomie. Při přijetí na ORL FNM v lokálním nálezu dominoval bolestivý otok měkkých tkání levé tváře, očních víček a levostranná slepota (obr. 3). Na tvrdém patře vlevo byl defekt velikosti 4x4 cm povleklý fibrinem. V nosní dutině vlevo zaschlé načernalé krusty. Subjektivně pacient udával výraznou bolestivost postižené oblasti. Radikální chirurgický výkon byl proveden 19. den od primárního výkonu. Peroperačně infiltrace postihovala celou orbitu, střední a dolní část vlastní nosní dutiny, přestupovala i na malou plochu laterální stěny nosohltanu při ústí Eustachovy tuby, ložiska byla i na nosním septu, celá výstelka čelistní dutiny byla postižena. Většina postižených sliznic byla nekrotická, černavé barvy, nekrvácející. V okolí maxily byla všemi směry infiltrace okolních měkkých tkání s nekrózami a mnohočetnými ložisky s hnisavou tekutinou, jak směrem do tváře, tak i laterálně od alveolárního výběžku, za zadní stěnou maxilární dutiny a v okolí pterygoidního výběžku i dorzálně od něj. Patrová sliznice, naléhající na levou polovinu tvrdého patra, byla kompletně nekrotická. Kosti celé maxily, pterygoidního výběžku, mediální a dolní části zevní stěny orbity byly změklé. Po částech byla provedena extenzivní resekce postižených tkání s maximální snahou dosažení zdravé tkáně. Byla provedena exenterace očnice, kompletní levostranná maxilektomie (zachována část měkkého patra vlevo), resekce pterygoidního výběžku a okolních měkkých tkání, zejména pterygoidní svaloviny a podvaz koncových větví a. carotis externa. Dorzálně bylo postupováno po zevní straně spodiny střední lební jámy, dosaženo foramen ovale s výstupem 3. větve n. trigeminus, pro infiltraci byl resekován n. lingualis, n. alveolaris inferior byl zachován, a. carotis interna zůstala těsně od tohoto bodu nepostižena. V hloubi resekční jámy tvořila laterální hranici částečně resekována svalovina m. temporalis a mediální plocha procesus coronoideus a ramus mandibulae. Byl přerušen arcus zygomaticus a byla provedena resekce postižené zygomatické kosti a spodní stěny orbity téměř až k apexu orbity. Kompletní resekce nosního septa, sanace stropu ethmoidů a sfenoidu vlevo, tam se infiltrace makroskopicky nešířila. Byla resekována přepážka mezi sfenoidem a nosohltanem, rovněž laterální stěna nosohltanu vlevo, včetně chrupavky Eustachovy tuby. Defekt obličeje a patra (obr. 4) nebyl, vzhledem k závažnému stavu a velmi otazné celkové prognóze přežití, primárně rekonstruován. Histologicky byla potvrzena diagnóza mukormykózy (obr. 5). Operační výkon i pooperační období proběhlo bez komplikací s přiměřeným nálezem na CT (obr. 6), pacient byl 3. pooperační den přeložen zpět na Kliniku infekčních, parazitárních a tropických nemocí Nemocnice na Bulovce, kde pokračovala systémová antimykotická terapie. Pacient byl po cca tříměsíční hospitalizaci propuštěn do ambulantního sledování. Nyní je již více než rok po operaci, všechny kontrolní kultivace byly bez průkazu mukormykózy. Kontrolní MRI hlavy jsou s uspokojivými nálezy. Byla zhotovena obličejová epitéza a obturátor patra (obr. 7). Dále pokračovala ambulantní perorální terapie posakonazolem v dávce 300 mg 3x denně další dva měsíce po propuštění.
Obr. 1. CT vedlejších nosních dutin - předoperačně před radikálním chirurgickým resekčním výkonem.
A-axiální projekce (infiltrace fossa pterygopalatina vlevo - viz šipka); B-koronární projekce (pneumoorbita - viz šipka)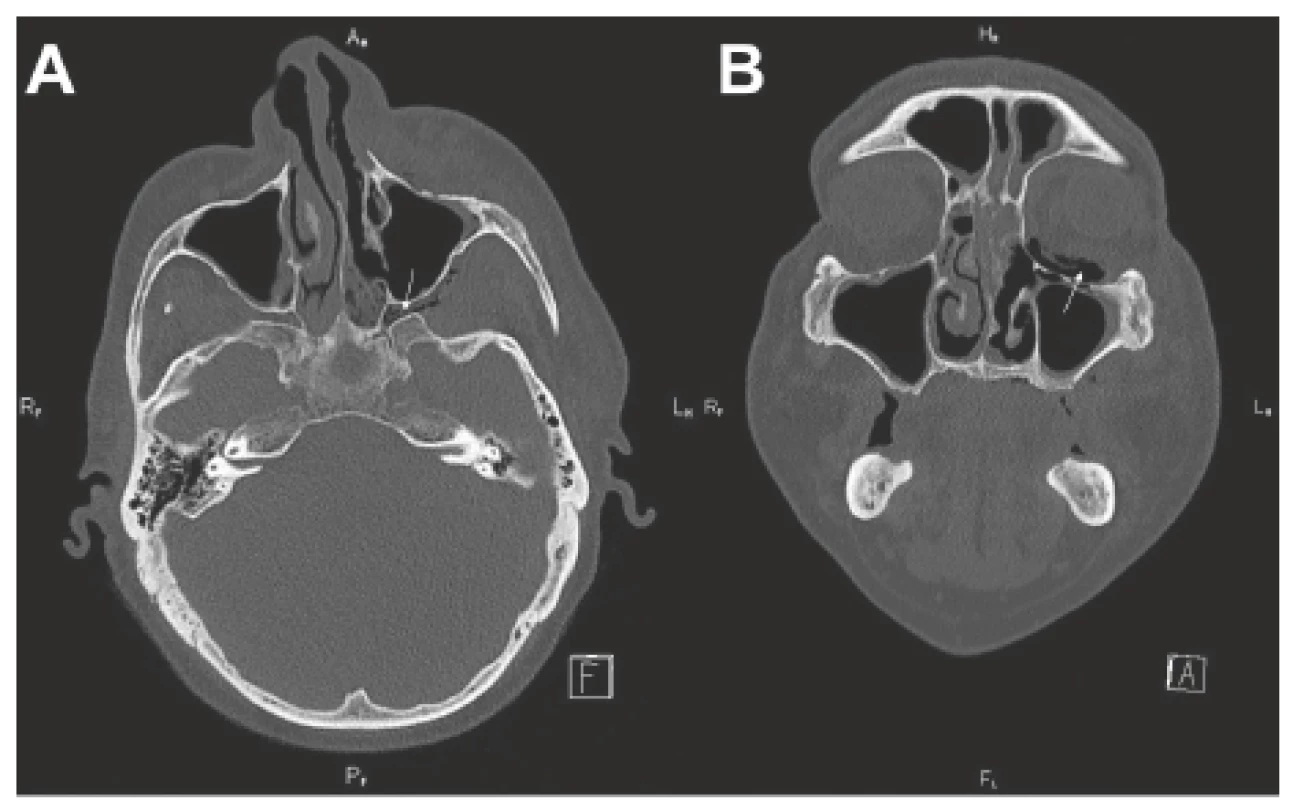
Obr. 2. MRI vedlejších nosních dutin - předoperačně před radikálním resekčním chirurgickým výkonem.
A-T1 vážení (zánětlivá infiltrace fossa pterygopalatina (viz šipka) a tkání levé tváře (viz *); B-T2 vážení (zánětlivá infiltrace tkání fossa pterygopalatina (viz šipka) a tkání levé tváře (viz *)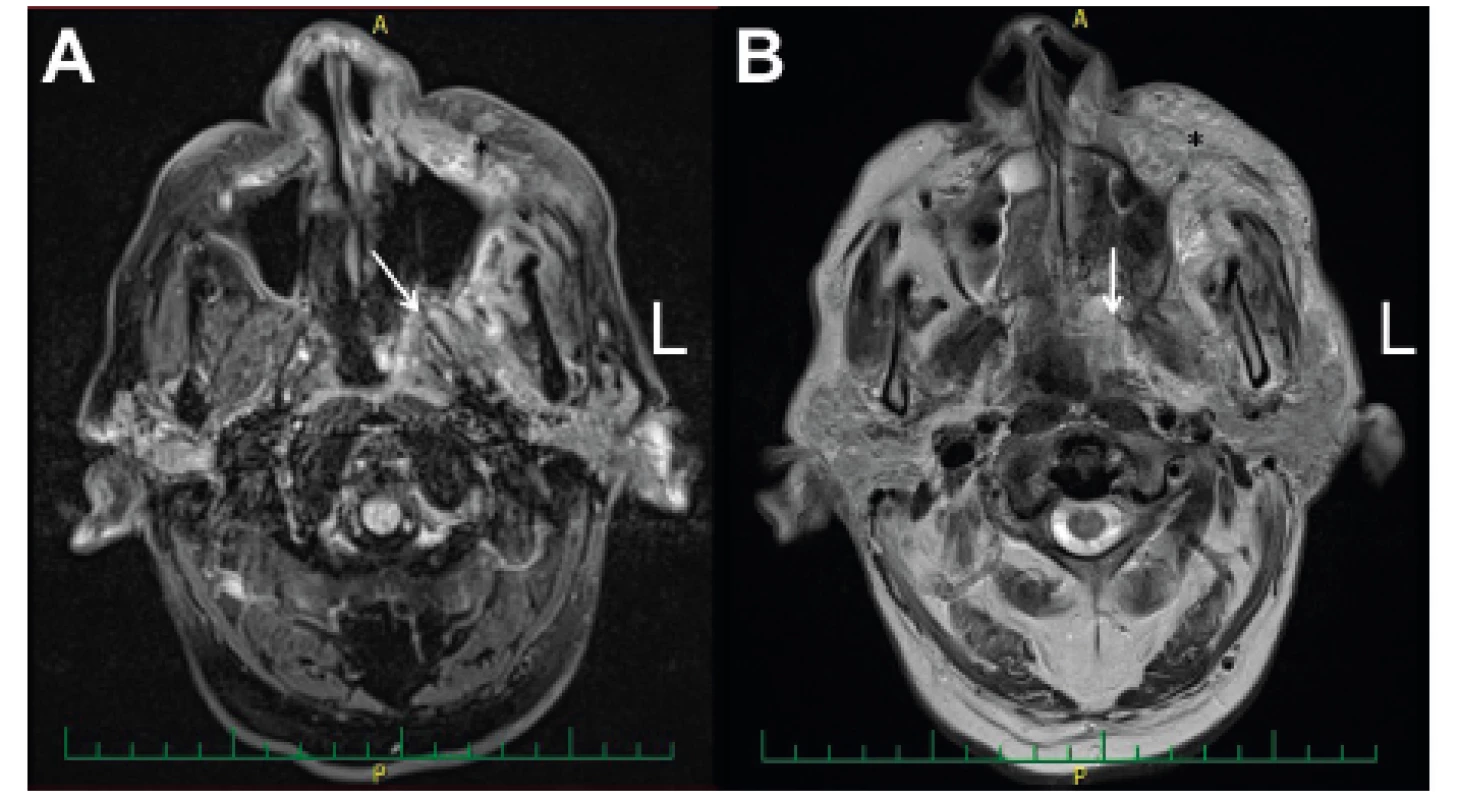
Obr. 3. Předoperační lokální nález před radikálním resekčním chirurgickým výkonem - infiltrace levé tváře (viz *). 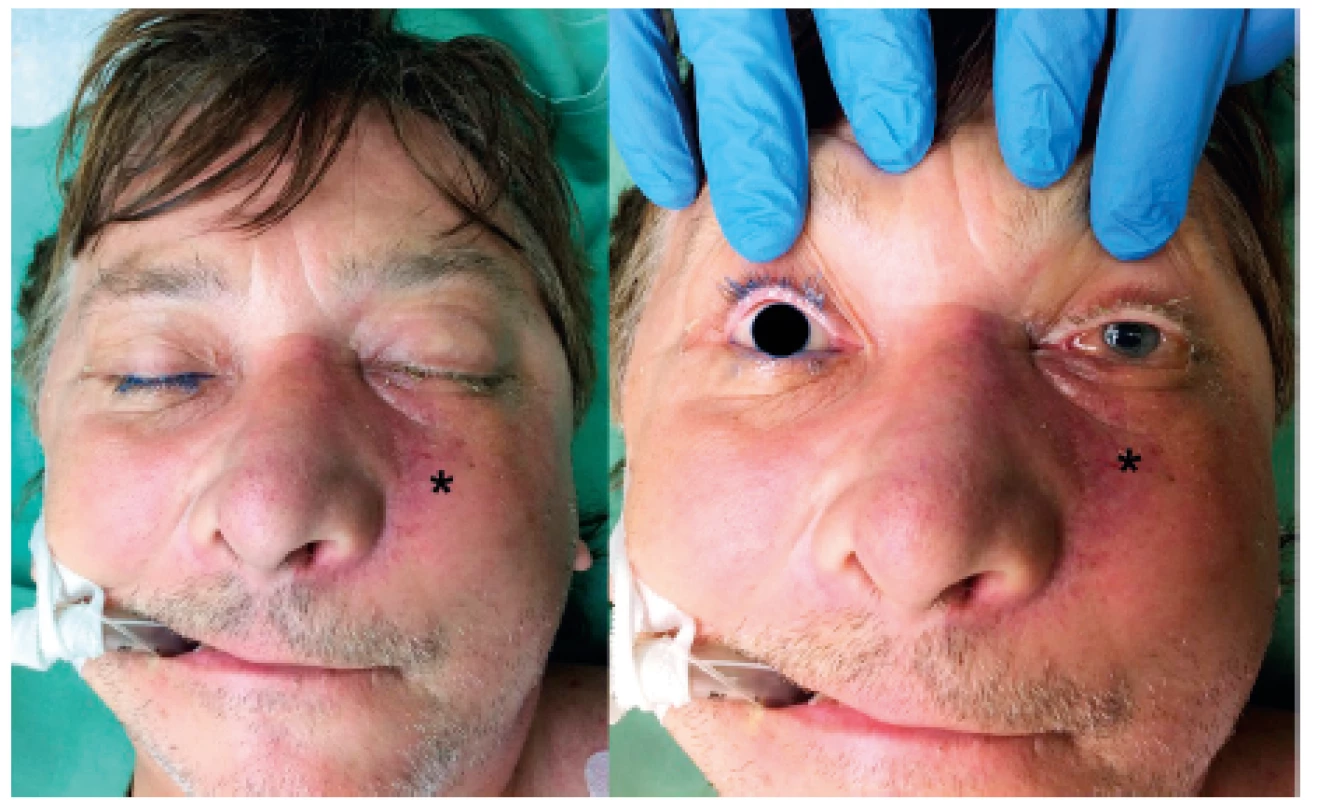
Obr. 4. Výsledná trepanační dutina. 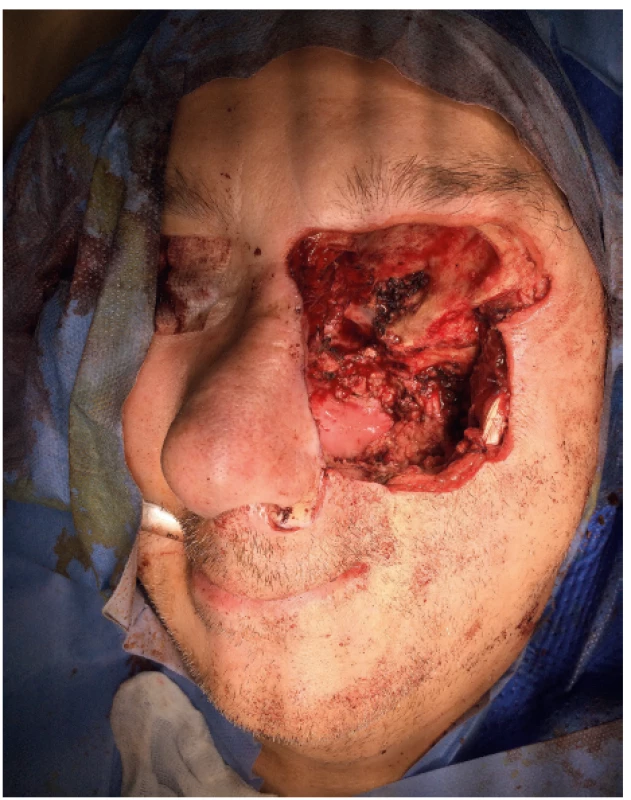
Obr. 5. A-Měkké tkáně: epiteloidní granulomy s obrovskými mnohojadernými buňkami, v centru granulomů nekróza, hnisavý zánět a pomnožená vlákna mykózy (HE, 400x); B: Maxilární sinus: pomnožená vláknitá mykofyta v nekróze na povrchu (HE, 400x); C: nosní septum: infitrace kosti mykózou (viz šipka) (HE, 200x); D: Invaze mykózy do cévy s počínající trombózou (viz šipka) a s nekrózou stěny (HE, 400x). 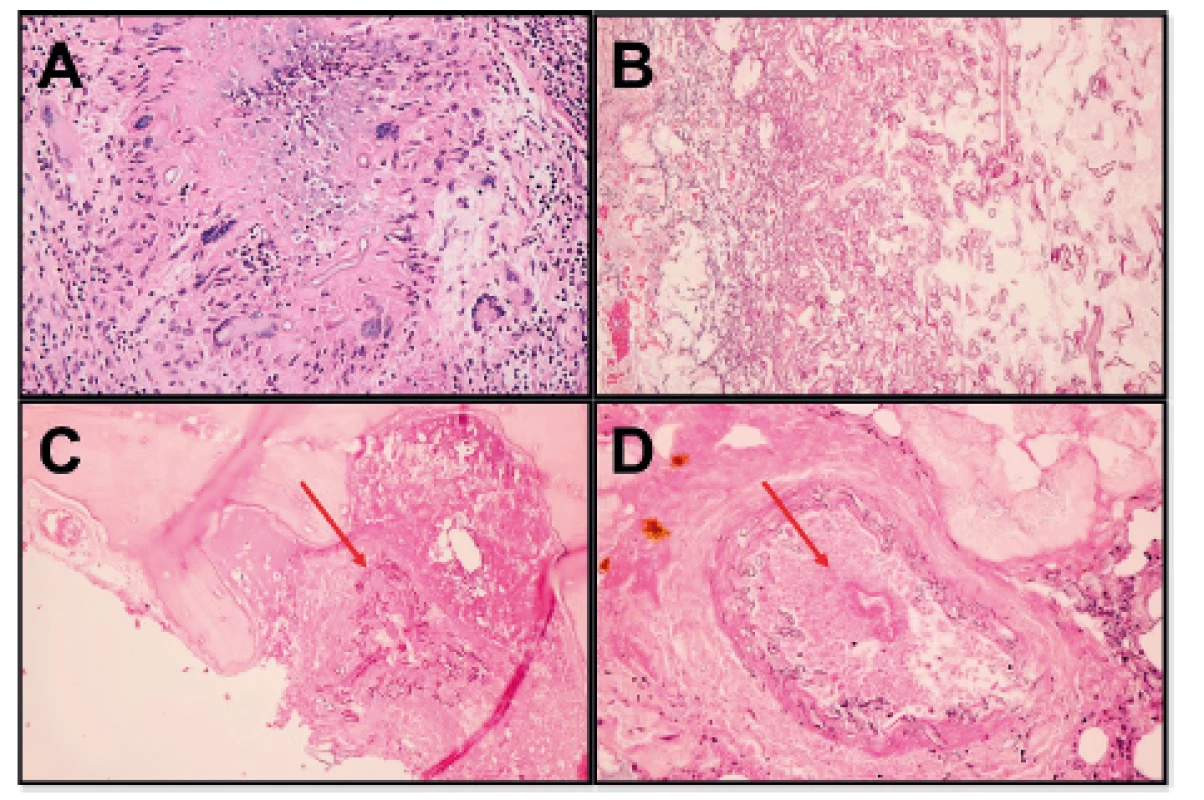
Obr. 6. CT projekce, pooperační stav, trepanační dutina vyplněná tamponádou (viz šipka), zadní hranice resekce při foramen ovale (viz *). 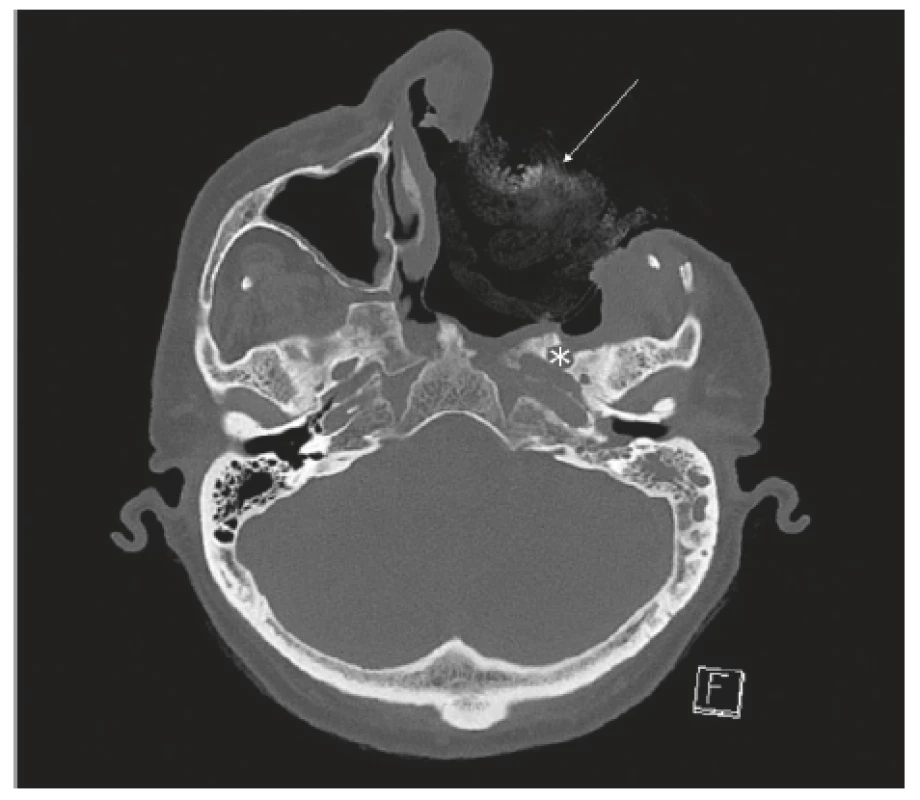
Obr. 7. Defekt řešen pomocí epitézy. 
DISKUSE
Nejčastější formou mukormykózy je rhino-cerebrální forma, kde hlavní predisponující faktor je dekompenzovaný DM, ale může být spojena i s jinými imunosupresivními stavy (5, 21, 26). Rhino-cerebrální mukormykóza se dále rozděluje dle lokalizace postižení na rhino-orbitální a rhino-orbito-cerebrální (11, 12).
Většina případů rhino-orbitalní, potažmo rhino-orbito-cerebrální mukormykózy, obvykle začíná inhalací plísňoých spór do nosní dutiny a vedlejších nosních dutin se vznikem sinusitidy (zejména ethmodální sinusitidy) (11, 19). Na začátku imituje mukormykóza příznaky rinosinusitidy, jako např. bolest hlavy, bolest v obličeji, zduření sliznic, nosní obstrukce, odontoalgie, jednostranný otok obličeje a hyposomie či anosmie (15). Následně dochází k přímému (destrukcí skeletu a tkání) či hematogennímu šíření do okolních struktur, predilekčně do tvrdého patra a z etmoidálních sinů přes preformované defekty v lamina papyracea do očnice. Na tvrdém patře může vzniknout bolestivá, nekrotická ulcerace. Při postižení očnice dominuje bolest, chemóza spojivky, oftalmoplegie, protruze bulbu až ztráta zraku (12). Oční příznaky jsou podobné jako u bakteriální celulitidy/flegmóny očnice (26). Oftalmoplegie vzniká při postižení okohybných svalů a orbity, nebo při zasažení III., IV. či VI. hlavového nervu. Dále může být pozorována periferní paréza lícního nervu a hypestezie tváře (12). V poslední fázi šíření dochází k rozšíření infekce intrakraniálně cestou fissura orbitalis superior, lamina cribriformis, v. ophtalmica či a. carotis interna (2, 20). V našem případě primárně dominovaly příznaky pro jednostrannou akutní rinosinusitidu s následnou orbitální komplikací. Vedlejším nálezem byl nekrotický defekt na tvrdém patře. Postupně docházelo k progresi očnicových příznaků, včetně ztráty zraku na levém oku. Dominujícím symptomem u našeho pacienta byla výrazná bolest zasažené oblasti.
Na mukormykózu je nutno vždy pomýšlet při periorbitální celulitidě u imunokompromitovaných pacientů, převážně diabetiků. Ve studii Petersona a kol., která zahrnovala 929 případů mukormykózy různých lokalizací, byl zjištěn DM u 36 % pacientů, z nichž byla jedna třetina s dekompenzovaným onemocněním s ketoacidózou (18). Jako důvod zvýšeného výskytu mukormykózy u dekompenzovaných diabetiků se uvádí ketoacidóza, která podporuje růst hub z čeledi Mucorales. Houby z čeledi Mucorales mají afinitu ke kyselému prostředí a obsahují enzym ketoreduktásu, který jim právě umožňuje růst ve stavu diabetické ketoacidózy (27). Son a kol. ve své práci doporučují u pacientů imunokompromitovaných, či pacientů s dekompenzovaným diabetem, se symptomy orbitocelulitidy s progresí ztluštění sliznice v maxilárním sinu na kontrolním CT, provést co nejdříve bioptické ověření s ev. časným zahájením terapie (26).
Terapie spočívá v dodržení čtyř zásadních faktorů: včasné diagnostice, eliminaci predisponujících faktorů, podávání antimykotik (např. Amfotericinu B) v dostatečné dávce a délce užívání a radikálním chirurgickém odstranění postižené (nekrotické) tkáně. Průnik protiplísňové terapie do infikované oblasti je chabý kvůli trombózám a tkáňovým nekrózám, a proto má radikální chirurgický zákrok kritický význam v léčbě pacientů s mukormykózou.
Stanovení diagnózy mukormykózy je zpravidla založeno na souboru klinických, histologických, mikrobiologických a radiologických nálezů. Vzhledem k absenci vhodného biomarkeru k rychlé diagnostice mukormykózy, je nutná vždy histologická verifikace, kultivace mikroorganismu, anebo vyšetření PCR – dostatečná je identifikace přítomnosti infekčního agens. Histologická diagnostika zůstává zlatým standardem. Histologicky se prokazuje v zánětlivě změněné tkání přítomnost vláknitých mykofytů (13). Dále se provádí i přímé kultivační vyšetření, které však může být až ve dvou třetinách falešně negativní. Nelze pominout fakt, že mikroskopický i kultivační průkaz mukormycet vyžaduje vyšetření dostatečně reprezentativního vzorku tkáně. PCR průkaz fungální DNA proto může svou senzitivitou umožnit časný (do 24 hodiny) průkaz infekce ze vzorku, který není dostatečně vhodný k mikroskopii a/nebo kultivaci. I přesto by měla být diagnóza potvrzena předchozími metodami (9). V našem případě byla diagnóza stanovena kultivačně a následně potvrzena histologicky.
Vyšetření zobrazovacími metodami je nezbytné pro správnou diagnózu a pro rozsah chirurgického výkonu. V rámci diagnostického algoritmu se doporučuje kombinace vyšetření CT a MRI. Na CT snímcích může být patrné ztluštění sliznice bez přítomnosti tekutiny v paranazálních dutinách s průkazem časné kostní destrukce (7, 8). Na MRI bývá zobrazeno ztluštění sliznic, včetně zánětlivě změněných měkkých tkání (svalů), dále lze lépe posoudit nález v orbitě či přítomnost intrakraniálního šíření. Obraz na CT má nižší specifitu pro mukormykózu než zobrazení na MRI (7, 8). V časné fázi onemocnění může být nález na CT a MRI negativní, proto při podezření na mukromukózu je nezbytné provedení bioptického vyšetření u vysoce rizikových pacientů (22). V rámci dispenzarizace se doporučuje provádět MRI hlavně vzhledem k vyšší specifitě nálezu pro mukromykózu a nutnosti opakovaných kontrol (10).
Léčba mukormykózy je převážně založena na kombinaci systémové antimykotické terapie s radikálním chirurgickým výkonem.
Lékem volby je amfotericin na lipidovém nosiči, vždy v maximální dávce (např. Amphotericin B Lipid Complex 5–7 mg/kg/den, ale i více), posakonazol je efektivní ve druhé linii léčby, zkouší se kombinace s echinokandiny, zatím však bez významného úspěchu (5).
Trvání terapie je individuální, celková doba terapie není jednoznačně specifikována a závisí na klinickém stavu. U dlouhodobě imunosuprimovaných pacientů, či při pokračování rizikových faktorů, je třeba zvážit udržovací léčbu s následnou dlouhodobou sekundární profylaxí – nebyl však dosud vytvořen skórovací systém k přesnému vyčlenění rizikových skupin (5, 16). V našem případě byl iniciálně podáván amfotericin na lipidovém nosiči s následnou změnou na amfotericin. Pro dlouhodobou zajišťovací terapii byl zvolen posakonazol.
Vzhledem k tomu, že onemocnění mukormukózou způsobuje obstrukci cév a limituje tedy průnik systémově podaného antimykotika do postižené tkáně, jsou některými autory doporučovány i výplachy, tedy lokální terapie Amfotericinem B (12). Přínos ke zlepšení prognózy však zůstává sporný. Seiff a kol. doporučují lokální výplachy/aplikaci s Amfotericinem B jako adjuvantní terapii při kontrole rhino-orbitální mykotické infekci, zejména u pacientů s reverzibilním imunokompromitovaným stavem (24).
Jako doplňková léčba se může využít i hyperbarická oxygenoterapie (HBO). Je doporučována kombinace standardní terapie a HBO jako doplňkovou léčbu ke zlepšení prognózy onemocnění (1, 4). Standardní tlak v hyperbarické komoře by měl být 2,5 až 3 atmosféry a 100% saturace kyslíkem. Vysoká koncentrace kyslíku v tkáních je fungicidní, podporuje aktivitu neutrofilů, inhibuje růst plísní, zvyšuje koncentraci kyslíku v ischemické oblasti, zlepšuje hojení podporou růstových faktorů (4).
Použití antikoagulační terapie je opodstatněno vzhledem ke vzniku cévní trombózy, která u mukormykózy vede k nekróze tkání. Kontrolované studie, které by potvrzovaly její benefit, ale nejsou (23).
Nelze opomenout, že v rámci terapeutických opatření je nutné kompenzovat základní vyvolávající onemocnění/stav, kterým je u rhino-cerebrální formy mukromykózy zejména dekompenzovaný DM.
Další nedílnou součástí léčby této formy mukormykózy je radikální chirurgická léčba, velmi často spojená s mutilujícím následkem pro pacienta.
Načasování a rozsah chirurgické léčby pro maximalizaci úspěchu léčby nejsou jednoznačně definované. V souboru pacientů autorů Plowes Hernandeze a kol. byl primární chirurgický výkon proveden do 24 hodin od stanovení diagnózy, revizní výkon byl indikován v případech s klinickými či lokálními známkami přetrvávající nekrotické tkáně (20).
Někteří autoři uvádějí, že zpoždění chirurgické léčby, trvající déle než 6 dní, představuje indikátor špatné prognózy (25). Naproti tomu Saedi a kol. uvádějí, že doba provedení chirurgického výkonu od primární diagnostiky (16,6 ± 7,7 dne) neměla žádný významný vztah k přežití pacientů v jejich souboru (23). Zdá se, že kompenzace predisponujících faktorů a časné zahájení antifungální terapie může být prognosticky významnější než časný chirurgický výkon (23). V našem případě byl radikální chirurgický výkon indikován 18. den po mikrobiologické diagnostice mukormykózy.
Chirurgický výkon by měl být radikální v rozsahu postižení mukormykózou až po dosažení makro a mikroskopicky zdravé tkáně (2). Plowes Hernandez a kol. ve shodě s prací Seiffa a kol. poukazují na to, že fisura pterygopalatina, kam se infekce dostává přes foramen sfenopalatinum, je hlavním rezervoárem pro Mucor a predispozičním místem pro šíření infekce do dalších míst. Proto doporučují při chirurgickém výkonu odstranit zadní stěnu maxilárního sinu, s vizualizací fisury pterygopalatiny (20, 24).
Trombóza větví arteria sfenopalatina ve fissura pterygopalatina, anebo trombóza přední etmoidální artérie může vysvětlovat vznik nekrózy nosní sliznice. Vzniklé krusty lze tedy považovat spíše za důsledek vaskulární nekrózy, než jako přítomnost mykotických organismů (6).
U postižení očnice je nutné zvažovat její exenteraci, která zejména u pacientů oftalmoplegií zlepšuje jejich přežití. Existují však různé názory na načasování jejího provedení (20). Dle práce Karadeniz Ugurlu a kol. by měla být indikována exenterace očnice při život ohrožující progresi onemocnění. Doporučují tedy pečlivě sledovat celkový stav pacienta, průběh onemocnění a odpověď na terapii (12). Plowes Hernandez a kol. naopak doporučují indikovat exenteraci orbity pouze u pacientů se syndromem orbitálního hrotu s trombózou kavernózního sinu (20). Exenterace orbity společně s odstraněním nekrotické tkáně z fissura pterygopalatina a horní orbitální fisury u pacientů s progresivním postižením očnice by měla odstranit potencionální mykotický rezervoár, a tím zabránit intrakraniálnímu šíření infekce (8).
V našem případě se jednalo o radikální mutilující chirurgický výkon i s odstraněním zadní stěny maxilární dutiny, včetně resekce měkkých tkání fossa pterygopalatina a tkání dorzálně od pterygoidního výběžku a s exenterací očnice. Dosažení zdravé tkáně bylo ověřeno histologicky. Kosmetický defekt obličeje byl v druhé době řešen pomocí obturátoru a zhotovením epitézy.
Prognóza rhino-orbitální mukormykózy je velmi závažná, kdy se mortalita pohybuje přibližně mezi 15 až 78,6 % zejména v závislosti na rychlosti stanovení diagnózy a zahájení adekvátní terapie (12, 22, 29). Na časnosti diagnózy je závislý i rozsah onemocnění (šíření do orbity, intrakraniální šíření), který výrazně zvyšuje mortalitu. U intrakraniálního šíření může být mortalita až ve 100 % (28, 29).
Dle autorů Vironneau a kol. je prognóza ovlivněna hlavně dosažením kompletní lokální kontroly bez známek onemocnění (jak klinicky, tj. kompletní odstranění nekrotických hmot a tkání infiltrovaných mukormykózou, tak i dle zobrazovacích metod) (30). U jimi sledovaného souboru pacientů za období 90 dnů, u kterých nebyla dosažena kompletní lokální kontrola, byla mortalita 75%, a naproti tomu u pacientů s dosažením kompletní lokální kontroly nebylo zaznamenané žádné úmrtí (30). V našem případě chirurgický výkon nebyl indikován primárně proto, že i přes radikální chirurgický výkon se zdálo být nepravděpodobné, že se podaří zaručit kompletní lokální kontrolu. K pokusu o kurativní chirurgickou léčbu bylo nakonec přistoupeno na základě další progrese onemocnění, kdy potencionálně úspěšný radikální chirurgický výkon dával jedinou šanci na přežití pacienta. U našeho pacienta se nakonec podařilo díky rozsáhlému chirurgickému výkonu zajistit kompletní lokální kontrolu onemocnění, a tedy vyléčení pacienta.
ZÁVĚR
Mukormukóza, bez ohledu na lokalizaci postižení, je onemocnění s fulminativním průběhem s vysokou mortalitou. Obeznámení se s charakteristikami tohoto onemocnění mohou být život zachraňující, spolu s včasnou diagnózou a léčbou, kdy neprodleně zahájená terapie je důležitým prognostickým faktorem. Radikální chirurgický zákrok má kritický význam v léčbě těchto pacientů.
Úspěch léčby mukormykózy mají zajistit 4 faktory: včasná diagnóza, ovlivnění predispozičních rizikových faktorů, např. kompenzace diabetu, důsledná antimykotická terapie, radikální chirurgický zákrok (odstranění nekrotických tkání a tkání zasažených mukormykózou). Velmi důležitá je i mezioborová spolupráce.
Poděkování
Poděkování za poskytnutí CT a MR snímků Nemocnici na Bulovce.
Prohlášení o střetu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
MUDr. Gabriela Neškudlová
Klinika ORL a chirurgie hlavy a krku
1. LF UK a FN Motol
V Úvalu 84
150 05 Praha 5
e-mail: gabriela.neskudlaa@fnmotol.cz
Zdroje
1. Almannai, M., Imran, H., Estrada, B. et al.: Successful treatment of rhino-orbital mucormycosis with posaconazole and hyperbaric oxygen therapy. Pediatr Hematol Oncol, 30, 2013, 3, s. 184-186.
2. Čelakovský, P., Vokurka, J., Laco, J. et al.: Invazivní mykotické sinusitidy. Cesk Slov Neurol N, 74, 2011, 2, s. 163-167.
3. Farojov, R., Aydin, O., Yilmaz, C. et al.: Rhino-orbita-maxillary mucormycosis after liver transplantation: A case report. Transplant Proc, 48, 2016, 9, s. 3210-3213.
4. Ferguson, B. J., Mitchell, T. G., Moon, R. et al.: Adjunctive hyperbaric oxygen for treatment of rhinocerebral mucormycosis. Rev Infect Dis, 10, 1988, 3, s. 551-559.
5. Haber, J.: Mykotické infekce u onkologického pacienta, přehled léčebných možností. Remedia, 24, 2014, 1, s. 36-41.
6. Hargrove, R. N., Wesley, R. E., Klippenstein, K. A. et al.: Indications for orbital exenteration in mucormycosis. Ophthalmic Plast Reconstr Surg, 22, 2006, 4, s. 286-291.
7. Herrera, D. A., Dublin, A. B., Ormsby, E. L. et al.: Imaging findings of rhinocerebral mucormycosis. Skull Base, 19, 2009, 2, s. 117-125.
8. Howells, R. C., Ramadan, H. H.: Usefulness of computed tomography and magnetic resonance in fulminant invasive fungal rhinosinusitis. Am J Rhinol, 15, 2001, 4, s. 255-261.
9. Chrenková, V., Hubáček, P., Weinbergerová, B. et al.: Invazivní mukormykóza u dětských hematoonkologických pacientů: zkušenosti 2005-2010. Klin Mikrobiol Infekc Lek, 18, 2012, 4, s. 102-108.
10. Imbernon, A., Agud, J. L., Cuetara, M. S. et al.: Successful therapy of progressive rhino-orbital mucormycosis caused by Rhizopus arrhizus with combined and sequential antifungal therapy, surgery and hyperbaric therapy. Med Mycol Case Rep, 6, 2014, s. 51-54.
11. Janušková, V., Komínek, P., Kostřicová, E. et al.: Mukormykóza nosní a ústní dutiny. Otorinolaryng a Foniat /Prague/, 50, 2001, 4, s. 250-252.
12. Karadeniz Ugurlu, S., Selim, S., Kopar, A. et al.: Rhino-orbital mucormycosis: clinical findings and treatment outcomes of four cases. Turk J Ophthalmol, 45, 2015, 4, s. 169-174.
13. Kontoyiannis, D. P., Lewis, R. E., Lortholary, O. et al.: Future directions in mucormycosis research. Clin Infect Dis, 54, 2012, Suppl 1, s. S79-85.
14. Lysková, P., Žačková, P., Petečuková, V. et al.: Plicní mukormykóza vyvolaná Rhizopus microsporus. Klin Mikrobiol Infekc Lek, 19, 2013, 4, s. 132-137.
15. Mantadakis, E., Samonis, G.: Clinical presentation of zygomycosis. Clin Microbiol Infect, 15, 2009, Suppl 5, s. 15-20.
16. Marák, J., Hejsek, L., Jakoubková, S. et al.: Rinocerebrální forma mukormykózy u mladé diabetičky. Kazuistiky v diabetol, 15, 2017, 2, s. 21-24.
17. Paltauf, A.: Mycosis mucorina - Ein Beitrag zur Kenntniss der menschlichen Fadenpilzerkrankungen. Virchows‘ Arch Pathol Anat, 102, 1885, 3, s. 543-564.
18. Peterson, K. L., Wang, M., Canalis, R. F. et al.: Rhinocerebral mucormycosis: evolution of the disease and treatment options. Laryngoscope, 107, 1997, 7, s. 855-862.
19. Petrikkos, G., Skiada, A., Lortholary, O. et al.: Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis, 54 Suppl 1, 2012, s. S23-34.
20. Plowes Hernandez, O., Prado Calleros, H. M., Soberon Marmissolle Daguerre, G. S. et al.: Rhino-orbito-cerebral mucormycosis. Management strategies to avoid or limit intracraneal affection and improve survival. Acta Otorrinolaringol Esp, 66, 2015, 6, s. 348-352.
21. Rammaert, B., Lanternier, F., Poiree, S. et al.: Diabetes and mucormycosis: a complex interplay. Diabetes Metab, 38, 2012, 3, s. 193-204.
22. Rapidis, A. D.: Orbitomaxillary mucormycosis (zygomycosis) and the surgical approach to treatment: perspectives from a maxillofacial surgeon. Clin Microbiol Infect, 15 Suppl 5, 2009, s. 98-102.
23. Saedi, B., Sadeghi, M., Seilani, P.: Endoscopic management of rhinocerebral mucormycosis with topical and intravenous amphotericin B. J Laryngol Otol, 125, 2011, 8, s. 807-810.
24. Seiff, S. R., Choo, P. H., Carter, S. R.: Role of local amphotericin B therapy for sino-orbital fungal infections. Ophthalmic Plast Reconstr Surg, 15, 1999, 1, s. 28-31.
25. Scheckenbach, K., Cornely, O., Hoffmann, T. K. et al.: Emerging therapeutic options in fulminant invasive rhinocerebral mucormycosis. Auris Nasus Larynx, 37, 2010, 3, s. 322-328.
26. Son, J. H., Lim, H. B., Lee, S. H. et al.: Early differential diagnosis of rhino-orbito-cerebral mucormycosis and bacterial orbital cellulitis: based on computed tomography findings. PLoS One, 11, 2016, 8, s. e0160897.
27. Spellberg, B., Edwards, J., Jr., Ibrahim, A.: Novel perspectives on mucormycosis: pathophysiology, presentation, and management. Clin Microbiol Rev, 18, 2005, 3, s. 556-569.
28. Talmi, Y. P., Goldschmied-Reouven, A., Bakon, M. et al.: Rhino-orbital and rhino-orbito-cerebral mucormycosis. Otolaryngol Head Neck Surg, 127, 2002, 1, s. 22-31.
29. Trief, D., Gray, S. T., Jakobiec, F. A. et al.: Invasive fungal disease of the sinus and orbit: a comparison between mucormycosis and Aspergillus. Br J Ophthalmol, 100, 2016, 2, s. 184-188.
30. Vironneau, P., Kania, R., Morizot, G. et al.: Local control of rhino-orbito-cerebral mucormycosis dramatically impacts survival. Clin Microbiol Infect, 20, 2014, 5, s. 336-339.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článek Za Martinom Švecom
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2019 Číslo 3- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Vývoj čelistních a čichových dutin u dětí dle výpočetní tomografie - volumometrická studie
- Vývojová dysfázie u dětí s bilingvní výchovou
- Měření nosní průchodnosti pomocí flowmetrie a klasifikace endoskopického obrazu nosní dutiny
- Analýza výsledků screeningu sluchu novorozenců v Moravskoslezském kraji v roce 2017 a 2018
- „ Novoročné“ cudzie teleso v orbite
- Kolofaryngoplastika v léčbě postkorozivní striktury polykacích cest
- Stenóza trachey jako komplikace nodózní strumy u pacienta po předchozí tracheostomii
- Rhino-orbitální mukormykóza
- Profesor MUDr. Jaroslav Fajstavr, DrSc., devadesátiletý
- Blahopřání k životnímu jubileu prof. MUDr. Romu Kostřicovi, CSc.
- Za Martinom Švecom
- 5. evropský ORL kongres –5th Congres of European ORL-HNS
- XVII. česko-slovenský kongres mladých otorinolaryngológov 2018
- Volby do výboru ČSORLCHHK ČLS JEP pro volební období 2020–2023
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rhino-orbitální mukormykóza
- Vývoj čelistních a čichových dutin u dětí dle výpočetní tomografie - volumometrická studie
- Vývojová dysfázie u dětí s bilingvní výchovou
- Stenóza trachey jako komplikace nodózní strumy u pacienta po předchozí tracheostomii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



