-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perorální antidiabetika
Oral antidiabetic drugs
Glycaemic control is important therapeutic target for Type 2 diabetic patients. These patients present with
- insulin deficiency,
- insulin resistance and
- alpha cell dysfunction.
To overcome failures of current therapy and to address the different underlying defects of pathology of Type 2 diabetes, a combined therapy of oral antidiabetic agents is used. The development of new agents that affect an insulin secretion, progression of beta cell failure and alpha cell dysfunction could be considered as an additional objective for the management of diabetes. The combination of such agents with other oral antidiabetic drugs could provide a long-term effect on good glycaemic control and reduce diabetic and cardiovascular complication in Type 2 diabetic patients.Key words:
diabetes mellitus Type 2, insulin secretion, insulin resistance.
Autoři: Z. Vlasáková; T. Pelikánová
Působiště autorů: Centrum diabetologie ; Přednosta: prof. MUDr. Terezie Pelikánová, DrSc. ; Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Prakt. Lék. 2011; 91(1): 28-32
Kategorie: 40. výročí založení IKEM
Souhrn
Kompenzace je důležitým terapeutickým cílem pro pacienty s diabetes mellitus 2. typu. U těchto pacientů prokazujeme
- poruchu inzulinové sekrece,
- inzulinovou rezistenci, a
- dysfunkci alfa buněk pankreatu.
Kombinační léčba perorálními antidiabetiky je vedena snahou překonat nedostatky současné terapie a zasáhnout všechny poruchy u diabetiků 2. typu. Rozšíření léčebného spektra o nové typy perorálních antidiabetik ovlivňujících sekreci inzulinu, ale i zpomalení progrese selhávání beta buněk a dysfunkci alfa buněk, se proto zdá velmi pozitivním krokem pro terapii diabetu. Taková kombinační terapie by mohla zajistit dlouhodobě dobrou kompenzaci a redukovat diabetické i kardiovaskulární komplikace u diabetiků 2. typu.Klíčová slova:
diabetes mellitus 2. typu, inzulinová sekrece, inzulinová rezistence.Úvod
Poznání, že dosažením cílových hodnot glykemií lze významně snížit morbiditu pacientů s diabetem 2. typu (DM2), dělá z léčby hyperglykemie důležitý terapeutický cíl. Podstatné z kardiovaskulárního hlediska je ovlivňovat i ostatní ukazatele metabolického syndromu, které zhoršují prognózu diabetiků 2. typu.
Perorální antidiabetika (PAD) jsou látky, které snižují koncentraci krevního cukru a jejichž podávání je indikováno u diabetiků 2. typu. Základním předpokladem použití většiny PAD je zachovaná sekrece inzulinu beta buňkami Langerhansových ostrůvků pankreatu. DM2 je chronické progresivní polygenní onemocnění, jehož patofyziologickou příčinou jsou jednak postupné selhávání funkce beta buněk pankreatu a inzulinová rezistence, ale také dysfunkce alfa buněk pankreatu, které produkují glukagon.
Přehled v současné době dostupných klasických PAD uvádí tabulka 1.
Tab. 1. Perorální antidiabetika – přípravky a dávkování 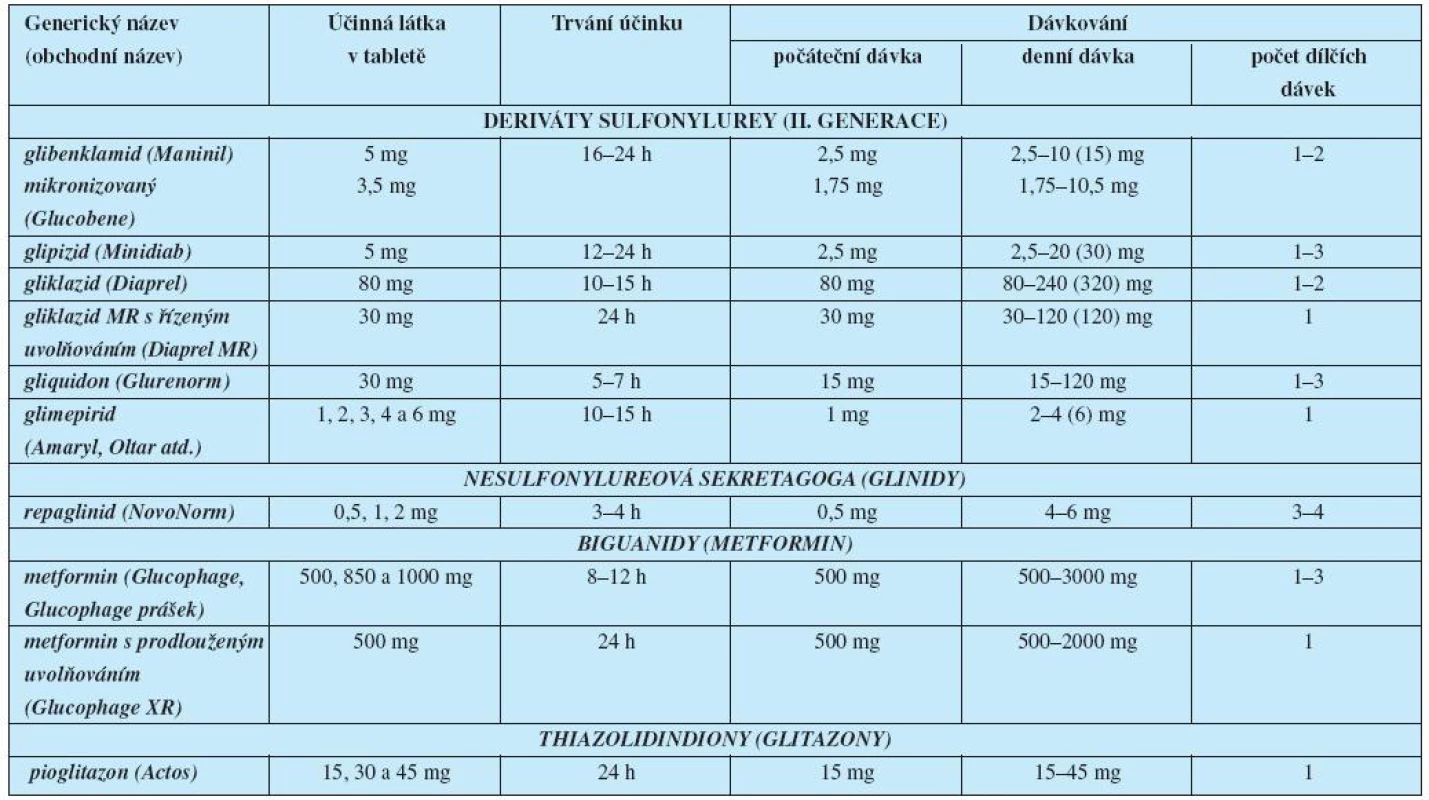
V minulé dekádě bylo objeveno a uvedeno na trh několik nových typů antidiabetik s odlišným účinkem (4, 5).
Metformin a thiazolidindiony (TZD) ovlivňují inzulinovou rezistenci.
Metformin je základním lékem, jehož podávání by mělo být zahájeno ihned po zjištění diagnózy diabetu zároveň s režimovými opatřeními.
Látky, které zvyšují inzulinovou sekreci, jsou sulfonylureová (SU) a nesulfonylureová sekretagoga (NSU) – glinidy. Nově byla mezi látky s antidiabetickým působením zařazena farmaka s inkretinovým účinkem (tab. 2).
Tab. 2. Léčiva ovlivňující inkretinový systém– přípravky a dávkování 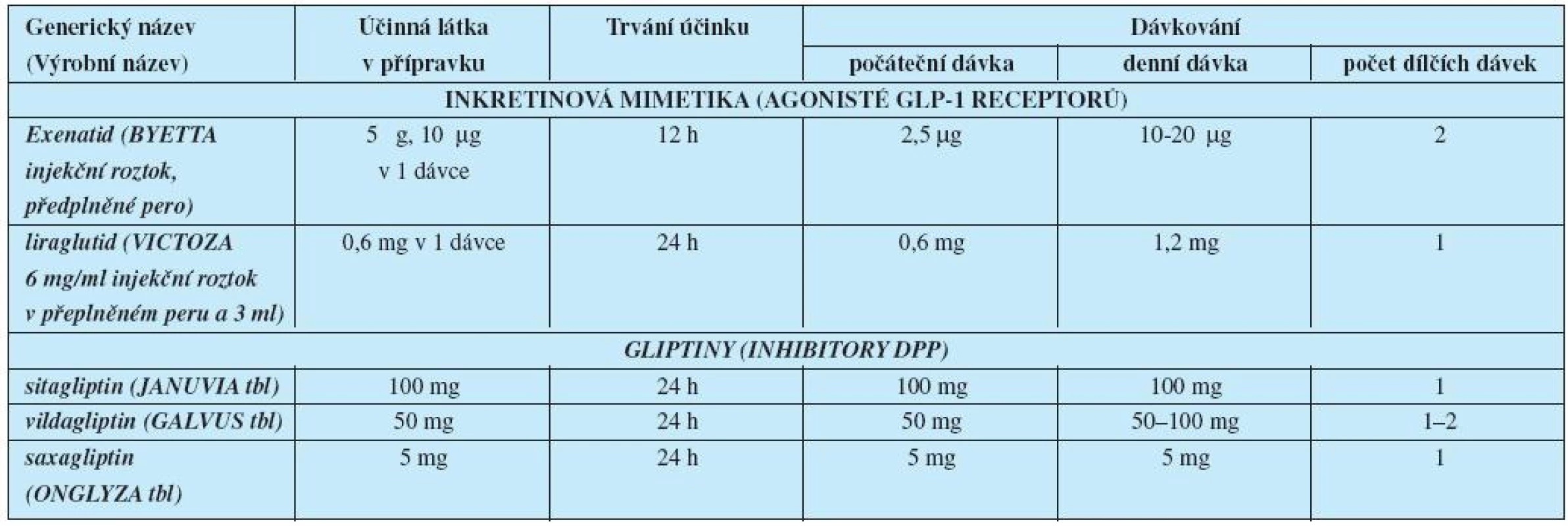
Inhibitory dipeptidyl peptidázy-4 (DPP-4), enzymu štěpícího střevní inkretiny se podávají stejně jako PAD perorálně ve formě tablet. Inkretinová mimetika jsou určena pro injekční podání.
Inkretiny navíc upravují dysfunkci alfa buněk a zvýšenou produkci glukagonu. Dalším možným terapeutickým ovlivněním glykemie je zpomalení vstřebávání glukózy střevem inhibitory střevních alfa-glukozidáz. Kombinované formy PAD uvádí tabulka 3.
Tab. 3. Kombinované přípravky s hypoglykemizujícím účinkem 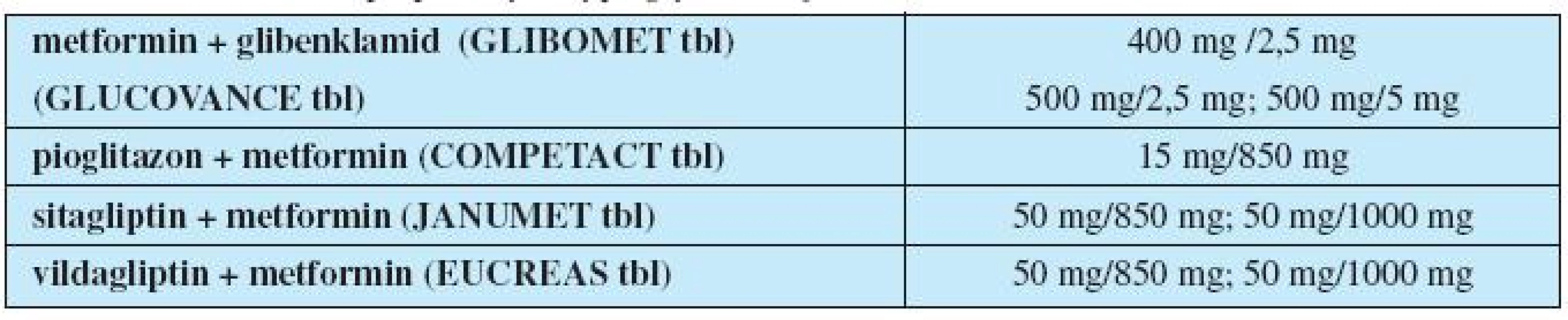
Biguanidy
Metformin je jediným biguanidem používaným v klinické praxi, protože buformin i fenformin byly již staženy z trhu pro vyšší výskyt nežádoucích účinků. Hypoglykemizující účinek metforminu není stále zcela objasněn, ale nejpravděpodobnější se zdá být ovlivnění inzulinové rezistence na úrovni jater, snížení produkce glukózy játry a možné omezení vstřebávání glukózy střevem. Metformin také zvyšuje sekreci glucagon-like peptidu-1 (GLP-1). Anorektický efekt se vysvětluje nejen případnými nežádoucími účinky na gastrointestinální trakt, ale i jako přímý vliv GLP-1 v CNS. Metformin nezvyšuje sekreci inzulinu a jeho výhodu proto je, že nevyvolává hypoglykemie.
Podávání metforminu má pravděpodobně kromě pozitivního vlivu na sacharidový metabolismus i vliv na pokles kardiovaskulárního rizika u pacientů s DM2 (18). V poslední době se ve velkých epidemiologických studiích prokázalo, že metformin snižoval riziko některých typů nádorů.
Podle současných mezinárodních i českých doporučení je metformin lékem první volby, který se má nasadit ihned po stanovení diagnózy DM2 současně s režimovým opatřeními. Výhodný je zejména pro obézní pacienty s inzulinovou rezistencí, i když profitovat z jeho léčby budou i neobézní pacienti s DM2.
Při progresi onemocnění, nestačí-li monoterapie, se metformin kombinuje s
- SU i NSU,
- inkretiny,
- TZD, i
- inzulinem.
Metformin se může podávat například s jednou dávkou dlouhodobě působícího inzulinu, nebo se může přidat k léčbě čtyřmi denními dávkami inzulinu. Při této kombinaci metformin účinně redukuje celkový denní počet jednotek inzulinu.
Je vhodné začít podávání metforminu malou dávkou – 500 mg denně – a postupně ji pak zvyšovat. Zabrání se tak významnějším nežádoucím účinkům, zejména gastrointestinálního charakteru. Dávka se může navyšovat až do 3 000 mg denně; u metforminu s prodlouženým účinkem, jehož výhodou je dávkování v jedné večerní dávce a v menších negativních účincích, je maximální dávka 2 000 mg denně.
Vzhledem k bezpečnému profilu metforminu, jeho prokázanému efektu na v prevenci DM2, poklesu kardiovaskulární mortality a nádorových onemocnění se jistě dočkáme doby, kdy bude indikován i pro podávání osobám s poruchou glukózové homeostázy a s metabolickým syndromem.
U nediabetických osob je doporučeno podávat metformin nemocným se syndromem polycystických ovarií, pokud jsou přítomny i další známky metabolického syndromu.
Při terapii metforminem je nutné pravidelně kontrolovat renální funkce, nicméně studie z poslední doby naznačují, že používání metforminu je bezpečné, pokud GF neklesne pod 30 ml/min (15). Stejně tak je kontraindikován při těžké jaterní poruše a stavech s rizikem lokální nebo celkové hypoxie, jako jsou
- akutní infarkt myokardu,
- kardiální insuficience,
- těžká plicní onemocnění,
kdy by mohl hrozit rozvoj laktátové acidózy.
V poslední době se rozvinula diskuse o tom, zda je metformin přínosný pro léčbu DM1 s obezitou a známkami metabolického syndromu.
Thiazolidindiony (TZD) – glitazony
TZD jsou po metforminu dalšími léky, které snižují inzulinovou rezistenci. Tvoří velkou skupinu selektivních agonistů nukleárních receptorů, působících na transkripci mnoha genů glycidového a lipidového metabolismu v mnoha tkáních organismu. Na našem trhu byly dva z nich:
- pioglitazon, a
- rosiglitazon.
Dne 23. 9. 2010 doporučila EMA (Evropská léková agentura) pozastavit registraci pro léčivé přípravky obsahující rosiglitazon. V EU tyto léky přestanou být dostupné v průběhu několika následujících měsíců. Došlo k tomu poté, co byly u rosiglitazonu publikovány některé studie naznačující zvýšené riziko kardiovaskulárních komplikací (13).
Naproti tomu u pioglitazonu metaanalýzy podporují možný kladný efekt na kardiovaskulární riziko (11).
TZD ovlivňují PPARgama v tukových buňkách, působí na lipolýzu a produkci dalších endokrinně aktivních látek v tukové tkáni. Inzulinová senzitivita se pak nejspíše druhotně zvýší nejen v tukové tkáni, ale i v dalších tkáních, zejména v kosterním svalu, játrech, ale i pankreatu.
Při terapii TZD se kompenzace diabetu zlepší, poklesne glykemie, ale kladný vliv mají TZD i na lipidové spektrum, ovlivňují endokrinní funkci tukové tkáně, ukazatele subklinického zánětu, endoteliální dysfunkci a další ukazatele metabolického syndromu. Zdají se být perspektivní i z hlediska zpomalení progrese selhávání funkce beta buněk u DM2. Jejich účinnost je srovnatelná s metforminem či SU preparáty, avšak dobrého efektu dosahuje léčba až po 6–8 týdnech a maximální účinek se dostaví dokonce po 3–6 měsících.
Pacienta je vhodné na tento jev upozornit.
Pioglitazon je indikován jako lék druhé volby do dvojkombinace při nedostatečné kompenzaci monoterapií maximální dávkou metforminu. Do dvojkombinace se SU se přidává tehdy, netolerují-li pacienti metformin, je-li u nich kontraindikován, nebo ho již užívají v maximální dávce bez dostatečného efektu na kompenzaci diabetu.
Další možností je kombinace TZD s inkretiny, a to jak blokátory DPP-4, tak s. c. aplikovanými inkretinovými mimetiky. Pioglitazon je doporučen i pro trojkombinaci s metforminem a SU při nedostatečné kompenzaci dvojkombinací PAD. Také je možné ho podávat s metforminem a inkretiny těm pacientům, kteří mají vyšší riziko hypoglykemie při léčbě SU a nejsou dvojkombinací PAD dobře kompenzováni. V monoterapii ho lze podat těm diabetikům, kteří mají intoleranci metforminu nejčastěji pro gastrointestinální obtíže a/nebo je u nich metformin kontraindikován.
Výhodou pioglitazonu oproti rosiglitazonu byla možnost podávání v kombinaci s inzulinem. Tato kombinace však může vést u rizikových pacientů ke vzniku otoků a při vystupňování retence tekutin i ke kardiálnímu selhávání (16). Pacient má být poučen o tom, že by měl pravidelně sledovat svoji hmotnost a při jejím rychlejším vzestupu informovat ošetřujícího lékaře. Při známkách kardiálního selhávání je samozřejmě nutné pioglitazon ihned vysadit.
Kromě retence tekutin, rizika srdečního selhání a hmotnostních přírůstků, je relativně častým nežádoucím účinkem akcelerace osteoporózy.
Deriváty sulfonylurey (SU)
Deriváty SU zvyšují vnímavost beta buněk ke glukóze, ale i dalším neglukózovým sekretagogům, a stimulují sekreci inzulinu z beta buněk pankreatu. Zvyšují uvolňování inzulinu ze sekrečních granulí, ale neovlivňují jeho syntézu. Nezbytným předpokladem pro účinek inzulinu je tedy zachovaná sekreční schopnost beta buněk pankreatu.
Deriváty SU se váží na specifické sulfonylureové receptory, jichž existuje několik typů, a vyskytují se v různých tkáních, v
- pankreatu,
- cévách,
- myokardu, a dalších.
Z hlediska bezpečnosti preparátů, zejména kardiovaskulární, je žádoucí selektivní vazba derivátů SU na beta buňky pankreatu. V tomto směru se zdají být výhodné gliclazid a glimepirid. Glibenclamid se váže kromě beta buněk pankreatu též na myokard. SU se ve vysokém procentu váží na plazmatické bílkoviny, což s sebou nese zvýšené riziko lékových interakcí a nutnost titrace účinné dávky.
Preparáty na bázi SU snižují glykemii nalačno, protože se inzulin dostává rychle venou portae do jater a tam účinně blokuje glukoneogenezi. Méně ovlivňují postprandiální glykemie, neboť jejich efekt na časnou fázi sekrece je menší.
SU patří mezi nejstarší hypoglykemizující léky. Jednotliví zástupci této skupiny se liší:
- délkou trvání účinku,
- metabolickou clearancí, a
- četností výskytu hypoglykemií.
Starší typy, SU I. generace (tolbutamid a chlorpropamid) se v dnešní době již neužívají. Některé typy SU II. generace jsou dostupné i ve formě preparátů s prodlouženým vstřebáváním z gastrointestinálního traktu a delším biologickým poločasem (gliclazid MR).
Deriváty SU jsou indikovány jako léky druhé volby, tudíž do dvojkombinace po nasazení metforminu. Další možností je kombinace s pioglitazonem, alfa-glukosidázou nebo večerní dávkou středně nebo dlouhodobě působícího inzulinu. Schválena je i kombinace s inkretiny, i když z hlediska patofyziologie není ideální kombinovat dvě různá sekretagoga.
Dávka SU se po přidání inkretinů často snižuje, aby se zabránilo hypoglykemiím. SU nejsou v průběhu času stejně úspěšné v udržení cílové glykemie jako metformin a/nebo TZD (10).
Kontraindikací SU jsou zejména
- DM1,
- respirační či oběhová insuficience,
- snížená renální funkce (neplatí pro gliquidon a gliclazid).
Nepříjemným nežádoucím účinkem jsou hypoglykemie (7), které provázejí zejména léčbu glibenclamidem s nejdelším biologickým poločasem. Těžší hypoglykemie může u starších pacientů imitovat centrální mozkovou příhodu. Je třeba si uvědomit, že hypoglykemie i po PAD mohou být navíc kardiovaskulárním rizikovým faktorem.
Dalším nežádoucím účinkem léčby SU je, podobně jako u TZD, přírůstek hmotnosti. Kombinace s inkretinem ho může zmírnit.
Volba SU je individuální, je třeba vzít v úvahu
- stáří pacienta,
- jeho hmotnost,
- spolupráci v dietě,
- pohybový režim, i
- celkový zdravotní stav.
Výběr SU se také řídí nástupem a požadovanou délkou trvání účinku a respektováním kontraindikací.
Dlouhý biologický poločas, nejsilnější hypoglykemizující efekt, ale také nejvyšší procento hypoglykemií má glibenclamid. Glipizid a gliclazid, deriváty s kratším poločasem, mají menší riziko hypoglykemie. Přestože mají dlouhý poločas – až 24 hodin, mají glimepirid a gliclazid MR nízké riziko hypoglykemií. Výhodou je naopak možnost podávání v jedné denní dávce. Při těžké renální insuficienci nebo už při dialyzační léčbě je možné podávat gliquidon, gliclazid jen při lehkém a středně závažném postižení ledvinné funkce.
Dávkování je také individuální. Vhodné je začít co nejnižší dávkou SU, po dvou týdnech pak zvyšovat do co nejnižší účinné dávky.
Víme, že ochota pacienta užívat léky se zvýší při redukci jejich počtu. Dnes je na trhu velké množství fixních kombinací jak metforminu se SU, tak metfrominu s pioglitazonem nebo inkretinem. Ošetřující lékaři by měli tyto možnosti využít a snížit tak většinou polymorbidním pacientům počet užívaných tablet.
Nesulfonylureová sekretagoga (NSU) – glinidy
Do této skupiny patří nateglinid a repaglinid, v naší republice je zaregistrován ke klinickému podávání pouze repaglinid.
NSU mají obdobný účinek jako SU, působí přímo na beta buňky pankreatu, avšak sekreci inzulinu zvyšují prostřednictvím jiných receptorů než SU. Jsou označovány jako regulátory postprandiální glykemie, glykemie nalačno téměř neovlivní. Mají velmi rychlý nástup účinku a krátké trvání efektu.
Výhodou oproti SU je nižší výskyt hypoglykemie (8) a to, že se nemusejí podávat v případě vynechání jídla. Repaglinid se metabolizuje v játrech a více než z 90 % vylučuje žlučí, je tedy možné podávat ho u nemocných v renální insuficienci. Nevýhodou je oproti SU vyšší cena.
Kontraindikací NSU je
- DM1,
- věk do 18 let,
- gravidita,
- laktace, a
- těžší poruchy jater.
Dávka se opatrně titruje od nejnižší – 1 mg – až po maximální denní dávku 16 mg, která je rozdělena do čtyř jednotlivých dávek před hlavními jídly.
Inhibitory střevních alfa-glukosidáz
Do této skupiny patří
- miglitol, který není na našem trhu,
- guar, který se užívá velmi omezeně, a
- akarbóza.
Akarbóza je nevstřebatelný pseudotetrapolysacharid, který má výrazně vyšší afinitu ke glukosidázám, štěpícím v trávicím traktu poly - a disacharidy. Akarbóza výrazně omezí vstřebávání glukózy z potravy a účinně snižuje postprandiální glykemie. Je vhodná i pro podávání u DM1. Při dlouhodobé léčbě účinně snižuje glykemii i glykovaný hemoglobin, vylepšuje hodnoty krevních lipidů i dalších markerů metabolického syndromu. Podávání akarbózy není vhodné u střevních onemocnění a gastroparéz.
Akarbóza se má zpočátku podávat v nízké dávce – 50 mg 3 x denně s hlavním jídlem. Při dobré toleranci je možné dávku zvyšovat alespoň v odstupu 14 dnů až na maximální dávku, tj. až 3 x 300 mg.
Nežádoucí účinky jsou bohužel časté, většinou meteorismus a flatulence. Při kombinované terapii se SU nebo inzulinem se mohou vyskytnout hypoglykemie.Ty nelze léčit vzhledem k účinku akarbózy sacharózou, ale pouze glukózou (Glukopur).
Inkretinová PAD – gliptiny (inhibitory DPP-4)
Inkretiny jsou hormony produkované buňkami trávicího traktu po příjmu potravy. Mezi nejdůležitější patří dva inkretiny:
- glucagon-like peptide-1 (GLP-1), a
- inzulinotropní polypeptid závislý na glukóze (GIP).
Fyziologický poločas inkretinů v těle je velmi krátký, řádově několik minut. Terapeutickým přístupem, využívajícím inkretinového efektu, je blokáda nebo inhibice enzymu DPP-4, štěpícího inkretinové hormony, která přetrvává u gliptinů více než 24 hod. Zvýšením koncentrace a prodloužením jejich působení se zesílí efekt na sekreci inzulinu beta buňkou v závislosti na potravě a glykemii (6,12).
Gliptiny mají mnoho dalších velmi pozitivních efektů spojených s přímým účinkem GLP-1 v CNS.
U pacientů s DM2
- snižují příjem potravy,
- snižují lačnou i postprandiální glykemii,
- vedou k poklesu glykovaného hemoglobinu,
- zlepšují funkci beta buněk i citlivost na inzulin (1).
Navíc pozitivně ovlivňují funkci alfa buněk pankreatu, snižují zvýšenou produkci glukagonu a vedou k poklesu glukoneogeneze v játrech.
Velkým kladem je neutrální vliv na hmotnost, pokles krevního tlaku, vylepšení některých ukazatelů lipidového spektra a minimální riziko hypoglykemií, pokud nejsou podávány spolu se SU. Ve zvířecích modelech jsou tyto preparáty schopny zvýšit masu beta buněk urychlením replikace a poklesem apoptózy beta buněk.
Do praxe byl jako první zaveden sitagliptin (9), dalším je vildagliptin (2) a od roku 2009 je schválen ke klinickému užívání i saxagliptin, se kterým jsou u nás zatím minimální zkušenosti.
Gliptiny jsou u DM2 indikovány jako lék druhé volby při nedostatečné kompenzaci monoterapií metforminem nebo glitazonem či derivátem SU. Do trojkombinace se užívají s metforminem a SU nebo metforminem a glitazony. Sitagliptin je schválen do kombinace s inzulinem a v monoterapii jen při intoleranci metforminu.
Kontraindikací je DM1,
- ketoacidóza,
- středně těžká až těžká porucha funkce ledvin a jater,
- gravidita, a
- laktace.
Kromě toho nejsou dostatečné zkušenosti s podáváním v kategoriích do 18 let a nad 75 let.
Gliptiny nemají téměř žádné nežádoucí účinky ani významné lékové interakce. Navíc existují preklinická data, že inhibitory DPP-4 mohou mít kardioprotektivní vliv (3). Je prokázáno, že hypoglykemie je spojena se zvýšeným kardiovaskulárním rizikem a inhibitory DPP-4 jsou známy svým nízkým hypoglykemizujícím potenciálem (12). Jeví se tedy jako velmi perspektivní léky, které jsou zatím schváleny pro podávání do kombinační léčby.
Vzhledem k jejich ochrannému vlivu na beta buňky, zpomalení ztráty funkce beta buněk a dalším kladným efektům se s nimi počítá i pro terapii časných stadií DM2, prediabetu, či metabolického syndromu.
Další perspektivní PAD
V preklinickém a klinickém hodnocení je mnoho nadějných nových typů PAD. Mimo jiné jsou jimi stimulátory glukokinázy nebo blokátory zpětného vstřebávání glukózy ledvinami – glifloziny, které zvyšují glykosurii a účinně snižují hyperglykemii. Jejich výhodou je, že nepůsobí hypoglykemie a nejsou závislé na sekreci inzulinu. Snižují hmotnost ztrátou velkého počtu kalorií a příznivě také ovlivňují krevní tlak.
Je prokázáno, že monoterapie PAD z dlouhodobého hlediska u velkého procenta pacientů selhává. Diabetolog má v současné době možnost vybírat a kombinovat mnoho typů PAD. Proto je velmi důležité se ve výběru vhodného PAD dobře orientovat a o každém pacientovi uvažovat individuálně. Svoji úlohu zde hrají
- mechanismus účinku PAD,
- nežádoucí účinky,
- kontraindikace,
- možné lékové interakce,
- věk pacienta,
- trvání nemoci,
- celková prognóza,
- přítomnost makro - a mikrovaskulárních komplikací,
- riziko hypoglykemie, a konečně i
- cena.
Obecně platí, že mladší pacienti bez komplikací diabetu by mohli profitovat z agresivnější léčby cílené na těsnější kompenzaci diabetu (HbA1c kolem 4,5 %). U starších diabetiků s kardiovaskulárním rizikem je uspokojivá kompenzace s HbA1cdo 6 %, ale s cílem zabránit hypoglykemiím (14, 17).
Součástí komplexní léčby všech DM2 je samozřejmě ovlivnění i ostatních součástí metabolického syndromu, jsou-li přítomny.
V základním algoritmu léčby DM2 zůstává tedy na prvním místě stále metformin, který je z hlediska bezpečnosti dlouhodobě prověřen. Vzhledem k výzkumům v posledních letech a jeho prokázanému vlivu na redukci kardiovaskulárního rizika a snížení rizika některých druhů nádorů se stal metformin jednoznačně lékem první volby nejen u DM2 s nadváhou, ale i u štíhlých pacientů s DM2. Ostatní typy PAD se pak přidávají do dvoj - a trojkombinace s metforminem, jak bylo uvedeno výše. Nedílnou součástí léčebného algoritmu je také kombinace PAD s inzulinem jak v jedné noční dávce, tak ve více denních dávkách.
* * *
I přes širokou paletu PAD zůstává DM2 stále závažným zdravotním a socio-ekonomickým problémem. V naší republice je dobře kompenzováno jen velmi malé procento diabetiků (kolem 10 %). U velkého počtu pacientů v populaci probíhá DM2 mnoho let němě, nediagnostikován. Přibývá obézních pacientů, dětských diabetiků a se stárnutím populace i polymorbidních diabetiků s četnými vaskulárními komplikacemi. Je proto nutné nejen pacienta, ale i lékaře a celou společnost průběžně edukovat v preventivních opatřeních, kterými jsou pro DM2 zejména
- vhodná strava,
- zvyšování fyzické aktivity, a
- nepřibývání na hmotnosti.
MUDr. Zuzana Vlasáková, CSc
Centrum diabetologie IKEM
Vídeňská 1958/9
140 00 Praha 4 – Krč
E-mail: zuvl@ikem.cz
Zdroje
1. Ahrén, B. Dipeptidyl peptidase-4 inhibitors: Clinical data and clinical implications. Diabetes Care, 2007, 30, p.1344-1350.
2. Ahrén, B., Schweizer, A., Dejager, S. et al. Vildagliptin enhances islet responsiveness to both hyper - and hypoglycemia in patients with type 2 diabetes. J. Clin. Endocrinol. Metab. 2009, 94, p. 1236-1243.
3. Ban, K., Hui, S., Drucker, D.J. et al. Cardiovascular consequence of drugs used for the treatment of diabetes: potential promise of incretin-based therapies. J. Am. Soc. Hypertens. 2009, 3, p. 245-259.
4. Campbell, R.K., White, J.R. Jr. More choices than ever before: emerging therapies for type 2 diabetes. Diabetes Educ. 2008, 34, p. 518-534.
5. De Sousa C., Fonseca V. Therapeutic targets to reduce cardiovascular disease in type 2 diabetes. Nat. Rev. Drug Discov. 2009, 8, p. 361-367.
6. Drucker, D.J. Biologic actions and therapeutic potential of the proglucagon-derived peptides. Nature Endocrinol. Metab. 2005, 1, p. 22-31.
7. Gangji, A.S., Cukierman, T., Gerstein, H.C. et al. A systematic review and meta-analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin. Diabetes Care 2007, 30, p. 389-394.
8. Gerich, J., Raskin, P., Jean-Louis, L. et al. PRESERVE-beta: two year efficacy and safety of initial combination therapy with nateglinide or gliburide plus metformin. Diabetes Care 2005, 28, p. 2093-2099.
9. Goldstein, B., Feinglos, M., Lunceford, J. et al. Effect of initial combination therapy with sigagliptin, a dipeptidyl peptidase-4 inhibitor, and metformin on glycemic control in patients with type 2 diabetes. Diabetes Care 2007, 30, p. 1979-1987.
10. Kahn, S.E., Haffner, S.M., Heise, M.A. et al. Glycemic durability of rosiglitazone, metformin, or gliburide monotherapy. N. Engl. J. Med. 2006, 355, p. 2427-2443.
11. Lincoff, A.M., Wolski, K., Nicholls, S.J. et al. Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomised trials. JAMA 2007, 298, p. 1180-1188.
12. Lovshin, J.A., Drucker, D.J. Incretin-based therapies for type 2 diabetes mellitus. Nat. Rev. Endocrinol. 2009, 5, p. 262-269.
13. Nissen, S.E., Wolski, K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N. Engl. J. Med. 2007, 356, p. 2457-2471.
14. Ray, K.K., Seshasai, S.R.K., Wijesuriya, S. et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet 2009, 373, p. 1765-1772.
15. Shaw, J.S., Wilmot, R.L., Kilpatrick, E.S. Establishing pragmatic estimated GFR thresholds to guide metformin prescribing. Diabet. Med. 2007, 24, p. 1160-1163.
16. Singh, S., Loke Y.K., Furberg, C.D. Thiazolidinediones and heart failure: a teleo-analysis. Diabetes Care 2007, 30, p. 2248-2254.
17. Skyler, J.S., Bergenstal, R., Bonow, R.O. et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE and VA diabetes trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Diabetes Care 2009, 32, p. 187-192.
18. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood glucose control with metformin on complication in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998, 352, p. 854-865.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek JUBILEAČlánek Onkomaják zazářil na Žofíně
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Centrum diabetologie a diabetologický program v IKEM
- Přehled počtu odběrů orgánů a transplantací v IKEM v letech 1990–2009
- Nová organizační složka ČLS JEP
- Transplantace pankreatu dříve a nyní
- Aktuality v prevenci a léčbě syndromu diabetické nohy; program podiatrické péče v IKEM
- Perorální antidiabetika
- IKEM Institut klinické a experimentální medicíny: na prahu páté dekády úspěšné existence
- Notes: minulost, současnost, budoucnost
- Vyšetření nemocných zařazovaných na čekací listinu k transplantaci ledviny
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Onkomaják zazářil na Žofíně
- Intervenční kardiologie: co nabízí v roce 2011
- Lékárna IKEM – součást komplexní péče o pacienty
-
Miniportréty slavných českých lékařů
Profesorka MUDr. Dagmar Benešová, zakladatelka české dětské patologické anatomie - Ze života odborných společností ČLS JEP
- Ceny za nejlepší knižní a časopisecké publikace v roce 2009 uděleny
- Moderní biologická léčba je pro řadu onkologických pacientů nedostupná
- IntegraGen získala certifikát poskytovatele služeb pro technologie Illumina GoldenGate a Infinium Genotyping ve Francii
- Světový objev vědců ÚHKT pomůže při léčbě onemocnění srážlivosti krve
- JUBILEA
- Vzpomínka na vznik výzkumných ústavů v Krči, prvopočátku dnešního IKEM
- Čtyřicet let Kardiocentra IKEM
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vyšetření nemocných zařazovaných na čekací listinu k transplantaci ledviny
- Perorální antidiabetika
- Centrum diabetologie a diabetologický program v IKEM
- JUBILEA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



