-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová strategie globální kontroly tuberkulózy/The End TB Strategy
Autori: M. Kubín
Pôsobisko autorov: Hygienická stanice hlavního města Prahy
Vyšlo v časopise: Prakt. Lék. 2016; 96(5): 238-241
Kategória: Aktuality/historie
ÚVOD
Světová zdravotnická organizace (WHO) vyhlásila na svém generálním zasedání v květnu 2014 úspěšné zakončení globálního plánu kontroly tuberkulózy (TBC) s názvem Stop TB Strategy, jehož cílem bylo snížit celosvětovou zátěž tuberkulózní pandemie a do roku 2015 zastavit dosavadní vzestupný trend epidemiologických ukazatelů TBC. Současně byl schválen návazný program End TB Strategy pro období let 2016–2050, kdy by mělo být dosaženo eliminace TBC jako celosvětového veřejně zdravotnického problému a kdy by se měla snížit incidence TBC na méně než JEDEN případ na 100 000 světové populace (5–7).
Strategický plán Stop TB Strategy vyhlášený v roce 1991 měl plnit následující dílčí cíle: 1. snížení hodnot prevalence TBC v roce 2015 na polovinu proti roku 1990; 2. zastavení vzestupného trendu incidence všech forem TBC k roku 2015; 3. snížení hodnot mortality v roce 2015 na polovinu proti roku 1990; 4. detekce nejméně 70 % nových případů bacilární TBC do roku 2005 a 5. vyléčení nejméně 85 % nových případů bacilární TBC do roku 2005.
Program předpokládal vyhledávání nových onemocněné založené převážně na pasivní depistáži symptomatických forem TBC, uplatňování kontrolovaného krátkodobého režimu DOTS (Directly Observed Treatment Short-term) v jejich léčbě, náležitou odbornou péči o léčené pacienty, spolehlivé dodávání antituberkulotik a vyhodnocování výsledků na všech stupních implementovaného systému kontroly TBC. Byla také získána spoluúčast jednotlivých vládních i nevládních organizací na finančním zajištění programovaných úkolů a byly identifikovány oblasti se zvýšenou zátěží TBC spojenou s nástupem nových epidemiologických i socio-ekonomických faktorů. V subsaharských státech Afriky šlo zejména o vzestup incidence TBC v důsledku koincidence s HIV a výskyt multirezistentních forem TBC, např. v Číně a v některých státech bývalého SSSR.
Zastavení dosavadního stoupajícího trendu incidence TBC bylo dosaženo ve všech oblastech WHO teprve v roce 2014. Incidence TBC se snižovala v průměru o 1,5 % ročně a klesla na 80 % hodnot hlášených v roce 2000, snížení úmrtnosti na polovinu hodnot roku 1990 bylo dosaženo ve čtyřech oblastech WHO. Nejvyšší počty nových případů TBC byly notifikovány v oblasti jihovýchodní Asie a západního Tichomoří, kde tvořily podíl 58 % z celkového počtu 9,6 milionů případů hlášených celosvětově. Ze souhrnného počtu 205 hodnocených zemí bylo také vyčleněno 22 států s vysokou zátěží TBC, které představují více než 60 % světové populace a tvoří více než 85 % celosvětových hodnot mortality i incidence TBC. V tomto počtu byla dále identifikována podskupina s názvem BRICS (Brazílie, Rusko, Indie, Čína a jižní Afrika), ve které je pět států s nejvyššími hodnotami epidemiologických ukazatelů TBC. Přehled absolutních i relativních hodnot mortality a incidence TBC v jednotlivých oblastech WHO, ve státech s vysokou zátěží TBC a ve státech BRICS (a pro srovnání také v České republice) za rok 2014 je uveden v tabulce 1.
Tab. 1. Populace, úmrtnost a incidence TBC v jednotlivých oblastech WHO (a v České republice), ve 22 státech světa s nejvyšší zátěží TBC a ve státech skupiny BRICS v roce 2014. Absolutní hodnoty populace, mortality a incidence TBC jsou uvedeny v tisících celkových počtů. 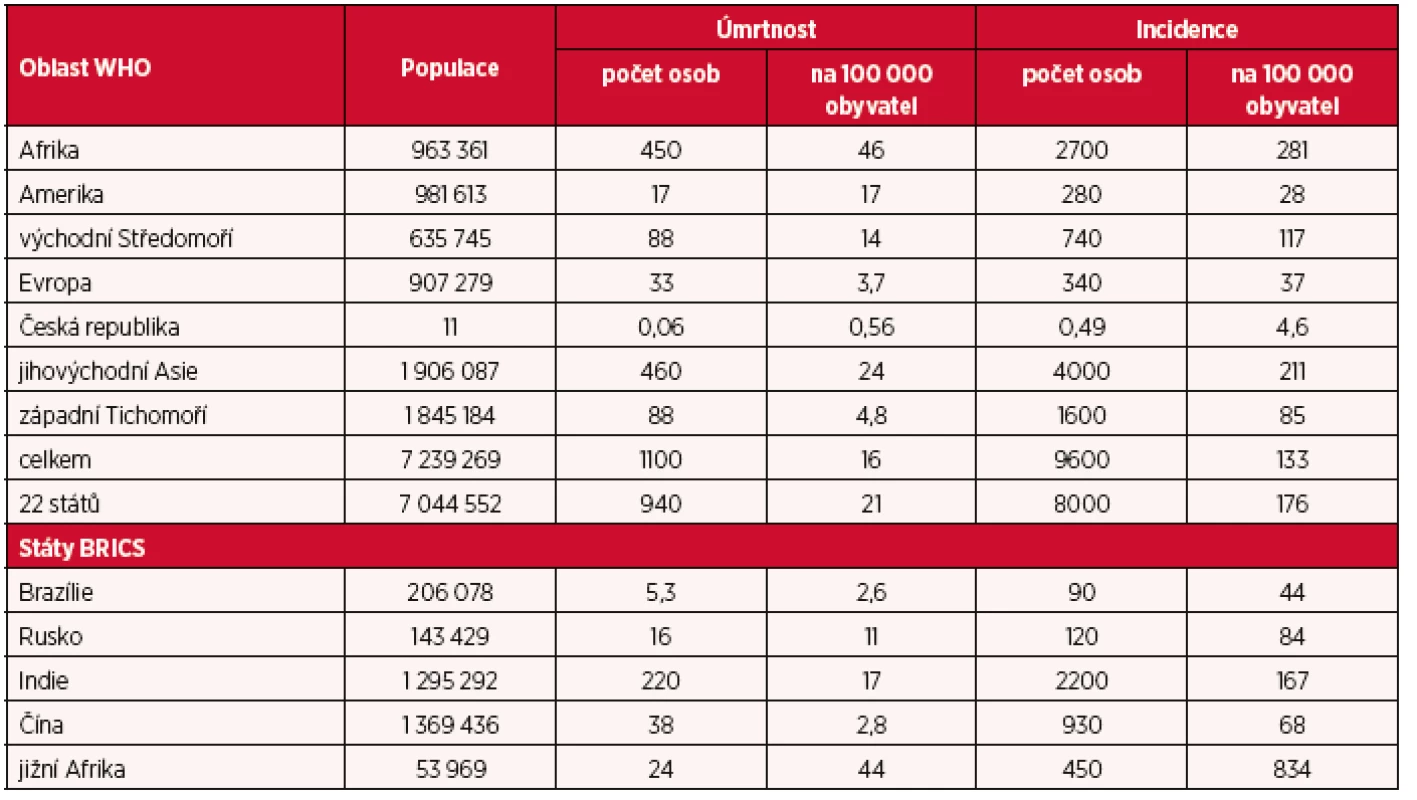
GLOBÁLNÍ ELIMINACE TBC
Strategický plán End the Global Tuberculosis Epidemics s cílem dosáhnout snížení incidence na jeden případ TBC na milion světové populace v roce 2050 byl vyhlášen na valném shromáždění WHO v květnu 2014 (5, 7). Plánovaný vývoj má být sledován mezičasech let 2025 a 2035, kdy bude stále ještě záležet nejen na implementaci současných metod kontroly TBC, ale také na příznivém vývoji socioekonomické situace ve státech s nejvyšší zátěží TBC ve světě. Snížení globální incidence TBC na současnou úroveň dosahovanou zatím jen v USA a v některých evropských státech (100 případů TBC na jeden milion populace) bude však vyžadovat zásadní obrat v dosavadní metodice kontroly TBC, především zavedení nových metodických postupů. V zemích s nízkou incidencí, tj. méně než deset nových případů na 100 000 obyvatel mají být definovány populační skupiny se zvýšeným rizikem onemocnění TBC. Jde zejména o jedince v kontaktu s aktivní TBC, migranty, infikované HIV a nemocné s TBC rezistentní na antituberkulotika. Česká republika se s hodnotou incidence 9,9 nových případů TBC na 100 000 obyvatel zařadila do skupiny států s nízkou incidencí TBC v roce 2005.
Splnění plánu globální eliminace TBC bude vyžadovat zásadní obrat v dosavadní metodice kontroly TBC a využití výsledků výzkumných úkolů, jejichž řešení je již dnes (2016) převážně ve stadiu ověřovacích studií. Jejich tematika je cílena na vývoj a implementaci tří hlavních oblasti nových metod a technologií:
- krátkodobé, účinné a dobře tolerované léčebné režimy všech forem TBC včetně latentní a lékově rezistentní TBC
- zavedení nových specifických testů k diagnostice lékové rezistence použitelných v místě vyšetření nemocného
- vývoj vakcíny k prevenci primoinfekce, postprimární progrese a aktivizace latentní TBC
Na úseku nových diagnostických technik jsou již v praxi ověřovány metody POCT (Point of Care Tests) rychlé metody průkazu Mycobacteria tuberculosis a stanovení lékové citlivosti, které mohou být používány i v ambulantních nebo ústavních zařízeních. Tyto techniky jsou založeny na amplifikaci a detekci specifických sekvencí mykobakteriálního genomu a výsledky vyšetření jsou signalizovány již po 20 minutách. V gesci WHO je také průkaz specifického antigenu TB LAM (lipoarabinomannan) v moči nemocných při komorbiditě TBC a HIV. WHO také svolala panel odborníků k řešení prediktivní diagnostiky přechodu klidové formy latentní TBC do fáze manifestní aktivizace. Dosud používané kožní tuberkulinové testy a testy uvolňování gamma-interferonu (Interferon-gamma Release Assays, IGRA) vyhovují pro průkaz TBC infekce, nedokážou však hodnotit aktivizaci primoinfektů nebo posttuberkulózních zbytkových lézí.
Příprava nových antituberkulotik a léčebných režimů předpokládá jejich uplatnění zejména při terapii multirezistentních forem TBC a při prevenci aktivizace inaparentní latentní TBC. Stálým problémem výzkumu je také požadavek zkrácení doby podávání antituberkulotik při standardní kombinované chemoterapii čerstvých nálezů, kde výpadky v zásobování léků a kde předčasné ukončování nebo přerušování léčby jsou nejčastějšími zdroji vzniku lékové rezistence. Ve fázi klinického ověřování léčby multirezistentní TBC je Bedaquilin (diargylchinolon) k použití v kombinaci se standardními režimy léčby multirezistentní TBC nebo v kombinaci s preparáty s nitroimidazoly Delamanidem nebo Pretomanidem. Preparáty třetí generace fluorochinolonů (gatifloxacin a moxifloxacin) byly ověřovány jako náhrada za etambutol nebo isoniazid ve standardních režimech při léčbě čerstvých forem TBC, nebyly však doporučeny do praxe pro vyšší riziko vzniku recidiv. Ve stadiu klinických pokusů je také ověřování nových kombinovaných režimů. Např. kombinace maxifloxacib-pretomanid-pyrazinamid po dvouměsíčním podávání ukázala u nemocných s lékově citlivou TBC příznivější výsledky než standardní čtyřkombinace isoniazid-rifampicin-pyrazinamid-etambutol. Současný přístup k léčbě latentní TBC cílen především na nemocné v imunosupresi při HIV pozitivitě, kdy se podává isoniazid současně s antiretrovirovou terapií.
Zavedení preventivní vakcinace u adolescentů a dospělých by mělo přímý vliv na snižování incidence TBC v těchto věkových skupinách, a tím by bylo dosaženo také snížení počtu potenciálních zdrojů infekce pro vnímavou populaci dětí a mladistvých. Tento nový element v kontrole TBC by byl vysoce přínosný i ekonomicky, neboť náklady na vakcinaci by představovaly jen asi 1 % výdajů potřebných pro diagnostiku a léčbu manifestních forem TBC. Dalším zadáním pro novou generaci vakcín je možnost jejich použití u jedinců již infikovaných, především u latentních forem TBC, kde by měly zabránit aktivizaci dosud klidných ložisek.
V různém stadiu ověřování v pilotních studiích je již celkem osm z celkového počtu 15 kandidátních vakcín připravovaných známými (Glaxo, SSI Copenhagen, Sanofi Pasteur) i méně známými producenty. V poslední fázi ověřování účinnosti je již vakcína připravovaná z lyzátu Mycobacteria vaccae, testovaná na 10 000 tuberkulin pozitivních osob, která má za cíl zkrácení léčebných režimů u lékově citlivých nemocných a zabránění aktivizace latentních forem TBC. Další testované produkty jsou rekombinantní subjednotkové vakcíny obsahující specifické antigeny Mycobacteria tuberculosis a 100 adjuvancia a rekombinantní vakcína odvozená od BCG s vloženým genem listerolysinu Listeria monocytoges. Jedinou plně životnou vakcínou v této skupině očkovacích látek byla připravena z Mycobacteria tuberculosis atenuovaného deplecí genů phoP a fadD26.
Latentní tuberkulózní infekce (LTBC) se stane kritickým faktorem TBC ve finální fázi globální kontroly TBC po roce 2035, kdy se předpokládá podstatné snížení incidence klinicky významných forem TBC šířených přímým přenosem mezi zdrojem infekce a zdravou populací. Její diagnostika se opírá již po dobu více než 100 let o pozitivní odpověď na tuberkulin u asymptomatických jedinců, u nichž nelze prokázat známky aktivity orgánových primárních infektů. Připomeňme objevitelské studie LTBC českého vojenského lékaře a pozdějšího generála a profesora pražské lékařské fakulty MUDr. Karla Franze (1864–1933), které prováděl v letech 1901–1902. V souboru 723 vyšetřených vojáků-nováčků z Bosny a Hercegoviny zjistil febrilní reakci u 465 (64,6 %) jedinců jako odpověď na podkožní injekci Starého Tuberkulinu. Během další tříleté prezenční služby došlo v tomto souboru k aktivizaci TBC procesu v 39 (8,4 %) případech a z nich 18 (3,9 %) na TBC zemřelo. Franz poukázal také na geografické rozdíly v incidenci LTBC když v kontrolní skupině vojáků-nováčků z východního Maďarska prokázal LTBC jen ve 2,5 % vyšetřených jedinců. V průběhu let byl podkožní tuberkulinový test nahrazen perkutánní a intrakutánní aplikací tuberkulinu (Pirquet 1907, Mantoux 1908) a Kochův Starý Tuberkulin byl nahrazen proteinovou frakcí získanou z metabolitů Mycobacteria tuberculosis (Purified Protein Derivative, PPD, Seibert 1937). Novým imunodiagnostickým prostředkem se pak staly testy uvolňování gamma-interferonu (Interferon-gamma Release Assays – IGRA).
Podle výsledků studií odvozených od výsledků tuberkulinace dětí školního věku, resp. od hodnot incidence klinicky závažných forem TBC bylo odhadnuto, že v roce 1999 byla téměř jedna třetina světové populace, tj. asi 2,3 miliardy jedinců, infikována Mycobacteria tuberculosis. Spolehlivost tohoto odhadu je však limitována jednak metodickými problémy provádění a hodnocení tuberkulinových testů a zejména pak nespecifickou senzibilizací vyšetřované populace environmentální mykobakteriální mikroflórou a předchozí BCG vakcinací. Také spolehlivost tzv. Stýblova pravidla, tj. předpokladu, že každý nemocný s klinicky závažnou formou TBC dýchacího ústrojí je zdrojem infekce po dobu 2 let pro deset exponovaných jedinců ročně, je ovlivňována řadou faktorů, např. dobou zahájení léčby a její úspěšností, hustotou populace, výskytem HIV infekce, přítomností lékové rezistence apod. Také genová výbava Mycobacteria tuberculosis vykazuje vývojovou variabilitu a různé mykobakteriální populace mohou vykazovat různé stupně virulence a imunogenity a v důsledku migračních pohybů populace se mohou šířit do různých geografických oblastí. Stanovení přesnějšího odhadu prevalence TBC infekce v populaci je proto velice obtížné a z vysokého počtu infikovaných jedinců nelze zatím spolehlivě vyčlenit osoby, u kterých dojde k aktivizaci dosud klidových TBC infektů.
Klíčovou úlohu v LTBC zaujímají perzistentní populace Mycobacteria tuberculosis, které přežívají ve fázi inaparentního asymptomatického průběhu infekce v primárních ložiscích, ze které mohou přejít do fáze plné replikační aktivity. Nekroptické nálezy i moderní zobrazovací techniky ukazují, že v orgánových infektech jedinců s LTBC je možné prokázat v průběhu doby jak známky progrese, tak i známky jejich následného hojení, které jsou důsledkem aktivizace perzistujících mykobakterií, nebo naopak jejich návratu do dormantní fáze. Předpokládá se také, že i v aktivních TBC ložiskách je přítomen určitý podíl mykobakterií, které mohou přejít z dormantního stavu do fáze plné replikační aktivity. Prevencí tohoto nepředvídatelného vývoje je nezbytnost dlouhodobého podávání antituberkulotik v léčbě aktivních TBC procesů a používání kombinovaných režimů s preparáty účinnými jak na plně replikující mykobakteriální subpopulace, tak i na perzistentní mykobakterie v dormantní fázi.
Novější poznatky LTBC ukazují, že v podmínkách nízké prevalence TBC dochází k aktivizaci dosud klidových forem LTBC nejčastěji v 1. roce od primoinfekce a v průběhu dalších 5–10 let se aktivita TBC procesu projeví asi u 12 % infikovaných. Riziko aktivizace LTBC je vysoké zejména u imigrantů z oblasti vysoké zátěže TBC a přetrvává po dobu 10 i více let od příchodu migrantů do hostitelské země. Zkušenosti z hromadného snímkování populace také ukázaly, že tzv. fibrózní léze jsou důsledkem asymptomatických subklinických epizod dočasné aktivace a následného návratu do klidové fáze LTBC. Tyto léze mohou v dalším vývoji přejít do plně rozvinutého obrazu floridní TBC a některé studie ukazují, že až 70 % jedinců s nově zjištěnou TBC mělo v anamnéze fibrózní léze na plicích.
Při přechodu LTBC do klinické formy aktivní TBC se uplatňují predispoziční faktory a stavy provázené imunosupresí, jako jsou zejména HIV, podvýživa, chronické postižení ledvin, diabetes aj., které mohou být vzájemně kombinovány. Věk infikovaného jedince je jedním z určujících faktorů vývoje a průběhu LTBC. Vysoké riziko vzniku aktivní TBC je u dětí do 2 let věku, ve věku 5–10 let je naopak riziko nízké a zvyšuje se pak u adolescentů a mladých jedinců v důsledku nastupujících imunoendokrinních procesů provázených změnami rovnováhy mezi prekurzory pohlavních hormonů a glukokortikoidy. Vyšší hodnoty notifikace TBC v jarních a letních měsících se vysvětlují karencí vitaminu D, který má protizánětlivý efekt a jehož syntéza v kůži je vlivem nedostatku slunečního záření v zimních měsících omezena. Na zvýšených hodnotách incidence TBC v jarních měsících a v létě se mohou podílet také prodělané respirační virové infekce, jak například ukázalo zvýšení incidence TBC po chřipkové pandemii v roce 1918. Progrese TBC infekce může být také hypoteticky ovlivňována genetickou variabilitou Mycobacteria tuberculosis, v různých mykobakteriálních populacích, které vykazují změněné biologické vlastnosti, např. zvýšenou virulencí nebo imunogenitu.
Současný přístup k léčbě LTBC je cílen na jedince s vysokým rizikem onemocnění, především na osoby v úzkém kontaktu s TBC zdrojem a nemocné v imunosupresi. V preventivním režimu se podává po dobu 6–9 měsíců isoniazid, v kombinaci s rifampicinem nebo rifapentinem se léčba zkracuje na 3 měsíce. V této kombinaci se využívá vysokého sterilizačního účinku obou léků rifamycinové řady, který může být navíc ještě potencován pyrazinamidem (jeho použití je však omezeno jeho toxicitou a vedlejšími účinky); úloha isoniazidu je zde zanedbatelná, neboť působí na plně životné mykobakteriální populace, ne však na jejich dormantní formy Pro pacienty podstupující transplantaci orgánů nebo hematopoetických a kmenových buněk byl vypracován postup diagnostiky a léčby TBC a LTBC, podle kterého je u indikovaných jedinců doporučena devítiměsíční monoterapie isoniazidem, podávání rifampicinu, eventuálně v kombinaci s isoniazidem po dobu 4, resp. 3 měsíců, případně léčba fluorochinolony (4). V blízké budoucnosti by se mohla v preventivní terapii LTBC uplatnit nová antituberkulotika, jako např. Bedaqualin, Sutezolid, moxifloxacin, nebo deriváty imidazolu. Hlavním problémem preventivní léčby LTBC je však rozhodnutí, u kterých asymtomatických a klinicky zdravých jedinců mají být dlouhodobě podávána antituberkulotika zatížená mnohdy toxicitou a vedlejšími účinky. Dalším dosud nevyřešeným problémem zůstává kontrola účinnosti této léčby, kde se rýsují možnosti využití biomarkerů, např. testu18-F fluorodeoxyglukózy, kterým se při léčbě antituberkulotiky prokazuje zvýšená metabolická aktivita neutrofilů a makrofágů.
Zcela novým přístupem k prevenci aktivace LTBC jsou zatím pokusné studie vakcinace infikovaných asymptomatických jedinců aplikované v průběhu léčby antituberkulotiky. Dosavadní výsledky však nejsou uspokojivé a svědčí o nedostatečných znalostech imunologických mechanismů, které provázejí aktivizaci dosud klidových forem LTBC. Vážným nebezpečím vakcinace je pak nebezpečí vzniku Kochova fenoménu, který může vyvolat nekontrolovanou imunopatologickou reakci v dosud klidných TBC infektech a jejich následnou progresi.
ZÁVĚR
Historickým úspěchem globální kontroly TBC se stalo snížení rozsahu celosvětové pandemie TBC a zastavení dosavadního vzestupného trendu mortality a incidence, kterého bylo dosaženo v roce 2014. V návazném programu koordinovaném Světovou zdravotnickou organizací má být dosaženo eliminace TBC jako celosvětového zdravotnického problému do roku 2050, kdy se má snížit incidence TBC na méně než jeden případ onemocnění na 100 000 světové populace. Do roku 2035, kdy budou uplatňovány převážně ještě současné metody kontroly TBC, bude záležet především na úspěchu kontrolních opatření ve státech s nejvyšší zátěží TBC, které se podílejí na globálních hodnotách mortality a incidence ve více než 80 %. Ve státech s nízkou incidencí TBC budou kontrolní programy cíleny především na populační skupiny s vysokým rizikem infekce TBC, tj. zejména na osoby v kontaktu s TBC, migranty a jedince infikované HIV. Po roce 2035 se předpokládá využití nových metodik rychlé diagnostiky TBC, zavedení nových léků a krátkodobých léčebných režimů a uplatnění nových typů vakcín k ochraně vnímavé populace. Latentní tuberkulózní infekce se stane kritickým faktorem globální kontroly TBC, neboť vysoké počty inaparentně infikovaných jedinců s nejistou předpovědí reaktivace primárních infektů budou představovat riziko dalšího přetrvávání TBC v populaci.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
MUDr. Milan Kubín, DrSc.
Hygienická stanice hlavního města Prahy
Rytířská 12,
100 01 Praha 1
e-mail: milankubin27@gmail.com
Zdroje
1. Esmail H, Barry CE, Young DB, Wilkinson RJ. The ongoing challenge of latent tuberculosis. Phil Trans R Soc B 2013; 369 : 0437.
2. Kubín M. Depistáž latentní tuberkulózy u vojáků rakousko-uherské armády v letech 1901–1902. Průkopnické studie generála profesora MUDr. Karla France (1864–1933). Kazuistiky Alerg Pneumol 2015; 12 : 44–47.
3. Trnka L. Doporučení Světové zdravotnické organizace pro země s nízkou incidencí TB k eliminaci tuberkulózy jako problému veřejného zdravotnictví. Stud Pneumol Phtiseol 2015; 75 : 73–74.
4. Vašáková M, Polcová V, Valentová-Bartáková L, Kopecká E. Doporučený postup diagnostiky a léčby tuberkulózy a latentní tuberkulózní infekce u pacientů před a po transplantaci solidních orgánů či hematopoetických kmenových buněk. Stud Pneumol Phtiseol 2015; 75 : 58–61.
5. Wallenfels J. Dočkáme se eliminace tuberkulózy? Stud Pneumol Phtiseol 2015; 75 : 17.
6. World Health Organization: Global Tuberculosis Report 2015. 20th Edition. Geneva 2016.
7. World Health Organization: The Stop Tuberculosis Strategy. Geneva 2006.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Intervence ergoterapeuta u osob s neurogenní dysfagií
- Výzkum názorů a postojů občanů České republiky k všeobecným praktickým lékařům
- Chorý s demenciou Alzheimerovho typu v kontexte rodinnej starostlivosti
- Incidence invalidity pro onemocnění diabetem
- Onkologicky nemocný diabetik v paliativní hospicové péči
- Nová strategie globální kontroly tuberkulózy/The End TB Strategy
- Profesor chirurgie Zdeněk Vahala
- Odhalenie pamätnej tabule Franzovi Kafkovi
- Péče o psychiku onkologicky nemocných
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Incidence invalidity pro onemocnění diabetem
- Intervence ergoterapeuta u osob s neurogenní dysfagií
- Profesor chirurgie Zdeněk Vahala
- Chorý s demenciou Alzheimerovho typu v kontexte rodinnej starostlivosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



