-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi
Sentinel Lymph Node Biopsy in the Breast Carcinoma in Clinical Practice
Aim:
In the management of early breast carcinoma, biopsy of sentinel lymph nodes has gradually replaced dissection of Level I and II axillary nodes. The aim of the study is to assess feasability and reliability of the method in our conditions.Method:
From June 1998 to June 2007, a total of 458 sentinel node biopsies (SLNB) were performed. Originally, patent blue sentinel node mapping was used. Since 2000, a combination of radiocolloid application and a gamma - probe (detector), as well as the patent blue, has been used. Originally, SLNBs were followed by axillary dissections, however, in 2002, the procedure was waived in cases of negative sentinel nodes findings.Results:
Out of the total of 458 SLNB patients, 382 female patients were included in the study. SLNB, without concomitant axillary dissection, was performed in 170 subjects. In 70 subjects, the sentinel node was positive and they were indicated for axillary dissections. Positive non-sentinel nodes were detected 17 times. In total, 899 sentinel nodes were examined in the study group of 382 biopsies. The mean was 2.35. False negative nodes were recorded in three cases in female patients with SLNB and axillary dissection (4.6%). No local relapses in the axilla were recorded in negative sentinel node findings without subsequent axillary dissections.Conclusion:
Sentinel node biopsy is a safe alternative to axillary dissection in the surgical management of early breast carcinoma.Key words:
breast carcinoma – sentinel lymph node – axillary dissection
Autori: J. Gatěk 1
; L. Hnátek 1; B. Dudešek 1; P. Vážan 3; J. Bakala 2; K. Hradská 1; J. Kotoč 1; T. Musil 1; J. Duben 1
Pôsobisko autorov: Chirurgické oddělení Nemocnice Atlas a. s. Zlín, Univerzita Tomáše Bati ve Zlíně, vedoucí: prim. MUDr. J. Gatěk Ph. D. 1; Oddělení nukleární medicíny Krajská nemocnice Tomáše Bati a. s. Zlín, vedoucí: prim. MUDr. J. Bakala 2; Bioptická a cytologická laboratoř Zlín, vedoucí: MUDr. J. Velecký 3
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 4, s. 180-185.
Kategória: Monotematický speciál - Původní práce
Súhrn
Cíl:
V chirurgickém léčení časného karcinomu prsu biopsie sentinelové uzliny postupně nahradila disekci axilárních uzlin I. a II. etáže. Cílem studie je ověřit proveditelnost a spolehlivost metody v našich podmínkách.Metoda:
V období od června 1998 do června 2007 bylo provedeno 458 biopsií sentinelové uzliny (SLNB). Ke značení uzlin byla nejdříve použita Patentblue a od roku 2000 kombinace radiokoloidu s gama sondou a Patentblue. Po SLNB následovala vždy disekce axily, od které bylo upuštěno u negativních sentinelových uzlin v roce 2002.Výsledky:
Z celkového počtu 458 SLNB bylo do souboru zařazeno 382 pacientek. Pouze SLNB bez současné disekce axily byla provedena 170x. V 70 případech byla sentinelová uzlina pozitivní a následovala disekce axily. Non-sentinelové uzliny byly pozitivní 17x. Celkem bylo v základním souboru 382 biopsií vyšetřeno 899 sentinelových uzlin. Průměr byl 2,35. Falešně negativní uzliny byly zaznamenány u pacientek se SLNB a následnou disekcí axily 3x (4,6 %.) Nebyla registrována lokální recidiva v axile u negativní sentinelové uzliny bez následné disekce axily.Závěr:
Biopsie sentinelové uzliny je bezpečná alternativa axilární disekce v chirurgické léčbě časného karcinomu prsu.Klíčová slova:
karcinom prsu – sentinelová uzlina – axilární disekceÚVOD
Novodobou historii sentinelové uzliny otevřel Cabanas, když prezentoval v roce 1977 výsledky vyšetření 100 pacientů, u kterých provedl lymfografii dorzálních lymfatik penisu. Prokázal existenci uzliny, ve které se zachytí primární metastázy. Myšlenku sentinelové uzliny dále rozvedl Morton u maligního melanomu [1]. V roce 1993 Krag zavedl techniku sentinelové uzliny do chirurgické terapie karcinomu prsu. Sentinelové uzliny značil radiokoloidem a identifikoval pomocí gama sondy [2]. O další rozvoj a popularizaci metody se výrazně zasadil Armando Giuliano a jeho tým [3]. K identifikaci uzliny používal modrou barvu. Následovalo mnoho dalších studií po celém světě, které ověřovaly a potvrzovaly platnost metodiky v klinické praxi [4, 5].
Sentinelová uzlina se postupně stala alternativou disekce axilámích uzlin I. a II. etáže, což byl dosavadní standard v léčbě invazivního karcinomu prsu v oblasti axily. Metoda přináší stejné informace a výsledky, avšak není provázena průvodními komplikacemi jako axilární disekce [6]. SLNB byla proto velmi rychle a široce přijata do klinické praxe. Americká studie B-32, která je zaměřena na srovnání SLNB s disekcí axily ještě není uzavřena, avšak další méně rozsáhlé studie potvrzují, že se jedná o postup přinášející stejný efekt, se srovnatelnými lokálními recidivami a stejným vlivem na celkové přežití jako axilární disekce [7].
Mohutný rozvoj metody přinášel také různé postupy a zkušenosti, což vyvolalo potřebu jejich zhodnocení a stanovení nejvhodnější metodiky. Třicet zástupců všech oborů, které spojila diagnostika a léčení karcinomu prsu, a kteří měli největší zkušenosti s biopsií sentinelové uzliny, vytvořilo panel na konferenci ve Philadelphii v dubnu 2001. Závěry panelové diskuse byly formulovány a vyjadřují současný stupeň znalostí v této problematice [8]. Uvedené závěry jsou využívány v denní praxi chirurgických týmů a staly se také základem mnoha guidelines např. německé senologické společnosti [9].
Výzkum se v současné době zaměřuje na nalezení kritérií, kdy by mohla být metoda využita u dalších skupin pacientek a mohlo by tak být upuštěno od disekce axily (neoadjuvantní terapie, nález mikrometastáz a submikrometastáz v sentinelové uzlině, pacientky s pouze pozitivní sentinelovou uzlinou a negativními non-sentinelovými uzlinami) [10, 11, 12]. Cílem naší studie bylo ověřit platnost metody v klinické praxi v našich podmínkách.
METODA
Na chirurgickém oddělení nemocnice Atlas ve Zlíně byla biopsie sentinelové uzliny poprvé použita v roce 1998. Patentblue byla nejprve aplikována peritumorálně a později byla kombinována peritumorální a subdermální aplikace. Od roku 2000 byl aplikován radiocolloid 99mTc Nanocoll Nycomed Amersham v kombinaci s Patentblue. K vlastní identifikaci sentinelových uzlin byl používán přístroj C-Trak, Care Wise Medical Product, Morgan Hill s gama sondou. Nanocoll byl podáván v dávce od 50 do 200 MBq. Byl monitorován vztah mezi dávkou Nanocollu, počtem impulzů v tumoru, sentinelových uzlinách a v oblasti axily po jejich odstranění. V současnosti je používána dávka 100 MBq. Polovina byla aplikována subdermálně a další peritumorálně. Byl používán dvoudenní protokol [13]. U všech pacientů byl den před chirurgickým výkonem na oddělení nukleární medicíny aplikován radiokoloid a za 1 hodinu byla ve dvou projekcích provedena lymfoscintigrafie. Druhý den ráno následoval chirurgický výkon. Čas od aplikace radiokoloidu do výkonu byl v průměru 20 hodin. Bezprostředně před chirurgickým výkonem bylo aplikováno 2 ml Patentblue a prs byl 5–10 minut jemně masírován. Modré a aktivní uzliny byly odstraněny. Následovala disekce axily. Pokud se při lymfoscintigrafii zobrazily parasternální uzliny a následně byla potvrzena zvýšená aktivita gama sondou parasternálně, aktivní uzliny byly odstraněny. Od roku 2002 neprovádíme u negativních sentinelových uzlin disekci axily.
Sentinelové uzliny byly vyšetřovány nejprve sériovými řezy a barveny hematoxylinem&eozinem. Od roku 2001 bylo do protokolu zařazeno imunohistochemické vyšetření u negativních sentinelových uzlin. V současnosti jsou sentinelové uzliny rozřezány na plátky tloušťky 2–3 mm a peroperačně vyšetřeny metodou zmraženého řezu. Používáme standardní metodu peroperačního vyšetření, kdy ze zmraženého preparátu na mikrotomu odebereme 2–3 řezy tloušťky 5–10 mikro a obarvíme hematoxylinem-eozinem. Zpracování včetně odečtení obvykle provádíme v časovém intervalu 10–15 minut. Zbylé tkáňové vzorky jsou poté fixovány ve formaldehydu a zality do parafinu. Bloky uzlin s negativním peroperačním nálezem jsou následně vyšetřeny metodou permanentních sériových řezů po 50 mikro, barvených 1x hematoxylin eosinem a 2x imunohistochemicky s použitím protilátky proti cytokeratinům (AE1/AE3 DAKO). Kompletně jsou poté bloky dořezány v intervalu 150–200 mikro a barveny hematoxylin&eozinem.
VÝSLEDKY
Biopsie sentinelové uzliny s následnou disekcí axily byla prováděna nejprve u všech karcinomů prsu, aby došlo k důkladnému osvojení nové metody a posléze prováděna výběrově u časných karcinomů (T1, T2). V období od června 1998 do června 2007 bylo provedeno 458 biopsií sentinelové uzliny. Ze sledovaného souboru byly následně vyřazeny pacientky s multicentrickým karcinomem 13x, double karcinomem 10x a rozsáhlým karcinomem 6x. Pacientky po neoadjuvantní chemoterapii 47x byly zařazeny do samostatného souboru. Soubor zahrnuje 382 axilárních biopsií sentinelové uzliny. Biopsie parasternálních a současně axilárních uzlin byla provedena 16x. Průměrný věk pacientek byl 59 roků (max. 85, min. 25). Velikost nádorů dosáhla průměr 18 mm s mediánem 15 mm (max. 35, min. 5).
Nádory byly diagnostikovány pomocí core-cut biopsie 245x, FNA 24x, excizí 113x. Soubor zahrnoval tumory velikosti T1-2, výjimečně T3 (Tab. l). V současnosti dominuje předoperační diagnostice biopsie nádoru pomocí core-cut. FNA a excisionální biopsie je výjimečná. Histologická charakteristika nádorů: duktální 285x, karcinom in situ 28x, lobulární 19x, medulární 11x, ostatní 39x. Rozložení nádorů: HZQ 237x, DZQ 24x, HVQ 46x, DVQ 26x, centrálně 49x. Lehce převažoval karcinom levého prsu 208x, vpravo 174x.
Tab. 1. Velikost nádoru Tab. 1. Tumor size 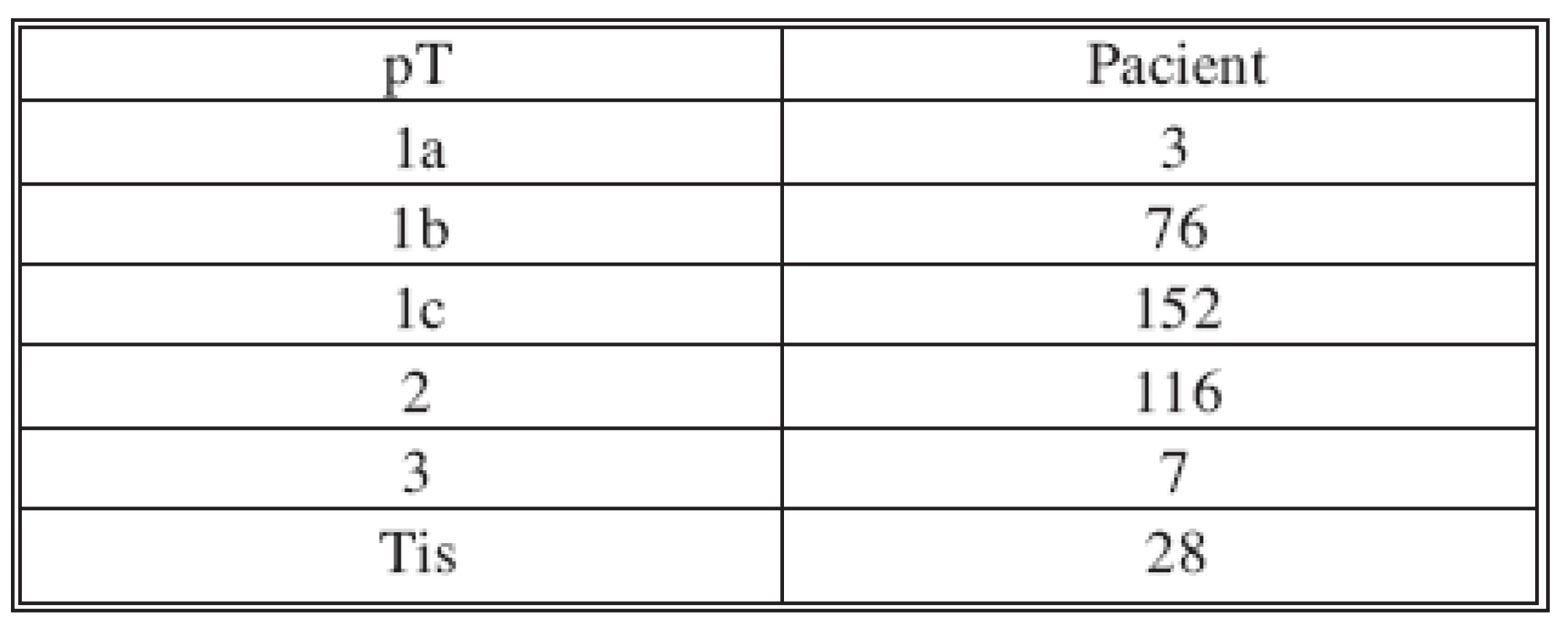
SLNB bez současné disekce axily byla provedena 170x z celkového počtu 382. V 70 případech byla sentinelová uzlina pozitivní a proto následovala disekce axily v druhé době. Non-sentinelové uzliny byly pozitivní 17x (Tab. 2 a 3). V souboru 382 SLNB bylo celkem vyšetřeno 899 sentinelových uzlin. Průměr 2,35. Medián 2 (max. 5, min. 1). Negativní sentinelové uzliny byly 235x a pozitivní 147x, to je 62 %. Procento pozitivních sentinelových uzlin narůstalo s velikostí nádoru (Tab. 4). Z chirurgických výkonů na prsu výrazně převažovaly konzervativní výkony (Tab. 5). Falešně negativní sentinelové uzliny byly registrovány 3x u SLNB se současnou disekci axily, což představuje 4,6 %. Výsledek je tvořen podílem falešně negativních uzlin a pozitivních axilárních uzlin. Dvě falešně negativní uzliny jsme zaznamenali v souboru s neoadjuvancí. Nepozorovali jsme lokální recidivu v axile u negativní sentinelové uzliny bez následné disekce axily.
Tab. 2. Stav uzlin Tab. 2. Condition of the nodes 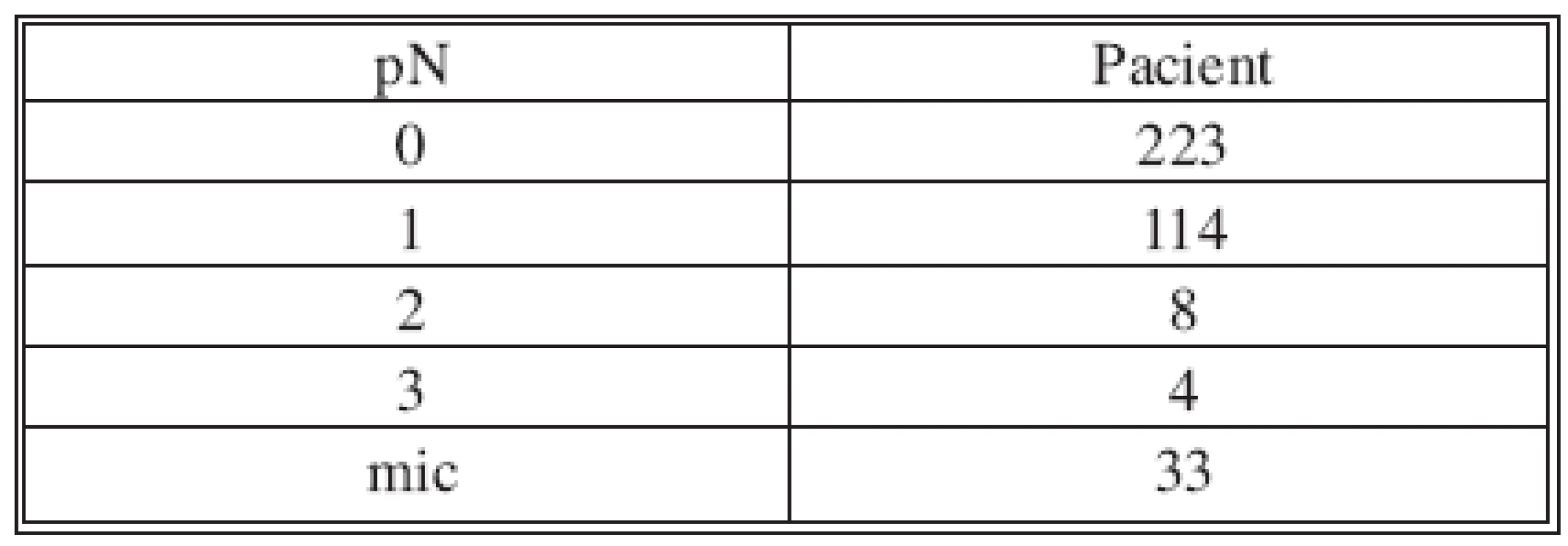
pM – 0 ve všech případech Tab. 4. Velikost nádoru/pozitivní uzliny Tab. 4. Tumor size/positive nodes 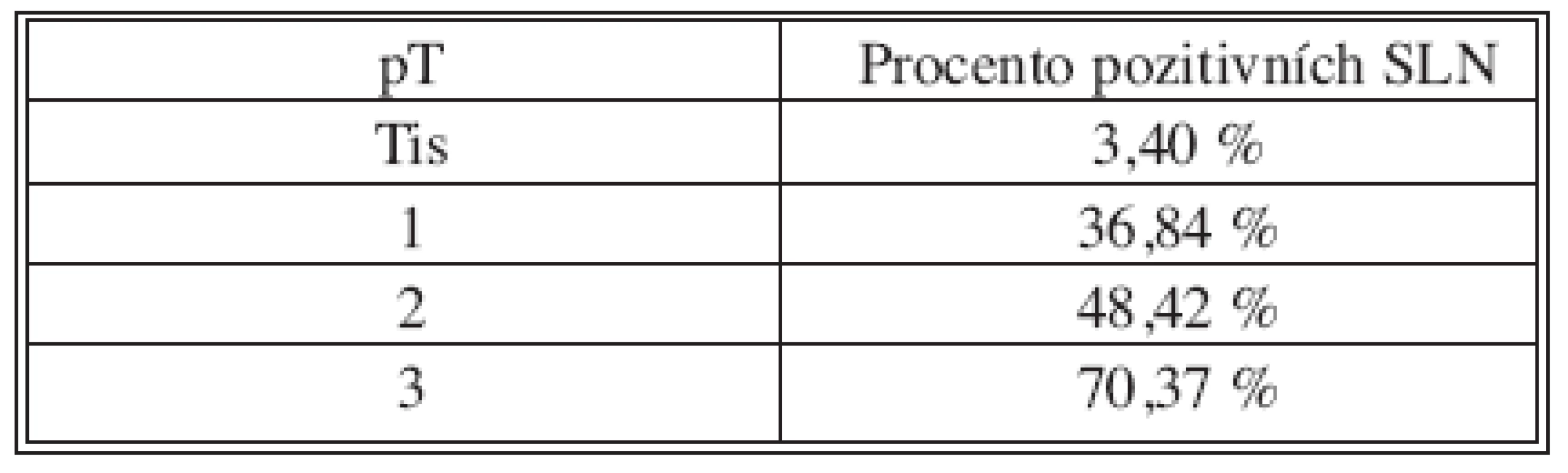
Tab. 5. Chirurgický výkon Tab. 5. Surgical procedure 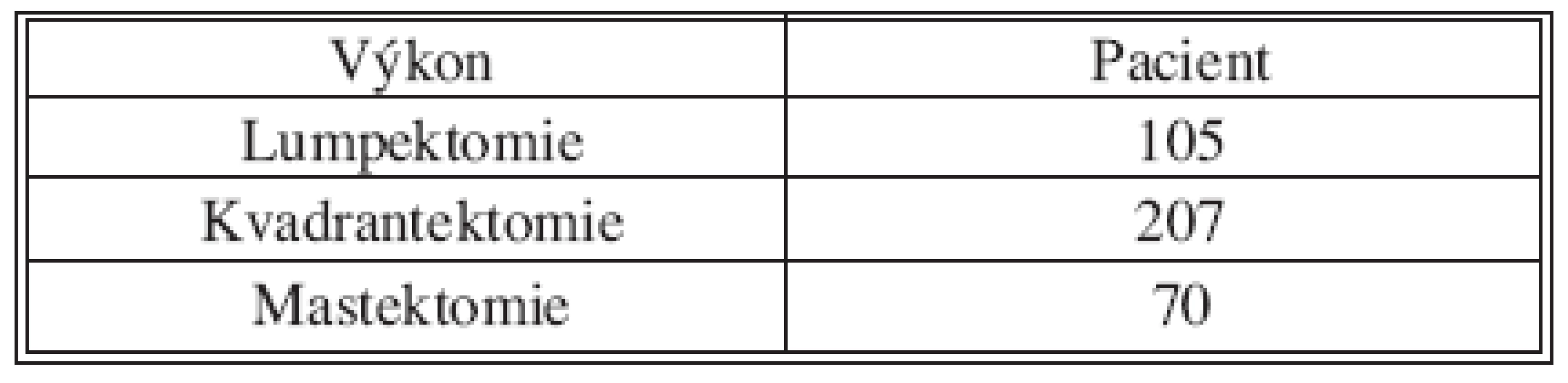
Maximální počet značení (343 pacientek) byl proveden oběma způsoby. Značení pouze pomocí Patentblue bylo použito 38x a to v úvodní fázi, kdy jsme neměli gama sondu. Jen radiokoloid s gama sondou byl použit 1x.
DISKUSE
Současné trendy v onkologii a onkochirurgii směřují k postupům, které respektují rozsah onemocnění, a které také zajišťují maximální účinnost léčby s minimálním dopadem na kvalitu života pacientů. Tyto zásady bezvýhradně splňuje SLNB v chirurgické léčbě časného karcinomu prsu. Metoda se proto velmi rychle rozšířila a stala se vyhledávaným postupem mezi chirurgy i pacienty. U pacientů s klinicky negativními axilárními uzlinami postupně nahradila axilární disekci uzlin I. a II. etáže, protože disekce axilárních uzlin je spojena s častými komplikacemi, z nich např. lymfedém výrazně a trvale omezuje pacientky v běžném životě [14,15].
Screeningové mammografické programy ve vyspělých zemích i u nás posouvají záchyt nádorů do nižších stadií, a protože byl opakovaně prokázán vztah mezi velikostí nádoru a rizikem šíření metastáz do axily, existuje zde významně menší riziko výskytu metastáz v axile [16]. Disekci axily je přisuzován jen malý léčebný efekt. Hlavní smysl spočívá ve stanovení prognózy onemocnění a lokoregionální kontrole, proto význam disekce axily klesá zvláště u časných nádorů. Další terapie se stále více odvíjí od nálezů vycházejících z primárního tumoru [17]. Tento fakt potvrzuje i náš soubor.
V současné době probíhá několik studií, které by měly definitivně rozptýlit veškeré pochybnosti o přesnosti metody. Největší a randomizovaná studie NSABP B-32 srovnává skupinu pacientek s provedenou SLNB a následnou disekcí axily, se skupinou, kde byla jen provedena SLNB a disekce uzlin jen v případě pozitivního nálezu. Studie by měla prokázat srovnatelné množství lokálních recidiv v axile a žádný rozdíl v délce přežití. [18] Již dnes jsou však publikovány práce, které referují o srovnatelném množství lokálních recidiv v axile po negativní sentinelové uzlině bez následné disekce axily. Studie prezentují dokonce menší počet lokálních recidiv v axile než po klasické disekci, což vysvětlují radioterapií, která je aplikována na prs při konzervativním výkonu a zachycuje dolní část axily. Nelze vyloučit i současný účinek chemoterapie, tam kde byla aplikována [19, 20, 21, 22]. My jsme lokální recidivu v axile po pouhé biopsii sentinelové uzliny nezaznamenali.
Hlavní výhrady vůči metodě jsou směřovány na existenci falešně negativních sentinelových uzlin. Falešně negativní uzlina je nejobávanější komplikací této metody. Jde o uzlinu, která je označena jako sentinelová, neobsahuje metastázy, je hodnocena jako negativní a v ostatních nonsentinelových uzlinách metastázy nalezneme. Procento falešně negativních uzlin se na každém pracovišti liší a může znevažovat používání metody. Přísné dodržování doporučených postupů a jemná operační technika by měly minimalizovat riziko identifikace falešně negativní uzliny na úroveň, která je srovnatelná s chybami při disekci axily [23].
Mimo operační techniku je v prevenci falešně negativní uzliny důležitá aplikace značící látky. Jsou popsány různé způsoby aplikace radiokoloidu a barvy (peritumorální, intratumorální, intradermální, subkutánní a subareolární). Při intradermální, subdermální, subareolární aplikaci dochází díky husté lymfatické síti ke zvýšenému vychytávání preparátu, což se projevuje zvýšenou úspěšností detekce sentinelových uzlin. Uzliny jsou více zbarveny a počet impulzů je vyšší. Metoda selhává prakticky výjimečně. Studie potvrzují stejné výsledky jako u peritumorální aplikace [24, 25, 26, 27, 28, 29, 30]. Největší zkušenosti a nejčastěji je používána peritumorální aplikace [8]. V našem souboru jsme použili všechny způsoby aplikace. Subareolární aplikaci jsme využili u centrálně lokalizovaných nádorů. Potvrzujeme zvýšenou resorpci preparátů v uzlinách při intradermální, subkutánní a sub - areolární aplikaci a z toho vyplývající snadnější identifikaci uzlin. V současnosti aplikujeme polovinu dávky peritumorálně a polovinu subdermálně nad tumorem. U nehmatných malých tumorů jsou značící preparáty aplikovány pod sonografickou kontrolou.
Postavení samotné lymfoscintigrafie a její nezbytnost v diagnostickém procesuje diskutována. Lhostejnější postoj k nutnosti provádět lymfoscintigrafii je na pracovištích ve Spojených státech amerických než v Evropě [8, 31, 32]. Kritiky je zdůrazňováno, že úspěšnost detekce uzlin není lymfoscintigrafii ovlivněna, a že stačí pouze detekce uzlin gama sondou během operačního výkonu. Je také potvrzeno, že negativní lymfoscintigrafie ještě neznamená, že uzliny nebudou při chirurgickém výkonu detekovány. Uvedený fakt snižuje její význam na některých pracovištích [32]. Převažují však opačné názory. Lymfoscintigrafie pomáhá chirurgovi přesněji identifikovat uzliny a zvláště extraaxilární uzliny [33, 34]. My se přikláníme k názoru, že lymfoscintigrafie usnadňuje provedení biopsie. Shlédnutí lymfoscintigrafických scanů nám biopsii usnadňovalo a považujeme ji za přínosnou. Nezaznamenali jsme tak vysoký podíl extraaxilárních „hot spot“ uzlin, jak je uváděno v literatuře [35].
Existuje velká skupina pacientek, u kterých byla pozitivní pouze sentinelová uzlina a následná disekce axily pozitivní uzliny již neprokázala. Skupina se zvětšuje, což způsobuje zvýšená citlivost patologicko-anatomického vyšetření uzlin, při kterém jsou zachyceny i jednotlivé buňky a vyšší podíl časných stadií. Přirozená je snaha i tyto pacientky ušetřit následného výkonu [36, 37]. V našem souboru tvoří pacientky, které měly postiženy pouze sentinelové uzliny 32 %. Zásady, které by zaručovaly, že je možno bezpečně od disekce axily při pozitivní sentinelové uzlině upustit nebyly stanoveny. Imunohistochemické vyšetření zvýšilo i v našem souboru počet pozitivních uzlin, zvláště záchytem mikrometastáz a izolovaných maligních buněk. Protože imunohistochemické vyšetření jsme neprováděli u všech biopsií v prezentovaném souboru, bude podíl imunohistochemického vyšetření na zpřesnění diagnózy prezentován v samostatně.
Velkou předností sentinelové uzliny je možnost podrobného vyšetření exstirpovaných uzlin. Technika více řezů a zvláště imunohistochemické vyšetření výrazně zpřesňují diagnózu, což při rutinním vyšetření více uzlin není možné a to z technických i ekonomických důvodů. Podrobná vyšetření, která jsou prováděna u sentinelových uzlin nelze aplikovat na všechny uzliny po disekci axily [38, 39]. Mikrometastázy unikají při vyšetření většího množství uzlin, což prokázalo více studií [33, 40, 41]. Imunohistochemické vyšetření dále zvýšilo úspěšnost detekce mikrometastáz. Názor na postavení imunohistochemie v rutinním vyšetření sentinelových uzlin je však v současně době nejednotný. Výsledkem jsou rozpaky jak postupovat v případě pozitivních sentinelových uzlin na cytokeratin zvláště při nálezu jednotlivých buněk. Provádět nebo neprovádět disekci axily? Panelová diskuse na konferenci v Pensylvánii v dubnu 2002 se shodla, že imunohistochemické vyšetření by v současné době nemělo být považováno za standardní součást patologického anatomického vyšetření a za metastázy by se měly považovat jen ty, které jsou zjištěny imunohistochemicky a dodatečně identifikovány při hematoxylin&eozinovém vyšetření. Imunohistochemie může také pomocí v nejistých nálezech [8, 42, 43, 44]. RT-PCR je zatím vyhrazeno k výzkumu.
Výsledky dosavadních studií vykazují různou úspěšnost při detekci sentinelové uzliny, která se většinou pohybuje více než 90 %. Úspěšnost detekce narůstá se vzrůstající zkušeností chirurgického týmu. Počet selhání také ovlivňuje výběr metody značení a způsob aplikace Patentblue a radiokoloidu. Nejpřesnější výsledky jsou dosaženy při kombinaci obou metod. Základní metoda značení je radiokoloid a barva ji doplňuje [8, 34, 45, 46]. Cox uvádí zkušenosti ze souboru 700 pacientů. Úspěšnost detekce „blue dye“ byla 76 %, radiokoloidem 90,1 % a v kombinací obou metod dosáhla 95,0 % s jednou falešně negativní uzlinou [47].
Biopsie sentinelové uzliny je provázena minimálním množstvím komplikací, což zvyšuje popularitu výkonu a jistě podporuje rychlé šíření metody. Nejzávažnější komplikací je alergická reakce, která se vyskytuje asi v 1 %. Na tuto možnost je nutno pamatovat a být na ni připraven [48]. Obávaný pooperační lymfedém je výjimečný a není rozsáhlý. Ostatní komplikace, které provází disekci axily se objevují zřídka a nejsou závažné. My jsme zaznamenali jednu vážnou alergickou reakci, která však byla zvládnuta běžnými postupy bez následků.
Všeobecně respektovanou kontraindikací SLNB je chemoterapie a radioterapie, i když byly prezentovány práce, které prokázaly srovnatelné výsledky i po její aplikaci. U multicentrických nádorů není biopsie sentinelové uzliny doporučována a biopsie je ve stadiu ověřování. Dále není doporučena u rozsáhlých ran v axile a na prsu [8]. Biopsie a exstirpace neovlivňují výsledek SLNB [49]. Pokud jsou suspektní hmatné axilární uzliny je vhodné pomocí FNA potvrdit nebo vyloučit metastázu [50].
Selhání metody, tzn. že nebyla identifikována sentinelová uzlina a vyšší počet falešně negativních uzlin je výrazně častější v období, kdy se tým seznamuje s metodou. S délkou praxe se počty falešně negativních uzlin snižují a selhání metody ubývá. Rozsáhlé studie několika pracovišť sledovaly tyto trendy a snažily se upozornit na úskalí spojená se zavedením postupu do klinické chirurgické praxe [51, 52, 53, 54, 55, 56, 57]. Tafra referuje, že úspěšnost identifikace se výrazně zlepšila po provedení 10 biopsií, avšak procento falešně negativních uzlin se snížilo až po 30 výkonech [54]. Bass udává, že 90% úspěšnost detekce byla dosažena po 23 biopsiích a 95% až po 53 případech [47]. McMaster má podobné závěry s výrazným snížením falešně negativních uzlin po provedení 20 procedur. Všechny studie se shodují, že minimální počet je mezi 20 a 30 provedenými výkony. Naše zkušenosti jsou obdobné. Všechny falešně negativní uzliny se objevily v období učební dráhy. Měly pořadí 5. a 15. při použití pouze Patentblue a 2. při společné detekci pomocí Patentblue a radiokoloidu. Sami jsme registrovali větší jistotu a sebevědomí po 50 provedených biopsiích. SLNB do počtu 50 jsme hodnotili jako „learning curve“. Disekci axilárních uzlin, navazující na SLNB, jsme však prováděli dále až do roku 2002, kdy na mammologickém kongresu v Brně došlo ke konsenzu, že SLNB je alternativou axilární disekce u časných karcinomů.
Uvedené studie a zkušenosti předních světových chirurgů zabývajících se karcinomem prsu formovaly doporučení, která by měla být dodržena, než je disekce axilárních uzlin nahrazena jen biopsií sentinelové uzliny. Je opakovaně zdůrazněno, že biopsie sentinelové uzliny je procedura, která je postavena na úzké spolupráci celého týmu zahrnujícího chirurgy, sestry, pracovníky nukleární medicíny a patologa. Než je opuštěna disekce axily, mělo by být provedeno minimálně 20–30 biopsií, které jsou následovány exenterací axily. Úspěšnost biopsie by měla přesahovat 90 % a počet falešně negativních uzlin by měl být pod 5 % a to z případů, kdy axila je pozitivní [8]. Naše zkušenosti se 458 biopsiemi tyto zásady jednoznačně podporují. Biopsii sentinelové uzliny lze bezpečně provádět i na našich pracovištích [58, 59, 60, 61, 62, 63, 64].
Věnováno 90. výročí narození emeritního primáře MUDr. Alfréda Rathauzského.
MUDr. J. Gatěk, Ph.D.
Chirurgické oddělení nemocnice Atlas
Tř. T. Bati 5135
760 01 Zlín
e-mail: gatekj@nemocniceatlas.cz
Zdroje
1. Morton, D., Wen, D., Wong, J., Cagle, L., Storm, K., Foshyg, L., Cochran, A. Technical Details of Intraoperative Lymphatic Mapping for Early Stage Melanoma. Arch. Surg., 1992, 127, 292–299.
2. Krag, D., Weaver, D., Alex, J., et al. Surgical Resection and Radiolocalization of the Sentinel Lymph Node in Breast Cancer Using a Gamma Probe. Surg. Oncol., 1993, 2, 335–340.
3. Giulliano, A., Dale, P., Turner, R., Morton, D., et al. Improved Axillary Staging of Breast Cancer wiťh Sentinel Lymphadenectomy Ann. Surg., 1995, 222, 394–401.
4. Turner, R., Ollila, D., Krasne, D, Giuliano, A. Histopathologic Validation of the Sentinel Lymph node Hypothesis for Breast Carcinoma. Ann. Surg., 1997, 226, 271–278.
5. Veronesi, U., Paganeli, G., Galimberti, V., et al. Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet, 1997, 349, 1864–1867.
6. Naik, A., Fey, J., Cody, H. The risk of axillary relapse after sentinel lymph node biopsy for breast cancer is comparable with that of axillary lymph node dissection a follow up study of 4808 procedures. Ann. Surg., 2004, 240, 462–471.
7. Veronesi, U., Paganelli G., Viale, G., et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N. Engl. Med., 2003, 349, 546–553.
8. Schwartz, G., Giuliano, A., Veronesi, U., et al. Preceedings of the Consensus Conference on the Role of Sentinel Lymph Node Biopsy in Carcinoma of the Breast April 19-22, 2001 Philadelphia Pennsylvania. Cancer, 2002. 94. 2542–2551.
9. Kühn, Bembenek, A., Buchels, H., et al. Interdisciplinare abgestimmter Konsensus der deutschen Gesellschaft fur Senologie fur eine qualiätsgesicherte Anwendung in der klinischen Routine. Onkologe, 2003, 9, 1011–1016.
10. Zee, K., Manasseh, D., Bevilacquam, J. A nomogram for predicting the likelihood o additional nodal meastases in breast cancer patients with a positive sentinel node biopsy. Ann. Surg. Oncol., 2003, 10, 1140–1151.
11. Xing, Y., Foy, M., Cox, D., et al. Meta-analysis of sentinel lymph node biopsy after preoperative chemotherapy in patients with breast cancer. Br. J. Surg., 2006, 93, 539–546.
12. Houvenaeghel, G., Nos, C., Mignotte, H., et al. Micrometastases in Sentinel Lymph Node in a Multicentric Study: Predictive Factors of Nonsentinel Lymph Node Involvement -Groupe Des Chirurgiens De La Federation Des Centres De Lutte Contre Le Cancer. J. Clin. Oncol., 2006, 24, 1814–1822.
13. Yeung, H., Cody, H., Turlakow, A., et al. Lymphoscintigraphy and Sentinel Node Localization in Breast Cancer Patiens: A Comparison Bettwen 1-Day and 2-Day protocols. J. Nucl. Med., 2001, 42, 420–423.
14. Duff, M., Hill, A., Greal, G., Walsh, S., et al. Prospective evaluation of the morbidity of axillary clearence for breast cancer. Br. J. Surg., 2001, 88, 114–117.
15. Roses, D., Brooks, A., Hartus, M., Shapiro, R., Mintnick, J. Complications of Level I. and II. Axillary Dissection in the Treatment of Carcinoma of the Brest. Ann. Surg., 1999, 230, 194–201.
16. Silverstein, M., Skinner, K., Lomis, T. Predicting Axillary Nodal Positivity in 2282 Patients With Breast Carcinoma. World J. Surg., 2001, 25, 767–772.
17. Moore, M., Kinne, D. Axillary Lymphadenectomy: A Diagnostic and Therapeutic Procedure. J. Surg. Oncol., 1997, 66, 2–6.
18. Weaver, D., Krag, D., Manna, E. Detection of occult sentinel lymph node micrometastases by irnunohistochernistry in breast cancer an NSABP Protocol B-32 Quality assurance study. Cancer, 2006, 107, 661–667.
19. Roumen, R., Kuijt, G., Liem, I., Beek, M. Treatment of 100 patients with sentinel node-negative breast cancer without further axillary dissection. Br. J. Surg., 2002, 88, 1639–1643.
20. Guiliano, A., Haigh, P., Brennan, et al. Prospective Observational Study of Sentinel Lymphadenectomy Without Further Axillary Dissection in Patients With Sentinel Node – Negative Breast Cancer. J. Surg. Oncol., 2000, 18, 2553–2559.
21. Chun, M., Steinhoff, M., Cady, B. Clinical axillary recurrence in breast cancer patients after negative sentinel node biopsy. Am. J. Surg., 2002, 184, 310–314.
22. Chung, M., Steinhoff, M., Cady B. Clinical axillary reccurence in breast cancer patients after a negative sentinel node biopsy Am. J. Surg., 2002, 184, 310–314.
23. McMasters, K., Giuliano, A., Ross, M., Reintgen, D., Hunt, K., Byrd, D., Klimberk, S., Whitworth, P., Tafra, L., Edwards, M. Sentinel Lymph Node Biopsy for Breast Cancer-Not Yet the Standard of Care. N. Engl. J. Med., 1998, 339, 990–994.
24. Borgstein, P., Meijer, S., Pijpers, R., Diest, P. Functional Lymphatic Anatomy for Sentinel Node Biopsy in Breast Cancer. Ann. Surg., 2000, 232, 81–89.
25. Klimberg, S., Rubio, I., Henry, R., Cowan, Ch., Korourian, S. SubareolarVersus Peritumoral Injection for Location of the Sentinel Lymph Node. Ann. Surg., 1999, 229, 860–865.
26. Shen, P.,Glass, E., DiFironzo Dermal versus intraparenchmal Lymphoscintigraphy of the breast. Ann. Surg. Oncology, 2001, 8, 241–248.
27. Borgstein, P., Meijer, S, Pijpers, R. Intradermal blue dye to identify sentinel lymphnode in breast cancer. Lancet, 1997, 349, 1668–1669.
28. Smith, L., Cross, M., Klimberg, V. Subareolar Injection Is a Better Technique for Sentinel Lymph Node Biopsy. Am. J. Surg., 2000, 180, 434–438.
29. McMasters, K., Wong, S., Martin, R., et al. Dermal Injection of Radioactive Colloids Is Superior to Peritumoral Injection for Breast Cancer Sentinel Lymph Node Biopsy: Results of a Multiinstitutional Study. Ann. Surg., 2001, 233, 676–687.
30. Cody, H., Fey, J. Akhurst, T, et al. Complementary of Blue Dye and Isotope in Sentinel Node Localization for Breast Cancer: Univariate and Multivariate Analyslsis of 966 Procedures. Ann. Surg. Oncol., 2001, 8, 13–19.
31. Burak, W., Michael, J., Walker, J. Routine Preoperative Lymphoscintigraphy Is Not Necessary Prior to Sentinel Node Biopsy for Breast Cancer. Am. J. Surg., 1999, 177, 445–449.
32. McMasters, K., Wong, S., Tuttle, T., et al. Preoperative Lymphoscintigraphy for Breast Cancer Does Not Improve the Ability to Identify Axillary Sentinel Lymph Nodes. Ann. Surg., 2000, 231, 724–731.
33. Borgstein, P., Pijpers, R., Comans, E., et al. Sentinel Lymph Node Biopsy in Breast Cancer: Guidelines and Pitfalls of Lymphoscintigraphy and Gamma Probe Detection. J. Am. Coll. Surg., 1998, 186, 275–283.
34. Noguchi, M. Sentinel lymph node biopsy and breast cancer. Br. J. Surg., 2002, 89, 21–34.
35. Nieweg, O. Lymphatic of the breast and the rationale for different injection techniques Ann. Surgical. Oncol., 2001, 8, 71–73.
36. Nos, C., MacKean, C., Fréneaux, P., et al. Prediction of tumor involvement in remaining axillary lymph nodes when the sentinel node in a woman with breast cancer contains metastases. Br. J. Surg., 2003, 90, 1354–1360.
37. Schrenk, P., Konstantiniuk, P., Wolfi, S., et al. Prediction of non-sentinel lymph node status in breast cancer with a micromestatic sentinel node. Br. J. Surg., 2005, 92, 707–713.
38. Turner, R., Ollila, D., Stern, S., Giuliano, A. Optimal Histopatologic examination of the sentinel lymph node for breast carcinoma staging. Am. J. Surg. Patol., 1999, 2, 263–267.
39. Motomura, K., Komoike, Y., Inaji, H., et al. Multiple sectioning and immunohistochemical staining of sentinel nodes in patiens with breast cancer. Br. J. Surg., 2002, 89, 1032–1034.
40. Liang, W., Sickle-Santanello, B., Nims, T. Is a completion axillary dissection indicated for micrometastases in the sentinel lymph node? Am. J. Surg., 2001, 182, 365–368.
41. Wong, S., Chao, C., Edwards, M., Simpson, D., McMasters, K. The use of cytokeratin staining in sentinel node biopsy for breast cancer. Am. J. Surg., 2001, 182, 330–334.
42. Teng, S., Dupont, E., McCann, Ch., Wang, J., Bolano, M., Durand, K., Peltz, E., et al. Do Cytokeratin -Positive - Only Sentinel Lymph Nodes Warrant Complete Axillary Lymph Node Dissection in Patients With Invasive Breast Cancer? Am. Surg., 2000, 66, 574–578.
43. Jakub, J., Diaz, N., Ebert, M., et al. Completion axillary lymph node dissection minimizes the likelihood of false negatives for patients with invasive breast carcinoma and cytokeratin positive only sentinel lymph nodes. Am. J. Surg., 2002, 184, 302–306.
44. Noguchi, M. Therapeutic relevance of brast cancer micrometastases in sentinel lymph nodes. Br. J. Surg., 2002, 89, 1505–1515.
45. Hill, A., Tran, K., Akhurst, T., et al. Lessons Learned from 500 Cases of Lymphatic Mapping for Breast Cancer. Ann. Surg., 1999, 229, 528–535.
46. Cody, H., Hill, D., Tran, K., Brennan, M., Borgen, P. Credentialing for Breast Lymphatic Mapping: How Many Cases Are Enough? Ann. Surg. 1999, 229, 723–728.
47. Siddharth, S. B., Cox, Ch., Ku, N., et al. The Role of Sentinel Lymph Node Biopsy in Breast Cancer. J. Am. Coll. Surg., 1999, 189, 183–194.
48. Albo, D., Wayne, J., Hunt, K., et al. Anaphylactic reactions to isosulfan blue dye during sentinel lymph node biopsy for breast cancer. Am. J. Surg., 2001, 182, 393–398.
49. Miner, T., Shriver, C., Jaques, D., et al. Sentinel Lymph Node Biopsy for Breast Cancer The Role of Previous Biopsy on Patient Eligibity. Am. Surg., 1999, 65, 493–499.
50. Cody, H. One-step surgery for breast cancer: Back to the future? World J. Surg., 2007, 31, 1153–1154.
51. Giuliano, A., Daniel, M. K., Guenther, J., Morton, D. L. Lymphatic Mapping and Sentinel Lymphadenectomy for Breast Cancer. Ann. Surg., 1994, 220, 391–401.
52. Krag, D., Weaver, D., Ashigaka ,T., Klimberk, S., et al. The Sentinel Node in Breast Cancer. N. Eng. J. Med., 1998, 339, 941–946.
53. Siddharth, S. B., Cox, Ch., Ku, N., et al. The Role of Sentinel Lymph Node Biopsy in Breast Cancer. J. Am. Coll. Surg., 1999, 189, 183–194.
54. McMasters, K., Wong, S., Chao, C., et al. Defining the Optimal Surgeon Experience for Breast Cancer Sentinel Lymph Node Biopsy: A Model for Implementation of New Surgical Techniques. Ann. Surg., 2001, 234, 292–300.
55. Tafra, L., Lanin, D., Swanson, M., et al. Multicenter Trial of Sentinel Node Biopsy for Breast Cancer using Both Technetium Sulfur Colloid and Isosulfan Blue Dye. Ann. Surg., 2001, 233, 51–59.
56. Tafra, L. The learning curve and sentinel node biopsy. Am. J. Surg., 2001, 182, 347–350.
57. Bergkvist, J., Frisell, J., Liljegren, G., et al. Multicentre study of detection and falše negative rates in sentinel node biopsy for breast cancer. Br. J. Surg., 2001, 88, 1644–1648.
58. Červinka, V., Šťastný, K., Havlíček, K., Vyhnálková, I., Vaňásek, J., Pavlíková, E., Rothrockel, P., Hácová, M., Nechvátal, L. Naše zkušenosti s detekcí sentinelové uzliny. Rozhl. Chir., 2004, roč. 83, č. 6., s. 217–220.
59. Hruška, J. Biopsie sentinelové uzliny na našem pracovišti. Rozhl. Chir., 2002, 81, č. 4, s. 170–171.
60. Pavlišta, D., Dudorkinová, D., Novotný, J. K problematice vyšetření sentinelových lymfatických uzlin u karcinomu prsu. Čes. Gynek., 2005, roč. 70, č. 3, s. 197–200.
61. Strnad, P., Rob, L., Zuntová, A., Chod, J., Halaška, M. Biopsie sentinelové lymfatické uzliny u karcinomu prsu v praxi. Čes. Gynek., 2005, roč.70, č.4, s. 291–295.
62. Gatěk, J., Bakala, J., Dudešek, B., Duben, J., Hnátek, L., Dvořáčková, J. Biopsie sentinelové uzliny v chirurgické léčbě karcinomu prsu: prospektivní studie Čes. Gynek., 2003, 68, č. l, s. 6–10.
63. Gatěk, J., Duben, J., Dudešek, B., Haša, E., Adámek, M. Sentinelová uzlina u karcinomu prsu. Rozhl. Chir., 2000, 79, č. 2, s. 77–80.
64. Vážan, P., Velecký, J., Gatěk, J. Vyšetření sentinelových uzlin u karcinomu prsu pomocí rychlé peroperační biopsie a imunohistochemie v sériových řezech. Čes.-slov. Patol., 43, 2007, 43, č. l, s. 13–17.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2008 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Akutní endovaskulární řešení disekce hrudní aorty a následné ischemie dolních končetin
- Výskyt a řešení prolongovaného úniku vzduchu po plicní lobektomii
- Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi
- Hluboká žíla dolní končetiny jako tepenná náhrada při řešení infekce cévní protézy
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Epidemiologie a ekonomie zlomenin proximálního femuru, proximálního humeru, distálního radia a luxačních zlomenin hlezna
- Prof. MUDr. Václav Vojtěch Tošovský, DrSc., zemřel ve věku 95 let
- Životní jubileum prof. MUDr. Vl. Krále, CSc. (29. 3. – 70 let)
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy