-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
Examination of lymph nodes in resected colon segments with colorectal carcinoma
Introduction:
Optimized staging of colorectal carcinoma (CRC) is essential for treatment planning and for estimating the prognosis of the disease. In addition to tumour size and the depth of bowel wall infiltration, the lymph node status is very important for the determination of the disease stage. For this reason, detection and assessment of the maximum number of lymph nodes is emphasized in the examination of resected segments of the large bowel. The number of lymph nodes (LNs) found in the segments resected depends on various circumstances. In our study, we focused on factors which could influence the number of pericolic LNs.Material and methods:
We examined two groups of CRC patients. The first group included 30 patients within the age range of 32–50 years (average: 47.5 years) and the second group consisted of 90 patients aged between 51 and 87 years (average: 68 years). The tumours were localized in various parts of the colon, predominantly in the descending colon and the sigmoid colon. Rectal tumour was present in 23 patients; 13 of them underwent preoperative chemoradiation therapy and 10 of them received no preoperative therapy. The length of the resected colon segments (radical intervention) ranged from 6 to 51 cm. The size of CRC ranged from 0.5 to 15 cm (average: 4.5 cm). The maximum tumour invasion depth reached into the subserosal tissue and pericolic adipose tissueResults:
The number of LNs found in 120 resected colon segments ranged from 1 to 60 LNs per case. The number of LNs showed differences among the patients and also depended on the location of CRC within the large intestine. In the resected segments of the ceacum with CRC, the average number of LNs was 11.5, whereas it was only 7 in rectal CRC. The largest volume of pericolic adipose tissue was found in the caecum, whereas the smallest volume was seen on the rectal circumference. In CRC patients aged 50 years or younger, the number of LNs was from 2 to 60 (average: 17). In contrast, the number of LNs ranged from 1 to 46 (average: 11) in patients older than 50 years. In resected segments that were 6 to 12 cm long, the number of LNs ranged from 1 to 18 (average: 8). In resected segments that were 12 to 51 cm long, the number of LNs was from 1 to 60 (average: 13.8). In 13 cases of rectal CRC with preoperative chemoradiation therapy, small LNs of an average length of 1–3 mm predominated, and the number of LNs ranged between 1 and 13 (average: 5). The required number of 12 LNs was reached in 4 resected parts of the rectum (31%).Conclusion:
The number of pericolic LNs found in the resected segments of the colon and the rectum with CRC depends on various factors. Besides individual differences, the number of LNs is influenced by the CRC location in the colon, the extent of the resected pericolic adipose tissue, the patient’s age and the length of the segment resected. In cases of rectal CRCs, it is also influenced by preoperative chemoradiation therapy.Key words:
colon – rectum – colorectal carcinoma – pericolic and mesorectal lymph nodes – tumour stage
Autoři: M. Dušek 1,2; A. Chlumská 1,2; P. Mukenšnabl 1,2; M. Zámečník 3
Působiště autorů: Šiklův patologicko-anatomický ústav FN a LF UK v Plzni, přednosta: Prof. MUDr. M. Michal, Ph. D. 1; Bioptická laboratoř, s. r. o., Plzeň, vedoucí lékař: Prof. MUDr. A. Skálová, CSc. 2; Medicyt, s. r. o., lab. Trenčín, Slovenská republika, primář: MUDr. M. Gogora, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 5, s. 250-254.
Kategorie: Původní práce
Souhrn
Úvod:
Optimální staging kolorektálního karcinomu (KRK) má zásadní význam pro odhad prognózy a adekvátní léčbu nemocných. Kromě velikosti karcinomu a hloubky nádorové invaze ve stěně střevní je pro určení stagingu rozhodující stav lymfatických uzlin. Z tohoto důvodu se při histologickém vyšetřování resekátů tlustého střeva s KRK klade důraz na detekci a vyšetření maximálního počtu lymfatických uzlin. Jejich počet je závislý na mnoha okolnostech. V naší studii jsme se zaměřili na faktory, které mohou množství perikolických lymfatických uzlin ovlivňovat.Materiál a metodika:
Vyšetřili jsme 30 nemocných s KRK tlustého střeva a rekta ve věku 32–50 let (průměrný věk 47,5 roku) a 90 nemocných ve věkovém rozmezí 51–87 let (průměrný věk 68 let). KRK se nacházel v průběhu celého tlustého střeva, nejčastěji v colon descendens a v colon sigmoideum; u 23 nemocných byl KRK lokalizovám v rektu, z toho u 10 nemocných bez předoperační léčby a ve 13 případech po předchozí aktinochemoterapii. Délka resekátů tlustého střeva se pohybovala mezi 6–51 cm; ve všech případech se jednalo o radikální výkon. KRK dosahoval maximální délky 0,5–15 cm (průměr 4,5 cm) s maximální hloubkou nádorové invaze do subserózního vaziva stěny střevní a perikolické tukové tkáně.Výsledky:
Počet lymfatických uzlin se ve 120 resekátech tlustého střeva pohyboval od 1 do 60 uzlin a byl závislý na lokalizaci KRK v tlustém střevě. V resekátech céka s KRK dosahoval průměrný počet 11,5 lymfatické uzliny, zatímco u KRK rekta pouze 7 lymfatických uzlin. Největší množství perikolické tukové tkáně se nacházelo v oblasti céka a nejmenší na obvodu rekta. U nemocných s KRK do 50 let se počet perikolických lymfatických uzlin pohyboval od 2 do 60 uzlin (průměr 17 uzlin) a u nemocných ve věku 51–87 let od 1 do 46 lymfatických uzlin (průměr 11 uzlin). V resekátech tlustého střeva a rekta délky 6–12 cm bylo nalezeno 1–18 lymfatických uzlin (průměr 8 uzlin), v resekátech délky >12–51 cm 1–60 lymfatických uzlin (průměr 13,8 uzlin). Ve 13 resekátech KRK rekta po předoperační aktinochemoterapii převažovaly malé lymfatické uzliny o průměru 1–3 mm a vyskytovaly se v počtu 1–13 uzlin (průměr 5 lymfatických uzlin). Požadovaný limit 12 lymfatických uzlin byl dosažen ve 4 resekátech rekta (31 %).Závěr:
Počet perikolických lymfatických uzlin v resekátech tlustého střeva a rekta s KRK je závislý na mnoha faktorech. Kromě individuálních rozdílů ovlivňuje množství perikolických lymfatických uzlin lokalizace KRK v tlustém střevě, rozsah resekované perikolické tukové tkáně, věk nemocných, délka resekovaného tlustého střeva a u nemocných s KRK rekta předoperační aktinochemoterapie.Klíčová slova:
tlusté střevo – rektum – kolorektální karcinom – perikolické a mezorektální lymfatické uzliny – stage nádoruÚvod
Optimální grading a staging kolorektálního karcinomu (KRK) má zásadní význam pro odhad prognózy a adekvátní léčbu nemocných [3,4,5,6,7,8,11,12,14,18]. Kromě velikosti karcinomu a hloubky nádorové invaze ve stěně střevní je pro určení stagingu rozhodující stav lymfatických uzlin [3,4,5,6,7,8,11,12,14,18]. Z tohoto důvodu se při histologickém hodnocení resekátů tlustého střeva a rekta s KRK klade velký důraz na detekci a vyšetření maximálního počtu perikolických lymfatických uzlin. Ale i při pečlivém zpracovávání resekátů nejsou výsledky vždy uspokojivé. Mezinárodní klasifikace karcinomů (UICC – International Union Against Cancer) a American Joint Commitee on Cancer (AJCC) vyžadují nález nejméně 12 perikolických lymfatických uzlin (resp. 10–14 lymfatických uzlin) [4,5,6,8], ale tento limit splňuje pouze 20–30 % vyšetřených resekátů tlustého střeva a 19–20 % KRK rekta po předoperační aktinochemoterapii [4,5,8,14].
Počet perikolických lymfatických uzlin je závislý na mnoha okolnostech. Abychom si ověřili, které faktory mohou ovlivňovat jejich množství, zrevidovali jsme 120 resekátů tlustého střeva a rekta s KRK. Při hodnocení resekátů jsme se zaměřili na fyziologický výskyt lymfatických uzlin v průběhu tlustého střeva, rozsah resekované perikolické tukové tkáně, délku resekovaného tlustého střeva, velikost nádoru, věk nemocných a u KRK rekta na vliv předoperační aktinochemoterapie.
Materiál a metodika
Sestavu tvořilo 30 nemocných s KRK tlustého střeva a rekta ve věku 32–50 let (prům. věk 47,5 roku) a 90 nemocných ve věkovém rozmezí 51–87 let (prům. věk 68 let) (Tab. 1). U 12 nemocných byl nádor lokalizován v céku, u 25 v colon ascendens a colon transversum, u 48 v colon descendens a v colon sigmoideum, u 12 v rektosigmoideu a u 23 v rektu, z toho v 10 případech bez předoperační léčby a u 13 nemocných po předchozí aktinochemoterapii (Tab. 2). Délka resekovaného tlustého střeva se pohybovala mezi 6–51 cm, u 26 nemocných bylo tlusté střevo resekované v délce 6–12 cm a u 94 nemocných v rozsahu >12–51 cm. Ve všech případech se jednalo o radikální výkon. Nádory dosahovaly maximální délky 0,5–15 cm (průměr 4,5 cm), malé karcinomy do průměru 2 cm se vyskytovaly pouze u 5 nemocných. Ve dvou případech prorůstal nádor do submukózy (T1), u dalších 26 do muscularis propria (T2), u 92 nemocných do subserózního vaziva stěny střevní a perikolické tukové tkáně (T3) s hloubkou invaze 1–25 mm (Tab. 3). U všech nemocných byl karcinom před resekcí ověřen endoskopickou biopsií a v resekátech hodnocen jako dobře diferencovaný – G1 (81krát), středně diferencovaný – G2 (20krát), špatně diferencovaný – G3 (12krát) a mucinózní (7krát) kolorektální adenokarcinom (podle WHO klasifikace 2010). Perikolická tuková tkáň resekátů tlustého střeva a rekta byla vyšetřena prokrájením v úzkých lamelách šířky 3–4 mm. Lymfatické uzliny měly průměr 1–15 mm. Vzorky tkáně byly po fixaci v 10% formolu zpracovány běžnou parafínovou technikou a histologické řezy barveny hematoxylinem-eosinem.
Tab. 1. Počet lymfatických uzlin (LU) v závislosti na věku pacientů Tab. 1: The dependency of the number of lymph nodes on the patient’s age 
Tab. 2. Lokalizace kolorektálního karcinomu v tlustém střevě Tab. 2: Localization of colorectal carcinoma in large bowel 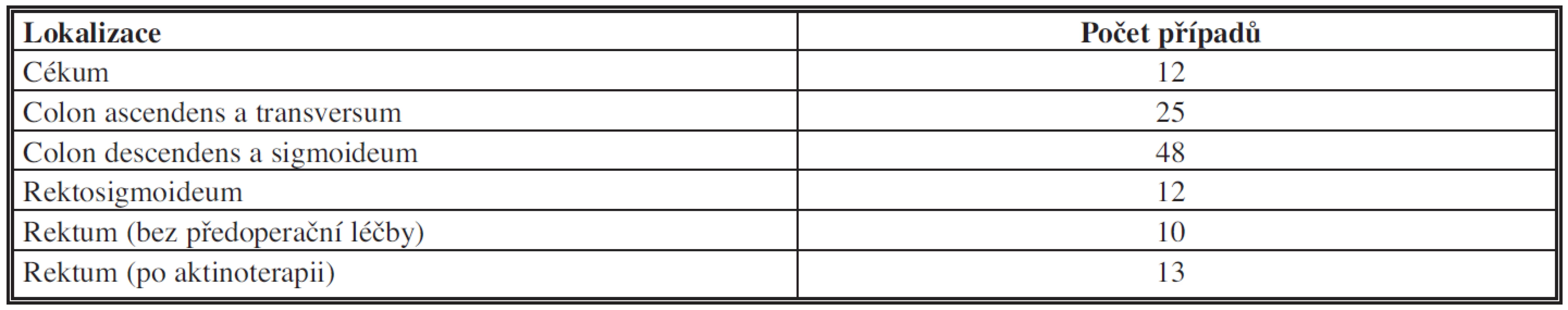
Tab. 3. Hloubka nádorové invaze kolorektálních karcinomů Tab. 3: Depth of the tumor invasion 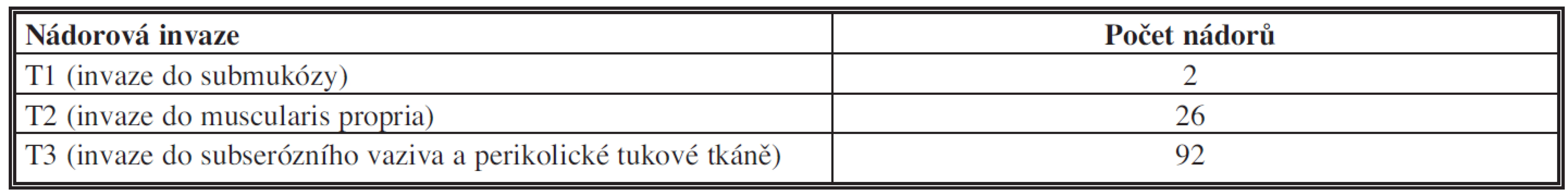
Výsledky
Počet lymfatických uzlin se ve 120 resekátech tlustého střeva pohyboval od 1 do 60 uzlin. Při hodnocení množství lymfatických uzlin v průběhu tlustého střeva byl porovnán jejich výskyt ve 12 resekátech KRK céka s 10 resekáty karcinomu rekta bez předoperační aktinochemoterapie. V céku dosahoval průměr 11,5 lymfatické uzliny a v mezorektální tkáni 7 lymfatických uzlin (Tab. 4). Ve všech resekátech byl největší objem resekované perikolické tukové tkáně v oblasti céka a nejmenší na obvodu rekta, zvláště v jeho distální části, kde se často nacházela pouze svalovina svěračů. U 30 nemocných ve věku od 32–50 let se počet lymfatických uzlin pohyboval od 2–60 lymfatických uzlin – průměr 17 lymfatických uzlin, a u 90 nemocných ve věku 51–87 let od 1 do 46 uzlin – průměr 11 lymfatických uzlin (Tab. 1). Ve 26 resekátech délky 6–12 cm bylo nalezeno 1–18 lymfatických uzlin – průměr 8 lymfatických uzlin; limit 12 lymfatických uzlin byl splněn v 69 % případů. V 94 resekátech délky >12–51 cm se množství lymfatických uzlin pohybovalo mezi 1–60 – průměrný počet 13,8 lymfatické uzliny; limit 12 lymfatických uzlin byl splněn v 73 % případů (Tab. 5). Ve 13 resekátech rekta s KRK po předoperační aktinochemoterapii převažovaly malé uzliny o průměru 1–3 mm a dosahovaly počtu 1–13 uzlin (průměr 5 lymfatických uzlin). Požadovaný počet (12 lymfatických uzlin) byl nalezen ve 4 resekátech (31 %).
Tab. 4. Průměrný počet lymfatických uzlin v resekátech céka a rekta Tab. 4: The average number of lymph nodes found in the resectates of the colon and rectum 
Tab. 5. Počet lymfatických uzlin (LU) v závislosti na délce resekátu Tab. 5: The dependency of the number of lymph nodes on the length of the resectate 
Diskuze
Nádorové metastázy v perikolických lymfatických uzlinách mají zásadní význam pro odhad prognózy a adekvátní léčbu nemocných s KRK [3,4,5,6,7,8,11,12, 14,17,18]. Optimální hodnocení nodálních metastáz je závislé na počtu nalezených lymfatických uzlin [6,8,11], a proto se v posledních letech klade velký důraz na jejich vyhledávání [3]. Protože se nádorové metastázy mohou vyskytovat i v malých lymfatických uzlinách, byly vypracovány vyšetřovací metody, které zvyšují jejich záchyt. Kromě nástřiku arterií v resekátu [10] zahrnují rozpouštění perikolické tukové tkáně a následné vyhledávání uzlin. V poslední době se doporučuje histologické vyšetřování veškeré rozpuštěné tukové tkáně [2] a rozpuštěné tukové tkáně redukované kompresí [5]. Švec se spol. [17] uvádějí v sestavě 59 nemocných s KRK rektosigmoidea, z toho u 39 po předoperační radioterapii, signifikantně vyšší záchyt lymfatických uzlin po rozpuštění tukové tkáně ve srovnání s 39 resekáty bez rozpuštění tukové tkáně. Ve velkých sestavách byly při zpracování veškeré rozpuštěné tukové tkáně nalezeny statisticky významné rozdíly pouze v počtu perikolických lymfatických uzlin do průměru 2 mm [10], zatímco u větších lymfatických uzlin nebyly kvantitativní rozdíly ve srovnání s rutinním manuálním vyšetřováním podstatné [10].
Množství perikolických lymfatických uzlin je v resekátech s KRK ovlivněno řadou faktorů. Především se uplatňují individuální rozdíly pravděpodobně podmíněné reaktivním zvětšením uzlin, které by v původní velikosti nebyly zachyceny [3,7,14,15], a nevylučuje se ani možnost tvorby nových lymfatických uzlin [3,9,13].
Je všeobecně známo, že počet lymfatických uzlin není v průběhu tlustého střeva rovnoměrný [3,4,5,8]. Nejvíce lymfatických uzlin se fyziologicky nachází v oblasti pravého tračníku a distálním směrem jejich počet klesá. Nejméně lymfatických uzlin je v mezorektální tukové tkáni [3,5,8,14,15,18]. Tuto skutečnost potvrdily i naše nálezy, které vycházejí ze srovnání počtu lymfatických uzlin v resekátech s karcinomem céka a rekta. V oblasti céka dosahoval průměr 11,5 lymfatické uzliny a v rektu pouze 7 lymfatických uzlin. Podobné výsledky uvádějí i další studie [3,5,7,15,18].
Množství lymfatických uzlin významně ovlivňuje rozsah resekované perikolické tukové tkáně [7,8,11,14]. Objem perikolického tuku je největší v oblasti céka, což nepochybně přispívá k vyššímu počtu lymfatických uzlin, které se v této lokalizaci nacházejí. Naproti tomu mezorektální tkáň je často resekovaná v menším rozsahu; platí to zejména pro distální část rekta, kde se na obvodu stěny střevní často nachází pouze svalová tkáň svěračů [14]. Mapování perikolických lymfatických uzlin prokázalo značné individuální rozdíly v propagaci KRK tlustého střeva lymfatickou cestou [1,3,16,19]. Z velkých sestav vyplývá, že se první nádorové metastázy mohou vyskytovat ve značně vzdálených lokalizacích, aniž by byly postiženy lymfatické uzliny v blízkosti nádoru. Neobvyklá lymfatická drenáž KRK se uvádí přibližně u 4–8 % nemocných a prakticky vylučuje možnost vyšetřování sentinelových lymfatických uzlin; u pravostranných KRK mohou dokonce první metastázy přesahovat rozsah hemikolektomie [1,19].
Z recentních studií vyplývá, že množství perikolických lymfatických uzlin do značné míry závisí na věku nemocných [4,7,8,11,15,18]. Odhaduje se, že v důsledku involuce klesá jejich počet v desetiletém intervalu přibližně o 9–10 % [8]. Rovněž v naší sestavě byl patrný rozdíl v počtu nalezených lymfatických uzlin v obou sledovaných věkových skupinách. U 30 nemocných ve věku do 50 let dosahoval průměr 17 perikolických lymfatických uzlin a u 90 nemocných v rozmezí 51–87 let pouze 11 perikolických uzlin.
Dalším faktorem, který se podílí na množství lymfatických uzlin, je délka resekovaného tlustého střeva. Z bioptické praxe je známo, že se nejvíce lymfatických uzlin a uzlin s nádorovými metastázami vyskytuje na spodině nádoru a v jeho blízkosti, přibližně v okruhu 1 cm [3]. Z tohoto důvodu se podle některých názorů považuje za dostačující vyšetření peritumorózních lymfatických uzlin a perikolické tukové tkáně v segmentu tlustého střeva 3 cm proximálně a distálně od nádoru [3]. Ve vzdálenějších úsecích od KRK je perikolických lymfatických uzlin v tlustém střevě podstatně méně [14] a většinou nebývají postiženy metastázami, zvyšují však celkový počet detekovaných lymfatických uzlin [15]. Rovněž v naší sestavě byl počet lymfatických uzlin v resekátech délky >12–51 cm vyšší (průměr 13,8 lymfatické uzliny) než v kratších resekátech délky 6–12 cm (průměr 8 lymfatických uzlin). V krátkých resekátech tlustého střeva (6–12 cm) byl požadovaný limit 12 lymfatických uzlin splněn v 18 z 26 případů (tj. v 69 %) a v delších resekátech tlustého střeva (>12–51 cm) splňovalo limit 69 z 94 případů (tj. 73 %). Ve zbývajících 25 resekátech této skupiny s nálezem méně než 12 lymfatických uzlin se většinou jednalo o kratší resekáty (maximální délky 16 cm) a starší nemocné s KRK levostranného tračníku.
Údaje o vlivu velikosti nádorů na počet nalezených perikolických lymfatických uzlin jsou rozdílné. Chou et al. [8] uvádí zvýšený počet lymfatických uzlin o 2–3 % na každý 1 cm nádorové tkáně s výjimkou KRK T3 a T4, kde jejich počet klesá. Více lymfatických uzlin u velkých nádorů prokázaly i další studie [11,14], jiné naopak tento vztah popírají [4,12]. V naší sestavě nemocných s KRK nebylo možno tento vliv spolehlivě hodnotit pro malý počet karcinomů do průměru 2 cm. Podobně jako Chou et al. [8] jsme ale rovněž pozorovali menší počet lymfatických uzlin u objemných karcinomů, pravděpodobně v důsledku přerůstání peritumorózních lymfatických uzlin nádorovou tkání.
Významná redukce lymfatických uzlin se pozoruje u karcinomů rekta po předoperační aktinochemoterapii [4,8,12,18]. V důsledku léčby dochází k jejich atrofii a fibróze, malé lymfatické uzliny mohou dokonce úplně vymizet [5,12]. Vyžadovaný počet (12 mezorektálních lymfatických uzlin) splňuje pouze 19–20 % resekátů [5,14]. V naší sestavě nemocných se množství mezorektálních lymfatických uzlin u 13 KRK rekta po aktinochemoterapii pohybovalo od 1–13 lymfatických uzlin. Požadovaný počet byl splněn ve 4 případech (31 %), celkový průměr odpovídal pouze pěti lymfatickým uzlinám.
Závěr
Počet perikolických lymfatických uzlin u nemocných s KRK je závislý na mnoha faktorech. Kromě individuálních rozdílů ovlivňuje množství lymfatických uzlin lokalizace karcinomu v tlustém střevě, rozsah resekované perikolické a mezorektální tukové tkáně, věk nemocných, délka resekovaného tlustého střeva a u karcinomů rekta předoperační aktinochemoterapie. Podle našich zkušeností je možno počet nalezených lymfatických uzlin ovlivnit větším rozsahem resekované perikolické tukové tkáně a histologickým vyšetřováním resekátů zkušeným patologem.
Seznam zkratek:
KRK – kolorektální karcinom
LU – lymfatická uzlina
UICC – mezinárodní klasifikace karcinomů (International Union Against Cancer)
AJCC – mezinárodní klasifikace karcinomů (American Joint Commitee on Cancer)
MUDr. Martin Dušek
Plzenecká 38
326 00 Plzeň
e-mail: dusek@medima.cz
Zdroje
1. Bilchik AJ, Saha S, Wiese D, et al. Molecular staging of early colon cancer on the basis of sentinel node analysis: a multicenter phase II trial. J Clin Oncol 2001;19 : 1128–36.
2. Brown HG, Luckasevic TM, Medich DS, Celebrezze JP, Jones SM. Efficacy of manual dissection of lymph nodes in colon cancer resections. Modern Pathology 2004;17 : 402–406.
3. Cserni, G. Nodal staging of colorectal carcinomas and sentinel nodes. J Clin Pathol 2003;56 : 327–335.
4. de la Fuente SG, Manson RJ, Ludwig KA, Mantyh ChR. Neoadjuvant chemoradiation for rectal cancer reduces lymph node harvest in proctectomy specimens. J Gastrointest Surg 2009;13 : 269–274.
5. Gehoff A, Basten O, Sprenger T, Conradi LCh, Bismarck C, Bandorski D, Merkelbach-Bruse S, Schneider-Stock R, Stoehr R, Wirtz RM, Kitz J, Müller A, Hartmann A, Becker H, Ghadimi BM, Liersch T, Rüschoff J. Optimal lymph node harvest in rectal cancer (UICC stages II and III) after preoperative 5-FU-based radiochemotherapy. Acetone compression is a new and highly efficient method. Am J Surg Pathol 2012;36 : 202–213.
6. Goldstein NS. Lymph node recoveries from 2427 pT3 colorectal resection specimens spanning 45 years. Recommendations for a minimum number of recovered lymph nodes based on predictive probabilities. Am J Surg Pathol 2002;26 : 179–189.
7. Chang GJ, Rodriquez-Bigas MA, Skibber JM, Moyer VA. Lymph node evaluation and survival after curative resection of colon cancer: systematic review. J Natl Cancer Inst 2007;99 : 433–441.
8. Chou JF, Row D, Gonen M, Liu YH, Schrag D, Weiser MR. Clinical and pathologic factors that predict lymph node yield from surgical specimens in colorectal cancer. A population-based study. Cancer 2010;116 : 2560–2570.
9. Kaiserling E. Newly-formed lymph nodes in the submucosa in chronic inflammatory bowel disease. Lymphology 2001;34 : 22–9.
10. Kerwel TG, Spatz J, Anthuber M, Wünsch K, Arnholdt H, Märkl B. Injecting methylene blue into the inferior mesenteric artery assures an adequate lymph node harvest and eliminates pathologist variability in nodal staging for rectal cancer. Dis Colon Rectum 2009;52 : 935–941.
11. Kim YW, Kim NK, Min BS, Lee KY, Sohn SK, Cho ChH. The influence of the number of retrieved lymph nodes on staging and survival in patients with stage II and III rectal cancer undergoing tumor-specific mesorectal excision. Ann Surg 2009;249 : 965–972.
12. Marks JH, Valsdottir EB, Rather AA, Nweze IC, Newman DA, Chernick MR. Fewer than 12 lymph nodes can be expected in a surgical specimen after high-dose chemoradiation therapy for rectal cancer. Dis Colon Rectum 2010;53 : 1023–1029.
13. Maurel J, Launoy G, Grosclaude P, et al. Lymph node harvest reporting in patients with carcinoma of the large bowel. A French population-based study. Cancer 1998;82 : 1482–6.
14. Mekenkamp LJM, van Krieken JHJM, Marijnen CAM, van de Velde CJH, Nagtegaal ID, for the Pathology Review Committee and the co-operative clinical investigators. Lymph node retrieval in rectal cancer is dependent on many factors – the role of the tumor, the patient, the surgeon, the radiotherapist, and the pathologist. Am J Surg Pathol 2009;33 : 1547–1553.
15. Shen SS, Haupt BX, Ro JY, Zhu J, Bailey HR, Schwartz MR. Number of lymph nodes examined and associated clinicopathologic factors in colorectal carcinoma. Arch Pathol Lab Med 2009;133 : 781–786.
16. Sterk P, Keller L, Jochins H, et al. Lymphoscintigraphy in patients with primary rectal cancer: the role of total mesorectal excision for primary rectal cancer-a lymphoscintigraphic study. Int J Colorectal Dis 2002;17 : 137–42.
17. Švec A, Horák L, Novotný J, Lysý P. Re-fixation in a lymph node revealing solution is a powerful method for identifying lymph nodes in colorectal resection specimens. EJSO 2006;32 : 426–429.
18. Tsai ChJ, Crane ChH, Skibber JM, Rodriguez-Bigas MA, Chang GJ, Feig BW, Eng C, Krishnan S, Maru DM, Das P. Number of lymph nodes examined and prognosis among pathologically lymph node-negative patients after preoperative chemoradiation therapy for rectal adenocarcinoma. Cancer 2011;117 : 3713–3722.
19. Tsoulias GJ, Wood TF, Mardton DL, et al. Lymphatic mapping and focused analysis of sentinel lymph nodes upstage gastrointestinal neoplasms. Arch Surg 2000;135 : 926–32.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Intenzivní péče v chirurgiiČlánek Elektrotrauma
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Intenzivní péče v chirurgii
- Vakuová drenáž jako varianta terapie infektu cévní infrainguinální protetické rekonstrukce – zkušenosti z našeho pracoviště a shrnutí problematiky
- Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Artrodéza ramene zevním fixatérem v léčbě chronických zánětlivých komplikací zlomenin proximálního humeru
- Zemřel profesor Jindřich Šebor
- Břišní aktinomykóza – 3 kazuistiky a přehled literatury
- Významné životní jubileum profesora Jana Schütznera
- Několik poznámek k současným principům léčby termických úrazů
- Chirurgické výkony v léčbě popáleninového traumatu
- Možnosti náhrady kože v 21. storočí
- Současné podmínky přípravy a použití biologických kožních krytů pro léčbu popálenin v České republice
- Kožní náhrada Integra® v klinické praxi
- Elektrotrauma
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chirurgické výkony v léčbě popáleninového traumatu
- Hodnocení lymfatických uzlin v resekátech tlustého střeva s kolorektálním karcinomem
- Elektrotrauma
- Kožní náhrada Integra® v klinické praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



