-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití acelulárních biologických xenotransplantátů v lokální léčbě Lyellova syndromu
The use of acellular biological xenografts in local treatment of Lyell’s syndrome
Lyell’s syndrome, also known as toxic epidermal necrolysis (TEN), is a rare skin disease characterized by a high mortality rate, systemic toxicity and extensive epidermal necrolysis with mucosal erosions. TEN is caused by an allergic autoimmune response, most commonly occurring as a result of an allergic reaction to medication. Our case report describes a nine-year-old boy suffering from Lyell’s syndrome, with 95% of the body surface area affected.
Key words:
Lyell’s syndrome – xenotransplantation
Autoři: H. Klosová; Z. Němečková Crkvenjaš; L. Petráš; J. Štětinský
Působiště autorů: Popáleninové centrum FN Ostrava, primářka: MUDr. Z. Němečková Crkvenjaš
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 2, s. 76-81.
Kategorie: Kazuistika
Souhrn
Lyellův syndrom neboli toxická epidermální nekrolýza je onemocnění s raritní frekvencí výskytu, vysokou letalitou, systémovou toxicitou a rozsáhlým kožním a slizničním postižením. Onemocnění vzniká na alergickém autoimunitním podkladě, nejčastěji jako poléková alergická reakce. V kazuistice popisujeme případ devítiletého chlapce s Lyellovým syndromem s rozsahem postižení na 95 % tělesného povrchu.
Klíčová slova:
Lyellův syndrom – xenotransplantaceÚvod
Lyellův syndrom neboli toxická epidermální nekrolýza (TEN) patří společně se Stevens-Johnsonovým syndromem (SJS), erytema multiforme, pemfigus vulgaris a stafylokokovým syndromem opařené kůže (SSSS) do skupiny onemocnění zvaných „burn-like“ syndromy, které se svými kožními a slizničními projevy jeví podobně jako popáleniny, resp. opařeniny. Syndrom byl pojmenován podle skotského dermatologa Alana Lyella, který jej poprvé popsal v roce 1956 [1].
Etiologickým spouštěčem tohoto alergického autoimunitního procesu jsou nejčastěji léky, s menší četností se etiologicky uplatňuje též infekce Mycoplasma pneumoniae či herpesviry. Onemocnění se může rozvinout i po alotransplantaci kostní dřeně v rámci reakce štěpu proti hostiteli. U HIV pozitivních pacientů je incidence TEN 1000krát vyšší než u ostatní populace [2]. U minoritní části pacientů může být etiologie neznámá. Rozvoji kožního postižení zpravidla předcházejí nespecifické příznaky ve formě nekomplikované, několik dnů trvající virózy (horečka, rýma, zánět spojivek, případně dysurie), která je následována postupným výsevem papulózního, zpravidla stranově symetrického erytému. Následně dochází k diseminaci a splývání erytému, tvorbě bul a exfoliaci epidermis, přičemž dynamika progrese kožního poškození je značně individuálně variabilní. U více než 90 % pacientů se rozvíjí i postižení sliznic dutiny ústní, genitálu anebo oka, méně časté je postižení sliznic dýchacího a gastrointestinálního traktu [3]. Slizniční léze, které mají podobu mokvavých erozí až ulcerací a hemoragických krust, působí pacientům poměrně výrazné bolesti.
V rámci celkových příznaků systémové toxicity dominuje alterace celkového stavu, febrilie, somnolence, únava, ztráty tekutin obdobné jako u popáleninového traumatu s rozvratem elektrolytové a vodní rovnováhy. V krevním obraze dominují lymfopenie a leukocytóza, je zvýšena sedimentace erytrocytů, vyšší jsou i hodnoty alfa a beta globulinů. Histopatologickým podkladem kožních projevů je plošná eozinofilní nekróza epidermis, edém a vazodilatace v horní vrstvě koria s absencí zánětlivých buněk v koriu a tvorba subepidermálních puchýřů [4].
Léčba Lyellova syndromu je komplexní, celková a místní. Základem celkové léčby je adekvátní protišoková infuzní terapie s ohledem na rozsah mokvavých ploch. Nezbytné je vysazení všech léků, které by mohly potencovat dynamiku progrese onemocnění. Lokální léčba Lyellova syndromu sestává z pravidelných převazů za přísně sterilních podmínek na operačním sále. Metodou lokální terapie, využívanou zejména na zahraničních pracovištích, jsou dočasné kožní kryty [4]. V letech 2007–2008 byl do klinické praxe zaveden biologický bezbuněčný kryt Xe-Derma® vyrobený z prasečí kůže. Na našem pracovišti je tento dočasný kožní kryt používán od ledna roku 2008. U Lyellova syndromu byla Xe-Derma® na našem pracovišti poprvé aplikována 5. 3. 2013.
Kazuistika
Devítiletý chlapec byl dne 5. 3. 2013 přijat na JIP pediatrického oddělení okresní nemocnice pro teploty a masivní toxoalergický exantém, který se postupně objevil a dále rozšířil třetí den při probíhajícím virovém onemocnění. Matkou byly doma podávány Paralen a Ibalgin. Při přijetí na pediatrickou JIP byl chlapec silně algický, febrilní, na těle s výsevem girlandovitých splývajících ložisek, celkově se známkami silné dehydratace. Vstupní laboratorní vyšetření detekovalo nízké hodnoty CRP a výraznou leukopenii v krevním obraze. Byla odebrána hemokultura a specifické IgE, zahájena parenterální rehydratace roztoky krystaloidů, podány kortikoidy, antihistaminika, analgetika. Při této terapii nastalo přechodně zlepšení celkového stavu, avšak po 12 hodinách od přijetí došlo k postupné progresi kožních projevů v podobě splývajícího exantému s tvorbou bul. Byla zahájena ATB terapie, na ranné plochy aplikován mastný tyl a mulové krytí. Během dalších 12 hodin postupně rozvoj zmatenosti a další progrese lokálního nálezu, celkově podán acyklovir. K vyloučení herpetické encefalitidy byla provedena lumbální punkce s negativním výsledkem. Byly odebrány specifické protilátky proti paracetamolu a ibuprofenu. Po celou dobu byl chlapec subfebrilní, oběhově stabilní, se spontánní a dostatečnou diurézou, silně algický. Vzhledem k progresi klinického stavu konzultováno Popáleninové centrum FN Ostrava a dohodnuto převzetí pacienta k další léčbě. Transfer proběhl bez komplikací, dne 5. 3. 2013 v 18 : 20 hodin byl pacient předán na příjmový sál Popáleninového centra FN Ostrava. V době převzetí lucidní, komunikující, orientovaný, spontánně ventilující s dobrou ventilační mechanikou, eupnoický, oběhově stabilní, dostatečně analgetizovaný. Kapilarita periferie v normě. Lokálně shledán splývavý exantém charakteru epidermolýzy s pozitivním Nikolského fenoménem, s drobnými bulami na bradě, ventrálně na trupu, zádech, na obou pažích a stehnech. Na zádech byly již místy plochy s exfoliací epidermis. Drobnomakulózní nesplývavý exantém s malými bulami na obou bércích a chodidlech, obou rukou, hýždích a předloktích. Vlasatá část hlavy, čelo a genitál zůstaly intaktní. Celkem se jednalo o postižení v rozsahu 90 % tělesného povrchu (dále TBSA) hloubky stupně IIa. Lokálně přiložen borový tyl, obklad s Dermacynem a mulové krytí. Zavedena centrální žilní kanyla. K celkové léčbě pacient předán na oddělení pediatrické resuscitační a intenzívní péče Kliniky dětského lékařství FN Ostrava. Zde pokračováno v infuzní terapii, nadále podávána antivirotika, analgetizace, zahájena enterální a parenterální nutrice. Zavedená ATB léčba ponechána. Provedeno oftalmologické vyšetření, při kterém byla zjištěna lehká povrchová injekce spojivek, rohovky intaktní. Podávána oční medikace v podobě kapek Maxitrol 3krát denně.
Během následujících 24 hodin byl pacient subfebrilní a s febrilními špičkami, oběhově subkompenzovaný, s nutností podávání nízkých dávek Noradrenalinu pro udržení adekvátního středního arteriálního tlaku. Infuzní terapie navýšena pro docílení vyššího obratu tekutin, podávány krystaloidy a koloidy v poměru 1 : 1. Pacient ventilačně suficientní, bez potřeby oxygenoterapie, diuréza spontánní, hojná. V krevním obraze iniciálně trombopenie, leukopenie, neutropénie, lymfopenie a monocytémie, lehká anémie, bez nutnosti krevních převodů. V séru vstupně elevace laktátdehydrogenázy, lehká hypoproteinémie, albumin v normě, CRP v normě, elevace D-dimerů. V iontogramu hyponatrémie s nutností parenterální substituce.
V průběhu druhého a třetího dne po přijetí dochází ke zhoršení celkového stavu. Pacient kontinuálně febrilní, bez žádoucí odezvy na podání antipyretik, oběhově instabilní a s nutností kontinuální vazopresorické podpory. V krevním obraze pozvolna progredující anemizace. Leukopenie, lymfopenie a neutropenie s tendencí k úpravě, přetrvávající monocytémie, trombocyty v odstupu 36 hodin po přijetí již v normě, přetrvávající elevace laktátdehydrogenázy, trend klesající, lehká elevace CRP. Iontogram při masívní suplementaci natria v normě. Aktivní herpesvirová infekce nepotvrzena, acyklovir vysazen. Při převazu zjištěna progrese lokálního nálezu, shledáno postižení na 95 % TBSA, nepostižen pouze genitál a vlasatá část hlavy. Ventrálně na trupu a na zádech v rozsahu 6 % TBSA mokvavé plochy s exfoliací epidermis (Obr. 1), proto přistoupeno ke xenotransplantaci biologickými bezbuněčnými xenotransplantáty Xe-Derma® (Obr. 2, Obr. 8). Na ostatní plochy postižené epidermolýzou opět borový tyl, Dermacyne obklad a mulové krytí. Vzhledem ke zhoršení celkového stavu a progresi lokálního nálezu pacient po převazu v celkové anestezii ponechán na umělé plicní ventilaci (dále UPV).
Obr. 1. Epidermolýza a exfoliace na zádech, hýždích a pravé paži druhý den po přijetí Fig. 1: Epidermolysis and exfoliation on the back, buttocks and the right arm on the second day following the patient’s admission 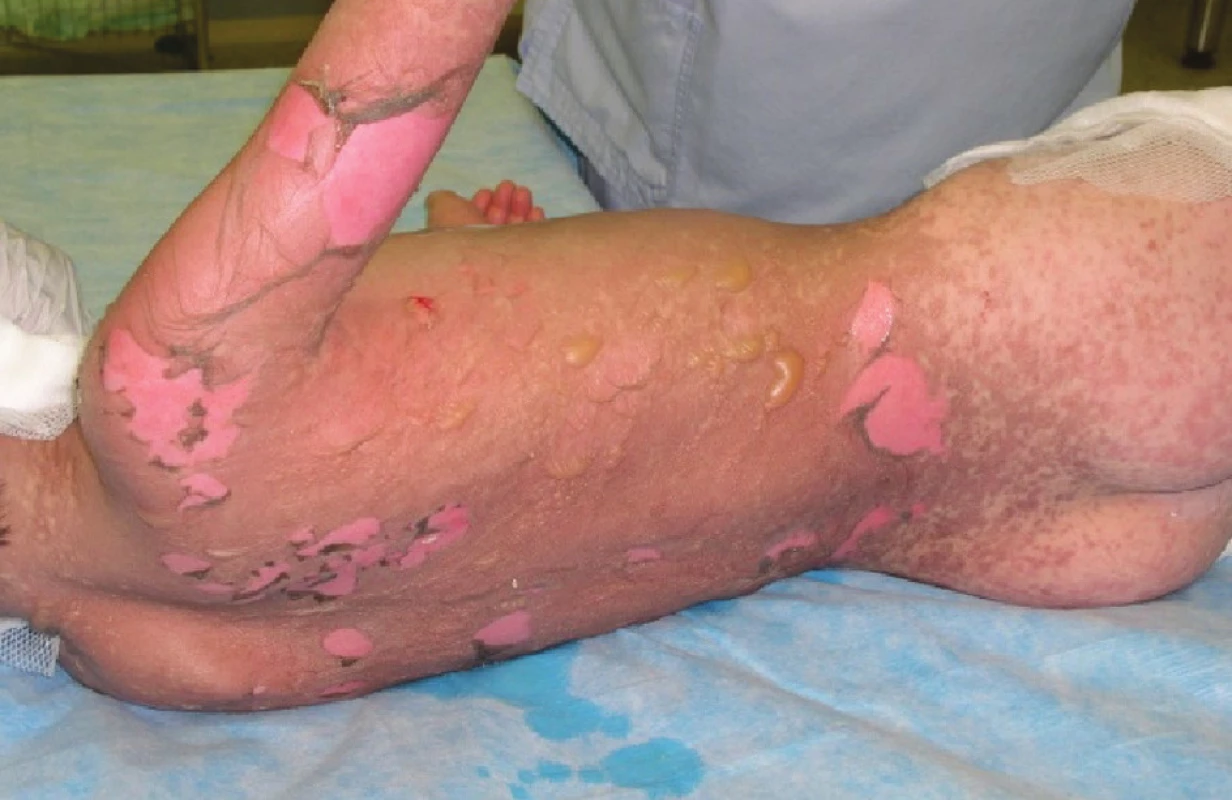
Obr. 2. Exfoliované plochy na zádech kryté Xe-Dermou Fig. 2: Exfoliated areas on the back covered with Xe-Derma 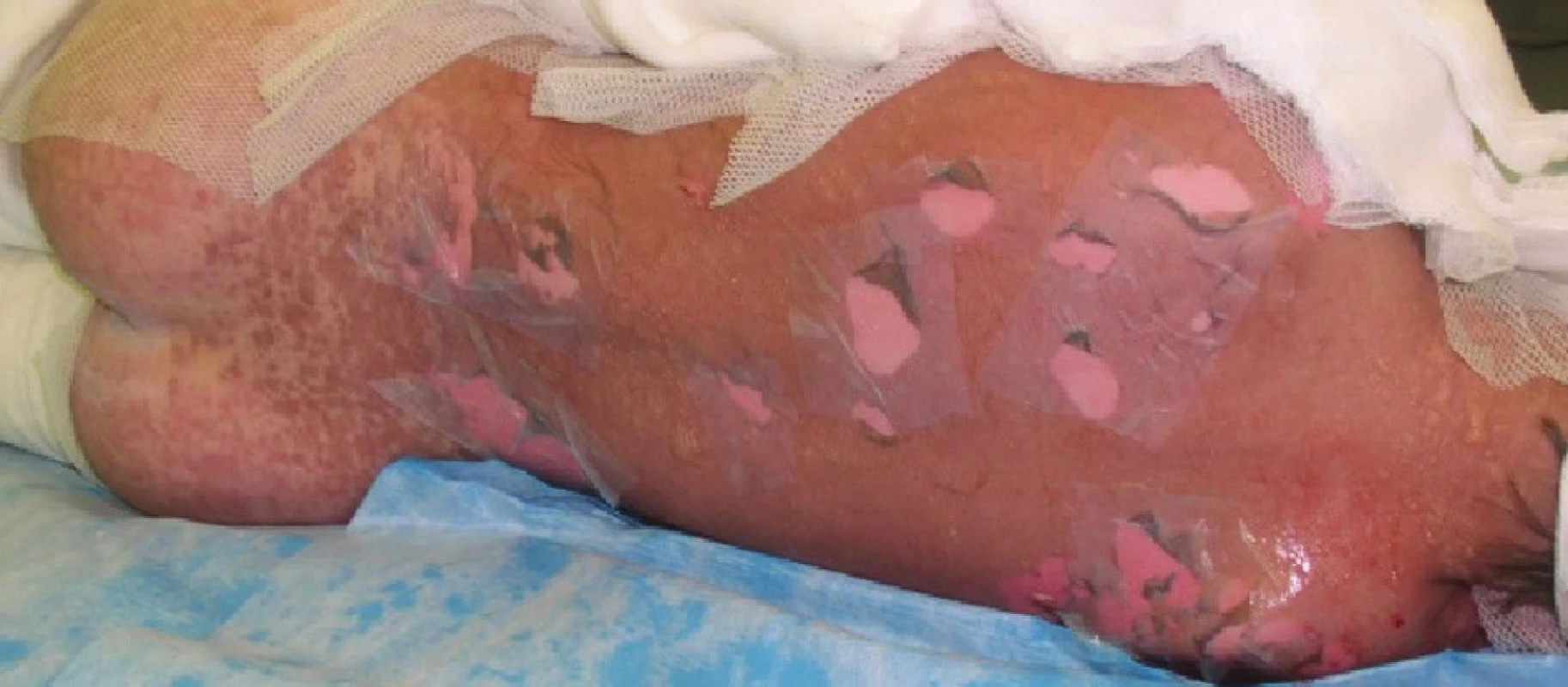
Obr. 3. Exfoliované plochy na levé tváři a na čele – na levé tváři stp. přiložení Xe-Dermy Fig. 8: Exfoliated areas on the left cheek and the forehead – the area on the left cheek following the application of Xe- Derma 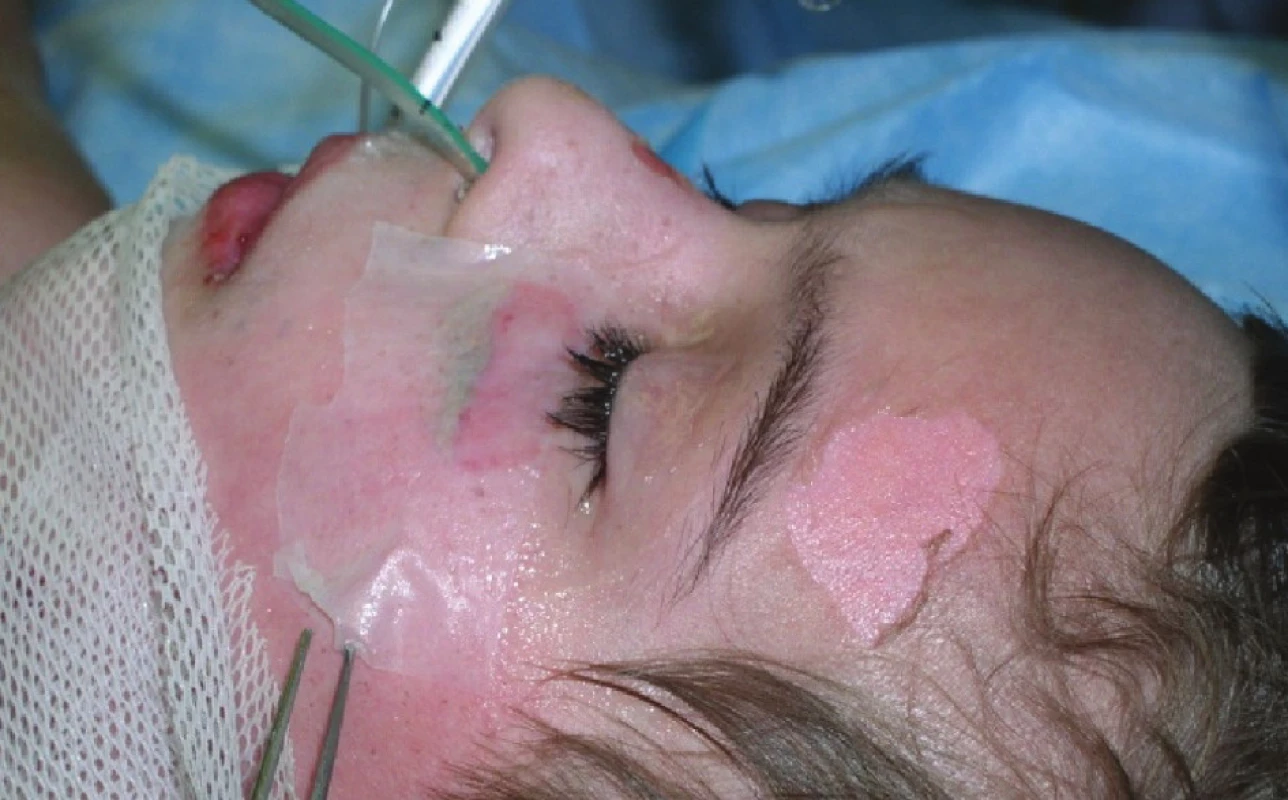
Čtvrtý den se celkový stav pacienta nemění. Lokálně při převazu plochy na bércích se zjevnou tendencí k zasychání. Na zádech, levé paži a ploskách nohou naplněné buly a mokvavé plochy, proto přistoupeno k další aplikaci Xe-Dermy® (Obr. 5, Obr. 6). Při tomto celkově třetím lokálním ošetření přiložena Xe-Derma® navíc v rozsahu 4 % TBSA (záda, levá paže, ploska levé nohy), celkový rozsah ploch krytých xenotransplantáty se zvýšil na 10 % TBSA.
Obr. 4. Naplněné buly na plosce levé nohy Fig. 5: Filled bullae on the sole of the left foot 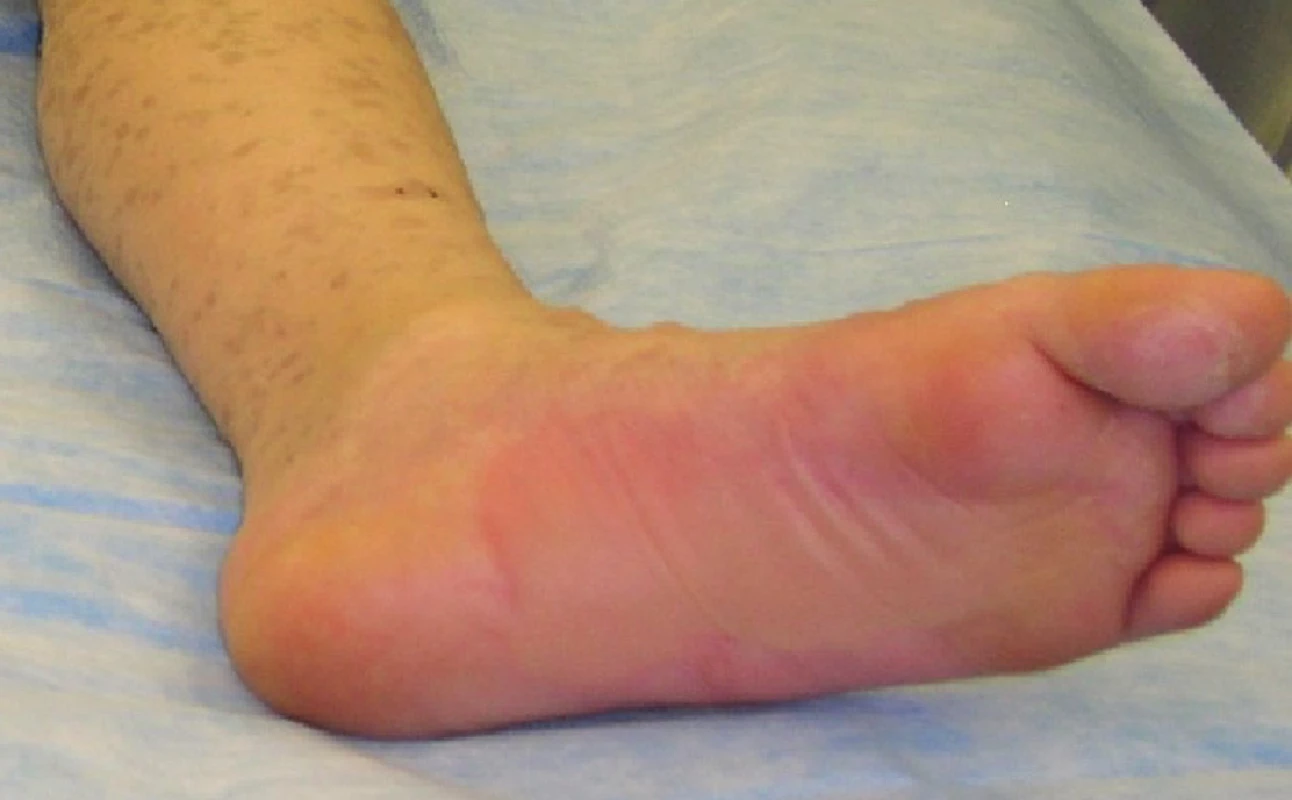
Obr. 5. Exfoliované plochy kryté xenotransplantáty na plosce levé nohy Fig. 6: Exfoliated areas covered with xenotransplants on the sole of the left foot 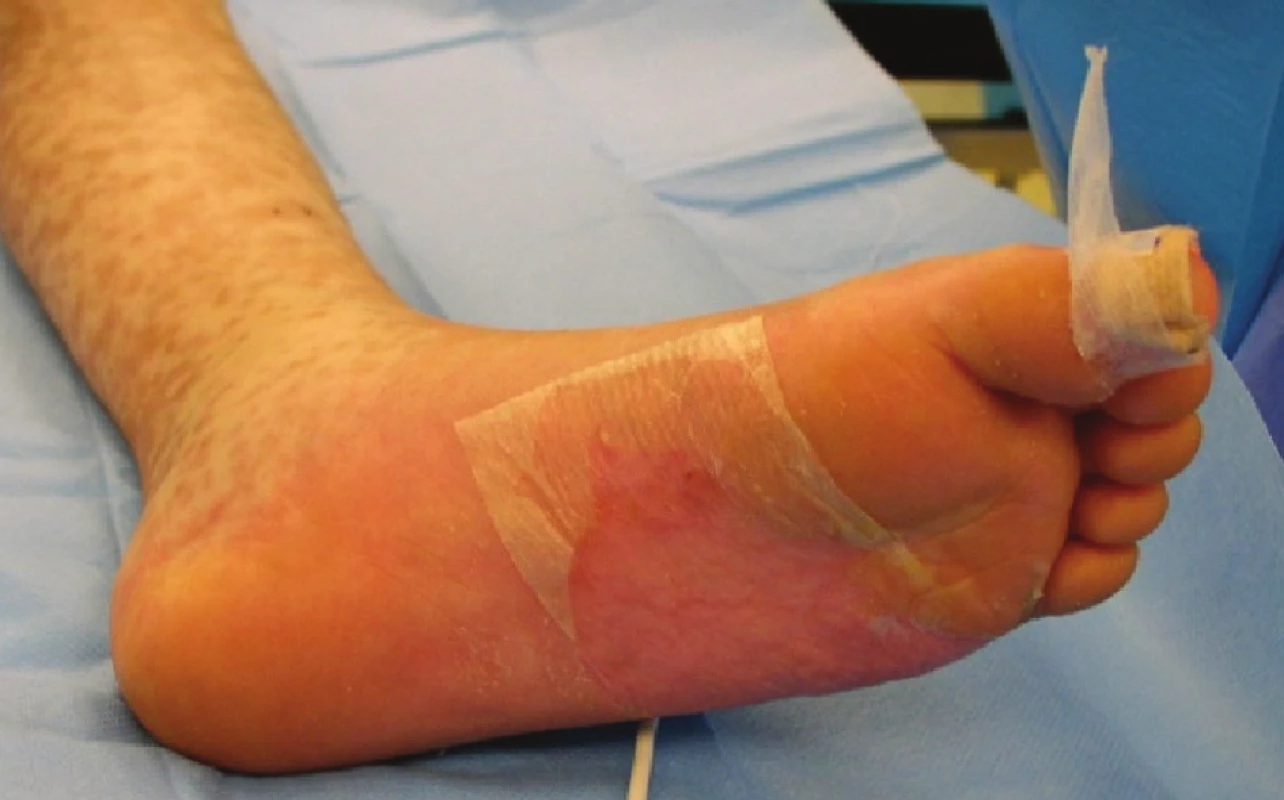
Pátý den po přijetí celkový stav bez podstatnějších změn, pacient kontinuálně febrilní, s dobrou tolerancí UPV a normosaturací, postupně oběhově stabilní na nízkých dávkách vazopresorů, s dostatečnou spontánní diurézou a nevelkou pozitivitou tekutinové bilance. Nutriční parametry při plné parenterální nutrici již v normě. Sérologická pozitivita EBV ve třídě IgM s doporučením kontroly v odstupu 3 týdnů, cytomegaloviry a herpesviry negativní.
Šestý den po přijetí při zavedené terapii postupně dochází ke zlepšení celkového stavu, pacient subfebrilní, nadále UPV. Při převazu na horních i dolních končetinách nález rychle epitelizujících a zasychajících ploch, xenotransplantáty v oblastech jejich aplikace s kompletní pevnou adhezí k rannému lůžku a postupující epitelizací. Na zádech se objevují nové mokvavé plochy v rozsahu 3 % TBSA, zde opět aplikována Xe-Derma®. Celkový rozsah xenotransplantace tak navýšen na 13 % TBSA. Lokální nález zřetelně zlepšen, aktuální rozsah ploch činil cca 25 % TBSA. Zahájen weaning, který byl během 24 hodin úspěšný.
Sedmý den po přijetí a zahájení terapie pacient extubován (celková délka trvání UPV 126 hodin), oběhově stabilní, vazopresory vysazeny. V laboratoři nález pokračující mírné anemizace bez nutnosti krevních převodů.
Devátý den byl proveden další převaz, plochy již byly většinou přeepitelizovány (Obr. 3). V oblasti zhojených ploch Xe-Derma® šetrně sejmuta (Obr. 7).
Obr. 6. Exfoliované plochy na zádech ve fázi epitelizace Fig. 3: Exfoliated areas on the back in the epitelization stage 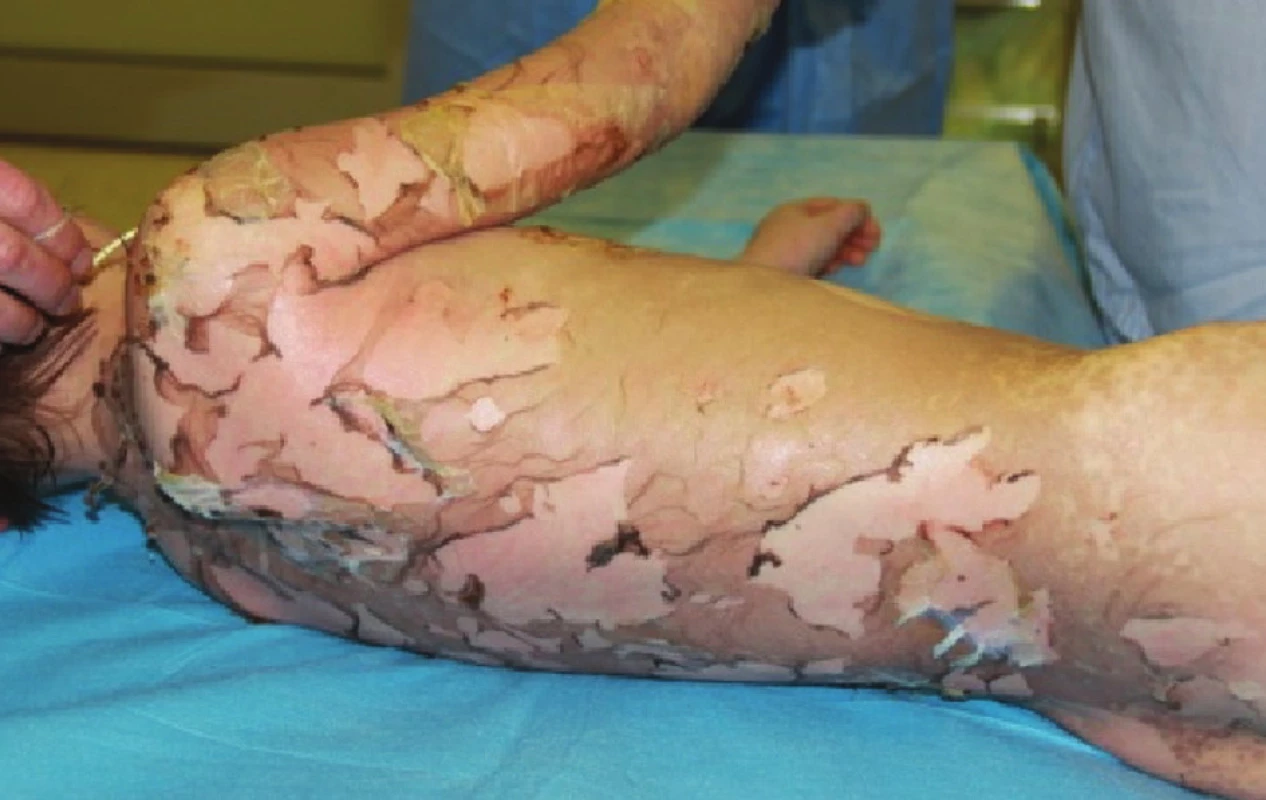
Obr. 7. Zhojené plochy po xenotransplantaci na plosce levé nohy Fig. 7: Healed areas following xenotransplantation on the sole of the left foot 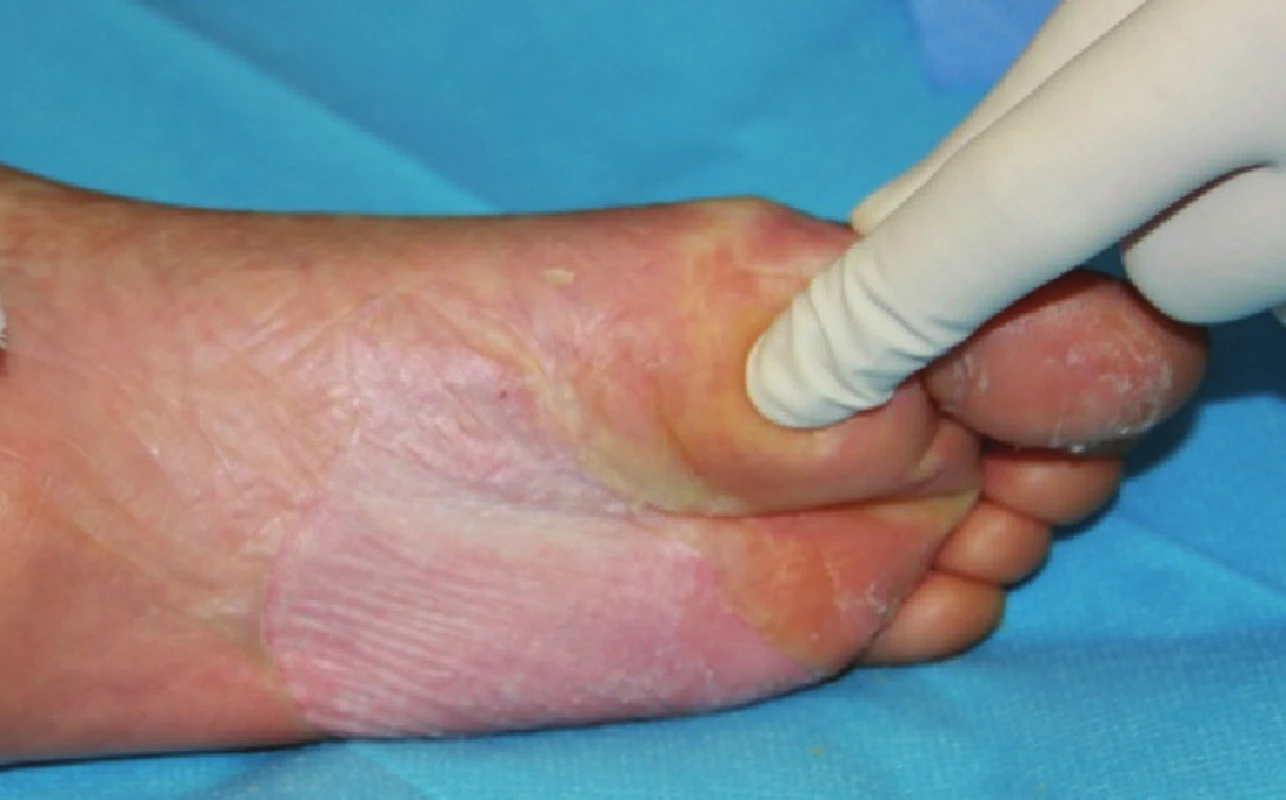
Desátý den po přijetí pacient afebrilní a v celkově stabilizovaném stavu přeložen k další léčbě na Popáleninové centrum FN Ostrava.
Třináctý den po přijetí pacient plně zhojen, z dohojených ploch na zádech sejmuta i zbylá Xe - Derma® (Obr. 4), pacient v celkově dobrém stavu propuštěn domů a předán do péče svého pediatra a rajonního dermatologa. Po celou dobu léčby probíhala pravidelná mikrobiologická surveillance, otisky z exfoliovaných ploch na semikvantitativní vyšetření po celou dobu sterilní, negativní byly i sputum a hemokultury, pouze ve stěru z močové trubice byla detekována kolonizace hemolytickým stafylokokem. Kontrolní vyšetření potvrdilo pozitivitu EBV. Protilátky proti paracetamolu a ibuprofenu negativní, etiologie vzniku onemocnění nezjištěna.
Obr. 8. Zhojené plochy na zádech po sejmutí xenotransplantátů Fig. 4: Healed areas on the back following the removal of xenotransplants 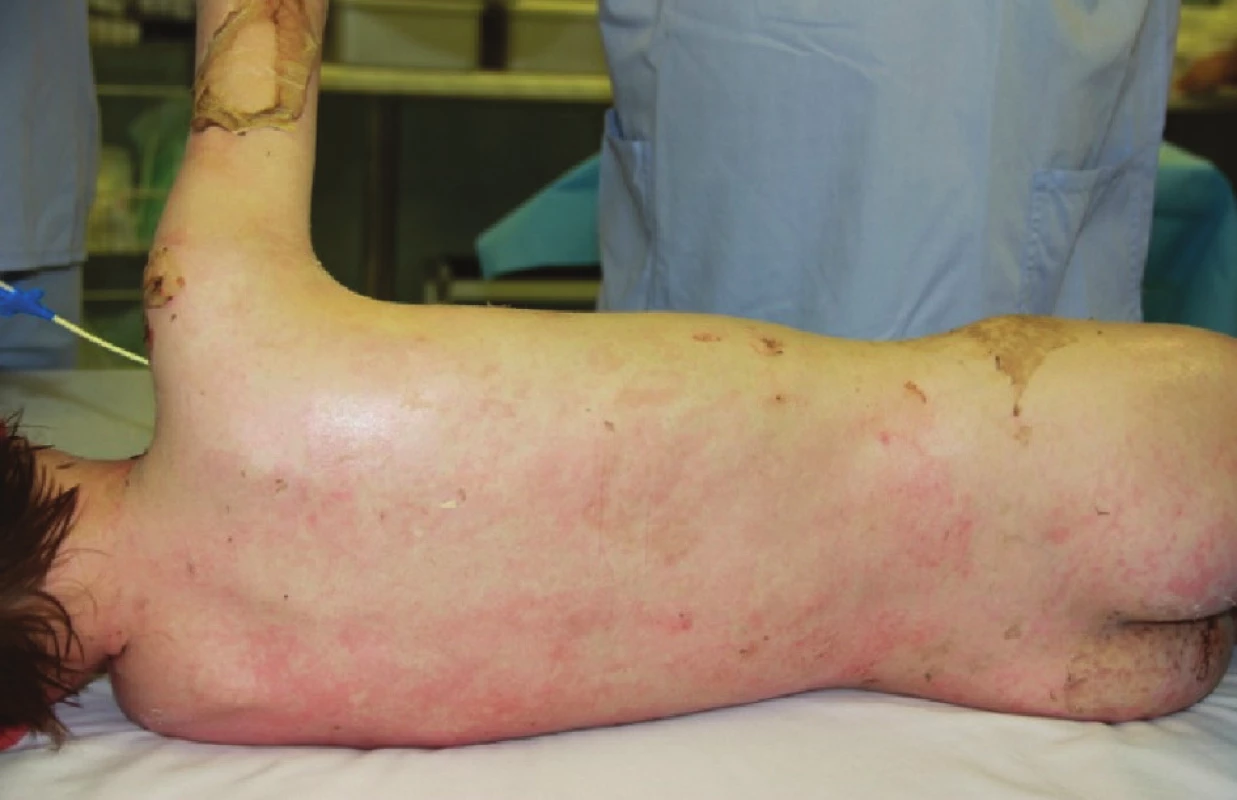
Při propuštění na kůži v celém rozsahu postižení zjevné jemné živě růžové jizvy s předpokladem kompletní restituce k normě ve výhledu týdnů až měsíců.
S odstupem tří měsíců byly na kůži v postižených oblastech zjevné pouze nevýrazné mapovité barevné změny v podobě zarůžovění a lehká smíšená pigmentace. Tyto barevné změny v průběhu následujících čtyř měsíců plně regredovaly. V souvislosti s pocením se nepravidelně objevuje okrskovitě výsev lehké urtiky se spontánní regresí v řádu dnů. Pacient je v péči ošetřujícího pediatra, bez medikace, dodržuje režimová opatření typu nedráždivé diety, kůži promazává indiferentními krémy. Po dobu jednoho roku mu byla doporučena přísná ochrana před UV zářením.
Diskuze
Lyellův syndrom má ze skupiny onemocnění připomínajících svými kožními projevy opaření (v anglosaské literatuře tzv. burn-like syndroms) nejrizikovější prognózu s vysokou letalitou pohybující se kolem 30 % [5]. Z hlediska incidence jde o raritní onemocnění, jehož výskyt je udáván v celosvětovém měřítku s přibližně stejnou četností, a to 1,5–2 případy na milion obyvatel za rok [6]. Jedná se o onemocnění, které se rozvíjí jako poléková toxoalergická reakce s rozsáhlým kožním i slizničním postižením a se závažnými projevy systémové toxicity.
V relativně vyšším riziku rozvoje TEN jsou starší lidé, a to zejména v souvislosti s farmakoterapií u této věkové skupiny, která bývá mnohdy bohatá a ne vždy důsledně zohledňuje zásady správné preskripce ve smyslu lékových interakcí, duplicit a rizik alergií. U minoritní části pacientů může být etiologie neznámá. Mezi léky, s nimiž je nejčastěji spojen rozvoj Lyellova syndromu patří allopurinol, antibiotika (nejvíce sulfonamidy, aminopeniciliny, cefalosporiny, chinoliny), nesteroidní antiflogistika a antiepileptika (karbamazepin, valproát, fenytoin a fenobarbital) [2].
Závažnost klinického stavu a riziko jeho fatálního zakončení lze s vysokou přesností hodnotit pomocí prognostického skórovacího systému SCORTEN (a severity-of-illness score for toxic epidermal necrolysis) [7]. Systém posuzuje celkem sedm vzájemně nezávislých klinických rizikových faktorů, a to v průběhu prvních 24 hodin od přijetí. Jedná se o věk nad 40 let, přítomnost malignity, tachykardie nad 120/min, vstupní rozsah kožního postižení nad 10 %, urea v séru vyšší než 10 mmol/l, glykémie vyšší než 14 mmol/l a bikarbonáty nižší než 20 mmol/l [8,9]. Každému z těchto rizikových faktorů je v případě jeho pozitivity přiřazena hodnota 1, výsledná hodnota SCORTEN je pak dána součtem jednotlivých skóre. Rostoucí hodnota SCORTEN predikuje vyšší mortalitu pacientů (Tab. 1) [2] tak, že SCORTEN 0-1 znamená 3,2% riziko úmrtí, SCORTEN 2 riziko 12,1 %, SCORTEN 3 riziko 35,3 %, SCORTEN 4 je asociováno s 58,3% rizikem a konečně SCORTEN 5 a více predikuje 90% riziko letality [8,2]. Hodnocení rizika letality a celkové prognózy Lyellova syndromu pomocí tohoto skórovacího systému je významným vstupním indikátorem závažnosti celkového stavu a cenným vodítkem při rozhodování o razanci a šíři terapie.
Tab. 1. SCORTEN skóre závažnosti Lyellova syndromu Tab. 1: Severity-of-Illness Score for Toxic Epidermal Necrolysis 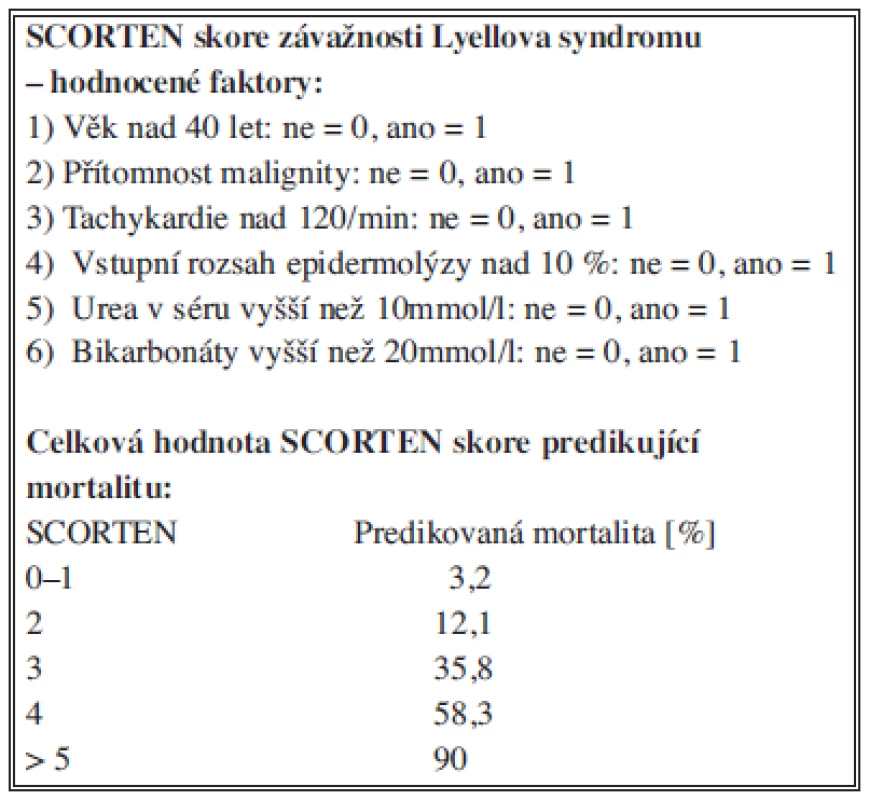
Léčba musí být vždy komplexní a současně i šetrná se zaměřením na vyloučení celkových i lokálních faktorů, které by mohly potencovat dynamiku rozvoje alergické autoimunitní reakce organismu. Základem celkové léčby je adekvátní protišoková infuzní terapie s ohledem na rozsah mokvavých ploch. Lze říci, že se řídí zásadami léčby popáleninového šoku.
Základním předpoklad úspěšné terapie spočívá ve správné taktice provádění lokální léčby. Nezbytné je provádění pravidelných převazů za přísně sterilních podmínek na operačním sále. Frekvence převazů se řídí celkovým stavem pacienta a vývojem lokálního nálezu. Technika ošetřování ploch musí být velmi šetrná, traumatizaci ploch je nutno omezit na minimum. Vysoce důležité je zabránit vzniku infekce ploch a předejít jejich vysychání, které může vést k prohloubení ranných ploch a prolongovanému hojení [10]. Jsou-li takto vytvořeny podmínky pro nekomplikované hojení, probíhá epitelizace zpravidla velmi rychle. Standardně jsou lokálně aplikovány antibakteriální a epitelizační prostředky, a to zpravidla ze spektra preparátů určených k vlhkému hojení ran, např. algináty (Flaminal Hydro). Na našem pracovišti poté v další vrstvě aplikujeme tyl s borovou vazelínou pro snížení absorpce použitého lokálního prostředku do mulového krytí. Následuje obklad s antiseptickým roztokem, např. s Dermacynem. Tento postup je v souladu s postupy uváděnými pracovišti zabývajícími se léčbou Lyellova syndromu [11].
Silversulfadiazinové preparáty nejsou v lokální léčbě Lyellova syndromu pro obsah sulfonamidové komponenty doporučovány, protože mohou potencovat dynamiku alergického procesu a dále zhoršit průběh onemocnění a jeho prognózu [2]. Vzhledem k možným rizikům se použití těchto lokálních prostředků, široce používaných u rozsáhlých popálenin, v léčbě Lyellova syndromu důsledně vyhýbáme.
Další metodou lokální terapie, využívanou zejména na zahraničních pracovištích, jsou dočasné kožní kryty, např. kryalizované kožní alografty [4].
V našich podmínkách byly tradičně v léčbě popálenin používány jako dočasné kryty viabilní prasečí xenotransplantáty. V posledních letech však v souvislosti s implementací požadavků Evropské unie do legislativy České republiky došlo ke změnám podmínek přípravy a skladování xenotransplantátů s výrazným nárůstem ekonomické náročnosti jejich použití. Tato opatření byla následována zásadní redukcí používání viabilních xenotransplantátů v lokální léčbě termického traumatu a dalších typů ran. Ke zvratu v tomto nepříznivém vývoji došlo postupně v letech 2007–2008, kdy byl do klinické praxe zaveden biologický bezbuněčný kryt Xe-Derma® vyrobený z prasečí kůže. Na našem pracovišti tento dočasný kožní kryt používáme od ledna roku 2008. Od té doby byly pomocí Xe-Dermy® s úspěchem léčeny desítky pacientů dětského i dospělého věku s popálením II. stupně. Xe-Derma® je na našem pracovišti používána i v dalším indikačním spektru, které zahrnuje léčbu odběrových ploch po odběrech dermoepidermálních štěpů, dočasné krytí ploch po nekrektomiích a krytí široce meshovaných dermoepidermálních autotransplantátů ke stimulaci jejich přihojení. Mezi hlavní přednosti tohoto krytu patří nebolestivá aplikace a výborná adheze ke spodině mokvavých ploch, díky níž je traumatizace spodiny během dalších převazů prakticky vyloučena anebo se pohybuje pouze v rovině mikrotraumatizace. Takto je umožněn nerušený průběh epitelizace ploch. Současně je díky adhezi krytu ke spodině minimalizována bolestivost během převazů, které se omezují pouze na výměnu sekundárního krytí. Tato vysoce kvalitní adheze Xe-Dermy® ke spodině je dána vytvořením tenké vrstvy fibrinu mezi ranným lůžkem a spodinou krytu. Aplikace Xe-Dermy® není spojena s vyšším rizikem infekce ploch, transparentnost krytu umožňuje průběžnou kontrolu stavu rány. Přirozená 3D struktura kolagenních a elastických vláken podporuje migraci buněk do rány, jejich proliferaci, diferenciaci a vytvoření kvalitní, mnohovrstevné stratifikované neoepidermis [12,13]. Po zhojení ploch dochází ke spontánnímu odlučování krytu od okrajů, což je známkou, že epitelizace ploch byla dokončena a Xe-Dermu® je možno šetrně sejmout. Aplikace Xe-Dermy® má navíc příznivý vliv na snížení ztrát tělesných tekutin z otevřených ranných ploch, a umožňuje tak redukovat množství podávaných infúzí. U ploch hlubšího II. stupně čili ploch koriových se sporným prokrvením spodiny, občas dochází k okrskovité lýze krytu. V těchto případech pak kombinujeme použití Xe-Dermy® s dalšími lokálními prostředky, např. s algináty. Na základě pozitivních klinických zkušeností s používáním Xe-Dermy® v konzervativní i operační léčbě popálenin bylo na našem pracovišti rozšířeno použití tohoto dočasného krytu i pro léčbu Lyellova syndromu. Poprvé jsme Xe-Dermu® u Lyellova syndromu použili 5. 3. 2013.
Závěr
Na základě jednoznačně pozitivních zkušeností získaných při léčbě devítiletého pacienta bylo na Popáleninovém centru FN Ostrava rozšířeno indikační spektrum dočasného acelulárního biologického kožního krytu Xe-Derma® o terapii exfoliovaných ploch u Lyellova syndromu.
MUDr. Hana Klosová
FN Ostrava
Popáleninové centrum
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: klosova.h@seznam.cz
Zdroje
1. Lyell A. Toxic epidermal necrolysis: an eruption resembling s calding of the skin. Br J Dermatol 1956;68 : 355–61.
2. Harr T, French LE. Toxic epidermal necrolysis and Stevens-Johnson syndrome. Orphanet J Rare Dis 2010;5 : 1–12.
3. Lebargy F, Wolkenstein P, Gisselbrecht M, Lange F, Fleury-Feith J, et al. Pulmonary complications in toxic epidermal necrolysis: a prospective clinical study. Intensive Care Med 1997;23 : 1237–1244.
4. Garcia Bernal FJ, Torrero V, Regalado J, Ferdinandez Samaniego F, Gabilondo GJ. Lyell syndrome management in a burn unit. Annals of Burns and Fire Disasters 1998;11 : 217–221
5. Wolkenstein P, Latarjet J, Roujeau JC, Duguet C, Boudeau S, et al. Randomised comparison of thalidomide versus placebo in toxic epidermal necrolysis. Lancet 1998;352 : 1586–1589.
6. Bachot N, Revuz J, Roujea JC. Intravenous immunoglobulin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis: a prospective noncomparative study showing no benefit on mortality or progression. Arch Dermatol 2003;139 : 33–6.
7. Cartotto R, Mayich M, Nickerson D, Gomez M. SCORTEN accurately predicts mortality among toxic epidermal necrolysis patients treated in a burn center. J Burn Care Res 2008; 29 : 141–6.
8. Bastuji-Garin S, Fouchard N, Bertocchi M, Roujeau JC, Revuz J, Wolkenstein P. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol 2000;115 : 149–53.
9. Imahara SD, Holmes JH4th, Heimbach DM, Engrav LE, Honari S, et al. SCORTEN overestimates mortality in the setting of a standardized treatment protocol. J Burn Care Res 2006;27 : 270–5.
10. Lipový B, Říhová H, Gregorová N, Suchánek I. Toxická epidermální nekrolýza: přehled možností terapie. Hojení ran 2011; 5 : 6–12.
11. Šuca H, Tokarik M, Pafčuga I, Zajíček R. Toxická epidermální nekrolýza – naše zkušenosti s celkovou i lokální léčbou. Hojení ran 2011;5 : 22–24.
12. Zajicek R, Mandys V, Mestak O, Sevcik J, Königova R, et al. Human keratinocyte growth and differentiation on acellular porcine dermal matrix in relation to wound healing potential. ScientificWorldJournal 2012;2012 : 1–8.
13. Zajíček R, Brož L, Klein L, Bláha J, Königová R, et al. Xe-Derma: nový biologický kryt pro léčbu akutních a chronických ran. Hojení ran 2008; 2 : 18–27.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Koncentrace chirurgické péče
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
- Koncentrace chirurgické péče
- Deset let endovenózní ablace varixů, úspěchy, neúspěchy a budoucnost
- Transarteriální chemoembolizace pomocí „drug eluting beads“ (TACE DEB) u nemocných s radikálně neodstranitelným hepatocelulárním karcinomem (HCC)
- Problematika klostridiové kolitidy na chirurgickém pracovišti
- Monografie Vladislava Hytycha věnovaná plicní chirurgii
- Využití acelulárních biologických xenotransplantátů v lokální léčbě Lyellova syndromu
- Využití telemetrického monitorování intrakraniálního tlaku v diferenciální diagnostice idiopatické nitrolební hypertenze – kazuistika
- Akademik Vladimír Balaš se dožívá 90 let
- Resekční okraje – onkologicky významný parametr R
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Resekční okraje – onkologicky významný parametr R
- Problematika stanovení bezpečných resekčních okrajů u nádorů parenchymatózních orgánů
- Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta
- Problematika stanovení bezpečných resekčních okrajů patologem v mamární onkochirurgii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



