-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba gastrointestinálních stromálních tumorů – komplexní pohled chirurga
Treatment of gastrointestinal stromal tumors – a comprehensive view of the surgeon
Introduction:
Gastrointestinal stromal tumors (GIST) are specific mesenchymal tumors of the gastrointestinal tract. Most of GISTs (95%) result from activating mutations in one of the receptor tyrosine kinase proteins (KIT). Tumor cells express this protein. GIST is most common in the stomach and small intestine, but may occur anywhere in the gastrointestinal tract and intra-abdominal soft tissues. The variety of its clinical presentations is related to localization of the tumor, its size and relationship to surrounding organs. Surgery is the first choice of treatment for patients with localized or potentially resectable tumors with the intention of R0 resection. Targeted therapy with imatinib (a selective inhibitor of the KIT protein) is the primary option for patients with metastatic GIST, as adjuvant treatment after surgery or neo-adjuvant therapy prior to surgery in indicated cases. This paper describes comprehensive therapy of GIST with an emphasis laid on the status of surgical treatment, and it highlights some controversial topics, e.g. the role of surgery for metastatic disease or neo-adjuvant targeted therapy.Conclusion:
GIST is a relatively rare tumor most commonly affecting the stomach and small intestine. Surgical treatment is not replaceable in the treatment strategy of this disease. The diagnostic-therapeutic approach to patients with GIST must be comprehensive. Due to prescribing restrictions of biological therapies, these patients are inevitably directed to specialized centers where surgical treatment should also be preferably provided.Key words:
GIST – gastroinestinal stromal tumor – imatinib
Autoři: L. Fiala 1; R. Šefr 1; I. Kocáková 2; M. Pacal 3
Působiště autorů: Oddělení chirurgické onkologie a centrálních operačních sálů, Masarykův onkologický ústav Brno, primář: MUDr. V. Chrenko, CSc. 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav Brno, přednosta: prof. MUDr. R. Vyzula, CSc. 2; Oddělení radiologie, Masarykův onkologický ústav Brno, primář: MUDr. H. Bartoňková 3
Vyšlo v časopise: Rozhl. Chir., 2015, roč. 94, č. 5, s. 189-192.
Kategorie: Souhrnné sdělení
Souhrn
Úvod:
Gastrointestinální stromální tumory (GIST) jsou specifické neepitelové mezenchymální nádory gastrointestinálního traktu. Většina GISTů (95 %) vzniká v důsledku mutace genu transmembránového tyrozinkinázového proteinu (KIT), což je receptor pro růstový faktor. Tento receptor na svém povrchu exprimují nádorové buňky GISTu. Nejčastěji postiženými orgány bývají žaludek a tenké střevo, ale můžeme ho nalézt kdekoli v průběhu trávicí trubice a orgánů dutiny břišní. Klinická manifestace bývá různá a je dána lokalizací nádoru, jeho velikostí či vztahem k okolním orgánům. U resekabilních nádorů je indikováno primární chirurgické řešení s cílem R0 resekce. Cílená léčba imatinibem (kompetitivní inhibitor KIT receptoru) je určena pro pacienty s metastatickým onemocněním a dále jako adjuvantní léčba po operaci nebo v indikovaných případech jako neoadjuvantní terapie. Práce se snaží o přehledné zpracování komplexní terapie GIST s důrazem na postavení chirurgické léčby a upozorňuje na některá kontroverzní témata, např. roli resekčního výkonu u pacientů s metastatickým onemocněním nebo neoadjuvantní podání cílené biologické léčby.Závěr:
I přes nezpochybnitelný úspěch biologické léčby má chirurgická léčba nezastupitelné místo v terapii tohoto onemocnění. Diagnosticko-terapeutický přístup k pacientům s GISTem musí být komplexní. Preskripční omezení biologické léčby přímo nutí směrovat tyto pacienty do specializovaných center, kde by s výhodou měla být prováděna i léčba chirurgická.Klíčová slova:
GIST – gastrointestinální stromální tumor – imatinibÚvod
Gastrointestinální stromální tumory (GIST) patří podle platné definice do skupiny neepitelových nádorů trávicího traktu tvořených vřetenitými a/nebo epiteloidními buňkami. Dle některých autorů vycházejí pravděpodobně z progenitorové buňky diferencující se směrem ke Cajalovým intersticiálním buňkám. Tyto nádory zahrnují celé spektrum biologického chování, od prakticky zcela benigních až po vysoce maligní tumory [1,2]. První zmínky o nádorech žaludku vycházejících z leiomyoidních buněk pochází z roku 1960. Termín GIST použili poprvé Mazur s Clarkem v roce 1983. Zásadní zlom ve studiu GISTů nastal v roce 1998, kdy byla v jeho nádorových buňkách zjištěna exprese transmembránového tyrozinkinázového proteinu KIT [3,4,5]. KIT protein (označovaný také jako CD 117) je buněčný transmembránový receptor, jehož intracelulární komponenta má tyrosin-kinázovou aktivitu a je kódovaný proto-onkogenem c-kit. Většina GISTů (80–95 %) je tzv. c-kit pozitivních (CD117+). Přirozeným ligandem receptoru je růstový faktor (stem cell factor, SCF). Navázaní ligandu na receptor spouští sérii buněčných procesů včetně proliferace, buněčné migrace nebo diferenciace. GISTy vznikají mutací proto-onkogenu c-kit, která vede k trvalé aktivaci receptoru i v nepřítomnosti jeho ligandu [6,7]. Mezníkem v terapii GISTů, které jsou chemo - i radiorezistentní, se stal rok 2002, kdy ve Spojených státech Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválil imatinib mesylát (Glivec®) k léčbě gastrointestinálních stromálních tumorů [8]. Jde o kompetitivní inhibitor KIT receptoru, který po navázání blokuje buněčnou proliferaci. V následujících letech byly odhaleny mutace i v dalších genech (např. mutace v genu PDGFRA), které představují alternativní možnosti onkogeneze stromálních tumorů a zřejmě tak vysvětlují, proč jsou některé GISTy i tzv. c-kit negativní. Až 35 % těchto c-kit negativních GISTů vykazuje mutace v genu PDGFRA [9].
GISTy jsou poměrně vzácné nádory, incidence se pohybuje kolem 14−20 případů na 1 milion obyvatel [10]. V ČR jde ročně přibližně o 150 nových případů. Medián výskytu je 62−63 let, přibližně stejně často postihuje muže i ženy [11]. Tři čtvrtiny pacientů mají v době stanovení diagnózy vyjádřeny klinické příznaky. Nejčastěji jsou to bolesti břicha, projevy obstrukce, chronická anemizace nebo akutní krvácení. Klinická symptomatologie ale může být velmi různorodá podle lokalizace tumoru, jeho velikosti či vztahu k okolí [12]. Nejčastěji nacházíme GISTy žaludku (60 %), následuje tenké střevo (20–30 %), dvanáctník (<5 %), tlusté střevo a konečník (5–10 %) a jícen (<5 %). Vzdálené metastázy nejčastěji nacházíme v játrech, dutině břišní (peritoneum, omentum), výjimečně v kostech nebo kůži a zcela raritně v lymfatických uzlinách a plicích [1,13].
K diagnostice využíváme konvenčních zobrazovacích metod. Standardem je CT, endoskopie a v případě podslizničních patologií má velký význam endosonografie [14]. Specifické sérové markery neexistují. V případě diagnostických rozpaků nebo tam, kde by byla indikována primární léčba imatinibem, je nezbytná histologická verifikace. Doporučována je core-cut biopsie, tenkojehlová biopsie (fine needle biopsy) zpravidla neposkytuje dostatek materiálu ke stanovení míry rizika maligního chování (tzv. maligní potenciál). V případě GISTů žaludku by měla být preferována biopsie navigovaná endosonograficky, perkutánní biopsie je spojena s vyšším rizikem krvácení z tumoru a peritoneální diseminace [8]. V současné době není známo kritérium, které by umožňovalo jednoznačně vyloučit možnost maligního chování, je tedy nutné každý nádor považovat za potenciálně maligní. Na NIH consensus konferenci v roce 2001 byla stanovena morfologická kritéria, na jejichž základě se stanovuje riziko agresivního chování GIST (Tab. 1). V roce 2006 byla navržena nová kritéria zahrnující lokalizaci primárního nádoru. Tato kritéria jsou založena na rozsáhlých studiích Miettinena a zohledňují odlišné chování GISTů především žaludku a tenkého střeva (Tab. 2). GISTy tenkého střeva se chovají agresivněji než stejně velké GISTy žaludku, především pokud se jedná v obou lokalizacích o nádory větší než 5 cm s nízkou mitotickou aktivitou. Příčina odlišného biologického chování srovnatelných GISTů žaludku a tenkého střeva není známá [1,15].
Tab. 1. Prognostická kritéria GIST z roku 2001 Tab. 1: Prognostic criteria of GIST, 2001 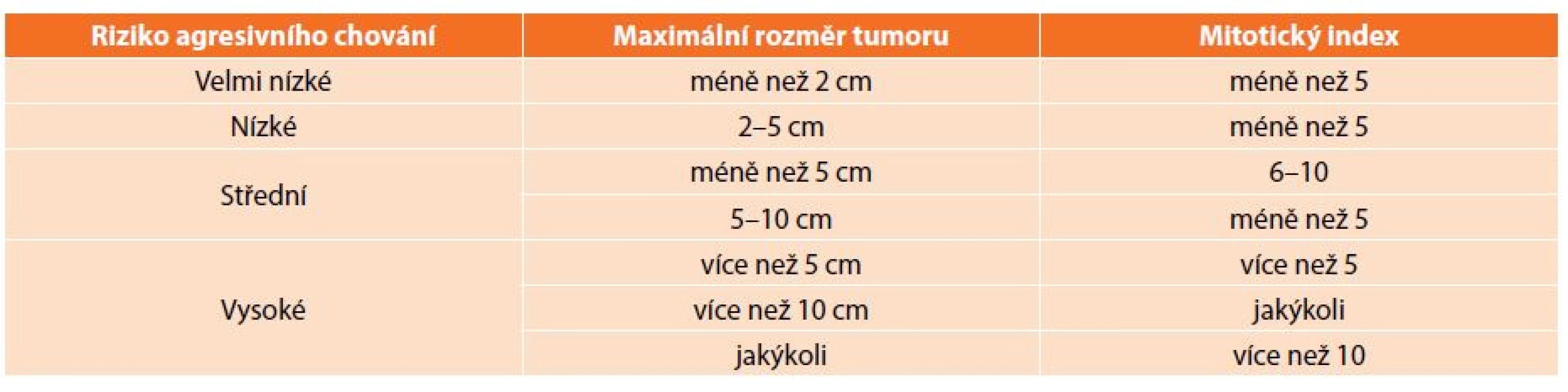
Tab. 2. Prognostická kritéria GIST dle Miettinena a spol. z roku 2006 Tab. 2: Prognostic criteria of GIST by Miettinen et al., 2006 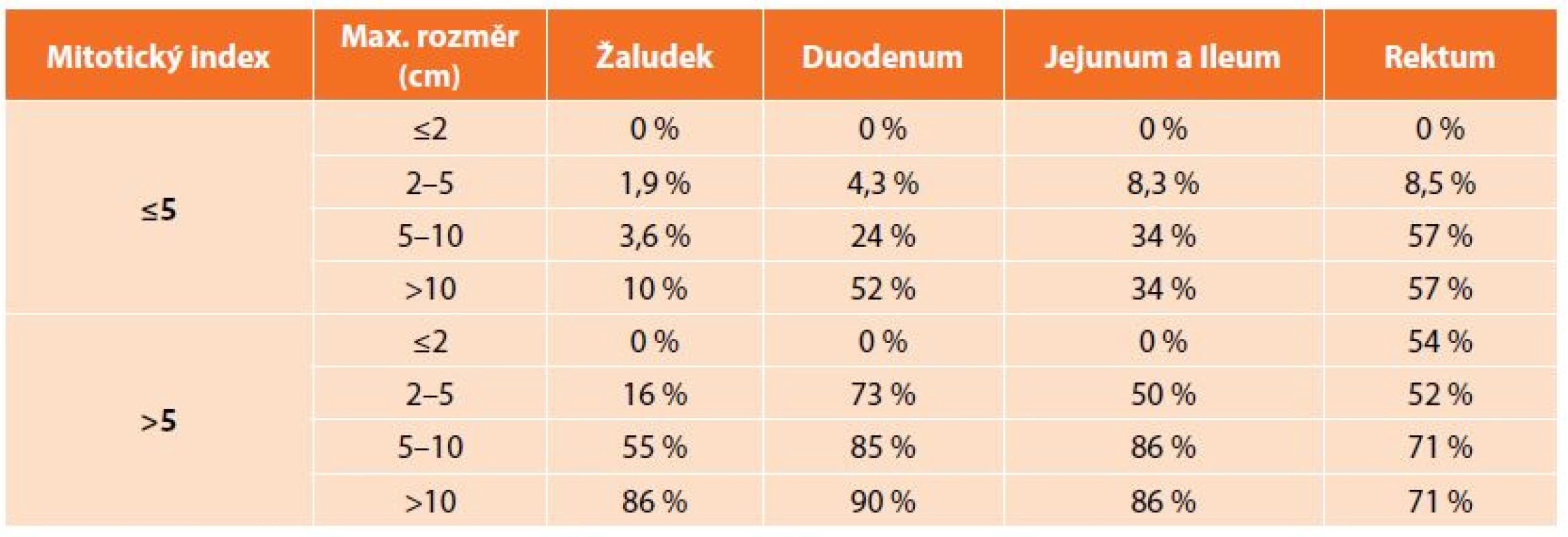
Léčba GISTů záleží na stadiu nemoci. U resekabilních nádorů je indikováno chirurgické řešení, jedinou potenciálně kurativní metodou je R0 resekce. Výkony mohou být velmi různorodé, od limitovaných resekcí až po extenzivní výkony typu hemipankreatoduodenektomií nebo amputací rekta. Obecnou snahou by však mělo být se těmto multiviscerálním výkonům vyhnout. Ve většině případů jsou plně dostačující segmentální či klínovité resekce s mikroksopicky negativními okraji [2,4,8]. Vždy však platí, že výkon závisí na lokalizaci tumoru, jeho velikosti a vztahu k okolí [12,16]. V literatuře jsou popsány i soubory pacientů, u kterých byla provedena endoskopická resekce drobných incidentálních tumorů [12]. Jako elektivní se tento způsob řešení GISTů jeví poněkud kontroverzní a někteří autoři připouštějí v těchto situacích (nádory do 1−2 cm v lokalizacích s nízkou pravděpodobností maligního potenciálu, tedy zejména žaludek) jako alternativu k resekci vyčkávací strategii s bedlivým „follow up“ pacienta [2,16]. V případě chirurgického výkonu je nezbytné zabránit ruptuře nádoru (riziko peritoneální diseminace). Role laparoskopie v chirurgické léčbě GIST je předmětem diskuzí. Chybí prospektivní studie na toto téma, četné kazuistiky či malé retrospektivní analýzy však dokazují, že laparoskopický přístup je možný. Platí nicméně všeobecná shoda, že laparoskopie by měla být vyhrazena pro nádory v příznivých lokalizacích (např. přední stěna žaludku, jejunum, ileum) a menších rozměrů. I při laparoskopickém výkonu je nezbytné zabránit ruptuře kapsuly nádoru [8,12,16]. Vzhledem k tomu, že GISTy prakticky nikdy nemetastazují lymfogenně, není provádění regionálních lymfadenektomií nutné [4,8]. Postavení chirurgie u metastatického onemocnění je předmětem diskuzí. V roce 2013 proběhla retrospektivní analýza hodnotící efekt iniciálního cytoredukčního operačního výkonu (debulking více než 75 % nádorové masy) s následnou léčbou imatinibem versus iniciální léčba imatinibem (s nebo bez následné chirurgické léčby) u pacientů s diseminovaným GISTem. Iniciální chirurgická léčba nevedla k prodloužení doby do progrese onemocnění (progression-free survival, PFS) ani celkového přežití (overall survival, OS) a nezvýšila ani počet následných kurabilních chirurgických výkonů. Zastánci iniciálního debulkingu poukazují na prokázaný vztah mezi velikostí nádorové masy a PFS a OS, přičemž platí, že čím větší objem nádoru, tím horší prognóza [17]. Autorům zmiňované studie se podařilo tento vztah potvrdit, ale zjistili, že terapeutický výsledek predikuje velikost nádorové hmoty po ukončení iniciální léčby imatinibem, nikoli v době jejího zahájení. Provedení elektivní cytoredukční operace před léčbou imatinibem proto pravděpodobně nepřináší pacientům s metastatickým onemocněním žádný benefit a je lépe se jí vyhnout. Tyto chirurgické výkony by měly být vyhrazeny pouze jako doplňující terapie pro pacienty s biologicky příznivými nádory (posuzováno příznivým efektem předchozí biologické léčby) nebo jako „salvage“ terapie pro pacienty progredující na terapii imatinibem (1. linie biologické léčby), u nichž může provedený debulking oddálit na blíže nespecifikovanou dobu nutnost nasazení 2. linie biologické léčby (sunitinib malát) [18,19].
Lokoregionálně neresekabilní a metastazující nádory jsou indikovány primárně k biologické léčbě imatinib mesylátem. Mnoho celosvětově provedených studií v posledních více než deseti letech potvrdilo efekt léčby imatinibem. V několika studiích fáze II a III bylo potvrzeno významné zlepšení celkového přežití i PFS u pacientů s neresekabilním či metastazujícím onemocněním léčeným imatinibem. Bezpečná a účinná dávka byla stanovena na 400 mg imatinib mesylátu denně, v indikovaných případech (progrese na dávce 400 mg/denně) lze dávku eskalovat až na 800 mg denně [8,18].
Neoadjuvantní podání imatinibu je možné u pacientů s lokálně pokročilým potenciálně resekabilním primárním nádorem a/nebo u pacientů s potenciálně resekabilním lokálním relapsem nebo resekabilním metastatickým onemocněním. V souvislosti s preoperační léčbou proběhlo jen pár prospektivních studií, které potvrdily, že neoadjuvantní léčba v důsledku zmenšení nádoru zvyšuje resekabilitu a snižuje pooperační morbiditu. V jedné ze studií byla pozorována redukce nádorové hmoty po neoadjuvantním podání imatinibu v průměru o 34 % [20]. Jiná studie potvrdila částečnou odpověď po preoperační léčbě imatinibem u 60 % pacientů, u 36 % pacientů s původně neresekabilním onemocněním byl efekt neoadjuvantní léčby takový, že mohli podstoupit resekční výkon v rozsahu R0 resekce. Průměrná délka neoadjuvantní léčby byla přibližně 7 měsíců a všichni pacienti pokračovali v pooperační léčbě imatinibem [21]. Výsledky doposud zveřejněných studií hodnotící preoperační léčbu imatinibem naznačují pozitivní efekt i bezpečnost tohoto způsobu podání. Přesto by indikace k neoadjuvantnímu podání s cílem downstagingu nádoru s následným kurativním chirurgickým řešením měly být posuzovány zcela individuálně [8].
Epidemiologii, léčbu a její výsledky u pacientů s GISTem v ČR a na Slovensku monitoruje klinický registr, do kterého je zapojeno 13 klinických center z obou zemí a je volně dostupný na internetové adrese www.gist.registry.cz.
Diskuze
Uvedení imatinibu znamenalo průlom v léčbě pacientů s GIST, který nemá v onkologii posledních let obdoby. I přes tento obrovský úspěch biologické léčby a předpokládané další zlepšení farmakoterapie z důvodu pokračujícího výzkumu a hledání nových možností bioterapie má chirurgická léčba stále nezastupitelné místo v terapii tohoto onemocnění. V této fázi se jeví jako klíčová především důsledná primární stratifikace pacientů a na základě toho potom zvolení nejvýhodnější léčebné strategie. Primárně dobře i hraničně resekabilní nádory jsou indikovány k primární chirurgické léčbě s následnou eventuální adjuvantní léčbou imatinibem nebo sledováním. Naopak kandidáty na iniciální cílenou terapii jsou pacienti iniciálně neresekabilní nebo inoperabilní. Specifickou skupinou pacientů z pohledu chirurgie jsou pacienti s částečnou odpovědí na léčbu imatinibem (konverze z iniciálně neresekabilního na resekabilní onemocnění), nejednoznačné je postavení chirurgie u mnohočetného metastatického onemocnění. Lákavá myšlenka na zmenšení objemu nádorové hmoty s následným lepším efektem cílené léčby imatinibem v případě GIST neplatí. Bylo prokázáno, že celkový terapeutický výsledek predikuje velikost nádorové hmoty po ukončení iniciální léčby imatinibem, nikoli v době jejího zahájení, a že tedy elektivní cytoredukční výkon před léčbou imatinibem pravděpodobně nepřináší pacientům s metastatickým onemocněním žádný benefit. Otázkou je, jak z pohledu chirurgie přistupovat k pacientům s izolovaným metastatickým onemocněním, které vykazuje dobrou odpověď na iniciální léčbu imatinibem. Managment léčby GIST proto jednoznačně vyžaduje multidisciplinární přístup klinického onkologa, chirurga, patologa, eventuálně rentgenologa, a proto se domníváme, že pacienti by měli být směrováni do specializovaných onkologických center, která mají s komplexní léčbou tohoto onemocnění zkušenosti.
Závěr
Chirurgická léčba má i přes nepopiratelný úspěch biologické léčby nezastupitelné místo v terapii GIST. Diagnosticko-terapeutický přístup k pacientům s tímto onemocněním musí být komplexní. Preskripční omezení biologické léčby přímo nutí směrovat tyto pacienty do specializovaných center, kde by s výhodou měla být prováděna i léčba chirurgická.
Práce byla sepsána u příležitosti 80. výročí otevření Masarykovy léčebny – Domu útěchy v Brně 13. 1. 1935.
Práce podpořena MZ ČR – RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Lukáš Fiala
Okrouhlá 359/22
625 00 Brno
e-mail: lfiala@mou.cz
Zdroje
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006;130(10):1466–78.
2. Bednarski BK, Pisters PWT, Hunt KK. The role of surgery in the multidisciplinary management of patients with localized gastrointestinal stromal tumors. Expert Rev Anticancer Ther 2012;12 : 1069–78.
3. Martin JF, Bazin P, Feroldi J, et al. Intramural myoid tumor of the stomach. Microscopic considerations on 6 cases. Ann Anat Pathol 1960;5 : 484−97.
4. Páral J, Lochman P, Kalábová H, et al. GIST: Novodobé poznatky a léčebné modality. Rozhl Chir 2012;4 : 189−98.
5. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983;7 : 507−19.
6. Nishida T, Hirota S, Taniguchi M, et al. Familial gastrointestinal stromal tumours with germline mutation of the KIT gene. Nat Genet 1998;19 : 323−24.
7. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998;279 : 577−80.
8. von Mehren M, Benjamin RS, Bui MM, et al. NCCN Clinical Practice Guidelines in Oncology: Soft Tissue Sarcoma. Version 2, 2012. Dostupný z www: http://www.gistonline.it/Portali/1/Documents/NCCN Soft Tissue Sarcoma v.3.2012.pdf.
9. Heinrich MC, Corless CL, Duensing A, et al. PDGFRA activating mutations in gastrointestinal stromal tumors. Science 2003;299 : 708–10.
10. Nilsson B, Bumming P, Medis-Kindblom JM, et al. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era − a population-based study in western Sweden. Cancer 2005;103 : 821–9.
11. Miettinen M, Lasota J. Histopathology of Gastrointestinal Stromal Tumor. Journal of Surgical Oncology 2011;104 : 865–73.
12. Neuhaus SJ, Clark MA, Hayes AJ, et al. Surgery for Gastrointestinal stromal tumour in the post-imatinib era, ANZ J Surg 2005;75 : 165–72.
13. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002;33 : 459–65.
14. Cao H, Zhang Y, Wang M, et al. Prognostic analysis of patients with gastrointestinal stromal tumors: a single unit experience with surgical treatment of primary disease, Chinese Medical Journal 2010;123 : 131−6.
15. Miettinen M, Makhlouf HR, Sobin LH, et al. Gastrointestinal stromal tumors (GISTs) of the jejunum and ileum: a clinicopathologic, immunohistochemical and molecular genetic study of 906 cases prior to imatinib with longterm follow-up. Am J Surg Pathol 2006;30 : 477–89.
16. Wente MN, Büchler MW, Weitz J. Gastrointestinale Stromatumoren (GIST). Chirurgische Therapie, Chirurg 2008;79 : 638–43.
17. Blanke CD, Demetri GD, von Mehren M, et al. Long-term results from a randomized phase II trial of standard-versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol 2008;26 : 620–5.
18. Kocakova I, Kocak I, Spelda S, et al. Long term experience of one center with targeted therapies consisting of imatinib mesylate and sunitinib malate in patients with unresectable or metastatic KIT positive gastrointestinal stromal tumors. Bratislava Medical Journal 2015;4 : 218−21.
19. Raut PCh, Gronchi A. Cytoreductive Surgery in Advanced GIST: Timing is Everything, Ann Surg Oncol 2013;20 : 4059–60.
20. Fiore M, Palassini E, Fumagalli E, et al. Preoperative imatinib mesylate for unresectable or locally advanced primary gastrointestinal stromal tumors (GIST). Eur J Surg Oncol 2009;35 : 739−45.
21. Blesius A, Cassier PA, Bertucci F, et al. Neoadjuvant imatinib in patients with locally advanced non metastatic GIST in the prospective BFR14 trial. BMC Cancer 2011;11 : 72.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Koloproktologie v běhu časuČlánek Českí lekári na SlovenskuČlánek Zemřel docent Karel Dlabal
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2015 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Koloproktologie v běhu času
- Peroperační verifikace integrity kolorektální anastomózy
- Léčba gastrointestinálních stromálních tumorů – komplexní pohled chirurga
- Metastázy do pankreatu − diagnostika a možnosti radikální léčby, komplikace, přežívání
- Perspektiva pacientů operovaných pro sekundární peritonitidu
- Českí lekári na Slovensku
- Střevní volvulus způsobený požitím magnetických kuliček: neočekávané riziko u dětí
- Femoropopliteální žilní trombóza a pseudoaneuryzma popliteální tepny jako komplikace mnohočetné hereditární osteochondromatózy
- Recenze monografie Českí lekári na Slovensku II.
- Endometrióza apendixu s projevy akutní apendicitidy – kazuistika
- IBD pracovní dny 2015, Hořovice
- Zemřel docent Karel Dlabal
- XXIV. Jarní setkání Loket 2015 – up-to-date v diagnostice a léčbě malignit GIT
- Using the new hemostatic gelatin GELITA-SPON RAPID3 to treat parenchymatous organs – a clinical observation
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metastázy do pankreatu − diagnostika a možnosti radikální léčby, komplikace, přežívání
- Endometrióza apendixu s projevy akutní apendicitidy – kazuistika
- Střevní volvulus způsobený požitím magnetických kuliček: neočekávané riziko u dětí
- Femoropopliteální žilní trombóza a pseudoaneuryzma popliteální tepny jako komplikace mnohočetné hereditární osteochondromatózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



