ERAS v kolorektální chirurgii – opomíjená přednemocniční část
ERAS in colorectal surgery – neglected preadmission items
The Enhanced Recovery After Surgery (ERAS) concept is a complex of strategies intended to reduce the perioperative stress response and achieve faster postoperative convalescence and rapid recovery of normal physiological functions. Adherence to ERAS should reduce the length of stay and postoperative complications, and it should improve the physical condition of the patient after dimission. This article is focused on those ERAS guidelines that apply to preadmission care.
Keywords:
rehabilitation – ERAS – preoperative care
Autori:
Z. Adamová 1; R. Slováček 1; G. Romanová 2
Pôsobisko autorov:
Chirurgické oddělení, Vsetínská nemocnice, a. s.
1; Oddělení klinické hematologie, Fakultní nemocnice Brno
2
Vyšlo v časopise:
Rozhl. Chir., 2019, roč. 98, č. 9, s. 345-349.
Kategória:
Souhrnné sdělení
doi:
https://doi.org/10.33699/PIS.2019.98.9.345–349
Súhrn
Koncept ERAS (Enhanced Recovery After Surgery) představuje soubor opatření, jejichž cílem je snížit perioperační stres, urychlit pooperační rehabilitaci a časně obnovit fyziologické funkce organismu. Dodržování tohoto přístupu má za cíl zkrátit délku hospitalizace, snížit pooperační komplikace, zlepšit celkovou kondici pacienta po propuštění z nemocnice. Tento článek se zabývá těmi doporučeními, která se týkají přednemocniční péče.
Klíčová slova:
ERAS – předoperační příprava – rehabilitace
Úvod
Období mezi stanovením diagnózy, stagingem onemocnění a projednáním na indikačním onkologickém semináři je pro pacienta značně stresující a většinou nevyužívané k předoperační přípravě. Nejpozději při stanovení termínu operace bychom měli pacientovi nejen vysvětlit plánovaný postup, zorganizovat předoperační vyšetření, ale zaměřit se i na ostatní počáteční kapitoly ERAS protokolu. V následujícím textu se chceme věnovat předoperační přípravě z pohledu koncepce ERAS (Enhanced Recovery After Surgery). Společnost ERAS, která se již několik desetiletí zabývá klinickými postupy, které by měly přispět k urychlenému zotavení pacientů po operaci, definovala celý soubor doporučení, jak pacienta co nejlépe připravit k výkonu a provést perioperačním obdobím. Doporučení pro kolorektální chirurgii vyšla již v roce 2005, poslední aktualizace je z roku 2018 [1]. Cílem je zkrátit dobu hospitalizace, snížit počty komplikací.
ERAS doporučení se týkají zejména chirurgů a anesteziologů. Na jejich přednemocniční části by se mohli/měli podílet i praktičtí lékaři, stomické sestry, onkologové, hematologové. Vzhledem k tomu, že chirurgové jsou vedoucími operačních týmů, domníváme se, že je nutné, abychom dohlédli na řádné dodržování celého protokolu. Nemyslíme tím, že by všechny postupy měly být realizovány v chirurgické ambulanci, ale měli bychom vědět, jestli jsou nastavená pravidla a postupy správně dodržovány.
I. Poučení pacienta
Člověk se většinou nejvíce bojí neznámého. Proto by pacient měl vědět, co jej v nemocnici čeká, jaký výkon je v plánu a jaký pooperační průběh lze očekávat. Pokud je zvažována stomie, měl by již předem tušit, co to pro něj bude obnášet. Optimálně by měl operaci s plánovanou stomií předcházet edukační pohovor se stomickou sestrou, který je doplněn praktickým nácvikem manipulace se stomickými pomůckami. Psychické rozpoložení pacienta má nezanedbatelný vliv na pooperační výsledky, zejména na délku hospitalizace a počty ranných infekcí. Studií na toto téma není mnoho a zahrnují většinou jen malé počty pacientů, nicméně jejich výsledky se prozatím shodují [2−7]. Pokud to stav pacienta vyžaduje, měl by být odeslán k psychologovi či psychiatrovi. Pro některé pacienty může být vhodný předpis antidepresiv [8,9].
II. Předoperační optimalizace celkového stavu pacienta
Stabilizace chronických chorob, jako jsou srdeční, plicní, renální onemocnění, hypertenze a cukrovka, je v rukou praktického lékaře či jednotlivých specialistů. Pacienti, kteří užívají perorální antikoagulační léčbu, jsou převáděni na nízkomolekulární heparin, diabetici II. typu z perorálních antidiabetik na krátkodobý inzulin. Blíže se této problematice věnuje např. kolektiv autorů z Hradce Králové [10].
Před operací je vhodné se zbavit i škodlivých návyků, zejména kouření a pravidelné konzumace alkoholu. Pokud si pacient dokáže odříct cigarety, je nutné, aby tak učinil minimálně 4−8 týdnů před operací, aby se mohl projevit příznivý efekt na dýchací cesty a hojení ran [11,12]. Když tak učiní v době kratší než 4 týdny před operací, není jisté, zda se dostaví kýžený výsledek, resp. dle některých prací je vliv právě opačný pro přechodné zvýšení produkce hlenu. Prakticky tedy z ukončení kouření mohou profitovat hlavně pacienti s plánovanou neoadjuvantní léčbou.
Pravidelná konzumace alkoholu (studie počítají s denním příjmem 50 ml 40% alkoholu, 150 ml 13% vína či 500 ml 4% piva) zvyšuje riziko pooperačních komplikací, zejména infekčních a syndromu z odnětí [13].
III. Prehabilitace
Prehabilitace je proces posílení funkční kapacity jedince, což mu umožňuje zvládnout stresovou událost. Filozofie prehabilitace vychází z toho, že operace představuje pro organismus velkou zátěž, zlepšení celkové kondice před přijetím do nemocnice by mělo zlepšit operační výsledky, snížit pooperační komplikace. Svalovina představuje více než 50 % bílkovin lidského těla, současně představuje nouzový rezervoár, ze kterého tělo může čerpat při stresu, jako je operace. Cvičení stimuluje syntézu bílkovin ve svalové tkáni a současně potlačuje katabolismus (za předpokladu adekvátního příjmu bílkovin). Dle kanadské studie se aerobním a rezistenčním cvičením kombinovaným s bílkovinnými doplňky sice nepodařilo snížit délku hospitalizace, ale po 8 týdnech po operaci byla výkonnost 80 % pacientů zařazených do prehabilitačního programu stejná jako před operací, u kontrolní skupiny toho bylo dosaženo pouze u 40 %[14]. Literatura na téma prehabilitace se rychle rozrůstá. Dle některých autorů dochází ke snížení počtu komplikací a zkrácení doby hospitalizace [15,16]. Dle letos publikované metaanalýzy zabývající se dopadem prehabilitace u pacientů po větších abdominálních výkonech (zahrnuto celkem 442 pacientů z osmi studií) došlo k redukci plicních komplikací (p=0,001), snížení pooperačních komplikací (p=0,01). Doba hospitalizace se ale nezkrátila [17]. Recentní práce z Annals of Surgery popisuje dokonce prodloužení doby přežití bez nemoci (DFS – disease free survival, p=0,044 )[18]. Jiné zdroje jsou kritičtější, poukazují na nesourodé metody měření výkonnosti, cvičení, ochotu ke spolupráci jednotlivých pacientů, ne zcela přesvědčivé výstupy [19−22]. Pokud chceme cvičení přesně měřit, pak studie bývá náročná, zkoumaná skupina malá a do praxe jsou výsledky špatně převoditelné, naopak pokud pouze doporučíme pacientům zvýšenou fyzickou aktivitu, hodnocení není možné. Nicméně žádná studie neuvádí, že by zvýšená aktivita před operací měla negativní dopad, proto bychom pravidelné cvičení odpovídající schopnostem jednotlivých pacientů měli doporučovat.
IV. Nutriční podpora
Pokud má pacient v důsledku hubnutí před operací snížené rezervy bílkovin, vitaminů, minerálních látek, má vyšší riziko komplikací, prodloužení doby hospitalizace. Současně u onkologických pacientů znamenají pooperační komplikace i oddálení adjuvantní léčby, což může mít vliv na dobu do progrese nádoru, celkové přežití.
Na malnutrici myslíme zejména, pokud pacient uvádí, že v poslední době zhubl. Ztráta hmotnosti o více než 10 % za 3−6 měsíců signalizuje, že je třeba se problémem vážně zabývat [19]. Nelze to však aplikovat jako jediné měřítko, pokud pacient retinuje tekutiny či dochází pouze ke ztrátě svalové hmoty, nemusí se váha výrazněji změnit [24]. Přitom sarkopenie zvyšuje riziko komplikací (je určitelná např. z CT, které je u těchto pacientů indikováno z diagnostických důvodů, avšak k měření svalové hmoty a viscerálního tuku často v praxi využíváno není). Dalším orientačním parametrem je BMI. Z laboratorních hodnot se k posouzení stavu výživy stanovuje hladina albuminu. Vhodné je s pacientem vyplnit nutriční screeningový test, Tomíška [24] doporučuje NRS 2002 (Tab. 1). Na jeho základě lze rozlišit pacienty s nízkým nutričním rizikem, u kterých není třeba dalších opatření, a ty, kteří získají více než 3 body, vyžadující další došetření v nutriční ambulanci. Při těžké malnutrici profituje pacient z odkladu operace (pokud je to tedy možné) a nutriční přípravy po dobu 1−2 týdnů, nejčastěji formou sippingu. Cílem není snížit nárůst hmotnosti, ale pouze snížit katabolismus.
Tab. 1. Nutritional risk screening NRS 2002 before surgery
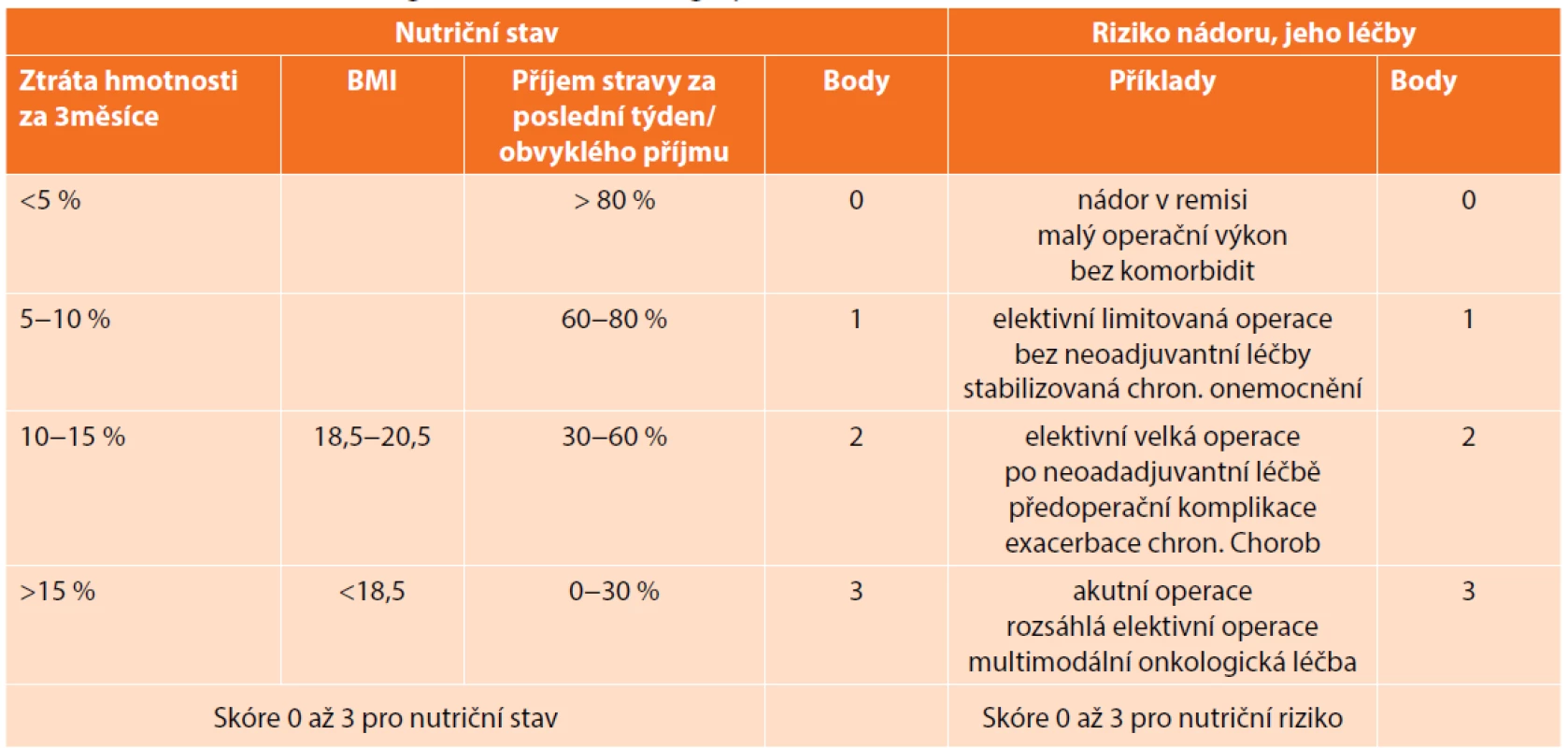
V ERAS doporučeních se uvádí perorální suplementace živin (bez další specifikace), v indikovaných případech doplněná o parenterální výživu. V poslední době přibývá dat, dle kterých bychom u pacienta před velkou operací na zažívacím traktu měli doporučovat imunomodulační nutriční přípravky. Metaanalýza z roku 2011 zahrnující 2730 pacientů konstatuje, že předoperačně podávané imunomodulační přípravky snižují celkový počet komplikací, zejména infekčních, zkracují dobu hospitalizace [25]. Moya předložil v roce 2016 srovnání běžných a imunomodulačních preparátů u pacientů po resekci kolorekta léčených dle ERAS protokolu. Popisuje snížení celkového počtu komplikací, zejména infekčních (p<0,0007) [26]. Další práce zahrnující 3375 kolorektálních pacientů z USA uvádí zkrácení doby hospitalizace (p=0,05) u těch, kteří měli doporučeno třikrát denně popíjet definované roztoky po dobu pěti dní před operací [27]. Velká metaanalýza z roku 2018, která hodnotila vliv pooperačně podávaných imunopreparátů u kolorektálních pacientů, dokumentuje snížení počtu komplikací, zkrácení hospitalizace [28]. Obdobné výsledky přináší i metaanalýza zaměřená na podávání této výživy pacientům po operaci na horní části zažívacího traktu – snížení infekčních komplikací (p=0,009) a zkrácení délky hospitalizace (p<0,00001), ovšem bez vlivu na závažné komplikace v podobě anastomotického leaku [29].
Od ostatních preparátů určených k sippingu se imunomodulační preparáty liší vyšším obsahem argininu a omega 3 mastných kyselin (n-3 PUFA, poly-unsaturated fatty acids), základní živiny a kalorická hodnota se ve většině případů od běžných preparátů neliší. Arginin je zapotřebí pro normální funkci lymfocytů. Protože krátce po operaci dojde ke zmnožení nezralých buněk myeloidního původu (exprimují arginázu), zvýší se metabolismus argininu způsobený arginázou, což vede k jeho nedostatku a následnému snížení funkce T lymfocytů a imunosupresi. Omega 3 nenasycené mastné kyseliny, jejichž přirozeným zdrojem jsou zejména mořské ryby, jsou další důležitou složkou stravy. Jsou inkorporovány do buněčných membrán a v případě potřeby se stávají zdrojem pro lipidové mediátory. Pokud jsou v membráně obsaženy zejména n-6 PUFA (obsažené ve slunečnicovém, sójovém a kukuřičném oleji), pak vznikají silně prozánětlivé prostaglandiny, tromboxany a leukotrieny, pokud dominují n-3 PUFA, vznikají eikosanoidy s podstatně slabším prozánětlivým působením, s antiproliferativním účinkem. V současné době jsou na trhu tyto imunomodulační preparáty: Oral Impact, Prosure, Supportan, Forticare [24].
Dále může pacient profitovat ze suplementace antioxidačních látek, jako jsou vitaminy C, E, zinek a selen. Zinek i selen jsou důležité pro adekvátní imunitní odpověď, zinek je také nezbytný pro hojení ran. Zájemci o podrobnější informace je najdou v recentní monografii Výživa onkologických pacientů docenta M. Tomíšky [24].
V. Korekce anémie
Anémie znamená snížení cirkulujících erytrocytů, pokles hematokritu a koncentrace hemoglobinu v krvi. Za spodní hranici normy se považuje hemoglobin 120 g/l u žen a 130−135 g/l u mužů. Nicméně při perioperačním krvácení dochází k rychlejšímu poklesu hemoglobinu u žen, proto z praktických důvodů může být za cílovou hladinu pro obě pohlaví považován vzestup nad 130 g/l [30]. Anémie se vyskytuje přibližně u 20 % evropské populace. Pacienti s anémií mají vyšší pooperační mortalitu, vyšší pravděpodobnost nutnosti přijetí na jednotku intenzivní péče a vyžadují delší hospitalizaci [31−33]. Dalším důvodem k aktivnímu řešení předoperační anémie je snaha vyhnout se krevním transfuzím pro negativní dopad na progresi onkologického onemocnění [34].
U pacientů s kolorektálním karcinomem je nejčastější sideropenická anémie, často kombinovaná s anémií chronických chorob. Pacienti ani nemusejí být anemičtí, ale mohou trpět nedostatkem železa, které není jen nezbytnou součástí hemoglobinu, ale i myoglobinu, je nutné pro správnou funkci mitochondrií, buněčnou imunitu. Množství zásobního železa můžeme posuzovat dle hladin feritinu. Pokud je jeho hladina <30 μg/l, jedná se o jednoznačnou známku deficitu železa. Je třeba pamatovat na to, že feritin je také proteinem akutní fáze, tj. zohlednit, zda jsou přítomny další známky zánětu či nikoliv. V případě, že CRP je vyšší než 5 mg/l a saturace transferinu je nižší než 20 %, je i feritin <100 μg/l indikátorem nedostatku železa.
Suplementovat železo je možné perorálně, k dosažení cíleného efektu je zapotřebí 4–6 týdnů, i když dle Liddera et al. i 14denní podávání perorálního železa snížilo potřebu transfuzí u pacientů po resekci tračníku [35].
V případě chronického zánětu se v játrech syntetizuje větší množství proteinu hepcidinu, který inhibuje vstřebávání železa ze zažívacího traktu. Při jeho zvýšení se železo ze střeva nevstřebává, a tudíž perorální preparáty nejsou účinné. Nejen v tomto případě je alternativou intravenózní podání železa. Parenterální podání je taktéž výhodné proto, že efekt se dostaví podstatně dříve. V současné době jsou na trhu preparáty nové generace, které jsou bezpečné a i jednorázová infuze může doplnit zásoby železa. Pokud je pacient indikován k neoadjuvantní terapii nebo z nějakého jiného důvodu je termín operace stanoven až za 4−6 týdnů, můžeme volit tabletovou formu železa (pokud pacient netrpí poruchou vstřebávání p. o. preparátů železa). V ostatních případech by mělo být preferovanou možností parenterální podání. Pro většinu pacientů by měla být dostatečná celková dávka 1000−1500 mg. Po její aplikaci se většina cítí lépe již za 3 dny, maximální efekt na hladinu hemoglobinu se dostaví za 2−4 týdny [30]. Asi nejvíce důkazů je k dispozici o pozitivních účincích železité karboxymaltózy, přípravku Ferinject. Jedná se o důkazy z hlediska bezpečnosti podávání, ale především z hlediska účinnosti a pozitivního vlivu na zdraví nemocných [28]. Ferinject však není plně hrazen z veřejného zdravotního pojištění. Pro pacienta levnější alternativou je Ferlecit. Vzhledem k tomu, že u onkologických pacientů se snažíme o co nejčasnější termín operace, mělo by být intravenózní podání železa jednoznačně preferovanou, ale domníváme se, že v reálné praxi málo rozšířenou alternativou. Kontraindikací k jeho podání je akutně probíhající infekce, protože v tom případě je jednak využíváno bakteriemi a současně potencuje oxidační stres (železnatý ion se podílí na reakci, při které vzniká hydroxylový radikál, který poškozuje organismus) [37].
V bezkrevné medicíně je využíván i erytropoetin, který ale není u onkologicky nemocných doporučován.
Závěr
Zde jsme se věnovali jen první kapitole ERAS doporučení, další se zabývají předoperační medikací, profylaktickým podáním antibiotik, perioperační náloží tekutin, miniinvazivními chirurgickými postupy, časnou pooperační výživou, rehabilitací apod. Je pravdou, že adherence k těmto doporučením nebývá na jednotlivých pracovištích příliš vysoká, ať už z organizačních důvodů či z jisté nedůvěry [38−39].
V tomto textu uvedený soubor opatření představuje jednoduché kroky, které mohou být učiněny již před definitivním stanovením diagnózy, jsou nezatěžující a současně mohou zlepšit operační výsledky. Důležitá je dobře fungující mezioborová spolupráce, jejímž cílem je co nejrychlejší optimalizace celkového stavu pacienta před operací, jak po stránce psychické a fyzické kondice, tak výživy a chronických chorob.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Zuzana Adamová
Nemocniční 955
755 01 Vsetín
e-mail: adamovaz@gmail.com
Zdroje
- Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations: 2018. World J Surg. 2019;43 : 659–5. doi:10.1007/s00268-018-4844-y.
- Padgett DA, Marucha PT, Sheridan JF. Restraint stress slows cutaneous wound healing in mice. Brain Behav Immun. 1998;12 : 64–73. doi.org/10.1006/brbi.1997.0512.
- Kiecolt-Glaser JK, Loving TJ, Stowell JR, et al. Hostile marital interactions, proinflammatory cytokine production, and wound healing. Arch Gen Psychiatry 2005;62 : 1377–84. doi:10.1001/archpsyc.62.12.1377.
- Vitalo A, Fricchione J, Casali M, et al. Nest making and oxytocin comparably promote wound healing in isolation reared rats. PLoS ONE 2009;4:e5523. doi:10.1371/journal.pone.000552.
- Detillion CE, Craft TK, Glasper ER, et al. Social facilitation of wound healing. Psychoneuroendocrinology 2004;29 : 1004–11. doi:10.1016/j.psyneuen.2003.10.003.
- Adamová Z, Adam Z. Psychologické aspekty v onkochirurgii. Rozhl Chir. 2019;98 : 308−11.
- Adamová Z, Adam Z. Vliv psychiky na hojení ran. Rozhl Chir. 2019;98.312−4.
- Farahani RM, Sadr K, Rad JS, et al. Fluoxetine enhances cutaneous wound healing in chronically stressed Wistar rats. Adv Skin Wound Care 2007;20 : 157–65. doi:10.1097/01.ASW.0000262710.59293.6b.
- Bláha J, Svobodová K, Kapounková Z. Therapeutical aspects of using citalopram in burns. Acta Chir Plast. 1999;41 : 25−32.
- Blažek M, Havel E, Bělobrádková E. Předoperační vyšetření a příprava chirurgického pacienta. Interní Med. 2012;14 : 422–8.
- Mills E, Eyawo O, Lockhart I, et al. Smoking cessation reduces postoperative complications: a systematic review and meta-analysis. Am J Med. 2011; 124(144–54):e148. doi:10.1016/j.amjmed.2010.09.013.
- Wong J, Lam DP, Abrishami A, et al. Short-term preoperative smoking cessation and postoperative complications: a systematic review and meta-analysis. Can J Anaesth. 2012;59 : 268–79. doi:10.1007/s12630-011-9652-x.
- Shabanzadeh DM, Sorensen LT. Alcohol consumption increases post-operative infection but not mortality: a systematic review and meta-analysis. Surg Infect. (Larchmt) 2015;16 : 657–68. doi:10.1089/sur.2015.009.
- Gillis C, Li C, Lee L, et al. Prehabilitation versus rehabilitation:a randomized control trial in patients undergoing colorectal resection for cancer. Anesthesiology 2014;121 : 937–47. doi:10.1097/ALN.0000000000000393.
- Kitahata Y, Hirono S, Kawai M, et al. Intensive perioperative rehabilitation improves surgical outcomes after pancreaticoduodenectomy. Langenbecks Arch Surg. 2018;403 : 711−8. doi:10.1007/s00423-018-1710-1.
- Gillis C, Buhler K, Bresee L, et al. Effects of nutritional prehabilitation, with and without exercise, on outcomes of patients who undergo colorectal surgery: A systematic review and meta-analysis. Gastroenterology 2018;155 : 391−410. doi:10.1053/j.gastro.2018.05.012.
- Heger P, Probst P, Wiskemann J. A systematic review and meta-analysis of physical exercise prehabilitation in major abdominal surgery (PROSPERO 2017 CRD42017080366). J Gastrointest Surg. 2019 on-line. doi: 10.1007/s11605-019-04287-w.
- Trépanier M, Minnella EM, Paradis T. Improved disease-free survival after prehabilitation for colorectal cancer surgery. Ann Surg. 2019;270 : 493–501. doi:10.1097/SLA.0000000000003465.
- Bolshinsky V, Li MH, Ismail H. Multimodal prehabilitation programs as a bundle of care in gastrointestinal cancer surgery: a systematic review. Dis Colon Rectum 2018;61 : 124−38. doi:10.1097/DCR.0000000000000987.
- Bruns ER, van den Heuvel B, Buskens CJ, et al. The effects of physical prehabilitation in elderly patients undergoing colorectal surgery: a systematic review. Colorectal Dis. 2016;18 : 267–77. doi:10.1111/codi.13429.
- Hijazi Y, Gondal U, Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg. 2017;39 : 156−62. doi:10.1016/j.ijsu.2017.01.111.
- Luther A, Gabriel J, Watson RP, et al. The impact of total body prehabilitation on post-operative outcomes after major abdominal surgery: A systematic review. World J Surg. 2018;42 : 2781−91. doi:10.1007/s00268-018-4569-y.
- Bozzetti F, Gianotti L, Braga M, et al. Postoperative complications in gastrointestinal cancer patients: the joint role of the nutritional status and the nutritional support. Clin Nutr. 2007;26 : 698–709.
- Tomíška M. Výživa onkologických pacientů. Mladá fronta, Praha 2018 : 743.
- Cerantola Y, Hubner M, Grass F, et al. Immunonutrition in gastrointestinal surgery. The British Journal of Surgery 2011;98 : 37–48.
- Moya P, Soriano-Irigaray L, Ramirez JM, et al. Perioperative standard oral nutrition supplements versus immunonutrition in patients undergoing colorectal resection in an enhanced recovery (ERAS) protocol: a multicenter randomized clinical trial (SONVI study) Medicine (Baltimore) 2016;95:e3704. doi:10.1097/MD.0000000000003704.
- Thornblade LW, Varghese TK Jr., Shi X, et al. Preoperative immunonutrition and elective colorectal resection outcomes. Dis Colon Rectum. 2017;60 : 68–75. doi:10.1097/DCR.0000000000000740.
- Xu J, Sun X, Xin Q, et al. Effect of immunonutrition on colorectal cancer patients undergoing surgery: a meta-analysis. Int J Colorectal Dis. 2018;33 : 273−83. doi:10.1007/s00384-017-2958-6.
- Wong CS, Aly EH. The effects of enteral immunonutrition in upper gastrointestinal surgery: A systematic review and meta-analysis.Int J Surg. 2016;29 : 137−50. doi:10.1016/j.ijsu.2016.03.043.
- Muñoz M, Acheson AG, Auerbach M. International consensus statement on the peri‐operative management of anaemia and iron deficiency. Anaesthesia 2017;72 : 233–47. doi:10.1111/anae.13773.
- Baron DM, Hochrieser H, Posch M. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. Br J Anaesth. 2014;113 : 416−23. doi:10.1093/bja/aeu098.
- Wu WC, Schifftner TL, Henderson WG, et al. Preoperative hematocrit levels and postoperative outcomes in older patients undergoing noncardiac surgery. J Am Med Assoc. 2007;297 : 2481–8.
- Musallam KM, Tamim HM, Richards T, et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. Lancet 2011;378 : 1396–407. doi:10.1016/S0140-6736(11)61381-0.
- Acheson AG, Brookes MJ, Spahn DR. Effects of allogeneic red blood cell transfusions on clinical outcomes in patients undergoing colorectal cancer surgery: a systematic review and meta-analysis. Ann Surg. 2012;256 : 235–44. doi:10.1097/SLA.0b013e31825b35d5.
- Lidder PG, Sanders G, Whitehead E. Pre-operative oral iron supplementation reduces blood transfusion in colorectal surgery – a prospective, randomised, controlled trial. Ann R Coll Surg Engl. 2007;89 : 418−21. doi.org/10.1308/003588407X183364.
- Češka R. Anémie a nedostatek železa v interní praxi: od gastroenterologie ke kardiologii a ještě dál. Vnitř Lék. 2014;60 : 1033−9.
- Ludwig H, Evstatiev R, Kornek G. Iron metabolism and iron supplementation in cancer patients. Wien Klin Wochenschr. 2015;127 : 907−19.
- Ryska O, Šerclová Z, Antoš F. Jak jsou dodržovány postupy moderní perioperační péče (Enhanced Recovery After Surgery) na chirurgických pracovištích v ČR – výsledky národní ankety. Rozhl Chir. 2013;92 : 435–432.
- Vymazal T, Kocián P, Přikryl P. ERAS v české nemocnici – utopie, nebo realita? Anest intenziv Med. 2018;29 : 317–321.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicínaČlánok vyšiel v časopise
Rozhledy v chirurgii

2019 Číslo 9
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
Najčítanejšie v tomto čísle
- Cizí tělesa v GIT u dětí
- Fyloidné nádory prsníka – retrospektívny prehľad 83 klinických prípadov
- ERAS v kolorektální chirurgii – opomíjená přednemocniční část
- Perkutánní endoskopická cékostomie v léčbě rekurentní střevní pseudoobstrukce − popis prvního výkonu v České republice
