-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Duktální karcinom in situ a rozsah chirurgického výkonu
Ductal carcinoma in situ and the extent of surgery
Introduction: Ductal carcinoma in situ (DCIS) is a very heterogenous disease. The incidence of DCIS has been increasing with the adoption of mammography screening. This opened new questions concerning surgical and adjuvant therapy.
Methods: We retrospectively observed the incidence of DCIS amongst the patients that underwent surgical resection in EUC clinic Zlín between 2017 and 2019. We also assessed the extent of breast surgery including interventions in axilla and the adjuvant therapy.
Results: There were 616 breast cancer patients, of whom 44 (7.1%) were diagnosed with DCIS. Breast-conserving surgery was performed in 35 (80%) patients. Lumpectomy alone was performed in 21 (47%) patients. Mastectomy was indicated primarily in 9 cases with additional two mastectomies performed to achieve clear margins. All sentinel nodes were negative.
Conclusion: Results confirmed, that the surgical therapy as well as radiotherapy and hormonal treatment are performed according to guidelines at our department. Proportion of sentinel node biopsy is remarkably higher, therefore an improvement in this area is our next goal.
Keywords:
DCIS – breast-conserving surgery − sentinel node − local recurrence
Autori: J. Gatěk 1,4
; V. Petrů 1; P. Kosáč 1; P. Vážan 2; M. Zábojníková 3; M. Ratajský 1; B. Dudešek 1; P. Holík 4; K. Lajmar 1; P. Jančík 1; J. Duben 1
Pôsobisko autorov: Chirurgické oddělení EUC Klinika Zlín 1; Cytologická laboratoř CGB Zlín 2; Onkologické oddělení KTNB Zlín 3; Univerzita Tomáše Bati ve Zlíně 4
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 4, s. 166-172.
Kategória: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.4.Súhrn
Úvod: Duktální karcinom prsu in situ (DCIS) je velmi heterogenní onemocnění. Od zavedení screeningového programu se incidence DCIS celosvětově zvyšuje. Narůstá jeho význam a objevují se nové otázky ve spojení s léčbou.
Metody: V retrospektivní studii jsme sledovali výskyt DCIS v souboru pacientů operovaných na chirurgickém oddělení EUC Kliniky Zlín v letech 2017 až 2019. Sledovali jsme rozsah výkonů na prsu a v axile včetně následné adjuvantní terapie.
Výsledky: V uvedeném období bylo operováno pro karcinom prsu 616 pacientů včetně 44 (7,1 %) s DCIS. Bylo provedeno 35 (80 %) prs záchovných výkonů a z toho 21 (47 %) bez výkonu v axile. Mastektomie jako primární výkon byla indikována 9×, prostá mastektomie s cílem zajistit volné okraje následovala 2×. Všechny vyšetřené sentinelové uzliny byly negativní.
Závěr: Výsledky potvrzují, že chirurgická terapie odpovídá současným doporučením, stejně jako radioterapie a hormonální terapie. Podíl biopsií sentinelové uzliny (SLN) je ale významně vyšší, a proto se v naší budoucí práci zaměříme na tuto oblast chirurgické péče.
Klíčová slova:
DCIS − prs záchovný výkon − sentinelová uzlina − lokální recidiva
Úvod
Incidence duktálního karcinomu in situ (DCIS) s rozvojem mamografického screeningového programu má významně vzrůstající tendenci. V USA dosahuje podíl DCIS u nově zjištěných nádorů prsu 20 % [1]. Podobný vývoj můžeme pozorovat v České republice. Před zavedením screeningového programu dosahovala u nás incidence DCIS 2 %. V současnosti dosahuje celorepublikově 7 % a stejný je i v naší sestavě (Graf 1 − UZIS).
Graf 1. Incidence DCIS v České republice
Graph 1: The incidence of DCIS in Czech Republic
Čistý DCIS neproniká přes bazální membránu, nemá schopnost vytvářet metastázy, takže prognóza onemocnění je dobrá. DCIS však často recidivuje. Počet recidiv dosahuje až 20 % a v polovině případů se bohužel jedná o invazivní karcinom, čímž se prognóza onemocnění zhoršuje. Worni uvádí, že za 12 roků sledování byly ipsilaterální recidivy diagnostikovány v 14,4 % a z toho invazivní forma karcinomu 7,7 % [2].
V chirurgickém léčení DCIS jsou postupně uplatňovány méně invazivní metody. Během 20 roků poklesl počet jednostranných mastektomií z 44,9 % na 19,3 %. Naopak lumpektomie s radioterapií je uplatňována ve zvyšující frekvenci a narůstá z 24,2 % na 46,8 %. Zvyšuje se také počet profylaktických mastektomií i oboustranných, zvláště u mladých žen. Na chirurgické výkony ve dvou třetinách případů navazuje adjuvantní radioterapie celého prsu, a u vybraných typů je také nasazována hormonální terapie. Současný trend je v zavádění miniinvazivních výkonů nejen na prsu, ale projevuje se i v axile. Disekce axilárních uzlin je postupně nahrazována biopsií sentinelové uzliny (SLNB) [3,2,4].
Přes vzrůstající incidenci DCIS jsou mlhavé informace o jeho původu, o dalším vývoji jednotlivých typů, a proto narůstá diskuze o přiměřenosti léčby, tak aby nedocházelo k nadléčení anebo naopak podléčení onemocnění, se všemi důsledky na kvalitu života pacientek [2,3,5].
V naší retrospektivní studii jsme sledovali podíl DCIS v našem souboru a rozsah chirurgických výkonů na prsu a v axile s následnou adjuvantní terapií.
Metody
V retrospektivní studii jsme hodnotili podíl a strukturu DCIS u pacientů léčených na EUC Klinice Zlín v období mezi roky 2017 až 2019 (Obr. 1). V sestavě jsme sledovali rozsah chirurgické terapie s ohledem na současné trendy léčení DCIS. Všichni pacienti, kteří byli operováni pro karcinom prsu včetně DCIS, byli předmětem jednání mezioborové komise. Komise stanovila u každého pacienta individuální léčebný plán a doporučila rozsah chirurgického výkonu na prsu i v axile. Před chirurgickým výkonem všichni podepsali informovaný souhlas.
Obr. 1. Histologie DCIS
Fig. 1: DCIS histology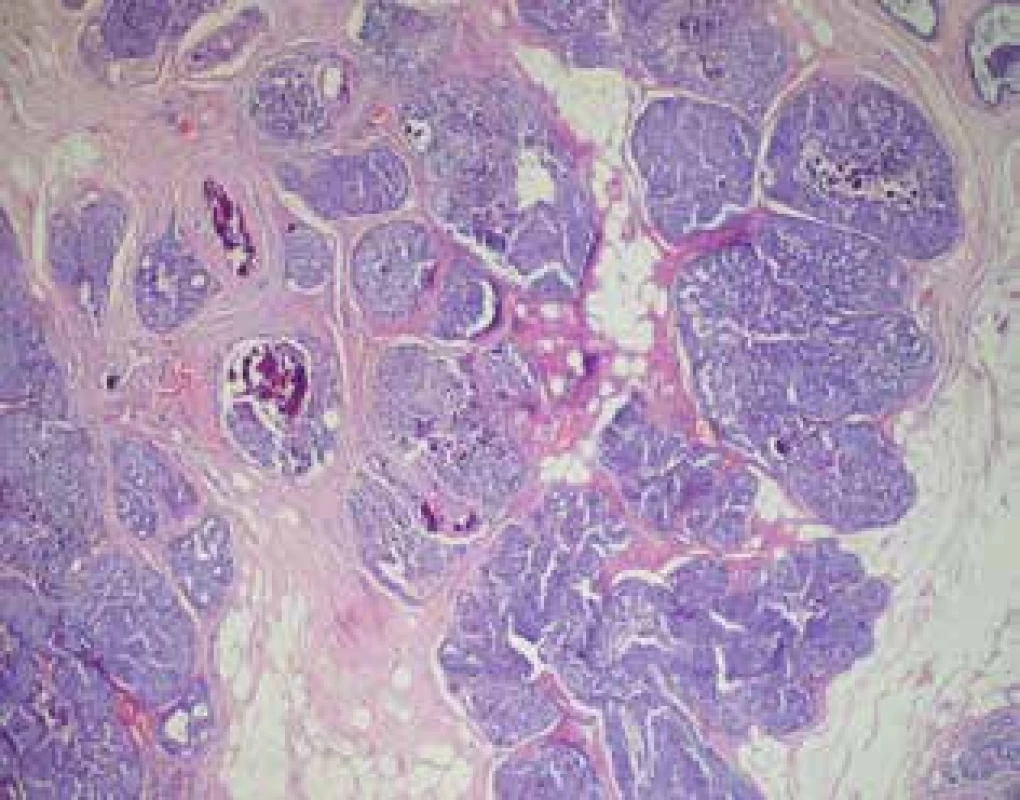
U nehmatných lézí byl určen způsob značení (sonografie, aplikace barviva − karba, vodič). V případě prs záchovných výkonů byla vždy po výkonu provedena kontrolní mamografie resekátu.
SLN byly vždy peroperačně vyšetřeny. Resekát byl v cytologické laboratoři standardně vyšetřen podle stejného protokolu jako u invazivního karcinomu. V případě vzdálenosti resekční linie menší než 2 mm od ložiska DCIS byl výsledek vyšetření individuálně posouzen, zda bude vhodná reoperace. U pozitivních resekčních okrajů byla vždy provedena reexcize označené stěny kavity. Pokud rozsah léze a stav resekčních okrajů byly takového charakteru, že by bylo obtížné dosáhnout volné okraje, následovala prostá mastektomie.
Výsledky
Na chirurgickém oddělení EUC Kliniky Zlín bylo od 1. 1. 2017 do 31. 12. 2019 operováno 616 pacientů s diagnózou karcinom prsu včetně DCIS. Do souboru pacientů s DCIS bylo zařazeno čtyřicet čtyři pacientek s prokázaným DCIS nebo s podezřením na DCIS (7,1 %).
Lokální recidiva v daném souboru nebyla diagnostikována, protože doba sledování byla velmi krátká. Jedna pacientka zemřela na metastázy jater během léčby karcinomu ovaria. Metastázy byly diagnostikovány již před diagnózou DCIS. Dvě lokání recidivy v sestavě vycházejí z výkonů z minulých roků. Podrobnou charakteristiku sestavy obsahuje Tab. 1. Přehled parametrů z histologického a imunohistochemického vyšetření zahrnuje Tab. 2. Předoperační histologická diagnóza byla změněna jedenáctkrát (Tab. 3). U benigního nálezu byl proveden „up-stage“ na neinvazivní in situ variantu šestkrát, jedenkrát DCIS v invazivní karcinom a jedenkrát invazivní karcinom v DCIS. Podrobně viz Tab. 3. Konzervativní výkon na prsu byl proveden 35× (80 %), z toho 21× bez výkonu v axile. Čtyřikrát byla provedena reexcize a v polovině případů tkáň obsahovala rezidua DCIS. Mastektomie byla provedena 9× a dvakrát se jednalo o prostou mastektomii jako definitivní výkon pro nemožnost dosažení volných resekčních okrajů po lumpektomii. Biopsie sentinelové uzliny byla provedena 23× (52 %) jako součást lumpektomie a mastektomie. Celkový počet vyšetřených uzlin byl 44, průměrný počet uzlin byl 1,9 (min. 1, max. 3). Nález maligních buněk v sentinelové uzlině jsme u čistého DCIS nepozorovali. Disekce axily byla provedena dvakrát pouze v případě lokální recidivy. Pooperační průběh komplikoval čtyřikrát serom a dvakrát infekce v ráně.
Radioterapie následovala po chirurgickém výkonu 26× (59 %). Hormonální terapie byla podávána u hormonálně aktivních lézí 30× (68 %).
Tab. 1. Charakteristika pacientů s DCIS
Tab. 1: Characteristics of patients with DCIS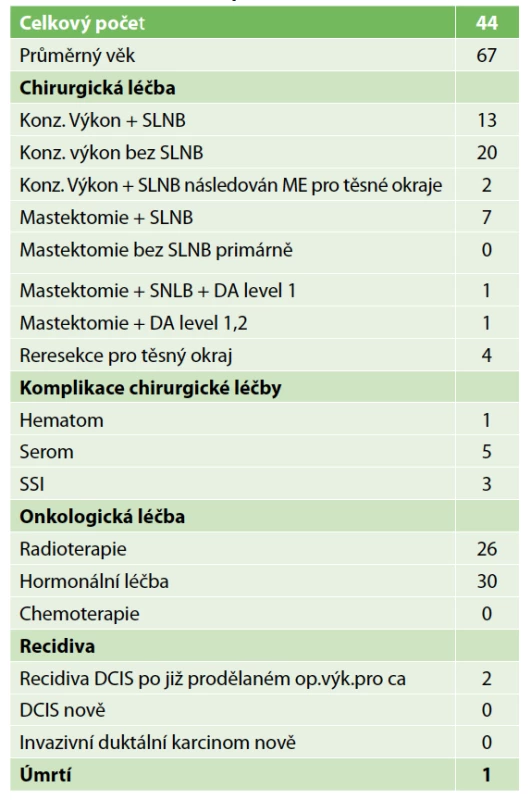
Tab. 2. Histologie
Tab. 2: Histology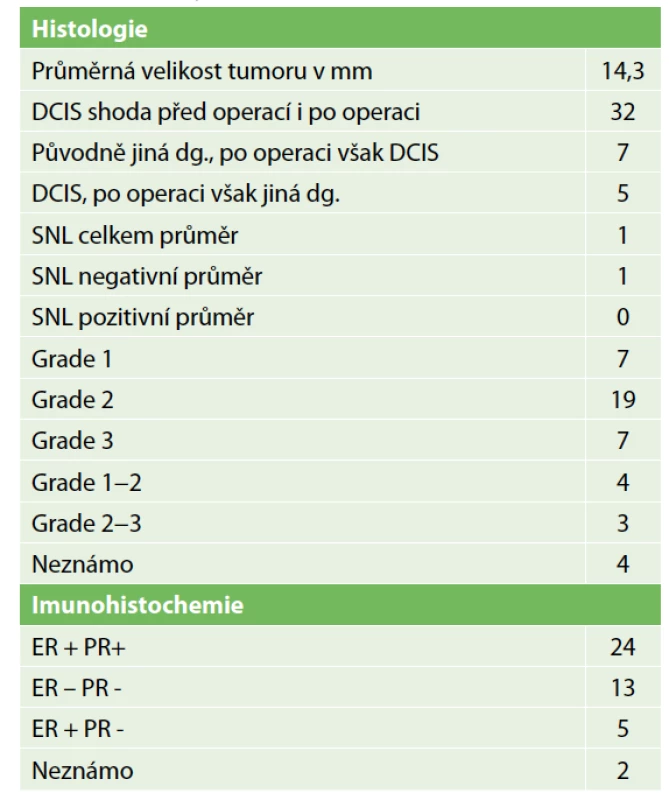
Tab. 3. Změny v histologii po výkonu
Tab. 3: Histological changes after the surgery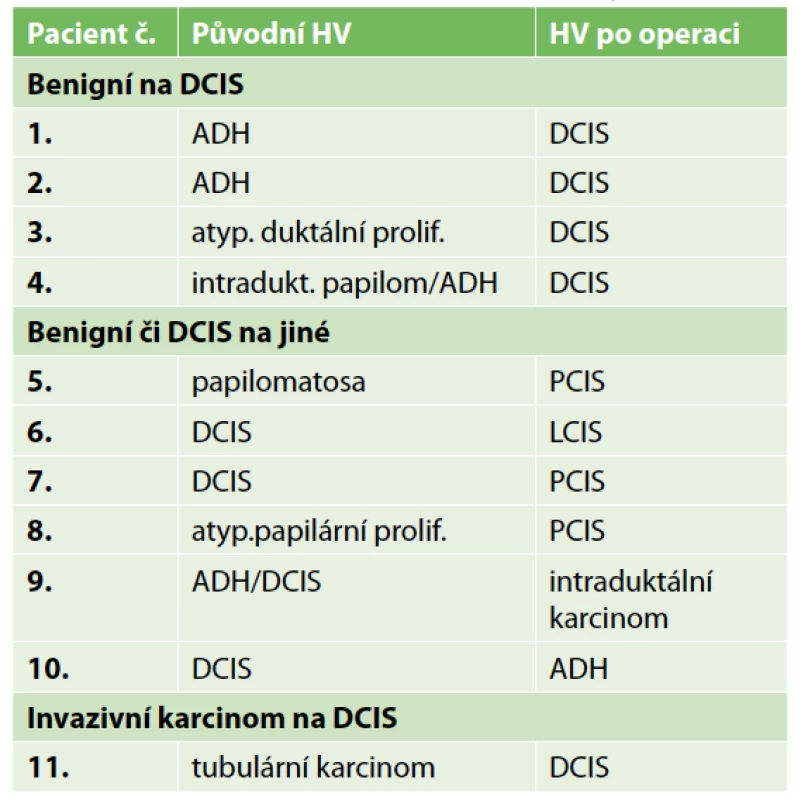
Diskuze
Strategie léčení DCIS vycházela po dlouhé roky z předpokladu, že všechny DCIS se budou vyvíjet v invazivní karcinom. Při narůstajícím počtu diagnostikovaných DCIS by se tak měl snižovat počet invazivních karcinomů, což praxe nepotvrzuje [3,6].
DCIS vzniká z epiteliálních buněk lemujících bazální membránu mezi terminálními dukty a lobuly. Zjednodušené schéma vývoje onemocnění předpokládá, že atypická duktální hyperplazie (ADH) progreduje, mění se v DCIS a ten následně v invazivní karcinom, ale tento proces rozhodně není automatický [6]. Epidemiologické studie naopak ukazují, že část ADH nepřechází v DCIS a část DCIS neprogreduje v invazivní karcinom. Uvedené závěry vycházejí ze zcela odlišných studií, které prokazují heterogenitu progrese DCIS:
- Zvýšený počet nově diagnostikovaných DCIS evidujeme až se zavedením screeningové mamografie, a zvláště po uvedení moderních digitálních přístrojů do klinické praxe [3,6].
- Nilsen pozoroval, že u 77 sekcí provedených pro jinou příčinu úmrtí byl ve 14 případech diagnostikován okultní DCIS, ale nebyla detekována invaze [7].
- Největší retrospektivní studie hodnotila 9000 benigních nálezů. V sestavě bylo nalezeno 80 lézí DCIS, které byly přehlédnuty a nebyly léčeny. Avšak pouze u 11 pacientek byl diagnostikován invazivní karcinom. Doba sledování byla 17,5 roku [8].
- Van Zee sledovala v retrospektivní studii 3000 pacientek s DCIS léčených pouze lumpektomií. V souboru bylo 271 pacientek s resekčním okrajem méně než 2 mm a 59 s pozitivními okraji. Reexcize nebyla provedena, nebyla indikována ani radiace, ani endokrinní terapie a 60 % žen žilo po 20 letech sledování bez známek invazivního karcinomu [9].
Všechny tyto tematicky odlišné studie nepotvrzují představu plynulého vývoje ADH přes DCIS v invazivní karcinom. Dosavadní znalosti o DCIS a současné prognostické markery nejsou schopny definovat přesný průběh konkrétního onemocnění, odhadnout progresi v invazivní karcinom a určit riziko vzniku recidivy. Z literatury vyplývá, že 20 až 30 % nálezů může být dlouhodobě pouze sledováno bez jakékoli terapie. Nelze však tuto skupinu spolehlivě identifikovat, proto je tento postup velmi málo uplatňován z obavy přechodu neinvazivního karcinomu v invazivní [2]. V případě, kdy po SVAB byla léze na prsu v našem souboru hodnocena jako kompletně odstraněná, jsme se k pouhému sledování též neodhodlali a všechny pacientky souhlasily s následnou extirpací.
Národní doporučení USA dovoluje široké možnosti lokální léčby DCIS, která zahrnuje lumpektomii s radioterapií nebo bez radioterapie, jednostrannou mastektomii, ale také oboustrannou mastektomii. Shody, kdy jsou jednotlivé postupy indikovány, zatím nebylo dosaženo. Pro pacientky s nízkým rizikem je možná pouhá excize tumoru jako akceptovatelná lokální terapie. Co znamená nízké riziko. ale není dobře definováno. Riziko lokální recidivy klesá s adjuvantní radiací a léčbou tamoxifenem. Bohužel redukce recidiv se nepromítá ve snížení vzniku vzdálených metastáz a prodloužení délky celkového přežití. Malý přínos adjuvantní terapie pro celkové přežití přináší malé, ale reálné riziko vedlejších účinků, které mohou být důvodem vynechat adjuvantní terapii po chirurgickém výkonu. V počátku byla snaha identifikovat skupinu pacientů, kteří mají nízké riziko, použitím klinických a patologických testů (Nomogramy, van Nuys index). Avšak dosavadní studie nejsou dostatečně reprodukovatelné a nemají spolehlivost v identifikaci pacientek s nízkým rizikem, zvláště pak, pokud jsou sledovány po dobu 10 roků [6−3,2−9]. V současnosti je výzkum ke stanovení rizika recidivy po chirurgickém výkonu zaměřen na molekulární testy. V centru zájmu je porovnání spolehlivosti molekulárních testů ve srovnání s tradičními klinickými a patologickými testy [3,2,6]. Radioterapie byla v našem souboru indikována po zhodnocení individuálního rizika pacientky, které vycházelo z věku, gradu a velikosti léze.
V průběhu posledních dvou desetiletí vývoj směřuje k miniinvazivním výkonům. Narůstá počet konzervativních výkonů na prsu na úkor radikální mastektomie [3,5,10].
Ve Worniho retrospektivní studii dominuje lumpektomie s radioterapií (43 %), následuje samostatná lumpektomie (26,5 %). Jednostranná mastektomie byla provedena ve 23,8 % a oboustranná 4,5 %. Bez terapie bylo 2,3 % žen. Je zajímavé, že u žen, u kterých byla provedena mastektomie (35 %), byl tumor menší než 15 mm, a ve 32 % byl dobře nebo středně diferencovaný. Znamená to, že mastektomie byla provedena, přestože léze měla nízké riziko. Oboustrannou mastektomii preferovaly spíše mladší pacientky bílé rasy a vdané ženy. Počet mastektomií se lišil dle regionů, na počet měly vliv spíše rasové předsudky a počet např. nekorespondoval ani s hustotou plastických chirurgů v regionu, spíše naopak. Role kontralaterální mastektomie v prevenci je diskutabilní a mimo genetickou predispozici nemá vážný prokazatelný důvod. Nabízí se vysvětlení, že ženy se obávají vývoje invazivního karcinomu. Úkolem je snížit agresivní chirurgickou terapii v případech, kdy není nutná, zvýšenou psychologickou péčí. Nezbytné je vysvětlit ženám, že strach z vývoje nádoru na druhém prsu je přeceňován [3,2,3,4,5,6]. Podobný podíl mastektomií (27 %) a konzervativních výkonů uvádí Zhang ve studii 130 731 pacientek z dat SEER (Surveillance, epidemiology, and end results program, National Cancer Institute, USA). Obdobně pozoruje narůstající počet kontralaterálních preventivních mastektomií, kterých bylo 23,8 % [11].
Prs záchovný výkon jako primární výkon byl proveden u třicet pěti pacientek, což představuje 80 %. U dvou následovala prostá mastektomie jako definitivní řešení. Z toho jedenkrát u recidivy bezprostředně po stanovení diagnózy. Revize axily byla provedena, protože nebylo možné spolehlivě zjistit rozsah primárního výkonu. Jedenkrát byla prostá mastektomie provedena s odstupem, protože pacientka nebyla schopna absolvovat následnou kompletní radioterapii pro kardiální obtíže. Primárně byla mastektomie indikována u devíti pacientek. Důvodem byly velikost, multicentricita a věk, kdy bylo pro pacientky obtížné absolvovat radioterapii. Rozložení výkonů na prsu v naší sestavě odpovídá literárním údajům.
Zvýšené riziko lokálních recidiv u prs záchovných výkonů je prokázáno, zvláště ve spojení s pozitivními resekčními okraji. Bezpečný volný okraj je po mnoho dekád předmětem odborných diskuzí. Na základě výsledků studií multidisciplinární panel odborných společností Society of Surgical Oncology (SSO), American Society for Radiation Oncology (ASTRO) a American Society of Clinical Oncology (ASCO) stanovil, že negativní okraje jsou definovány jako „no ink in DCIS“. Pozitivní okraj zvyšuje riziko lokální recidivy. Riziko není možné snížit adjuvantní radioterapií. Minimální vzdálenost resekční linie 2 mm je spojena se sníženým rizikem lokálních recidiv, ale vzdálenost větší než 2 mm již nezaručuje nižší počet lokálních recidiv [3,12,13]. Konsenzus dále doporučuje klinické hodnocení, které by mělo určit další potřebu reoperace, pokud je hranice menší než 2 mm. V MD Anderson není automaticky indikován další výkon při vzdálenosti menší než 2 mm, tak aby byla rozšířena resekční hranice. Aktivní postoj následuje v případě, že nebude následovat radioterapie, je zasaženo více okrajů resekátu nebo nejsou kompletně odstraněny mikrokalcifikace. Významné je přesné označení léze před výkonem (sono, barvivo – karbo, vodič, radioaktivní zrno). Pokud jsou pochybnosti o kompletním odstranění mikrokalcifikací, měla by po chirurgickém výkonu následovat mamografie. V MD Anderson není rutinně prováděn „shaving“ kavity, aby se zbytečně neodstraňovala zdravá tkáň, a nezhoršil se tak výsledný kosmetický efekt. K bezprostřední reresekci jsou indikovány jen suspektní strany kavity [3,10,13,14,15]. Na našem pracovišti při značení nehmatných lézí využíváme sonografii, aplikaci barviva – karba a vodič. Radioaktivní zrno jsme nepoužili, ale tuto metodiku bychom chtěli implementovat. Rutinní „shaving“ celé kavity neprovádíme. Pouze v případě nedostatečné resekce reexcidujeme označené okraje. Ve studii byla reoperace provedena čtyřikrát a dvakrát byly v resekátu rezidua DCIS. Pokud byla diagnóza provedena pomocí SVAB (stereotactic vacuum assisted biopsy), vždy provádíme reexcizi lůžka a pouze dvakrát byl DCIS kompletně odstraněn.
Po mastektomiích jsou lokální recidivy výjimečné, avšak po konzervativních výkonech včetně radioterapie i bez radioterapie se vyskytují v 5−30 %. U poloviny případů se jedná o invazivní karcinom. Radioterapie redukuje počet lokálních recidiv na polovinu [10,16]. Studie Solina uvádí, že ve 12letém sledování u nízce a středně diferencovaného DCIS se počet lokálních recidiv objevil v 14,4 % a v 7,7 % se jednalo o invazivní karcinom. Rizikovým faktorem pro vznik lokálních recidiv byly velikost léze, věk, resekční okraje, multicentricita [17]. Van Zee v Memorial Sloan Kettering Cancer Center (MSKCC) sledovala pacienty u prs záchovných výkonů s DCIS v retrospektivní analýze. U 157 pacientek léčených v letech 1978 a 1990 s mediánem sledování 74 měsíců se lokální recidiva objevila u 33 žen (21 %). Po 6 letech sledování byla lokální recidiva s radioterapií 9,6 %; bez radioterapie 20,7 %. Při podrobném rozboru u pacientek mladších než 40 roků byla recidiva diagnostikována po šesti letech v 47,2 %; ale u pacientek 40–69 roků byl výskyt recidiv 14,0 %; u 70 roků a více byl 10,8 %. Studie ukázala, že při srovnání starších a mladších pacientek léčených lumpektomií s DCIS je větší pravděpodobnost vývoje recidivy u mladších žen [18]. K podobným závěrům dospěli Hwang et al. Předpokládá, že chirurgové u starších pacientek odstraní větší objem prsní žlázy na úkor kosmetického výsledku. Pacientky s menším rozsahem resekce mají v šestiletém sledování vyšší počet lokálních recidiv (21 % versus 5,6 %). V obou skupinách měla pozitivní vliv na vznik recidiv radioterapie. Hwang et al. udávají další možné vysvětlení. Komplex žlázy u starších nemocných se ztrácí, prsní žláza se redukuje a je rozložena mezi tukovou tkání bez vzájemného spojení. Žláza je tak anatomicky a fyziologicky méně vhodná k plošnému šíření DCIS. U mladších žen má DCIS více agresivní biologii s nižším jaderným grade a je hormonálně pozitivní [10,18,19].
Náš soubor zahrnuje dvě lokální recidivy po prs záchovných výkonech z minulých let. Obě se objevily po 17 a 18 letech. U obou bylo velmi svízelné zjistit přesný rozsah původního výkonu v axile, proto byla součástí mastektomie i revize axily. Výsledná histologická diagnóza byla u obou DCIS.
Existuje všeobecná shoda, že čistý DCIS, bez koexistujícího invazivního karcinomu, se nemůže šířit do lymfatických cest a do regionálních uzlin. Nicméně v současnosti neexistuje metoda, která by spolehlivě predikovala léze, které nebudou mít současně invazivní karcinom. Z tohoto důvodu některá pracoviště používají SLNB i u všech diagnostikovaných DCIS pomocí „core cut“ anebo SVAB. Retrospektivní studie však ukazují, že pouze malé procento metastazuje. Převážně se pak jedná o mikrometastázy nebo izolované tumorózní buňky (isolated tumor cells − ITC). Počet metastáz u čistého DCIS je 1 % a mikrometastáz 1,5 % [2,3,10]. Disekce axilárních uzlin (ALND) jako primární výkon u DCIS proto není indikována a alternativou ke stanovení axilárního stagingu je SLNB. V případě mastektomie je automaticky indikována, protože to znemožňuje provést SLNB při následné operaci. Další indikací SLNB je nález masy při klinickém vyšetření a/nebo při zobrazovacích metodách, které velmi sugestivně ukazují na invazivní karcinom nebo oblast DCIS přesahuje 5 cm [10,20,21]. V MSKCC hodnotí riziko současné mikroinvaze nebo invaze v DCIS, pokud je hmatný tumor nebo mamograficky viditelný nález. Dále indikují SLNB u multicentrického nebo high grade tumoru a při přítomnosti nekrózy. Moore v multicentrické studii 2159 pacientů, kteří byli operováni pro DCIS v MSKCC, John Wayne Cancer Institutu a na pracovišti University of Southern California, byla SLNB provedena u 470, a to převážně pro high risk DCIS. Čtyřicet tři žen (9 %) mělo pozitivní SLNB. Z těch u tří (7 %) se vyskytla makrometastáza, u čtyř (9 %) mikrometastáza a 36 (84 %) mělo ITC. Při opakovaném vyšetření původního resekátu u dvou byla diagnostikována mikroinvaze a u dvou lymfovaskulární invaze [22].
V MD Anderson je indikace lymfatického mapování pomocí SLNB posuzována případ od případu, a to v závislosti na velikosti DCIS a event. složitosti onkoplastické rekonstrukce. V Británii u DCIS doporučují provádět SLNB, mimo obvyklé indikace, pokud je přítomen DCIS v oblasti horního zevního kvadrantu a u složitých onkoplastických výkonů s velkým posunem tkání. Worni uvádí v retrospektivní studii počet SLNB u DCIS 18 % a Morrow hodnotí tento počet jako příliš vysoký [2,3].Biopsie sentinelové uzliny byla u nás prováděna jako součást lumpektomie a mastektomie, což odpovídá 50 % případů. Podrobně viz Tab. 1. Počet je s ohledem na mezinárodní trendy vyšší a lze jej vysvětlit zvýšenou obavou z mikroinvaze nebo invaze. Počet vyšetřených uzlin je nižší a neodpovídá našim výsledkům u invazivního karcinomu. Všechny sentinelové uzliny byly vždy negativní. Indikací k SLNB se na našem pracovišti budeme zabývat, aby výkon v axile více odpovídal nálezu na prsu a riziku invaze. Primární disekci axily jsme indikovali pouze u lokální recidivy a předoperační diagnózy invazivního karcinomu.
Riziko úmrtí na karcinom prsu u žen s čistým DCIS je nízké. Častý argument, že to tak není, je z obavy ze vzniku invazivního karcinomu. Sám DCIS neovlivňuje významně mortalitu, ale ta narůstá až 17×, pokud je diagnostikována recidiva invazivního karcinomu. Existuje však také skupina žen léčených pro DCIS, které zemřely na metastatický karcinom bez lokální recidivy. Hypoteticky, některé DCIS mají významný potenciál metastatického šíření pomocí vzdálených metastáz anebo ukrývají okultní invazivní karcinom [16].
Worniho studie také sledovala bezpříznakové období a celkové přežití u jednotlivých věkových skupin a podle typu léčby (medián sledování byl 71 měsíců). Ve věkové skupině pacientek mladších 49 roků přežívalo 97,8 %. U žen starších 70 roků to bylo pouze 72 %. V celé sestavě byl diagnostikován karcinom prsu jako příčina smrti v 9,2 %. Převládající příčinou úmrtí byly kardiovaskulární choroby, a to v 33 %. Maligní nález byl příčinou smrti v 22 %. Významný rozdíl v úmrtí byl u žen starších 70 roků a více, kdy na kardiovaskulární choroby zemřelo 40,2 % žen a na maligní lézi 5,4 %.
Celkové 5 a 10leté přežití bylo nejvyšší u pacientů po lumpektomii s radiací (96,8 % a 89,6 %). Následovala mastektomie (95,1 % a 86,1 %). Lumpektomie bez radiace měla nejnižší délku přežití (92,3 % a 80,6 %). Bezpříznakové období po stanovení diagnózy DCIS korespondovalo s celkovým přežitím [2].
V našem souboru jsme zaznamenali jedno úmrtí u pacientky, která byla léčena pro karcinom ovaria s mnohočetnými metastázami jater, které měla diagnostikovány ještě před výkonem na prsu pro DCIS. Generalizaci ani úmrtí s příčinou v DCIS jsme nezaznamenali, i proto, že doba sledování byla příliš krátká. Ve studii jsme se zaměřili na chirurgickou a bezprostřední adjuvantní léčbu. Zmiňované lokální recidivy nemají původ ve sledovaném souboru, ale vycházely z výkonů v minulosti a do souboru jsme je zahrnuli, abychom zjistili, jaký je podíl lokálních recidiv v profilu nálezů DCIS během sledovaných tří roků.
Závěr
DCIS je heterogenní onemocnění, které zahrnuje onemocnění s různou biologickou aktivitou a rizikem k lokální recidivě, generalizaci a následně k úmrtí. Názory na léčbu DCIS se neustále vyvíjejí. Snahou je sestavit ji tak, aby odpovídala individualitě pacientky [24]. Výsledky naší studie potvrzují, že chirurgická terapie odpovídá současným doporučením. Podíl biopsií sentinelové uzliny je významně vyšší, a proto se zaměříme na tuto oblast chirurgické péče. Nasazení radioterapie a hormonální terapie bylo racionální a korespondovalo s charakterem souboru.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. Jiří Gatěk, Ph.D.
Fügnerovo nábřeží 5476
760 01 Zlín
e-mail: gatekj@gmail.com
Zdroje
- Choi D, Van Zee K, Memorial Sloan-Kettering Cancer Center: two decades of experience with ductal carcinoma in situ of the breast. Int J Surg Oncol. 2012;(3):723916. doi: 10.1155/2012/723916.
- DeSnyder S, Hunt K, Dong W, et al. American Society of Breast Surgeons’ practice patterns after publication of the SSO-ASTRO-ASCO DCIS consensus guideline on margins for breast-conserving surgery with whole-breast irradiation. Ann Surg Oncol. 2018;(25):2965−2974;(10):2965−2974. doi:10.1245/s10434-018-6580-9.
- Rojas K, Fortes T, Borgen P. Leveraging the variable natural history of ductal carcinoma in situ (DCIS) to select optimal therapy. Breast Cancer Research and Treatment 2019;(174):307−313. doi:10.1007/s10549-018-05080-0.
- Marinovich M, Azizi L, Macaskill P, et al. The association of surgical margins and local recurrence in women with ductal carcinoma in situ treated with breast-conserving therapy: A meta-analysis. Ann Surg Oncol. 2016;(23):3811−3821. doi:10.1245/s10434-016-5446-2.
- Morrow M, Katz S. Addressing overtreatment in DCIS: What should physicians do now? JNCI: Journal of the National Cancer Institute 2015; 107(1−2). doi.org/10.1093/jnci/djv290.
- Morrow M, Van Zee K, Solin L, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in ductal carcinoma in situ. Pract Radiat Oncol. 2016;6(5):287−295. doi:0.1016/j.prro.2016.06.011.
- Kuerer H, Smith B, Mariana Chavez-MacGregor M. DCIS margins and breast conservation: MD Anderson cancer center multidisciplinary practice guidelines and outcomes. J Cancer 2017;8(14):2653−2662. doi:10.7150/jca.20871.
- Wadsten C, Garmo H Fredriksson, et al Risk of death from breast cancer after treatment for ductal carcinoma in situ. Br J Surg. 2017;(104):1506−1513. doi:10.1002/bjs.10589.
- Worni M, Akushevich I, Greenup R, et al. Trends in treatment patterns and outcomes for ductal carcinoma in situ. JNCI 2015;(107):1−10 djv263.
- Shiyanbola O, Sprague B, Hampton J, et al. Emerging trends in surgical and adjuvant radiation therapies among women diagnosed with ductal carcinoma in situ. Cancer 2016;122(18):2810–2818. doi:10.1002/cncr.30105.
- Moore KH, Sweeney KJ, Wilson ME, et al. Outcomes for women with ductal carcinoma-in-situ and a positive sentinel node: a multi-institutional audit. Ann Surg Oncol. 2007;(10):2911−2917. doi:10.1245/s10434-007-9414-8.
- Lyman G, Giuliano A, Somerfield M et al American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol. 2005;(23):7703−7720. doi:10.1200/JCO.2005.08.001.
- Lyman G, Temin S, Edge S, et al. Sentinel lymph node biopsy for patients with early-stage breast cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2014; (32):1365−1383. doi:10.1200/JCO.2013.54.1177.
- Ramzi S, Najeeb, E Coulthard E, et al. Does sentinel lymph node biopsy for screening high-grade ductal carcinoma in situ of the breast cause more harm than good? Breast Cancer Res Treat. 2020;(182):47−54. doi:10.1007/s10549-020-05690-7.
- Keerthi GK Ductal carcinoma in situ: How much is too much? Cancer 2016;(122):2780−2782. doi:10.1002/cncr.30107.
- Muhsen S, Barrio A, Miller M, et al. Outcomes for women with minimal-volume ductal carcinoma In situ completely excised at core biopsy. Ann of Surg Oncol. 2017;(24):3888−3895. doi:10.1245/s10434-017-6043-8.
- Nielsen M, Jensen J Andersen J. Precancerous and cancerous breast lesions during lifetime and at autopsy. A study of 83 women Cancer 1984;(54):612−615. doi:10.1002/1097-0142(1984)54 : 4<612:aid-cncr2820540403>3.0.co;2-b.
- Ernster V, Barckay J Kerlikowske K. Mortality among women with ductal carcinoma in situ of the breast in the population-based surveillance, epidemiology and end results program. Arch Intern Med 2000;(160):953–958. doi:10.1001/archinte.160.7.953.
- Van Zee K, Subhedar P, Olcese C, et al. Relationship between margin width and recurrence of ductal carcinoma in situ: Analysis of 2996 women treated with breast-conserving surgery for 30 years. Ann Surg. 2015;(262):623–631. doi:10.1097/SLA.0000000000001454.
- Solin L, Gray R, Hughes L, et al. Surgical excision without radiation for ductal carcinoma in situ of the breast: 12-year results from the ECOG-ACRIN E5194 study. J Clin Oncol. 2015;(33):3938−3944. doi:10.1200/JCO.2015.60.8588.
- van Zee K, Liberman L, Samli B, at al. Long term follow‐up of women with ductal carcinoma in situ treated with breast‐conserving surgery. Cancer 1999;(86):1757−1767. doi.org/10.1002/(SICI)1097-0142(19991101)86 : 9<1757.
- Hwang E, Samli B, Tran K, et al. Volume of resection in patients treated with breast conservation for ductal carcinoma in situ, Ann Surg Oncol. 1998; (8):757−63. doi:10.1007/BF02303488.
- Zhang B, Coopey S, Gadd M, et al. Trends in unilateral and contralateral prophylactic mastectomy use in ductal carcinoma in situ of the breast: Patterns and predictors. Ann Surg Oncol. 2019;(26):3863–3873. doi.org/10.1245/s10434-019-07628-w.
- Gatěk J, Duben J, Hnátek L, et al. Chirurgická terapie duktálního karcinomu in situ. Rozhl Chir. 2004;83(11):597−603.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2021 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- 100 let časopisu České chirurgické společnosti ČLS JEP
- Ke zrodu časopisu Rozhledy v chirurgii
- Kam směřuje péče o karcinom prsu
- Karcinom prsu – onkologické minimum 2021
- Duktální karcinom in situ a rozsah chirurgického výkonu
- Pagetova choroba prsu – observační retrospektivní studie za období 20 let
- Radioterapie v hlubokém nádechu u pacientek s levostranným karcinomem prsu po parciální mastektomii
- Chirurgické řešení rozsáhlého postradiačního defektu u pacientky po 33 letech od léčby karcinomu prsu − kazuistika
- Granulomatózní mastitida − možnosti léčby a naše zkušenosti
- Sebaceózní karcinom v prsní oblasti − kazuistika
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pagetova choroba prsu – observační retrospektivní studie za období 20 let
- Granulomatózní mastitida − možnosti léčby a naše zkušenosti
- Karcinom prsu – onkologické minimum 2021
- Duktální karcinom in situ a rozsah chirurgického výkonu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



