-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Postavení chirurgické léčby v rámci step-up managementu těžké akutní pankreatitidy
Position of surgical treatment in step-up management of severe acute pancreatitis
Introduction: The incidence of acute pancreatitis has been increasing over the past twenty years and there is still no causal treatment available. Although cases of severe acute pancreatitis account for only about a fifth of all cases of acute pancreatitis, high morbidity and lethality call for an optimization and unification of treatment procedures.
Methods: We operated on 27 patients suffering from severe acute pancreatitis in the past five years. We compared selected parameters such as gender, age, body mass index, aetiology, presence of type 2 diabetes, BISAP score, previous minimally invasive treatment and presence of the intraabdominal compartment syndrome.
Results: The average age of men and women was similar in our group. Most patients were overweight or obese. Alcoholic aetiology was more common in men while biliary aetiology prevailed in women. The mortality rate was 26% in our group. The intra-abdominal compartment syndrome followed by emergency decompression surgery was present in one fourth of the patients. A minimally invasive approach was used in approximately in one half of the patients, and surgical treatment was used only in cases where the minimally invasive approach failed.
Conclusion: After each surgical revision, clinical deterioration of the patient´s condition occurs during the first two to three days in response to operative stress. Therefore, the current trend in the treatment of acute pancreatitis is to proceed as conservatively as possible, or using the minimally invasive approach, and surgical treatment should be reserved only for conditions that cannot be managed otherwise. If surgical treatment is used, it is advisable to perform cholecystectomy, whatever the aetiology of the pancreatitis.
Keywords:
surgical treatment – acute necrotizing pancreatitis – minimally invasive treatment – step-up approach – intra-abdominal compartment syndrome
Autori: J. Sedláčková 1; J. Zajak 1
; B. Jon 1; J. Maňák 2; S. Rejchrt 3; F. Čečka 1
Pôsobisko autorov: Chirurgická klinika Fakultní nemocnice Hradec Králové a Lékařská fakulta Univerzity Karlovy v Hradci Králové 1; III. Interní gerontometabolická klinika Fakultní nemocnice Hradec Králové a Lékařská fakulta Univerzity Karlovy v Hradci Králové 2; II. interní gastroenterologická klinika Fakultní nemocnice Hradec Králové a Lékařská fakulta Univerzity Karlovy v Hradci Králové 3
Vyšlo v časopise: Rozhl. Chir., 2023, roč. 102, č. 2, s. 64-74.
Kategória: Původní práce
doi: https://doi.org/10.33699/PIS.2023.102.2.64–74Súhrn
Úvod: Incidence akutní pankreatitidy za posledních dvacet let stále stoupá a kauzální léčba není k dispozici. Přestože těžké pankreatitidy tvoří jen asi pětinu všech akutních pankreatitid, jejich komplikovaný průběh a vysoká letalita nutí k optimalizaci a ke sjednocení léčebných postupů.
Metody: V pětiletém období jsme operovali 27 pacientů s těžkou formou akutní pankreatitidy. Porovnávali jsme vybrané parametry jako pohlaví, věk, BMI, etiologii, přítomnost cukrovky 2. typu, BISAP skóre a jeho korelaci s úmrtími pacientů, předcházející miniinvazivní terapii a přítomnost nitrobřišní hypertenze.
Výsledky: V naší skupině byl průměrný věk mužů i žen podobný. Většina pacientů měla nadváhu nebo byla obézní. U mužů byla nejčastěji etiologie alkoholická, u žen biliární. Mortalita v našem souboru čítala 26 %. Syndrom nitrobřišního kompartmentu s následnou urgentní dekompresní operací byl přítomen u čtvrtiny pacientů. Miniinvazivní přístup byl užit přibližně u poloviny pacientů a k chirurgickému řešení se přistupovalo v případě jeho neúčinnosti či selhání.
Závěr: Po každé chirurgické revizi dojde během prvních dvou až tří dnů ke klinickému zhoršení stavu pacienta v reakci na operační stres. Proto je současný trend v léčbě akutní pankreatitidy postupovat co nejvíce konzervativně, případně miniinvazivně a chirurgickou léčbu rezervovat pro stavy nezvládnutelné jinak. Pokud je k chirurgické revizi přikročeno, je výhodné provést cholecystektomii, ať je etiologie pankreatitidy jakákoliv.
Klíčová slova:
chirurgická léčba – akutní nekrotizující pankreatitida – „step-up“ strategie – břišní kompartment syndrom – miniinvazivní léčba
ÚVOD
Incidence akutní pankreatitidy (AP) za posledních dvacet let stále stoupá a kauzální léčba není k dispozici. Přestože těžké pankreatitidy tvoří jen asi pětinu všech případů, jejich komplikovaný průběh a vysoká letalita nutí k optimalizaci a ke sjednocení léčebných postupů.
Akutní pankreatitidu poprvé popsal téměř před 400 lety nizozemský lékař Nicholas Dutch a od té doby trvá snaha o poznání patofyziologie a vylepšení diagnostiky i léčby tohoto zajímavého onemocnění. Ještě na konci 19. století dominovaly v léčbě AP časné chirurgické revize – jednak k potvrzení diagnózy, jednak k případné nekrektomii a drenáži [1]. V diagnostice byl přelomový rok 1908, kdy Wohlgemuth stanovil hodnotu amylázy v moči [2]. Paxton a Payne v roce 1948 upozornili na dvojnásobně vyšší mortalitu u operovaných pacientů [1]. Právě vysoká mortalita po těchto výkonech vedla lékaře k postupnému hledání konzervativnějšího způsobu léčby. Jako počátek moderní chirurgické léčby AP je možné označit 80. léta minulého století, kdy byly Begerem, Howardem a Bradleyem zavedeny do rutinní chirurgické praxe odložené nekrektomie s laváží [1]. V naší práci se zaměřujeme na aktuální postavení chirurgické léčby v managementu těžkých forem akutní pankreatitidy.
METODY
V období od 1. 1. 2017 do 31. 12. 2021 jsme na naší klinice operovali 27 pacientů s těžkou formou akutní pankreatitidy. Jednalo se o případy hospitalizované na JIP, u nichž jsme porovnávali vybrané parametry – věk, etiologii onemocnění, přítomnost DM 2. typu (diabetes mellitus 2. typu) a hodnoty body mass indexu. Dále jsme se zabývali BISAP skóre (Bedside index for severity in acute pancreatitis skóre), které je vyhodnoceno během prvních 24 hodin po přijetí a stanoví pravděpodobnost těžkého průběhu akutní pankreatitidy (Tab. 1). Rychlost zahájení léčby a strategie léčby hraje klíčovou roli, a pokud se chceme pokusit ovlivnit průběh pankreatitidy, rozhoduje prvních 12−24 hodin od vzniku obtíží [3]. Je tedy snaha již vstupně vyselektovat pacienty s vyšším rizikem rozvoje těžké AP. Sledovali jsme hodnoty BISAP skóre ve skupině zemřelých.
Tab. 1. Skóre pro stanovení pravděpodobnosti závažného průběhu akutní pankreatitidy
Tab. 1: Bedside index for severity in acute pancreatitis (BISAP) Score
Dalším hodnoceným parametrem byla miniinvazivní terapie předcházející chirurgické léčbě. Posledním hodnoceným parametrem byla přítomnost nitrobřišního kompartment syndromu, který je definován jako zvýšení nitrobřišního tlaku nad 20 cm H2O současně se selháním jednoho orgánu. Hodnota IAP (nitrobřišního tlaku) byla měřena speciálně upraveným močovým katétrem.
Článek je doplněn komentovanými obrazovými příklady step-up postupu u vybraných pacientů z našeho souboru (Obr. 1−4).
Obr. 1. a−1c: Těžký průběh alkoholické akutní pankreatitidy s MOF u 37letého muže
Dle CT objemné tekutinové kolekce v dutině břišní s útlakem okolních struktur (Obr. 1a). Iniciálně indikován k CT navigované perkutánní drenáži (Obr. 1b), v dalším průběhu chirurgická revize pro krvácení ze sleziny, provedena splenektomie, nekrektomie a drenáž. Následně opakovaně provedena direktní endoskopická nekrektomie břišní dutiny ranou po drénu (Obr. 1c). Postupné lepšení stavu a regrese kolekcí. Délka hospitalizace 166 dní, z toho ventilován 41 dní.
Fig. 1a−1c: Severe course of acute alcoholic pancreatitis with MOF in a 37-year-old man
Voluminous fluid collections oppressing the surrounding structures were present were shown by the CT scan (Fig. 1a). Initially, CT guided drainage was indicated (Fig. 1b); later surgical revision was approached for splenic bleeding – splenectomy, necrectomy and drainage were performed. Subsequently, direct endoscopic necrectomy was done repeatedly via the drain wound (Fig. 1c). This was followed by a gradual improvement of the condition and regression of the fluid collections. Hospital stay was 166 days; the patient was ventilated for 41 days.
Obr. 2. a−2b: Těžký průběh alkoholické pankreatitidy s MOF u 41leté pacientky
Chirurgická revize dutiny břišní a laparostoma pro kompartment syndrom. Ohraničená kolekce tekutiny v epigastriu s bublinami plynu velikosti 65×140×185 mm (Obr. 2a), perkutánní drén nefunkční. Kolekce byla drenována transgastricky kovovým lumen apozičním stentem (Obr. 2b). Po opakované nekrektomii regrese ložiska. Délka hospitalizace 269 dnů, z toho ventilována 92 dnů.
Fig. 2a−2b: Severe course of alcoholic pancreatitis with MOF in a 41-year-old woman
Surgical revision with a laparostoma due to compartment syndrome. Circumscribed fluid collection in the epigastrium sized 65×140×185 mm with gas bubbles (Fig. 2a); the percutaneous drain was dysfunctional. The collection was drained transgastrically by the lumen-apposing metal stent (Fig. 2b). Regression of deposits in the epigastrium after repeated necrectomy. Hospital stay was 269 days; the patient was ventilated for 92 days.
Obr. 3. a−3b: Těžký průběh akutní biliární pankreatitidy s nekrózou >50 % pankreatu u 44letého muže
Obraz nekrotizující pankreatitidy, vícečetné septované tekutinové porce 190×90×160 mm, nález nevhodný k perkutánní či transgastrické drenáži (Obr. 3a), indikována otevřená chirurgická revize, drenáž, open abdomen, dle CT patrná výrazná regrese nálezu (Obr. 3b). Délka hospitalizace 122 dní, ventilován 15 hodin.
Fig. 3a−3b: Severe course of acute biliary pancreatitis with pancreatic necrosis of more than 50% of pancreatic tissue in a 44-year-old man
Necrotizing pancreatitis, multiple septated fluid portions 190×90×160 mm unsuitable for percutaneous or transgastric drainage (Fig. 3a). Open surgical revision, drainage and open abdomen were indicated. There was a significant regression of the collections on the control CT scan (Fig. 3b). Hospital stay was 122 days; the patient was ventilated for 15 hours.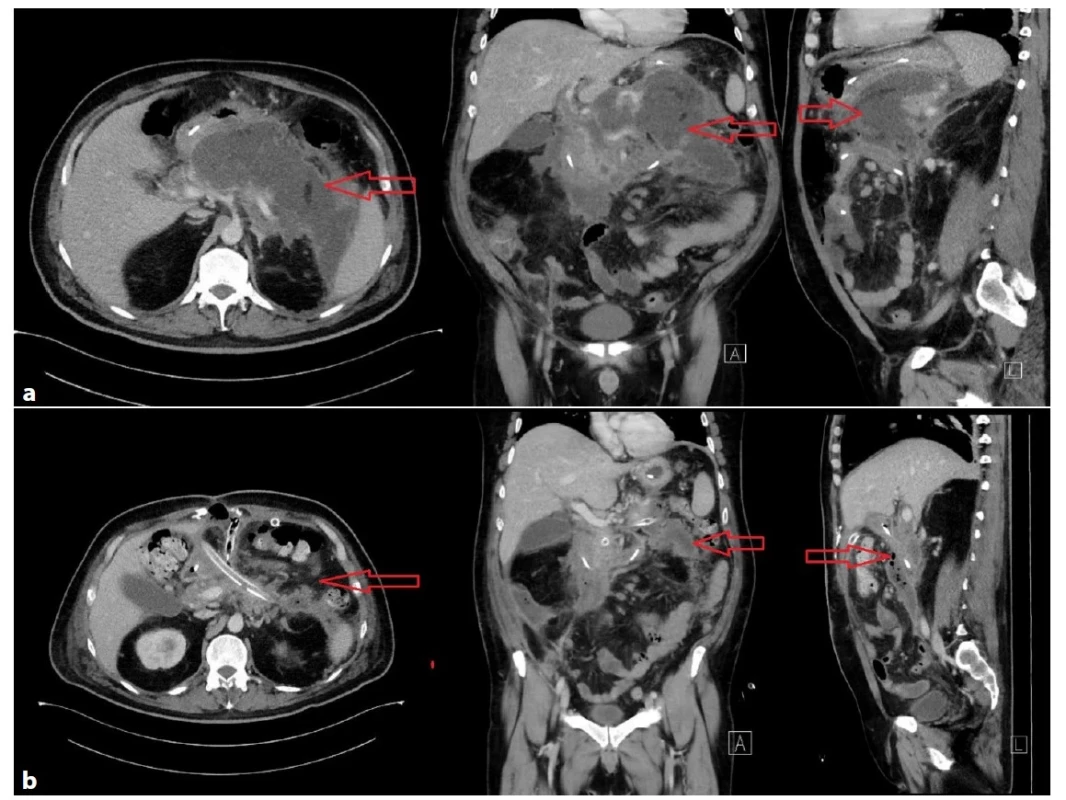
Obr. 4. a−4b: Rozvoj těžké AP po laparoskopické cholecystektomii na jiném pracovišti u 79leté ženy, po 20 dnech hospitalizace přeložena do FNHK
Těžký průběh AP s MOF. Primárně byla indikována k perkutánní drenáži pod CT (Obr. 4a), v dalším průběhu byla indikována chirurgická revize pro nedostatečnou drenáž, nelepšení stavu a peritoneální známky. V dutině břišní při chirurgické revizi nalezeno 2900ml exsudátu, provedena laváž, drenáž a ponecháno open abdomen, uzavřeno po 14 dnech. Hospitalizována celkově 31 dní, ventilována celkem 3,5 dne. V dalším průběhu tvorba objemné pseudocysty v omentální burze (Obr. 4b), indikována k transgastrické drenáži.
Fig. 4a−4b: Development of severe acute pancreatitis after laparoscopic cholecystectomy in another hospital in a 79-year-old woman who had been transferred to the University Hospital Hradec Kralove after 20 days of hospitalization
Severe course of acute pancreatitis with MOF. The patient was initially indicated for CT-guided percutaneous drainage (Fig. 4a); later surgical revision was indicated for insufficient drainage, lack of improvement and signs of peritoneal irritation. 2900 ml of exudate was found in the abdominal cavity during surgical revision. Lavage, drainage and open abdomen were performed; the open abdomen was closed after 14 days. The patient was hospitalized for a total of 31 days, and she was ventilated for 3.5 days. In the further course, a voluminous pseudocyst was formed in the omental bursa (Fig. 4b), which was indicated for transgastric drainage.
VÝSLEDKY
Za uvedené období 5 let bylo na jednotkách intenzivní péče FNHK (Fakultní nemocnice Hradec Králové) hospitalizováno pro těžkou akutní pankreatitidu 380 pacientů, z toho operovaných bylo jen 27 (7,1 %). Pokud se nejednalo o urgentní výkon z vitální indikace, tak vždy předcházela snaha o miniinvazivní řešení a chirurg byl osloven v rámci multioborové spolupráce, pouze pokud nebyla miniinvazivní léčba technicky možná či byla neúspěšná.
V našem souboru bylo dvojnásobně více mužů, průměrný věk u mužů byl o 3 roky vyšší než u žen. Stran etiologie byla u mužů nejčastější toxonutritivní (převážně alkoholická) etiologie, v jednom případě se jednalo o rozvoj akutní pankreatitidy po pravostranné hemikolektomii pro adenokarcinom vzestupného tračníku. Ve 2 případech byla pankreatitida hodnocená jako idiopatická, z toho v jednom případě s podílem mírné hyperlipidemie. Ve skupině žen byla nejčastější biliární etiologie, v jednom případě se jednalo o rozvoj pankreatitidy po laparoskopické cholecystektomii pro opakované biliární koliky v kombinaci s hyperkalcémií při adenomu příštítného tělíska. Ve 2 případech se jednalo o rozvoj onemocnění v důsledku hyperlipidemické krize s hladinou TAG nad 100 mmol/l. Diabetes mellitus 2. typu byl anamnesticky přítomen u 4 mužů.
Při hodnocení BMI byla většina pacientů v pásmu nadváhy a obezity prvního stupně, morbidně obézní byli 2 muži ve věku 47 a 70 let. Průměrné BMI ve skupině žen bylo 30,6, ve skupině mužů 29,6.
Výrazněji zvýšené riziko mortality (tzn. BISAP 3 a více) mělo v našem souboru 19 pacientů z 27 sledovaných. Mortalita byla 26 %. Ve skupině zemřelých bylo u všech vstupní BISAP skóre 3 a více bodů.
V rámci miniinvazivního přístupu byla nejčastěji užita perkutánní CT navigovaná drenáž, a to i opakovaně. Transgastrická drenáž se zavedením kovového stentu a s vyvedením nasoabscesového pigtail drénu k proplachům byla provedena u 3 pacientů. U některých pacientů byla užita kombinace metod. U ostatních pacientů nebyla buď miniinvazivní terapie technicky možná, nebo byl nutný urgentní chirurgický výkon z vitální indikace. ERCP bylo před operací provedeno ve skupině mužů u 9 pacientů, ve skupině žen bylo provedeno u 4 pacientek, někdy i opakovaně.
Nitrobřišní kompartment syndrom byl v našem souboru přítomen přibližně u čtvrtiny operovaných pacientů a průměrná hodnota IAP byla 31 cm H2O, nejvyšší zaznamenaný IAP byl u muže (65 let) s alkoholickou akutní pankreatitidou, a to 47 cm H2O, zde dominovala zejména rychlá progrese vzestupu IAP s rozvojem anurie. Následným výkonem byla ve většině případů dekompresní laparotomie s laváží, drenáží a ponecháním open abdomen.
Výsledky přehledně shrnuje tabulka (Tab. 2).
Tab. 2. Demografická a klinickoterapeutická charakteristika souboru pacientů s těžkou akutní pankreatitidou
Tab. 2: Demographic and clinical characteristics of patients with severe acute pancreatitis
DISKUZE
Incidence AP v ČR je přibližně 34/100 000 obyvatel a za posledních 20 let má vzrůstající trend [3]. Je to onemocnění, které má, i po adekvátním zaléčení, poměrně často pro pacienta závažné následky, ať již rozvoj diabetu, exokrinní insuficienci, recidivu nebo rozvoj chronické pankreatitidy. Etiologií je celá řada, nejčastěji cholelitiáza a alkohol. Dosud nepanuje shoda na tom, do jaké míry po etiologii pátrat. Bezesporu to má smysl tam, kde by výsledek vyšetření změnil bezprostřední léčebný postup (např. u virových nebo polékových etiologií) [4]. Ačkoli víme stále více o patofyziologii onemocnění, kauzální léčba není k dispozici a pacienty léčíme ve snaze zabránit progresi onemocnění či zmírnit průběh a předejít komplikacím. Kolem 80 % případů AP probíhá v lehké edematózní formě jako tzv. self-limiting disease, kterou je možné léčit v podstatě uniformně na běžných odděleních. Zbytek však tvoří skupina těžkých nekrotizujících zánětů, často s rozvojem komplikací, kde již letalita prudce stoupá [3,5]. Léčba těchto těžkých stavů patří na intenzivní lůžka specializovaných pracovišť, která s ní mají zkušenosti [6]. Snahou je přísně individualizovaná léčba a multidisciplinární přístup v týmu, který je schopen neukvapeného, ale zároveň dostatečně aktivního přístupu v jakoukoli denní či noční hodinu spolu s možností využití miniinvazivní intervenční radiologie, diagnostické i terapeutické endoskopie a chirurgické terapie včetně miniinvazivních chirurgických technik, managementu nitrobřišní hypertenze a open abdomen [3,7,8].
Podle aktuálně uznávaných a používaných Atlantských kritérií z roku 2012 je pro stanovení diagnózy AP nutno splnit minimálně dvě ze tří podmínek: typická akutní trvalá bolest v mezogastriu či epigastriu často s propagací do zad, trojnásobná elevace amylázy či lipázy v séru a charakteristický nález při kontrastním CT či sonografii [4,6]. Optimální načasování kontrastního CT je 72−96 hodin od začátku příznaků, sonografii většinou provádíme vstupně, je přínosná zejména v hodnocení podjaterní krajiny, ale obtížně posuzuje např. pankreatické nekrózy či střevní ischemii [9]. Atlantská klasifikace dále definuje 3 stupně závažnosti AP – od lehké AP, u níž nedochází ani k selhání orgánů, ani k rozvoji lokálních či systémových komplikací, přes středně těžkou AP s přechodným orgánovým selháním odeznívajícím do 48 hodin nebo s vyjádřenými lokálními či systémovými komplikacemi bez orgánového selhání delšího než 48 hodin, až po těžkou akutní pankreatitidu se selháním jednoho či více orgánů perzistujícím více než 48 hodin [4,6,10,11]. Další prognóza pacienta přímo závisí na perzistenci orgánového selhání a rozvoji sekundární infekce pankreatických nekróz. Smrtnost lehké akutní pankreatitidy je minimální, zatímco u těžké formy dosahuje 20−40 % [4]. Příčinný inzult spouští zánětlivý proces zahrnující aktivaci zánětlivých cytokinů a pankreatických enzymů, v jejichž důsledku dochází k autodigestivnímu postižení žlázy a následně i okolních tkání [6]. Je důležité si uvědomit, že se nejedná o izolované zánětlivé postižení pankreatu, ale jsou postiženy i další retroperitoneální tkáně, přičemž jsou v peritoneální dutině, ve střevě a v retroperitoneu často zadrženy litry extracelulární tekutiny. Jedním z nejzávažnějších problémů u AP je fakt, že progrese ze stadia lehkého edému k hemoragické nekrotizující pankreatitidě je často velmi rychlá [5]. Pacienti v těžkém stavu vyžadují multidisciplinární přístup, jehož součástí je i léčba chirurgická [11]. Rychlost zahájení léčby a strategie léčby hraje klíčovou roli. Je tedy snaha již vstupně vyselektovat pacienty s vyšším rizikem rozvoje těžké AP. Vznikla řada skórovacích systémů, mezi často používané patří BISAP skóre (Tab. 1). Přínosná mohou být Ransonova kritéria hodnotící určité parametry při přijetí (věk, hladinu leukocytů, glykemii, AST, LDH) a po 48 hodinách od přijetí (vzestup sérové urey, kalcémii, hypoxémii, deficit bází, odhadovanou sekvestraci tekutin). Dalšími používanými skórovacími systémy jsou například APACHE II či SOFA skóre [12]. Pacienti s očekávaným těžkým průběhem a již nestabilní nebo rizikoví pacienti by měli být hospitalizováni na jednotkách intenzivní péče již iniciálně.
Těžká akutní pankreatitida je charakterizovaná perzistujícím orgánovým selháním jednoho či více orgánů. V principu probíhá ve dvou fázích. V časné fázi v prvních dnech jde o dysfunkci orgánů následkem vlastního SIRS při vyplavení velkého množství zánětlivých mediátorů, dominuje redistribuce tekutin, útlum imunitního systému a rizika plynoucí z bakteriální translokace. V pozdní fázi (přibližně ve 3.−4. týdnu) pak převažují následky pankreatické nekrózy a sepse s možným rozvojem dalších závažných komplikací (mimo jiné ischemie či perforace gastrointestinálního traktu, infarkt sleziny, trombóza portálního řečiště, vznik pseudoaneurysmat či eroze peripankreatických cév s vysokým rizikem krvácení, pankreatický ascites). Tyto stavy, nezřídka následované multiorgánovým selháním, často končí smrtí [3,6]. Základním principem léčby těchto těžkých stavů je intenzivní péče zahrnující tekutinovou resuscitaci směřující k obnově objemu cirkulující tekutiny potřebné k prokrvení životně důležitých orgánů a zábraně jejich selhání. Za roztok volby je považován Ringerův laktátový roztok [4]. Dále je klíčová podpůrná léčba ve smyslu dostatečné oxygenace, antikoagulační profylaxe, korekce glykemie, léčba bolesti. Preventivní podávání antibiotik není asociováno se signifikantním poklesem mortality či morbidity [9,13]. Je doporučeno řídit se obecnými zásadami antibiotické politiky směřujícími k minimalizaci rizika rozvoje antibiotické rezistence, a proto by antimikrobiální profylaxe neměla být rutinně podávána [4]. Pokud je antibiotická léčba indikována, empiricky volíme antibiotika s dobrým průnikem do pankreatických nekróz pokrývajícím jak aerobní, tak anaerobní spektrum a grampozitivní i gramnegativní organismy. Častým nálezem v pankreatických nekrózách bývají kvasinky. Účinné se jeví acylureidopeniciliny a cefalosporiny III. generace. Karbapenemy rezervujeme pro kriticky nemocné pacienty [9]. Další důležitou kapitolou je výživa pacientů s AP. Pacientům s akutní pankreatitidou by neměl být rutinně předepisován režim s vyloučením perorálního příjmu. Pokud perorální příjem nestačí pokrýt nutriční potřeby nebo se jedná o těžší formu pankreatitidy, upřednostňujeme enterální výživu (ideálně zahájenou do 72 hodin od příjmu) před výživou parenterální [4]. Hlavní posun v léčbě AP je v řešení komplikací směrem k miniinvazivním technikám prováděným indikovaně, včas, ale pokud možno co nejpozději od iniciálního inzultu [3]. Infekční komplikace jsou hlavní příčinou morbidity a mortality pacientů s AP, infekce pankreatických či peripankreatických nekróz vzniká nejčastěji bakteriální translokací z tlustého střeva, ascendentním šířením z duodena do žlučových cest nebo hematogenním šířením z jiného zdroje či iatrogenně [10]. Na infekci upozorní nelepšící se stav pacienta, elevace teplot a zánětlivých parametrů, případně septický stav adekvátně nereagující na nasazení antibiotik. Z paraklinických vyšetření se nejpřínosnější jeví kontrastní CT vyšetření, které například zobrazením bublin plynu v nedrénované kolekci může podpořit podezření na anaerobní infekci. Rutinní provádění CT navigované tenkojehlové aspirační biopsie peripankreatických hmot se dnes nedoporučuje, při významném podezření je indikována drenáž. Indikace k invazivním zákrokům přehledně shrnuje tabulka (Tab. 3)[3,10,14].
Tab. 3. Shrnutí indikace invazivních zákroků [1]
Tab. 3: Summary of indications for invasive procedures [1]![Shrnutí indikace invazivních zákroků [1]<br>
Tab. 3: Summary of indications for invasive procedures
[1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e87450453de326f81bb9870275fdbc2c.jpg)
Metody miniinvazivní jsou pro pacienta šetrnější, snižují riziko recidivy dalšího multiorgánového selhání, riziko mortality i rozvoje pooperačního diabetu [7] a jsou spojeny i s menšími náklady na léčbu [4]. Otevřená chirurgická revize dutiny břišní je rezervována pro pacienty, u nichž miniinvazivní terapie selhala, nebo v případě náhle vzniklé život ohrožující komplikace.
Management u biliární pankreatitidy se v principu neliší od již popsaného. Specifickou problematikou je zajištění biliární dekomprese a následně prevence recidivy obstrukce žlučových cest. V dnešní době jsou u AP jedinými dvěma indikacemi k provádění akutních ERCP s endoskopickou papilosfinkterotomií akutní cholangitida a obstrukce společného žlučového vývodu s významnou či progredující cholestázou. U akutní cholangitidy má být výkon proveden co nejdříve – nejpozději do 24 hodin od počátku příznaků. Při obstrukci společného žlučového vývodu s cholestázou se za bezpečné považuje provést zákrok do 72 hodin od počátku příznaků. V případě probíhající AP je během ERCP cíleně sondován a kontrastní látkou nastřikován pouze biliární strom, pankreatický vývod se nenastřikuje v obavě ze zhoršení již probíhajícího zánětu slinivky. Pokud není možné z nějakého důvodu ošetřit a zrevidovat žlučové cesty pomocí ERCP, je možností chirurgická revize žlučových cest s cholecystektomií. Jedná se o urgentní výkon s vysokou morbiditou i mortalitou, který je opodstatněné provést pouze při fulminantní cholangitidě [3].
Otevřená chirurgická nekrektomie byla dlouhá léta tradičním postupem léčby infikované nekrózy ať už ze střední laparotomie, či z transverzálního subkostálního řezu [10]. Toto postavení je v dnešní době v rámci již zmíněného „step-up“ postupu nahrazeno z velké části miniinvazivními technikami a chirurgický zákrok by měl být použit až jako poslední možnost řešení. Je nutné provést předoperační CT či MR vyšetření, aby byla identifikována a následně ošetřena všechna infikovaná ložiska, a naopak neotevírat prostory, kde infekce zatím není. Současně je nutné pacienta co nejvíce normalizovat stran hemokoagulace. Otevřené chirurgické revizi nelze upřít výhody v podobě dobré explorace dutiny břišní, širokého přístupu k pankreatu a poměrně bezpečného i šetrného debridement [11]. Klíčové se jeví načasování výkonu, který je zatížen větší mortalitou, obzvláště pokud musí být proveden v prvních 14 dnech od počátku onemocnění. Indikace k operační léčbě shrnuje tabulka (Tab. 4).
Tab. 4. Indikace chirurgické léčby [1]
Tab. 4: Indications for surgical treatment [1]![Indikace chirurgické léčby [1]<br>
Tab. 4: Indications for surgical treatment [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/f15a0384cbb019a92d4d7c337182f856.jpg)
Popisovány jsou laparoskopické postupy v případě nekrektomií či laparoskopické drenáži kolekcí. Laparoskopický přístup je miniinvazivní modalitou otevřené nekrektomie. Vzhledem k obtížnému provedení po technické stránce, nutnosti kapnoperitonea u fragilních pacientů v těžkém stavu a riziku diseminace infekčních fokusů po břišní dutině není v dnešní době metodou volby v léčbě infikovaných nekróz [11]. Navíc o těchto výkonech nelze uvažovat u pacientů se známkami nitrobřišní hypertenze – a u těchto pacientů je chirurgická intervence indikována velmi často. Na druhou stranu pacienti s vyzrálou infikovanou nekrózou po minimálně dvou týdnech trvání choroby mohou z laparoskopického přístupu profitovat. Chirurgickou nekrektomii je dle potřeby možné provést jak transperitoneálně, tak extraperitoneálně a oba přístupy mohou být provedeny jak otevřeně z laparotomie či lumbotomie, tak laparoskopicky (retroperitoneoskopicky) [3,15]. Při laparoskopické transperitoneální drenáži je výhodné umístit do omentální burzy čtyři drény, dva ke kaudě a dva k hlavě pankreatu s vyvedením do kříže a s uzavřením omentální burzy suturou velké předstěry k žaludku. V případě omezení nekróz na přední plochu slinivky může být metodou volby transgastrická laparoskopická nekrektomie s interní drenáží do žaludku. Kolekce nepřístupné laparoskopii by měly být „dodrénovány“ perkutánně, případně endoskopicky. Vždy by měl být odebraný materiál odeslán k mikrobiologickému vyšetření [16]. Po débridementu by měla být zavedena drenáž ke kontinuální laváži. K laváži je ideální fyziologický roztok, nejsou nutná žádná lokální dezinficiens ani antibiotika. V akutním stadiu je uzávěr laparotomie mnohdy obtížný, až nemožný, proto je možné ponechat laparostoma. Laparostoma je také vhodné při opakovaných revizích dutiny břišní, například při nejisté vitalitě střeva. Laparostoma by v současnosti mělo využívat podtlakovou terapii a je doporučeno k němu připojit fasciální trakci [17]. Některé práce uvádějí, že podtlaková terapie redukuje výskyt pozdních incizionálních kýl [16]. V případě laparostomatu nikdy nevolíme příčnou laparotomii, která se vlivem retrakce přímých břišních svalů s větším časovým odstupem velmi obtížně uzavírá a nese s sebou větší riziko vzniku kýl. Při každé další revizi bychom se měli pokoušet o zmenšení laparostomatu a usnadnit tak následný definitivní uzávěr. I tak se někdy nevyhneme nutnosti relaxačních laterálních nářezů fascie šikmých svalů. Chirurg musí vést v patrnosti i specifické komplikace s open abdomen související, jako jsou ztráta proteinů a hyperkatabolický stav, bakteriální kolonizace a možný vznik enterální píštěle. Pozdní uzávěr laparostomatu (později než za 7 dní od primárního chirurgického ošetření) výrazně zvyšuje riziko těchto komplikací [16].
Součástí všech revizí pankreatitid jakékoli etiologie by měla být cholecystektomie, pokud je to technicky možné. Důvodem je fakt, že i u pacientů s nebiliární etiologií pankreatitidy se může rozvinout nekrotizující cholecystitida či akalkulózní cholecystitida akutně nemocných – které již jsou indikací k neodkladnému provedení cholecystektomie [16]. Cholecystektomie snižuje riziko opakování biliární AP i dalších biliárních komplikací, jako jsou koliky, obstrukce či cholangitidy. Je prokázáno, že nebyla-li cholecystektomie provedena, tak až u 30 % pacientů s AP dochází v řádu měsíců k recidivě [3]. Načasování cholecystektomie je předmětem diskuzí a u pacientů s lehkou či středně těžkou biliární pankreatitidou je možné její provedení během téže hospitalizace po normalizaci stavu. U pacientů s těžkou biliární AP je možné cholecystektomii provést po krátké rekonvalescenci po odeznění aktivity zánětu a resorpci kolekcí. Načasování výkonu je nutno individuálně posoudit u pacientů se závažnými komorbiditami a/nebo věkem nad 80 let, kdy je například možné jej „nahradit“ endoskopickou papilosfinkterotomií [3].
Těžká akutní nekrotizující pankreatitida je jednou z hlavních příčin rozvoje břišního kompartment syndromu [18], jak již bylo uvedeno výše. Příčinou bývá rychlý přesun a akumulace tekutin v abdominální a retroperitoneální oblasti, významný podíl může mít i příliš razantní volumoterapie. Dochází ke zvyšování nitrobřišního tlaku a u rizikových pacientů je nutné jej monitorovat. Bylo testováno více technik monitorace, jednak nepřímé (intragastrická, intrakolická, intravenózní), jednak přímé metody – měření IAP intraperitoneálním katétrem. Zlatým standardem je v dnešní době měření intravezikálně za pomoci speciálního močového katétru [18]. Pokud dojde k rozvoji tohoto stavu, nejprve se jej snažíme zvládnout konzervativně, můžeme provést luminální dekompresi gastrickou sondou či desuflaci tlustého střeva, důležitá je vyrovnaná či mírně negativní bilance tekutin, účinná analgezie. Zároveň musíme mít na paměti dostatečný systémový perfúzní tlak v prevenci ischemického poškození nitrobřišních orgánů. Stav nereagující na konzervativní postup je indikován k dekompresi perkutánní, nejčastěji CT navigovanou drenáží, některá pracoviště referují dobré zkušenosti s bedside zavedením několika pigtail drénů pod sonografickou kontrolou [18]. Chirurgická léčba přichází na řadu při selhání těchto postupů ve formě dekompresní laparotomie, při níž se doporučuje neotevírat ani burzu, ani retroperitoneum ve snaze zabránit sekundární infekci těchto prostor. Při operaci je taktéž potřeba provést desuflaci útrob bez jejich otevření (přesunutí obsahu tenkého střeva do žaludku a odsátí sondou) a drenáž všech kolekcí.
Při těžké AP mohou nastat také krvácivé komplikace. Může jít o krvácení do gastrointestinálního traktu, peritoneální dutiny nebo zakrvácení do pankreatického parenchymu či peripankreatických hmot, kdy je vlivem agresivní pankreatické šťávy erodována probíhající céva. Terapeutická léčba respektuje zásady léčby akutního krvácení, k lokalizaci zdroje může posloužit CT angiografie s možnostmi vasografické embolizace krvácející cévy. V případě urgentní situace s život ohrožujícím krvácením je indikována chirurgická revize s ošetřením zdroje krvácení, eventuálně tamponádou [19].
Disrupce pankreatického vývodu je spojena s rozsáhlejší nekrózou zejména střední části pankreatu. Podílí se na tvorbě pankreatických a peripankreatických kolekcí, výpotků, ascitu a píštělí. Tyto komplikace se snažíme řešit multidisciplinárními postupy. Postupem první volby je podle současného doporučení Evropské společnosti pro gastrointestinální endoskopii postup endoskopický – transpapilární či transgastrická drenáž. Tyto metody mají přednost před perkutánními. Transgastrické plastové stenty se ponechávají několik měsíců. Snaha o minimální stimulaci pankreatu parenterální výživou či podávání somatostatinu má v celé situaci jen podružný význam. Část pacientů ale nakonec vyžaduje chirurgické řešení (distální pankreatektomii či drenážní operaci) [3,20].
Tvorba pankreatické píštěle je nejčastěji důsledkem drenáží či chirurgických zákroků, ale může vzniknout i spontánně. Vzhledem k tomu, že drénuje nekrotické či infikované hmoty, nesnažíme se ji v obavě z tvorby abscesu předčasně zavírat. Naproti tomu fistulace mezi pankreatickými či peripankreatickými kolekcemi a střevem jsou indikací k neodkladnému chirurgickému zákroku [3].
Atlantská klasifikace dělí peripankreatické tekutinové kolekce do 4 skupin: akutní peripankreatické kolekce, pankreatické pseudocysty, akutní nekrotické kolekce a vyzrálé nekrózy. Jejich management s ohledem na časovou osu průběhu těžké akutní pankreatitidy shrnuje schéma na obrázku (Obr. 5). Obecně je možné říci, že pokud je nutno řešit kolekce v časné fázi AP (neohraničené kolekce), je metodou volby radiologicky (nejčastěji CT) navigovaná drenáž a teprve u ohraničených kolekcí (vznikajících nejdříve po 3−4 týdnech trvání nemoci) je možné přistoupit k endoskopické drenáži. Pankreatické pseudocysty jsou mnohdy bezpříznakové, někdy spontánně vymizí. Indikacemi k řešení pseudocysty jsou významné komplikace – infekce, krvácení, útlak dvanáctníku, cév nebo žlučového stromu, pankreatický ascites nebo pleurální píštěl a podezření na malignitu. Dle velikosti a klinických projevů můžeme predikovat vznik komplikací, vyšší riziko je u asymptomatických pseudocyst větších než 5−6 cm, které neregredují během 6 týdnů, a u symptomatických pseudocyst (tlak, bolesti, dyspepsie, krvácení). Perkutánní CT navigovaná drenáž se ukázala jako poměrně neefektivní, a proto jsou v dnešní době preferovány buď endoskopická, nebo chirurgická (ideálně laparoskopická) vnitřní drenáž pseudocysty [21]. V rozhodování o přístupu je kritériem síla stěny mezi lumen žaludku a pseudocysty. U síly stěny do 1 cm má přednost endoskopické řešení, při větší vzdálenosti pak chirurgické. Endoskopicky je možné provést transgastrickou drenáž, pseudocysty komunikující s hlavním pankreatickým vývodem lze řešit endoskopickou transpapilární drenáží. Chirurgickým řešením je vnitřní drenáž pseudocysty s napojením a konstrukcí anastomózy se žaludkem (Jedličkova operace, Juraszova operace), duodenem nebo tenkou kličkou. Ideální je však chirurgické řešení asymptomatických pseudocyst s odstupem více než 8 týdnů. Chirurgická i endoskopická léčba mají srovnatelnou jak úspěšnost, tak procento komplikací, výhodou endoskopického řešení je, že je levnější a délka hospitalizace je kratší [3,22].
Obr. 5. Časová osa step-up postupu u peripankreatických tekutinových kolekcí při těžké akutní pankreatitidě [14]
Fig. 5: Timeline of the step-up approach for peripancreatic fluid collections in severe acute pancreatitis [14]![Časová osa step-up postupu u peripankreatických tekutinových kolekcí při těžké akutní pankreatitidě [14]<br>
Fig. 5: Timeline of the step-up approach for peripancreatic fluid collections in severe acute pancreatitis [14]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/3cc9a86a986ffdd78573e7c422fc466e.jpg)
ZÁVĚR
Po každé chirurgické revizi dojde během prvních dvou až tří dnů ke klinickému zhoršení stavu pacienta v reakci na operační stres. Proto je současný trend v léčbě akutní pankreatitidy postupovat co nejvíce konzervativně, případně miniinvazivně se snahou chirurgickou léčbu oddalovat a rezervovat pro stavy nezvládnutelné jinak.
Výhodné je provedení cholecystektomie ať již při akutní revizi u těžké pankreatitidy, či během hospitalizace pro lehčí formu akutní pankreatitidy.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jana Sedláčková
Chirurgická klinika FN Hradec Králové
e-mail: jana.sedlackova@fnhk.cz
Zdroje
1. Pannala R, Kidd M, Modlin IM. Acute pancreatitis: a historical perspective. Pancreas 2009 May;38(4):355−366. doi: 10.1097/ MPA.0b013e318199161c.
2. Akinfemiwa O, Muniraj T. Amylase. In: StatPearls [Internet], Treasure Island (FL): StatPearls Publishing 2022.
3. Trna J, Kala Z, Kunovský L, et al. Klinická pankreatologie, 2. přepracované a doplněné vydání. Praha, Maxdorf 2021 : 78−142.
4. Maňák J, Rejchrt S, Andrašina T, et al. Těžká akutní pankreatitida: Adaptovaný doporučený postup (NICE guideline: Pancreatitis, AGA: Initial Medical Treatment of Acute Pancreatitis). Národní portál klinických doporučených postupů. Published in 2022.
5. Zadák Z, Havel E, et al. Intenzivní medicína na principech vnitřního lékařství. 2. doplněné a přepracované vydání. Praha, Grada 2017 : 287−297.
6. Pagliari D, Brizi MG, Saviano A, et al. Clinical assessment and management of severe acute pancreatitis: a multidisciplinary approach in the XXI century. Eur Rev Med Pharmacol Sci. 2019 Jan;23(2):771−787. doi: 10.26355/eurrev_ 201901_16892.
7. Morato O, Poves I, Ilzarbe L, et al. Minimally invasive surgery in the era of step-up approach for treatment of severe acute pancreatitis. Int J Surg. 2018 Mar;51 : 164−169 doi: 10.1016/j. ijsu.2018.01.017.
8. Harfouche M, Clark J, Kim K, et al. Characteristics and outcomes of drainage versus surgery first in severe pancreatitis. Am Surg. 2020 Sep;86(9):1073−1077. doi: 10.1177/0003134820943118.
9. Leppaniemi A, Tolonen M, Tarasconi A, et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg. 2019 Jun 13;14 : 27. doi: 10.1186/s13017-019-0247-0.
10. El Boukili I, Boschetti G, Belkhodja H, et al. Role of surgery in acute necrotizing pancreatitis. J Visc Surg. 2017 Dec;154(6):413−420. doi: 10.1016/j.jviscsurg. 2017.06.008.
11. Ulrych J. Akutní pankreatitida – pohled chirurga. Rozhledy v chirurgii 2019; 98 : 18−23.
12. Silva-Vaz P, Abrantes AM, Castelo-Branco M, et al. Multifactorial scores and biomarkers of prognosis of acute pancreatitis: Applications to research and practice. Int J Mol Sci. 2020 Jan 4;21(1):338. doi: 10.3390/ijms21010338.
13. Nayar MK, Bekkali NLH, Bourne D, et al. Novel multidisciplinary hub-and-spoke tertiary service for the management of severe acute pancreatitis. BMJ Open Gastroenterol. 2021 Mar;8(1):e000501. doi: 10.1136/bmjgast-2020-000501.
14. Baron TH, DiMaio ChJ, Wang AY, et al. American Gastroenterological Association clinical practice update: Management of pancreatic necrosis. Gastroenterology 2020 Jan;158(1):67−75.e1. doi: 10.1053/j.gastro.2019.07.064.
15. Heckler M, Hackert T, Hu K, et al. Severe acute pancreatitis: surgical indications and treatment. Langenbecks Arch Surg. 2021 May;406(3):521−535. doi: 10.1007/s00423-020-01944-6.
16. Siebert M, Le Fouler A, Sitbon N, et al. Management of abdominal compartment syndrome in acute pancreatitis. J Visc Surg. 2021 Oct;158(5):411−419. doi: 10.1016/j.jviscsurg.2021.01.001.
17. Husu HL, Leppaniemi AK, Mentula PJ. Who would benefit from open abdomen in severe acute pancreatitis? A matched case-control study. World J Emerg Surg. 2021 Jun 10;16(1):32. doi: 10.1186/ s13017-021-00376-x.
18. Soonyoung P, Seungho L, Hyo Deok L, et al. Abdominal compartment syndrome in severe acute pancreatitis treated with percutaneous catheter drainage. Clin Endosc. 2014 Sep;47(5):469−4672. doi: 10.5946/ce.2014.47.5.469.
19. Sorrentino L, Osvaldo Ch, Mutignani M, et al. Combined totally mini-invasive approach in necrotizing pancreatitis: a case report and systematic literature review. World J Emerg Surg. 2017 Mar 16;12 : 16. doi: 10.1186/s13017-017-0126 - 5.
20. Arvanitakis M, Dumonceau JM, Albert J, et al. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy 2018 Apr;50 : 524−546. doi: 10.1055/a-0588-5365.
21. Lancaster A, Zwijacz M. Acute pancreatitis and fluid filled collections: Etiology and endoscopic management. Gastroenterol Nurs. 2019 Sep/Oct;42(5):417−419. doi: 10.1097/SGA.0000000000000396.
22. Umapathy Ch, Gajendran M, Mann R, et al. Pancreatic fluid collections: Clinical manifestations, diagnostic evaluation and management. Dis Mon. 2020 Nov;66(11):100986. doi: 10.1016/j.disamonth. 2020.100986.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Editorial
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2023 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Editorial
- Maisonneuveova zlomenina hlezna
- Náhlé příhody břišní v onkochirurgii
- Postavení chirurgické léčby v rámci step-up managementu těžké akutní pankreatitidy
- Fresh arterial allograft as a replacement for an infected common femoral prosthetic graft and recurrent false aneurysm
- Akutní hemoragická cholecystitida jako vzácná příčina hemobilie
- Adenokarcinom tenkého střeva asociovaný s Crohnovou chorobou
- Borreliový pseudolymfom obočí u dospělého pacienta
- Aktuální kontroverze v léčbě varixů dolních končetin a jejich komplikací
- Zápis z jednání Redakční rady časopisu Rozhledy v chirurgii, konané online dne 23. 2. 2023.
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Maisonneuveova zlomenina hlezna
- Náhlé příhody břišní v onkochirurgii
- Postavení chirurgické léčby v rámci step-up managementu těžké akutní pankreatitidy
- Fresh arterial allograft as a replacement for an infected common femoral prosthetic graft and recurrent false aneurysm
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



