-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klonální evoluce u chronické lymfocytární leukemie
Clonal evolution in chronic lymphocytic leukemia
Chromosomal aberrations have important prognostic significance in patients with chronic lymphocytic leukemia. Aberrations detected by fluorescence in situ hybridization define specific subgroups that differ in the overall survival and the time from diagnosis to first treatment. Patients with deletion 17p appear resistant to standard chemotherapy regimens and detection of this cytogenetic abnormality may influence therapeutic decisions. Because additional genetic defects (clonal evolution) may be acquired during the course of the disease, cytogenetic analysis is recommended not only at diagnosis, but prior every line of the treatment.
Key words:
chronic lymphocytic leukemia, chromosomal aberations, clonal evolution
Autori: M. Brejcha 1; J. Mayer 2; D. Klodová 1; J. Sobotka 1; M. Wróbel 1; M. Doubek 2; Y. Brychtová 2; Š. Pospíšilová 2
Pôsobisko autorov: Kooperující pracoviště České leukemické skupiny – pro život (CELL , The CzEch Leukemia Study Group – for Life) *; Hematologické oddělení, Onkologické centrum J. G. Mendela, Nový Jičín 1; Interní hematoonkologická klinika FN Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 2, p. 103-106.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Významným prognostickým faktorem u pacientů s chronickou lymfocytární leukemií je nález chromozomálních aberací. Jejich průkaz pomocí fluorescenční in situ hybridizace umožňuje rozdělit pacienty do prognostických skupin s rozdílným celkovým přežitím a intervalem od diagnózy do zahájení první terapie. Nález delece 17p je spojený s rezistencí na standardní chemoterapeutické režimy a průkaz této aberace může modifikovat léčebné rozhodnutí. Protože změny karyotypu nejsou stabilní po celou dobu onemocnění a v průběhu choroby může dojít ke klonální evoluci se vznikem nových aberací, je vhodné provádět cytogenetické vyšetření nejen při diagnóze, ale zvláště před zahájením každé linie léčby.
Klíčová slova:
chronická lymfocytární leukemie, chromozomální aberace, klonální evoluceÚvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií v dospělém věku v Evropě a Severní Americe. Klinický průběh onemocnění je velmi různorodý. U některých pacientů může mít onemocnění dlouhé, roky trvající bezpříznakové období s jediným znakem nemoci – lymfocytózou. Na druhé straně jsou pacienti, u kterých má nemoc agresivní průběh i přes řádně vedenou terapii. Základní prognostický údaj v době diagnózy poskytuje stanovení klinického stadia dle Raie a Bineta (1, 2). Tyto stážovací systémy definují nízké (Rai 0, Binet A), střední (Rai I/II, Binet B) a vysoké (Rai III/IV, Binet C) riziko onemocnění. Mezi jednotlivými rizikovými skupinami kolísá medián přežití od 1–3 let u pacientů ve vyšším klinickém stadiu až po více než 10 let u pacientů v stadiu nízkém. Mezi pacienty stejného klinického stadia je přesto značná variabilita v chování nemoci. Individuální riziko progrese lze definovat na základě řady klinických a laboratorních nálezů, včetně moderních cytogenetických a molekulárně genetických vyšetření (3, 4). Chromozomální aberace jsou u chronické lymfocytární leukemie v současnosti detekovány především fluorescenční in situ hybridizací (5, 6). Po zavedení nové metody kultivace buněk (CPG oligonukleotidy s interleukinem 2) se zvýšil záchyt aberací klasickým vyšetřením karyotypu a byl dále rozšířen prognostický význam cytogenetického vyšetření (7–9). Kromě toho, že cytogenetické abnormality mají významnou prognostickou hodnotu, je jejich nález důležitý pro stanovení léčebné strategie (10). Pacienti s chronickou lymfocytární leukemií mohou v průběhu onemocnění podstoupit i více linií terapie. Při volbě léčebného protokolu je nutno vzít v úvahu, že změny karyotypu nemusí být stabilní po celou dobu trvání nemoci.
Cytogenetické vyšetření
Při klasickém cytogenetickém vyšetření jsou u pacientů s CLL prokazovány chromozomální aberace ve 40 až 50 % případů (11). Se zavedením metodiky fluorescenční in situ hybridizace (FISH) se záchyt cytogenetických změn u CLL zvýšil na více než 80 %, přičemž nejčastěji prokazovanými aberacemi jsou delece 13q, delece 11q, trisomie 12 a delece 17p (5). Jednotlivé aberace korelují s celkovým přežitím (OS – overall survival) a intervalem do nutnosti zahájení léčby (TFS – treatment free survival) (5, 6). Nálezy delece 17p a delece 11q jsou považovány za prognosticky nepříznivé, zatímco ostatní nálezy jsou prognosticky příznivé (delece 13q), nebo neutrální (normální karyotyp, trisomie 12). Na základě porovnání jednotlivých aberací s klinickým průběhem nemoci bylo definováno celkem 5 prognostických skupin a vytvořen tzv. hierarchický model chromozomálních abnormalit (viz tab. 1). Kromě prognostického významu chromozomálních aberací byla prokázána jejich souvislost s klinickým chováním nemoci. Pro deleci 11q je charakteristická lymfadenopatie, pro deleci 17p rezistence na standardní chemoterapeutické režimy obsahující alkylační cytostatika a purinová analoga (12, 13). Novou prognostickou podskupinu u CLL představuje nález chromozomálních translokací. Po zavedení nové metodiky stimulace (CPG oligonukleotidy s interleukinem 2) se zvýšil záchyt chromozomálních aberací při klasickém cytogenetickým vyšetřením na přibližně 80 % a zároveň bylo prokázáno, že pro CLL jsou charakteristické především nebalancované translokace (7, 8). Na souboru 96 pacientů bylo následně zjištěno, že nález translokací koreluje se zkrácením OS (94 vs. 346 měsíců) i TFS (24 vs. 106 měsíců) (9). V této studii bylo zároveň prokázáno, že nález translokací modifikuje prognózu pacientů definovanou dle FISH. U pacientů s izolovanou delecí 13q byl nález translokací spojen se signifikantně kratším TFS (41 vs. 132 měsíců), u nemocných s delecí 11q zkrátil nález translokací TFS ze 48 měsíců na 13 měsíců.
Tab. 1. Hierarchický model chromozomálních abnormalit u CLL dle Döhnera a kol. (2000). 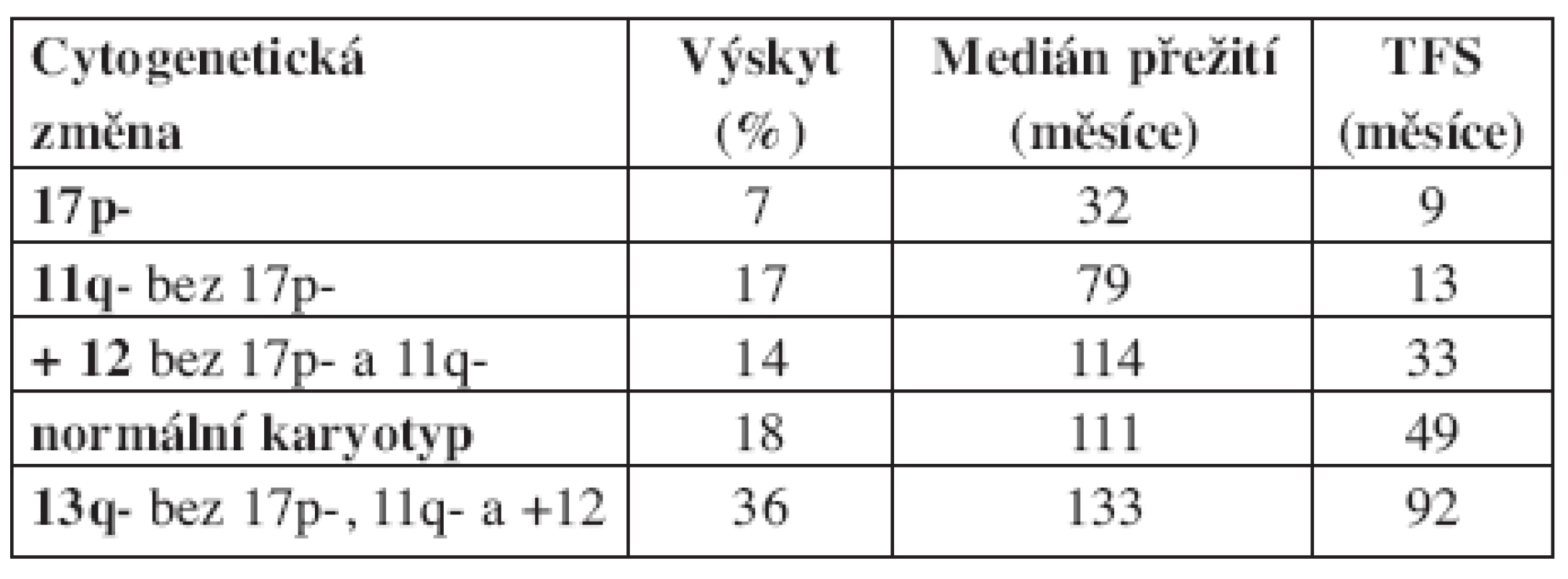
Klonální evoluce
Současně s průkazem cytogenetických abnormalit u CLL vyvstala otázka, zda jsou tyto aberace charakteristické pro maligní klon, či zda se v průběhu choroby mohou objevit další změny, které pak mohou eventuálně ovlivnit prognózu nemocných. Práce, které byly publikovány koncem 80. a počátkem 90. let minulého století, prokázaly, že ke klonální evoluci sice dochází, není ale příliš častá a nemá významnější dopad na prognózu. Největší práce z té doby pochází od Osciera a kol., kteří sledovali 112 pacientů s CLL (14). Změna karyotypu byla zaznamenána u 16 % (18/112) nemocných, pouze u jednoho z nich však byla jasná korelace mezi progresí choroby, změnou morfologie a změnou karyotypu. U ostatních pacientů s novou cytogenetickou změnou sice choroba progredovala, ale k progresi došlo ještě před vznikem nové změny karyotypu. Podobné výsledky měly i další dvě práce, které sledovaly menší počty pacientů. Juliusson a kol. zjistili změnu karyotypu u 15 % (6/41) sledovaných jedinců, přičemž pouze u dvou z nich se projevily současně i klinické změny (15). Nowel a kol. sledovali 21 pacientů po dobu 2 a více let (16). U 62 % (13/21) došlo k progresi choroby s nutností léčby, ani v jednom případě nebyla zaznamenána nová cytogenetická změna. Avšak mezi dalšími 12 pacienty, sledovanými méně než 2 roky, se vyskytli 4, kteří měli klonální evoluci, jež byla spojená s časnou mortalitou.
Z druhé poloviny 90. let minulého století pochází dvě práce, které přinesly poněkud odlišný pohled na změny karyotypu v průběhu CLL. Klonální evoluci považovaly za častější a zvláště prognosticky významný nález. Fegan a kol. prospektivně sledovali 45 pacientů s CLL (17). Klonální evoluce byla zjištěna v průběhu pětiletého sledování u 38 % (17/45) z nich a signifikantně korelovala s progresí choroby. Z celkového souboru došlo k progresi choroby u 35 % (16/45) pacientů a v této skupině byly změny karyotypu signifikantně častější (12/16, 75 %) než u jedinců se stabilní chorobou (5/29, 17 %). Podobné výsledky zaznamenali i Finn a kol. (18). Při sledování 51 pacientů došlo ke změně karyotypu u 43 % nemocných (22/51) a klinicky definovaná progrese (zvýšení Rai stadia či úmrtí na CLL) byla častější u jedinců se změnou karyotypu. Mezi nemocnými s klonální evolucí choroba progredovala u 50 % (11/22), zatímco mezi pacienty se stabilním karyotypem progredovala klinicky pouze u 17 % (5/29).
První práci sledující frekvenci klonální evoluce při použití FISH analýzy představili Shanafelt a kol. (19). V této prospektivní studii bylo sledováno 159 nemocných s dosud neléčenou CLL. Během pozorování byly změny cytogenetického nálezu zjištěny u 11 % (18/159) pacientů, přičemž míra klonální evoluce stoupala s trváním diagnózy. V prvních 2 letech sledování k ní došlo pouze u jednoho pacienta oproti 17 sledovaným 5 a více let. Medián vzniku nové cytogenetické změny od prvního FISH vyšetření byl 7,8 roků (od 1,9 do 11 roků). Celkem u 5 nemocných znamenala nová cytogenetická abnormalita zhoršení prognózy dle hierarchického modelu (viz tab. 2). Klonální evoluce byla častější mezi ZAP-70 pozitivními než ZAP-70 negativními jedinci. Podobný trend byl sledován i u nemocných s nemutovaným IgVH genem, zde ale nebylo dosaženo statistické významnosti pro malý počet pacientů, u kterých byl znám IgVH status. Klonální evoluce byla také častější u pacientů, kteří byli v průběhu sledování léčeni. Před vznikem změny karyotypu léčbu podstoupilo celkem 71 % nemocných. U všech pacientů s mutovaným IgVH genem byla novou cytogenetickou abnormalitou delece 13q, zatímco mezi jedinci s nemutovaným IgVH genem se u 4 nově objevila delece 17p a u jednoho delece 11q. Ukazuje se tak, že pacienti ZAP-70 pozitivní nebo s nemutovaným IgVH genem mají větší chromozomální instabilitu, a s tím spojené větší riziko vzniku nové cytogenetické změny. Vzhledem k tomu, že nově získané aberace u některých nemocných zhoršily prognózu dle hierarchického modelu, bylo možné předpokládat, že klonální evoluce představuje nepříznivý prognostický faktor. Toto bylo potvrzeno na stejném souboru o 2 roky později (20). Medián přežití mezi pacienty s klonální evolucí byl 2,3 roky, u jedinců bez klonální evoluce nebyl medián dosažen. Prognózu nemocných s klonální evolucí také ovlivnilo to, jaký typ aberace získali. Medián přežití pacientů, kteří získali deleci 17p nebo 11q, byl 1,3 roků, u jedinců s jinou novou aberací (nejčastěji delece 13q) nebyl medián dosažen (viz tab. 3).
Tab. 2. Klonální evoluce se zhoršením rizika dle hierarchického modelu. Podle Shanafelta (2006). 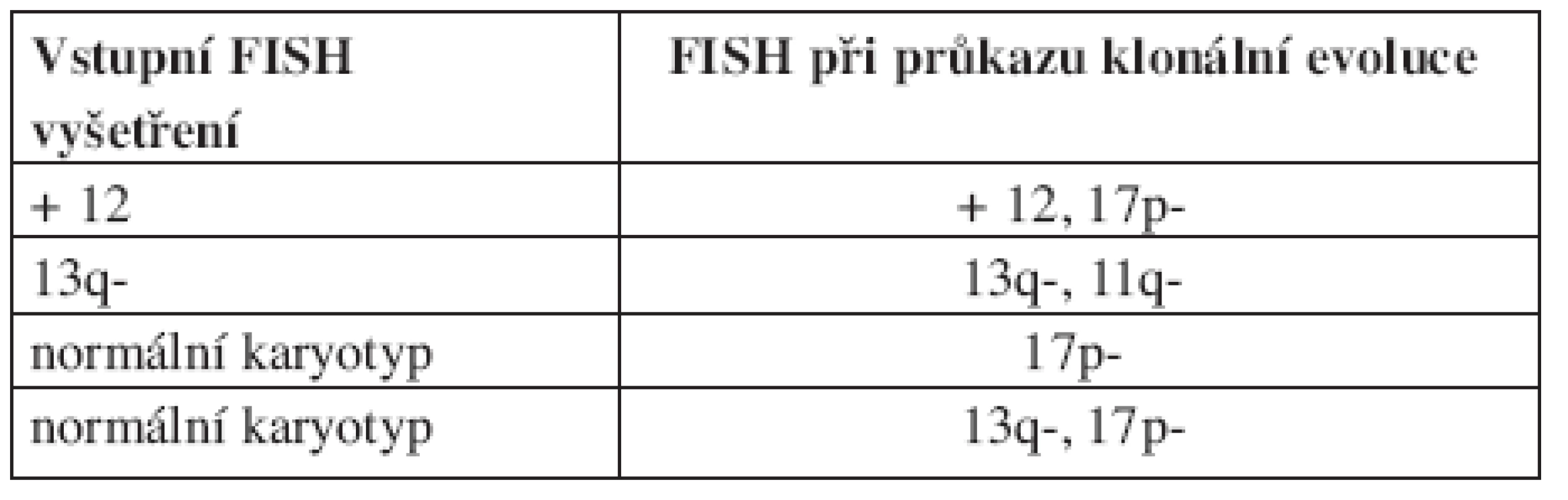
Tab. 3. Medián přežití od doby zjištěné klonální evoluce (medián sledování 2,1 roků). Podle Shanafelta (2008). 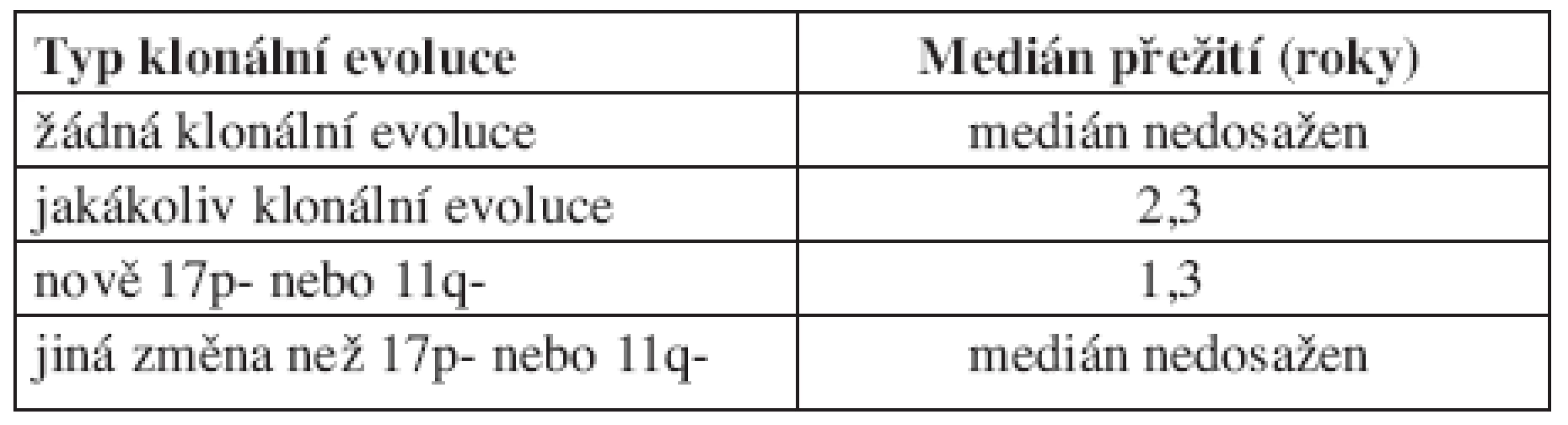
Opakované FISH vyšetření prováděli u pacientů s CLL také Stilgenbauer a kol. (21). Retrospektivně bylo zhodnoceno 64 pacientů s opakovaným cytogenetickým vyšetřením a u 17 % (11/64) z nich se v průběhu sledování objevila nová cytogenetická abnormalita: u čtyř delece 17p, u tří delece 6q, u dvou delece 11q, u jednoho trisomie chromozomu 8, a u tří došlo k evoluci z monoalelické delece 13q do bialelické delece 13q. Ve skupině s klonální evolucí byla patrná progrese v klinickém stadiu dle Bineta (82 % vs. 28 %) a častěji bylo nutno zahájit léčbu u dosud neléčených nemocných (91 % vs. 62 %). Klonální vývoj byl zaznamenán pouze u jedinců s nemutovaným IgVH genem a změny karyotypu byly častější u léčených nemocných. Léčeno bylo 9 z 11 (82 %) pacientů, u kterých došlo ke změně karyotypu. Delece 17p se objevila u tří pacientů, kteří byli předtím léčeni, ale byla také nově zjištěna u jednoho pacienta bez předchozí terapie. Klonální evoluce celkově představovala nepříznivý prognostický faktor, odhadovaný medián přežití od detekce klonální evoluce byl 21,7 měsíců.
Profil genové exprese
Poměrně novou technologií v onkologické diagnostice je využití tzv. DNA čipů (DNA microarrays), které dokážou stanovit stupeň exprese několika tisíců genů současně v jedné reakci a pomocí specializovaného softwaru je následně vytvořen tzv. profil genové exprese (gene expression profile – GEP) analyzovaného vzorku. Vy - užití DNA čipů v hematoonkologii je poměrně známé u difuzního velkobuněčného B lymfomu, kde pomocí stanovení profilu genové exprese lze odlišit 2 subtypy tohoto lymfomu s odlišnou prognózou (22). Chronická lymfocytární leukemie představuje další z hematologických malignit, na které byla problematika DNA čipů zkoumána. Rozdílným profilem genové exprese u pacientů se stabilní a progredující chorobou se zabývali např. Fält a kol. (23). Profil genové exprese byl stanoven u 11 pacientů se stabilní a 10 pacientů s progredující chorobou. Při porovnání GEP obou skupin byla nalezena skupina genů, které byly schopny odlišit obě klinické jednotky s přesností 70–90 %. Na problematiku změny genové exprese při progresi CLL se zaměřili Fernandez a kol. (24). U 16 pacientů s CLL byl opakovaně stanoven GEP. První vyšetření bylo provedeno v době diagnózy při nízkém klinickém stadiu (Binet A) a druhé vyšetření při progresi choroby (Binet B, C). Většina pacientů (15/16) měla nemutovaný IgVH gen a byla ZAP-70 pozitivní (12/16). Pro srovnání byli opakovaně vyšetřeni i 3 pacienti se stabilní chorobou (všichni měli nemutovaný IgVH gen a byli ZAP-70 pozitivní). Při stanovení GEP v době diagnózy a při progresi nemoci byla zjištěna skupina 58 genů odlišně exprimovaných v obou situacích. Toto nebylo pozorováno u pacientů s klinicky stabilní chorobou. Kromě GEP bylo vstupně provedeno i vyšetření komparativní genomovou hybridizací, která prokázala chromozomové změny u 56 % (9/16) pacientů. Při opakovaném vyšetření při progresi choroby byly u dalších 2 pacientů (2/16, 12,5 %) zjištěny nové chromozomální aberace. Progrese choroby tak byla spojena nejen se změnou GEP, ale i se změnou karyotypu.
Závěr
Přestože z uvedených skutečností vyplývá, že ke změnám karyotypu dochází u necelých 20 % pacientů s CLL, klonální evoluce představuje nepříznivý prognostický faktor spojený se zkrácením celkového přežití. Očekávat ji lze spíše u nemocných s delším trváním nemoci, u pacientů s nemutovaným IgVH genem, pozitivitou ZAP-70 a u těch, kteří již prodělali léčbu. Vzhledem k významu cytogenetického vyšetření pro zvolení léčebné strategie, by toto mělo být provedeno u všech pacientů, u nichž přichází v úvahu podání chemoterapie. Pro možný vznik klonální evoluce je vhodné vyšetření opakovat i před každou další linií léčby. V době diagnózy přináší cytogenetické vyšetření především prognostický údaj a jeho indikace by měla být rutinní.
Seznam použitých zkratek
CLL – chronická lymfocytární leukemie
FISH – fluorescenční in situ hybridizace
GEP – profil genové exprese
TFS – doba bez nutnosti léčby
OS – celkové přežití
MUDr. Martin Brejcha
Hematologické odd., OC JGM
Máchova 30
741 01 Nový Jičín
e-mail: martin.brejcha@onkologickecentrum.cz
Doručeno do redakce: 16. 10. 2008
Přijato: 19. 2. 2009
Zdroje
1. Rai KR, Sawitsky A, Cronkite EP, et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46 : 219–234.
2. Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48 : 198–206.
3. Mayer J, Schwarz J, Doubek M, et al. Co nám v každodenní praxi skutečně říkají tzv. moderní prognostické faktory u chronické lymfatické leukemie? Transf Hemat dnes 2007; 13 : 106–116.
4. Papajík T, Jarošová M, Pikalová Z, Indrák K. B-chronická lymfatická leukemie. Část II: Diagnostická kritéria a význam stavení individuální prognózy nemocného. Transfuze Hemat dnes 2006; 12 : 132–139.
5. Döhner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343 : 1910–1916.
6. Kröber A, Seiler T, Benner A, et al. V(H) station status, CD38 expression level, genomic abberations, and survival in chronic lymphocytic leukemia. Blood 2002; 100 : 1410–1416.
7. Dicker F, Schnittger S, Haferlach T, Kern W, Schoch C. Immunostimulatory oligonucleotide-induced metaphase cytogenetics detect chromosomal aberrations in 80% of CLL patients: a study of 132 CLL cases with correlation to FISH, IgVH status, and CD38 expression. Blood 2006; 108 : 3152–3160.
8. Haferlach C, Dicker F, Schnittger S, Kern W, Haferlach T. Comprehensive genetic characterization of CLL: a study on 506 cases analysed with chromosome banding analysis, interphase FISH, IgV(H) status and immunophenotyping. Leukemia 2007; 21 : 2442–2451.
9. Mayr C, Speicher MR, Kofler DM, et al. Chromosomal translocations are associated with poor prognosis in chronic lymphocytic leukemia. Blood 2006; 107 : 742–751.
10. Hallek M., Cheson BD, Katovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International workshop on chronic lymphocytic leukemia updating the National Cancer Institute–Working Group 1996 guidelines, Blood 2008; 111 : 5446–5456.
11. Juliusson G, Oscier DG, Fitchett M, et al. Prognostic subgroups in B-cell chronic lymphocytic leukemia defined by specific chromosomal abnormalities. N Engl J Med 1990; 323 : 720–724.
12. Döhner H, Stilgenbauer S, James MR, et al. 11q deletions identify a new subset of B-cell chronic lymphocytic leukemia characterized by extensit nodal involvement and inferior prognosis. Blood 1997; 89 : 2516–2522.
13. Döhner H, Fischer K, Bentz M, et al. p53 gene deletion predicts for poor survival and nonresponse to therapy with purine analogs in chronic B-cell leukemias. Blood 1995; 85 : 1580–1589.
14. Oscier D, Fitchett M, Hergert T, Lambert R. Karyotypic evolution in B-cell chronic lymphocytic leukaemia. Genes, Chromosomes & Cancer 1991; 3 : 16–20.
15. Juliusson G, Friberg K, Gahrton G. Consistency of chromosomal aberrations in chronic B-lymphocytic leukemia. Cancer 1988; 62 : 500–506.
16. Nowell PC, Moreau L, Growney P, Besa EC. Karyotypic stability in chronic B-cell leukemia. Cancer Genet Cytogenet 1988; 33 : 155–160.
17. Fegan C, Robinson H, Thompson P, Whittaker JA, White D. Karyotypic evolution in CLL: Identification of a new sub-group of patients with deletions of 11q and advanced or progressive disease. Leukemia 1995; 9 : 2003–2008.
18. Finn WG, Kay NE, Kroft SH, Church S, Peterson LC. Secondary abnormalities of chromosome 6q in B-cell chronic lymphocytic leukemia: A sequential study of karyotypic instability in 51 patients. Am J Hematol 1998; 59 : 223–229.
19. Shanafelt TD, Witzig TE, Fink SR, et al. Prospective evaluation of clonal evolution during long-term follow-up of patients with untreated early-stage chronic lymphocytic leukemia. J Clin Oncol 2006; 24 : 4634–4641.
20. Shanafelt TD, Hanson C, Dewald GW, et al. Karyotype evolution on fluorescent in situ hybridization analysis is associated with short survival in patiens with chronic lymphocytic leukemia and is related to CD49d expression. J Clin Oncol 2008; 26(14): e5–e6.
21. Stilgenbauer S, Sander S, Bullinger L, et al. Clonal evolution in chronic lymphocytic leukemia: acquisition of high-risk genomic aberrations associated with unmutated VH, resistence to therapy, and short survival. Haematologica 2007; 92 : 1242–1245.
22. Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of difuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403 : 503–511.
23. Fält S, Merup M, Gahrton G, Lambert B., Wennborg A. Identification of progression markers in B-CLL by gene expression profiling. Exp Hematol 2005; 33 : 883–893.
24. Fernandez V, Jares P, Salaverria I, et al. Gene expression profile and genomic changes in disease progression of early-stage chronic lymphocytic leukemia. Haematologica 2008; 93 : 132–136.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2009 Číslo 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Oznámení
- Klonální evoluce u chronické lymfocytární leukemie
- Adaptorové molekuly PAG, NTAL a LAT ve fyziologických lymfocytárních prekurzorech a u dětských leukemií
- Novinky v terapii nízce rizikových nemocných s myelodysplastickým syndromem
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Za prim. Jindřiškou Maškovou
- Recenze
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Leukémie u dojčiat
- Interfant 99 – léčebná studie zohledňující odlišnou biologii akutní lymfoblastické leukemie kojenců a její výsledky v České republice
- Rizikové faktory u chronické lymfocytární leukemie, validace flow-cytometrické detekce ZAP-70 pomocí RT-PCR a imunohistochemie
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2009_05 ze dne 15. 5. 2009
- Mikrochimérismus – na hraně počínajícího relapsu AML?
- K životnímu jubileu prim. MUDr. Dagmar Radochové, CSc.
- Klonální evoluce u chronické lymfocytární leukemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



