-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
Cytomegalovirus – specific cellular imunity: profile of immune function assesment provides clinically relevant answer
Introduction:
Effective immune response, mediated by T-cells in particular, is necessary to control CMV infection. Children after hematopoietic stem cell transplantation (HSCT) are highly vulnerable to repeated, often life-threatening CMV infections, due to secondary immunodeficiency caused by conditioning regimens.Methods:
We examined peripheral blood mononuclear cells of 57 healthy volunteers and 10 patients two or more years after HSCT for CMV antigen evoked ex vivo T-cell responses. We compared responses between CMV positive and CMV negative donors. We also compared responses among the CMV-positive children, adults and patients recovered two or more years after HSCT. Measurement of intracellular cytokines (IFN-γ and IL-2), activation molecule CD154 (CD40L), a marker of degranulation (CD107a) allowed us to define different subsets of CD4+ and CD8 + T-cell responses using multicolor flow cytometry.Results:
We found following subsets relevant for CMV control by comparing CMV seropositive and seronegative volunteers among CD4+ T-cells: IFN-γ+/CD40L+ and IFN-γ+/IL-2+/CD40L+. There were also five relevant populations among CD8+ T-cells: IFN-γ+/ IL-2+/CD107a+/CD40L+, IFN-γ+/IL-2+/CD40L+, IFN-γ+/IL2+, IFN-γ+/CD40L+ and IFN-γ+. When comparing children’s and adult healthy donors to patients 2 or more years after HSCT with fully restored immunity, we found no statistically significant differences, thus CMV specific immunity is fully restored after HSCT. Finally, we demonstrate comparison of the immune function profile of patients at risk of reactivation with those with fully restored immunity.Conclusion:
In conclusion, ex vivo testing of CMV specific T-cell immune responses is a valuable tool for immune monitoring of patients after HSCT and complements the already established method of CMV viral load monitoring using quantitative PCR.Key words:
cytomegalovirus, hematopoietic stem cell transplantation, intracellular detection of cytokines, flow-cytometry, immune reconstitution
Autori: L. Król 1,2; D. Kotus 1; D. Thürner 1; P. Hubáček 2
; P. Sedláček 2; O. Hrušák 1,2; J. Starý 2; T. Kalina 1,2
Pôsobisko autorov: CLIP – Cytometrie, Klinika dětské hematologie a onkologie, UK 2. lékařská fakulta a FN Motol 1; Klinika dětské hematologie a onkologie, UK 2. lékařská fakulta a FN Motol 2
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 3, p. 141-149.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Úvod:
Efektivní imunitní odpověď, zejména T-buněčná, je nezbytná pro kontrolu CMV infekce. Děti po transplantaci kmenových buněk krvetvorby jsou vysoce ohroženou skupinou, protože vlivem transplantačních režimů u nich dochází k sekundárnímu imunodeficitu, což vede k opakovaným, často život ohrožujícím, reaktivacím CMV s nutností léčby virostatiky.Metody:
Vyšetřili jsme ex vivo CMV antigenem vyvolanou odpověď mononukleárních buněk periferní krve 57 zdravých dobrovolníků a 10 pacientů 2 a více let po transplantaci. Měření intracelulárních cytokinů (IFN-γ a IL-2), aktivační molekuly CD154 (CD40L) a markeru degranulace (CD107a) pomocí mnohobarevné průtokové cytometrie nám umožnilo definovat různé podtypy CD4+ a CD8+ T-buněčné odpovědi.Výsledky:
Porovnáním CMV séropozitivních a séronegativních dobrovolníků jsme nalezli v rámci odpovědi CD4+ T-lymfocytů dvě populace buněk relevantní pro kontrolu CMV infekce: IFN-γ +/CD40L+ a IFN-γ +/IL-2+/CD40L+. V rámci odpovědi CD8+ T-lymfocytů se jednalo o 5 populací: IFN-γ +/IL-2+/CD107a+/CD40L+, IFN-γ +/IL-2+/CD40L+, IFN-γ +/IL2+, IFN-γ +/CD40L+ a IFN-γ +. Při srovnání dětských a dospělých CMV pozitivních dobrovolníků s pacienty s klinicky plně obnovenou imunitou více než dva roky po HSCT jsme nenalezli statisticky významné rozdíly, což znamená, že CMV specifická imunita je u nich plně funkčně obnovena. Nakonec demonstrujeme porovnání profilu imunitní funkce pacientů v riziku reaktivace s pacienty s plně obnovenou imunitou.Závěr:
Ex vivo stanovení CMV specifické T buněčné odpovědi je užitečným nástrojem monitorování imunity pacientů po HSCT a vhodně doplňuje již zavedené metody sledování pacientů pomocí kvantitativního PCR.Klíčová slova:
cytomegalovirus, transplantace kmenových buněk krvetvorby, intracelulární detekce cytokinů, průtoková cytometrie, rekonstituce imunityÚvod
Cytomegalovirus (CMV) je herpetický virus z rodiny beta-herpesviridae. Jedná se o běžný patogen, kterým je infikováno 50–90 % dospělé populace, přičemž procento séropozitivních jedinců stoupá s věkem (1).
U imunokompetentních jedinců je primoinfekce CMV nejčastěji asymptomatická, pouze ojediněle vede k horečce a tonsilitidě a obrazu mononucleosis-like syndromu. Po primoinfekci následuje latentní fáze, kdy virus přežívá zejména v makrofázích a jeho aktivita je limitovaná funkcí imunitního systému, především T-lymfocytů hostitele. CMV tak latentně perzistuje v hostiteli po zbytek života s občasnými, zpravidla asymptomatickými reaktivacemi.
Zcela odlišná situace je u imunokompromitovaných pacientů, u kterých bez virostatické terapie může CMV infekce probíhat fulminantně. Rozvíjí se viremie s horečkou a leukopenií a s poškozením orgánů je spojen obraz rozvinuté CMV nemoci. Cílovými orgány jsou zejména plíce, centrální nervový systém, játra a trávicí systém, u HIV pozitivních pacientů typicky retina. Nejčastěji se jedná o reaktivaci latentního CMV, méně často pak o primoinfekci.
Děti po transplantaci kmenových buněk krvetvorby (HSCT – hematopoietic stem cell transplantation) jsou vysoce ohroženou skupinou, neboť normální funkce imunitního systému, zvláště T-lymfocytů, se vlivem použitých transplantačních režimů obnovuje za 1 až 2 roky po HSCT (2). CMV proto zůstává příčinou signifikantní morbidity a mortality i přes výrazné pokroky v diagnostice a léčbě (3, 4).
Mezi hlavní rizikové faktory u pacientů po HSCT patří CMV sérostatus dárce a příjemce (5), přičemž nejrizikovější kombinací je CMV séropozitivní příjemce transplantovaný štěpem CMV séronegativního dárce (6) a reakce štěpu proti hostiteli (GvHD – graft versus host disease) s nutností léčby kortikoidy, které inhibují funkci T-lymfocytů (7).
Existuje několik terapeutických schémat, přičemž cílem všech je zahájit terapii ještě v okamžiku viremie, protože mortalita rozvinuté CMV nemoci se pohybuje kolem 90 %. V minulosti používaný tzv. preventivní režim, kdy se všichni pacienti léčili v prvních 3 měsících po HSCT ganciklovirem (GCV), se dnes již téměř nepoužívá. Jeho častou komplikací totiž byla tzv. pozdní CMV nemoc, opět s vysokou mortalitou, která se objevila po ukončení preventivní léčby GCV. Hlavními příčinami pozdní CMV nemoci jsou v tomto případě pravděpodobně myelotoxický účinek GCV vedoucí k pomalé rekonstituci specifické buněčné imunity a nízké množství CMV antigenů, které by stimulovaly funkci CMV specifických T-lymfocytů.
Proto je dnes standardem v léčbě CMV tzv. preemptivní režim, kdy jsou všichni pacienti po HSCT monitorování od dne +7 po HSCT pomocí kvantitativního PCR a při vzestupu počtu CMV kopií nad určitý práh je zahájena léčba GCV (8, 9). Tento přístup umožnil ušetřit část pacientů nežádoucích účinků virostatik a vytvořil u nich prostor pro rekonstituci CMV specifické imunity, protože T-lymfocyty jsou stimulovány určitou podprahovou virovou náloží.
Dlouhodobá protekce je zprostředkována rekonstitucí CMV specifické imunity, zejména T-lymfocyty (7). I přesto, že bylo provedeno mnoho studií u imunokompromitovaných pacientů, zůstávají naše znalosti protektivních faktorů velmi omezené (10–13). Ukazuje se, že dostatečnou imunitní odpověď není možno predikovat pouze na základě počtu CMV specifických lymfocytů (měření pomocí CMV tetrametrů) (14) nebo množství lymfocytů produkujících interferon gama (IFN-γ) (12).
Protože v dnešní době je standardem monitorování pacientů po HSCT pomocí PCR (15) a neexistuje jasný korelát protekce při studiu lymfocytů pomocí detekce produkce IFN-γ, rozhodli jsme se vytvořit 8barevný panel protilátek, který umožňuje simultánní detekci esenciálních funkcí CD4+ a CD8+ T-lymfocytů z 1 vzorku krve metodou mnohobarevné průtokové cytometrie. Mezi esenciální funkce se řadí produkce IFN-γ (hlavní prozánětlivý cytokin) a interleukinu 2 (IL-2 – růstový faktor lymfocytů), zvýšení exprese CD40 ligandu (CD40L – marker časné odpovědi CD4+ lymfocytů) a membránové exprese CD107a (LAMP1 protein – marker degranulace CD8+ lymfocytů) po stimulaci CMV antigeny. Navíc se domníváme, že ve skupině pacientů léčených při vzestupu počtu kopií CMV stále existuje část pacientů, kteří mají dobrou rekonstituci CMV specifických T-lymfocytů i při nízkých celkových počtech lymfocytů a kteří by mohli být ušetřeni nežádoucích efektů léčby virostatiky. Cílem prezentované studie je ověřit specifictu určení CMV specifických lymfocytů porovnáním CMV-séropozitivních dobrovolníků s dobrovolníky naivními (CMV séronegativními). Vzhledem k zaměření našeho pracoviště na HSCT v dětském věku jsme porovnávali frekvence CMV specifických lymfocytů u pacientů časně po transplantaci a pacientů, kteří úspěšně obnovili T-buněčnou imunitu více než 2 roky po HSCT. Závěrem porovnáváme vybrané profily pacientů časně po HSCT, kteří CMV kontrolují s těmi, kteří CMV nekontrolují.
Materiál a metodika
Dobrovolníci a pacienti
Krevní vzorky byly získány od 19 zdravých dospělých dobrovolníků a 38 dětí, u kterých se jednalo o zbytek vzorku krve, který jim byl odebrán na rutinní vyšetření krevního obrazu. U všech dobrovolníků byl vyšetřen CMV sérostatus. Bližší charakteristika dobrovolníků je uvedena v tabulce 1. Výsledky získané od těchto dobrovolníků byly porovnány s výsledky skupiny 10 pacientů 2 a více let po HSCT, jejichž charakteristika je uvedena v tabulce 2, kterým byl odebrán vzorek krve při výročí po HSCT. Výsledky pacientů 2 a více let po HSCT navíc sloužily k vytvoření referenčního rozmezí pro pacienty časně po HSCT. Koincidenční interval (KI) je ohraničen 10. a 90. percentilem.
Tab. 1. Charakteristika zdravých dobrovolníků. 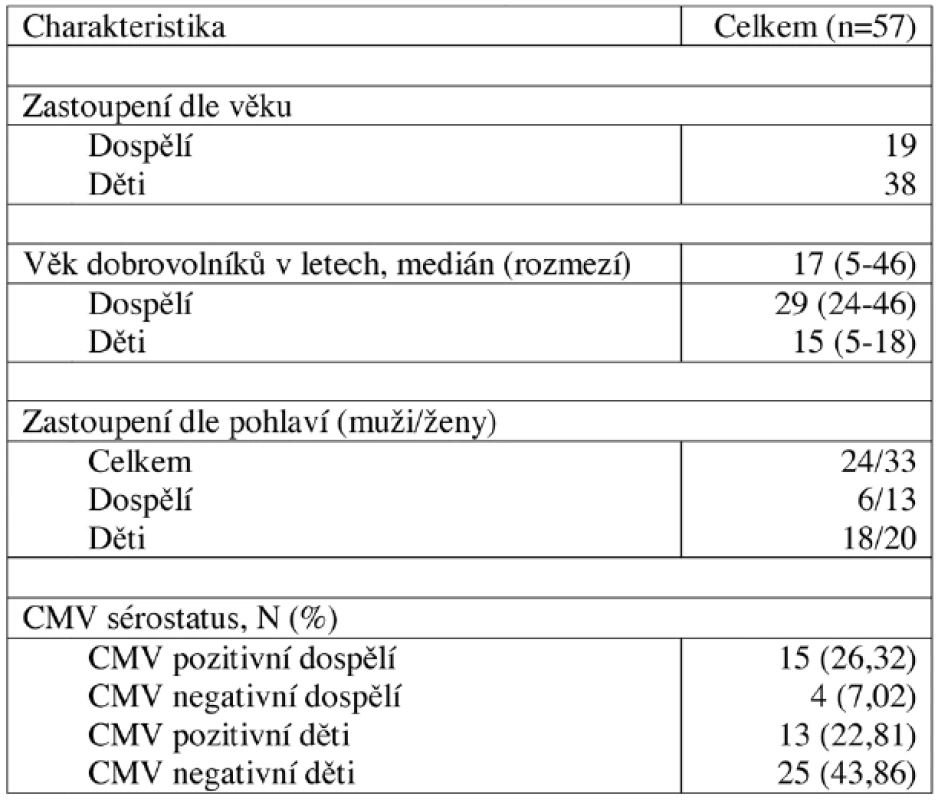
Tab. 2. Charakteristika pacientů 2 a více let po HSCT. 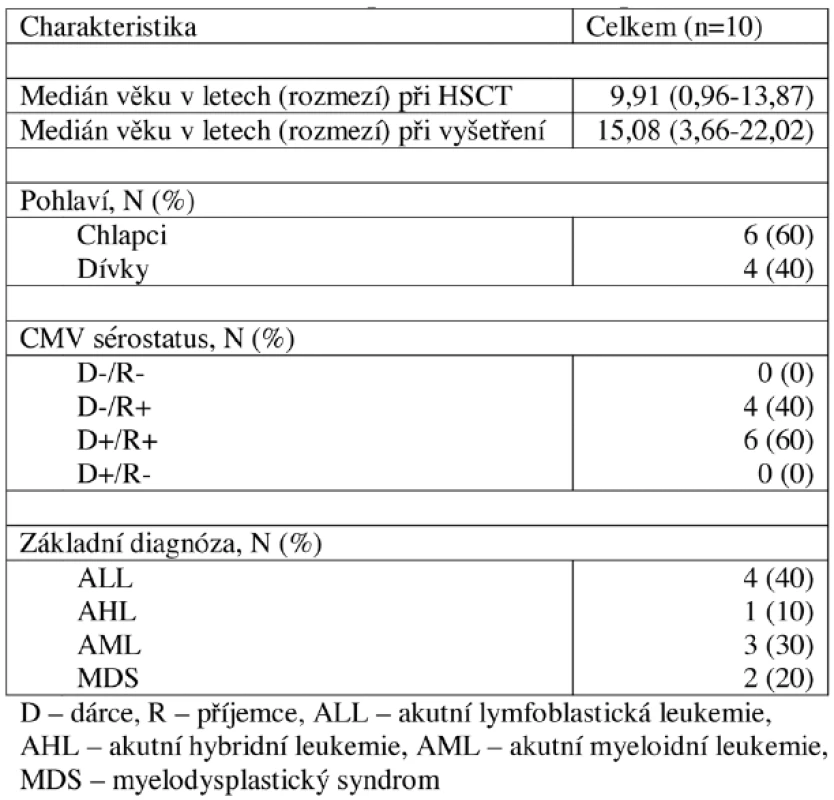
Studie byla povolena Etickou komisí Fakultní nemocnice v Motole. Všichni dobrovolníci dodali informovaný souhlas, přičemž u nezletilých dobrovolníků byl souhlas podepsán jejich zákonným zástupcem, a to v souladu s Helsinskou deklarací. Všichni dobrovolníci byli vyšetřování prospektivně.
Zpracování CMV specifických T-lymfocytů
Mononukleární buňky z periferní krve (PBMCs) byly získány pomocí gradientní separace na Ficoll-Paque (Pharmacia, Uppsala, Švédsko). Takto získané PBMCs byly promyty v pufru PBS (phosphate-buffer saline) a byly resuspendovány v 10 ml kompletního média RPMI 1640 (RPMI 1640 doplněné o 10 % tepelně inaktivovaného fetálního séra, 100 U/ml penicilinu, 100 μg/ml streptomycinu a 1,7 mM glutamanu sodného) a ponechány přes noc v inkubátoru při 37 °C v atmosféře s 5% CO2. Následující den dopoledne byly PBMCs zkoncentrovány na koncentraci 20 x 106 buněk/ml. K buňkám byly přidány kostimulační protilátky CD28/CD49d (BD Biosciences, San José, CA, USA) a protilátka CD107 Alexa488 (klon B-T47, Exbio Praha, Praha, Česká republika). Buňky byly rozděleny po 100 μl a přeneseny do 96jamkové destičky, která obsahovala 1 μg/ml peptidů pp65 a IE-1 a 10 μg/ml CMV lyzátu. Každý test byl proveden v jamce stimulované CMV antigenem a paralelně také v nestimulované a nespecificky stimulované (anti-CD3, 10 μg/ml, Exbio Praha) jamce, které sloužily jako negativní a pozitivní kontrola. Buňky byly inkubovány 2 hodiny při 37 °C. Poté byl přidán do každé jamky brefeldin A (10 μg/ml, Sigma-Aldrich, Saint Louis, MO, USA). Stimulace pokračovala další 4 hodiny při 37 °C. Po inkubaci byly do každé jamky přidány monoklonální protilátky CD14 Pacific Blue, CD20 Pacific Blue (Exbio Praha), CD8 Pacific Orange (Invitrogen, Carlsbad, CA, USA) a dále LIVE/DEAD Violet Viability Dye (Invitrogen) a 2 μl 0,1mM EDTA (Sigma-Aldrich). Povrchové značení probíhalo ve tmě při pokojové teplotě po dobu 15 minut. Buňky byly poté promyty promývacím pufrem (PBS obsahující 0,1% azid sodný a 2% želatinu (Sigma-Aldrich)). Následovala fixace a permeabilizace pomocí činidel FACS Lyse/FACS Perm 2 (BD Biosciences). Po permeabilizaci bylo provedeno značení monoklonálními protilátkami CD3 PerCP-Cy5.5 (eBioscience), CD4 ECD (Immunotech, Marseille, Francie) a protilátkami proti intracelulárním markerům IFN-γ PE-Cy7, IL-2 APC (eBioscience) a CD154 PE (Immunotech). Buňky byly poté znovu promyty.
Peptidy a CMV lyzát
Ke stimulaci CD8+ lymfocytů jsme použili směs peptidů o 15 aminokyselinách (11 překrývajících se), odpovídajících hlavním CMV imunogenním proteinům pp65 a IE-1 (JPT Peptides, Berlin, Německo). Pro stimulaci CD4+ lymfocytů byl použit CMV lyzát (Vidia, Vestec u Prahy, Česká republika). Oba typy stimulace byly provedeny současně v jedné jamce.
Průtoková cytometrie
Obsah každé jamky byl změřen průtokovým cytometrem BD LSR II (BD Immunocytometry Systems, San José, CA, USA) pomocí robotického modulu HTS. Analýza dat byla provedena pomocí software FlowJo, verze 8.8.6 (TreeStar, Ashland, OR, USA). Klíčovým parametrem pro zajištění citlivosti detekce v nízkých frekvencích CMV specifických T-lymfocytů byla akvizice dostatečného množství buněk (50 000 od každého subsetu T-lymfocytů). Analýza začala výběrem forward scatter area (FSC-A) proti forward scatter height (FSC-H) k vyloučení dubletů. Buňky byly dále vybírány podle pozitivity CD3+, přičemž z analýzy byly vyloučeny CD14 a CD20 Pacific Blue a LIVE/DEAD Violet Viability dye pozitivní eventy, což vedlo k odstranění mrtvých buněk a redukci pozadí. Poté byl vytvořen výběr pro CD4+ a CD8+ T-lymfocyty, na kterých byly samostatně selektovány vždy všechny 4 funkční znaky. Pomocí funkce Boolean gating ve FlowJo bylo vytvořeno 16 možných kombinací jednotlivých funkcí pro každý typ lymfocytů. Tím vzniklo 32 parametrů, které byly předmětem další analýzy.
Statistická analýza
U všech dat bylo odečteno pozadí. K tomuto odečtu sloužila data získaná z nestimulované jamky obsahující pouze CD28/CD49d a dále data ze specificky stimulovaných lymfocytů (směsí pp65+IE-1+CMV lyzát) od CMV negativních dobrovolníků. Byl vytvořen práh, který odpovídal součtu mediánu a 1 směrodatné odchylky z hodnot dosažených z těchto specificky stimulových lymfocytů CMV negativních dobrovolníků. Hodnoty, které byly nižší než tento práh, byly nastaveny na 0 (16). Statistická významnost meziskupinových porovnání byla zjištěna Mann-Whitney U testem. Protože bylo vzájemně porovnáváno vždy 15 typů odpovědí pro CD4+ a CD8+, byl stupeň statistické významnosti upraven pomocí Bonferroniho korekce na p < 0,003 – hodnoty v rozmezí p > 0,003 a < 0,01 byly považovány pouze za hraničně významné. Pro výpočty a zobrazení byl použit GraphPad software, verze 5 (GraphPad Software, La Jolla, CA, USA).
Výsledky
Ex vivo stanovení funkční odpovědi T-lymfocytů CMV pozitivních a CMV negativních dobrovolníků na stimulaci CMV antigenem
Stanovili jsme profil imunitní odpovědi T-lymfocytů po stimulaci CMV antigenem. Měření mnohobarevnou cytometrií (8 fluorescenčních parametrů) umožňuje stanovení fenotypu buňky a zároveň 4 funkční odpovědi (IFN-γ, IL-2, CD40L a CD107a). Porovnáním CMV séropozitivního dobrovolníka se séronegativním (obr. 1A a 1B), vidíme např. v rámci CD8+ T-lymfocytů séropozitivního dobrovolníka buňky produkující zároveň IFN-γ a IL-2 (pravý horní panel obr. 1A a 1B). Analogicky zjišťujeme frekvence všech kombinací sledovaných odpovědí na každé buňce. Jednotlivé pozitivní buňky, které nalézáme u CMV séronegativního dobrovolníka (obr. 1B) jsou nespecifickým signálem (pozadím), které může vznikat např. spontánní aktivací T-lymfocytů antigenem v organismu těsně před odběrem krve.
Obr. 1. Typická funkční odpověd CD4+ a CD8+ T-lymfocytů stanovená průtokovou cytometrií po ex vivo stimulaci antigenem CMV. 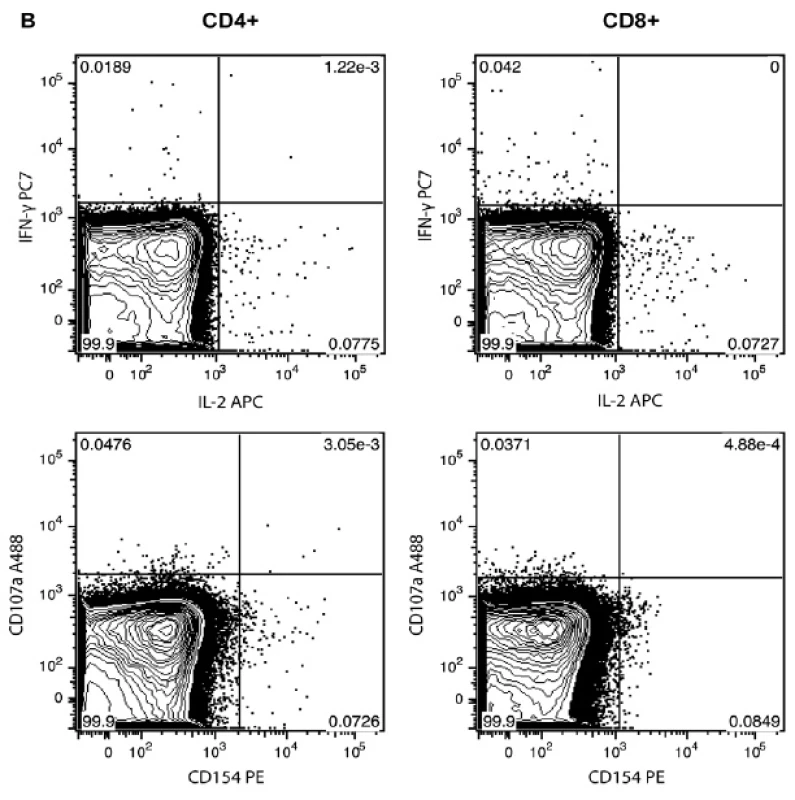
Obrázek ukazuje primární data získaná z průtokového cytometru, zobrazeny jsou v grafu pouze buňky odpovídající CD4+ nebo CD8+ T-lymfocytům (dle označení v záhlaví sloupce). Každý bod reprezentuje jednu buňku. Na panelu A je ukázán CMV séropozitivní dobrovolník po stimulaci CMV antigenem, na panelu B je dobrovolník séronegativní, kde zobrazené body odpovídají nespecifickému signálu pozadí. Ověření citlivosti a relevance detekce CMV specifických T-lymfocytů u zdravých dobrovolníků
Vzhledem k velmi nízkým frekvencím CMV specifických T-lymfocytů jsme potřebovali ověřit specificitu a relevanci detekce jednotlivých funkčních odpovědí. Teoretická citlivost s koeficientem variability 50 % při 50 000 změřených událostech v podskupině dosahuje 0,01 %. Abychom zjistili skutečnou relevanci detekce v takto nízkých frekvencích, porovnali jsme kohortu zdravých dobrovolníků CMV-séropozitivních (n = 27) s kohortou CMV-séronegativních (n = 30) (obr. 2). Předpokládali jsme, že v těch typech funkční odpovědi, kde nalezneme signifikantní rozdíl, můžeme považovat detekované buňky za buňky CMV specifické. V rámci odpovědi CD4+ T-lymfocytů jsme nalezli významně více zastoupené tyto funkční profily (obr. 2, CD4+): IFN-γ spolu s CD40L (průměr 0,33 %), IFN-γ spolu s IL-2 a CD40L (průměr 0,007 %). V rámci odpovědi CD8+ T-lymfocytů (obr. 2, CD8+) byla nejčastější formou odpovědi sekrece samotného IFN-γ (průměr 1,27 %), případně IFN-γ spolu s IL-2 (průměr 0,06 %). Méně časté, avšak významné byly překvapivé odpovědi dosud vzácně popisovaných CD8+ helperů, které odpovídaly tvorbou CD40-ligandu a zároveň IFN-γ (průměr 0,05 %), či CD40L+ IFN-γ+ spolu s IL-2 (průměr 0,016 %).
Obr. 2. Srovnání frekvence CD4+ a CD8+ T-lymfocytů jednotlivých funkčních typů mezi CMV séropozitivními a séronegativními dobrovolníky. 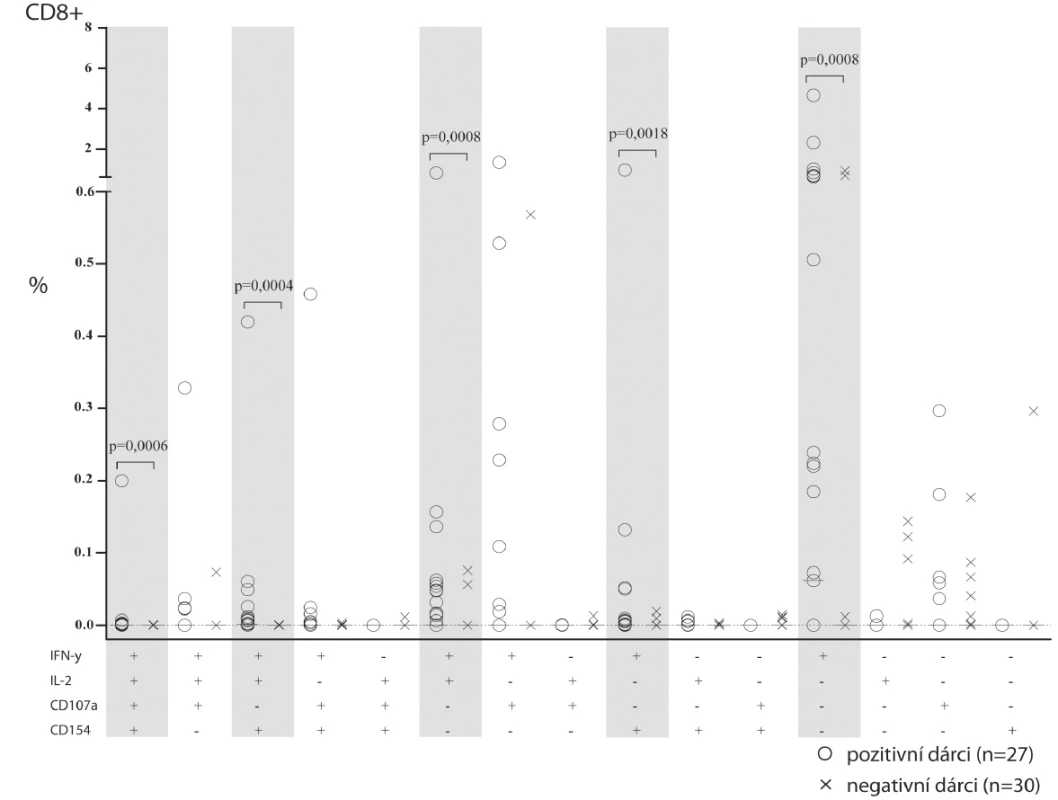
Na grafu je znázorněna frekvence buněk dané funkce z CD4+ (nahoře) nebo z CD8+ (dole) T-lymfocytů po ex vivo stimulaci CMV antigenem. Kombinace funkční odpovědi (sloupec) je anotována pomocí symbolů + a – v řádku každé testované funkce pod grafem. Šedivým podkladem a hvězdičkou jsou zvýrazněny funkční odpovědi, které jsou signifikantně odlišné mezi CMV séropozitivními a séronegativními. Porovnání dětských a dospělých CMV pozitivních dobrovolníků s pacienty více než 2 roky po HSCT
Při srovnání dětských a dospělých zdravých dobrovolníků s pacienty s klinicky plně obnovenou imunitou více než dva roky po HSCT jsme nenalezli statisticky významné rozdíly (obr. 3). Mezi dospělými dobrovolníky a mezi rekonstituovanými pacienty po HSCT jsme našli jednotlivce, kteří měli podstatně zmnožené CD8+ T-lymfocyty produkující pouze IFN-γ anebo IFN-γ+IL-2+. Lze se domnívat, že se jedná o buňky, které jsou paměťovým pozůstatkem prodělaných CMV reaktivací (včetně klinicky němých). Hraničně zmožené byly u zdravých dospělých oproti zdravým dětem CD8+IFN-γ+CD40L+ produkující T-lymfocyty (průměr 0,07 vs. 0,01, p = 0,02). Naopak pacienti po HSCT měli oproti dospělým detekovatelné degranulující CD4+ CD107a+ buňky (průměr 0,08 vs. 0; p = 0,01), které byly dříve popsané jako typické efektory odpovědi proti CMV. Zjištěné rozdíly mezi skupinami byly překvapivě malé, což je částečně vysvětlitelné značnou inter-individuální variabilitou.
Obr. 3. Srovnání frekvence CD4+ a CD8+ T-lymfocytů mezi CMV séropozitivními dospělými, CMV séropozitivními dětmi a imunitně rekonstituovanými dětmi více než 2 roky po HSCT. 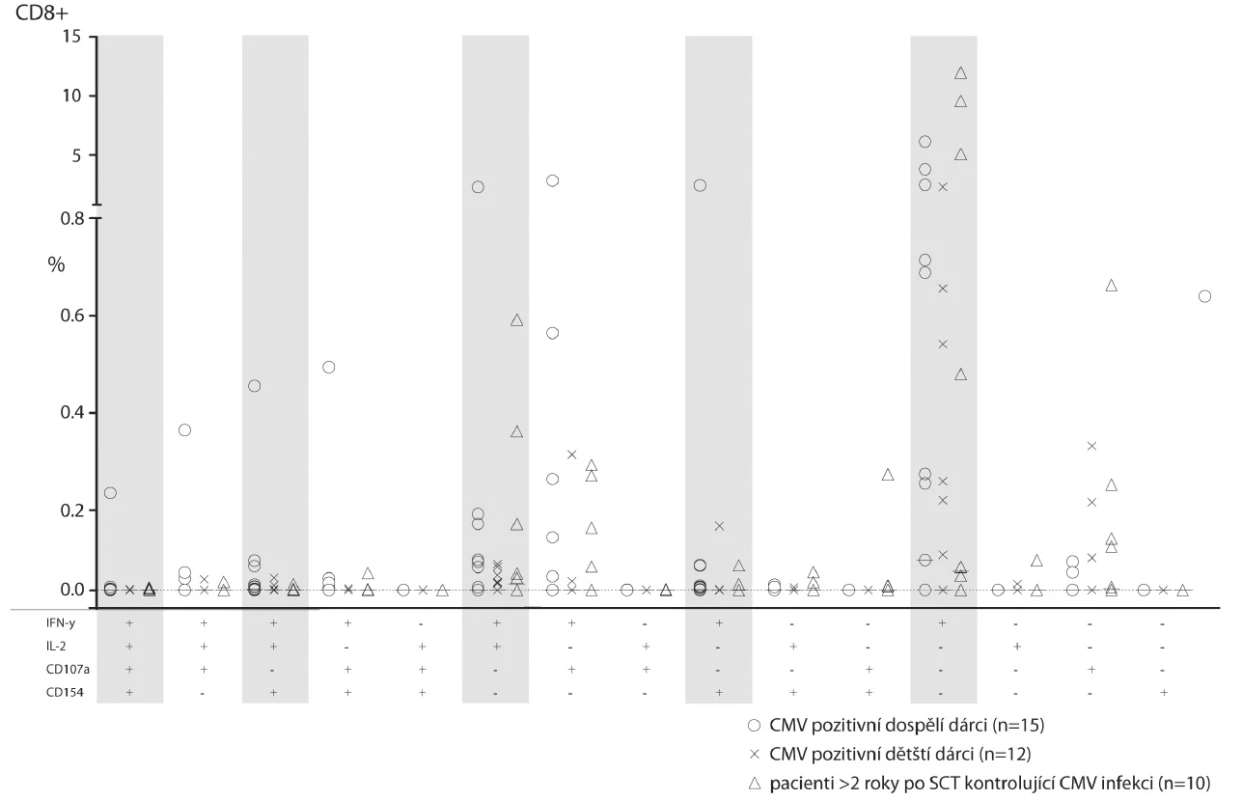
Na stejném grafu jako v obrázku 2 je zobrazeno zastoupení funkčních typů odpovědi po stimulaci CMV antigenem. Šedivým podkladem jsou vyznačeny stejné typy odpovědí jako v obrázku 2. Vybrané profily pacientů po HSCT ve srovnání se zdravými dobrovolníky
V současné fázi studie ještě nemáme k dispozici dostatečné množství dat pro stanovaní referenčních norem pacientů pro úspěšnou predikci jejich CMV specifické imunitní odpovědi. Na základě změřených frekvencí u úspěšně rekonstituovaných pacientů více než 2 roky po HSCT (n = 10) jsme jako referenční hodnoty frekvencí jednotlivých funkčních odpovědí stanovili 10. a 90. percentil. Porovnáním změřených hodnot u pacientů časně po HSCT a referenčních hodnot lze usuzovat na úspěšnost rekonstituce CMV specifické imunity.
Na vybraných příkladech je možné prezentovat souvislost mezi klinickým ovládnutím CMV reaktivace (tj. pacienti, kteří časně po HSCT měli PCR dokumentovanou CMV reaktivaci, byli léčeni virostatiky a v dalším období již reaktivace neprodělali) (obr. 4A). Ovládnutí CMV reaktivací u tohoto pacienta (dárce i příjemce byli v tomto případě oba CMV séropozitivní) je provázeno detekovatelnými frekvencemi CD8+ T-lymfocytů s funkční odpovědí typu IFN-γ+IL-2+. V období lymfocytopenie a čilé rekonstituce po HSCT dominuje odpověď samotným IFN-γ nebo v kombinaci IFN-γ+CD107a+, která se časem sníží, přestože pacient stále CMV reaktivaci kontroluje. V rámci CD4+ odpovědi je významná odpověď IFN-γ+IL-2+CD40L+ a IFN-γ+ CD40L+ (obr. 4B).
Naopak u pacienta s trvající reaktivací CMV, který je intermitentně léčen virostatiky, chybí jak CD8+ IFN-γ+IL-2+, tak i CD8+ IFN-γ+. Přítomnost CD4+ helperů secernujích IFN-γ+IL-2+CD40L+ a IFN-γ+CD40L+ není zřejmě pro kontrolu reaktivace dostatečná (obr. 4B).
V případě dvou pacientů, kteří nedosáhli klinické CMV-specifické rekonstituce ani více než 2 roky po HSCT, jsme nalezli vysoké frekvence CD8+ buněk produkujících pouze IFN-γ (nad 5 %, respektive 15 %), přičemž polyfunkční odpověď (zahrnující IL-2 či CD40L) zcela chyběla (obr. 4C a D).
Obr. 4. Vybrané profily rozvoje CMV specifické CD8+ odpovědi u pacientů časně po HSCT. 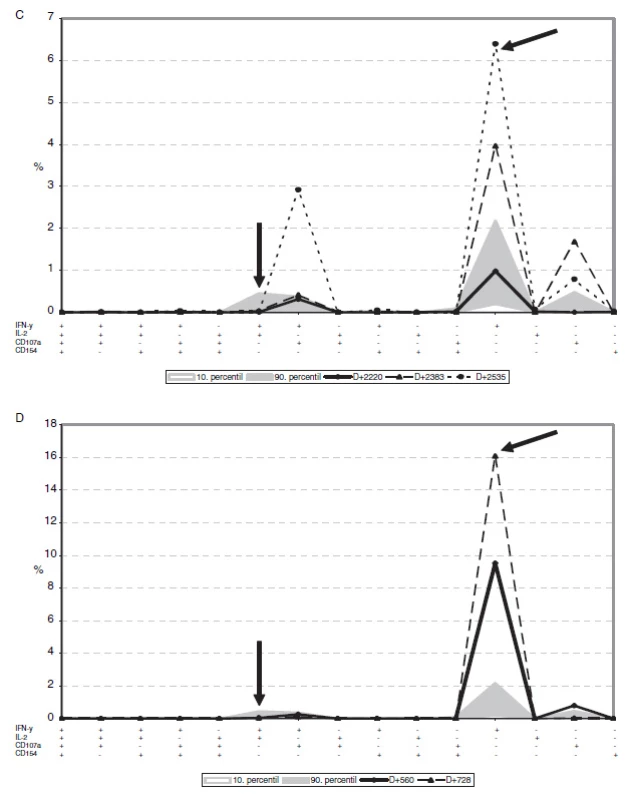
Obrázek ukazuje příklady pacientů v různých časových bodech po transplantaci, kteří kontrolují (A) nebo nekontrolují CMV reaktivace (B, C, D). Pacienti A a B jsou časně po transplantaci, pacienti C a D jsou 2 a více let po transplantaci. Na grafu je zobrazena pouze CD8+ T-lymfocytární odpověď. Jednotlivé časové body po transplantaci jsou znázorněny spojnicovým grafem a udané jako den po transplantaci v legendě. Plošným grafem v pozadí je zobrazeno referenční rozmezí získané z dat pacientů 2 a více let po HSCT, kteří kontrolují CMV reaktivace. Svislá šipka znázorňuje buňky produkující zároveň IFN-γ a IL-2, šikmá šipka označuje buňky produkující pouze IFN-γ Shrnutí a diskuse
V prezentované práci jsme popsali metodiku ex vivo stanovení funkční odpovědi T-lymfocytů na stimulaci antigenem CMV. Ukázali jsme, že pro zachycení relevantních funkčních odpovědí je třeba citlivost stanovení frekvence CMV specifických T-lymfocytů na úrovni alespoň 0,01 %. Je ovšem možné, že pokud bychom dosáhli i vyšší citlivosti, nalezli bychom další relevantní typy odpovědi. Porovnáním deseti imunitně rekonstituovaných pacientů se zdravými dětmi i dospělými jsme zjistili, že v odstupu více než 2 let po HSCT jsou funkční CMV-specifické lymfocyty zastoupeny nejen početně, ale i funkčně (v jednotlivých funkčních podskupinách) podobně jako u zdravých jedinců, přestože pro ideální definitivní potvrzení by bylo třeba většího souboru pacientů stejných klinických charakteristik (věk, léčba, GvHD, imunosuprese atd.). Dále bude zajímavé identifikovat faktory ovlivňující kvalitu i délku dosažení plně funkční imunitní rekonstituce po HSCT. Monofunkční CD8+ T-lymfocyty produkující jen IFN-γ dosahují relativně vysokých frekvencí u zdravých CMV séropozitivních dobrovolníků (více než 10 % dobrovolníků má hodnoty nad 1 %), ovšem nalézáme je ve vysokých frekvencích též u pacientů, kteří nedosáhli rekonstituce imunity schopné zastavit CMV reaktivace. Tato pozorování dokumentují přínos stanovení polyfunkčních odpovědí ve srovnání se stanovením samotného IFN-γ anebo stanovení frekvence specifických CD8+ T-lymfocytů pomocí MHC-multimerů (17). Monitorování antigen specifických T-lymfocytů je v současné době dostupná, leč časově a technicky náročná a drahá metoda, která má potenciál uplatnění především v léčbě imunokompromitovaných pacientů (pacientů po HSCT, po chemoterapii, při imunosupresi po transplantaci solidních orgánů, případně u HIV pozitivních pacientů). Monitorování může pomoci při racionálním rozhodování o protivirové terapii, která by měla být poskytnuta bezodkladně pacientům s reaktivací viru bez detekovatelné funkční imunitní odpovědi, ale jejíž efekt při nadbytečném podání zpomaluje imunitní rekonstituci, zatěžuje pacienty nežádoucími účinky a v neposlední řadě je ekonomickou zátěží pro zdravotní systém. Na základě monitorování těchto imunologických parametrů je možno též indikovat pacienty k transplantaci virus specifických T-lymfocytů, což je postup v současné době experimentálně provozovaný v několika evropských (Londýn, Würzburg, Tübingen) a světových (Houston, New York) centrech. Vzhledem k rozvoji transplantačních programů a dalších získaných imunodeficiencí je pravděpodobné, že metody monitorování imunity budou v blízké budoucnosti klinickými pracovišti vyžadované pro stále větší počet pacientů. Zavedení monitorování imunity funkčních odpovědí T-lymfocytů jako rutinního testu v klinické laboratoři bude závislé především na jeho zjednodušení, či zařazení robotizace do jeho provádění, jak je v současnosti pilotně zaváděno na našem pracovišti.
Poděkování:
Děkujeme L. Gondorčínové za technickou asistenci, sestrám transplantační jednotky Kliniky dětské hematologie a onkologie UK 2.LF a FN v Motole, jmenovitě V. Čepelákové, B. Nagyové a A. Pertlové, za odebírání pacientských vzorků, lékařům transplantační jednotky (P. Keslové, R. Formánkové, M. Matulové a A. Stetsko) za příkladnou péči o naše pacienty, M. Zajacovi za sérologické testování, K. Kopeckému a M. Kopecké za poskytnutí vzorků zdravých dobrovolníků. Děkujeme všem našim pacientům a zdravým dárcům.
Projekt byl podpořen grantem GA UK číslo 47807 a grantem IGA MZ ČR číslo NS/9996-4.
Doručeno do redakce: 11. 3. 2010
Přijato po recenzi: 24. 3. 2010
MUDr. Ladislav Król
Klinika dětské hematologie a onkologie
UK 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: ladislav.krol@lfmotol.cuni.cz
Zdroje
1. Scholz M, Doerr HW, Cinatl J. Human cytomegalovirus retinitis: pathogenicity, immune evasion and persistence. Trends Microbiol 2003; 11 : 171-178.
2. Storek J, Geddes M, Khan F, et al. Reconstitution of the immune system after hematopoietic stem cell transplantation in humans. Semin Immunopathol 2008; 30 : 425-437.
3. Boeckh M, Ljungman P. How we treat cytomegalovirus in hematopoietic cell transplant recipients. Blood 2009; 113 : 5711-5719.
4. Baldanti F, Lilleri D, Gerna G. Monitoring human cytomegalovirus infection in transplant recipients. J Clin Virol 2008; 41 : 237-241.
5. Zhou W, Longmate J, Lacey SF, et al. Impact of donor CMV status on viral infection and reconstitution of multifunction CMV-specific T cells in CMV-positive transplant recipients. Blood 2009; 113 : 6465-6476.
6. Ljungman P, Perez-Bercoff L, Jonsson J, et al. Risk factors for the development of cytomegalovirus disease after allogeneic stem cell transplantation. Haematologica 2006; 91 : 78-83.
7. Hakki M, Riddell SR, Storek J, et al. Immune reconstitution to cytomegalovirus after allogeneic hematopoietic stem cell transplantation: impact of host factors, drug therapy, and subclinical reactivation. Blood 2003; 102 : 3060-3067.
8. Singh N. Antiviral drugs for cytomegalovirus in transplant recipients: advantages of preemptive therapy. Rev Med Virol 2006; 16 : 281-287.
9. Verkruyse LA, Storch GA, Devine SM, Dipersio JF, Vij R. Once daily ganciclovir as initial pre-emptive therapy delayed until threshold CMV load > or =10000 copies/ml: a safe and effective strategy for allogeneic stem cell transplant patients. Bone Marrow Transplant 2006; 37 : 51-56.
10. Pourgheysari B, Piper KP, McLarnon A, et al. Early reconstitution of effector memory CD4+ CMV-specific T cells protects against CMV reactivation following allogeneic SCT. Bone Marrow Transplant 2009; 43 : 853-861.
11. Eid AJ, Brown RA, Hogan WJ, et al. Kinetics of interferon-gamma producing cytomegalovirus (CMV)-specific CD4+ and CD8+ T lymphocytes and the risk of subsequent CMV viremia after allogeneic hematopoietic stem cell transplantation. Transplant Infect Dis 2009; 11 : 519-528.
12. Barron MA, Gao D, Springer KL, et al. Relationship of reconstituted adaptive and innate cytomegalovirus (CMV)-specific immune responses with CMV viremia in hematopoietic stem cell transplant recipients. Clin Infect Dis 2009; 49 : 1777-1783.
13. Gratama JW, Brooimans RA, van der Holt B, et al. Monitoring cytomegalovirus IE-1 and pp65-specific CD4+ and CD8+ T-cell responses after allogeneic stem cell transplantation may identify patients at risk for recurrent CMV reactivations. Cytometry B Clin Cytom 2008; 74 : 211-220.
14. Morita-Hoshi Y, Heike Y, Kawakami M, et al. Functional analysis of cytomegalovirus-specific T lymphocytes compared to tetramer assay in patients undergoing hematopoietic stem cell transplantation. Bone Marrow Transplant 2008; 41 : 515-521.
15. Tanaka N, Kimura H, Iida K, et al. Quantitative analysis of cytomegalovirus load using a real-time PCR assay. J Med Virol 2000; 60 : 455-462.
16. Betts MR, Nason MC, West SM, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood 2006; 107 : 4781-4789.
17. Zimmerli SC, Harari A, Cellerai C, et al. HIV-1-specific IFN-gamma/IL-2-secreting CD8 T cells support CD4-independent proliferation of HIV-1-specific CD8 T cells. Proc Natl Acad Sci U S A 2005; 102 : 7239-7244.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Výběr z tisku
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 3- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Globální hodnocení funkce hemostázy – část II. Vlastní zkušenosti s použitím trombin generačního testu u pacientů s trombofilií
- Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Folikulární lymfom a význam nádorového mikroprostředí
- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
- XXIV. Olomoucké hematologické dny s mezinárodní účastí
- Výběr z tisku a zprávy o knihách
- Autotransfuze v České republice v roce 2009
- Produkce transfuzní služby ČR za rok 2009
- Informace o volbách do výboru České hematologické společnosti, revizní komise, výboru zdravotních laborantů a výboru sester.
- Komentář k článku: Novinky v klasifikaci MDS a stanovení prognózy dle WPSS Žídková M., Voglová J., Bělohlávková P., Vrbacký F. Transfuze a Hematologie dnes 2010, 16: 42-46
- Odpověď na komentář Doc. Neuwirtové
- Výběr z tisku
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Folikulární lymfom a význam nádorového mikroprostředí
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy







