-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu)
Autori: H. Klamová 1; J. Voglová 2
Pôsobisko autorov: Ústav hematologie a krevní transfuze, Praha 1; II. interní klinika – oddělení klinické hematologie, Fakultní nemocnice Hradec Králové 2
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 2, p. 1-5.
Kategória: Doporučené postupy
1. Úvod
Chronická myeloidní leukemie (CML) je myeloproliferativní onemocnění charakterizované přítomností tzv. Philadelphského chromozomu (Ph), vzniklého reciprokou translokací mezi chromozomy 9 a 22 a/nebo fúzního genu BCR/ABL1. Produktem onkogenu je protein s konstitutivně aktivovanou tyrosinkinázou, která působí nekontrolované dělení buňky s následným vznikem nádorového klonu.
V České republice onemocní každoročně chronickou myeloidní leukemií 100-150 dospělých. Od roku 2000, kdy byl v ČR poprvé podán nemocným CML imatinib, se převratně zlepšila prognóza onemocnění, jejímž důsledkem je výrazný meziroční nárůst prevalence. Zásadně se změnilo také léčebné schéma a monitorování zbytkové nemoci. Současným cílem léčby s CML je zabránit progresi chronické fáze do pokročilejších a hůře terapií ovlivnitelných stadií.
V první dekádě 21. století se imatinib stal všeobecně uznávaným lékem první volby v chronické fázi (CP) CML a inhibitory tyrosinových kináz (TKI) druhé generace dasatinib a nilotinib se začaly standardně podávat u pacientů, u kterých se rozvinula rezistence na imatinib nebo tento lék nebyl nemocným tolerován. Alogenní transplantace krvetvorných buněk (alo-TKD) se posunula v chronické fázi z první do další, většinou třetí léčebné linie.
Nilotinib a dasatinib prokázaly v randomizovaných klinických studiích u nemocných s nově diagnostikovaným onemocněním lepší účinnost než imatinib (studie ENEST a Dasasion) (13, 14). V roce 2010 pak byly americkou Food and Drug Administration (FDA) a Evropskou agenturou pro léčivé přípravky - European Medicines Agency (EMA) schváleny také jako léčba první linie pro nemocné s CML v chronické fázi (FDA Tasigna 18. 6. 2010, Sprycel 29. 10. 2010, EMA Sprycel 8. 12. 2010, Tasigna 23. 12. 2010) (17).
Léčba CML je velmi nákladná a do určité míry u řady nemocných individuální. Pacienti by proto již při stanovení diagnózy měli být odesláni do hematoonkologických center, kde mohou být provedena všechna potřebná vyšetření a současně nabídnuta léčba nejmodernějšími účinnými léky. Terapii tyrosinkinázovými inhibitory hradí zdravotní pojišťovny pouze v hematoonkologických centrech, kde je zajištěno pravidelné monitorování nemocných, transplantační a podpůrná péče.
Následující doporučení vychází z materiálů European LeukemiaNet (ELN), National Comprehensive Cancer Network, Clinical Practice Guidelines in Oncology (NCCN) (15) a ESMO (Evropská společnost klinické onkologie) a shrnuje současné nejnovější poznatky o diagnostice, léčbě a monitorování onemocnění (2, 7, 15). Je určeno nejen, hematologům, ale i dalším lékařům, kteří se s nemocnými s CML setkávají v klinické praxi v situaci diferenciální diagnostiky nebo např. v souvislosti s řešením komplikací souvisejících s léčbou.
2. Diagnostika chronické myeloidní leukemie
Podezření na chronickou myeloidní leukemii (CML) lze vyslovit při nálezu splenomegalie a typických patologických změn v krevním obrazu (KO) - leukocytóza, trombocytóza, bazofilie, v diferenciálním rozpočtu leukocytů tzv. posun doleva s vyplavením všech vývojových stadií granulocytů. V klinickém obraze často přítomna splenomegalie. V aspirátu kostní dřeně (KD) je zvýšená buněčnost s převažujícím podílem bílé složky, kde dominují granulocyty různého stupně zralosti. K definitivnímu potvrzení diagnózy je nutný průkaz Ph chromozomu nebo fúzního genu BCR/ABL1.
2.1 Doporučená vyšetření u nemocného s CML při stanovení diagnózy
2.1.1 Klinické vyšetření: anamnéza a fyzikální nález
2.1.2 Laboratorní vyšetření
- krevní obraz + diferenciální rozpočet,
- aspirát kostí dřeně na morfologické vyšetření, cytogenetické vyšetření (karyotyp, FISH), imunocytologie v případě blastického zvratu k rozlišení fenotypu blastů
- histologické vyšetření kostní dřeně (trepanobiopsie)
- PCR BCR-ABL – určení typu přestavby genu BCR/ABL a kvantitativní vyšetření – množství transkriptu BCR/ABL v % (Q-RT-PCR)
- biochemické parametry – kyselina močová, urea, kreatinin, LDH, bilirubin, ALT, AST, základní koagulační vyšetření, případně další biochemické parametry dle stavu pacienta.
Zamražení a uschování RNA pro ev. další analýzy v průběhu léčby (např. mutace).
Diagnózu CML potvrzuje nález v periferní krvi a aspirátu kostní dřeně ve spojení s průkazem Ph chromozomu a /nebo fúzního genu BCR/ABL.
2.1.3 Další vyšetření před zahájením léčby
UZ břicha se zaměřením na slezinu, játra, uzliny, skiagram plic, ekg, případně UZ srdce před léčbou inhibitory tyrosinových kináz.
HLA typizace I. a II. třídy v případě úvahy o indikaci alogenní transplantace krvetvorných buněk a vyhledávání dárce.
3. Stadia chronické myeloidní leukemie
CML je zpravidla diagnostikována v chronické fázi, méně často v akcelerované fázi nebo blastickém zvratu.
Definice klinických fází dle European LeukemiaNet (ELN) doporučení (1, 7):
Akcelerovaná fáze (AP): blasty ve dřeni (KD) nebo periferní krvi (PK) 15-29 %, blasty + promyelocyty > 30 % v KD nebo PK, bazofily > 20 % v PK, perzistující trombocytopenie (< 100 x 109/l), která nebyla způsobená léčbou
Blastický zvrat (BP): blasty ≥ 30 % v KD nebo PK, extramedulární blastická infiltrace
Definice klinických fází dle World Health Organization (WHO) kritérií (15):
Akcelerovaná fáze (AP): blasty10–19 % v KD nebo PK, bazofily ≥ 20 % v PK, perzistující trombocytopenie (< 100 x 109/l) nezpůsobená léčbou nebo perzistující trombocytóza (> 1000 x 109/l) nereagující na léčbu, zvětšující se slezina a stoupající počet leukocytů při léčbě, klonální evoluce (přídatné cytogenetické změny)
Blastický zvrat (BP): blasty> 20 % KD nebo PK, extramedulární blastická infiltrace, velké shluky blastů v KD (při histologickém vyšetření)
4. Prognóza chronické myeloidní leukemie
Prognózu nemocných s CML významně ovlivňuje fáze choroby a do určité míry ji lze odhadnout také za pomoci indexů relativního rizika (RR), hodnoceného dle prognostického skórovacího systému Sokala a Hasforda (3, 4). Výpočet indexů na http://www.leukemia-net.org/ /content/e58/e459/el1733/.
K odhadu transplantačního rizika u alogenních transplantací krvetvorných buněk slouží tzv. Gratwohlovo (EBMT) skóre (hodnoty bodů 0–7) (5).
4.1 Prognostické faktory
- I. Základní prognostické faktory – fáze choroby a index relativního rizika (RR)
- II. Prognostické faktory pro hodnocení dynamiky léčebné odpovědi: dosažení hematologické, cytogenetické a molekulární odpovědi v závislosti na době trvání léčby
- III. Varovné prognostické faktory při stanovení diagnózy: vysoké riziko dle Sokala a Hasforda, přídatné chromozomální aberace v Ph+ buněčném klonu při stanovaní diagnózy, kdykoliv pak další chromozomální abnormality v Ph-klonu a výrazný vzestup hladin transkriptu BCR-ABL1 (1, 7).
5. Léčba chronické myeloidní leukemie
5.1 Cytoredukce a podpůrná léčba
Symptomatická leukocytóza: hydroxyurea, leukocytaferéza.
Symptomatická trombocytóza nebo vysoké riziko trombotických komplikací: hydroxyurea, anagrelid, trombocytaferéza.
Prevence hyperurikemie: alopurinol od zahájení léčby do normalizace počtu leukocytů, dostatečná hydratace, monitorování vnitřního prostředí.
5.2 Léčba a monitorování chronické fáze CML
5.2.1 Léčba I
Doporučenou léčbou dospělých pacientů s nově diagnostikovanou CML v chronické fázi jsou TKI: imatinib (Glivec) 400 mg jednou denně, nilotinib (Tasigna)* 300 mg dvakrát denně a dasatinib (Sprycel)* 100 mg jednou denně (NCCN version 2.2011). Léčba je podávána dlouhodobě, po dobu trvání optimální odpovědi (schéma 1).
*Výše úhrady přípravků Tasigna a Sprycel v 1. linii léčby CML z prostředků veřejného zdravotního pojištění není v ČR k 1. 5. 2011 stanovena.
V průběhu léčby je zcela nezbytné monitorování léčebné odpovědi ve smyslu hodnocení úrovně hematologické, cytogenetické a molekulární odpovědi. Hodnocením v daných časových intervalech od zahájení léčby dle doporučení panelu expertů European LeukemiaNet je pak definována odpověď na léčbu jako optimální, suboptimální a selhání léčby (7).
5.2.2 Monitorování odpovědi na léčbu TKI
Hodnocení úrovně hematologické, cytogenetické a molekulární odpovědi na léčbu a doporučení intervalů monitorování.
Kompletní hematologická odpověď/remise (KHR)
Leukocyty < 10 x 109/l
Trombocyty < 450 x 109/l
V diferenciálním rozpočtu leukocytů KO: žádné myelocyty, promyelocyty, blasty, bazofilů < 5 %, slezina nehmatná.Cytogenetická odpověď/remise (CyR)
Definice odpovědi na léčbu imatinibem v první linii u pacientů v CP-CML v tabulce 1 (7).Tab. 1. Definice odpovědí na léčbu u pacientů s CML (7). 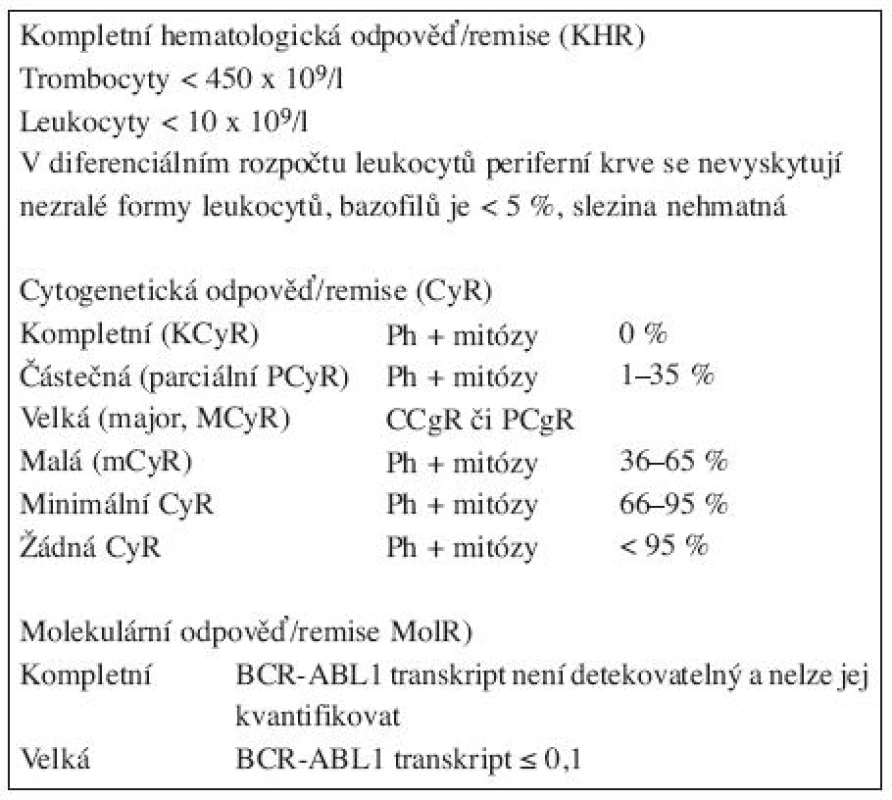
Molekulární odpověď/remise (MoIR)
Kompletní (KMoIR): BCR-ABL1 transkript není detekovatelný pomocí RQ RT-PCR a/nebo nested PCR (negativní ve 2 následujících vzorcích PK) a nelze jej kvantifikovat.Velká (MMoIR): poměr BCR-ABL/ABL1 (ev.jiný kontrolní gen) transkript ≤ 0,1 % IS.
Prováděná vyšetření:
Krevní obraz: 1 x za týden do stabilizace KO (ukončení poklesu hodnot leukocytů a destiček), po stabilizaci hodnot KO a dosažení kompletní hematologické odpovědi možno prodloužit intervaly kontrol až na 3 měsíce.
Klasické cytogenetické vyšetření (z kostní dřeně): 1 x za 3–6 měsíců do docílení a následného potvrzení kompletní cytogenetické odpovědi (KCyR) a okamžitě při ztrátě stávající odpovědi.
Kvantitativní stanovení hladiny transkriptu BCR/ABL1 z periferní krve: 1 x za 3 měsíce při trvající KCyR (6).Doporučení pro monitorování odpovědi na léčbu IM u pacientů v CP CML v 1. linii v tabulce 2.
Tab. 2. Monitorování odpovědi na léčbu imatinibem v první linii u pacientů v CP-CML (7). 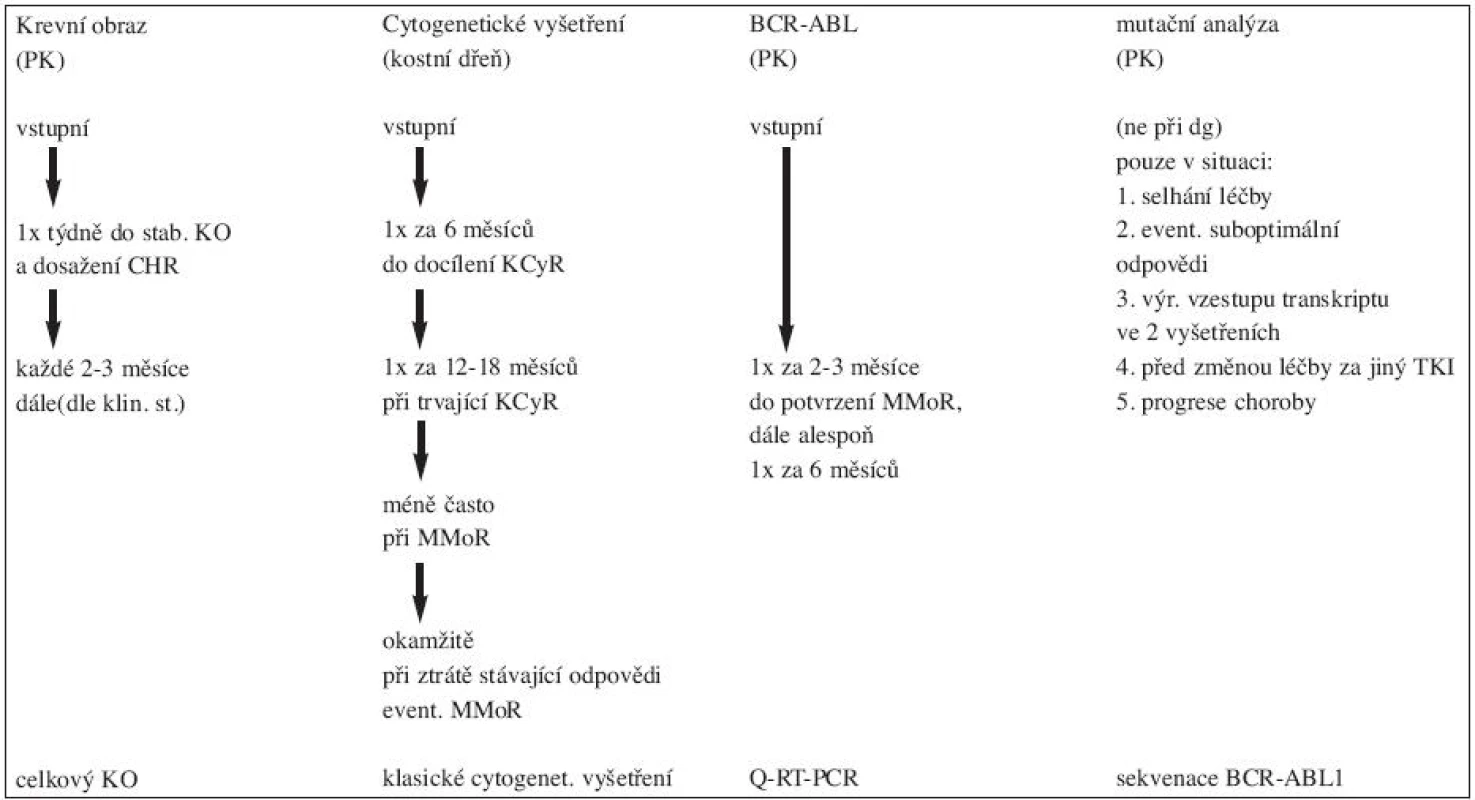
Na základě stupně dosažené léčebné odpovědi v časových intervalech (3, 6, 12 a 18 měsíců) od zahájení léčby imatinibem byla panelem expertů ELN definovány 3 varianty léčebných odpovědí, a to optimální a suboptimální odpověď a selhání léčby, tabulka 3 (7).
Tab. 3. Definice optimální, suboptimální odpovědi a selhání léčby u pacientů léčených IM v první linii v CP-CML (dle ELN 2009 doporučení) (7). 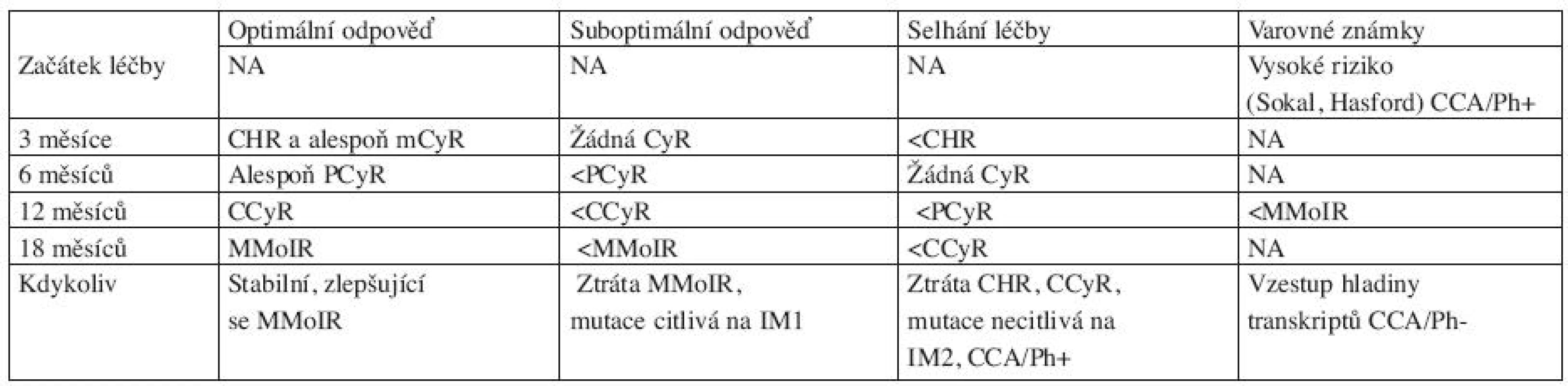
1 mutace v kinázové doméně BCR-ABL s nízkým stupněm rezistence na IM 2 mutace v kinázové doméně BCR-ABL s vysokým stupněm rezistence na IM CCA další cytogenetická aberace Mutační analýza genu BCR-ABL1 (z periferní krve):
Mutace v oblasti kinázové domény BCR-ABL1 genu jsou považovány za jednu z nejčastějších příčin rezistence na léčbu imatinibem (8). V časné chronické fázi se mutace vyskytují velmi zřídka, u sekundární rezistence na imatinib se vyskytují v 50–90 % případů. Vyšetření se proto doporučuje provést vždy při selhání léčby imatinibem, při progresi choroby a individuálně při suboptimální odpovědi na léčbu (9). Detekce přítomnosti mutace T315I je např. indikací k časnému provedení alogenní TKB, pokud nemocný splňuje ostatní indikační transplantační kritéria a má dostupného dárce.Monitorování toxicity léčby
Nežádoucí účinky léčby (NÚ) (toxicita) jsou hodnoceny dle National Cancer Institute Common Toxicity Criteria for Adverse Events (CTCAE v4.0). Rozlišujeme hematologické a nehematologické NÚ stupně 1–4 (http://ctep. cancer.gov) (16). Možnost symptomatické léčby, dočasné snížení dávky, trvalé vysazení léku.Diskutován je také význam stanovování hladiny imatinibu v plazmě a event. možné interakce s jinými látkami a léky (např. CYP450 3A4), které mohou účinnost stávající léčby výrazně ovlivnit (10).
(http://medicine.jupui.edu/flockhart/table.htm)
5.2.3 Léčba II
V situaci jiné než optimální odpovědi na léčbu imatinibem v první linii nebo jeho netolerovatelné toxicitě je doporučena změna léčby za TKI 2. generace dasatinib nebo nilotinib. Volba typu TKI 2. generace by měla vycházet zejména ze znalostí přítomnosti a typu mutace v kinázové doméně BCR-ABL, anamnestických údajů, projevů toxicity, možné interakce s jinými léky. Při odpovědi suboptimální lze ještě event. na určitou dobu zvýšit dávku IM. Návrh definice odpovědí na léčbu TKI 2. generace ve 2. léčebné linii (po selhání imatinibu) v CP-CML v tabulce 4 (7).
Tab. 4. Návrh definice odpovědí na léčbu TKI 2. generace ve 2. léčebné linii (po selhání imatinibu) (7). 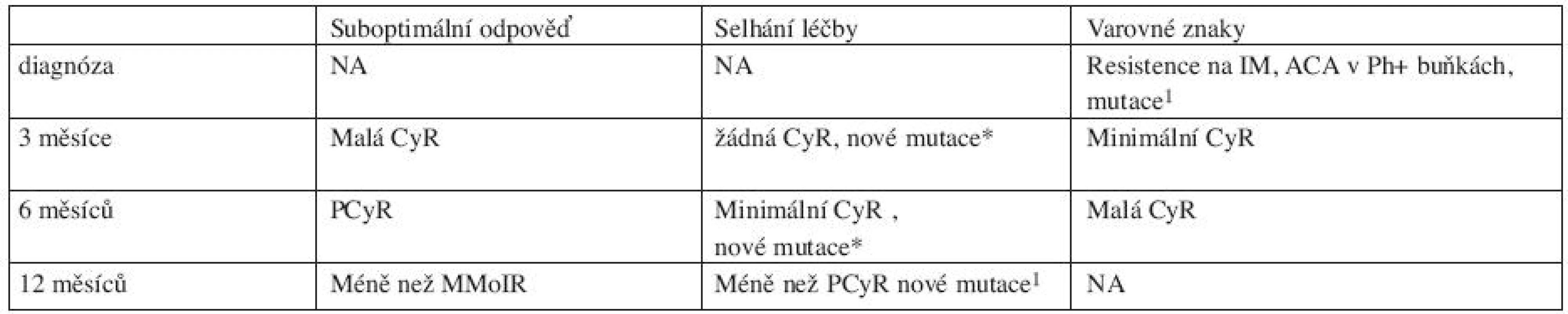
1 vysoce rezistentní k IM mutace v kinázové doméně málo citlivá k TKI CCA další cytogenetická aberace Baccarani M, et al. 2009, Barcelona (ELN recommendations) Tab. 5. Doporučení pro léčbu pacientů s AP-CML a BP-CML 
Léčebné možnosti pacientů po selhání imatinibu v první linii:
- Nilotinib400 mg 2 x denně
- Dasatinib100 mg 1 x denně
- Zvýšení dávky imatinibu na 600–800 mg/den (pouze při suboptimální odpovědi)
- Alogenní transplantace krvetvorných buněk (dle EBMT rizika TKB a rizika nemoci)
- Při neúspěchu léčby TKI 1. a 2. generace
a nevhodnosti TKB:
- interferon alfa samostatně nebo v kombinaci s cytosinarabinosidem
- hydroxyurea
- nové látky v rámci klinické studie
Možnosti léčby nemocných s CML v chronické fázi viz schéma 1.
Schéma 1. Doporučení pro léčbu pacientů s CP-CML. 
*Výše úhrady přípravků Tasigna (nilotinib) a Sprycel (dasatinib) v 1. linii léčby CML z prostředků veřejného zdravotního pojištění není v ČR k 1. 5. 2011 stanovena 5.3 Léčba akcelerované a blastické fáze CML
Léčba CML ve fázi akcelerace vyžaduje vyšší dávky TKI a je spojena s vyšším výskytem nežádoucích účinků. Zvýšená hematologická toxicita souvisí mimo jiné s větší expanzí patologického klonu a ubývající rezervou normální krvetvorby v pokročilejších stadiích nemoci. IM v dávce 600 – 800 mg denně se používá k zahájení léčby u nemocných, u nichž se CML zjistila v AP bez předcházející CP. Nemocní, u nichž došlo k progresi do AP při léčbě IM, jsou indikováni k léčbě nilotinibem nebo dasatinibem (schéma 2). U všech nemocných v AP CML by měla být vždy pečlivě zvážena indikace alogenní TKB.
Schéma 2. Doporučení pro léčbu pacientů s AP-CML a BP-CML. 
* podmíněna přítomností vhodný dárce a schopnost pacaienta výkon podstoupit V blastické fázi CML nevede monoterapie TKI k dlouhodobé kontrole nemoci. Pro nemocné s lymfoblastickou transformací se doporučuje kombinace TKI a chemoterapie jako u Ph pozitivní akutní lymfoblastické leukemie (ALL), u nemocných s myeloblastickou transformací se používají TKI v kombinaci s postupy běžnými u akutní myeloidní leukemie (AML) (12). Pravděpodobnost relapsů u BP a AP CML je vysoká, riziko lze redukovat alogenní TKB provedenou co nejdříve po dosažení remise. U všech nemocných v AP a BP CML by měla být indikace alogenní TKB vždy pečlivě zvážena. Doporučení pro vyhledávání dárce a načasování alogenní TKB dle doporučení ELN 2009 jsou uvedena v tabulce 6.
Tab. 6. Doporučení pro alogenní transplantaci krvetvorných buněk. 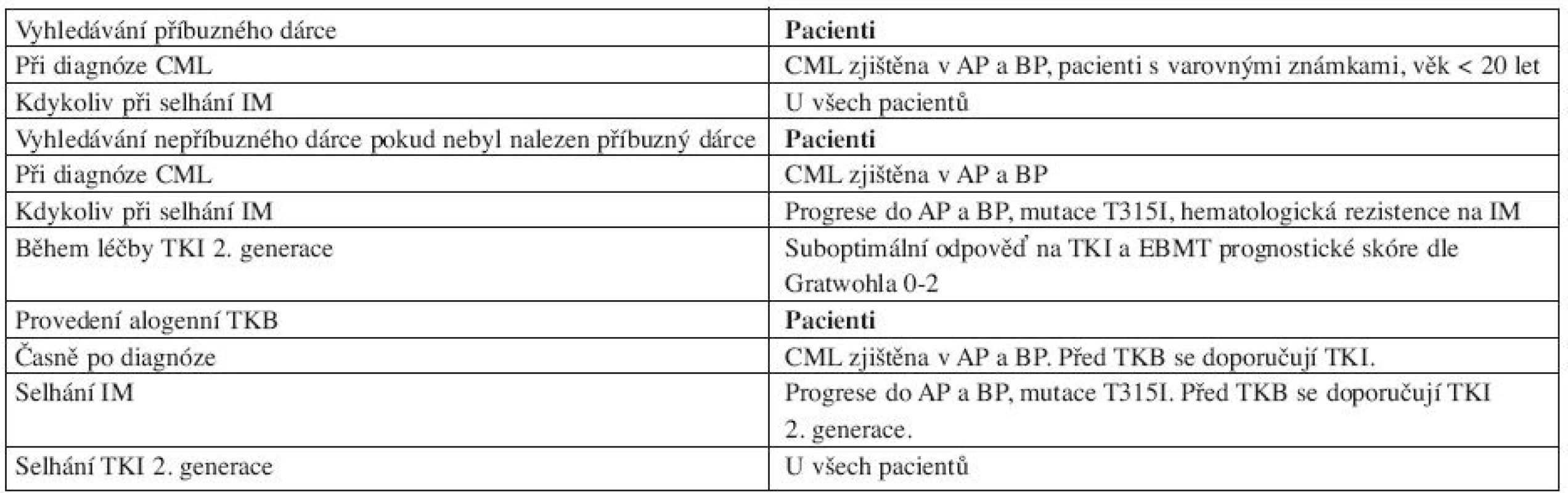
Upraveno podle doporučení ELN 2009 (Baccarani 2009, literární odkaz č. 7). Současné léčebné možnosti CMLznamenají významné prodloužení jak celkového přežití, tak přežití bez progrese nemoci a výrazně zlepšují také kvalitu života nemocných.
Zdroje
1. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006; 108 : 1809-1820.
2. Hochhaus A, Dreyling M. Chronic myelogenous leukemia: ESMO Clinical Recommendations for the diagnosis, treatment and follow-up. Ann Onc 2008; 19 : 63-64.
3. Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in good-risk chronic granulocytic leukemia. Blood 1984; 63 : 789-799.
4. Hasford J, Pfirmann M, Hehlman R, et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. J Natl Cancer Inst 1998; 90 : 850-858.
5. Gratwohl A, Hermans J, Goldman JM, et al. Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation: Chronic Leukemia Working Party of European Group for Blood and Marrow Transplantation. The Lancet 1998; 352 : 1087-1092.
6. Shah NP. Medical Management of CML. Hematology 2007. Atlanta: ASH, 2007, 371-375, 352 : 1087-1092
7. Baccarani M, Cortes J, Pane F, et al. Chronic Myeloid Leukemia: An Update Concept and Management Recommendations of European LeukemiaNet. J Clin Oncol 2009, 27 : 6041-6051.
8. Kantarjian H, Schiffer Ch, Jones D, et al. Monitoring the response and course of chronic myeloid leukemia in the modern era of BCR-ABL tyrosine kinase inhibitors: practical advice on the use and interpretation of monitoring methods. Blood 2008; 111 : 1774-1780.
9. Branford S. Chronic Myeloid Leukemia: Molecular Monitoring in Clinical Practice. Hematology 2007. Atlanta: ASH, 2007, 376-382.
10. Picard S, Titier K, Etienne G, et al. Through imatinib plasma levels are associated with both cytogenetic and molecular responses to standard-dose imatinib in chronic myeloid leukemia. Blood 2007; 109 : 3496-3499.
11. Radich JP. The Biology of CML Blast Crisis. Hematology 2007. Atlanta: ASH, 2007, 384-390.
12. Goldman JM. Initial treatment for patients with CML. Hematology 2009; American Society of Hematology education Program Book: 453-460.
13. Saglio G. et al. Nilotinib demonstrated superior efficacy compared with imatinib in patients with newly diagnosed CML. N Engl J Med 2010; 362 : 2251-59.
14. Kantarjian H et al. Dassatinib versus imatinib in newly diagnosed CML CP. N Engl J Med; 362; 24 : 2260-70.
15. NCCN Practice guidelines in oncology, Chronic myelogenous leukemia,version 2.2011 http://www.nccn.org
16. National Cancer Institute Common Toxicity Criteria for Adverse Events (CTCAE v4.0). (http://ctep.cancer.gov)
17. Evropská léková agentura pro léčivé přípravky
(http://www.ema.europa.eu)
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2011 Číslo 2- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Životní jubileum MUDr. Vladimír Kulich
- Iron chelation therapy with deferasirox in patiens with aplastic anemia: a subgroup analysis of 116 patients from the EPIC trial
- Pharmacokinetic, pharmacodynamic and pharmacogenetic determinants of osteonecrosis in children with acute lymphoblastic leukemia
- Randomized, double-blind trial of fluconazole versus variconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- Markery buněčného poškození trombocytů u směsných trombocytových transfuzních přípravků v aditivních roztocích
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
- Does microgranular variant morphology of acute promyelocytic leukemia independently predict a less favorable outcome compared with classical M3 APL? A joint study of the North American Intergroup and the PETHEMA Group
- Chronobiologické aspekty v hematológii
-
Chronická myeloidní leukemie
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



