-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Delece TP53 u nemocných s mnohočetným myelomem a monoklonální gamapatií nejistého významu – molekulárně cytogenetická analýza souboru 84 nemocných
TP53 deletion in patients with multiple myeloma and monoclonal gammopathy of undetermined significance - molecular cytogenetic analysis of 84 patients
In the pathogenesis of multiple myeloma (MM), both primary and secondary genetic changes play an important role. The latter includes deletion of TP53 gene, which belongs among a group of high-risk changes associated with significantly shorter progression-free survival as well as overall survival.
Our objective was to determine the frequency and type of deletion of TP53 gene (17p13) in a group of 84 patients with MM or monoclonal gammopathy of undetermined significance (MGUS), comprising 41 males and 43 females with a median age of 61 years. In 45 patients, two distinct bone marrow samples were available, therefore we compared the results from these two collections, too. Bone marrow samples obtained from all patients were analysed using both conventional and molecular cytogenetic methods. To detect deletion of the TP53 gene, the FICTION technique with the LSI TP53/CEP 17 probe (Abbott Molecular) was used. The cut-off was set at 20%.
The analysis of 84 patients with MM revealed deletion of TP53 gene in 12 (14%) patients; one patient had chromosome 17 monosomy. Deletion of TP53 gene was not observed in any of the six individuals with MGUS. Most frequently, the deletion was observed in more advanced stages of multiple myeloma. In 10 out 12 patients, the deletion of TP53 gene was a part of a complex karyotype changes. All deletions in our cohort were monoallelic. The study also confirmed a correlation between the deletion of TP53 gene and the deletion of RB1 gene. Our results support the recommendations of the European Myeloma Network supporting the role of routine examination of MM patients for TP53 gene deletion.Key words:
multiple myeloma, chromosomal changes, deletion of the TP53 gene, FICTION
Autori: P. Mičková 1; J. Balcárková 1; T. Pika 2; V. Ščudla 2; J. Bačovský 2; J. Minařík 2; K. Nevimová 1; M. Jarošová 1
Pôsobisko autorov: Hemato-onkologická klinika, LF UP a FN Olomouc 1; III. interní klinika – NRE, LF UP a FN Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 1, p. 32-38.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
V patogenezi mnohočetného myelomu (MM) hrají významnou úlohu primární i sekundární genetické změny. Do skupiny sekundárních změn patří delece genu TP53. Tvoří skupinu vysoce rizikových změn, které jsou asociovány s výrazně kratším obdobím přežití bez progrese onemocnění i celkovým přežitím.
Cílem naší studie bylo určit frekvenci a typ delece genu TP53 (17p13) v souboru 84 nemocných s MM nebo monoklonální gamapatií nejistého významu (MGUS), který tvořilo 41 mužů a 43 žen s mediánem věku 61 let. U 45 nemocných, u kterých jsme měli k dispozici dva vzorky kostní dřeně, byly porovnány výsledky ze dvou odběrů. Vzorky kostní dřeně všech nemocných byly vyšetřeny metodami konvenční a molekulární cytogenetiky. K detekci delece genu TP53 byla využita metoda FICTION se sondou LSI TP53/CEP 17 (Abbott Molecular). Hodnota cutt-off byla stanovena na 20 %.
Výsledky analýzy delece TP53 v souboru 84 nemocných odhalily deleci u 12 (14 %) nemocných, u 1 nemocné byla prokázána monozomie chromozomu 17. Delece genu TP53 nebyla pozorována u žádného ze šesti jedinců s MGUS. Nejčastěji byla delece pozorována v pokročilých stadiích mnohočetného myelomu a u 10 z 12 nemocných byla delece genu TP53 součástí komplexního karyotypu. Všechny delece v našem souboru byly monoalelické. V této studii jsme rovněž potvrdili korelaci výskytu delece genu TP53 s delecí genu RB1. Naše výsledky podporují doporučení Evropské myelomové sítě (EMN), kterým je rutinní vyšetřování delece genu TP53 u nemocných s MM.Klíčová slova:
mnohočetný myelom, chromozomové změny, delece genu TP53, FICTIONÚvod
Mnohočetný myelom (MM) je druhá nejčastější hemato-onkologická malignita vyznačující se nadměrným zmnožením klonálních plazmocytů (nejčastěji izotyp IgG), akumulací těchto plazmocytů především v kostní dřeni nemocných a produkcí monoklonálního imunoglobulinu.
Za prvotní příčinu vzniku MM jsou považovány genetické změny postihující B-lymfocyty v jejich terminálním vývojovém stadiu – plazmoblasty germinálních center lymfatických uzlin či plazmocyty kostní dřeně. Takto pozměněným plazmatickým buňkám je za podpory stromálních buněk kostní dřeně (KD) umožněna nekontrolovaná proliferace na úkor ostatních složek krvetvorné tkáně a současná inhibice apoptózy způsobující jejich dlouhodobé přežívání. V důsledku destabilizace genomu a následných sekundárních genetických změn pak dochází k progresi do pokročilejších stadií onemocnění (1).
Přítomnost chromozomových abnormalit odhalených pomocí konvenční a molekulární cytogenetiky předurčuje léčebnou odpověď a prognózu nemocných. Mezi rekurentní vysoce rizikové chromozomové aberace prognostického významu byly na základě předchozích studií zařazeny hypodiploidie, translokace t(4;14), t(14;16), t(14;20) a delece genu TP53 (2).
K inaktivujícím mutacím genu TP53 způsobujícím ztrátu schopnosti buněk reagovat na buněčný stres dochází přibližně u 50 % solidních nádorů (3). Změny tohoto významného tumor supresorového genu jsou detekovány i u nemocných s hematologickými malignitami, s vyšší frekvencí v pokročilých a agresivních stadiích onemocnění (4).
Protein p53 je transkripční faktor řady genů kontrolujících růst buněk, stárnutí buněčných populací, opravy DNA, apoptózu i angiogenezi. Nízká hladina proteinu p53 v buňce je za fyziologických okolností udržována jeho interakcí s MDM2 proteinem, jehož syntézu protein p53 sám indukuje. V případě buněčného stresu dochází k narušení této interakce v důsledku stabilizace p53 posttranslačními úpravami. Zvýšené hladiny p53 pak vedou k transkripci pro-apoptotických genů (např. PUMA, BAX, BAK) nebo k zastavení buněčného cyklu prostřednictví inhibitoru cyklin dependentních kináz (CDK) – proteinu p21WAF1/CIP1, zabraňujícímu replikaci poškozené DNA a následné destabilizaci genomu (5).
Nejčastější příčinou inaktivace genu TP53 u nemocných s MM je intersticiální monoalelická delece krátkého ramene chromozomu 17. Metodou FISH bývá delece detekována u 0–3 % jedinců s monoklonální gamapatií nejistého významu (MGUS) (6–8), u 5–34 % nemocných s nově dg MM a u přibližně 40 % nemocných v pokročilém stadiu onemocnění (9–16). Nejčastěji je delece pozorována u nemocných s primární i sekundární plazmocelulární leukemií (PCL; 56 % vs. 83 % nemocných) (17).
Ve srovnání s delecí, lze mutace tohoto genu detekovat u nemocných s MM s nižší frekvencí výskytu. Práce Lodé a kolektivu (4) odhalila výskyt mutace genu TP53 výhradně u nemocných s delecí druhé alely. Společný výskyt delece/mutace genu TP53 je často pozorován u nemocných s extramedulární propagací onemocnění, postižením centrálního nervového systému či renální insuficiencí a hyperkalcemií, což potvrzuje asociaci těchto změn s progresí a pokročilými stadii onemocnění (18–20).
U nemocných s delecí genu TP53 pozorovanou ve > 60 % plazmocytů KD byla prokázána výrazně kratší doba přežití bez známek choroby (EFS) i celkové přežití (OS) (21).
Cílem této studie bylo vyhodnocení frekvence výskytu a typu delece v souboru nemocných s MGUS a MM nebo plazmocelulární leukemií (PCL) a současně porovnání cytogenetických a molekulárně cytogenetických nálezů v KD ze dvou po sobě následujících vyšetření.
Soubor nemocných a metodika
Soubor 84 nemocných tvořilo 41 mužů a 43 žen ve věkovém rozmezí od 35 do 81 let, medián věku byl 61 let. Nejčastějšími typy těžkého řetězce monoklonálního imunoglobulinu byly řetězce IgG (45 nemocných, 54 %) a IgA (29 nemocných, 35 %). U 8 nemocných (10 %) se jednalo o Bence-Johnsonův typ onemocnění (BJ), 2 nemocní měli nesekreční formu MM. Celkem 52 (61,9 %) nemocných mělo určený lehký řetězec kappa. Medián OS byl 7,8 let.
Dle Durie-Salmon stážovacího systému bylo 18 nemocných v době odběru KD v klinickém stadiu I, 23 nemocných v klinickém stadiu II, 37 nemocných ve stadiu III. Dle mezinárodního prognostického indexu (IPI/ISS) bylo 34 nemocných ve stadiu I, 21 nemocných ve stadiu II a 23 nemocných ve stadiu III. Navíc byla kostní dřeň odebrána u 6 nemocných s monoklonální gamapatií nejistého významu (MGUS).
Všichni nemocní byli diagnostikováni na III. Interní klinice-NRE, u nemocných se symptomatickou formou mnohočetného myelomu probíhala léčba na III. Interní klinice-NRE a Hemato-onkologické klinice FN a LF UP v Olomouci v letech 2000–2012.
Vyšetření přítomnosti delece genu TP53 bylo provedeno u 6 nemocných v době diagnózy MGUS, u 46 nemocných v době diagnózy MM (5 nemocných v asymptomatickém stadiu MM), u 31 nemocných v době progrese nebo relapsu MM a v 1 případě v době diagnózy PCL.
Z celkových 84 nemocných bylo u 45 nemocných provedeno cytogenetické a molekulárně cytogenetické vyšetření dvou vzorků kostní dřeně odebraných v různých fázích onemocnění. 4 jedinci měli odběry KD v době diagnózy MGUS a následně v době transformace do MM, 34 nemocných v době diagnózy MM a v období progrese nebo relapsu MM (21 x 1.,9 x 2., 3 x 4. a 1 x 5. relaps/progrese), u 6 nemocných byly srovnány výsledky ze vzorků KD odebrané v období dvou progresí/relapsů onemocnění (4 x 1. vs. 2. relaps, 1 x 2. vs. 3. relaps a 1 x 1. vs. 4. relaps/progrese) a v případě 1 nemocné byly srovnány výsledky z doby diagnózy MGUS a 1. relapsu MM (graf 1).
Graf 1. Rozdělení nemocných s 2 porovnávanými výsledky z odběrů KD podle stavu onemocnění (např. MGUS → dg MM = nemocný vyšetřen ve stadiu MGUS a v době diagnózy MM). 
Cytogenetické vyšetření bylo provedeno klasickým způsobem na nestimulovaných buňkách kostní dřeně (22). K určení delece TP53 (17p13) a její frekvence byla u všech nemocných provedena metoda fluorescenční in situ hybridizace s imunobarvením lehkých řetězců (FICTION) (22) se sondou LSI TP53/CEP 17 (Abbott Molecular, Des Plaines, IL, USA). Hodnota cut-off pro deleci byla na podkladě doporučení Evropské myelomové skupiny (EMN) pro FISH u MM stanovena na 20 %. Dále byly touto metodou vyšetřeni všichni nemocní pro určení delece genu RB1, přestavbu genu IgH, početní změny chromozomu 15 a změny v počtu kopií oblastí 1q21 a 1p36 se sondami LSI RB1, LSI IgH, CEP 15, ON 1q21/1p36 (Abbott Molecular; Kreatech Diagnostics, Amsterdam, Netherlands). V případě nalezené přestavby genu IgH byly využity i sondy pro detekci translokací t(11;14)(q13;q32), t(4;14)(p16;q32) a t(14;16)(q32;q23) (LSI CCND1/IgH, LSI FGFR3/IgH, LSI MAF/IgH) (Abbott Molecular).
Hodnota cut-off pro detekci translokací, duplikací, popř. amplifikací lokusově specifickými sondami byla 10 %, pro hodnocení delecí nebo monozomií s lokusově specifickými nebo centromerickými sondami pak 20%. Hybridizace byla provedena podle doporučení výrobce sond. Hodnoceno bylo nejméně 100 jader plazmatických buněk.
Výsledky
Delece genu TP53 byla prokázána v KD 12 (14 %) z celkem 84 vyšetřených nemocných. U 5 nemocných byla delece prokázána v době diagnózy MM, u jednoho nemocného v době relapsu MM a v 6 případech se jednalo o deleci detekovanou v době progrese onemocnění. U jedné nemocné byla prokázána monozomie chromozomu 17.
Současně s delecí genu TP53 byla nejčastěji pozorována delece genu RB1 (6 nemocných) a přítomnost nadpočetné kopie oblasti 1q21 (7 nemocných). Přestavba genu IgH byla detekována pouze u tří nemocných, z toho u jednoho nemocného byla prokázána translokace t(4;14), u jednoho translokace t(14;16) a u jedné nemocné se nepodařilo určit translokačního partnera. Delece genu TP53 nebyla pozorována u žádného nemocného s translokací t(11;14). Z 12 nemocných s delecí genu TP53 byly u 10 nemocných detekovány komplexní změny karyotypu. Všechny určené delece byly monoalelické.
Z klinického hlediska byla delece asociována s pokročilými stadii onemocnění: u 6 nemocných byla delece odhalena ve stadiu III dle Durie-Salmona (DSS) a u 4 nemocných ve stadiu II. Z těžkých řetězců monoklonálního imunoglobulinu byl nejčastěji zastoupen řetězec IgG (5 nemocných), u 3 nemocných řetězec IgA a 4 nemocní vykazovali Bence-Johnesovu bílkovinu. S přihlédnutím k zastoupení jednotlivých typů těžkých řetězců v celém souboru nemocných byla delece nejčastěji detekována ve skupině nemocných s BJ bílkovinou (50 % nemocných s BJ; 11 % nemocných s IgG, 10 % nemocných s IgA). Poměr sekrece lehkého řetězce kappa:lambda byl 7 : 5. Klinická data a další nalezené cytogenetické a molekulárně cytogenetické změny nemocných s delecí TP53 a monozomií chromozomu 17 ukazuje tabulka 1.
Tab. 1. Klinická data a výsledky cytogenetických a molekulárně cytogenetických vyšetření nemocných s delecí TP53 a monozomií chromozomu 17. 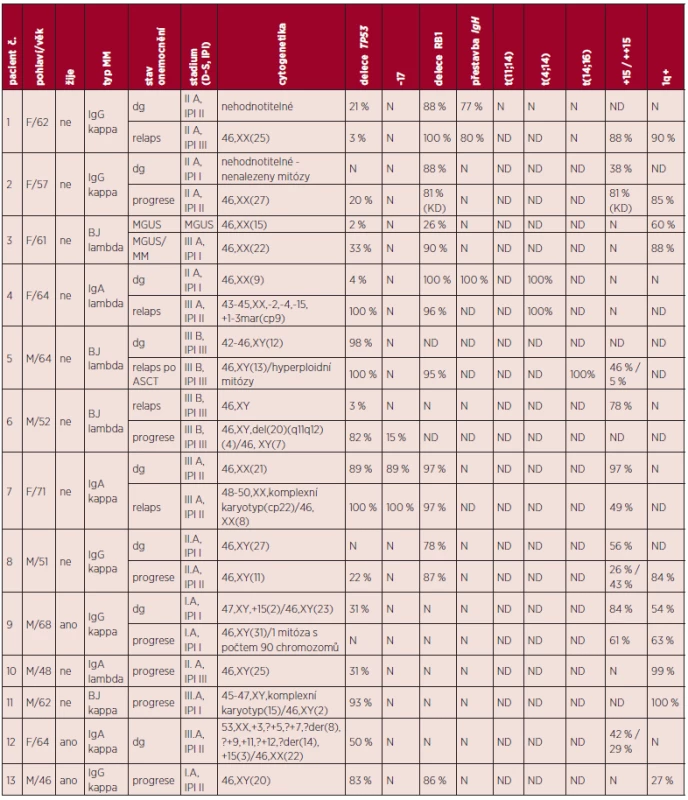
Vysvětlivky: N - normální nález; ND - nehodnoceno; KD - vyšetření provedeno z plné kostní dřeně. U 45 nemocných bylo provedeno cytogenetické a molekulárně cytogenetické vyšetření dvou vzorků kostní dřeně odebraných v různých stadiích onemocnění (graf 1). Z nich byla delece nalezena u 8 nemocných, u jedné byla nalezena monozomie chromozomu 17.
Delece byla nalezena u dvou nemocných v době diagnózy MM (21 % PB s delecí TP53; 31 % PB s delecí TP53) bez jejího průkazu v následujícím odběru z doby relapsu onemocnění. V 1 případě byla delece prokázána v době diagnózy MM s negativním nálezem ve vzorku KD z období nemaligního stadia onemocnění – MGUS a u 3 nemocných se vzorky KD odebraných při diagnóze a progresi MM měly pozitivní nález s delecí TP53 pouze vzorky získané v době progrese onemocnění. U 2 nemocných byla delece genu TP53 pozorována jak v době diagnózy MM, tak v době relapsu, ale u jednoho z nich jako výsledek monozomie chromozomu 17. Ze 13 nemocných vyšetřených v období dvou po sobě následujících relapsů byla pouze u jednoho nemocného určena delece a to ve druhém relapsu onemocnění (tab. 2).
Tab. 2. Výsledky opakovaných vyšetření v různých stadiích MM. 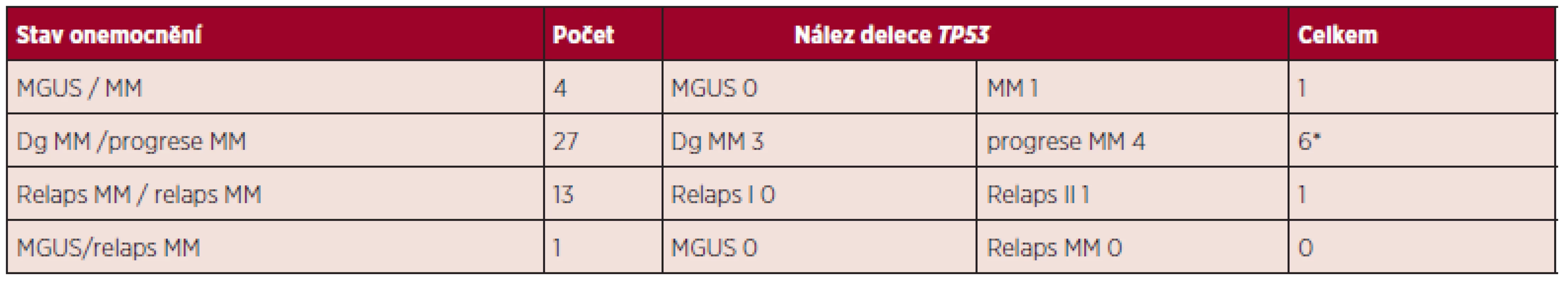
*u 1 nemocného prokázána delece TP53 v době diagnózy i relapsu MM Nebyla nalezena korelace delece TP53 a typu lehkého řetězce imunoglobulinu. Častěji byla delece detekována u nemocných s BJ bílkovinou. Podle našich výsledků opakované vyšetření nemocných v po sobě následujících dvou relapsech neukazuje tendenci vyššího výskytu této změny. Hodnocení klinických dat pouze potvrzuje, že delece se vyskytuje častěji v pokročilejším stadiu onemocnění a srovnání celkového přežívání nemocných s delecí a bez delece ukázalo, že delece tohoto genu je spojena s tendencí ke kratší době přežívání – s cut-off 50 % bylo průměrné přežití nemocných s delecí 5,4 let a průměrné přežití nemocných bez delece bylo 7,9 let.
Diskuse
Mutace/delece/snížené exprese genu TP53 detekované nejen v oblasti solidních nádorů, ale i u nemocných s hematologickými malignitami jsou považovány za genetické aberace nezávislého negativního prognostického významu, spojované s časnou progresí onemocnění, rezistencí k chemoterapii a krátkým přežíváním nemocných.
V našem souboru 84 nemocných s MM jsme detekovali výskyt monoalelické delece genu TP53 u 14 % nemocných, což je v souladu s frekvencí výskytu delece udávané v publikovaných výsledcích jiných studií (9–16). U těchto nemocných bylo ve srovnání s nemocnými bez delece TP53 pozorováno kratší OS. Potvrdili jsme i v některých studiích uváděnou tendenci ke korelaci výskytu delece genu TP53 s výskytem delece genu RB1 (6, 23).
Vzhledem k recesivnímu charakteru mutací v tumor supresorových genech se v případě monoalelické delece genu TP53 nabízí otázka inaktivace druhé alely tohoto genu. V práci Lodé L. et al. (4) byla podobně jako u nemocných s CLL (24) pozorována korelace výskytu mutace jedné alely genu TP53 s výskytem delece alely druhé. Jiným mechanismem vedoucím k umlčení genu TP53 je hypermetylace CpG ostrůvků jeho promotoru (25).
K narušení signální dráhy p53 může kromě inhibice transkripce genu TP53 dojít i jinými mechanismy jako například „overexpresí“ proteinu MDM2, mutací genů p14(ARF), CHK1, CHK2, ATM nebo ATR, popřípadě metylací promotorů microRNA miR-192, 194 a 215 ovlivňující vzájemnou interakci mezi MDM2 a p53 (26).
Cytogenetické a molekulárně cytogenetické změny v KD nemocných s MM patří mezi hlavní faktory rozhodující při výběru léčby. Je známo, že negativní prognostický dopad některých genetických změn jako například t(4;14) může být překonán „novými“ léčivy jako je bortezomib. U nemocných s detekovanou inaktivací genu TP53 tento efekt nebyl prokázán. Pouze v případě volby lenalidomidu bylo u těchto nemocných pozorováno delší přežití bez progrese onemocnění (PFS) (27). Jiné studie však tento efekt lenalidomidu u nemocných s delecí TP53 vyvracejí (28, 29).
Vzhledem k epigenetickým změnám podílejícím se na patogenezi mnohočetného myelomu a hypermetylaci řady genů včetně TP53 je potenciální léčebnou možností i regulace metylace histonů (30).
Detekce delece/mutace genu TP53 může být přínosná i z důvodu potenciálního budoucího využití takových léčebných přípravků jako je nutlin nebo RITA u nemocných s mnohočetným myelomem (31–35).
Delece TP53 v našem souboru byly u všech nemocných monoalelické a častěji pozorované ve spojení s progresí onemocnění nebo relapsem. Delece nebyla pozorována u žádného nemocného jako jediná změna, ale naopak u 12/14 nemocných byla součástí komplexních změn. Delece byla nalezena u dvou nemocných v době diagnózy MM, ale vyšetření z doby relapsu onemocnění bylo negativní i po opakované kontrolní hybridizaci. Tento nález může souviset s rozdílným počtem plazmatických buněk ve vyšetřovaném vzorku. Zatímco v době diagnózy pacienta č. 9 byl vyšetřen vzorek s 12 % plazmocytů, v době relapsu bylo ve vyšetřovaném vzorku pouze 2,5 % plazmocytů. Stejně tak u nemocné č. 1, měl vyšetřený vzorek kostní dřeně v době diagnózy 35 % plazmocytů, zatímco v době relapsu jsme vyšetřili vzorek s 13 % plazmocytů.
Opakované vyšetření delece TP53 v různých stadiích onemocnění provedené u 45 nemocných ukázalo, že vývoj onemocnění byl spojen se vznikem delece u 5 nemocných.
Identifikace delece genu TP53 u nemocných s mnohočetným myelomem by s ohledem k jejímu prognostickému významu a v souladu s doporučením Evropské myelomové skupiny (EMN) z roku 2012 měla být společně s translokacemi t(4;14) a t(14;16) integrální součástí rutinního screeningu genetických změn metodou FISH respektive FICTION. Naše výsledky toto doporučení podporují a vyšetření delece genu TP53 se stala součástí diagnostického screeningu v laboratořích HOK FN a LF UP Olomouc.
Podíl autorů na rukopisu
MP a JM napsání rukopisu, MP, BJ a NK provádění vyšetření, PT, ŠV, BJ, MJ diagnostika, léčba a odběry materiálu nemocných.
Poděkování: Dr. J. Zapletalové za statistickou analýzu, Práce byla podporována grantem IGA NT 11400 a LF UP 2013-04.
Mgr. Pavla Mičková
U Dvora 15
779 00 Olomouc
e-mail: pmickova@seznam.cz
Zdroje
1. Adam Z, Hájek R, Mayer J, Ščudla V, Vorlíček J, a kol. Mnohočetný myelom a další monoklonální gamapatie. Brno, 1999. 19-21.
2. Nahi H, Sutlu T, Jansson M, et al. Clinical impact of chromosomal aberrations in multiple myeloma. J Intern med 2011; 269(2): 137-47.
3. Hollstein M, Sidransky D, Vogelstein B, Harris CC. p53 mutations in human cancers. Science 1991; 253(5015): 49-53.
4. Lodé L, Eveillard M, Trichet V, et al. Mutations in TP53 are exclusively associated with del(17p) in multiple myeloma. Haematologica 2010; 95(11): 1973-6.
5. Strachan T, Read A. Human molecular genetics. 4th edition. New York, 2010; 556.
6. Liebisch P, Döhner H. Cytogenetics and molecular cytogenetics in multiple myeloma. Eur J Cancer 2006; 42(11): 1520-9.
7. Bacher U, Haferlach T, Wolfgang K, et al. Correlation of cytomorphology, immunophenotyping, and interphase fluorescence in situ hybridization in 381 patients with monoclonal gammopathy of undetermined significance and 301 patients with plasma cell myeloma. Cancer Genet Cytogenet 2010; 203(2): 169-75.
8. Chiecchio L, Dagrada GP, Ibrahim AH, et al. Timing of acquisition of deletion 13 in plasma cell dyscrasias is dependent on genetic context. Haematologica 2009; 94(12): 1708-13.
9. Chang H, Qi C, Yi QL, et al. p53 gene deletion detected by fluorescence in situ hybridization is an adverse prognostic factor for patients with multiple myeloma following autologous stem cell transplantation. Blood 2005; 105(1): 358-60.
10. Ortega MM, Melo MB, De Souza CA, et al. A possible role of the p53 gene deletion as a prognostic factor in multiple myeloma. Ann hematol 2003; 82(7): 405-9.
11. Drach J, Ackerman J, Kaufmann H, et al. Deletions of the p53 gene in multiple myeloma. Br J Haematol 2000; 108(4): 886.
12. Carlebach M, Amiel A, Gaber E, et al. Multiple myeloma: monoallelic deletions of the tumor suppressor genes TP53 and RB1 in long-term follow-up. Cancer Genet Cytogenet 2000; 117(1): 57-60.
13. Avet-Loiseau H, Li JY, Godon C, et al. p53 deletion is not a frequent event in multiple myeloma. Br J Haematol. 1999; 106(3): 717-9.
14. Drach J, Ackermann J, Fritz E, et al. Presence of a p53 gene deletion in patients with multiple myeloma predicts for short survival after conventional-dose chemotherapy. Blood 1998; 92(3): 802-9.
15. Fonseca R, Blood E, Rue M, et al. Clinical and biologic implications of recurrent genomic aberrations in myeloma. Blood 2003; 101(11): 4569-75.
16. Liebisch P, Wendl C, Wellmann A, et al. High incidence of trisomies 1q, 9q, and 11q in multiple myeloma: results from a comprehensive molecular cytogenetic analysis. Leukemia 2003; 17 : 2535-7.
17. Tiedemann RE, Gonzales-Paz N, Kyle RA, et al. Genetic aberrations and survival in plasma cell leukemia. Leukemia 2008; 22(5):1044-52.
18. Chang H, Sloan S, Li D, Keith Stewart A. Multiple myeloma involving central nervous system: high frequency of chromosome 17p13.1 (p53) deletions.
19. Stewart AK, Fonseca R. Prognostic and therapeutic significance of myeloma genetics and gene expression profilig. J Clin Oncol 2005; 23(26): 6339-44.
20. Kapoor P, Rajkumar SV. Update on risk stratification and treatment of newly diagnosed multiple myeloma. Int J Hematol 2011; 94(4): 310-20.
21. Avet-Loiseau H, Attal M, Moreau P, et al. Genetic abnormalities and survival in multiple myeloma: the experience of the Intergroupe Francophone du Myélome. Blood 2007; 109(8): 3489-95.
22. Balcárková J, Procházková K, Ščudla V, a kol. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Transfuze a hematol dnes 2007; 4 : 176 -182.
23. Xiong W, Wu X, Starnes S, et al. An analysis of the clinical and biologic significance of TP53 loss and the identification of potential novel transcriptional targets of TP53 in multiple myeloma. Blood 2008; 112(10): 4235-46.
24. Malcikova J, Smardova J, Rocnova L, et al. Monoallelic and biallelic inactivation of TP53 gene in chronic lymphocytic leukemia: selection, impact on survival, and response to DNA damage. Blood 2009; 114(26): 5307-14.
25. Smith EM, Boyd K, Davies FE. The potential role of epigenetic therapy in multiple myeloma. Br J Haematol 2010; 148(5): 702-13.
26. Pichiorri F, Suh SS, Rocci A, et al. Downregulation of p53-inducible microRNAs 192, 194, and 215 impairs the p53/MDM2 autoregulatory loop in multiple myeloma development. Cancer Cell 2010; 18(4): 367-81.
27. Avet-Loiseau H, Caillot D, Marit G, et al. Long-term maintenance with lenalidomide improves progression free survival in myeloma patients with high-risk cytogenetics: An IFM study. ASH Annual Meeting Abstracts 2010; 116(21):1944.
28. Reece D, Song KW, Fu T, et al. Influence of cytogenetics in patients with relapsed or refractory multiple myeloma treated with lenalidomide plus dexamethasone: adverse effect of deletion 17p13. Blood 2009; 114(3): 522-5.
29. Bahlis NJ, Song K, Trieu Y, et al. Lenalidomide overcomes poor prognosis conferred by del 13q and t(4;14) but not del 17p13 in multiple myeloma: results of the Canadian MM016 trial. Blood 2007; 110 : 1052A (ABSTRACT).
30. Hodge DR, Peng B, Cherry JC, et al. Interleukin 6 supports the maintenance of p53 tumor suppressor gene promoter methylation. Cancer res 2005; 65(11): 4673-82.
31. Jones RJ, Bjorklund CC, Baladanadayuthapani V, et al. Drug resistance to inhibitors of the human double minute-2 E3 ligase is mediated by point mutations of p53, but can be overcome with the p53 targeting agent RITA. Mol Cancer Ther 2012; 11(10): 2243-53.
32. Saha MN, Jiang H, Mukai A, et al. RITA inhibits multiple myeloma cell growth through induction of p53-mediated caspase-dependent apoptosis and synergistically enhances nutlin-induced cytotoxic responses Mol Cancer Ther 2010; 9(11): 3041-51.
33. Zhang Q, Lu H. Nutlin’s two roads toward apoptosis. Cancer Biol Ther 2010; 10(6): 579-81.
34. Saha MN, Jiang H, Jayakar J, et al. MDM2 antagonist nutlin plus proteasome inhibitor velcade combination displays a synergistic anti-myeloma activity. Cancer Biol Ther 2010; 9(11): 936-44.
35. Saha MN, Micallef J, Qiu L, et al. Pharmacological activation of the p53 pathway in haematological malignancies. J Clin Pathol 2010; 63(3): 204-9.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 1- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Toxoplazma a imunodeficience, kazuistika
- Léčba rekombinantním faktorem VIII nevede u předtím neléčených pacientů s hemofilií A v České republice ke zvýšení rizika výskytu inhibitoru
- Jsme oprávněni řadit nemocné s dvěma samostatnými buněčnými klony a to s delecí 5q a s trizomií 8 jako podskupinu myelodysplastického syndromu typu 5q- syndromu?
- Delece TP53 u nemocných s mnohočetným myelomem a monoklonální gamapatií nejistého významu – molekulárně cytogenetická analýza souboru 84 nemocných
- Oznámení
- Výběr z tisku a zprávy o knihách
- Úvodník
- Optimální proces vyhledávání dospělého nepříbuzného dárce krvetvorných buněk. Doporučení transplantační sekce české hematologické společnosti
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Toxoplazma a imunodeficience, kazuistika
- Delece TP53 u nemocných s mnohočetným myelomem a monoklonální gamapatií nejistého významu – molekulárně cytogenetická analýza souboru 84 nemocných
- Jsme oprávněni řadit nemocné s dvěma samostatnými buněčnými klony a to s delecí 5q a s trizomií 8 jako podskupinu myelodysplastického syndromu typu 5q- syndromu?
- Optimální proces vyhledávání dospělého nepříbuzného dárce krvetvorných buněk. Doporučení transplantační sekce české hematologické společnosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



