-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Von Willebrandova choroba
Von Willebrand disease
It is likely that every haematologist has in his care a patient with von Willebrand’s disease. However, this disease is not always diagnosed in a patient and on the contrary the disease does not always require treatment. The author presents the fundamentals of the pathophysiology, diagnosis and treatment of this disease, pointing to some current and problem issues.
Key words:
von Willebrand factor, von Willebrand disease, diagnosis, treatment, guidelines
Autoři: P. Smejkal
Působiště autorů: Katedra laboratorních metod, Lékařská fakulta, Masarykova univerzita, Brno ; Oddělení klinické hematologie, Fakultní nemocnice Brno
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 2, p. 53-66.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Je pravděpodobné, že pacienta s von Willebrandovou chorobou má ve své péči každý hematolog, ne vždy je však choroba u pacienta diagnostikovaná a naopak ne vždy tato choroba vyžaduje léčbu. Autor uvádí základy patofyziologie choroby, její diagnostiky a léčby s upozorněním na některé aktuální a problematické oblasti.
Klíčová slova:
von Willebrandův faktor, von Willebrandova choroba, diagnóza, léčba, doporučený postupÚVOD
Von Willebrandova choroba (VWCH) je krvácivá choroba, jejíž příčinou je vrozený defekt von Willebrandova faktoru (VWF) [1]. Nese jméno po finském lékaři Eriku Adolfu von Willebrandovi, který v r. 1924 vyšetřil na Ålandském souostroví pro krvácivé projevy pětiletou dívku a její rodinu a chorobu původně nazval pseudohemofilií [2]. Imunologické testy umožňující separátní stanovení faktoru VIII (FVIII) a VWF, tehdy označovaného jako FVIII-related antigen, však byly k dispozici až v 70. letech minulého století [3].
PATOFYZIOLOGIE
Gen pro VWF o velikosti 178 kilobází (kb) se nachází na 12. chromozomu a je uspořádaný do 52 exonů o velikosti 40 párů bází až po největší exon 28 tvořený 1,4 kb. Pseudogen s 97% identitou se nachází na chromozomu 22, který však obsahuje stop kodony, a není proto exprimován [4]. Transkript genu VWF má velikost 9 kb a jeho primární translační produkt pre-pro-polypetid VWF obsahuje 2813 aminokyselin (AMK). Prvních 22 AMK tvoří signální peptid, který je nutný pro jeho vstup do endoplazmatického retikula, ve kterém je odštěpen a ve kterém dochází ke glykosylaci pro-polypetidu VWF. Dalších 741 AMK tvoří propeptid VWF (VWFpp) tvořený doménami D1 a D2, který je nutný pro uspořádání VWF ještě v endoplazmatickém retikulu do dimerů, a v Golgiho komplexu, kde dochází spojením jednotlivých dimerů VWF ke vzniku makromolekul (tzv. multimerů), je pak VWFpp od výsledného proteinu VWF o velikosti 2050 AMK odštěpen a do běhu je secernován v ekvimolárním poměru s VWF jako dimer. Vzhledem k jeho kratšímu plazmatickému poločasu (t1/2) je však v plazmě jejich výsledný molární poměr VWFpp : vWF = 1 : 10. Plazmatický t1/2 VWFpp je 2–3 hod. [5, 6], zatímco plazmatický t1/2 VWF je přibližně 12 hod., resp. je dvoufázový, s rychlejší (t1/2 = 3 hod.) a pomalejší eliminací (t1/2 = 12–20 hod.) [7]. Ke zvýšení molárního poměru VWFpp : VWF až na 4 : 10 dochází při stimulaci endotelu po aplikaci 1-deamino-8-D-arginin vazopresinu (DDAVP), po fyzické námaze, při endotoxemii [5, 8], zatímco při dlouhodobé stimulaci endotelu (diabetes mellitus) se plazmatický poměr mezi propeptidem a VWF nemění [8]. Vlastní VWF je složen z domén D´-D3-A1-A2-A3--D4-B1-B2-B3-C1-C2-CK. V Golgiho komplexu dochází k modifikaci cukerných zbytků VWF a k polymerizaci VWF do multimerů o velikosti až 50 dimerů VWF.
VWF je syntetizovaný v megakaryocytech (asi 15 %) a především v endoteliálních buňkách. V trombocytech je uskladněn v α-granulích a je uvolňován při jejich aktivaci. Z endoteliálních buněk je VWF uvolňován z části kontinuálně a z části je skladován v granulích nazývaných Weibel-Paladeho tělíska, ze kterých je uvolňován po stimulaci nebo poškození endoteliálních buněk. V doménách D´-D3 VWF váže koagulační faktor FVIII, a chrání ho tak před proteolytickou degradací. Zprostředkovává adhezi trombocytů k subendotelu vazbou na kolagen (domény A1, A3), což následně umožní i vazbu na destičkový glykoprotein (GP) Ib (doména A1). Vazbou na aktivovaný GP IIb/IIIa (doména C1) se podílí na vzájemné agregaci trombocytů. V doménách D´-D3 a A1 jsou i vazebná místa pro heparin. V doménách A1 a A3 VWF vytváří prostřednictvím disulfidových můstků mezi Cys1272-Cys1458 a mezi Cys1686-Cys1872 dvě smyčky [9]. Uplatnění VWF v hemostáze uvádí tabulka 1.
Tab. 1. Funkce von Willebrandova faktoru v hemostáze 
VWF = von Willebrandův faktor FVIII = koagulační faktor VIII GP = glykoprotein destičkové cytoplazmatické membrány HMW = vysokomolekulární (high molecular weight) VWF je do cévního řečiště uvolňován ve formě multimerů o ultra velké molekulové hmotnosti (ULMW). Tyto však ihned po sekreci, kdy VWF zůstává ještě ukotvený k endoteliální buňce, vlivem smykového tření podléhají přechodné transformaci z globulární struktury do napřímené, při které dojde po obnažení A2 domény, ve které je VWF štěpen metaloproteázou ADAMTS-13 mezi aminokyselinami Tyr1605-Met1606. Tímto mechanismem z původní polymerní makromolekuly ULMW VWF vznikají různorodé multimery VWF obsahující štěpy monomeru VWF a různý počet intaktních monomerů, resp. dimerů VWF [10, 11, 12]. Vysokomolekulární (HMW) multimery VWF jsou při adhezi trombocytů účinnější, protože obsahují více vazebných míst ke kolagenu a GPIb.
Plazmatická hladina VWF je ze 40 % ovlivňována získanými faktory, jako jsou stres, věk, hormonální vlivy, ze 60 % pak vlivy genetickými. Hladina VWF v plazmě je o 25 % nižší u jedinců s krevní skupinou (KS) 0 ve srovnání s KS non-0 (A, B, AB). Předpokládá se zvýšení clearance plazmatického VWF nesoucího prostý H antigen, na rozdíl od KS non-0, kdy je H antigen modifikován. Navíc u KS 0 s antigeny Le(a-b+) a sekretorstvím H substance (genotyp Se/Se nebo Se/se) je hladina VWF o 11 % nižší proti KS non-0 a non-sekretorství H substance [7]. KS se podílí z ⅓ na genetických faktorech ovlivňujících hladinu VWF [13]. Ostatní genetické faktory jsou dosud neznámé. Hladina VWF se zvyšuje s věkem, resp. od 40 let věku se zvyšuje asi 6 % za dekádu [14], následkem beta adrenergní stimulace při stresu (fyzická zátěž, trauma, operace), v těhotenství, při infekcích, nádorech, diabetes mellitus, ateroskleróze [7]. U části fertilních žen dochází v cirkulaci ke kolísání VWF během menstruačního cyklu, s nejnižšími hladinami 9.–10. den cyklu, při užívání hormonální antikoncepce jsou hladiny nejnižší 5.–6. den cyklu [15]. Hladinu VWF zvyšuje hormonální antikoncepce, která snižuje cyklické výkyvy VWF [16].
EPIDEMIOLOGIE
VWCH je nejčastější dědičná krvácivá choroba, s prevalencí snížené hladiny VWF v populaci přibližně 1%. Definitivní diagnóza onemocnění je však podmíněna i přítomností krvácivých projevů a pozitivní rodinnou anamnézou. Těžká forma onemocnění se vyskytuje s četností 1–3/milion populace, odhad celkové prevalence VWCH v populaci je až 1/1000 [11].
KLASIFIKACE VWCH [1]
- Typ 1: Parciální kvantitativní defekt VWF, dědičnost autozomálně dominantní (AD).
- Typ 2: Kvalitativní defekt VWF, dědičnost převážně AD, se dělí na subtypy:
- 2A: Pokles na VWF závislé adheze trombocytů, spojený s chyběním HMW multimerů VWF.
- 2B: Zvýšená afinita VWF k destičkovému GPIb.
- 2M: Pokles na VWF závislé adheze trombocytů, který není způsoben chyběním HMW multimerů VWF.
- 2N: Pokles afinity VWF k FVIII, dědičnost autozomálně recesivní (AR).
- Typ 3: Úplný nedostatek VWF, dědičnost AR.
Původní klasifikace VWCH z 80. let minulého století rozlišovala tři stejné základní typy onemocnění, ale označovala je římskými číslicemi I–III. Typ I byl rozdělen podle fenotypu onemocnění do 11 variant a typ II do 13 variant. Současná klasifikace vznikla s cílem spojit jednotlivé fenotypy choroby s kauzální genetickou abnormalitou a celou klasifikaci zjednodušit.
U typu 1 je však vhodné samostatně diferencovat subtyp 1V (Vicenza), který je způsobený záměnnou mutací Arg1205His s následnou přítomností ultra velkých multimerů VWF s výrazným urychlením clearance a se zvýšením poměru WFpp/VWF:Ag.
U typu 2A je pak na zvážení nadále rozlišovat jeho klasickou variantu, u které se nachází mutace v A2 doméně v exonu 28 a deficit HMW multimerů VWF a multimery mají na elektroforéze strukturu klasického tripletu (vedlejší 1–2 pomalejší a 1–2 rychlejší proužky kolem každého multimeru), od jeho několika dalších variant [1, 12, 17] – obr. 1:
- 2A/ IIC, s mutacemi VWFpp v doménách D1 a D2, které mají za následek poruchu na úrovni vzniku multimerů VWF, také chybí HMW multimery a jednotlivé multimery nemají charakter tripletů (chybí vedlejší proužky), dědičnost je v tomto případě pro typ 2A výjimečně AR.
- 2A/IID, s mutacemi v CK doméně VWF, které mají za následek poruchu vzniku dimerů VWF, na elektroforéze je absence HMW multimerů a jednotlivé multimery také nemají tripletní struktury a jsou navíc přítomny proužky jednotlivých monomerů VWF, dědičnost je AD.
- 2A/IIE, s mutacemi v doméně D3, s následnou poruchou vzniku multimerů, sekrece VWF i jeho urychlenou clearance, snížení HMW multimerů je pouze relativní, v tripletní struktuře multimerů je zvýrazněn vnitřní proužek a chybí zevní proužek, dědičnost je AD.
Obr. 1. I STH klasifikace typu 2A VWCH a jeho subtypy Znázorněna je struktura multimerů VWF a lokalizace mutací v jednotlivých doménách VWF, upraveno podle [17] s laskavým svolením autora. ![I STH klasifikace typu 2A VWCH a jeho subtypy
Znázorněna je struktura multimerů VWF a lokalizace mutací v jednotlivých doménách VWF, upraveno podle [17] s laskavým svolením autora.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/026c3c964a5babe7a2dcbfad583bb4a1.jpg)
Získaný von Willebrandův syndrom
Sekundárně dochází k deficitu VWF různými mechanismy [18]:
- Protilátky proti VWF (nejčastější příčina) – objevují se především u lymfoproliferativních onemocnění či monoklonálních gamapatií.
- Imunoadsorpcí komplexu FVIII/VWF na maligní buňky či trombocyty u myeloproliferací.
- Zvýšenou proteolýzou komplexu FVIII/VWF v cirkulaci. Popsáno u paraproteinemie IgM lambda, amyloidózy, akutní leukemie, cirhózy jater, pankreatitidy, myeloproliferace.
- Sníženou produkcí VWF, např. u hypotyreózy.
- Zvýšenou spotřebou VWF v cirkulaci. Za vysokých smykových rychlostí v aterosklerotických arteriolách a při stenóze aorty dochází k ireverzibilní interakci mezi HMW multimery VWF a trombocyty a k odstranění komplexů VWF/trombocyty z cirkulace, a tím ztrátě HMW multimerů VWF.
- Nejasný mechanismus snížení VWF je po léčbě valproátem.
Destičkový typ von Willebrandovy choroby
Ve starší literatuře také označovaný jako a pseudo-VWCH má obdobný fenotyp jako typ 2B VWCH. V tomto případě se však nejedná o defekt VWF, ale o defekt destičkového receptoru, GPIb (příčinou je mutace v jeho genu), který má zvýšenou afinitu pro VWF. Následkem odstranění komplexu VWF-trombocyt chybí, obdobně jako u typu 2B VWCH, HMW multimery VWF v plazmě a může být přítomna trombocytopenie. Dědičnost je AD [19].
DIAGNOSTIKA
Pro definitivní diagnózu VWCH musí být splněny tři následující faktory:
- Kvantitativní či kvalitativní defekt VWF.
- Krvácivé projevy.
- Dědičnost – VWCH v rodinné anamnéze.
Při chybění jednoho z faktorů podle bodu 2 či 3 lze diagnózu VWCH považovat za pravděpodobnou/možnou, ne však za jistou [11, 19, 20].
Ad 1) Za patologii se považuje plazmatická hladina antigenu VWF (VWF:Ag) a jeho funkční aktivity ristocetin kofaktoru (VWF:RCo) pod dvě směrodatné odchylky od průměru populace [20]. Prakticky je však pro jednotlivá pracoviště nemožné stanovit si svoje vlastní normální hodnoty. Orientačně je pro VWF:Ag, VWF:RCo i pro FVIII:C za dolní mez normálu považována hladina 50 %. Pro VWF (Ag i RCo) u KS 0 je hranice nižší, podle evropské studie MCMMDM-1 VWD je cut-off pro KS 0 pro percentil 2,5 VWF:RCo 43 % a VWF:Ag 44 % a pro KS non-0 je cut-off pro VWF:RCo i VWF:Ag 54 % [21]. V guidelines USA je doporučení za VWCH považovat pouze pacienty se snížením VWF:Ag/VWF:RCo pod 30 % [22]. Některé instituce používají jako cut-off hladinu VWF 40 % [23]. Jaká je hranice mezi ještě normální a již sníženou hladinou VWF je nejasné. Vyšetření hladiny VWF by mělo být provedeno minimálně ze dvou různých odběrů.
Protože však většina terapeutických guidelines (včetně USA) doporučuje udržovat hladinu VWF:RCo při krvácení či perioperačně nad 50 %, bude vhodné jako mezní hodnoty pro sníženou hladinu VWF:Ag/VWF:RCo používat spíše ty získané v rámci studie MCMDM-1 VWD. Laboratorní kritéria pro diagnózu typu 1 VWCH srovnává práce Quiroga [23]. Retrospektivně hodnotí 4 298 pacientů vyšetřovaných pro slizniční či kožní krvácivé projevy s použitím čtyř různých kritérií pro diagnózu VWCH:
- a) VWF:Ag a VWF:RCo < 30 % a při hladinách 30–50 % je stav označován jako „possible VWD/low VWF“ podle National Heart, Lung and Blood Instituce (NHLBI) v USA;
- b) ≤ 2,5 percentil v minimálně dvou případech ze tří parametrů: VWF:Ag (≤ 42 %), VWF:RCo (≤ 37 %) a VWF vazba kolagenu (VWF:CB) (≤ 39 %), což bylo kritérium zvolené autory;
- c) VWF:RCo nebo VWF:CB ≤ 40 % podle European Group on von Willebrnad Disease (EUVWD);
- d) ≤ 40 % VWF:Ag nebo VWF:RCo podle Zimmerman Program for the Molecular and Clinical Biology of VWD (ZPMCBVWD).
Podle daných kritérií se pak nachází VWCH u následujícího procenta z vyšetřovaných pacientů: 2,8 % (+ 16,4 % s hladinami 30–50 %), 6,5 %, 7,9 % a 8,3 %, resp. zvýšením cut-off ze 30 % na 40 % se téměř ztrojnásobil počet diagnostikovaných případů a dalším navýšením cut-off na dosud konvenčních 50 % se dále více než zdvojnásobil.
Ad 2) podle Mezinárodní společnosti pro trombózu a hemostázu (ISTH) jsou požadovány minimálně 2 krvácivé symptomy bez ohledu na jejich intenzitu nebo jeden symptom vyžadující transfuzní terapii a/nebo opakující se minimálně 3krát za různých okolností [20]. Je snaha jednotlivé krvácivé příznaky kvantifikovat pomocí skórovacích systémů, což je stále ve vývoji a dosud je nejčastěji používáno krvácivé skóre vyvinuté v rámci evropské studie MCMDM-1 VWD [24] – tabulka 2. Za patologické bylo navrženo považovat skóre u mužů více než 3 a u žen více než 5 bodů [25]. Problémem je, že i v běžné populaci je incidence méně závažných krvácivých projevů poměrně častá, u žen například 5,3–7,7 na 100 osob/rok a pro obě pohlaví platí, že ve 30 letech života má ⅓ populace zkušenost s jedním menším krvácivým symptomem a 6 % dokonce se dvěma. Minimálně jeden krvácivý symptom se objeví u 40 až 50 % mužů a 50–60 % žen. Závažné krvácivé projevy jsou pak v populaci o dva řády méně časté – 0,05 u mužů a 0,06 u žen na 100 osob/rok [26].
Tab. 2. Krvácivé skóre použité v evropské studii MCMDM-1VWD [24] ![Krvácivé skóre použité v evropské studii MCMDM-1VWD [24]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/be01848ae9e476aae4775c748bd9564e.jpg)
Ad 3) Požadována je prokázaná VWCH alespoň u jednoho příbuzného v první řadě nebo dvou v řadě druhé, případně prokázaná kauzální mutace [20]. Problémem je, že kauzální mutace u typu 1 VWCH je většinou prokázána při hladině VWF pod 20–30 %, ale jen asi v polovině případů s vyšší hladinou VWF [27]. Předpokládá se, že defekt VWF je způsoben jinými mechanismy – poruchou nitrobuněčného transportu, sekrece, posttranslačními změnami, zvýšenou proteolýzou.
V praxi je diagnóza VWCH založena na klinickém obraze, tedy krvácivých projevech v anamnéze osobní i rodinné, a na laboratorním průkazu defektu VWF.
Typ 1 se nachází asi u 60–80 % pacientů s VWCH, typ 2 u 7–30 % a typ 3 u 5–20 % z nich [7]. Rozložení VWCH na jednotlivé typy onemocnění závisí především na tom, kteří jednici jsou řazeni k typu 1, resp. jaké je zvoleno cut-off pro normální hladinu VWF, případně na tom, zda v dané populaci jsou jedinci s mírnějšími projevy choroby vůbec diagnostikováni.
Klinický obraz
Klinicky se VWCH projevuje především krvácením ze sliznic (epistaxe, menoragie, krvácení z dásní, méně často krvácení do trávicího traktu), časté jsou i kožní hematomy. Druhým typickým krvácivým projevem je časné krvácení při poraněních a perioperačně. U těžkých forem se objevuje i hemofilický typ krvácení – svalové a kloubní. V literatuře udávaný výskyt jednotlivých krvácivých projevů uvádí tabulka 3 [22].
Tab. 3. Incidence (v procentech) krvácivých projevů ve zdravé populaci a u pacientů s von Willebrandovou chorobou* 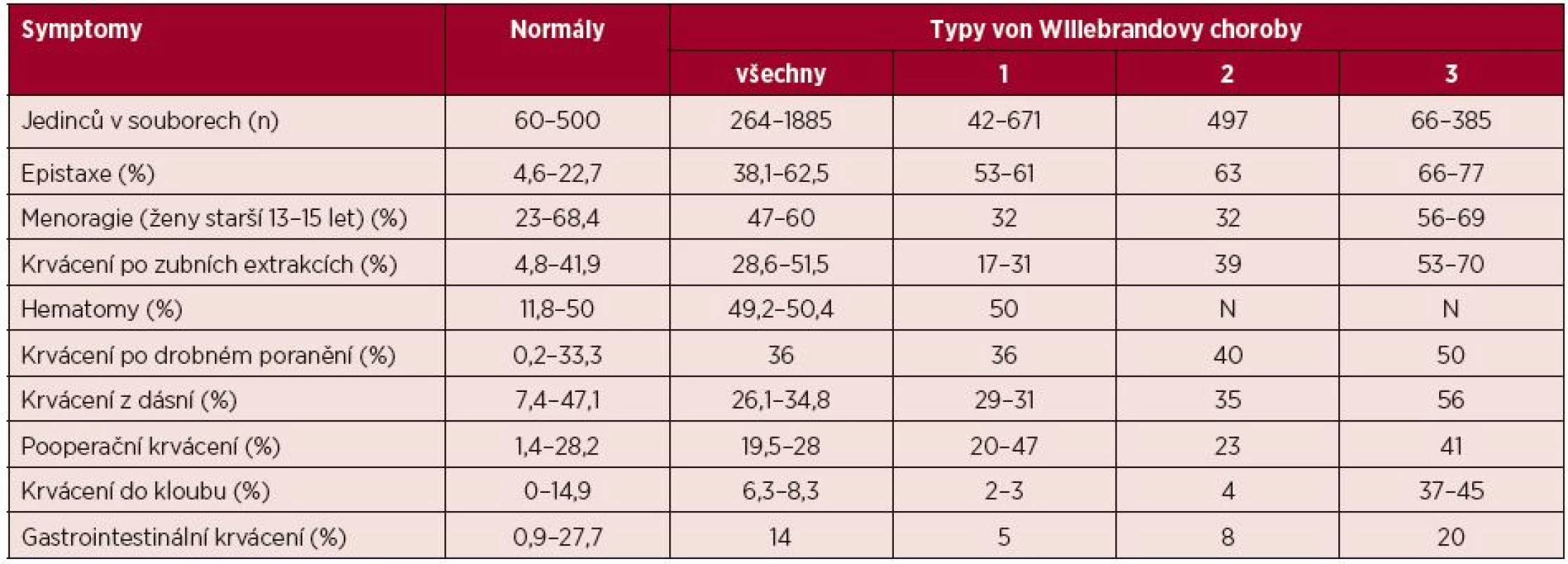
N = neuvedeno *Sumarizační tabulka z jedenácti literárních zdrojů publikovaná v doporučeném postupu USA pro diagnostiku a léčbu VWCH [22]. Laboratorní diagnostika
a) Screeningové testy: Patří sem počet trombocytů (snížení u typu 2B), aPTT (aktivovaný parciální tromboplastinový čas), který je prodloužený při sekundárním defektu FVIII. Doba krvácení bývá prodloužená především u typu 2A, B, M a 3. Nověji je doba krvácení nahrazována vyšetřením pomocí PFA-100 – analyzátor funkce destiček („Platelet Function Analyzer“) při senzitivitě prakticky 100% pro typ 2 A, B, M a 3, menší pak pro typ 1 VWCH [14]. Výjimkou je typ 2N, u kterého jsou obě vyšetření v normě.
b) Specifické testy: Zahrnují stanovení plazmatické hladiny VWF a FVIII. Koagulační aktivita FVIII (FVIII:C) se provádí v praxi jednofázovou metodou, stanovení jeho antigenu není nutné. Odráží sekundární snížení plazmatické hladiny FVIII. VWF:Ag lze stanovit několika metodami. Dříve rozšířená EID (electro-immuno diffusion) se již prakticky nepoužívá a byla nahrazena metodou ELISA (enzyme linked immuno-sorbant assay), která je nejpřesnější metodou nebo jednodušším a rychlejším LIA (latex immuno assay) stanovením VWF:Ag. Pro stanovení funkční aktivity VWF slouží aktivita ristocetin kofaktoru (VWF:RCo). Posuzuje se agregace nebo aglutinace stabilizovaných „normálních“ trombocytů po přidání vyšetřované plazmy za přítomnosti ristocetinu, který navázáním na destičkový GPIb iniciuje vazbu vyšetřovaného VWF na GPIb. Nověji bylo stanovení VWF:RCo automatizováno: rekombinantní fragment GPIb je fixován pomocí monoklonální protilátky a na fragment GPIb následně navázaný, vyšetřovaný VWF je stanoven ELISA metodou nebo turbidimetricky při jeho navázání na malé částice, které pak vyšetřovaný VWF aglutinuje (např. Innovance®). Pokud je fragment GPIb navázán na magnetické částice, lze je po navázání vyšetřovaného VWF separovat a tento pak stanovit chemiluminiscenčně (např. HemosIl AcuStar®). Při použití fyziologického fragmentu GPIb je k vyšetření, stejně jak při původní metodě VWF:RCo, nutno k indukci vazby GPIb na VWF přidat ristocetin, nebo při použití fragmentu GPIb se dvěma tzv. gain of function mutacemi probíhá vyšetření bez nutnosti přidávat ristocetin a označujeme ho pak za aktivitu VWF (VWF:Ac). Tyto nové, lépe standardizované metody vyšetření funkční aktivity VWF velmi dobře korelují s původní klasickou metodou stanovení VWF:RCo [28]. Výsledky VWF:Ac využívající fragment GPIb navázaný na jednotlivé malé částice mohou být falešně vyšší při přítomnosti revmatoidního faktoru [29] či přítomnosti zvířecích protilátek, které se mohou vázat na protilátku zvířecího původu fixující fragment GPIb. Tyto protilátky mohou být přítomny až u 40 % populace, ale zřejmě jen ojediněle jsou klinicky významné [30]. Ideální tak je provádět screening onemocnění vyšetřením funkční aktivity VWF vícero metodami. Za diskriminační mez mezi kvantitativním a kvalitativním defektem VWF je považován poměr VWF:RCo/VWF:Ag < 0,7 [14, 19, 22]. Druhou metodou k posouzení funkční aktivity je VWF:CB – vazebná kapacita pro kolagen (collagen binding) na principu ELISA metody. Toto vyšetření je však méně rozšířené než VWF:RCo. Metoda není plně standardizovaná vzhledem k tomu, že i komerčně dostupné diagnostické soupravy používají různé typy a zdroje kolagenu – typ I či III, a to lidský či koňský. Je třeba si i uvědomit, že VWF:RCo a VWF:CB nejsou vyšetření vzájemně zaměnitelná, a že každé z nich hodnotí jinou funkci VWF. U typu 2A a 2B, kde chybí HMW multimery, je VWF:CB snížena většinou výrazněji než VWF:RCo, zatímco u typu 2M, kde jsou HMW multimery přítomny, je naopak větší pokles VWF:RCo než VWF:CB, resp. poměr VWF:CB/VWF:Ag je > 0,7 a VWF:RCo/VWF:Ag je < 0,7 [14, 19, 22]. Nové vydání britských guidelines z roku 2014 doporučuje pro kvalitativní defekt VWF cut-off tohoto poměru 0,6 [31].
c) Diskriminační testy rozlišují jednotlivé typy VWCH – ristocetinem indukovaná agregace trombocytů (ristocetin-induced platelet aggregation – RIPA) je snížená jen u těžších defektů VWF. Diagnostický význam má především při určení typu 2B VWCH, kdy vlivem zvýšené afinity VWF k destičkovému GPIb dochází k agregaci při nízké koncentraci ristocetinu ≤ 0,5 mg/ml – 0,7 mg/ml [19], zatímco plazma bohatá na destičky zdravých jedinců ani pacientů s jiným typem VWCH při koncentraci ristocetinu < 1,0 mg/ml neagreguje [32]. Při standardní koncentraci ristocetinu používané k agregačnímu vyšetření k průkazu hypoagregace (1,0 mg/ml – 1,5 mg/ml) dochází k hypoagregaci u těžšího deficitu VWF (typ 3 a těžší formy typů 2 A, B, M i 1) s hladinou VWF < 15 % [32]. U lehčích forem VWCH pak může být RIPA i bez hypoagregace. U části pacientů s typem 2B VWCH se hyperagregace projevuje při relativně vysoké koncentraci ristocetinu 0,6–0,7 mg/ml [33], tedy na rozdíl od starších doporučení se jeví jako racionální používat ke screeningu typu 2B koncentraci ristocetinu kolem 0,7 mg/ml.
Deficit HMW multimerů VWF i jejich porušenou strukturu (typ 2A, B, M) lze definitivně prokázat či vyvrátit pouze elektroforézou na SDS-agarózovém--polyakrylamidovém gelu. Toto vyšetření je však velmi pracné a vyžaduje značnou zkušenost při jeho vyhodnocení a v ČR je prováděno pouze v Ústavu hematologie a krevní transfuze (ÚHKT) v Praze.
Stanovení vazebné kapacity VWF pro FVIII (VWF:FVIIIB) je nezbytné k diagnostice typu 2N VWCH a provádí se metodou ELISA – taktéž doposud dostupné pouze na ÚHKT.
Propeptid VWF (VWFpp), dříve také nazývaný jako VWF:AgII, se do oběhu uvolňuje společně s VWF a podle poměru VWFpp/VWF:Ag můžeme odhadnout, zda dochází k poruše syntézy/sekrece VWF či se na jeho deficitu podílí zvýšená eliminace [14]. Stanovuje se metodou ELISA.
Molekulárně-genetické vyšetření se běžně neprovádí. Spektrum mutací u typu 1 a 3 VWCH je značně heterogenní. Jednodušší situace je u typu 2A, B, kdy většina mutací jsou záměnné mutace v exonu 28. genu pro VWF, u typu 2M a 2N jsou tyto mutace ve vícero exonech a prakticky v délce celého genu pak u typu 1 a 3. Praktický význam molekulárně-biologické diagnostiky je především v prenatální diagnostice u typu 3, v diferenciální diagnostice typu 2B a destičkového typu VWCH, resp. typu 2N VWCH a lehké hemofilie A.
Rozlišení na jednotlivé typy v praxi (tab. 4) [11, 22, 31, 32, 34]:
- u typu 1 VWCH je proporcionální snížení VWF:Ag, VWF:RCo, případně i FVIII:C;
- u typu 2 VWCH je snížen především VWF:RCo většinou na 5–30 % jen při lehce patologických či normálních hodnotách VWF:Ag a FVIII:C;
- při nedostupnosti přímého vyšetření deficitu HMW multimerů VWF a jejich struktury lze k odlišení typu 1 a 2 VWCH použít poměru VWF:RCo/VWF:Ag – je-li pod 0,6–0,7, jedná se pravděpodobně o typy 2A, B, M;
- při možnosti vyšetřit VWF:CB lze pomocí poměru VWF:Ag/VWF:CB odlišit typy 2A, B (< 0,6–0,7), nekonstantně je snížen i u typu 2M;
- RIPA je vhodným orientačním vyšetřením, pokud je nutné urychleně vyloučit závažnější formu VWCH (např. před akutní operací), protože normální RIPA při základní koncentraci ristocetinu vyloučí těžší defekt VWF;
- obdobně lze v této situaci využít i PFA-100;
- typ 2B VWCH lze odlišit pomocí RIPA při výsledné koncentraci ristocetinu ideálně 0,6–0,8 mg/ml, kdy dochází k agregační odpovědi, zatímco u ostatních typů i u normálu k agregaci nedochází;
- typ 2N VWCH se klinicky projevuje jako lehká či středně těžká, autozomálně recesivně dědičná hemofilie A, poměr FVIII:C/VWF:Ag je < 0,6, odlišit lze vyšetřením VWF:FVIIIB, případně i molekulárně-genetickým vyšetřením;
- typ 3 VWCH je charakterizován snížením VWF pod 5 %a FVIII pod 10 %.
Tab. 4. Nálezy specifických a diskriminačních testů u jednotlivých typů VWCH 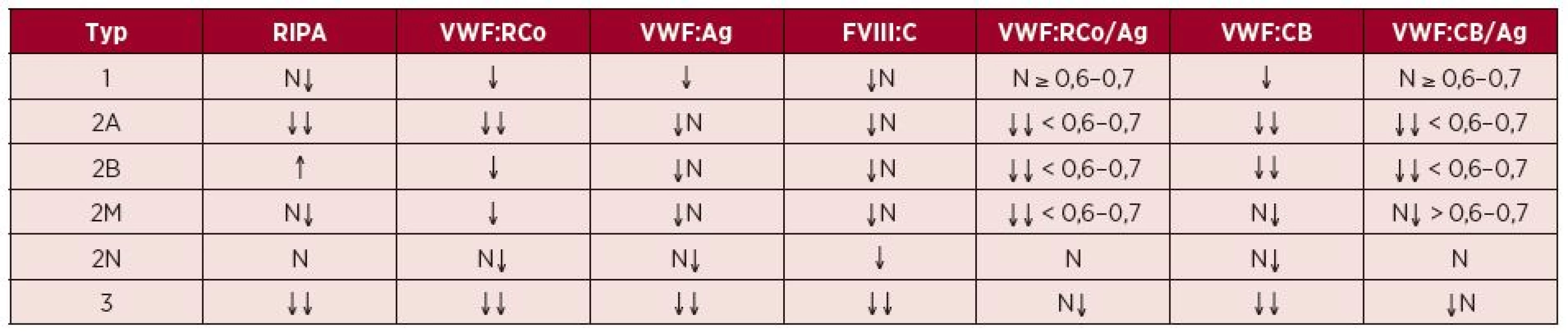
(Upraveno podle [11, 22, 31, 32, 34].) FVIII:C = aktivita koagulačního faktoru VIII, N = v normě, RIPA = agregace trombocytů indukovaná ristocetinem (ristocetin-induced platelet aggregation), VWF:Ag = antigen von Willebrandova faktoru, VWF:CB = vazebná kapacita von Willebrandova faktoru pro kolagen (collagen binding capacity), VWF:RCo = ristocetinový kofaktor von Willebrandova faktoru Cave: Standardně používané vyšetření funkční aktivity VWF:RCo ani jiné běžně dostupné vyšetření funkční aktivity VWF (VWF:Ac, VWB:CB) nemusí dát jednoznačnou odpověď, zda daný jedinec má, či nemá VWCH.
Může se jednat např. o izolovanou poruchu vazby VWF na kolagen a snížená může být pouze VWF:CB. Situace je navíc komplikována tím, že komerční soupravy k vyšetření VWF:CB používají kolagen typu I a III, ale byly popsány kauzální mutace spojené s defektem vazby VWF pouze na kolagen typu VI, který v komerčních soupravách k vyšetření VWF:CB není přítomen. Jedná se především o polymorfismus R1399H zastoupený v populaci USA 2 % a odhad incidence homozygotů je 1/10 000 populace, dále mutace S1387I, Q1402P a delece 11 AMK 1392–1402, které mají poruchu vazby VWF pouze na kolagen typu VI [35]. Pacienti s polymorfismem R1399H s již diagnostikovanou VWCH měli pozitivní krvácivé skóre, zatímco zdraví probandi, také s polymorfismem R1399H, byli bez krvácivých projevů. V případě ostatních zmíněných mutací měla pozitivní krvácivé skóre jen část jejich nositelů. Jaký je skutečný význam diagnostiky vazby VWF na kolagen VI bude určeno až v budoucnosti na základě podrobnějšího zkoumání.
Opačný problém přináší polymorfismus D1472H rozšířený především mezi Afroameričany, u kterých se nalézá v cca 63 % ve srovnání s cca 17 % u kavkazské populace. Nositelé tohoto polymorfismu mohou mít hraničně snížený VWF:RCo a homozygoti pak mají snížený poměr VWF:RCo/VWF:Ag < 0,7 (36), nemají však krvácivé projevy a pacienti s diagnózou VWCH a přítomnosti tohoto polymorfismu nemají zvýšené krvácivé skóre [37]. Výsledky vyšetření VWF:Ac Innovance® jsou u tohoto polymorfismu mírně vyšší (průměrně 79 % ± 4 %), ale statisticky významně se od VWF:RCo neliší (průměrně 76 % ± 20 %) [38].
DIFERENCIÁLNÍ DIAGNOSTIKA
1. Deficit koagulačních faktorů VIII, IX, XI, XII – při prodloužení aPTT a nejednoznačných výsledcích koagulačních odběrů specifických pro VWCH.
2. Destičkový typ VWCH – je také zvýšená agrega-ce po ristocetinu (agregace i při koncentraci 0,3 až 0,8 mg/ml), navíc agregace je vyvolaná i přidáním VWF ve formě koncentrátu či kryoprecipitátu k vyšetřované plazmě bohaté na trombocyty i bez indukce ristocetinem. Nejspolehlivější odlišení je molekulárně-genetickým vyšetřením, tedy průkaz kauzální mutace v exonu 28. genu VWF nebo průkaz jedné ze čtyř kauzálních mutací destičkového typu VWCH v genu GP1BA pro GPIbα (Gly233Val, Met239Val, Gly233Ser nebo delece 27 párů bází) [39]. Poměr incidence typu 2BVWCH a destičkového typu VWCH je asi 10 : 1 [36].
3. Získaný von Willebrandův syndrom (ZVWS), na který je třeba myslet při negativní rodinné anamnéze a/nebo diagnostice až ve vyšším věku a/nebo stavů spojených s tímto syndromem jako autoimunitní onemocnění, lymfoproliferace, myeloproliferace, solidní nádory, hypotyreóza, aortální stenóza, léčba valproátem. Problémem je, že případný inhibitor VWF Bethesda metodou většinou nelze prokázat, protože tento nezpůsobuje funkční defekt, ale urychlení clearance komplexu VWF-protilátka. U lymfoproliferací byl ZVWS popsán v 7 %, u chronických myeloproliferativních chorob v 11 % [40]. V různých registrech ZVWS je podíl lymfoproliferativních onemocnění na etiologii ZVWS uváděn v 18–48 %, myeloprolife-rací v 15–38 % a kardiovaskulárních chorob ve 12–37 % [18].
4. Trombocytopatie – u syndromu Bernard-Soulier nedochází, na rozdíl od VWCH, ke korekci snížené RIPA po přidání normální plazmy.
5. Vaskulopatie.
LÉČBA
Cílem terapie VWCH je zástava či profylaxe krvácení se snahou o korekci poruchy primární hemostázy a koagulace způsobené defektem VWF – normalizace adhezivní funkce trombocytů zvýšením plazmatické hladiny VWF a normalizace koagulační aktivity FVIII na podkladě zvýšení hladiny VWF jako nosiče FVIII, v praxi ale i přímou substitucí FVIII. Plazmatickou hladinu VWF lze zvýšit uvolněním endogenního VWF nebo substitucí podáním exogenního VWF.
1. Uvolnění endogenního VWF
DDAVP (1-deamino-8-D-arginin vazopresin) je syntetický analog antidiuretického hormonu, který uvolňuje VWF z endoteliálních buněk. Terapeutická dávka je 0,3 µg/kg i. v. s maximálním vzestupem VWF i FVIII za 30–60 minut od ukončení aplikace, stejnou dávku lze podat i s. c. s maximem vzestupu za 60–120 min. Výhodné je intranazální použití v dávce 150 µg do každé nosní dírky (při hmotnosti pod 50 kg poloviční dávku), s maximem vzestupu za 60–90 min. [41]. Po všech způsobech aplikace DDAVP dochází ke vzestupu výchozí hladiny VWF i FVIII průměrně 3krát, uvádí se však velké rozpětí (1,3–53,7) [42]. Plazmatický t1/2 obou faktorů je po aplikaci DDAVP přibližně 8–10 hod. u zdravých jedinců [22], avšak u pacientů s VWCH je značně heterogenní. Terapeutický efekt DDAVP je závislý na typu VWCH. Většinou je uspokojivý u typu 1, kdy je popisovaná normalizace hladiny VWF a FVIII na dobu 6–8 hod. od aplikace [41]. K selhání dochází při současném defektu VWF v trombocytech [43]. Menší účinnost je u typu 2A a 2M, kdy se vyplavuje defektní VWF a může být zrychlení clearance uvolněného VWF. U typu 2N dochází sice k dostatečnému vzestupu VWF i FVIII, ovšem FVIII má kratší t1/2 = 2,4–4,4 hod. [44]. U typu 2B dochází po DDAVP k prohloubení trombocytopenie a užití DDAVP je standardně považováno za kontraindikované. Rozvoj trombocytopenie u typu 2B lze částečně predikovat podle kauzální mutace [33] a např. guidelines USA [22] podání DDAVP u typu 2B nekontraindikují, je však třeba počet trombocytů monitorovat. Téměř bez efektu je DDAVP u typu 3 VWCH. Před terapeutickým užitím DDAVP u jakéhokoli typu VWCH je nutné provést terapeutický pokus se sledováním efektu DDAVP na plazmatickou hladinu FVIII a VWF včetně jeho aktivity. Tento lze vynechat pouze u pacientů s typem 1 VWCH a s hladinou VWF:RCo nad 30 % a s negativním krvácivým skóre (u mužů ≤ 3 a u žen ≤ 5 bodů) [45]. Po opakovaném podání dochází k efektu tachyfylaxe – snížení účinnosti asi o 30 % po druhé dávce, méně pak po další opakované aplikaci. Interval mezi dávkami je doporučován 12–24 hod. s trváním léčby nejdéle 5 dnů. Terapeutické užití DDAVP lze vzhledem k efektu tachyfylaxe opakovat nejdříve za 4–7 dnů. Kromě velkých operačních výkonů a život ohrožujícího krvácení lze tímto způsobem zaléčit většinu pacientů s VWCH typu 1 a část pacientů s typem 2 [46]. Během terapie je třeba snížit příjem tekutin na polovinu a kontraindikován je u malých děti, kardiaků, epilepsie, selhání ledvin. Bohužel však, i když se jedná o československý patent, není v současné době v ČR ani v SR DDAVP registrován ve formě vhodné pro parenterální či intranazální aplikaci v dostatečné koncentraci.
Hladinu endogenního VWF a FVIII zvyšuje interleukin 11. Rekombinantní IL11 byl zatím s úspěchem použit ve studii fáze II [47].
2. Substituční léčba
Tato je indikována v ostatních případech, kdy aplikací DDAVP není možno dosáhnout efektivní hemostázy. V minulosti byl podáván kryoprecipitát, který se pro riziko přenosu infekce v současnosti již nepoužívá (1 transfuzní jednotka obsahuje přibližně 80–100 j VWF i FVIII). V současnosti jsou k dispozici vysoce čištěné plazmatické koncentráty FVIII, které obsahují i VWF, a vysoce čištěný koncentrát VWF. Z dostupných koncentrátů FVIII na našem trhu má nejvyšší poměr VWF:RCo/FVIII:C = 2,4 preparát Haemate P®, většina ostatních koncentrátů FVIII obsahujících i VWF má tento poměr kolem 1,0. Z těchto je v současné době k léčbě VWCH registrován v ČR preparát Fanhdi® a Wilate®. Registrován je již i preparát s vysokým obsahem VWF Willfact® s poměrem VWF:RCo/FVIII:C ³ 10, po jehož aplikaci však dochází k opožděnému vzestupu plazmatické hladiny FVIII – rychlostí cca 6 %/hod. [48]. Rekombinantní koncentrát VWF již také existuje, ale dosud není komerčně k dispozici. Vzestup FVIII je po substituci obdobný jako u hemofilie A, zhruba o 2 % po aplikaci 1 j FVIII/kg, ale s delším t1/2 (12–24 hod.) [49]. Výjimkou je preparát Wilate®, u kterého t1/2 FVIII není prodloužený a více kopíruje t1/2 VWF:RCo [50]. Po aplikaci 1 j VWF:RCo/kg podle SPC (Summary of Product Characteristics) jednotlivých preparátů se plazmatická hladina VWF:RCo zvýší zhruba o 2 %, s t1/2 přibližně 7–18 hod., který je ale velmi heterogenní podle použitého preparátu a typu VWCH. Cílové plazmatické hladiny VWF:RCo a FVIII:C pro invazivní výkony a léčbu krvácení podle aktuálních doporučení jsou uvedeny v tabulce 5 [22, 34, 46, 51, 52].
Tab. 5. Doporučené plazmatické hladiny VWF:RCo a FVIII:C v léčbě von Willebrandovy choroby 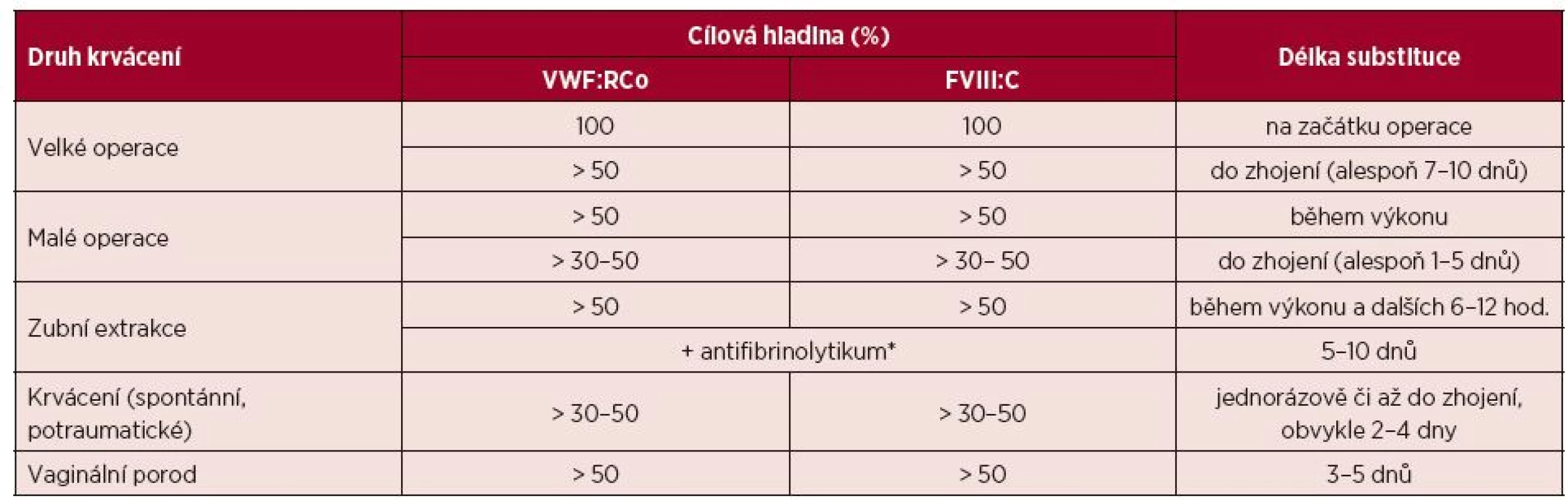
(Upraveno podle [22, 34, 46, 51, 52]) FVIII:C = aktivita koagulačního faktoru VIII, VWF:RCo = ristocetinový kofaktor von Willebrandova faktoru *Ve vyšším dávkování než je standardní, např. tranexamová kyselina p. o. až 25 mg/kg 3krát denně. Kromě typu 3 VWCH, kdy jsou časté i spontánní krvácivé projevy, jsou u většiny pacientů důvodem substituce především invazivní výkony. Korekce VWF funkční aktivity a doby krvácení (PFA-100) je nutná především u slizničního typu krvácení, zatímco u chirurgických výkonů je rozhodující korekce FVIII:C [52]. Monitorování plazmatické hladiny FVIII:C i VWF:RCo je v den chirurgického výkonu vhodná i vícekrát, později stačí jednou denně. Sledování terapeutické odpovědi pomocí VWF:CB je dosud méně rozšířené pro nestandardnost jednotlivých setů používaných k diagnostice. Pro navýšení rizika trombózy by hladina FVIII po substituci neměla přesáhnout ideálně 150 %. Vlivem rozdílného t1/2 VWF:RCo a FVIII se tomu většinou perioperačně nevyhneme a reálnější je pak snažit se při substituci udržet FVIII pod 200–250 % [22].
Z preparátů dostupných v ČR jsou největší zkušenosti s léčbou krvácení a v chirurgii s Haemate P® a Willate®. Účinnost v léčbě krvácení i při zabezpečení operací je uváděna prakticky identická: excelentní či dobrá pro Haemate P® v 95–97 % [53, 54, 55] a pro Willate® v 94 až 98 % [56, 57, 58]. V detailně propracovaných guidelines USA se uvádí excelentní nebo dobrá účinnost v léčbě velkých krvácivých epizod a perioperačně v 92–100 % bez udání použitého koncentrátu VWF/FVIII. Ovšem jednotlivé publikované studie nejsou sourodé. Liší se jednak spektrem zastoupení jednotlivých typů VWCH a jednak spektrem chirurgických výkonů a v neposlední řadě i posuzování, co je považováno za účinnost excelentní či dobrou, také nemá jednotná kritéria. Teoreticky by šlo srovnání mezi jednotlivými preparáty realizovat pouze v léčbě typu 3 a těžkého typu 1 VWCH [59]. U lehčích forem typu 1 VWCH je samozřejmě nižší riziko krvácení se zvyšující se výchozí hladinou VWF a u kvalitativních defektů je klinický fenotyp a odezva na substituční léčbu (především t1/2) velmi variabilní.
Při použití čištěného koncentrátu VWF (Wilfactin®/Willfact®) je nutno při nízké hladině FVIII podat na úvod současně i bolus koncentrátu FVIII. Excelentní a dobrá účinnost je popsána v 89 % krvácivých epizod (FVIII byl podáván při jeho výchozí hladině pod 20 %) a ve 100 % operačních výkonů ve studii, která zahrnovala jen pacienty s VWF:RCo < 10 % [60].
I při fyziologickém počtu trombocytů při nedostatečném hemostatickém efektu substituce koncentrátem FVIII/VWF i přes dosažení doporučené hladiny FVIII:C a VWF:RCo (zejména, nedochází-li ke korekci doby krvácení a při slizničním typu krvácení) lze podat trombocytový transfuzní přípravek. Podaný VWF obsažený v trombocytech se uplatní v místě porušené primární hemostázy [34]. Tento je samozřejmě indikován i v léčbě destičkového typu VWCH.
3. Nespecifická, pomocná terapie
Antifibrinolytika jsou doporučovaná v léčbě slizničního krvácení, jako jsou epistaxe, menoragie, krvácení v dutině ústní a ve stomatochirurgii, kdy je lze užít i formou výplachu dutiny ústní [22, 34, 46, 51, 52]. V Evropě je nejvíce používaná tranexamová kyselina (Exacyl®) v dávce p.o. až 25 mg/kg á 8 hod. Z dob dřívějších je v ČR oblíbená, tehdy z východního Německa dostupnější, para-aminomethylbenzoová kyselina (Pamba®) v dávce p. o. 4 x 1 tbl. V léčbě menstruačního krvácení lze užít kontraceptiva s obsahem estrogenů, které jednak zvyšují hladinu VWF/FVIII, jednak působí i přímo na děložní sliznici [52].
Při invazivních výkonech, především při zubních extrakcích, je ke zvážení použití fibrinového lepidla.
Etamsylát lze podat ke zmírnění kapilárního krvácení, i když podle guidelines doporučován běžně k léčbě VWCH není.
Nejčastější specifické klinické situace
Profylaxe
Obdobně jako u hemofilie, lze i u VWCH koncentráty podávat i profylakticky. Jedná se většinou o sekundární či krátkodobou profylaxi z důvodu recidivujícího krvácení – nejčastěji pro krvácení do trávicího traktu, gynekologické, kloubní a epistaxe. Dávkování se pohybuje v rozpětí cca 25–100 j (obvykle 40–60 j) VWF:RCo/kg 2–3krát týdně při použití plazmatických koncentrátů FVIII s poměrem VWF:RCo/FVIII:C ≥ 1 i koncentrátu s nízkým obsahem FVIII (Wilfactin®, který je v ČR registrován pod názvem Willfact®) [61]. Profylaxe má většinou výborný efekt na prevenci kloubního krvácení, kdy je popisována více než 90% redukce frekvence hemartros, naopak nejméně účinná je v prevenci gastrointestinálního krvácení, kdy nemusí být dosaženo ani poloviční redukce [62].
Léčba menstruačního krvácení a v těhotenství
Silné menstruační krvácení lze zmírnit již výše zmíněnou kombinovanou hormonální kontracepcí a/nebo antifibrinolytikem. Místo kombinované perorální kontracepce lze použít intrauterinní tělísko s řízeným uvolňováním levonorgestrelu nebo cyklicky podávaný progesteron [63, 64]. Pokud selže tato nekauzální terapie, lze použít DDAVP a pokud jeho aplikací nedosáhneme požadovaného efektu, je nutná v době menstruace přechodná profylaktická substituce VWF/FVIII koncentrátem.
V graviditě od druhé poloviny prvního trimestru dochází fyziologicky ke vzestupu plazmatické hladiny VWF i FVIII a krvácivé komplikace v graviditě se objevují většinou jen u těžších defektů VWF. Hladinu VWF:RCo a FVIII:C je doporučeno kontrolovat 28. a 34. týden gravidity [65]. U typu 2B může dojít v graviditě k poklesu počtu trombocytů. Pro porod je většinou doporučovaná minimální hladina 50 % VWF:RCo a 50 % FVIII:C na 3–5 dnů, u pacientek s typem 3 VWCH až na 7 dnů [22, 46, 65]. K poklesu FVIII a VWF na původní hodnoty dochází během jednoho až tří týdnů [22], někdy však i dříve [66] a kontrola hladiny VWF a FVIII je doporučována 3.až 5. den po porodu [46].
Zubní extrakce
Většina guidelines doporučuje dosáhnout normalizace VWF:RCo a FVIII, tedy hladinu > 50 %, obdobně jako u malé chirurgie [22, 46]. Pouze italské guidelines doporučují jen zvýšení hladiny FVIII > 50 po dobu 12 hodin od extrakce [52], severské země konkrétní cílovou hladinu neuvádějí [51]. Vždy se však doporučuje antifibrinolytikum, nejčastěji tranexamová kyselina formou výplachů nebo p. o. po dobu minimálně 5 dnů, vhodné je spíše nejméně týden, aby s překlenula doba odhojování koagula 5.–7. den po výkonu. Při nekomplikované extrakci stačí jednorázová aplikace DDAVP nebo substituce, u komplikovaných a vícečetných extrakcí je nutná normalizace hladiny VWF i několik dnů. Vždy je současně nutné i pečlivé lokální ošetření, případně aplikace fibrinového lepidla.
Léčba krvácení z angiodysplazií gastrointestinálního traktu
Tato může být u VWCH velmi problematická. Z teoretických poznatků nutno poznamenat, že nedostatek VWF může být příčinou krvácení z angiodysplazií, ve kterých je dosahováno vyšších smykových rychlostí a deficit HMW multimerů VWF za těchto okolností navozuje výraznou poruchu primární hemostázy. Na druhé straně nedostatek VWF ve Weibel-Paladeho tělískách v experimentu spouští angiogenezi, tedy může podporovat tvorbu angiodysplazií [67]. Kromě profylaktické aplikace VWF/FVIII se v léčbě zkouší octreotid, antifibrinolytika, estrogeny, jsou popsány kazuistiky s úspěšnou léčbou antiangiogenně působícím talidomidem [67, 68], vysokými dávkami atorvastatinu (40–80 mg/den) [67, 69], který má na angiogenezi bifazický efekt – nízké dávky ji indukují a vysoké naopak inhibují [70], ojediněle byl popsán i příznivý efekt danazolu [71].
Léčba pacientů s alogenními protilátkami proti VWF
U těžkých forem onemocnění (typ 3) může substituce koncentráty VWF indukovat vznik specifického inhibitoru VWF; jsou popsány i anafylaktické reakce na plazmatické koncentráty VWF. K léčbě jsou proto doporučovány rekombinantní (r) koncentráty FVIII neobsahující VWF, které zvýší hladinu FVIII, i když s kratším t1/2. Použít lze trombocytové transfuzní přípravky, které lokalizují VWF v místě poruchy hemostázy. Jako život zachraňující léčbu lze užít rFVIIa [31, 34, 46, 51, 52]. Na rozdíl od hemofilie A není standardním postupem imunotoleranční léčba; byla dosud publikována jen jedna úspěšná kazuistika [72].
Terapie získaného von Willebrandova syndromu
Především je třeba odstranit vyvolávající příčinu či léčit přidružené základní onemocnění, které je důvodem poklesu VWF. Substituční léčba je obdobná jako u vrozené formy, ale plazmatický poločas VWF i FVIII při substituci koncentrátem i při uvolnění endogenního VWF po podání DDAVP je krátký. Jsou-li příčinou protilátky proti VWF, lze užít preparát rFVIII (pokud jsou protilátky pouze proti VWF, lze alespoň normalizovat hladinu FVIII), současně eliminovat inhibitor imunosupresí kortikoidy (v kombinaci s alkylačními cytostatiky), imunoglobuliny (jsou účinné při IgG paraproteinu, ale ne při IgM), plazmaferézou. Při krvácení či operacích lze jako univerzální hemostatikum při selhání ostatních léčebných metod použít rFVIIa ve standardním dávkování jako u pacientů s hemofilií a inhibitorem FVIII [18].
Prohlášení autora
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce: 7. 11. 2014
Přijato po recenzi: 2. 3. 2015
MUDr. Petr Smejkal, Ph.D.
Oddělení klinické hematologie
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: psmejkal@fnbrno.cz
Zdroje
1. Sadler JE, Budde U, Eikenboom JC, et al. Update on the pathophysio-logy and classification of von Willebrand disease: a report of the Subcommittee on von Willebrand Factor. J Thromb Haemost 2006; 4 : 2103–2114.
2. Von Willebrand EA. Hereditar pseudohemofili. Finska Läkaresällskapets Handlingar 1926; LXVII: 87–112.
3. Blombäck M. Memories of my research into von Willebrand´s disease. Haemophilia 2012; 18 : 3–6.
4. Haberichter SL. Biosyntehsis and organozation of von Willebrand factor. In: Federici AB, Lee CA, Berntorp E, et al. Von Willebrand Disease, Basic and Clinical Aspects. 1. ed. Oxford, Blackwell Publishing 2011; 7–29.
5. Borchiellini A, Fijnvandraat K, Cate JW, et al. Quantitative analysis of von Willebrand factor propeptide release in vivo: effect of experimental endotoxemia and administration of 1-Deamino-8-D-Arginine Vasopressin in humans. Blood 1996; 88 : 2951–2958.
6. Vischer UM, Ingerslev J, Wollheim CB, et al. Acute von Willebrand factor secretion from the endothelium in vivo: assessment through plasma propeptide (vWF:AgII) levels. Thromb Haemost 1997; 77 : 387–393.
7. Sadler JE, Mannucci PM, Berntorp E, et al. Impact, diagnosis and treatment of von Willebrand disease. Thromb Haemost 2000; 84 : 160–174.
8. Van Mourik JA, Boertjes R, Huisveld IA, et al. von Willebrand factor propeptide in vascular disorders: a tool to distinguish between acute and chronic endothelial cell perturbation. Blood 1999; 94 : 179–185.
9. Montgomery RR, Haberichter SL. Von Willebrand factor structure and function. In: Federici AB, Lee CA, Berntorp E et al. Von Willebrand Disease, Basic and Clinical Aspects. 1. ed. Oxford, Blackwell Publishing 2011 : 30–48.
10. Huck V, Schneider MF, Gorzelanny C, Schneider SW. The various states of von Willebrand factor and their function in physiology and pathophysiology. Thromb Haemost 2014; 111 : 598–609.
11. Lillicrap D. The basic science, diagnosis and clinical management of von Willebrand disease. Dostupné na www: http://www.wfh.org/2/docs/Publications/VWD_WomenBleedingDisorders/TOH-35_VWD_%20Revision2008.pdf
12. Lillicrap D. Translational medicine advances in von Willebrand disease. J Thromb Haemost 2013; 11 (Suppl. 1): 75–83.
13. Levy G, Ginsburg D. Getting at the variable expressivity of von Willebrand disease. Thromb Haemost 2001; 86 : 144–148.
14. Budde U, Favaloro EJ. Laboratory diagnosis of von Willebrand dise-ase: the phenotype. In: Federici AB, Lee CA, Berntorp E et al. Von Willebrand Disease, Basic and Clinical Aspects. 1. vyd. Oxford, Blackwell Publishing 2011 : 100–113.
15. Kadir RA, Economides DL, Sabin CA, et al. Variations in coagula-tion factor in women: effects of age, ethnicity, menstrual cycle and combined oral contraceptive. Thromb Haemost 1999; 82 : 1456–1461.
16. Knol HM, Kemperman RFJ, Kluin-Nelemans HC, et al. Haemostatic variables during normal menstrual cycle. Thromb Haemost 2012; 107 : 22–29.
17. Gadisseur A, Hermans C, Berneman Z, Schroyens W, Deckmyn H, Michiels JJ. Laboratory diagnosis and molecular classification of von Willebrand disease. Acta Haematol 2009; 121 : 71–84.
18. Budde U, Federici AB, Rand JH. Pathophysiology, epidemiology, diagnosis, and treatment of acquired von Willebrand syndrome. In: Federici AB, Lee CA, Berntorp E, et al. Von Willebrand Disease, Basic and Clinical Aspects. 1. ed. Oxford, Blackwell Publishing, 2011; 214–230.
19. Laffan M, Brown SA, Collins PW, et al. The diagnosis of von Willebrand disease: a guideline from the UK Haemophilia Centre Doctors´ Organization. Haemophilia 2004, 10 : 199-217.
20. Sadler JE, Rodeghiero F. Provisional criteria for the diagnosis of VWD type 1. J Thromb Haemost 2005; 3 : 775–777.
21. Eikenboom J, Van Marion V, Putter H, et al. Linkage analysis in families diagnosed with type 1 von Willebrand disease in the European study, molecular and clinical markers for the diagnosis and management of type 1 VWD. J Thromb Haemost 2006; 4 : 774–782.
22. Nichols WL, Hultin MB, James AH, et al. von Willebrand disease (VWD): evidence-based diagnosis and management guidelines, the National Heart, Lung, and Blood Institute (NHLBI) Expert Panel report (USA). Haemophilia 2008; 14 : 171–232.
23. Quiroga T, Goycoolea M, Belmont S, et al. Quantitative impact of using different criteria for the laboratoř diagnosis of type 1 von Willebrand disease. J Thromb Haemost 2014; 12 : 1238–1243.
24. Tosetto A, Rodeghiero F, Castaman G, et al. A quantitative analysis of bleeding symptoms in type 1 von Willebrand disease: results from a multicenter European study (MCMDM-1 VWD). J Thromb Haemost 2006; 4 : 766–773.
25. Rodeghiero F, Castaman G, Tosetto A, et al. The discriminant power of bleeding history for the diagnosis of type 1 von Willebrand disease: an international, multicenter study. J Thromb Haemost 2005; 3 : 2619–2626.
26. Tosetto A, Castaman G, Rodeghioero F. Bleeders, bleeding rates, and bleeding score. J Thromb Haemost 2013; 11(Suppl. 1): 142–150.
27. Collins PW, Cumming AM, Goodeve AC, Lillicrap D. Type 1 von Willebrand disease: application of emerging data to clinical practice. Haemophilia 2008; 14 : 685–696.
28. De Maistre E, Volot F, Mourex G, et al. Performance of two new automated assays for measuring von Willebrand activity: HemosIl AcuStar and Innovance. Thromb Haemost 2014; 112 : 825–830.
29. Lasne D, Dey C, Dautzenbeerg MD, et al. Screening for von Willebrand disease: contribution of an automated assay for von Willebrand factor activity. Haemophilia 2012; 18: e158–e163.
30. Reilly-Stitt C, Coppell J, Mumford AD. Discrepancy in von Willebrand factor activity determined by ristocetin cofactor and immunoturbidometric assays. Haemophilia 2014; 20: e336–e358.
31. Laffan MA, Lester W, O´Donnell JS, et al. The diagnosis and management of von Willebrand disease: a United Kingdom Haemophilia Centre Doctors Organization guidelines approved by the British Committee for Standards in Haematology. British Journal of Haematology 2014; publikováno elektronicky. DOI 10.1111/bjh.13064.
32. Favaloro EJ. Laboratory assessment as a critical component of the appropriate diagnosis and sub-classification of von Willebrand‘s disease. Blood Reviews 1999; 13 : 185–204.
33. Federici AB, Mannucci PM, Castaman G, et al. Clinical and molecular predictors of trombocytopenie and risk of bleeding in patients with von Willebrand disease type 2B: a cohort study of 67 patients. Blood 2009; 113 : 526–534.
34. Federici AB, Castaman G, Mannucci PM, et al. Guidelines for the diagnosis and management of von Willebrand disease in Italy. Haemophilia 2002; 8 : 607–621.
35. Flood VH, Gill JC, Montgomery RR. Critical von Willebrand factor A1 domain residues influence type VI collagen binding. Thromb Haemost 2012 Jul; 10(7): 1425–1432, publikováno elektronicky. DOI 10.1111/j.1538-7836.2012.04746.x.
36. Flood VH, Gill JC, Friedman KD, et al. Von Willebrand disease in the United States: a perspective from Wisconsin. Semin Thromb Hemost 2011 July; 37(5), publikováno elektronicky. DOI 10.1055/s-0031-1281039.
37. Flood VH, Friedman KD, Gill JC, et al. No increase in bleeding identified in type 1 VWD subjects with D1472H sequence variation. Blood 2013; 121(18): 3742–3744.
38. Graf L, Moffat KA, Carlino SA, et al. Evaluation of an automated method for measuring von Willebrand factor activity in clinical samples without ristocetin. Int Jnl Lab Hem 2014; 36 : 341–351.
39. Grover N, Boama V, Chou MR. Pseudo (Platelet-type) von Willebrand disease in pregnancy: a case report. BMC Pregnancy and Childbirth 2013; 13 : 16.
40. Tiede A, Rand JH, Budde U, Ganser A, Federici AB. How I treat acquired von Willebrand syndrome. Blood 2011; 117(25): 6777–6785.
41. Federici AB. The use of desmopressin in von Willebrand disease: the experience of the first 30 years (1997-2007). Haemophilia 2008; 14 (Suppl. 1): 5–14.
42. Lethagen S, Federici AB, Castaman G. On the use of desmopressin in von Willebrand disease. In: Federici AB, Lee CA, Berntorp E, et al. Von Willebrand Disease, Basic and Clinical Aspects. 1. ed. Oxford, Blackwell Publishing 2011 : 186–199.
43. Mannucci PM. Treatment of von Willebrand disease. Thromb Haemost 2001; 86 : 149–153.
44. Mazurier C, Guacher Ch, Jorieux S, et al. Biological effect of desmopressin in eight patients with type 2N („Normandy“) von Willebrand disease. Br J Haematol 1994; 88 : 849 – 854.
45. Rodeghiero F, Castaman G, Tosetto A. Optimizing treatment of von Willebrand disease by using phenotypic and molecular data. Hematology Am Soc Hematol Educ Program 2009; 113–123, publikováno elektronicky. DOI 10.1182/asheducation-2009.1.113.
46. Pasi KJ, Collins PW, Keeling DM, et al. Management of von Willebrand disease: a guideline from the UK Haemophilia Centre Doctors´Organization. Haemophilia 2004; 10 : 218–231.
47. Ragni MV, Jankowitz RC, Jaworski K, et al. Phase II prospective open-label trial of recombinant interleukin-11 in women with mild von Willebrand disease and refractory menorrhagia. Thromb Haemost 2011; 106 : 641–645.
48. Goudemand J, Scharrer I, Berntorp E, et al. Pharmacokinetic studies on Wilfactin®, a von Willebrand factor concentrate with a low factor VIII content treated with three virus-inactivation/removal methods. J Thromb Haemost 2005; 3 : 2219–2227.
49. Chang AC, Rick ME, Pierce LR, Weinstein MJ. Summary of a workshop on potency and dosage of von Willebrand factor concentrates. Haemophilia 1998; 4 (suppl. 3): 1–6.
50. Kessler CM, Friedman K, Schwartz BA, et al. The pharmacokinetic diversity of two von Willebrand factor (VWF)/factor VIII (FVIII) concentrates in subjects with congenital von Willebrand disease. Thromb Haemost 2011; 106 : 279–288.
51. Nordic guidelines for diagnosis and management of von Willebrand disease – Guidelines of the Nordic Hemophilia Council – April (2008). Dostupné na www: http//www.nordhemophilia.org.
52. Mannucci PM, Franchini M, Casataman G, et al. Evidence-based recommendation on the treatment of von Willebrand disease in Italy. Blood Transfus 2009; 7 : 117–126.
53. Lillicrap D, Poon MC, Walker I, Xie F, Schwartz BA. Efficacy and cafety of the factor VIII/von Willebrand factor concentrate, Haemate-P: Ristocetin cofactor unit dosing in patients with von Willebrand disease. Thromb Haemost 2002; 87 : 224–230.
54. Lenthagen S, Kyrle PA, Castaman G, Haertel S, Mannucci PM. von Willebrand factor concentrate/factor VIII concentrate (Haemate P) dosing based on pharmacokinetics: a prospective multicenter trial in elative surgery. J Thromb Haemost 2007; 5 : 1420–1430.
55. Federici AB, Castaman G, Franchini M, et al. Clinical use of Haemate P in inherited von Willebrand´s disease: a cohort study on 100 Italian patients. Haematologica 2007; 92 : 944–951.
56. Berntorp E, Windyga J. Treatment and prevention of acute bleedings in von Willebrand disease – efficacy and safety of Wilate, a new generation von Willebrad factor/factor VIII concentrate. Haemophilia 2009; 15 : 122–130.
57. Windyga J, von Depka-Prondzinski M. Efficacy and safety of a new generation von Willebrand factor/factor VIII concentrate (Wilate) in the management of perioperative haemostasis in von Willebrand disease patients undergoing surgery. Thromb Haemost 2011; 105 : 1072–1079.
58. Batty P, Chen YH, Bowles L, at al. Safety and efficacy of a von Willebrand factor/factor VIII concentrate (Wilate): a single centre experience. Haemophilia 2014; 20 : 846–853.
59. Morfini M. Pharmacokinetics of VWF/FVIII concentrates is a very intricate matter. Haemophilia 2011; 17 : 846–848.
60. Borel-Derlon A, Federici AB, Roussel-Robert V. et al. Treatment of severe von Willebrand disease with a high-purity von Willebrand factor concentrate (Wilfactin): a prospective study of 50 patients. J Thromb Haemost 2007; 5 : 1115–1124.
61. Berntorp E. Prophylaxis in von Willebrand disease. In: Federici AB, Lee CA, Berntorp E, et al. Von Willebrand Disease, Basic and Clinical Aspects. Oxford: Blackwell Publishing 2011 : 207–213.
62. Abshire TC, Federici AB, Alvárez MT, et al. Prophylaxis in severe forms of von Willebrand´s disease: results from the Willebrand Disease Prophylaxis Network (VWD PN). Haemophilia 2013; 19 : 76–81.
63. James AH, Kouides PA, Abdul-Kadir R et al. Von Willebrand disease and other bleeding disorders in women: Consensus on diagnosis and management from an international expert panel. Am J Obstet Gynecol 2009; 201: e1–e8.
64. Pai M, Chan A, Barr R. How I manage heavy menstrual bleeding. Br J Haematol 2013; 162 : 721–729.
65. Lee CA, Chi C, Pavord SR, et al. The obstetric and gynaecological management of women with inherited bleeding disorders – review with guidelines produced by a taskforce of UK Haemophilia Centre Doctors´ Organization. Haemophilia 2006; 12 : 301–336.
66. Ramsahoye BH, Davies SV, Dasani H, et al. Obstetric management in von Willebrands disease: a report of 24 pregnancies and a review of the literature. Haemophilia 1995; 1 : 140–144.
67. Franchini M, Mannucci PM. Gastrointestinal angiodysplasia and bleeding in von Willebrand disease. Thromb Haemost 2014; 112 : 427–431.
68. Konkle BA. Von Willebrand factor and aging. Semin Thromb Hemost 2014; 40 : 640–644.
69. Sohal M, Laffan M. von Willebrand disease and angiodysplasia responding to atorvastatin. Br J Haematol 2008; 142 : 308–309.
70. Ii M, Losordo DW. Statins and the endothelium. Vascular Pharmacology 2007; 46 : 1–9, publikováno elektronicky. DOI 10.1016/j.vph.2006.06.012.
71. Botero JP, Pruthi RK. Refractory bleeding from intestinal angiodysplasias successfully treated with danazol in free patients with von Willebrand disease. Blood Coagul Fibrinolysis 2013; 24 : 884–886.
72. Pergantou H, Xafaki P, Adamtziki E, et al. The challenging management of a child with type 3 von Willebrand disease and antibodies to von Willebrand factor. Haemophilia 2012; 18(3): e66–e67.
Štítky
Gynekológia a pôrodníctvo Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2015 Číslo 2- Nejasný stín na plicích – kazuistika
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Kvantifikace ošetřovatelské péče v oboru hematoonkologie
- GATA2 deficiency-associated bone marrow disorder differs from idiopathic aplastic anemia
- Risk of venous and arterial thrombotic events in patients diagnosed with superficial vein thrombosis: a nationwide cohort study
- Prognostic factors for remission of and survival in acquired hemophilia A (AHA): results from the GTH-AH 01/2010 study
- ASXL1 mutations in younger adult patients with acute myeloid leukemia: a study by the German-Austrian Acute Myeloid Leukemia Study Group
- Von Willebrandova choroba
- Hodnotenie terapeutickej odpovede v kostnej dreni u pacientov s vysokorizikovým myelodysplastickým stavom
- Monoklonální protilátky v léčbě mnohočetného myelomu
- Pokroky v léčbě akutní lymfoblastické leukemie dospělých
- Projekt myelodysplastický syndrom na severní a střední Moravě
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Von Willebrandova choroba
- Monoklonální protilátky v léčbě mnohočetného myelomu
- Hodnotenie terapeutickej odpovede v kostnej dreni u pacientov s vysokorizikovým myelodysplastickým stavom
- Pokroky v léčbě akutní lymfoblastické leukemie dospělých
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



