-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
Imprint lymph node cytology: 11 years old experience
Aims: Lymphatic node imprint cytology has been performed at the authors´ institution over a long period of time and has been used for further diagnosis, staging or starting treatment before histology is available as well as for fluorescent in-situ hybridization genetic testing. The aim of this study is to assess diagnostic reliability of cytology.
Results: The authors analysed retrospectively 122 samples that could be compared with histology findings. Five imprints were not representative. Overall sensitivity, specificity, positive and negative predictive value and diagnostic accuracy were 67, 69, 85, 44 and 67% respectively. The lowest sensitivity of 36% was found in the group of low grade non-Hodgkin's lymphomas with other malignancies demonstrating 77% sensitivity. Specificity for metastases of non-haematology tumours was 100%. The authors identified 7 cases where treatment was started before histology results were available, of which five cases had correct cytology results. The causes of incorrect diagnostics were: similar or identical monomorphic infiltration with basophilic vacuolised blasts often associated with macrophages in various blastic lymphomas and metastases; cohesive clumps of tumour cells in lymphomas; similarity of physiological and lymphoma lymphocytes; similarity of Hodgkin and Sternberg-Reed cells and cells in non-Hodgkin's lymphomas and metastases, frequently with a reactive background population. Proliferation of eosinophils was found only in 40% of Hodgkin's lymphomas.
Conclusion: Cytology does not have absolute diagnostic accuracy when determining the type of malignancy, except for an absolute specificity for unequivocal metastatic infiltration. Cytology results may be used for early staging. In the emergency setting, a clinician may use cytology results before histology findings are available for targeted cytoreductive treatment that can reverse tumour compression of organs or even prevent progressive malignant cachexia and worsening of overall patient performance status due to very aggressive tumours, which could limit intensive antineoplastic therapy once the diagnosis is definitive.
Keywords:
cytology – lymph node – lymphadenopathy – imprint
Autori: A. Wild 1,2; J. Holasová 1,2; L. Plank 3,4; P. Szépe 3,4; T. Balhárek 3,4; J. Marcinek 3,4
Pôsobisko autorov: Hematologické oddelenie a Centrálny laboratórny komplex FNsP F. D. Roosevelta v Banskej Bystrici 1; LF SZU v Bratislave 2; Ústav patologickej anatómie, Jesseniova lekárska fakulta UK a Martinská univerzitná nemocnica v Martine 3; Martinské bioptické centrum, s. r. o. v Martine 4
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 2, p. 176-185.
Kategória: Původní práce
Súhrn
Ciele: Cytológie imprintov lymfatických uzlín sa dlhodobo vykonávajú na pracovisku autorov pre prípad potreby ďalšej diagnostiky, vyhodnotenia štádia („staging“) alebo začatia terapie pred získaním výsledku histologického vyšetrenia a prípadne ako materiál pre genetické vyšetrenie metódou FISH. Cieľom je zhodnotiť ich význam z hľadiska určenia správnej diagnózy.
Metódy: Autori retrospektívne vyhľadali popisy cytológie lymfatických uzlín od apríla 2007 do júna 2018. Porovnali výsledky cytológie a histológie lymfatických uzlín, znovu hodnotili prípady s nesprávnym záverom, vyhľadali klinické postupy.
Výsledky: Autori identifikovali 122 nálezov porovnateľných s histologickým vyšetrením. Pať imprintov bolo nereprezentatívnych. Celková senzitivita, špecificita, pozitívna a negatívna prediktívna hodnota a diagnostická správnosť boli 67, 69, 85, 44 a 67 %. Najnižšia senzitivita bola v prípade malobunkových non-Hodgkinových lymfómov – 36 %, v prípade ostatných malignít 77 %. V prípade sekundárnych metastáz nehematologických nádorov bola špecificita 100 %. Autori identifikovali 7 prípadov terapeutickej reakcie pred definitívnym výsledkom histológie, 5 v prípade správneho výsledku cytológie. Príčinou nesprávnej alebo nepresnej diagnostiky bola: podobnosť až zhodnosť monomorfnej infiltrácie bazofilnými vakuolizovanými blastami, často aj s prítomnosťou makrofágov pri rôznych blastických lymfómoch a metastázach, kohezívne zhluky nádorových buniek pri lymfómoch, podobnosť fyziologických a nádorových lymfocytov, podobnosť Hodgkinových a Sternberg-Reedovej buniek s bunkami non-Hodgkinových lymfómov a metastáz, často v reaktívnom prostredí. Zmnoženie eozinofilov sa našlo len v 40 % Hodgkinových lymfómov.
Záver: Až na absolútnu špecificitu cytologicky jednoznačnej metastatickej infiltrácie nemá cytológia absolútnu diagnostickú presnosť v identifikovaní typu malignity. Výsledok možno využiť pre včasné zahájenie stagingu. V nevyhnutnom prípade môže klinik využiť cytologický nález pred obdržaním výsledku histológie pre cielenejšie podanie cytoreduktívnej predfázy, pulzu kortikosteroidov, prípadne chemoterapie. Umožní to zvrátiť komplikácie z orgánového útlaku nádorom, ale aj predísť pri veľmi agresívnych nádoroch progresívnemu znižovaniu stavu výživy a výkonnosti, čo by mohlo obmedziť použitie intenzívnej protinádorovej liečby po stanovení definitívnej diagnózy.
Klíčová slova:
lymfatické uzliny – lymfadenopatia – cytológia – otlačok
ÚVOD
Okrem výnimiek, ako je chronická lymfocytová leukémia, je diagnostika lymfómov založená na histológii, imunohistochémii, prípadne molekulovej genetike postihnutej lymfatickej uzliny (LU) alebo tumoru. V reálnej praxi dostane klinik výsledok o 2–5 týždňov, zriedkavo skôr. Predbežný výsledok, hoci s nižšou mierou diagnostickej správnosti, umožňuje cytológia imprintov LU (CILU) alebo tumoru už v deň odberu, prípadne na druhý deň. CILU sa na pracovisku autorov vykonáva dlhodobo pre prípad potreby ďalšej diagnostiky, stanovenia štádia ochorenia („staging“) alebo aj začatia terapie pred výsledkom histologického vyšetrenia a v určitom období aj ako materiál pre genetické vyšetrenie metódou fluorescenčnej in situ hybridizácie (FISH). Cieľom je zhodnotiť ich význam z hľadiska určenia správnej diagnózy.
MATERIÁL A METODIKA
Spracovanie materiálu
Po chirurgickej exstirpácii LU, celého či časti tumoru chirurg resekát rozreže. Hematologický laborant materiál mierne stlačí smerom k reznej ploche, ktorú otlačí na podložné sklíčko. Materiál nechá štandardne vysušiť, fixovať a ofarbí ho podľa Giemsu--Romanovského druhý pracovný deň po exstirpácii. Hodnotenie vykonáva lekár-hematológ. Písomné kópie nálezov sa odkladajú spolu v chronologickom poradí.
Histologická diagnostika bola vykonaná v Martinskom bioptickom centre v Banskej Bystrici a v Martine.
Vyhľadávanie informácií
Autori vyhľadali písomné kópie nálezov od zavedenia súčasného nemocničného a laboratórneho informačného systému Fakultnej nemocnice s poliklinikou (FNsP) F. D. Roosevelta v Banskej Bystrici (NIS, LIS) v roku 2007 do júna 2018. V NIS vyhľadali presnú histologickú diagnózu. Porovnali obidva výsledky.
Terapeutický klinický zásah bol zisťovaný v prípadoch, kde autori očakávali včasnú klinickú odozvu pred výsledkom histológie. Vstupnými kritériami boli suspektná diagnóza lymfómu alebo granulomatózneho zápalu. Vylučovacími kritériami boli cytologické diagnózy nešpecifickej lymfadenitídy, neistý nález, tumor neistého pôvodu a suspektná metastatická infiltrácia. Vo vybraných prípadoch vyhľadali v NIS najbližšie klinické údaje po dátume biopsie LU a zisťovali, či na základe výsledku CILU pred obdržaním konečného výsledku histológie boli vykonané špecifické opatrenia.
Autori spätne znovu hodnotili imprinty, kde výsledok cytológie a histológie bol diskrepantný a určovali príčinu nesprávnej predikcie definitívnej diagnózy cytologicky.
Štatistické hodnotenie
Autori vypočítali senzitivitu, špecificitu, pozitívnu (PPV) a negatívnu prediktívnu hodnotu (NPV) a diagnostickú správnosť so zameraním na jednotlivé typy diagnóz (malobunkové lymfómy (iNHL), blastické lymfómy (HG-NHL), Hodgkinov lymfóm (HL), metastázy nehematologického malígneho nádoru (MTS)), ich skupiny (malignity s výnimkou iNHL) a celkovo. Pre celkové hodnotenie sa určovala špecificita a NPV pre kumulatívny výsledok malignít a granulomatózneho zápalu. Diagnostickú správnosť vypočítali podľa postupu popísaného v diskutovanej literatúre [1]:
VÝSLEDKY
Autori identifikovali 122 výsledkov imprintov od 121 pacientov. Porovnanie výsledkov cytológie a histológie je v tabuľke 1. Štatistické zhodnotenie je v tabuľke 2.
Tab. 1. Porovnanie záveru cytológie a definitívneho výsledku histológie 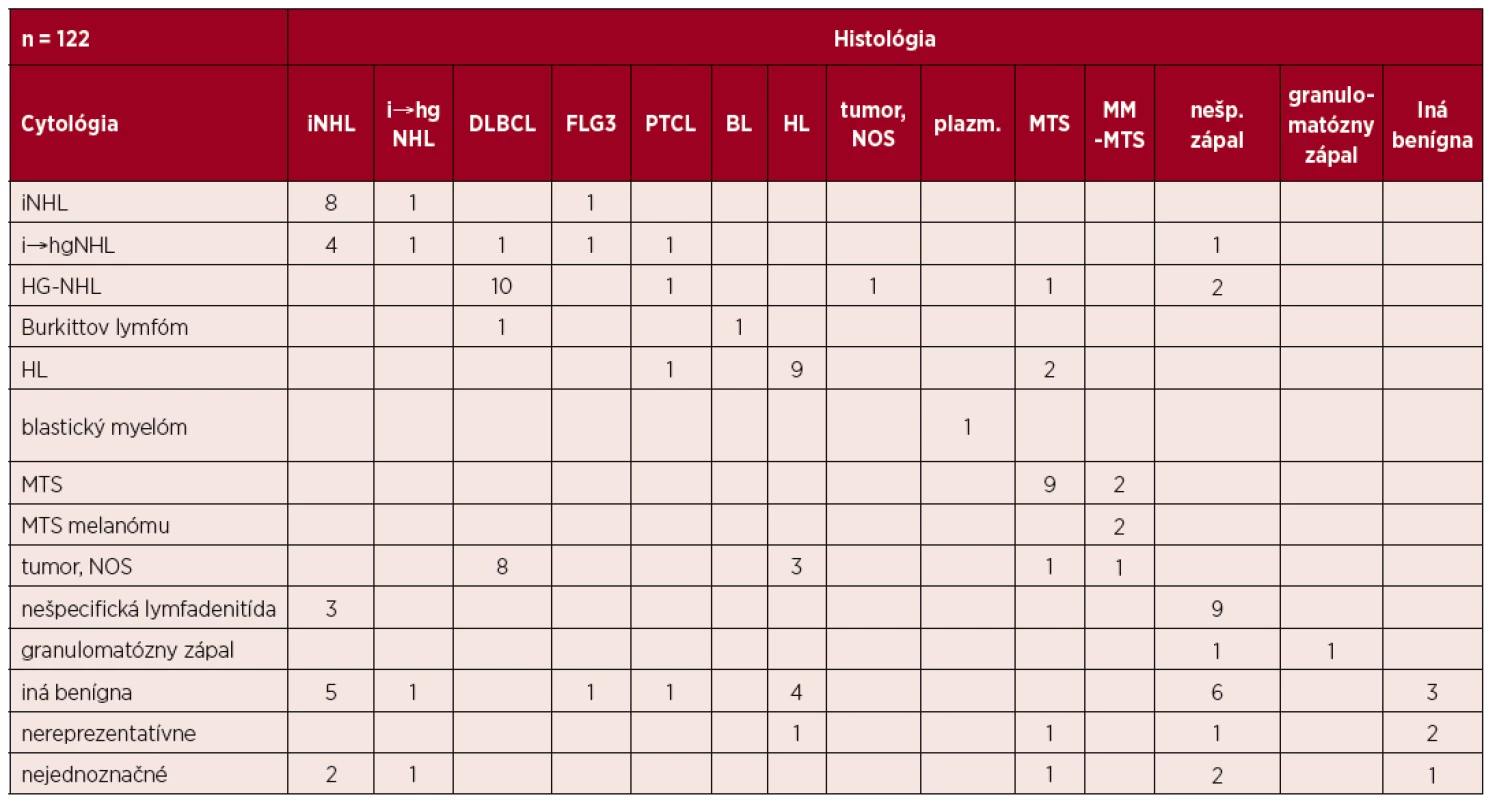
FLG3 – folikulový lymfóm, grade 3; iNHL – indolentný non-Hodgkinov lymfóm; i → HG-NHL – transformácia indolentného do blastického non-Hodgkinovho lymfómu; MM-MTS – metastáza melanómu; nešp. zápal – nešpecifická lymfadenitída; plazm. – plazmoblastová infiltrácia, PTCL – periférny T-bunkový lymfóm; tumor, NOS – bližšie nešpecifikovaná nádorová infiltrácia; ostatné skratky v texte. Tab. 2. Výsledky štatistického zhodnotenia cytológie imprintov lymfatických uzlín 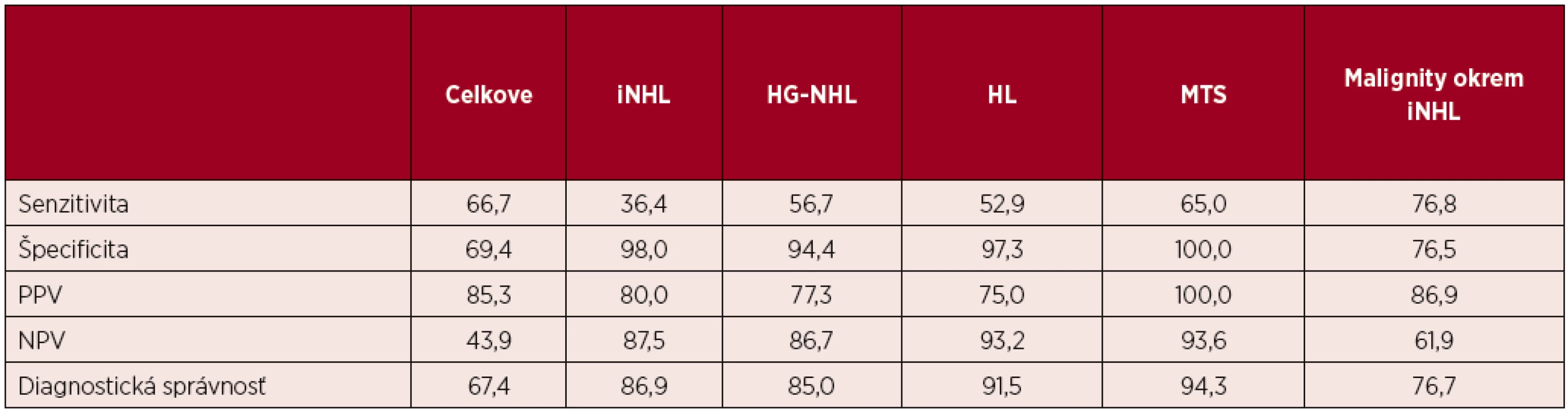
Skratky vysvetlené v texte Príčiny nesprávneho záveru cytológie boli:
- Prítomnosť makrofágov (v menšom počte ako pri Burkittovom lymfóme (BL)) v kombinácii s blastami alebo blastoidnými bunkami s bazofilnou vakuolizovanou cytoplazmou v iných blastických non-Hodgkinových lymfómoch (HG-NHL) a nehematologických nádoroch (obr. 1, 2).
- Prítomnosť kohezívnych zhlukov často pomerne monomorfných nádorových buniek charakteristických pre metastázy aj pri non-Hodgkinovom lymfóme viedlo k diagnóze bližšie nešpecifikovanej malígnej infiltrácie (obr. 3).
- Podobnosť fyziologických lymfocytov a nádorových lymfocytov pri malobunkových lymfómoch (obr. 4).
- Zámena Hodgkinovych a Sternberg-Reedovej buniek v klasickom Hodgkinovom lymfóme s podobnými bunkami pri non-Hodgkinovych lymfómoch (periférny T-bunkový lymfóm (PTCL)) a metastázach, najmä pri prítomnosti reaktívneho prostredia eozinofilov, lymfocytov a plazmocytov (obr. 5, 6). Početnejšie eozinofily v imprintoch boli prítomné len u 40 % HL.
- V prípade cytologicky zjavnej nádorovej infiltrácie nejasného pôvodu autori radšej zvolili kategóriu bližšie nešpecifikovanej nádorovej infiltrácie.
Obr. 1. Makrofágy medzi bazofilnou nádorovou infiltráciou
1A: Makrofágy (označené šípkami) rozosiate medzi bazofilnými blastami pri Burkittovom lymfóme vytvárajúc tak obraz hviezdneho neba, zväčšenie 200x. Makrofágy sa v menšom množstve vyskytujú aj pri B-difúznom veľkobunkovom lymfóme – DLBCL (1B, zväčšenie 400x) aj infiltrácii inými nádormi: 1C – slabo diferencovaný malígny tumor neurčitého pôvodu a histogenézy (zväčšenie 400x), 1D – MTS melanómu (zväčšenie 1000x).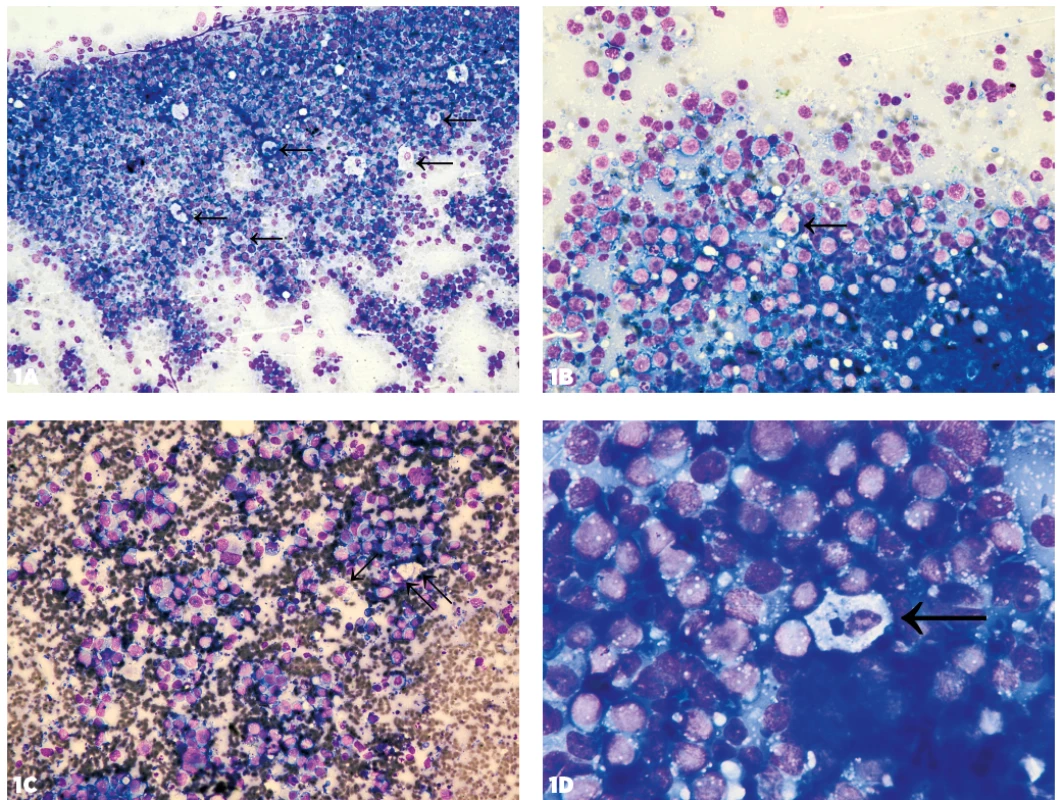
Obr. 2. Infiltrácia bazofilnými vakuolizovanými blastami rôzneho pôvodu
Snímky z rovnakého materiálu ako na obrázku 1, zväčšenie 1000x. Blasty alebo blastoidné elementy so silne bazofilnou vakuolizovanou cytoplazmou sa nevyskytujú len pri Burkittovom lymfóme (2A), ale aj pri DLBCL (2B – DLBCL, „triple expressor“) a metastázach: 2C – slabo diferencovaný malígny tumor neurčitého pôvodu a histogenézy, 2D – metastáza melanómu.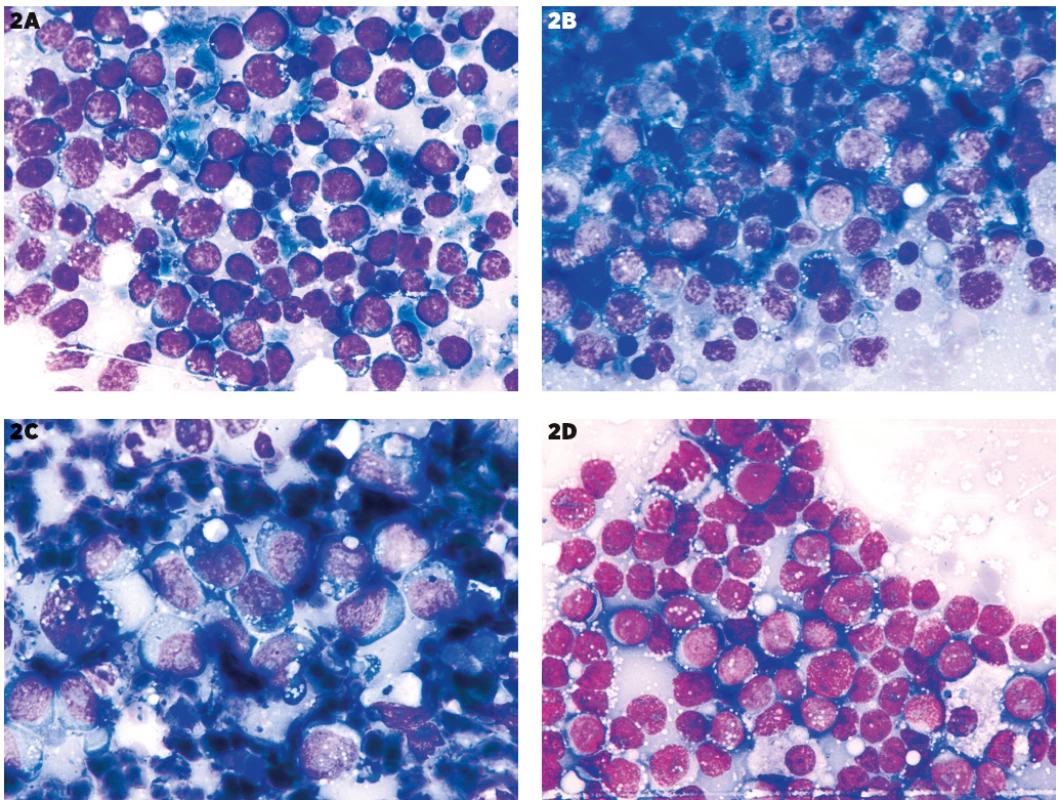
Obr. 3. Kohezívne zhluky pri difúznom veľkobunkovom lymfóme
B-pôvodu (DLBCL)
3A, 3B – kohezívne zhluky pripomínajúce MTS
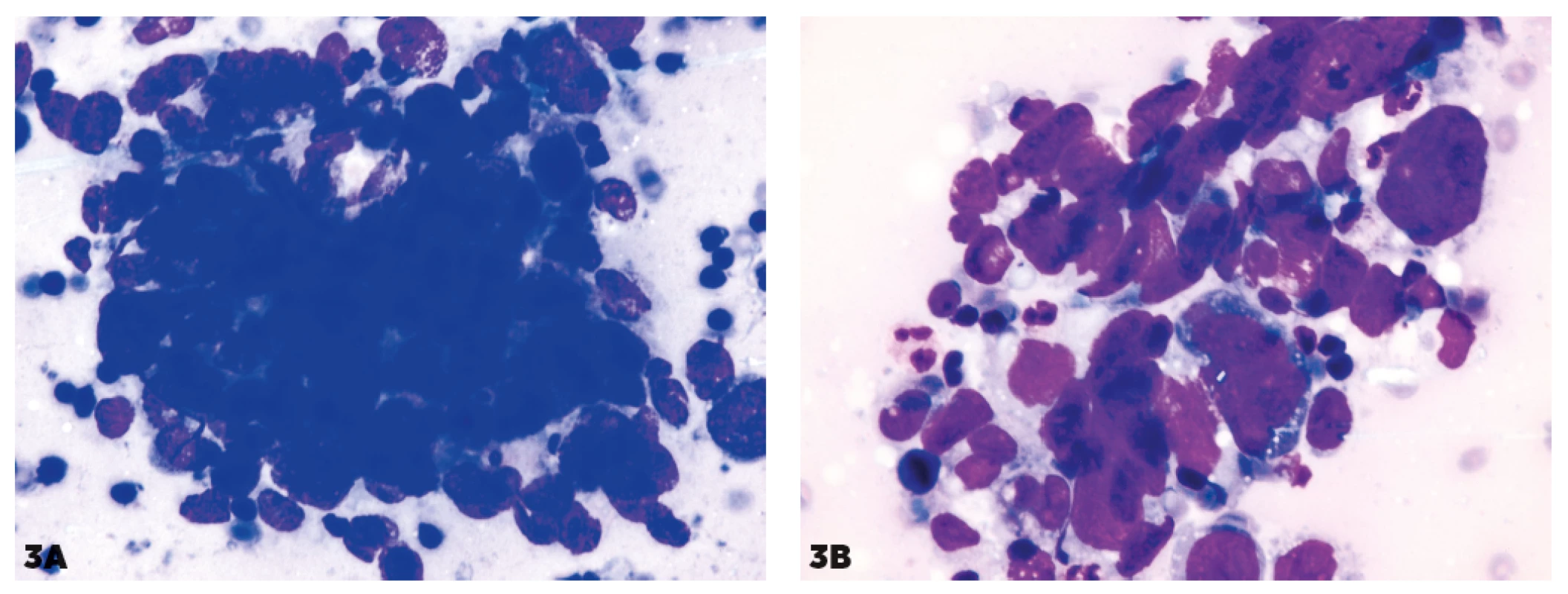
Obr. 3. 3C – v iných častiach imprintu nález imponuje ako blastický lymfóm. 
Obr. 4. Podobnosť lymfocytov malobunkového lymfómu a lymfocytov pri nešpecifickej lymfadenitíde
4A – folikulový lymfóm, 4B – nešpecifická lymfadenitída.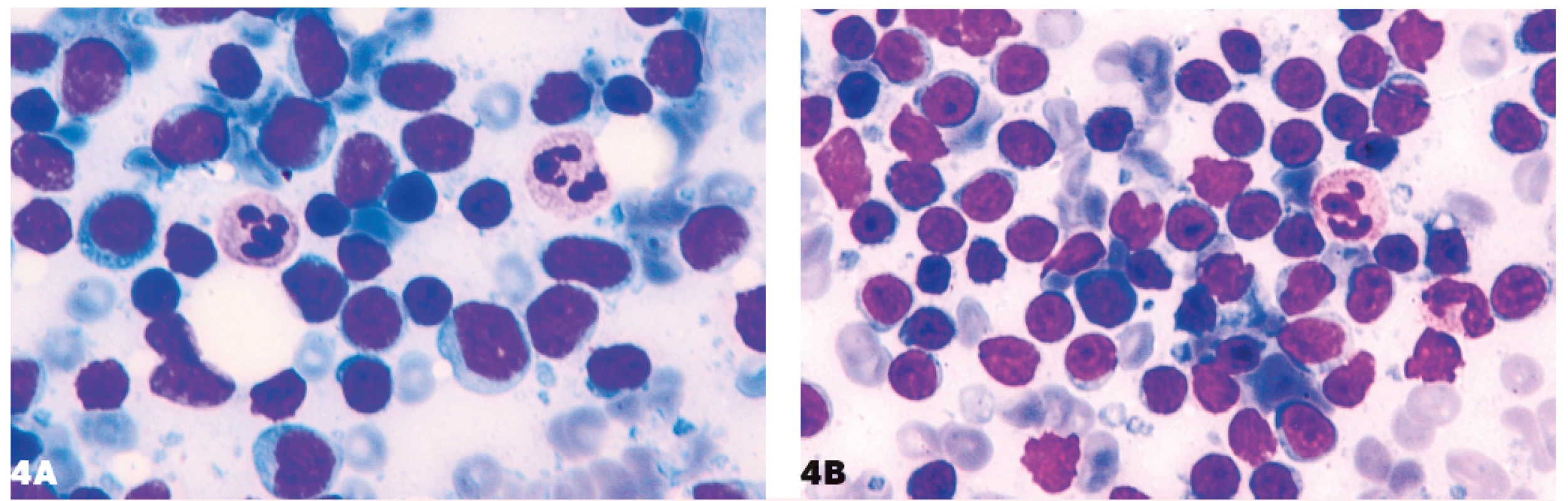
Obr. 5. Porovnanie Hodgkinovych buniek pri klasickom Hodgkinovom lymfóme (cHL) a buniek podobných Hodgkinovym bunkám pri metastázach pri malom zväčšení. 5A (zväčšenie 200x), 5B (zväčšenie 400x) – Hodgkinove bunky pri cHL. 5C – bunky podobné Hodgkinovym pri metastáze klasického seminómu, zväčšenie 400x. 5D – bunka podobná Hodgkinovej na reaktívnom pozadí lymfocytov, plazmocytov a eozinofilov (ktoré je typické pre Hodgkinov lymfóm) pri metastáze veľkobunkového epidermoidného karcinómu, zväčšenie 1000x. Časť týchto buniek je vyznačených šípkami. 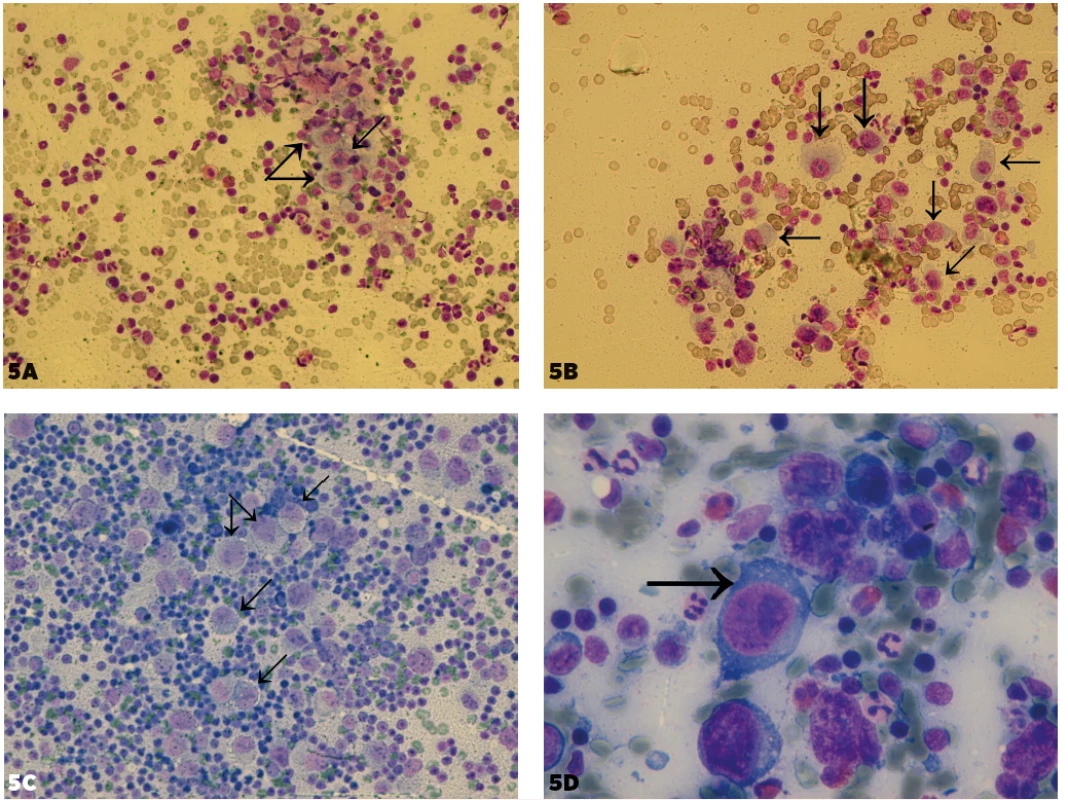
Obr. 6. Porovnanie Hodgkinovych buniek a Sternberg-Reedovej (SR) buniek pri klasickom HL a buniek podobných Hodgkinovym bunkám pri metastázach pri zväčšení 1000x
6A–B – Hodgkinove bunky, 6C–D Sternberg-Reedovej bunky, 6E–F – MTS klasického seminómu, s reaktívnym okolím, 6G – metastáza veľkobunkového epidermoidného karcinómu s reaktívnym okolím. Predmetné bunky sú vyznačené šípkami.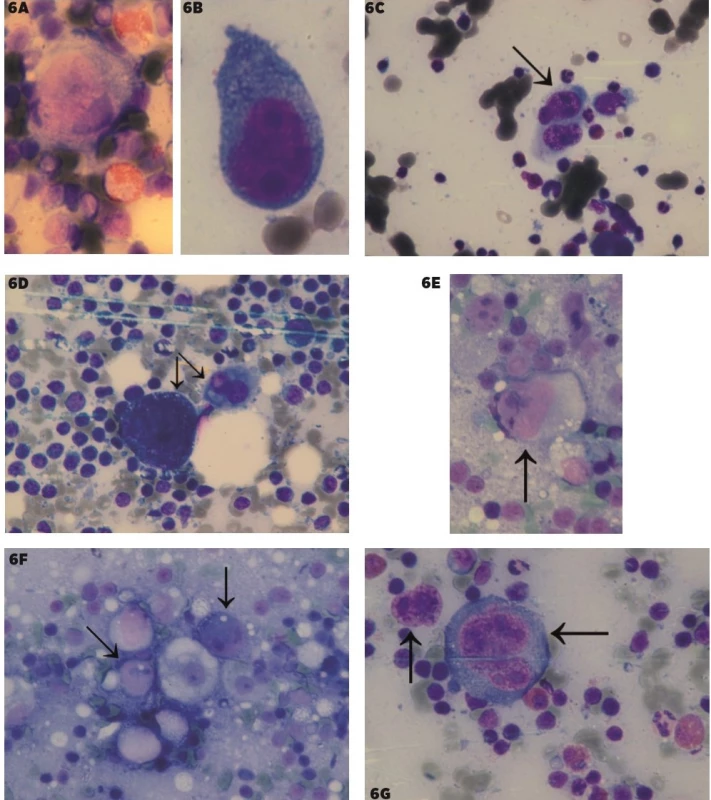
Klinickú terapeutickú reakciu pred výsledkom definitívnej histológie autori zisťovali v 53 suspektných prípadoch. U 3 pacientov so suspektným lymfómom (u 2 predbežná histológia primárneho lymfoproliferatívneho ochorenia) bola zahájená cytoreduktívna predfáza. U 1 pacienta s blastickou transformáciou myelómu chemoterapia podľa protokolu VAD, u 1 pacienta s klasickým HL stredne vysoké dávky metylprednizolónu. U týchto pacientov sa histologicky potvrdila diagnóza. U dvoch sa cytologicky suspektná diagnóza histologicky nepotvrdila: u jedného s podozrením na potransplantačné lymfoproliferatívne ochorenie (zmena imunosupresie, histologicky lymfadenitída) a u jedného so suspektnou blastickou transformáciou známej CLL (CHOP bez efektu, histologicky karcinóm neznámeho miesta vzniku). U pacientov hodnotených ako MTS nebola žiadna klinická reakcia, v 3 prípadoch dokumentácia nebola dostupná.
DISKUSIA
Publikácia výsledkov cytológie imprintov LU u pa-cientov s rôznymi diagnózami nie je častá, výsledky sú uvedené v tabuľke 3. Celková diagnostická správnosť v našom materiáli zodpovedá údajom anglických autorov [2]. Ostatní autori rozlišovali skupiny nešpecifickej lymfadenitídy, tuberkulózy (TBC), NHL, HL (alebo spolu ako primárne lymfoproliferatívne ochorenia) a metastatické postihnutie nehematologickým nádorom a dosiahli vyššiu diagnostickú správnosť 92–97,8 % oproti 72 % v našom materiáli [1, 3–6].
Pre účely tejto práce bola vybraná cytologická diagnóza, ktorá bola označená ako najpravdepodobnejšia, ale v časti prípadov cytológ uviedol diferenciálnu diagnostiku viacerých diagnóz.
Pre lymfómy je typická monomorfná infiltrácia, na rozdiel od prítomnosť blastov a reaktívnych buniek v prípade nešpecifickej lymfadenitídy. Avšak podľa skúseností nášho pracoviska sa aj v prípade lymfómov vyskytujú reaktívne bunky (viď obr. 4). To znižuje schopnosť rozlíšiť nešpecifickú lymfadenitídu od malobunkového NHL alebo difúzneho veľkobunkového B-lymfómu (DLBCL) bohatého na T-lymfocyty. Iní autori neuvádzajú podobnosť fyziologických lymfocytov pri nešpecifickej lymfadenitíde a nádorových lymfocytov pri malobunkových lymfómoch ako príčinu nesprávnej predikcie diagnózy cytologicky [1–7]. Rovnako pri zvýšenom počte blastov v monomorfnej malobunkovej populácii (prípadne už pri anamnéze malobunkového lymfómu) je ob-tiažne posúdiť, či sa jedná o blastickú transformáciu pôvodne malobunkového NHL. Podobnú skúsenosť prezentujú aj iní [2].
Autori uvedených prác neuvádzajú ako zdroj nesprávnej cytologickej diagnózy podobnosť nádorových elementov, ako sú blasty alebo blastoidné elementy so silnou bazofilnou vakuolizovanou cytoplazmou typickou pre Burkittov lymfóm, ktoré sa vyskytujú aj pri iných HG-NHL a pri MTS [1–7]. Súčasný výskyt makrofágov môže vyvolať dojem obrazu hviezdneho neba. Z obmedzených skúseností autorov bol obraz hviezdneho neba v BL zrejmý a výskyt makrofágov v prípade NHL a metastáz bol nižší (viď obr. 1).
Pri určení NHL a HL ako bližšie nešpecifikovaného tumoru bol dôležitý faktor prítomnosti kohezívnych zhlukov typických pre metastázy v inak monomorfnej populácii buniek skôr lymfómovej morfológie. Rovnaký dôvod pri NHL uviedol Molyneux et al. [2].
Opačnú zámenu metastáz za NHL spôsobila prítomnosť bazofilných vakuolizovaných blastoidných elementov (s relatívne malým množstvom cytoplazmy) bez kohezívnych zhlukov (viď obr. 1, 2). Podobnú skúsenosť uvádzajú aj iní, a to rovnako v prípade metastáz seminómu [2]. Iní autori uvádzajú ako dôvody aj malé množstvo buniek pri fibróze [7].
Prítomnosť buniek podobných Hodgkinovym a Sternberg-Reedovej bunkám (viď obr. 5–6) spôsobilo nesprávnu interpretáciu metastáz a PTCL ako HL, najmä ak bolo súčasne prítomné aj reaktívne okolie (viď obr. 5, 6) s lymfocytmi, plazmocytmi a eozinofilmi, ktoré sa považuje za typické pri HL. Rovnaký prípad zámeny metastáz za HL uviedol Molyneux et al. [2].
Cytologicky monomorfná infiltrácia v kohezívnych zhlukoch alebo zjavne nehematologického pôvodu svedčila pre metastatický proces. Tento nález mal v našom materiáli 100 % špecificitu. Podobne to bolo aj v iných prácach. Podľa našej skúsenosti prítomnosť tmavého – čierneho farbiva – v cytoplazme makrofágov nie je vo všetkých prípadoch metastáz melanómu, jeho prítomnosť v nádorových bunkách je výnimočná.
Celkovo v našom materiáli cytológia imprintov LU vo významnej časti prípadov nerozlíši malobunkovú lymfómovú infiltráciu a reaktívne zmeny, blastickú transformáciu malobunkového lymfómu. Pravdepodobnosť môže zvyšovať predchádzajúca anamnéza určitej malignity. Dochádza k zámenám blastického NHL a HL za MTS. Absolútnu špecificitu má cytologicky jednoznačná metastatická infiltrácia. Iní autori nepopisujú klinický dopad nálezov, pravdepodobne preto, že sa jedná o osobitné cytologické/patologické pracoviská. Hematológ je súčasne morfológ aj klinik, a preto vykonáva aj využíva cytológiu imprintu LU. Pritom zohľadňuje výhody (rýchly výsledok väčšinou do druhého dňa, možnosť využiť otlačky pre genetické vyšetrenie v prípade nádoru alebo na farbenie na TBC v prípade obrazu granulomatózneho zápalu) aj nevýhody (uvedené obmedzenia nižšej diagnostickej správnosti v prípade lymfómov). Klinický onkológ starajúci sa o iné ako hematologické malignity toto vyšetrenie nevyužil.
Diagnostickú správnosť cytológie imprintov LU by mohla zvýšiť kombinácia s imunofenotypizáciou buniek časti LU pomocou prietokovej cytometrie (FC). Bola publikovaná 88% konkordancia FC a histopatológie s imunohistochémiou, v jednotlivých prípadoch bola pomocou FC určená nesprávna diagnóza reaktívnej hyperplázie namiesto HL a NHL [8]. V posledných rokoch sa záujem skôr sústreďuje na využitie aspirátu z tenkoihlovej biopsie. Využitie vyšetrenia klonality pomocou reťazcov imunoglobulínov pre NHL B-pôvodu a ešte výraznejšie aberantných fenotypov pre NHL T-pôvodu a pre ich diferenciálnu diagnostiku voči nemalígnym ochoreniam má svoje obmedzenia [9, 10]. Navyše falošne negatívne výsledky pri identifikácii lymfómovej infiltrácie prostredníctvom FC sa pripisujú parciálnej infiltrácii LU, nízkej bunečnatosti, chybám pri spracovaní, fragilite, apoptóze či nekróze veľkých nádorových buniek a ich umiestneniu mimo vyšetrovanej oblasti. Pri difúznom veľkobunkovom lymfóme B-pôvodu bohatom na T bunky a histiocyty (THRLBCL) často FC identifikuje len reaktívnu komponentu [8, 9]. Jediný prípad THRLBCL v materiáli autorov bol hodnotený ako nádorová, najskôr blastická lymfómová infiltrácia, pričom boli prítomné aj lymfocyty a retikulárne bunky. Aj v prípadoch ostatných, histologicky verifikovaných DLBCL boli prítomné lymfocyty v rôznom, aj hojnom počte. Autori nemali ambíciu určovať na základe morfológie presnú diagnózu, z blastických lymfómov sa snažili vyčleniť len Burkittov lymfóm. V časti prípadov FC v kombinácii s cytológiou nie je dostatočná pre typizáciu a vyžaduje použitie imunocytochémie [8, 9,10].
ZÁVER
Až na absolútnu špecificitu cytologicky jednoznačnej metastatickej infiltrácie nemá cytológia absolútnu diagnostickú presnosť v identifikovaní typu malignity. Výsledok možno využiť pre včasnejší „staging“. Pri znalosti anamnézy predchádzajúcich nádorov môže klinik, a to pravdepodobne hlavne hematológ, v nevyhnutnom prípade pred obdržaním výsledku histológie použiť výsledok pre podanie cytoreduktívnej predfázy alebo pulzu kortikosteroidov, prípadne aj začatie chemoterapie. Umožní to zvrátiť závažné komplikácie ochorenia, ako je útlak orgánov (útlak dýchacích ciest, ileus, obštrukčný ikterus, útlak odvodných močových ciest, tlak na cievy, tlak na nervy), ale aj predísť pri veľmi agresívnych nádoroch progresívnemu znižovaniu stavu výživy a výkonnosti, čo by mohlo obmedziť použitie intenzívnej protinádorovej liečby po stanovení definitívnej diagnózy.
Podiel autorov na príprave rukopisu
WA – pôvodné odčítanie cytológie, porovnanie cytológie s histológiou, opätovné hodnotenie cytológií, ktoré boli diskrepantné s histologickým záverom, štatistika, fotodokumentácia, zostavenie písomnej podoby práce.
HJ – pomoc s vyhľadaním cytologickým nálezov, vyhľadanie histologických nálezov.
PL, SP, BT, MJ – patológovia, hodnotenie histológie LU/tumoru, ktoré bolo použité ako referenčné.
Čestné prehlásenie
Autori práce prehlasujú, že v súvislosti s témou, vznikom a publikáciou tohoto článku nie sú v strete záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou.
Poďakovanie
Ďakujem laborantom nášho pracoviska, menovite Jane Pavlíčkovej a Alene Vaníkovej, bez ktorých dôslednej práce by táto štúdia nevznikla. Ďalej ďakujem Martinskému bioptickému centru, pracovisko Banská Bystrica, za pomoc s vytvorením fotodokumentácie tejto štúdie.
Doručeno do redakce dne 10. 12. 2018.
Přijato po recenzi dne 30. 1. 2019.
MUDr. Alexander Wild
Hematologické oddelenie
FNsP F. D. Roosevelta
Nám. L. Svobodu 1
975 17 Banská Bystrica
Slovenská republika
e-mail: awild@nspbb.sk
Zdroje
1. Arif SH, Hassan MJ, Jain M, Verna AK, Naim M. Role of imprint cytology in diagnosis of lymph node lesions. Indian Med Gazette 2011;145(10):385–390.
2. Molyneuax AJ, Attanoos RL, Coghill SB. The value of lymph node imprint cytodiagnosis – an assessment of inter observer agreement and diagnostic accuracy. Cytopathol 1997;8(4):256–264.
3. Tiwari G, Rane V D, Bansal R, Sharma S, Khare A. Touch imprint cytology and its correlation with histomorphologic findings in lymphadenopathies. Int J Curr Res 2015;7(4): 15078–15080.
4. Luqman M, Jafarey NA. Imprint cytology of lymph nodes 1980;30(12):266–267.
5. Al-Mulhim AS, Al-Ghamdi AMA, Al-Marzooq YM, et al. The role of fine needle aspiration cytology and imprint cytology in cervical lymphadenopathy. Saudi Med J 2004;25(7):862–865.
6. Patra SP, Bhattacharya N, Maugal S. FNAC, Imprint cytology and histopathology for diagnosing diseases of lymph node. J Cytol 2003;20(3):124–128.
7. Kundu P, Pathak D, Mondal S, Debnath M, Saha S, Saha T K. Histopathological correlation of lymph nodes imprints. Journal of dental and medical sciences 2015;14(11):101–105.
8. El-Sayed AM, El-Borai MH, Bahnassy AA, El-Gerzawi SMS. Flow cytometric immunophenotyping (FCI) of lymphoma: correlation with histopathology and immunohistochemistry. Diag Pathol 2008;3 : 43.
9. Cozzolino I, Rocco M, Villani G, Picardi M. Lymph node fine-needle cytology of non-Hodgkin lymphoma: diagnosis and classification by flow-cytometry. Acta Cytol 2016;60(4):302–314.
10. Barroca H, Marques C. A basic approach to lymph node and flow cytometry fine-needle cytology. Acta Cytol 2016;60(4):284–301.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Corrigendum
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2019 Číslo 2- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Studium klonality akutní myeloidní leukemie na myších modelech
- Corrigendum
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
- Hodnocení kostního obratu a významu deficitu vitaminu D u pacientů s myelofibrózou
- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Změny v epidemiologii invazivních mykotických infekcí v českých a slovenských hematoonkologických centrech v letech 2005–2017: analýza dat FIND
- Sympozium G3 2019 – „Umělá inteligence – budoucnost onko-hematologie“
- Nový výbor Společnosti pro transfuzní lékařství
- Sekce pro hemostázu a trombózu České hematologické společnosti
- Cena České hematologické společnosti za nejlepší původní vědeckou práci a/nebo monografii v oboru hematologie v roce 2018
- Životní jubileum paní primářky MUDr. Libuše Novosadové
- Interní, hematologická a onkologická klinika LF a FN Brno, v roce 2019 slaví 30 let od založení. Vyprávění o jejím zakladateli – profesorovi Jiřím Vorlíčkovi
- Zemřel MUDr. Josef Časta (28. 4. 1931 – 4. 2. 2019)
- 28. června 2019 nás opustila MUDr. Ema Alena Kubíková-Kouřilová, CSc.
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




