-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Změny v epidemiologii invazivních mykotických infekcí v českých a slovenských hematoonkologických centrech v letech 2005–2017: analýza dat FIND
Changing epidemiology of invasive mould infections at Czech and Slovak haematological institutions from 2005 to 2017: analysis of the FIND
Background: Invasive fungal diseases are life-threatening infectious complications affecting haematological patients and their early diagnosis can contribute to improved survival of affected patients. In the last years, the patterns of invasive fungal infections have changed mainly due to the selection pressure of antifungals.
Material and Methods: The aim of our analysis to evaluate retrospectively changes in the epidemiology of invasive aspergillosis, invasive candidiasis and rare mycoses in haematological patients at Czech and Slovak haematological centres from 2005–2017. The observed period was divided into: 2005–2012 (1st period) and 2013–2017 (2nd period). Data entered into FIND – Fungal INfection Database (according to the EORTC/MSG criteria from 2008) was used for the analysis. The total consumption of posaconazole and micafungin was expressed in relative annual consumption per 1000 bed-days.
Results: A total of 349 invasive aspergillosis, 168 invasive candidiasis and 102 rare mycoses (65.7% invasive zygomycosis) were documented. The incidence of aspergillosis increased from 2005 to 2012, with a declining trend since 2013 (the average number of cases per centre in 2005–2012–2017 was: 1.1–3.6–0.7). The incidence of aspergillosis in high risk patients decreased (2005 – 72.7%, 2013 – 42.4%, 2017 – 18.2%). Total consumption of posaconazole has been on the increase since 2005 (rDDD in 2005-2010-2015 : 0-831-1043). The total number of invasive candidiasis and rare mycoses remained unchanged over the years. The Candida albicans vs. non-albicans ratio remained unchanged in the 1st and 2nd periods (26.1% vs. 29.1%, p=0.732). There was a significant increase in rare mycoses in breakthrough infections on posaconazole or voriconazole prophylaxis compared to non-breakthrough infections (35.3% vs. 14.4%).
Conclusion: Based on our analysis, we have confirmed a decrease in the incidence of invasive aspergillosis from 2013 after the introduction of routine antifungal prophylaxis with posaconazole in high-risk patients. The ratio of high-risk patients with invasive zygomycosis has also decreased. Patients on posaconazole or voriconazole prophylaxis have changed the spectrum of infections in favour of rare pathogens.
Keywords:
invasive fungal infection – haematological patient – acute leukaemia
Autori: B. Weinbergerová 1; T. Kabut 1; I. Kocmanová 2; L. Drgoňa 3; M. Kouba 4; M. Hričinová 4; J. Gabzdilová 5; T. Guman 5; V. Petečuková 6; J. Novák 6; K. Forsterová 7; J. Haber 7; B. Žiaková 8; E. Bojtárová 8; A. Zavřelová 9; M. Karas 10; V. Chrenkova 11; P. Sedláček 11; B. Tkáčiková 12; P. Múdrý 12; N. Mallátová 13; P. Timr 13; A. Kolenova 14; D. Tanušková 15; J. Horáková 15; M. Navrátil 16; J. Chudej 17; J. Sokol 17; M. Rolencová 1; P. Žák 9; P. Cetkovský 4; J. Mayer 1,18; Z. Ráčil 1,18
Pôsobisko autorov: Interní hematologická a onkologická klinika LFMU a FN Brno 1; Oddělení klinické mikrobiologie FN Brno 2; Klinika onkohematológie, NOÚ a LF UK Bratislava 3; Ústav hematologie a krevní transfuze Praha 4; Klinika hematológie a onkohematológie, UN LP Košice 5; Interní hematologická klinika, FNKV Praha 6; I. interní klinika-klinika hematologie, VFN Praha 7; Klinika hematológie a transfuziológie, UN Bratislava 8; IV. interní hematologická klinika, FN Hradec Králové 9; Hematologicko-onkologické oddělení, FN Plzeň 10; Klinika dětské hematologie a onkologie, 2. LF UK a FN Motol, Praha 11; Klinika dětské onkologie, LFMU a FN Brno 12; Dětské oddělení, Nemocnice České Budějovice 13; Klinika detskej hematológie a onkológie, DFNsP Bratislava 14; Transplantačná jednotka kostnej drene, KDHaO, DFNsP Bratislava 15; Klinika hematoonkologie, FN Ostrava 16; Klinika hematológie a transfuziológie, JLF a UN Martin 17; CEITEC – Central European Institute of Technology, Masaryk University Brno 18
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 2, p. 186-196.
Kategória: Původní práce
Súhrn
Úvod: Invazivní mykotické infekce představují život ohrožující infekční komplikace u hematologických pacientů a jejich časná diagnostika může přispět ke zlepšení přežívání těchto nemocných. Jejich zastoupení se v posledních letech mění zejména vlivem selekčního tlaku antimykotik.
Materiál a metodika: Cílem naší práce bylo retrospektivní zhodnocení změn v epidemiologii invazivních aspergilóz, invazivních kandidóz a vzácných mykóz u hematologických nemocných v českých a slovenských hematoonkologických centrech v letech 2005–2017. Sledované období bylo rozděleno na 1. období (2005–2012) a 2. období (2013–2017). K analýze byla použita data zadaná do databáze FIND (Fungal INfection Database) na základě diagnostických EORTC/MSG kritérií z roku 2008. Spotřeba vybraných antimykotik byla vyjádřena v relativní roční spotřebě na 1 000 lůžkodní.
Výsledky: Celkem bylo zdokumentováno 349 invazivních aspergilóz, 168 invazivních kandidóz a 102 vzácných mykóz (z toho 65,7 % invazivních zygomykóz). Výskyt invazivní aspergilózy vzrůstal v 1. období, přičemž od roku 2013 nastal naopak klesající trend (průměrný počet případů na centrum v letech 2005–2012–2017 : 1,1–3,6–0,7). Snížilo se zastoupení invazivních aspergilóz u vysoce rizikových pacientů (2005 – 72,7 %; 2010 – 40,7 %; 2017 – 18,2 %). Celková spotřeba posakonazolu rostla od roku 2005 (rDDD v roce 2005–2010–2015 : 0–831–1043). Celkový počet invazivních kandidóz a vzácných mykóz zůstal v letech neměnný. Zastoupení druhů Candida albicans vs. non-albicans se také v 1. a 2. období nelišilo (26,1 % vs. 29,1 %; p = 0,732). U průlomových infekcí na profylaxi posakonazolem nebo vorikonazolem se signifikantně častěji vyskytovaly vzácné patogeny ve srovnání s infekcemi vzniklými u pacientů bez této profylaxe (35,3 % vs. 14,4 %; p = 0,000).
Závěr: Na základě analýzy byl potvrzen klesající výskyt invazivních aspergilóz dominantně v souvislosti se zavedením rutinní antimykotické profylaxe posakonazolem u vysoce rizikových pacientů. Zastoupení zygomykózy u těchto nemocných také kleslo. U pacientů na profylaxi posakonazolem nebo vorikonazolem došlo ke změně spektra infekcí ve prospěch vzácných patogenů.
Klíčová slova:
invazivní mykotické infekce – hematologický pacient – akutní leukemie
ÚVOD
Invazivní mykotické infekce (IMI) představují život ohrožující komplikace u imunokompromitovaných nemocných. Za nejvíce rizikové pro rozvoj IMI jsou považováni pacienti s hematologickými malignitami, především s akutní leukemií (AL) v indukci a reindukci a nemocní podstupující alogenní transplantaci hematopoetických kmenových buněk (human stem cell tranplantation, HSCT) [1–3]. Výsledky SEIFEM studie uvádějí 4,6% incidenci IMI u hematologických pacientů, přičemž u pacientů s akutní myeloidní leukemií (AML) 12% [4].
Historicky nejčastější kauzální patogeny IMI představovaly kvasinky, především Candida spp. [2]. Nicméně nedávné epidemiologické studie jasně ukázaly, že se invazivní kandidové infekce pravděpodobně díky účinné antifungální profylaxi v současnosti vyskytují u hematologických pacientů již s nízkou frekvencí [5] a vlivem faktorů prostředí dochází ke změně spektra kandidových infekcí ve prospěch kmenů Candida non-albicans [4, 6–9]. Na druhé straně se v posledních letech do popředí dostaly IMI způsobené vláknitými houbami, zejména rodem Aspergillus spp. [4]. Na základě těchto pozorování byly publikovány studie určující rizika rozvoje IMI u hematologických nemocných [4, 10–12]. Navzdory zlepšení diagnostiky a léčby IMI zůstává úmrtnost s nimi spojená stále vysoká a infekční komplikace představují i nadále hlavní příčinu úmrtí hematologických pacientů, a navyšují tak náklady na péči o tyto nemocné [13, 14]. Epidemiologické studie posledních let potvrzují fakt recentně klesajícího trendu incidence invazivní aspergilózy (IA) a současný nárůst výskytu mukormykózy a opět i kandidových IMI u hematologických pacientů [15].
U hematologických pacientů ve vysokém riziku rozvoje IMI je stále častěji používána antimykotická profylaxe azoly s účinkem na vláknité houby (posakonazol, POSA nebo vorikonazol, VORI) s cílem snížení pravděpodobnosti rozvoje těchto život ohrožujících infekcí [16–18]. Nicméně plošná expozice azolovým antimykotikům může vést ke zvýšení incidence rezistentních kmenů a průlomových IMI [19–21]. V literatuře bylo doposud publikováno velmi málo dat analyzujících průlomové IMI, většinou invazivních kandidóz (IK) na profylaxi flukonazolem [22–26].
Naše původní práce předkládá rozsáhlou retrospektivní analýzu epidemiologických dat týkajících se vývoje výskytu případů IMI na českých a slovenských hematologických centrech zadaných do mezinárodní databáze IMI-FIND (Fungal INfection Database).
MATERIÁL A METODIKA
Provedli jsme retrospektivní zhodnocení změn v epidemiologii IMI (invazivní aspergilózy, invazivní kandidózy a invazivních vzácných mykóz) u hematologických nemocných diagnostikovaných celkem v 15 českých a slovenských hematoonkologických centrech v letech 2005–2017. Sledované období jsme rozdělili do dvou period: 2005–2012 (1. období) a 2013–2017 (2. období) s ohledem na zavedení antimykotické profylaxe POSA do rutinní klinické praxe u vysoce rizikových pacientů. K analýze byla použita data zadaná do mezinárodní databáze IMI-FIND (Fungal INfection Database), která vznikla pod záštitou České leukemické skupiny – pro život (the Czech Leukemia Study Group – for Life, CELL) a je schválena Etickými komisemi jednotlivých zúčastněných pracovišť. Diagnóza pravděpodobné a prokázané IMI byla stanovena na základě EORTC/MSG kritérií z roku 2008 [27]. U vzácných IMI byl jako mikrobiologické kritérium uznán navíc průkaz vzácné houby pomocí diagnostiky PCR (polymerase chain reaction; polymerázové řetězové reakce). Hodnocenými parametry byly hematologické onemocnění, protinádorová léčba před diagnózou IMI a rizikové faktory IMI (neutropenie, kortikoterapie a reakce štěpu proti hostiteli). Průlomová infekce byla definována jako IMI, která se rozvinula u pacienta na antimykotické profylaxi POSA nebo VORI trvající 7 a více dní. Vývoj spotřeby POSA a mikafunginu (MIKA) definovaný jako relativní roční spotřeba na 1 000 lůžkodní (rDDD) byl analyzován v letech 2005, 2010 a 2015 souhrnně na celkem 4 velkých českých a slovenských hematologických centrech-IHOK FN Brno, ÚHKT Praha, 4. interní klinika FN Hradec Králové a NOÚ Bratislava. Léčebná odpověď byla hodnocena na základě EORTC/MSG kritérií z roku 2008 [28]. Statistické zhodnocení dat bylo provedeno pomocí Fišerova exaktního testu. Spojité proměnné byly porovnány Mannovým--Whitneyovým U testem. Pro všechny analýzy byla použita jako úroveň statistické významnosti α = 0,05. Práce byla podpořena Českou leukemickou skupinou – pro život (CELL), grantem MUNI/A/1105/2018 a grantem MZ ČR – RVO (FNBr 65269705).
VÝSLEDKY
1. Invazivní aspergilóza
Analyzovaný soubor zahrnuje celkem 258 (73,9 %) pravděpodobných a 91 (26,1 %) jistých IA. Kompletní charakteristika souboru je uvedena v tabulce 1. Medián věku pacientů v době diagnózy IA byl stacionární v obou sledovaných obdobích – 58 let (min-0,4; max-87). Od roku 2013 vzrostl podíl pravděpodobných IA v porovnání s 1. obdobím (81,6 % vs. 69,1 %; p = 0,009). Protrahovaná a hluboká neutropenie v době diagnózy IA byla identifikována jako frekventní rizikový faktor u 251 (71,9 %) případů. Ve 2. sledovaném období kleslo zastoupení pacientů s reakcí štěpu proti hostiteli (graft versus host disease, GvHD) po alogenní HSCT před diagnózou IA (8,9 % vs. 1,5 %; p = 0,005). Celkem 46 pacientů (13,2 %) mělo průlomovou IA na antimykotické profylaxi POSA nebo VORI. Nejčastěji byl v 1. linii cílené antimykotické léčby ve 229 případech (78,2 %) použit VORI v monoterapii nebo kombinaci. Celková léčebná odpověď po 1. linii cílených antimykotik byla dosažena u 47,4 % případů. Celková úmrtnost ve 3 měsících od diagnózy IA byla 43,3 %, přičemž klesá ve 2. sledovaném období (47,4 % vs. 36,8 %; p = 0,060). Pacienti umírají do třetího měsíce po stanovení diagnózy převážně v souvislosti s IA (84,1 %).
Tab. 1. Charakteristika souboru pacientů s invazivní aspergilózou 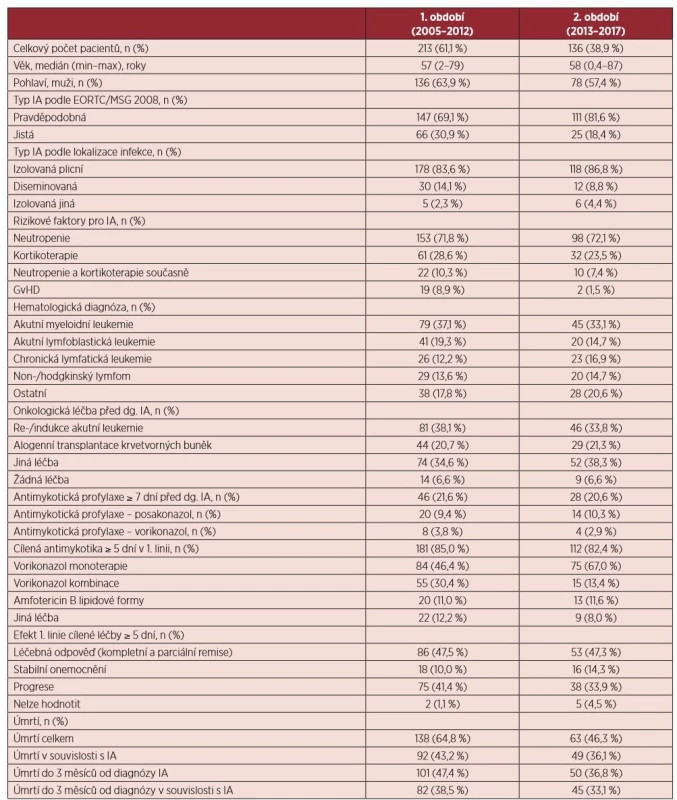
IA – invazivní aspergilóza; EORTC/MSG – European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group; GvHD – Graft versus host disease Výskyt IA vzrůstal v 1. období v letech 2005–2012. Od roku 2013 dochází k poklesu incidence IA dominantně v souvislosti se zavedením profylaxe POSA do rutinní klinické praxe u vysoce rizikových pacientů s AML a kortikoid-rezistentních pacientů s GvHD po alogenní HSCT (celkový počet případů IA v letech 2005-2012-2017 byl: 11-51-11; průměrný počet případů na centrum v letech 2005-2012-2017 byl: 1,1-3,6-0,7) (graf 1). Celková spotřeba POSA a MIKA dohromady na 4 velkých českých a slovenských hematologických centrech od roku 2005 stoupá (POSA: rDDD v roce 2005-2010-2015 : 0-831-1043; MIKA: rDDD v roce 2005-2010-2015 : 15-228-290) (graf 1). Přičemž data týkající se výskytu IA na těchto 4 centrech kopírují již zmíněný trend (celkový počet případů IA v letech 2005–2012–2017 byl: 8–21–6). Ve sledovaném období klesá zastoupení případů IA u pacientů s AML v indukci či reindukci a pacientů s GvHD po alogenní HSCT (2005 – 72,7 %; 2010-40,7 %; 2015 – 24,3 % a 2017 – 18,2 %) (graf 2). Zastoupení pacientů s akutní lymfoblastickou leukemií (ALL) v indukci či reindukci vykazuje také mírně klesající tendenci (viz graf 2).
Graf 1. Vývoj celkového počtu invazivních mykotických infekcí a spotřeby posakonazolu a mikafunginu v letech 2005–2017
Pozn.: spotřeba POSA a MIKA souhrnně celkem ve 4 hematologických centrech IMI – invazivní mykotické infekce; rDDD – relativní roční spotřeba na 1 000 lůžkodní; POSA – posakonazol; MIKA – mikafungin; spotřeba antimykotik vyjádřená jako logaritmická spojnice trendu
Graf 2. Vývoj zastoupení případů invazivní aspergilózy u pacientů s AML indukci/reindukci a GvHD po alogenní HSCT v letech 2005–2017
AML – akutní myeloidní leukemie; GvHD – graft versus host disease; HSCT – hematopoietic stem cell transplantation
2. Invazivní kandidóza
Celkem bylo zdokumentováno 168 jistých IK (85,1 % kandidemií). Kompletní charakteristika souboru je uvedena v tabulce 2. Zavedený centrální žilní katétr a protrahovaná a hluboká neutropenie byly identifikovány jako nejčastější rizikové faktory u 88,1 % a 70,8 % případů. Počet případů s antimykotickou profylaxí v době diagnózy IK je stacionární v obou obdobích (47,8 % vs. 46,1 %; p = 0,877). V profylaxi dominuje použití flukonazolu u 42,5 % případů IK. Pouze 11 pacientů (6,6 %) mělo průlomovou IK na antimykotické profylaxi POSA nebo VORI. Nejčastějšími cílenými antimykotiky v 1. linii byly echinokandiny (49,1 %). Celková léčebná odpověď byla dosažena u 73,8 % případů. Celková úmrtnost ve 3 měsících od diagnózy IK byla 32,1 % a signifikantně se nemění ve sledovaných obdobích. Zhruba polovina pacientů zemře do třetího měsíce v souvislosti s IK (53,7 %).
Tab. 2. Charakteristika souboru pacientů s invazivní kandidózou 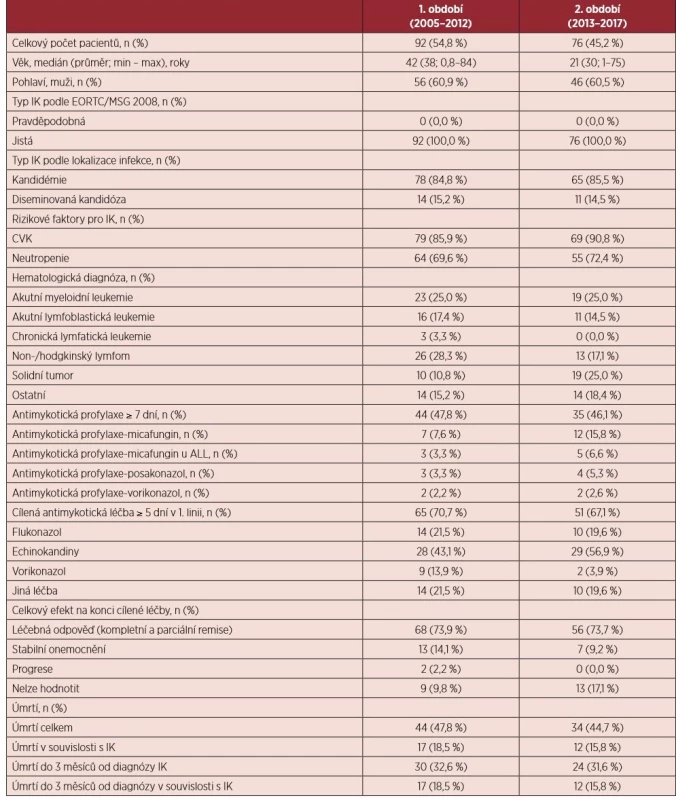
IK – invazivní kandidóza; EORTC/MSG – European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group; CVK – centrální venózní katétr; ALL – akutní lymfoblastická leukemie Celkový počet IK v jednotlivých letech zůstává neměnný (průměrný počet případů na centrum a rok: 1,3) – viz graf 1). Signifikantně stoupá relativní zastoupení pacientů se solidním tumorem (1. vs. 2. období: 10,8 % vs. 25,0 %; p = 0,040). Zastoupení druhů Candida albicans vs. non-albicans vykazuje v 1. i 2. období obdobnou frekvenci (26,1 % vs. 29,1 %; p = 0,732). U pacientů se solidním tumorem jsou signifikantně častěji zastoupeny kmeny Candida albicans oproti pacientům s hematologickými malignitami (51,4 % vs. 27,8 %; p < 0,007).
3. Vzácné invazivní mykózy
Celkem bylo zdokumentováno 24 pravděpodobných a 78 prokázaných vzácných mykóz, dominantně invazivních zygomykóz (IZ; 65,7 %). Podrobná charakteristika souboru je uvedena v tabulce 3. Medián věku pacientů byl 41 let (min-0,8; max-72). V období od roku 2013 narůstá podíl pravděpodobných vzácných mykóz (39,5 % vs. 11,9 %; p = 0,002) a izolovaných plicních forem (41,9 % vs. 22,0 %; p = 0,049). Protrahovaná a hluboká neutropenie byla identifikována jako frekventovaný rizikový faktor (84,3 % případů). Antimykotickou profylaxi POSA mělo 11,9 % případů IZ. Celkem 31 pacientů (30,4 %) mělo průlomovou vzácnou IMI na antimykotické profylaxi POSA nebo VORI. Nejčastěji byly v 1. linii cílené antimykotické léčby IZ použity amphotericin B lipidový komplex případně v kombinaci s POSA (63,4 % případů). Celková léčebná odpověď byla dosažena u 41,8 % IZ. Celková úmrtnost ve 3 měsících od diagnózy vzácné IMI byla 42,2 % a signifikantně se ve sledovaných obdobích neliší, téměř ve všech případech v souvislosti se vzácnou IMI (97,7 %).
Tab. 3. Charakteristika souboru pacientů se vzácnou invazivní mykózou 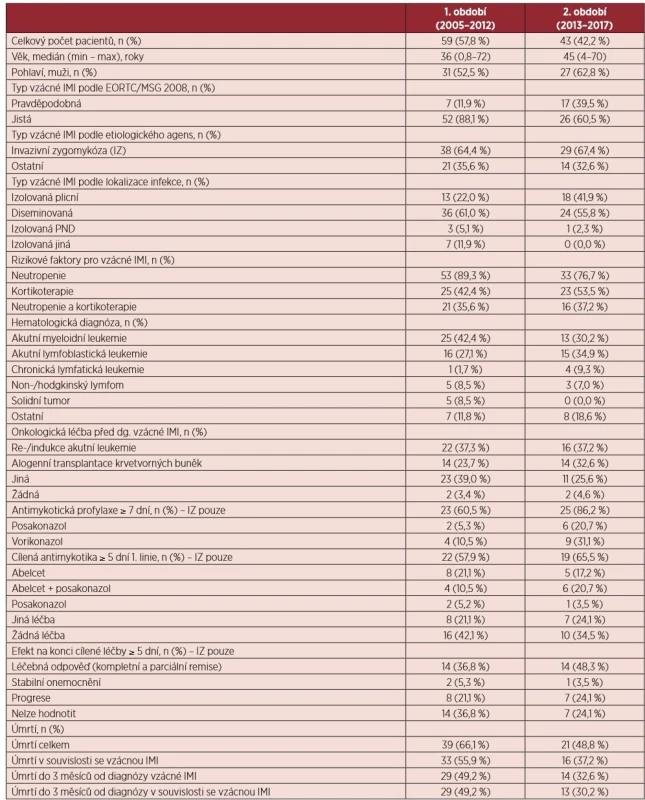
IMI – invazivní mykotická infekce; EORTC/MSG – European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group; IZ – invazivní zygomykóza Celkový počet vzácných IMI se v jednotlivých letech neměnil (průměrný počet případů na centrum a rok: 0,9) – viz graf 1. V 1. i 2. období dominuje IZ (64,4 % a 67,4 %; p = 1,0). Zastoupení pacientů se vzácnou IMI a AML v indukci nebo reindukci klesá (graf 3).
Graf 3. Vývoj zastoupení případů se vzácnou IMI u pacientů s AML v indukci/reindukci v letech 2005-2017
AML – akutní myeloidní leukemie; IMI – invazivní mykotické infekce
4. Průlomové invazivní mykotické infekce
Zastoupení jednotlivých typů IMI u 88 (14,2 %) průlomových infekcí na POSA nebo VORI vs. 541 (85,8 %) infekcí bez antimykotické profylaxe je zobrazeno v grafu 4. U průlomových IMI jsou častěji zastoupeny vzácné mykózy (67,7 % zygomykózy) ve srovnání s infekcemi bez profylaxe POSA nebo VORI (35,3 % vs. 14,4 %; p = 0,000). Naopak IK a IA jsou zastoupeny s větší frekvencí u IMI bez profylaxe oproti průlomovým IMI (IK: 29,0 % vs. 12,5 %; p = 0,001; IA: 56,0 % vs. 52,2 %; p < 0,00001).
Graf 4. Zastoupení jednotlivých typů IMI u pacientů bez profylaxe posakonazolem nebo vorikonazolem a průlomových infekcí na profylaxi posakonazolem nebo vorikonazolem
IMI – invazivní mykotické infekce; POSA – posakonazol; VORI – vorikonazol
DISKUSE
V posledních dekádách dochází ke změnám v incidenci IMI u hematologických pacientů jako důsledek změn v protinádorové léčbě a dalších hostitelských faktorech, zlepšení diagnostiky a zavedení nových antimykotik do klinické praxe [4, 5, 9, 15, 29–32]. Naše retrospektivní analýza předkládá vývoj epidemiologie IMI na českých a slovenských hematoonkologických centrech a hodnotí faktory ovlivňující spektrum kauzálních patogenů a další epidemiologické parametry.
V současné době publikovaná data potvrzují souvislost používání antimykotické profylaxe se změnou spektra IMI a celkovým poklesem jejich výskytu u hematologických pacientů. Studie sekčních nálezů hematologických nemocných potvrdila klesající incidenci IA a současný nárůst výskytu mukormykózy a kandidových IMI [15]. Chamilos et al. publikovali 30% prevalenci IMI zachycených v sekčních nálezech u hematologických nemocných v letech 1989–2003 [29]. Následně stejný tým publikoval v letech 2004–2008 signifikantní pokles prevalence IMI na 19 % [15]. Podobně pozorujeme v našem souboru od roku 2013 klesající trend výskytu IMI, respektive IA, s relativním nárůstem zastoupení IK a vzácných IMI. Výskyt IA nejprve narůstal do roku 2013 s následným poklesem pravděpodobně dominantně v souvislosti s rutinním zavedením profylaxe POSA do klinické praxe u vysoce rizikových hematologických pacientů. Zlepšení diagnostiky IA pomocí časného sérologického markeru, galaktomananu, způsobilo signifikantní nárůst podílu pravděpodobných forem IA oproti jistým [33]. Celkový počet vzácných IMI a IK se v našem souboru v letech nemění. Roste zastoupení pravděpodobných a izolovaných plicních forem vzácných IMI dominantně v souvislosti se zavedením diagnostiky hub pomocí PCR z BAL do rutinní klinické praxe v posledních letech.
Za nejvíce rizikové pro rozvoj IMI jsou považováni pacienti s hematologickými malignitami, především s akutní leukemií v indukci a reindukci a nemocní podstupující alogenní HSCT [1–3, 34]. Randomizovaná multicentrická studie Cornelyho et al. potvrdila signifikantní benefit antimykotické profylaxe POSA u vysoce rizikových neutropenických pacientů s AML v souvislosti se snížením incidence IMI a jejich mortality [16]. Následně byla pro vysokou úroveň důkazu profylaxe POSA u vysoce rizikových pacientů doporučena v mezinárodních guidelines [35–37]. Tento fakt podpořila i prospektivní studie skupiny SEIFEM, která prokázala snížení incidence IMI u 881 pacientů s AML po indukci na profylaxi POSA [38]. Podobně naše data ukazují klesající trend incidence IA a vzácných IMI u vysoce rizikové skupiny pacientů s akutní leukemií v indukci či reindukci a GvHD po alogenní HSCT ve sledovaném období. Jedním z možných faktorů vysvětlujících tento fakt může být právě plošné pokrytí vysoce rizikových nemocných antimykotickou profylaxí POSA, případně pacientů s ALL v indukci či reindukci profylaxí MIKA. Podobné výsledky týkající se nízké incidence (4,1 %) průlomových IMI u 49 pacientů s ALL v indukci na profylaxi MIKA uvedli ve svém abstraktu Kabut et al. [39].
Oproti literárním datům se v případě IK zastoupení kmenů C. albicans vs. non-albicans v naší studii v letech nemění [4, 6–9]. Tento fakt může být dán kromě jiných faktorů vlivem vyššího relativního zastoupení flukonazolu v profylaxi u vysoce rizikových pacientů v 1. období oproti 2. období. Chyba malých čísel se také může podílet na odlišném výsledku oproti publikovaným údajům. V souladu s publikovanými daty jsme u pacientů s IK a solidním tumorem signifikantně častěji zachytili kmeny Candida albicans v porovnání s pacienty s hematologickými malignitami (51,4 % vs. 27,8 %; p < 0,007). Vyšší incidence C. non-albicans kmenů u pacientů s hematologickými malignitami se převážně přisuzuje frekventovanějšímu používání profylaxe flukonazolem u těchto nemocných [40].
Lamoth et al. publikovali retrospektivní analýzu hodnotící 24 průlomových mikrobiologicky dokumentovaných IMI na profylaxi POSA nebo VORI a 66 IMI bez této profylaxe u hematologických nemocných a pacientů po transplantaci solidního orgánu [26]. Prokázali zvýšení výskytu „non-aspergilových“ vláknitých hub u průlomových infekcí vs. IMI bez profylaxe POSA nebo VORI (76 % vs. 44 %; p = 0,003) se signifikantním nárůstem azol-rezistentních kmenů u průlomových IMI. Podobně v naší práci průlomové IMI na POSA nebo VORI byly signifikantně s vyšší frekvencí způsobeny vzácnými patogeny (nejčastěji IZ) v porovnání s IMI bez profylaxe POSA nebo VORI (35,3 % vs. 14,4 %; p = 0,000). Naopak IK a IA byly u průlomových IMI zastoupeny v signifikantně nižší frekvenci.
Naše studie je zatížena limitacemi včetně jejího retrospektivního multicentrického designu a možným rizikem nekonzistentních postupů v diagnostice IMI.
ZÁVĚR
Naše analýza potvrdila klesající trend výskytu IA od roku 2013 dominantně u vysoce rizikové skupiny hematologických pacientů s velkým podílem zavedení rutinní antimykotické profylaxe POSA a MIKA u těchto nemocných. Zastoupení vysoce rizikových pacientů s IZ také v posledních letech klesá. U pacientů na profylaxi POSA nebo VORI dochází ke změně spektra kauzálních patogenů průlomových IMI v relativní prospěch vzácných patogenů, dominantně IZ. Poměr kmenů C. albicans a non-albicans se v letech nemění. U hematologických nemocných se častěji vyskytují C. non-albicans kmeny s vysokým podílem vlivu antimykotické profylaxe flukonazolem, u pacientů se solidními tumory je poměr opačný.
Podíl autorů na přípravě rukopisu
BW – napsání rukopisu
BW, MR, ZR, JM – příprava analýzy
BW, TK, IK, LD, MK, MH, JG, TG, VP, JN, KF, JH, BŽ, EB, AZ, MK, VCH, PS, BT, PM, NM, PT, AK, DT, JH, MN, JCH, JS, MR, PŽ, PC, JM, ZR – diagnostika a léčba nemocných, revize rukopisu
Čestné prohlášení
BW, TK, IK, LD, MK, MH, JG, TG, VP, JN, KF, JH, BŽ, EB, AZ, MK, VCH, PS, BT, PM, NM, PT, AK, DT, JH, MN, JCH, JS, MR, PŽ, PC, JM, ZR – autoři prohlašují, že nemají žádný relevantní konflikt zájmů.
Poděkování
Práce byla podpořena Českou leukemickou skupinou – pro život (CELL), grantem MUNI/A/1105/2018 a grantem MZ ČR – RVO (FNBr 65269705).
Do redakce doručeno dne 2. 1. 2019.
Přijato po recenzi dne 8. 2. 2019.
MUDr. Barbora Weinbergerová
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: weinbergerova.barbora@fnbrno.cz
Zdroje
1. Herbrecht R, Bories P, Moulin JC, Ledoux MP, Letscher-Bru V. Risk stratification for invasive aspergillosis in immunocompromised patients. Ann N Y Acad Sci 2012;1272 : 23–30.
2. Pagano L, Akova M, Dimopoulos G, Herbrecht R, Drgona L, Blijlevens N. Risk assessment and prognostic factors for mould-related diseases in immunocompromised patients. J Antimicrob Chemother 2011;66(Suppl 1):i5–14.
3. Racil Z, Weinbergerova B, Kocmanova I, et al. Invasive aspergillosis in patients with hematological malignancies in the Czech and Slovak republics: Fungal InfectioN Database (FIND) analysis, 2005–2009. Int J Infect Dis 2013;17(2):e101–109.
4. Pagano L, Caira M, Candoni A, et al. The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica 2006;91 : 1068–1075.
5. Cornely OA, Gachot B, Akan H, et al. Epidemiology and outcome of fungemia in a cancer Cohort of the Infectious Diseases Group (IDG) of the European Organization for Research and Treatment of Cancer (EORTC 65031). Clin Infect Dis 2015;61 : 324–331.
6. Enoch DA, Yang H, Aliyu SH, Micallef C. The changing epidemiology of invasive fungal infections. MethodsMol Biol 2017;1508 : 17–65.
7. Tortorano AM, Peman J, Bernhardt H, et al. Epidemiology of candidaemia in Europe: results of 28-month European Confederation of Medical Mycology (ECMM) hospital-based surveillance study. Eur J Clin Microbiol Infect Dis 2004;23 : 317–322.
8. Wisplinghoff H, Ebbers J, Geurtz L, et al. Nosocomial bloodstream infections due to Candida spp. in the USA: species distribution, clinical features and antifungal susceptibilities. Int J Antimicrob Agents 2014;43 : 78–81.
9. Haber J, Ráčil Z, Mayer J, Mallátová N, Kouba M, Sedláček P, et al. Léčba invazivní kandidózy – doporučení odborných společností. Transfuze Hematol dnes 2009;15(1):7–16.
10. Kontoyiannis DP, Marr KA, Park BJ, et al. Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients, 2001–2006: overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database. Clin Infect Dis 2010;50 : 1091–1100.
11. Omer AK, Ziakas PD, Anagnostou T, et al. Risk factors for invasive fungal disease after allogeneic hematopoietic stem cell transplantation: a single center experience. Biol Blood Marrow Transplant 2013;19 : 1190–1196.
12. Girmenia C, Raiola AM, Piciocchi A, et al. Incidence and outcome of invasive fungal diseases after allogeneic stem cell transplantation: a prospective study of the Gruppo Italiano Trapianto Midollo Osseo (GITMO). Biol Blood Marrow Transplant 2014;20 : 872–880.
13. Ananda-Rajah MR, Cheng A, Morrissey CO, et al. Attributable hospital cost and antifungal treatment of invasive fungal diseases in high-risk hematology patients: an economic modeling approach. Antimicrob Agents Chemother 2011;55 : 1953–1960.
14. Heimann SM, Vehreschild MJ, Cornely OA, et al. A cost and resource utilization analysis of micafungin bridging for hemato-oncological high-risk patients undergoing allogeneic stem cell transplantation. Eur J Haematol 2015;94 : 526–531.
15. Lewis RE, Cahyame-Zuniga L, Leventakos K, et al. Epidemiology and sites of involvement of invasive fungal infections in patients with haematological malignancies: a 20–year autopsy study. Mycoses 2013;56 : 638–645.
16. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med 2007;356 : 348–359.
17. Neoh CF, Snell GI, Kotsimbos T, et al. Antifungal prophylaxis in lung transplantation - a world-wide survey. Am J Transplant 2011;11 : 361–366.
18. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med 2007;356 : 335–347.
19. Verweij PE, Chowdhary A, Melchers WJ, Meis JF. Azole resistance in Aspergillus fumigatus: can we retain the clinical use of mold-active antifungal azoles? Clin Infect Dis 2016;62 : 362–368.
20. van der Linden JW, Arendrup MC, Melchers WJ, et al. Azole resistance of Aspergillus fumigatus in immunocompromised patients with invasive aspergillosis. Emerg Infect Dis 2016;22 : 158–159.
21. Wang E, Farmakiotis D, Yang D, et al. The ever-evolving landscape of candidaemia in patients with acute leukaemia: non-susceptibility to caspofungin and multidrug resistance are associated with increased mortality. J Antimicrob Chemother 2015;70 : 2362–2368.
22. Auberger J, Lass-Flörl C, Aigner M, et al. Invasive fungal breakthrough infections, fungal colonization and emergence of resistant strains in high-risk patients receiving antifungal prophylaxis with posaconazole: real-life data from a single-centre institutional retrospective observational study. J Antimicrob Chemother 2012;67 : 2268–2273.
23. Biehl LM, Vehreschild JJ, Liss B, et al. A cohort study on breakthrough invasive fungal infections in high-risk patients receiving antifungal prophylaxis. J Antimicrob Chemother 2016;71 : 2634–2641.
24. Corzo-León DE, Satlin MJ, Soave R, et al. Epidemiology and outcomes of invasive fungal infections in allogeneic haematopoietic stem cell transplant recipients in the era of antifungal prophylaxis: a single-centre study with focus on emerging pathogens. Mycoses 2015;58 : 325–336.
25. Lerolle N, Raffoux E, Socie G, et al. Breakthrough invasive fungal disease in patients receiving posaconazole primary prophylaxis: a 4 -year study. Clin Microbiol Infect 2014;20 : 952–959.
26. Lamoth F, Chung SJ, Damonti L, et al. Changing epidemiology of invasive mold infections in patients receiving azole prophylaxis. Clin Infect Dis 2017;64 (11):1619–1621.
27. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46 : 1813–1821.
28. Segal BH, Herbrecht R, Stevens DA, et al. Defining responses to therapy and study outcomes in clinical trials of invasive fungal diseases: Mycoses Study Group and European Organization for Research and Treatment of Cancer consensus criteria. Clin Infect Dis 2008;47(5):674–683.
29. Chamilos G, Luna M, Lewis RE, et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989–2003). Haematologica 2006;91 : 986–989.
30. Ráčil Z, Mayer J, Kocmanová I, et al. Léčba invazivní aspergilózy – doporučení odborných společností. Transfuze Hematol dnes 2009;15(1):17–24.
31. Gabzdilová J, Tóthová E, Guman T, Raffač Š, Jarčuška P. Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom. Transfuze Hematol dnes 2015;21(1):24–29.
32. Haber J, Ráčil Z. Přístupy k antimykotické terapii: od profylaxe k léčbě. Transfuze Hematol dnes 2013;19(1):39–43.
33. Weinbergerova B, Kocmanova I, Racil Z, Mayer J. Serological approaches. Methods Mol Biol 2017;1508 : 209–221.
34. Čerňan M, Szotkowski T, Kolář M, Hubáček J, Faber E. Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukemie bez použitia antibiotickej profylaxie. Transfuze Hematol dnes 2015;21(1):14–23.
35. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008;46 : 327–360.
36. Maertens J, Marchetti O, Herbrecht R, et al. European guidelines for antifungal management in leukemia and hematopoietic stem cell transplant recipients: summary of the ECIL 3-2009 update. Bone Marrow Transplant 2011;46 : 709–718.
37. Cornely OA, Böhme A, Buchheidt D, et al. Primary prophylaxis of invasive fungal infections in patients with hematologic malignancies: recommendations of the Infectious Diseases Working Party of the German Society for Haematology and Oncology. Haematologica 2009;94 : 113–122.
38. Caira M, Candoni A, Verga L, et al. SEIFEM group: Prechemotherapy risk factors for invasive fungal diseases: prospective analysis of 1,192 patients with newly diagnosed acute myeloid leukemia (SEIFEM 2010 - a multicenter study). Haematologica 2015;100 : 284–292.
39. Kabut T, Folber F, Šálek C, et al. Primární antimykotická profylaxe micafunginem, v dávce 50 mg na den, u dospělých pacientů během indukční chemoterapie akutní lymfoblastické leukemie (ALL): hodnocení z pohledu běžné klinické praxe. Transfuze Hematol dnes 2016;22(S1):133–135.
40. Wingard JR, Merz WG, Rinaldi MG, et al. Increase in Candida krusei infection among patients with bone marrow transplantation and neutropenia treated prophylactically with fluconazole. N Engl J Med 1991;325 : 1274–1277.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Corrigendum
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2019 Číslo 2- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Studium klonality akutní myeloidní leukemie na myších modelech
- Corrigendum
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
- Hodnocení kostního obratu a významu deficitu vitaminu D u pacientů s myelofibrózou
- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Změny v epidemiologii invazivních mykotických infekcí v českých a slovenských hematoonkologických centrech v letech 2005–2017: analýza dat FIND
- Sympozium G3 2019 – „Umělá inteligence – budoucnost onko-hematologie“
- Nový výbor Společnosti pro transfuzní lékařství
- Sekce pro hemostázu a trombózu České hematologické společnosti
- Cena České hematologické společnosti za nejlepší původní vědeckou práci a/nebo monografii v oboru hematologie v roce 2018
- Životní jubileum paní primářky MUDr. Libuše Novosadové
- Interní, hematologická a onkologická klinika LF a FN Brno, v roce 2019 slaví 30 let od založení. Vyprávění o jejím zakladateli – profesorovi Jiřím Vorlíčkovi
- Zemřel MUDr. Josef Časta (28. 4. 1931 – 4. 2. 2019)
- 28. června 2019 nás opustila MUDr. Ema Alena Kubíková-Kouřilová, CSc.
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



