-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současná terapie těžkých kraniocerebrálních poranění – souborný referát
Contemporary treatment of severe head injury – review article
Introduction:
Authors present current options of prevention, diagnostics and complex treatment of severe head injury.Discussion:
The need for concetration of severe head injury in well-equipped traumacentres is stressed. New trends in multimodal monitoring are outlined. It improves diagnostics and provides targeted therapy. Current guidelines of surgical treatment are presented. Special attention is paid to decompressive craniectomy.Conclusion.
Heterogenity of severe head injuries brings the need for complex and targeted treatment in traumacentres.Key words:
severe head injury, prevention, diagnostics, conservative and surgical treatment, decompressive craniectomy, multimodal monitoring.
Autori: Vladimír Přibáň 1,2; Martin Smrčka 2
Pôsobisko autorov: Department of Neurosurgery, Hospital České Budějovice, Czech Republic 1; Neurochirurgické oddělení, Nemocnice České Budějovice a. s. 1; Neurochirurgická klinika LF MU a FN Brno 2; Neurochirurgická klinika LF MU a FN Brno 2
Vyšlo v časopise: Úraz chir. 17., 2009, č.3
Věnováno nedožitým 80. narozeninám MUDr. Miloslava Pexy, emeritního přednosty traumatologického oddělení nemocnice České Budějovice.
Súhrn
Úvod:
Autoři prezentují současné možnosti prevence, diagnostiky a komplexní terapie těžkých poranění mozku.Diskuze:
Je zdůrazněna nezbytnost koncentrace těžkých poranění mozku do traumacenter s adekvátním zajištěním personálním a materiálním. Dále jsou nastíněny nové možnosti multimodální monitorace, která zpřesňuje diagnostiku a nabízí cílenou terapii. V oblasti chirurgické léčby jsou prezentovány současné guidelines. Zvláštní pozornost je věnována dekompresivní kraniektomii.Závěr:
Heterogenita těžkých poranění mozku přináší potřebu komplexní a cílené terapie v traumacentrech.Klíčová slova:
těžká poranění mozku, prevence, diagnostika, konzervativní a chirurgická léčba, dekompresivní kraniektomie, multimodální monitorace.Úvod
Chirurgická léčba mozkových poranění je nepochyb-ně nejstarším neurochirurgickým výkonem, který byl prováděn již ve starověku. Rozvoj neurochirurgie ve 20. století podmínil dostupnost včasné operační léčby poranění mozku. Operace sama však není zárukou příznivé prognózy poraněného pacienta.
V posledních desetiletích došlo k značnému pokroku v pochopení patofyziologie mozkových úrazů, a to jak v oblasti biomechaniky, tak procesů na buněčné úrovni. Přes nadějné výsledky na laboratorní úrovni však dosud nebyla nalezena „magická pilulka“, která by dokázala zabránit sekundárním destrukčním procesům mozkového poranění v klinice. Zlepšila se skokově kvalita a zároveň dostupnost diagnostiky. Dnes je téměř nepředstavitelné, že před přibližně 40 lety spočívala diagnostika v klinickém vyšetření neurologa s doporučením: „tady vrtejte“ nebo v lepším případě v doplnění klinického vyšetření angiografií.
Přesto nejsou výsledky těžkých kraniotraumat dosud uspokojivé.
Intenzita primárního inzultu je klíčová pro osud pacienta s těžkým poraněním mozku. Zde je naše šance na ovlivnění nulová. Veškeré snažení směřuje tedy k ovlivnění sekundárního postižení. Čas je klíčovým parametrem výsledku léčby. Proto podmínkou úspěchu je správná organizace práce. Ke zlepšení výsledků těžkých kraniocerebrálních poranění v posledních desetiletích přispívají: preventivní opatření, zavedení záchranného systému do přednemocniční péče, dostupnost zobrazovacích vyšetření a v neposlední řadě intenzivní perioperační péče. Multimodální monitorace na jednotce intenzivní péče – měření nitrolebního tlaku, mikrodialýza, monitorace mozkové oxygenace - ukazují nové trendy v možnostech ovlivnění sekundárního postižení mozku. Dále je důležité mít na paměti, že pacienti s těžkým poraněním mozku mají v 30–56 % zároveň extracerebrální poranění [14].
Tyto skutečnosti jasně dokazují, že péče o pacienty s těžkým poraněním mozku je práce týmová.Terapie těchto pacientů by proto měla být koncentrována do traumacenter s trvalou přítomností neurochirurga. Spolupráce intenzivisty, neurochirurga, radiologa, traumatologa, břišního chirurga, plastického chirurga, stomatochirurga, očního lékaře, lékaře ORL, hrudního chirurga, kardiochirurga, urologa a dalších specialistů dává naději na maximálně dosažitelný výsledek v této obtížné oblasti medicíny.
Epidemiologie
Poranění mozku jsou v současné době velmi závažným medicínským a společenským problémem. Incidence mozkových poranění v populaci je 2 % a má tendenci k mírnému nárůstu. Příčinou jsou narůstající dopravní nehody, dále sportovní úrazy a pády. Střelná poranění v současné době nejsou zdaleka tak častá, jako je tomu z historických důvodů v USA. Ve věkové skupině do 45 let je poranění mozku vůbec nejčastější příčinou smrti a invalidity. Mortalita v České republice v 90. letech 20. století oscilovala okolo 20/100 000 obyvatel/rok. V žebříčku onemocnění mozku jsou poranění na 2. místě za cerebrovaskulárními chorobami s incidencí 150/100 000/rok [49]. Podle americké databáze [34] jsou výsledky léčby těžkých poranění mozku následující: smrt v 30–35 %, vegetativní stav v 5 %, těžké postižení v 15 %, lehké postižení v 15–20 % a dobrý výsledek bez deficitu v 25 % případů. K podobným číslům dospěli v poslední době i rakouští autoři [46]. Středně těžká a těžká poranění mozku jsou dále spojena s až 4,5x vyšším rizikem výskytu Alzheimerovy choroby ve stáří [32]. Těžká poranění mozku jsou ve 25–45 % komplikována rozvojem intrakraniálního hematomu [6]. Z těchto dat vyplývá závažnost problematiky a snaha o systémové řešení péče o kra-niotraumata obecně.
Prevence
Preventivní opatření v posledních desetiletích přinášejí pozitivní výsledky. Jedná se o kombinaci opatření technologických, restriktivních a edukačních. Technologická opatření v automobilovém průmyslu kladou důraz na zvýšení bezpečnosti v dopravě. Patří sem zlepšení odolnosti karoserie proti nárazu, užívání airbagů a elektronických podpůrných systémů řízení. Mezi restrikční opatření patří rychlostní limity v dopravě, povinné užívání bezpečnostních pásů v automobilech a helem při jízdě na motocyklech. V neposlední řadě působí užívání helem a dalších ochranných prostředků preventivně u sportovních úrazů v cyklistice, lyžování a bruslení. Výchovné programy, jako například v USA vzniklý ThinkFirst, jsou přirozeným a nezbytným doplňkem restriktivních a technologických opatření. Objevují se data, která prokazují efektivitu těchto programů [54].
Klasifikace poranění mozku
Historická Petitova klasifikace dělí poranění mozku na otřes, kontuzi a kompresi. Poslední jednotka byla považována za indikaci k chirurgické léčbě. V současné době dělíme poranění mozku na podkladě časového faktoru na primární a sekundární. Primární poranění vznikají v okamžiku úrazu. Sekundární léze se projeví v určitém časovém odstupu od okamžiku úrazu a komplikují iniciální stav. Další dělení na morfologickém podkladě je na fokální a difuzní. Fokální poranění jsou z hlediska mechanizmu úrazu obvykle léze kontaktní. Ve velmi krátkém časovém intervalu desítek milisekund dojde k nárazu pohybujícího předmětu do hlavy, nebo naopak narazí pohybující se hlava na předmět, který je v klidovém stavu. Do skupiny fokálních primárních poranění mozku patří poranění skalpu, zlomeniny kalvy, zlomeniny lební baze, penetrující poranění, kontuze mozku, subarachnoidální krvácení a intrakraniální hematomy – epidurální, subdurální a intracerebrální. U epidurálního a subdurálního hematomu je třeba zdůraznit, že se dále uplatní sekundární vliv daný kompresí mozkové tkáně s postupným nárůstem nitrolebního tlaku. Někdy vznikne poranění mozku bez kontaktu s předmětem na základě prudkého akceleračně deceleračního pohybu. Tento mechanizmus je zodpovědný za vznik difuzního axonálního poranění [42]. Čím intenzivnější a delší je působení úrazu, tím je větší je postižení axonů. Lehké reverzibilní postižení axonů, které se může morfologicky projevit jejich zduřením, má klinický korelát v komoci. Ta je takto nejlehčí formou difúzního axonálního poranění. Při těžším postižení přerušení axonů dobíhá několik hodin až dní a bývá v nejtěžších případech doprovázeno přerušením cév v corpus callosum a mozkovém kmeni. Na proximálním i distálním konci přerušeného axonu dojde k zacelení axolemmy se současným rozšířením konců, které se nazývají Cajalovy retrakční kužely. Dochází k Wallerově degeneraci a pochopitelným výsledkem je deaferentace distálních neuronů. Nejtěžší formy difuzního axonálního poranění se klinicky projevují dlouhodobým hlubokým komatem, popřípadě přetrvávajícím vegetativním stavem. CT nález bývá s výjimkou drobných hemoragií v corpus callosum a mozkovém kmeni prakticky negativní [41, 51].
Sekundární postižení mozku, jehož výsledkem je fokální, popřípadě difuzní ischemie, může být způsobeno více faktory. Mezi systémové vlivy patří zejména hypotenze a hypoxie. Hypotenze se vyskytuje při polytraumatech a sdružených poraněních; její přítomnost zásadně zvyšuje mortalitu [23]. K hypoxii dochází při aspiraci a při poranění hrudníku. Vzhledem k zlepšení organizace přednemocniční péče o pacienty s poraněním mozku se incidence hypoxie v posledních letech snižuje. Míra vlivu hypoxie na celkový výsledek tak klesá [24].
Dalším sekundárním faktorem poranění mozku je mozkový edém. Můžeme jej schematicky rozdělit na vazogenní a cytotoxický. Vazogenní otok vzniká primárně v bílé hmotě mozku na základě přestupu tekutiny a proteinů plazmy do extracelulárního prostoru při poruše hematoencefalické bariery. Otok se může chovat expanzivně a takto být příčinou nitrolební hypertenze. Cytotoxický edém postihuje naproti tomu šedou i bílou hmotu. U úrazů mozku může navazovat po ztrátě mikrocirkulace na vazogenní edém. Zvláštní jednotkou otoku mozku je mozkové zduření (swelling, engorgement). Vzniká na základě vazoparalýzy, která vyvolá zvýšením mozkového krevního objemu nitrolební hypertenzi. Terminálně dojde k snížení perfuzního tlaku mozku a mozkové ischemii.Další klasifikace poranění mozku hodnotí tíži stavu podle závažnosti poruchy vědomí na základě Glasgowské škály [26]. Dělí poranění na lehká (GCS 15–13), střední (CCS 12–9) a těžká (GCS 8–3). Přestože tato klasifikace neříká nic o mechanizmu vzniku a patofyziologii úrazu, je nesmírně cenná. Definuje srozumitelně a jednoznačně závažnost nálezu v daném okamžiku. Navíc pravidelné skórování umožňuje zachytit dynamiku progrese nálezu a včasně terapeuticky zasáhnout. Tabulka 1 zachycuje hodnocení Glasgow Coma Scale.
Tab. 1. Hodnocení Glasgow Coma Scale 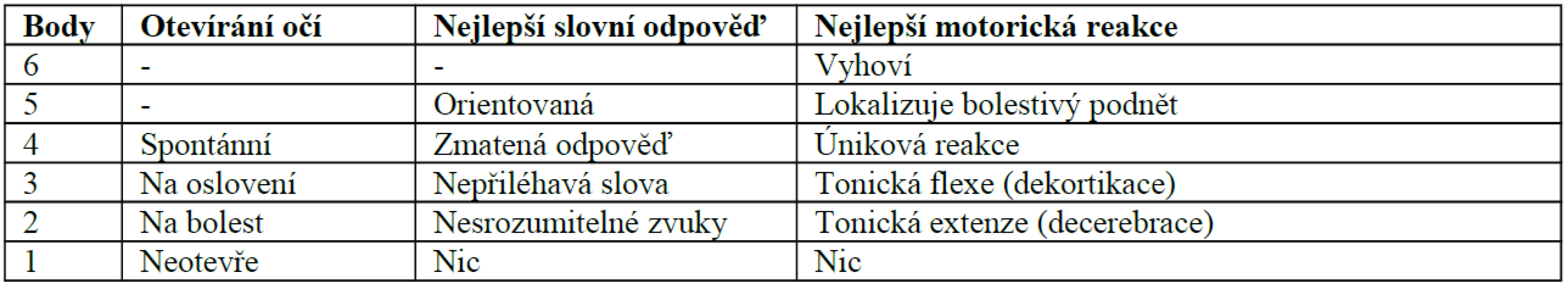
Patofyziologie
Dospělý člověk v poloze vleže má normální hodnoty nitrolebního tlaku (ICP) mezi 7–15 mm Hg. Ve vzpřímené poloze může ICP poklesnout pod hodnoty atmosférického tlaku [22]. Během kýchání, kašle nebo jiných typů Valsalvova manévru vystupuje přechodně ICP fyziologicky až k hodnotám kolem 60 mm Hg. Hodnoty ICP vyšší než 20 mm Hg trvající více jak 5 minut jsou považovány za patologické [36]. Vztah mezi objemem a tlakem uvnitř lebeční popisuje Monroe-Kellieho hypotéza. Podle této teorie je lebeční dutina rigidní schránka fixního objemu, ve které se nacházejí tři nestlačitelné kompartmenty: mozková tkáň, krev a mozkomíšní mok. Relativně malý nárůst objemu uvnitř tohoto uzavřeného prostoru (nitrolební hematom, edém) vede ke zvýšení nitrolebního tlaku. Nitrolební hypertenze je nejčastější příčinou smrti u poranění mozku [37]. Vliv objemových změn uvnitř lebeční dutiny na nitrolební tlak je závislý na stavu kompenzačních mechanizmů (přesun likvoru intraspinálně, snížení objemu krve v žilách mozku, stav elasticity mozkové tkáně). Podle tlakově-objemové křivky [29] roste po vyčerpání těchto kompenzačních mechanizmů intrakraniální tlak exponenciálně. Záleží také na rychlosti objemového přírůstku. V praxi to znamená, že náhle vzniklý úrazový hematom vede k většímu nárůstu nitrolebního tlaku, než pomalu rostoucí nádor dvojnásobného objemu. Po vyčerpání těchto mechanizmů může prudce se zvyšující nitrolební tlak způsobit posuny mozkové hmoty a vznik takzvané mozkové herniace. Pokud působí expanzivní léze unilaterálně, dochází k středočárovému posunu mozkové hmoty. Závažná je herniace temporálního laloku do tentoriální incisury (tentoriální herniace, temporální konus, laterální mezencefalický syndrom). Ta nastává typicky u velkých epidurálních a subdurálních hematomů. Jedná se o výraz dekompenzované nitrolební hypertenze. Mortalita těchto pacientů dosahuje podle některých studií 60–80 % [2]. Dalším důležitým parametrem vedle nitrolebního tlaku je mozkový perfuzní tlak (CPP) Podle mnoha autorů je udržení CPP ve fyziologických mezích důležitější v prevenci rozvoje sekundárního ischemického postižení než kontrola ICP [33]. CPP je definován jako MABP - ICP (mean arterial blood pressure - MABP = střední arteriální krevní tlak). U pacientů s pora-něním mozku se snažíme udržet CPP nad 60 mmHg. Význam CPP spočívá v tom, že má vztah k mozkovému krevnímu průtoku (cerebral blood flow - CBF). Stabilita CBF je klíčová pro mozkovou tkáň vzhledem k trvalé potřebě přísunu kyslíku a živin. Díky schopnosti autoregulace mozkových tepen je CBF stabilní v širokém rozmezí mozkového perfuzního tlaku 40–160 Hg. Podle většiny autorů je autoregulační schopnost mozkových cév narušena od 31 % [3] do téměř 100% [45] případů těžkých poranění mozku. Kromě autoregulace na základě změn systémového a mozkového perfuzního tlaku bývá u těchto poranění porušena též reaktivita na změny parciálního tlaku CO2.
V obecné rovině platí, že nedokáže-li mozkový krevní průtok uspokojit metabolické nároky mozkové tkáně, dochází k ischemii. Geneze vzniku ischemického postižení po poranění hlavy je komplexní. Mohou se uplatnit jak vlivy globální, tak fokální. Z globálních vlivů podporuje vznik ischemie mozkový edém a zvýšený nitrolební tlak, který způsobí poruchy průtoku především mechanickým stlačením kapilární části řečiště. Hypotenze a nízký mozkový perfuzní tlak jsou dalším globálním faktorem. Difuzní poruchy perfuze způsobí také hyperventilace a následná vazokonstrikce. Difuzní nebo ložiskové cévní spazmy může způsobit traumatické subarachnoidální krvácení. Častým fokálním mechanizmem vzniku ischemie je tlak hematomu na mozkovou tkáň za vzniku subkortikální hypoperfuze různého stupně. Jiným fokálním mechanizmem je uskřinutí magistrální tepny (klasicky a. cerebri posterior) o tentorium při herniaci gyrus parahippo-campalis. Všechny tyto patofyziologické mechanizmy posttraumatické ischemie se mohou navzájem kombinovat.
Tab. 2. Klasifikace poranění mozku podle CT nálezu 
Diagnostika
Komputerová tomografie (CT) je pilířem diagnostiky těžkých poranění mozku. Moderní spirální CT jsou dostupná a čas vyšetření je přijatelně krátký. CT umožňuje vyšetřit průtok krve v mozku (CBF) a v neposlední řadě CT angiografii. Zajištěný přenos dat po síti mezi nemocnicemi poskytuje okamžitou konzultaci při vyšetření mimo traumacentrum. Doplňujícími diagnostickými modalitami jsou SPECT a transkraniální doppler. SPECT je alternativou k perfuznímu CT při vyšetření CBF, doppler monitoruje potenciální rozvoj vazospazmů po traumatickém subarachnoidálním krvácení. Magnetická rezonance se v akutní fázi mozkových poranění neuplatňuje. V širším smyslu slova patří k diagnostickým metodám monitorace tkáňové oxymetrie a mikrodialýza, určení genotypu apolipoproteinu E a stanovení proteinu S 100 B, které budou zmíněny dále.
Základní CT obrazy jsou notoricky známé. Epidurální hematom je hyperdenzní a má typický bikonvexní tvar. Nejčastěji je uložen temporálně a bývá přítomna fisura spánkové kosti. Naproti tomu subdurální hematom (opět hyperdenzní) obtéká v různém rozsahu přilehlou hemisféru. Při dosažení určité velikosti dochází tlakem na mozek ke kompresi bazálních cisteren a přesunu středočárových struktur kontralaterálně. V současnosti užívaná CT klasifikace byla zavedena Marshallem v roce 1991 a zahrnuje vedle chirurgických lézí i klasifikaci difuzních axonálních poranění [35].
Chirurgická léčba
Impresivní zlomeniny
Impresivní zlomeniny se dělí na uzavřené (prosté) a otevřené (komplexní). Otevřené zlomeniny tvoří 80 % impresivních zlomenin. U zavřených zlomenin nenastává porušení galea aponeurotica. Konzervativní léčba může být metodou volby. Operační léčba je indikována jen tehdy, pokud je imprimovaný úlomek vpáčen více než o tlouštku kosti. Při lokalizaci na čele je z kosmetických důvodů operační indikace přísnější. Velká opatrnost a zdrženlivost se doporučuje při impresi v oblasti žilního splavu. Po elevaci fragmentu může nastat velmi obtížně řešitelné masivní krvácení. Při ztrátovém poranění žilního splavu může dokonce být situace technicky neřešitelná [43]. Komplexní otevřené zlomeniny jsou standardně ošetřovány chirurgicky. Operace spočívá v elevaci úlomků, debridement rány, sutuře pleny a rekonstrukci kostních úlomků. Časné ošetření významně snižuje riziko infekčních komplikací [4]. Současný chirurgický přístup u otevřených impresivních zlomenin je založen na časné elevaci fragmentů, sutuře tvrdé pleny a rekonstrukci kostních úlomků v cloně antibiotik. Absolutní indikací operace je porušení dury mater, přítomnost intrakraniálního hematomu, pneumocefalus, významná kontami-nace rány, imprese o více než 10 mm a výrazná kosmetická deformita [7].
Penetrující poranění
Penetrující poranění mozku nastává v případě úrazové komunikace mezi zevním prostředím a intrakraniálním prostorem.
Dle mechanizmu vzniku se dělí obecně na bodné, střelné a sečné. Rizikem těchto poranění je postižení velkých mozkových cév, vznik intracerebrálního hematomu, difuzního poranění mozku a v neposlední řadě pozdní zánětlivé komplikace - meningitis nebo absces [39]. Střelná poranění představují heterogenní skupinu poranění. Rozsah postižení mozku záleží především na rychlosti střely a hmotnosti projektilu.
Frontobazální poranění
Zlomeniny lebeční spodiny v přední jámě lební jsou zvláštním typem penetrujících poranění, při kterých dochází ke kranionazální komunikaci. Klinickým projevem je likvorea nebo pneumocefalus. V důsledku komunikace může vznikout i v dlouhém časovém odstupu život ohrožující meningitida. Kranionazální komunikace je indikací k chirurgické revizi a jejímu uzávěru vaskularizovaným periostálním lalokem. Velkým obhájcem konceptu časné chirurgické léčby frontobazálních poranění u nás byl Mraček [38].
Akutní epidurální hematom
Indikace k operační léčbě epidurálního hematomu je léze >30 cm3 bez ohledu na GCS. Epidurální hematom menší než 30 cm3 a s přetlakem středových struktur méně než 5 mm, který má zároveň GCS skóre vyšší než 8 bodů je možné léčit konzervativně v neurochirurgickém centru. Operace by měla proběhnout co nejdříve a z hlediska techniky je preferována cílená kraniotomie před návrty [8]. V typickém případě bývá zdrojem krvácení a. meningica media v místě fisury temporální skvamy. Dobrá organizace a dostupná diagnostika vedla k jednoznačnému zlepšení výsledků [5]. To je podmíněno jen malým přimárním poraněním. Progrese stavu vědomí je způsobena nárůstem objemu hematomu a kompresí mozkové tkáně s rozvojem temporálního konu. Po odstranění útlaku evakuací hematomu a kontrole hemostázy dochází obvykle k rychlému zlepšení stavu. Pokud úprava nenastane, je třeba vždy pátrat po příčině. Nejčastěji bývá na vině časová prodleva s rozvojem sekundární ischemie při dlouho trvající kompresi.
Akutní subdurální hematom
Vzhledem k časté přítomnosti primárního poranění mozku je prognóza akutního subdurálního hematomu zlá – různé práce udávají mortalitu 50–90 % [13, 18, 53]. Na druhou stranu Seelig ve své práci zdůrazňuje vliv časového faktoru na výsledný stav [48]. Uvádí přežití 70 % u pacientů, kteří byli operováni časně do 4 hodin od úrazu. Sekční nálezy prokazují u dvou třetin pacientů, zemřelých na subdurální hematom, sekundární ischemické postižení [58]. To dává předpoklad zlepšení výsledku časnou a cílenou terapií s využitím multimodální monitorace [19]. Obecně může být příčinou hematomu krvácení z mozkové kontuze (obvykle frontobazálně a temporobazálně podél malého křídla kosti klínové) nebo přerušením přemosťujících žil. Přítomnost léze mozku pod hematomem má zásadní negativní vliv na prognózu.
Operační indikace [9]:
- Akutní subdurální hematom tlouštky>10 mm nebo přesun středočárových struktur>5mm bez ohledu na stav GCS.
- Komatózní pacient (GCS≤8) s hematomem tloušťky<10 mm a přesunem středočárových struktur< 5 mm pokud
- a) došlo k poklesu GCS o 2 body, nebo
b) má anizokorii, nebo
c) ICP je >20 mm Hg.
- Všichni komatózní pacienti s akutním subdurál-ním hematomem mají mít ICP monitoring.
Akutní úrazový intracerebrální hematom/kontuze
Operační indikace [10]: expanze objemu>50 cm3. U frontálních a temporobazálních kontuzí je větší riziko temporálního konu, a proto je indikace časnější. Objem hematomu>20 cm3 u pacientů v bezvědomí s přesunem středočárových struktur>5 mm nebo kompresí bazálních cisteren je indikací k operaci. Standardním výkonem u akutního subdurálního a intracerebrálního hematom je velká kraniotomie nad postiženou hemisférou, často v kombinaci s dekompresí ke kontrole nitrolební hypertenze.
Postavení dekompresivní kraniektomie
Při selhání konzervativních možností kontroly ICP nabízí dekompresivní kraniektomie vhodnou a poslední alternativu. Řada pracovišť provádí dekompresivní kraniektomii u akutních subdurálních hematomů s přítomností kontuzí primárně. Ke kontrole ICP je důležité, aby velikost dekomprese byla dostatečná, nejlépe nad celou hemisférou – tedy fronto-temporo-parieto-okcipitální. V opačném případě hrozí přetrvávání hypertenze, herniace mozku do otvoru kalvy a jeho poškození. Kostní ploténka je za sterilních podmínek uložena do mrazicího boxu při teplotě minus 70 stupňů Celsia. Šupina temporální kosti a zevní část malého křídla kosti klínové jsou odstraněny. Tento krok je extrémně důležitý. Je prevencí tentoriální herniace mediální části temporálního laloku a tedy vzniku temporálního konu. Tvrdá plena je otevřena radiálními nástřihy a případný intradurální hematom evakuován. Po kontrole hemostázy je vnitřní část temporálního svalu fixována několika stehy k duře v místě křídla. Následně je temporální sval s periostem překlopen do rány a přišit stehy k cípům tvrdé pleny. Sutura galey a kůže ukončí operaci. Redonův drén je zaveden epidurálně na malý podtlak. Po správně provedené kraniektomii má odstraněný kostní lalok velikost 100 – 150 cm2 [44].
Metoda dekompresivní kraniektomie byla v minulých desetiletích považována z hlediska výsledku za neefektivní [12]. Příčiny neúspěchu mohly být pestré. Pozdní indikaci výkonu jako příčinu selhání zdůrazňuje ve své monografii již Mraček. Stejně tak je důležitá dostatečná velikost dekomprese. Compagnone [11] uvádí, že nedostatečná velikost dekomprese byla v multicentrické studii chirurgické léčby intradurálních poúrazových expanzí až v 25 procentech. Přitom užití techniky dekompresivní kraniektomie bylo relativně časté: přibližně v jedné třetině operací. V posledních letech je dekompresivní kraniektomie znovu objevena a užívána na většině neurochirurgických pracovišť. Její účinnost je přesvědčivá, přestože z hlediska medicíny evidentních dat dosud nepotvrzená. Aktuálně probíhají dvě multicentrické prospektivní studie na toto téma [21, 47]. Aarabi [1] hodnotil efekt dekompresivní kraniektomie u maligního edému mozku po kranicerebrálním poranění. U 85 % pacientů došlo po operaci k normalizaci nitrolebního tlaku. Výsledek byl závislý na iniciálním GCS: pacienti v hlubokém bezvědomí měli příznivý výsledek v 17 procentech, pacienti s GCS 6–15 v 67 procentech. Výsledek nebyl ovliněn přesunem středových struktur, stavem zornic, načasováním operace a ani věkem pacientů!! Naproti tomu Navrátil [40] zjistil, že faktory, ovlivňující výsledek jsou věk pacienta, iniciální stav vědomí, šíře a reaktivita zornic. Dekompresivní kraniektomie dokáže efektivně snížit nitrolební tlak do normálních mezí [55]. Zároveň bylo prokázáno zlepšení průtoku krve mozkem (CBF) v místě dekompresivní kraniektomie s odpovídajícím zlepšením klinického výsledku [57]. V mozkové tkáni pod oblastí dekomprese zároveň nastává významné zvýšení parciálního tlaku kyslíku [25].
Konzervativní léčba
Základním cílem všech léčebných postupů je zajistit adekvátní perfuzi mozkové tkáně a zabránit rozvoji hypoxického poškození mozku (tj. udržení CPP) a dále zabránit herniaci mozkové tkáně (tj. ovlivnění ICP). Měření nitrolebního tlaku a léčba nitrolební hypertenze jsou základními principy v péči o pa-cienty s těžkým poraněním mozku. Současně dbáme na udržení dostatečného CPP. Mnohé léčebné modality, které vedou k absolutní redukci hodnot ICP, však mohou vést k mozkové ischemii nebo potencují její vznik [50]. Terapie je indikována, je-li CPP < 60 mmHg déle než 5 minut nebo ICP > 20 mmHg déle než 5 minut. Vzhledem k nutnosti především udržet adekvátní perfuzi krve mozkem za primární cíl terapie proto považujeme dosažení a udržení CPP > 60 mmHg (děti 50 mmHg).
První fáze konzervativní léčby těžkých poranění mozku spočívá v aplikaci obecných principů – nastolení a udržení extrakraniální homeostázy organizmu. To představuje udržení optimální oxygenace, kompletní resuscitaci oběhu, ovlivnění tělesné teploty směrem k normotermii, adekvátní analgosedaci eventuálně myorelaxaci. Udržení stability celého systému je prioritou a zároveň základní předpoklad pro dosažení stability (homeostázy) intrakraniální. Důležitá je již poloha pacienta. Je nutno zajistit elevaci hlavy a zamezit možné obstrukci jugulárních žil. U pacientů s těžkým poraněním mozku je obvykle nutná a žádoucí intubace a řízená ventilace. Ventilace by měla být vedena k dosažení dolní hranice normokapnie tj. 4,66 kPa. Při použití zevní komorové drenáže k monitoringu ICP je evakuace likvoru první terapeutický krok při elevaci ICP. Při přetrvávání nitrolební hypertenze i přes všechna tato opatření je použití dalších modalit závislé na zvážení konkrétního rizika. Pokud evakuace likvoru nevede k ovlivnění ICP nebo není dostupná, měl by být aplikován manitol s respekto-váním hranice osmolality séra pro jeho podání na úrovni 320 mOsm/l. V průběhu aplikace manitolu je nutné udržovat normovolemii. Pokud aplikace manitolu nevede k ovlivnění ICP, je indikována změna ventilace směrem k navození hypokapnie (3,99–4,66 kPa). Při nutnosti agresivnější hyperventilace by měl být přiřazen monitoring CBF nebo jugulární oxymetrie.
Jednotlivé terapeutické modality v detailu:
Adekvátní ventilace a oxygenace: Zajistíme normoventilaci se vstupními ventilačními parametry:
DF =10-12, DO = 6–8ml/kg, PEEP do 5 cm H2O, FiO2 =0,4–1,0. PEEP nastavujeme elektivně také v závislosti na existenci sdružených poranění (plíce, hrudník, šokový stav apod.). Optimální hodnoty vyšetření krevních plynů (Astrup) jsou: paO2 > 13,3 kPa, SaO2 > 95%, paCO2 4,2–4,8 kPa, pH – norm. Hyperventilace s hodnotami paCO2 < 4,2 kPa již představuje specifickou léčebnou modalitu.
Adekvátní systémová perfuze:
a) bilance tekutin:
Okamžitě korigujeme deficity s následnou vyrovnanou bilancí tekutin. Snahou je zajistit normovolemii při parametrech: S–Osm = 295–305mosm/kg H2O, onkotický tlak plasmy > 3,0 kPa, Hb = 105–110g/l , Htk > 0,30. Osmolalita séra je dána především hladinou sodíku. S-Na udržujeme v rozmezí 145–155mmol/l. Deficit hradíme koncentrovanými roztoky NaCl.
Onkotický tlak plasmy je dán hladinou albuminu, která by měla být vyšší než 30 g/l a onkotický tlak by měl být kolem 3,3 kPa. Deficit hradíme albuminem nebo hydroxyethylškrobem.
b) krevní oběh:
Stabilita hemodynamiky je nezbytná pro stabilitu nitrolebních poměrů. „Cílová“ hodnota středního arteriálního tlaku (MAP) > 90 mmHg. Ke korekci eventuální hypotenze používáme noradrenalin a dopamin, při nežádoucí hypertenzi možno podat clonidin, labetalol, β-1 antagonisty.
Analgosedace: Používají se kontinuální režimy s kombinací opiátů s benzodiazepiny. Při manipulacích s pacientem a při toaletě dýchacích cest se jako prevence zvýšení ICP podává bolusově Thiopental v dávce 1–2mg/kg.
Myorelaxace: Primární je kvalitní analgosedace. Myorelaxancia podáváme pouze, když prokazatelně vedou k poklesu ICP.
Tělesná teplota: Primární je snaha udržovat normotermii - fyzikální chlazení (hlava, trup), antipyretika. V poslední době se stále častěji využívá mírné řízené hypotermie kolem 34–35° po dobu 4–7 dnů, která bez nežádoucích účinků efektivně snižuje ICP.
Nutriční podpora: Preferujeme časnou enterální výživu (bolusově). Nutriční podporu je vhodné zahájit do 72 hodin od poranění. Při intoleranci enterální výživy zahajujeme výživu parenterální. Plné výživy by mělo být dosaženo do 7. dne od úrazu.
Prevence stresového vředu: Samozřejmostí je podávání sucralfatu, H2-antagonistů – např. ranitidin 3x1 amp.i.v. po dobu 72 hodin, pak 1 amp. i.v. na noc. K prevenci stresového vředu napomáhá také to, že u poranění mozku není indikováno podávání kor-tikoidů (nezlepšují výsledky léčby těchto pacientů).
Antikoagulancia: K použití antikoagulancií není jednoznačné doporučení. Obvykle možno podávat frakcionované hepariny po 24 hodinách od poranění. Výběr konkrétního typu antikoagulancia závisí na aktuálním stavu pacienta a jeho hemokoagulačních parametrech.Antibiotika: Antibiotika podáváme mnohdy jako „cílenou terapii“ (zlomeniny baze lební, otevřená poranění). Výběr antibiotika se děje standardně dle ATB politiky oddělení a aktuální nozokomiální situace.
Poloha pacienta: Výhodná je zvýšená poloha hlavy cca 20 stupňů ve středním postavení, která může být optimalizována průběžně podle hodnot ICP (jsou-li měřeny) a podle existence eventuální likvorey.Ovlivnění CPP: Udržení adekvátního mozkového perfuzního tlaku (CPP) při normovolemii podáním katecholaminů (noradrenalin, dopamin) vede při zachovalé mozkové autoregulaci ke snížení ICP. Pokud se zvýšením MAP roste úměrně i ICP, je to projevem ztráty presorické autoregulace, nebo projevem pře-konání prahu autoregulace při arteriální hypertenzi. Hodnotu CPP 60 mmHg nelze brát dogmaticky, v praxi jsme často omezeni na dosažení co nejlepšího CPP při co nejnižším ICP.
Hyperventilace: Způsobuje arteriální vazokonstrikci v nepoškozených částech mozku, čímž snižuje v těchto oblastech edém a tím také ICP. Je to však mechanizmus, který je potenciálně nebezpečný – vazokonstrikce může vést až k ischemii. Navíc redistribucí krevního toku do oblastí, které nereagují na hypokapnii vazokonstrikcí, dochází k vzestupu hydrostatického tlaku a může dojít ke zhoršení vazogenního edému. Efekt hyperventilace je nejvýznamnější asi po dobu 6 hodin, úplná adaptace s následnou paradoxní vazodilatací nastupuje asi za 24–30 hodin od aplikace této modality. Hyperventilace je vhodná k akutnímu snížení ICP, bez znalosti ICP a SvjO2 je indikována jenom při rychlém zhoršení neurologického obrazu. Relativně bezpečnou je tzv. „optimalizovaná“ hyperventilace (pHmax=7,5) dle hodnot SvjO2 (jugulární oxymetrie). Pokud se daří při použití hyperventilace udržet hodnoty SvjO2 mezi 55–75%, je riziko ischemie prakticky eliminováno.
Osmoterapie
a) Manitol: Svým hemodynamickým a osmotickým účinkem vede ke snížení ICP a zvýšení CBF. Následná osmotická diuréza může poté snížit systémový tlak krevní. V oblastech mozku s porušenou hematoencefalickou barierou proniká extravazálně, čímž zde po poklesu sérové osmolarity může působit osmoticky aktivně – rebound fenomén – a zhoršit edém. Bez znalosti ICP je podání manitolu indikováno jen při známkách rychlého zhoršování neurologického obrazu! Furosemid může potencovat efekt manitolu na ICP (v dávce 0,25 mg/kg).
Dávkování: Manitol 20% = 0,25–1,0 g/kg/20min. i.v., možno podat opakovaně - á 2–6 hod při S-Osm do 320 mOsm/l.
b) Hypertonické roztoky NaCl (3–10%): Pokles ICP po aplikaci NaCl 3% je srovnatelný s poklesem po aplikaci stejného objemu manitolu 20%. Dávkování: např. NaCl 10% = 50 ml/30 min. i.v. Při osmoterapii je nutný častý monitoring vnitřního prostředí.
Barbituráty - thiopenthal: Jeho kontinuální aplikace může být výhodná u refrakterní nitrolební hypertenze. V závislosti na dávce snižuje spotřebu kyslíku mozkem (CMRO2), čímž vede k hypometabolické vazokonstrikci a poklesu CBF. Stoupající dávka zvyšuje pravděpodobnost oběhové nestability, ve vysoké dávce může vést k vazodilataci mozkových cév. Dávkování: bolus = 1–3 mg/kg i.v. (manipulace, hygiena dýchacích cest), kontinuálně = 0,5–6 mg/kg/hod (nutností je souběžné sledování EEG – dosažení tzv. burst suppression).
Antiepileptika: Profylaktická aplikace (phenytoin, karbamazepin) není doporučována jako prevence pozdních posttraumatických epileptických projevů. Antiepileptika jsou indikována v prevenci časných posttraumatických křečí, nejsou však dostatečné údaje zda prevence zlepšuje výsledky léčby pacientů, sami je preventivně nepodáváme.
Nové trendy – multimodální monitorace
Monitorování mozkové oxygenace (tkáňová oxymetrie)
Sekundární ischemické postižení velmi často komplikují těžká poranění mozku. Obvyklou metodou monitorování mozkové oxygenace je měření saturace kyslíku v jugulárním bulbu. Metoda detekuje globální oxygenaci, ale o regionálním zásobení mozku kyslíkem informaci nedává. Měření tkáňového kyslíku v mozku s využitím Clarkovy polarografické sondy (systém Licox) poskytuje informaci o stavu lokální oxygenace. Optimální umístění sondy je v blízkosti vlastní léze. Tato tkáň zvaná penumbra je nejvíce ohrožena sekundární ischemií. Příčinou snížení parciálního tlaku kyslíku v mozkové tkáni může být nitrolební hypertenze a dále systémové vlivy jako hypotenze, anemie. Hodnoty parciálního tlaku kyslíku v mozkové tkáni (PbtO2) nad 15 mmHg jsou považovány za fyziologické [52]. Kritická hodnota PbtO2 pro rozvoj ischemie je pak 10 mmHg [20]. Je známo, že k ischemii může dojít i při adekvátním perfuzním tlaku a absenci nitrolební hypertenze [31]. Velmi významné pro včasný a cílený terapeutický zásah je fakt, že pokles PbtO2 předchází o několik hodin elevaci ICP a pokles mozkového perfuzního tlaku. Zkušenosti s monitorací mozkové oxygenace u poranění mozku a subarachnoidálních krvácení přibývají a byly publikovány v poslední době i v domácím písemnictví [15, 16, 17].
Mikrodialýza
Metoda umožňuje analýzu metabolitů glukózy, laktátu, pyruvátu, glycerolu a glutamátu. Podobně jako u monitorace mozkové oxygenace se jedná o metodu invazivní. Stejně tak je sonda zavedena do oblasti penumbry. Hodnocení vzorků je v intervalové (30, 60 minut) i když v poslední době se pracuje na možnosti kontinuální monitorace. Zvýšení poměru laktát/pyruvát je známkou probíhající ischemie. Paralelně dochází k elevaci glutamátu, snížení hladiny glukózy a pyruvátu. Ve shodě s monitorací mozkové oxygenace mohou předcházet patologické nálezy mikrodialýzy o několik hodin nástup nitrolební hypertenze. Mozková mikrodialýza je vzhledem k náročnosti zpracování množství vzorků, invazivitě a ceně považována v současnosti za metodu doplňkovou.
S100B
Prognózu pacientů s těžkým poraněním mozku je často obtížné predikovat. U ventilovaných pacientů není hodnocení neurologického stavu mnohdy možné. Stanovení hladiny proteinu S 100B umožní stanovit prognózu u izolovaného poranění mozku [56]. Protein S100B se vyskytuje v gliových buňkách nervové tkáně, ale i v tukových buňkách, chondrocytech. Předpokládá se, že v nízkých koncentracích se může podílet na reparativních procesech CNS. Při zvýšených koncentracích naopak indukuje programovou smrt buněk – apoptózu [27]. Pro prognózu klinického stavu má klíčový význam hodnota za 24 a 72 hodin. Hodnota nad 1,17 mikrogramu znamená 12,8násobné riziko špatného výsledku. Naopak normalizace hladiny do 72 hodin dává 92% příznivého výsledku [30].
ApoE
Výsledný stav po poranění mozku je také podmíněn geneticky. Polymorfizmus apolipoproteinu E genu (APOE) ovlivňuje celkový výsledek. Pacienti s alelou APOEepsilon4 mají depozita amyloidu v mozkové kůře a pokud u nich dojde k úrazu mozku, je riziko špatného výsledku dvojnásobné. Pacienti, kteří přežijí poranění mozku, mají 10násobné riziko pozdějšího vzniku Alzheimerovy choroby, než ti, kteří nemají alelu APOE epsilon4 [32]. Pokud dojde u těchto pacientů k vzniku intrakraniálního hematomu, bude jeho objem větší ve srovnání s ostatními pacienty [32].
Závěr
Heterogenita těžkých poranění mozku přináší úskalí diagnostiky a léčby. Lze si snadno představit modelovou situaci hromadné dopravní nehody s těžkým poraněním mozku u 5 pacientů. První pacient bude mít intrakraniální extradurální hematom, druhý maligní nitrolební hypertenzi, třetí difuzní axonální poranění, čtvrtý penetrující poranění a pátý traumatické subarachnoidální krvácení. Všichni budou v bezvědomí a jejich terapie a prognóza bude zcela odlišná. Vzhledem k této komplexnosti problematiky těžkých poranění mozku je nezbytná správná organizace přednemocniční péče a týmový přístup v dobře vybaveném traumacentru. Spolu se zaváděním multimodální monitorace je to cesta ke zlepšení výsledků těžkých poranění mozku. Další možností zlepšení výsledků léčby o tyto těžké pacienty je zřízení center intenzivní neurorehabilitační péče. Tato centra by umožnila některým pacientům zlepšení stavu i několik měsíců po poranění mozku.
MUDr. Vladimír Přibáň, Ph.D
Neurochirurgické oddělení
B. Němcové 54
370 87 Č. Budějovice
Zdroje
1. Aarabi, B., Hesdorffer, D. C., Ahn, E. S. et al. Outcome following decompressive craniectomy for malignant swelling due to severe head injury. J Neurosurg. 2006, 104, 469–479.
2. Andrews, B.T., Pitts, L.H. Functional recovery after traumatic transtentorial herniation. Neurosurgery. 1991, 29, 227–235.
3. Bouma, G. J., Muizelaar, J. P., Bandoh, K. et al. Blood pressure and intracranial pressure-volume dynamics in severe head injury: Relationship with cerebral blood flow. J Neurosurg. 1992, 77, 15–20.
4. Braakman, R. Depressed skull fracture: Data, treatment and follow-up in 225 consecutive cases. J Neurol Neurosurg Psychiatry. 1972, 35, 395–402.
5. Bricolo, A. P, Pasut, L. M. Extradural hemato-ma: towards zero mortality: A prospective study. Neurosurgery. 14, 1984, 8–12.
6. Bullock, M. R, Chesnut, R, Ghajar, J. et al. Guidelines for the surgical management of traumatic brain injury. Neurosurgery. 2006, 3, 1–3.
7. Bullock, M. R, Chesnut, R, Ghajar, J. et al. Guidelines for the surgical management of traumatic brain injury. Neurosurgery. 2006, 3, 56–60.
8. Bullock, M. R., Chesnut, R., Ghajar, J. et al. Guidelines for the surgical management of traumatic brain injury. Neurosurgery. 2006, 3, 7–15.
9. Bullock, M. R, Chesnut, R, Ghajar, J. et al. Guidelines for the surgical management of traumatic brain injury. Neurosurgery. 2006, 3, 16–24.
10. Bullock, M. R, Chesnut, R, Ghajar, J. et al. Guidelines for the surgical management of traumatic brain injury. Neurosurgery. 2006, 3, 25–46.
11. Compagnone C. H., Murray, G., Teasdale G. et al. The management of patients with intradural posttrauamatic mass lesions: A multicenter survey of current approaches to surgical management in 729 patients coordinated by the European Brain Injury Consortium. Neurosurgery. 2005, 57, 1183–1192.
12. Cooper, P. R., Rovit, R. L., Ransohoff, J. Hemicraniectomiy in the treatment of acute subdural hematoma. A reappraisal. Surg Neurol. 1976, 5, 25–28.
13. Duhaime, A. C., Gennarelli, L. M., Yachnis, A. Acute subdural bematoma: is the blood itself toxic? J Neurotrauma. 1994, 11, 669–678.
14. EBIC - Murray, G.D., Teasdale, G.M., Braakman, R. C. et al. The European Brain Injury Consortium Survey of Head Injuries. Acta Neurochir. 1999, 141, 233–236.
15. Filaun, M., Horáček, M., Steindler, J. et al. Monitorování mozkové oxygenace. Cesk Slov Neurol. 2008, 6, 657–663.
16. Hejčl, A., Bartoš, R., Humhej, I. et al. De-kompresivní kraniektomie v léčbě posttraumatického edému mozku a přínos nových monitorovacích metod. Čas Lék Čes. 2007, 146, 307–312.
17. Gál, R., Smrčka, M., Šťourač, P. et al. Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky. Česk Slov Neurol. 2007, 5, 562–566.
18. Hlatký, R., Valadka, A. B., Goodman, J. C., Robertson, C. S. Evolution of brain tissue injury after evacuation fo acute traumatic subdural hematomas. Neurosurgery. 2004, 55, 1318–1324.
19. Hoelper, B. M., Allesandri, B., Heimann, A. et al. Brain oxygen monitoring: in vitro accuracy, long-term drift and response-time of Licox and neuro-trend sensors. Acta Neurochir. 2005, 147, 767–774.
20. Hutchinson, P. J., Corteen, E., Czosnyka, M. et al. Decompressive craniectomy in traumatic brain injury: the randomised multicenter RESCUEicp study. Acta Neurochir. Suppl., 2006, 96, 17–20.
21. Goodman G. C., Valadka, A. B., Gopinath, S. P. et al. Extracellular lactate and glukose alterations in the brain after head injury measured by mi-crodialysis. Crit Care Med. 1999, 27, 1965–1973.
22. Chapman, P. H., Cosman, E. R., Arnold, M. A. The relationship between ventricular fluid pressure and body pressure in normal subjects and subjects with shunts: A telemetric study. Neurosurgery. 1990, 26, 181–190.
23. Chestnut, R. M., Marshall, S. B., Piek, J. et al. Early and late systemic hypotension as a frequent and fundamental source of cerebral ischemia following severe head injury in Trauma Coma Data Bank. Acta Neurochir. 1993, 59, 121–125.
24. Chestnut, R. M, Marshall, L. F. Analysis of the role of secondary brain injury in determining outcome form severe head injury. J Neurosurg. 1990, 72, 360–362.
25. Jaeger, M., Soehle M., Meixenbauer, J. Effects of decompressive craniectomy on brain tissue oxygen in patients with intracrainal hypertension. J Neurol Nerosurg Psychiatry. 2003, 74, 513–515.
26. Jennet, B., Bond, M. Assessment of outcome after severe brain damage: a. practical scale. Lancet. 1975, 1, 480–484.
27. Korfias, S., Stranjalis, G., Papadimitriou, A. et al. Serum S-100B protein as a biochemic marker of brain injury: a review of current concepts. Curr Med Chem. 2006, 13, 3719–3731.
28. Langlois, J, Rutland-Brown, W, Wald, M. The Epidemiology and Impact of Traumatic Brain Injury: A Brief Overview. J Trauma Rehab. 2006, 21, 375–378.
29. Langfitt, T.W., Kassell, N.F.: Non-filling of cerebral vessels during angiography: Correlation with intracranial pressure. Acta Neurochir. 1966, 14, 96–98.
30. Lavička, P., Pikner, R., Kormunda, S. et al. Význam stanovení S 100B proteinu u pacientů s izolovaným poraněním hlavy. Česk Slov Neurol. 2007, 70, 521–526.
31. LeRoux, P. D., Newell, D. W., Lam, A. M. et al. Cerebral arteriovenous oxygen diference: a predictor of cerebral infarction and outcome in patiens with severe head injury. J Neurosurg. 1997, 87, 1–8.
32. Liaquat, I., Dunn, L. T., Nicoli, J. A. et al. Effect of apolipoprotein E genotype on hematoma volume after trauma. J Neurosurg. 2002, 96, 90–96.
33. Marmarou, A., Anderson, R.L., Ward, J.D. et al. Impact of ICP instability and hypotension on outcome in patients with severe head trauma. J Neurosurg. 1991, 75, 59–65.
34. Marshall, L. F, Gautille, T, Klauber, M. R. et al. The outcome of severe closed head injury. J Neurosurg. 1991, 75, 28–36.
35. Marshall, L. F., Marshall, S. B., Klau-ber, M. R. et al. A new classification of head injury based on computerized tomography. J Neurosurg. 1991, 75, 14–20.
36. Marshall, L.F., Smith, R.W., Shapiro, R.M. The outcome with agressive treatment in severe head injuries. I. The significance of intracranial pressure monitoring. J Neurosurg. 1979, 50, 20–26.
37. Miller, J. D., Becker, D. P, Ward, J. D. et al. Significance fo intracranial hypertension in severe head injury. J Neurosurg. 1977, 47, 503–516.
38. Mraček, Z. Kraniocerebrální poranění. Praha: Grada Avicenum, 1988. 304 s.
39. Musa, B. S., Simpson, B. A., Hartfield, R.D. Recurrent self-inflicted craniocrebral injury: case report and review of the literature. Br J Neurosurg. 11, 1997, 564–569.
40. Němeček, S, Němečková, J, Cerman, J. Patomorfologie poranění mozku. Neurologie pro praxi. 2003, 6, 290–295.
41. Navrátil, L. Dekompresivní kraniektomie u kraniocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu. Čes Slov Neurol Neurochir. 2007, 3, 294–301.
42. Ommaya, A. K, Gennarelli, T. H. Cerebral concussion and traumatic unconsciousness: Correlation of experimental and clinical observations on blunt head injuries. Brain. 1974, 97, 633–654.
43. Přibáň, V., Bombic, M. Impresivní zlomenina týlní šupiny s lacerací mozku a poraněním sinus sagitalis superior - kazuistika. Rozhl chir. 2006, 86, 539–542.
44. Přibáň, V., Řehoušek, P., Fiedler, J. Postavení dekompresivní kraniektomie v chirurgické léčbě mozkových poranění – zhodnocení výsledků z období 2002–2004. Úraz chir. 2008, 2, 27–33.
45. Rosner, M. J. Pathophysiology and management of increased intracranial pressure. In Andrews, B. T. ed. Neurosurgical Intensive Care. New York, Mc Graw-Hill, 1993, 57–112.
46. Rusnak, M, Janciak, I, Majdan, M. et al. Severe traumatic brain injury in Austria I: Introduction to the study. Wien Klin Wochenschr. °119, 2007, 23–28.
47. Sahuquillo, J., Arikan, F. Decompressive craniectomy for the treatment of refractory high intracranial pressure in traumatic brain injury. Cochrane Da-tabase Syst Rev. 2006.
48. Seelig, J. M., Becker, D. P., Miller, J. D. Traumatic acute subdural hematoma: Major mortality reduction in comatose patiens treated within four hours. N Engl J Med. 1981, 304, 1511–1518.
49. Smrčka, M. et al. Poranění mozku. Praha: Grada, 2001. 272 s.
50. Smrčka, M. Konzervativní léčba potraumatické nitrolební hypertenze. Neurologie pro praxi. 2003, 6, 296–300.
51. Strich, S. J, Diffuse degeneration of cerebral white matter in severe dementia following head injury. J Neurol Neurosurg Psychiatr. 1956, 19, 163–185.
52. Valadka, A.B., Gopinath, S. P., Contact, C. F. et al. Relationship of brain tissue PO2 to outcome after severe head injury. Crit Care Med. 1998, 26, 1576–1581.
53. Valadka, A. B., Gopinath, S. P., Robertson, C. S. Midline shift after severe head injury: Pathophysiologic implications. J Trauma. 2000, 49, 1–8.
54. Wehner, D. L, Sutton, L. An interactive, hospital-based injury preventive program for first-, second-, and third-grade students. J Emerg Nurs. 2005, 31, 383–386.
55. Whitfield, P. C., Patel, H., Hutchinson, P. J. et al. Bifrontal decompressive craniectomy in the management of posttraumatic intracranial hypertension. Br J Neurosurg. 2001, 15, 500–507.
56. Woertgen, C., Rothoerl, R. D., Brawanski, A. Early S-100B serum level correlates to quality of life in patiens after severe head injury. Brain Injury. 2002, 16, 807–816.
57. Yamakami, I., Yamamura, A. Effects of decompressive craniectomy on regional cerebral blood flow in severe head trauma patients. Neurol Med Chir. 1993, 33, 616–620.
58. Yamieson, K. G., Yelland, J. D. Surgically treated traumatic subdural hematomas. J Neurosurg. 1972, 37, 137–149.
Štítky
Chirurgia všeobecná Traumatológia Urgentná medicína
Článok vyšiel v časopiseÚrazová chirurgie
Najčítanejšie tento týždeň
2009 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Metamizol v terapii akutních bolestí hlavy
Najčítanejšie v tomto čísle- Současná terapie těžkých kraniocerebrálních poranění – souborný referát
- Plovoucí klíček - kazuistika
- Sugitův víceúčelový rám fixace hlavy v neurochirurgii - technická poznámka
- Navigace v traumatologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



