-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické projevy, symptomy a prognostické faktory renálního karcinomu
Autori: P. T. Nieh; K. Ogan; F. F. Marshall
Pôsobisko autorov: Department of Urology, Emory University School of Medicine, Emory Clinic, Atlanta, GA, USA
Vyšlo v časopise: Urol List 2007; 5(4): 72-77
Úvod
Klinický obraz karcinomu z renálních buněk (RCC) prošel následkem časnější detekce v uplynulých několika desetiletích zásadními změnami. Vzhledem k jeho častému výskytu v kombinaci s paraneoplastickými syndromy a nepředvídatelnému šíření metastáz však může manifestace RCC lékaře stále často snadno zmást.
Incidence
Incidence maligních tumorů ledviny tvoří více než 2 % výskytu všech karcinomů. Mortalita na toto onemocnění představuje také více než 2 %. Podle údajů programu National Cancer Institute (NCI) Surveillance, Epidemiology and End Results (SEER) se odhadovaný počet nových případů karcinomu ledviny ve Spojených státech pohybuje kolem 31 900 a počet úmrtí na tento karcinom kolem 11 900 případů. Chow et al zaznamenali v letech 1975 1995 rychle se zvyšující incidenci RCC. Nejvyšší incidence byla zaznamenána u lokalizovaných tumorů, nárůst byl zaznamenán také u pokročilých tumorů [1]. U pacientů s karcinomem diagnostikovaným v období mezi lety 1974—1976 a 1992 1998 bylo zaznamenáno statisticky signifikantní zvýšení míry přežití po dobu 5 let (52 % vs. 62 %). Tento nárůst lze pravděpodobně přičítat zdokonalení léčby a péče o pacienty s pokročilými tumory.
Míra incidence RCC je přibližně 2krát vyšší u mužů než u žen (19 500 vs 12 400) a onemocnění je diagnostikováno nejčastěji v 7. a 8. dekádě života. Přestože se RCC vyskytuje častěji u bělochů než u afroameričanů, míra incidence i mortality u afroamerické populace rychle stoupá [1]. U hereditárních RCC, jako je např. von Hippelova-Lindauova choroba, hereditárních papilárních RCC, familiárních onkocytomů a syndromu Birt-Hogg-Dube se nejčastěji vyskytují multifokální tumory ledvinné kůry. Multifokální tumory byly detegovány u 5,3 % ze 1 071 vzorků získaných při radikální nefrektomii prováděné u pacientů se sporadickým renálním karcinomem [2]. Výskyt četných ohnisek tumoru byl prokázán zejména u papilárního karcinomu [3]. Zajímavé je zjištění, že mezi skupinami pacientů s unifokálními a multifokálními tumory nebyl zaznamenán žádný rozdíl v míře přežití specifické pro karcinom. Míra synchronního výskytu RCC je velmi nízká (2,1 %). Mezi pacienty se synchronním RCC a unilaterálním RCC nebyl opět zaznamenán signifikantní rozdíl v míře přežití specifické pro karcinom [3]. Multifokální tumory v 1 ledvině a synchronní bilaterální tumory lze proto považovat za samostatné tumory a nikoliv za renální metastázy. U pacientů s metachronními renálními tumory byla naopak ve srovnání s pacienty se synchronními tumory zaznamenána horší doba přežití specifická pro karcinom, což může představovat první důkaz přítomnosti metastazujícího onemocnění [4].
Klasifikace
Většinu renálních tumorů postihujících ledvinnou kůru tvoří adenokarcinomy, běžně nazývané jako karcinomy z renálních buněk. V dnešní době je nejčastěji užíván klasifikační systém vytvořený Světovou zdravotnickou organizací (WHO) v roce 1997. Základní histologické typy RCC zahrnují konvenční karcinom (ze světlých buněk), papilární karcinom, chromofobní karcinom a karcinom sběrných kanálků [5].
Konvenční karcinom ze světlých buněk tvoří asi 70—80 % renálních neoplazmat [5,6]. 2. nejčastějším karcinomem je papilární RCC, který představuje přibližně 10—15 % renálních neoplazmat [7,8]. Ve srovnání s karcinomem ze světlých buněk bývá papilární RCC spojován s lepší prognózou, ale také častějším výskytem multifokálních tumorů. Míra celkového přežití po dobu 5 let se u papilárního RCC pohybuje v rozmezí 82—90 %, u konvenčního karcinomu ze světlých buněk v rozmezí 44—54 % [8,9]. Chromofobní RCC tvoří přibližně 5 % renálních neoplazmat a ve srovnání s konvenčním RCC ze světlých buněk je spojen s lepší kumulativní dobou přežití po dobu 5 let. Karcinom sběrných kanálků (karcinom Belliniho kanálků) představuje vzácně se vyskytující typ RCC a reprezentuje pouhých 0,4—2,6 % renálních neoplazmat [10,11]. Tyto tumory se vyznačují agresivním průběhem a vysokou incidencí lokoregionálního šíření a vzniku metastáz [12]. Sarkomatoidní RCC již dnes není považován za samostatnou histologickou kategorii, ale spíše za podtyp RCC se střední dobou přežití pouze 9 19 měsíců [13,14]. Z výše uvedených skutečností je tedy zřejmé, že histologický typ RCC úzce souvisí s prognózou a může představovat pomůcku pro výběr adjuvantní systémové terapie.
Rizikové faktory
Navzdory mnohým epidemiologickým studiím zůstává příčina vzniku RCC převážně neznámá. Přesto však byly stanoveny určité genetické, dietní a environmentální rizikové faktory, které ovlivňují vznik tohoto onemocnění. Hereditární RCC představují obrovské riziko pro ostatní členy rodiny, které by je mělo podnítit k časnému screeningu. Získané cystické onemocnění vznikající sekundárně při chronické hemodialýze také souvisí se zvýšeným rizikem vzniku RCC [15]. U pacientů podstupujících transplantaci ledviny bylo následkem nezbytné aplikace imunosupresiv zaznamenáno až 80násobné zvýšení rizika vzniku RCC [16].
Mnohé studie uvádějí mezi rizikovými faktory podílejícími se na vzniku RCC také kouření [17], hypertenzi [18], užívání diuretik [19], styk s azbestem [20] a naftou [20] či časté užívání analgetik [21]. Co se týká vlivu specifických potravin na zvýšení rizika vzniku RCC, máme k dispozici protichůdné údaje. Mnohé studie však uvádějí souvislost mezi zvýšením rizika vzniku RCC a obezitou a vysokým indexem tělesné hmotnosti (BMI) [22,23].
Znaky a symptomy
Přibližně u 10 % pacientů se RCC projevuje 3 klasickými symptomy — bolestí v boku, abdominální rezistencí a hematurií. V nedávné době provedené studie však prokazují, že vzhledem k časnější manifestaci se dnes všechny 3 symptomy současně u jediného pacienta vyskytují pouze výjimečně. RCC byl dříve z důvodu neobvyklých způsobů manifestace, vzniku paraneoplastických syndromů a různých typů metastatického šíření nazýván tumorem internistů. Tento druh manifestace je naštěstí vzácný a většina tumorů je ve skutečnosti detegována náhodně [24] a v nižším stadiu než jejich symptomatické protějšky [25,26]. Thompson a Peek zjistili, že 82 % náhodně detegovaných tumorů bylo ve stadiu I nebo II. Pouze 32 % symptomatických tumorů bylo odhaleno v časném stadiu. U pacientů s náhodně detegovanými tumory byla tedy po terapii zaznamenána lepší doba přežití po dobu 10 let než u pacientů se symptomatickými tumory (90 % vs. 30 %) [26]. Za zmínku stojí také fakt, že tyto malé tumory detegované v časném stadiu lze častěji léčit pomocí nefrony zachovávajících a minimálně invazivních technik.
Přibližně u 10—40 % pacientů, u nichž byl diagnostikován RCC, jsou přítomny paraneoplastické symptomy, které zahrnují anemii, horečku, kachexii a dysfunkci jater (Staufferův syndrom) [27]. Paraneoplastický syndrom je soubor příznaků a symptomů, které jsou podmíněny uvolňováním proteinů souvisejících s tumorem nebo imunitní reakcí, spíše než přímou invazí tumoru. Bylo prokázáno, že přítomnost paraneoplastických syndromů představuje nezávislý rizikový faktor ovlivňující progresi onemocnění a snížení doby přežití specifické pro karcinom [27,28]. Přestože tyto syndromy obvykle nereagují na konzervativní léčbu, většina z nich ustoupí po odstranění primárního tumoru nebo podstatné části metastáz.
Įada výzkumníků prokázala, že manifestace symptomů je předzvěstí horší prognózy [26-28]. Kim et al hodnotili symptomy přítomné při diagnostikování onemocnění a předoperační laboratorní výsledky v současné databázi, jež zahrnuje 1 046 pacientů, kteří podstoupili nefrektomii v období od roku 1989 do 2001 [29]. Mezi 3 nejčastěji se vyskytující příznaky patřila anemie (52,1 %), hematurie (35,2 %) a dysfunkce jater (31,5 %). V tab. 1 jsou uvedeny symptomatické manifestace lokalizovaného a metastazujícího RCC a jejich dopad na dobu přežití specifickou pro karcinom. V univarietní analýze byla prokázána statisticky signifikantní souvislost mezi manifestací symptomů a dobou přežití specifickou pro karcinom. Tato souvislost se týkala všech nálezů s výjimkou hypertenze a hematurie. Na základě multivarietní analýzy, stanovení TNM kategorie, ECOG, hodnocení celkového stavu a stanovení grade dle Fuhrmanové však byla prokázána signifikantní souvislost mezi dobou přežití specifickou pro karcinom a symptomy souvisejícími pouze s kachexií (hypoalbuminemie, úbytek váhy, anorexie a celkový diskomfort).
Tab. 1. Manifestace lokalizovaného a metastazujícího RCC a vliv na dobu přežití specifickou pro karcinom (upraveno podle [29]). ![Manifestace lokalizovaného a metastazujícího RCC a vliv na dobu přežití specifickou pro karcinom (upraveno podle [29]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dc740c2eacf9edea3b276d5368f6cd72.png)
Metastázy se u pacientů s RCC šíří zcela nepředvídatelně a zasahují téměř všechny orgánové systémy. Přibližně u 30—40 % pacientů je přítomno metastazující onemocnění, a u dalších 30—40 % pacientů s lokálním nebo lokálně pokročilým onemocněním dojde následně ke vzniku metastáz [30]. Nejčastěji zasaženými místy jsou plíce (76 %), regionální lymfatické uzliny (66 %), skelet (42 %) a játra (41 %) [31]. Metastázy však mohou zasahovat i nadledviny, mozek, pankreas, hlavu, krk nebo kůži. Bylo prokázáno, že lokalizace metastatického šíření přímo ovlivňuje účinnost léčby a následně i dobu přežití specifickou pro karcinom.
Stanovení stadia karcinomu
Původní Robsonův klasifikační systém (tab. 2) byl z velké části nahrazen více deskriptivním systémem AJCC Tumor Node Metastasis TNM. Verze z roku 1987 limituje velikost onemocnění T1 na 2,5 cm, zahrnuje do stadia T4 IVC nádorový trombus umístěný supradiafragmaticky a do stadia T3c zahrnuje nádorový trombus umístěný infradiafragmaticky, vzhledem k horší prognóze než při samotném zasažení renální žíly. Klasifikační systém TNM z roku 1997 rozšířil velikost onemocnění T1 až na 7 cm, přesunul nádorový trombus umístěný supradiafragmaticky z kategorie T4 do T3c a nádorový trombus umístěný infradiafragmaticky z kategorie T3c do T3b, na úroveň onemocnění zasahujícího renální žílu.
Tab. 2. Robsonův systém pro určení stadia RCC. 
Verze TNM systému z roku 2002 (tab. 3) vyřešila problém týkající se velikosti tumoru stadia T1 rozdělením této kategorie na 2 skupiny. První zahrnuje tumory o velikosti ≤ 4 cm (T1a) a druhá tumory o velikosti 4—7 cm (T1b), což přesně odpovídá příznivým výsledkům při provádění parciální resekce ledviny u menších lézí a horší prognóze u tumorů větší velikosti [32,33]. Spolu s rostoucí velikostí tumoru se zkracuje doba přežití. Při zdvojnásobení velikosti tumoru se riziko úmrtí zvyšuje 3,51krát [34]. Některé studie uvádějí hraniční hodnotu 4,5 cm [35] nebo 5 cm [36]. Hodnota 4 cm představuje dobrý kompromis a zlepšení oproti verzi z roku 1997 [37].
Tab. 3. TNM klasifikační systém pro RCC (AJCC, 2002). Kurzívou označené údaje jsou ve vztahu k původní verzi (1997) pozměněné. 
Údaje týkající se doby přežití u onemocnění stadia T3 jsou poněkud protichůdné. Přímá invaze nadledvin (T3a) má signifikantně horší prognózu než onemocnění zasahující perinefrickou tukovou tkáň nebo tkáň renálního sinu (0 % vs 36 % doby přežití specifické pro karcinom po dobu 5 let, střední doba přežití 12,5 měsíců vs 36 měsíců), což odpovídá spíše onemocnění ve stadiu T4 [38]. Zkoumána byla také kategorie T3b, která zahrnuje tumory s makroskopickým rozšířením do renální žíly nebo vena cava pod bránicí. Někteří autoři zaznamenali u pacientů s nádorovým trombem renální žíly (narozdíl od pacientů s nádorovým infrahepatickým trombem) zlepšení doby přežití specifické pro karcinom po dobu 10 let [39], jiní nezaznamenali žádný rozdíl, což odpovídá kategorii T3b ve verzi klasifikace TNM z roku 2002 [40].
Doba přežití a prognostické faktory
Tab. 4 uvádí srovnání doby přežití bez onemocnění po dobu 5 let po radikální nefrektomii (u různých TNM kategorií), která představuje standardní metodu léčby renálních karcinomů. Je třeba zdůraznit, že onemocnění zasahující renální žílu a IVC trombus, i trombus umístěný supradiafragmaticky, má při úplné resekci lepší prognózu než kapsulární invaze, metastázy do regionálních uzlin nebo vzdálené metastázy [41-44]. Stále oblíbenější technikou pro léčbu malých lézí se stává nefrony šetřící operace (otevřená i laparoskopická) a ablace tumoru pomocí kryoterapie nebo radiofrekvence. Tyto metody představují pro pečlivě vybranou skupinu pacientů účinnou možnost léčby. TNM klasifikace umožňuje stanovit na základě makroskopického rozšíření tumoru prognózu onemocnění. Další histologické a klinické nálezy však umožňují u pacientů s vyšším rizikem predikovat recidivu onemocnění, jeho progresi a horší dobu přežití (tab. 5).
Tab. 4. TNM stadium a doba přežití bez onemocnění po dobu 5 let po operaci. 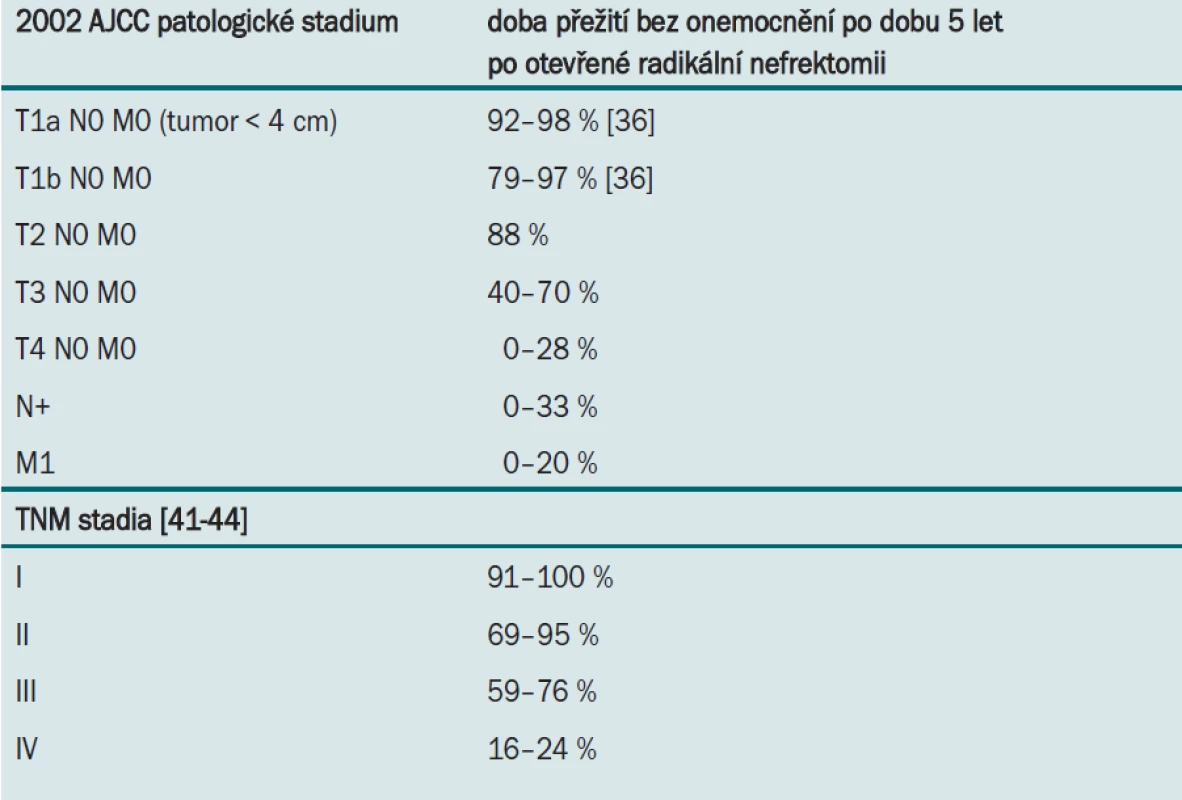
Tab. 5. Faktory (s výjimkou TMN kritérií) ovlivňující prognózu RCC. 
Určení nukleárního grade — na základě stanovení nukleárního grade podle Fuhrmanové bylo prokázáno, že pacienti s tumory vyššího grade (grade podle Fuhrmanové 3 a 4) mají horší dobu přežití specifickou pro karcinom a dobu přežití bez výskytu metastáz než pacienti s tumory s nižším grade (grade 1 a 2) [45].
Histologický podtyp — má signifikantní vliv na dobu přežití 5 let, která kolísá od 87 % u chromofobního a papilárního karcinomu, po 69 % u karcinomu z jasných buněk, a která je velmi krátká u tumoru sběrných kanálků [46].
Mikrovaskulární invaze (MVI) — bylo prokázáno, že mikrovaskulární invaze souvisí se vznikem a recidivou metastáz [47-49,51]. U 39 % pacientů s MVI došlo po střední době 72 měsíců k progresi onemocnění, zatímco pouze u 6,2 % pacientů bez MVI došlo po 160 měsících k progresi onemocnění [50]. U onemocnění T1N0M0 s MVI byla během 1 roku po nefrektomii zaznamenána 45% míra progrese. Ve studii zahrnující 230 pacientů byla recidiva zaznamenána u 46 % pacientů s MVI, ale pouze u 6 % pacientů bez MVI [51]. Dále byla prokázána souvislost mezi MVI a velikostí tumoru, nukleárním grade, patologickým stadiem, zasažením lymfatických uzlin a přítomností sarkomatoidních znaků. Ve studii zahrnující pacienty s onemocněním T1-2N0M0 byla u pacientů s MVI zaznamenána 45% míra přežití bez onemocnění po dobu 5 let a u pacientů bez MVI 90% míra přežití [52].
Sarkomatoidní změny — sarkomatoidní změny se mohou vyskytovat u jakéhokoliv typu RCC, častěji však u pacientů s pokročilejším onemocněním. I po přizpůsobení tumoru jeho stadiu a velikosti mají pacienti s tumorem se sarkomatoidními změnami špatnou prognózu se střední dobou přežití 9—19 měsíců, 22% mírou doby přežití po dobu 5 let a 13% mírou doby přežití po 10 let (vs. 79 % a 76 % u pacientů s tumorem bez sarkomatoidních změn) [13,14].
Histologicky prokázaná nekróza tumoru se vyskytuje přibližně u 1/3 všech RCC a je spojena s 3krát vyšším rizikem úmrtí na karcinom [53,54].
Barvení CA IX — exprese CA IX úzce souvisí s dobou přežití. Nízká úroveň barvení tkáně představuje u pacientů s metastazujícím renálním karcinomem špatný nezávislý prognostický faktor. Riziko lze dále predikovat pomocí stanovení T stadia, grade podle Fuhrmanové, zasažení lymfatických uzlin a celkového stavu pacienta. U nemetastazujícího onemocnění s vysokým rizikem vzniku progrese umožňuje nízká úroveň nabarvení tkáně predikovat výsledek podobně jako u pacientů s metastazujícím onemocněním [55].
Invaze sběrného systému — zasažení urotelu RCC se vyskytuje u přibližně 14 % případů a obvykle je pozorováno u větších (≥ pT3) tumorů ze světlých buněk se sarkomatoidními znaky, vyšším grade podle Fuhrmanové, vaskulární invazí a tedy horší prognózou se střední dobou přežití 19 měsíců a 1,4krát vyšším rizikem úmrtí než u pacientů, u nichž nedojde k zasažení sběrného systému. U pacientů s uroteliální invazí a lokalizovaným karcinomem stadia T1 nebo T2N0 byla zaznamenána lepší doba přežití specifická pro karcinom, ale i v těchto případech dosahovala maximálně 46 měsíců [56,57]. Další klinické faktory s negativním dopadem na prognózu onemocnění jsou afroamerická rasa, špatný celkový stav, nižší hladina feritinu a lymfadenopatie [58-62].
Trombocytóza, definovaná počtem destiček > 400 000, představuje u nemetastazujícího onemocnění v časném stadiu po nefrektomii negativní prognostický faktor [63].
Kachexie, charakterizovaná symptomy celkového diskomfortu, úbytku váhy, anorexie nebo hypoalbuminemie představuje nezávislý predikátor horší doby přežití u onemocnění T1, s výraznějším zhoršením u tumorů vyššího grade [64].
S objevením cílené terapie bude stanovení RCC v budoucnu využívat molekulární faktory, jako například části mTOR dráhy [65].
Peter T. Nieh, MD
Kenneth Ogan, MD
Fray F. Marshall, MD
Department of Urology, Emory University School of Medicine, Emory Clinic, Atlanta, GA, USA
Zdroje
1. Chow WH, Devesa SS, Warren JL et al. Rising incidence of renal cell cancer in the United States. Jama 1999; 281(17): 1628-1631.
2. Richstone L, Scherr DS, Reuter VR et al. Multifocal renal cortical tumors: frequency, associated clinicopathological features and impact on survival. J Urol 2004; 171(2 Pt1): 615-620.
3. Blute ML, Itano NB, Cheville JC et al. The effect of bilaterality, pathological features and surgical outcome in nonhereditary renal cell carcinoma. J Urol 2003; 169(4): 1276-1281.
4. Zincke H, Swanson SK. Bilateral renal cell carcinoma: influence of synchronous and asynchronous occurrence on patient survival. J Urol 1982; 128(5): 913-915.
5. Storkel S, Eble JN, Adlakha K et al. Classification of renal cell carcinoma: Workgroup No. 1. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997; 80(5): 987-989.
6. Kovacs G, Akhtar M, Beckwith BJ et al. The Heidelberg classification of renal cell tumours. J Pathol 1997; 183(2): 131-133.
7. Kovacs G. Molecular differential pathology of renal cell tumours. Histopathology 1993; 22(1): 1-8.
8. Mancilla-Jimenez R, Stanley RJ, Blath RA. Papillary renal cell carcinoma: a clinical, radiologic, and pathologic study of 34 cases. Cancer 1976; 38(6): 2469-2480.
9. Guinan PD, Vogelzang NJ, Fremgen AM et al. Renal cell carcinoma: tumor size, stage and survival. Members of the Cancer Incidence and End Results Committee. J Urol 1995; 153(3 Pt 2): 901-903.
10. Fleming S, Lewi HJ. Collecting duct carcinoma of the kidney. Histopathology 1986; 10(11): 1131-1141.
11. Rumpelt HJ, Storkel S, Moll R et al. Bellini duct carcinoma: further evidence for this rare variant of renal cell carcinoma. Histopathology 1991; 18(2): 115-122.
12. Chao D, Zisman A, Pantuck AJ et al. Collecting duct renal cell carcinoma: clinical study of a rare tumor. J Urol 2002; 167 : 71-74.
13. Mian BM, Bhadkamkar N, Slaton JW et al. Prognostic factors and survival of patients with sarcomatoid renal cell carcinoma. J Urol 2002; 167(1): 65-70.
14. de Peralta-Venturina M, Moch H, Amin M et al. Sarcomatoid differentiation in renal cell carcinoma: a study of 101 cases. Am J Surg Pathol 2001; 25(3): 275-284.
15. Schillinger F. Acquired cystic kidney disease in renal insufficiency: a multicentre study. Group of Nephrologists of the East of France. Eur J Med 1993; 2(8): 457-460.
16. Hoshida Y, Nakanishi H, Shin M et al. Renal neoplasias in patients receiving dialysis and renal transplantation: clinico-pathological features and p53 gene mutations. Transplantation 1999; 68(3): 385-390.
17. Kuper H, Boffetta P, Adami HO. Tobacco use and cancer causation: association by tumour type. J Intern Med 2002; 252(3): 206-224.
18. Chow WH, Gridley G, Fraumeni JF jr et al. Obesity, hypertension, and the risk of kidney cancer in men. N Engl J Med 2000; 343(18): 1305-1311.
19. Grossman E, Messerli FH, and Goldbourt U. Does diuretic therapy increase the risk of renal cell carcinoma? Am J Cardiol 1999; 83(7): 1090-1093.
20. Mandel JS, McLaughlin JK, Schlehofer B et al. International renal-cell cancer study. IV. Occupation. Int J Cancer 1995; 61(5): 601-605.
21. Gago-Dominguez M, Yuan JM, Castelao JE et al. Regular use of analgesics is a risk factor for renal cell carcinoma. Br J Cancer 1999; 81(3): 542-548.
22. Lindblad P, Wolk A, Bergstrom R et al. The role of obesity and weight fluctuations in the etiology of renal cell cancer: a population-based case-control study. Cancer Epidemiol Biomarkers Prev 1994; 3(8): 631-639.
23. Shapiro JA, Williams MA, Weiss NS. Body mass index and risk of renal cell carcinoma. Epidemiology 1999; 10(2): 188-191.
24. Jayson M, Sanders H. Increased incidence of serendipitously discovered renal cell carcinoma. Urology 1998; 51(2): 203-205.
25. Konnak JW, Grossman HB. Renal cell carcinoma as an incidental finding. J Urol 1985; 134(6): 1094-1096.
26. Thompson IM, Peek M. Improvement in survival of patients with renal cell carcinoma--the role of the serendipitously detected tumor. J Urol 1988; 140(3): 487-490.
27. Ou YC, Yang CR, Ho HC et al. The symptoms of renal cell carcinoma related to patients‘ survival. J Chin Med Assoc 2003; 66(9): 537-543.
28. Tsui KH, Shvarts O, Smith RB et al. Renal cell carcinoma: prognostic significance of incidentally detected tumors. J Urol 2000; 163(2): 426-430.
29. Kim HL, Belldegrun AS, Freitas DG et al. Paraneoplastic signs and symptoms of renal cell carcinoma: implications for prognosis. J Urol 2003; 170(5): 1742-1746.
30. Ritchie AW, Chisholm GD. The natural history of renal carcinoma. Semin Oncol 1983; 10(4): 390-400.
31. Pritchyk KM, Schiff BA, Newkirk KA et al. Metastatic renal cell carcinoma to the head and neck. Laryngoscope 2002; 112(9): 1598-1602.
32. Greene LF, Page DL, Fleming D et al. American Joint Committee on Cancer (AJCC). Cancer Staging Manual. 6. ed. New York: Springer-Verlag 2002.
33. Sobin L, Wittekind C. TNM Classification of Malignant Tumors. 6. ed. New York: John Wiley & Sons 2002.
34. Delahunt B, Kittelson JM, McCredie MR et al. Prognostic importance of tumor size for localized conventional (clear cell) renal cell carcinoma: assessment of TNM T1 and T2 tumor categories and comparison with other prognostic parameters. Cancer 2002; 94(3): 658-664.
35. Zisman A, Pantuck AJ, Chao D et al. Reevaluation of the 1997 TNM classification for renal cell carcinoma: T1 and T2 cutoff point at 4.5 rather than 7 cm. better correlates with clinical outcome. J Urol 2001; 166(1): 54-58.
36. Elmore JM, Kadesky KT, Koeneman KS et al. Reassessment of the 1997 TNM classification system for renal cell carcinoma.Cancer. 2003; 98(11): 2329-2334.
37. Igarashi T, Tobe T, Nakatsu HO et al. The impact of a 4 cm. cutoff point for stratification of T1N0M0 renal cell carcinoma after radical nephrectomy. J Urol 2001; 165(4): 1103-1106.
38. Han KR, Bui MH, Pantuck AJ et al. TNM T3a renal cell carcinoma: adrenal gland involvement is not the same as renal fat invasion. J Urol 2003; 169(3): 899-903.
39. Moinzadeh A, Libertino JA. Prognostic significance of tumor thrombus level in patients with renal cell carcinoma and venous tumor thrombus extension. Is all T3b the same? J Urol 2004; 171 : 598-601.
40. Kim HL, Zisman A, Han KR et al. Prognostic significance of venous thrombus in renal cell carcinoma. Are renal vein and inferior vena cava involvement different? J Urol 2004; 171(2 Pt 1): 588-591.
41. Javidan J, Stricker HJ, Tamboli P et al. Prognostic significance of the 1997 TMN classification of renal cell carcinoma. J Urol 1999; 162 : 1277-1281.
42. Tsui KH, Shvarts O, Smith RB et al. Prognostic indicators for renal cell carcinoma: a multivariate analysis of 643 patients using the revised 1997 TNM staging criteria. J Urol 2000; 163 : 1090-1095.
43. Guinan P, Frank W, Saffrin R et al. Staging and survival of patients with renal cell carcinoma. Semin Surg Oncol 1994; 10 : 47-50.
44. Kinouchi T, Saiki S, Meguro N et al. Impact of tumor size on the clinical outcomes of patients with Robson stage I renal cell carcinoma. Cancer 1999; 85 : 689-695.
45. Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Patholog 1982; 6 : 655-663.
46. Cheville JC, Lohse CM, Zincke H et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27 : 612-624.
47. Sanchez de la Muela P, Zudaire JJ, Robles JE et al. Renal cell carcinoma: vena caval invasion and prognostic factors. Eur Urol 1991; 19 : 284-290.
48. Dekel Y, Koren R, Kugel V et al. Significance of angiogenesis and microvascular invasion in renal cell carcinoma. Pathol Oncol Res 2002; 8(2): 129-132.
49. Griffiths DF, Verghese A, Golash A et al. Contribution of grade, vascular invasion and age to outcome in clinically localized renal cell carcinoma. BJU Int 2002; 90(1): 26-31.
50. Van Poppel H, Vandendriessche H, Boel K et al. Microscopic vascular invasion is the most relevant prognosticator after radical nephrectomy for clinically nonmetastatic renal cell carcinoma. J Urol 1997; 158(1): 45-49.
51. Dall‘oglio MF, Antunes AA, Sarkis AS et al. Microvascular tumour invasion in renal cell carcinoma: the most important prognostic factor. BJU Int 2007; 100(3): 552-555.
52. Madbouly K, Al-Qahtani SM, Ghazwani Y et al. Microvascular tumor invasion: prognostic significance in low-stage renal cell carcinoma. Urology 2007; 69(4): 670-674.
53. Amin MB, Tamboli P, Javidan J et al. Prognostic impact of histologic subtyping of adult renal epithelial neoplasms: an experience of 405 cases. Am J Surg Pathol 2002; 26 : 281-291.
54. Cheville JC, Blute ML, Zincke H et al. Stage pT1 conventional (clear cell) renal cell carcinoma: pathological features associated with cancer specific survival. J Urol 2001; 166 : 453-456.
55. Bui MH, Seligson D, Han KR et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res 2003; 9(2): 802-811.
56. Palapattu GS, Pantuck AJ, Dorey F et al. Collecting system invasion in renal cell carcinoma: impact on prognosis and future staging strategies. J Urol 2003; 170(3): 768-772.
57. Uzzo RG, Cherullo EE, Myles J et al. Renal cell carcinoma invading the urinary collecting system: implications for staging. J Urol 2002; 167(6): 2392-2396.
58. Vaishampayan UN, Do H, Hussain M et al. Racial disparity in incidence patterns and outcome of kidney cancer. Urology 2003; 62(6): 1012-1017.
59. Zisman A, Pantuck AJ, Dorey F et al. Improved prognostication of renal cell carcinoma using an integrated staging system. J Clin Oncol 2001; 19 : 1649-1657.
60. Pantuck AJ, Zisman A, Dorey F, et al. Renal cell carcinoma with retroperitoneal lymph nodes: role of lymph node dissection.J Urol. 2003 Jun;169(6):2076-83.
61. Vasselli JR, Yang JC, Linehan WM et al. Lack of retroperitoneal lymphadenopathy predicts survival of patients with metastatic renal cell carcinoma. J Urol 2001; 166(1): 68-72.
62. Miyata Y, Koga S, Nishikido M et al. Relationship between serum ferritin levels and tumour status in patients with renal cell carcinoma. BJU Int 2001; 88(9): 974-977.
63. O‘Keefe SC, Marshall FF, Issa MM et al. Thrombocytosis is associated with a significant increase in the cancer specific death rate after radical nephrectomy. J Urol 2002; 168(4 Pt 1): 1378-1380.
64. Kim HL, Han K, Zisman A et al. Cachexia-like symptoms predict a worse prognosis in localized T1 renal cell carcinoma. J Urol 2004; 171 : 1810-1813.
65. Pantuck AJ, Seligson DB, Klatte T et al. Prognostic relevance of the mTOR pathway in renal cell carcinoma: implications for molecular patient selection for targeted therapy. Cancer 2007; 109(11): 2257-2267.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2007 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Guidelines EAU pro diagnostiku, léčbu a sledování renálního karcinomu
- Kvíz
- Prevence karcinomu prostaty
- Transrektální ultrazvukem vedené biopsie prostaty
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
- Možnosti chemoterapie u pacientů s karcinomem prostaty refrakterním na hormonální léčbu
- Editorial
- Co na publikované články říká profesor Patrik C. Walsh?
- EPCA a EPCA-2 jako potencionální biomarkery karcinomu prostaty
- Přednáška Patricka C. Walshe, MD, u příležitosti udělení doktorátu honoris causa Masarykovou univerzitou
- Patrick Craig Walsh Doctor Honoris Causa Universitatis Masarykianae Brunensis
- Klinické projevy, symptomy a prognostické faktory renálního karcinomu
- Paralýza signální dráhy: identifikace nových terapeutických cílů u renálního karcinomu
- Současné možnosti provedení nefroureterektomie
- Ze zahraničních periodik
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Současné možnosti provedení nefroureterektomie
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



