-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Paralýza signální dráhy: identifikace nových terapeutických cílů u renálního karcinomu
Autori: R. Barod; P. H. Maxwell
Pôsobisko autorov: Renal Research Section, Imperial College London, London, Great Britain
Vyšlo v časopise: Urol List 2007; 5(4): 78-82
Úvod
Zatímco operace v časném stadiu karcinomu obvykle umožní jeho vyléčení, prognóza metastazujícího karcinomu z renálních buněk (mRCC) je obvykle skličující - méně než 10 % pacientů se dožije dalších 5 let. Tumor je rezistentní jak na chemoterapii, tak i na radioterapii. U malé skupiny pacientů byl zaznamenán malý, ale přesto signifikantní účinek cytokinové terapie. Pro zlepšení výsledků léčby tohoto onemocnění je nezbytné objevit nové terapeutické přístupy. Objasnění genetických a molekulárních drah umožnilo identifikaci potenciálních cílů, které mohou být předmětem zkoumání nových preparátů.
Karcinom z renálních buněk (RCC) postihuje ve Velké Británii každoročně 6 000 osob a jeho incidence se stále zvyšuje (Cancer Research UK Cancer Incidence Statistics). RCC se dělí na několik heterogenních skupin tumorů, které lze na základě histologické charakteristiky rozdělit na 5 hlavních typů [1]:
- světlobuněčný tumor (70 80 %)
- papilární tumor (10 15 %)
- chromofobní tumor (5 10 %)
- medulární tumor (1 %)
- tumor sběrných kanálků (1 %)
Každý typ tumoru může mít rozdílný klinický průběh, může různě odpovídat na danou léčbu a může být zapříčiněn alteracemi různých genů.
Standardní léčba RCC sestává z operační excize primárního tumoru. Přestože u lokalizovaného onemocnění vede tato léčba obvykle k jeho vyléčení, přibližně u 30 % pacientů podstupujících operaci dojde k recidivě [2]. Pacienti s recidivujícím onemocněním a pacienti s diseminovaným onemocněním mohou mít benefit z aplikace interferonu-α (IFN-α) nebo interleukinu-2 (IL-2). Tato léčba má obvykle nízkou míru odpovědi a je spojena se signifikantní toxicitou, u malé skupiny pacientů však umožňuje déle trvající remisi [3,4]. Pro zlepšení výsledků léčby tohoto onemocnění je nezbytné objevit nové terapeutické přístupy.
Jak prokázaly některé studie, mnoho genetických alterací podílejících se na vzniku vzácného hereditárního syndromu renálního karcinomu (tab. 1) se vyskytuje i u běžnějších nehereditárních sporadických renálních tumorů. Právě díky tomuto zjištění byly v nedávné době objasněny některé molekulární dráhy podílející se na tumorogenezi RCC, což vedlo k odhalení nových terapeutických cílů. V tomto článku se zaměřujeme na genetické a molekulární dráhy, které se podílejí na vzniku RCC, a na některé nové preparáty pro léčbu tohoto onemocnění testované v právě probíhajících studiích.
Tab. 1. Hereditární syndromy podílející se na vzniku renálního karcinomu. 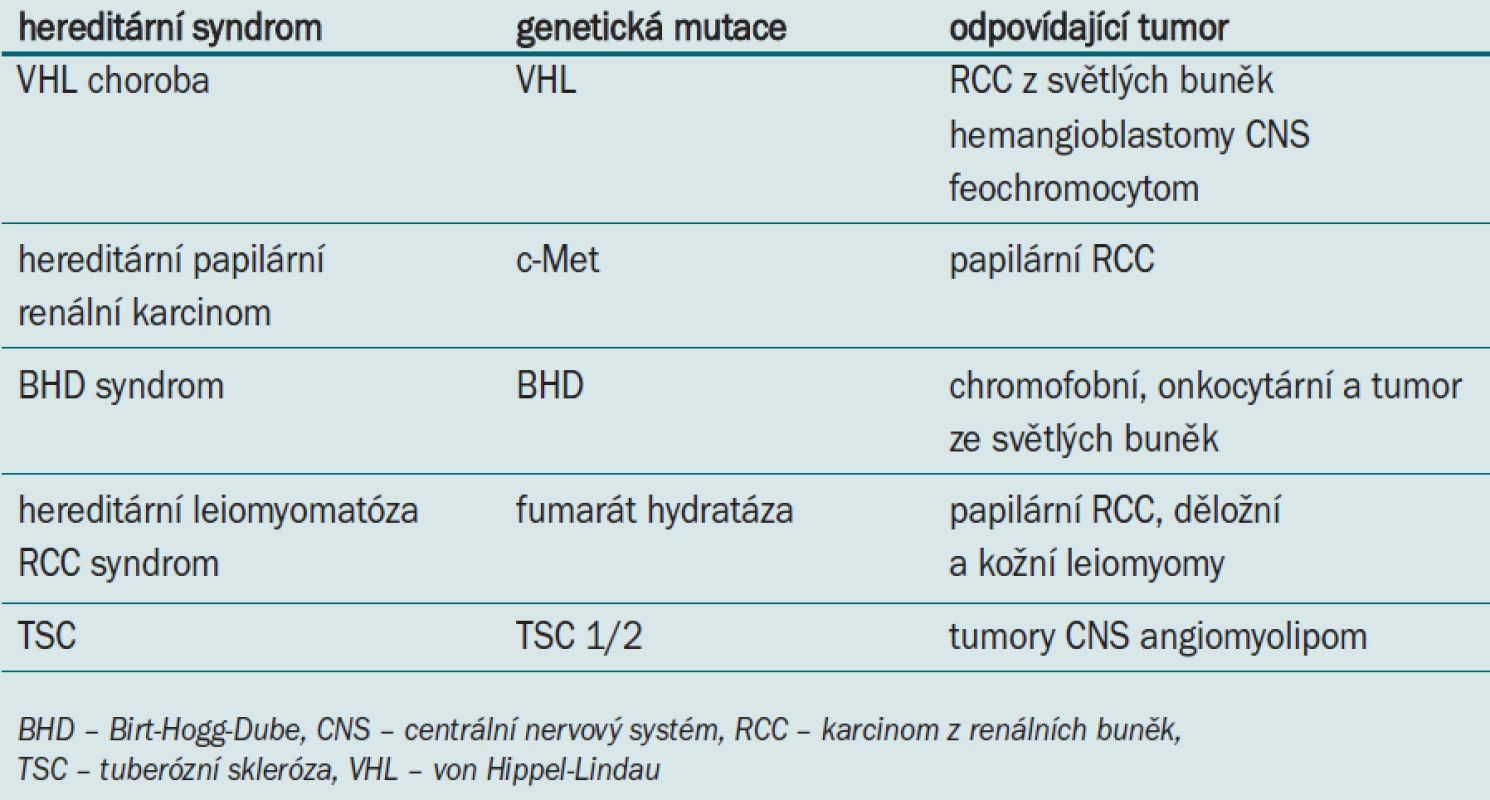
Von Hippelova-Lindauova choroba
Von Hippelova-Lindauova choroba (VHL) je vzácně se vyskytující autozomálně dominantní hereditární rakovinný syndrom, pro nějž je charakteristický vznik hemangioblastomu centrálního nervového systému (CNS), RCC z světlých buněk, feochromocytomu a tumorů pankreatu [5]. Postižené osoby zdědí zárodečnou linii mutace v jedné alele VHL (3p25) a v průběhu jejich života dojde u některých buněk ke vzniku somatické inaktivace druhé alely. Bylo prokázáno, že u 60—80 % pacientů se sporadickým RCC z světlých buněk dochází k somatické inaktivaci 2 alel VHL genu, a to buď přímou genetickou mutací, nebo hypermetylací promotoru [6].
Hlavní funkcí proteinu VHL je zacílení podjednotek faktoru α (HIFα), jejichž exprese je indukována hypoxií a jejichž destrukce probíhá za přítomnosti kyslíku [7]. HIF je transkripční faktor, který hraje klíčovou roli při adaptaci buněčných struktur na hypoxii (schéma 1). V případě defektní funkce VHL dochází k poklesu degradace HIF-α a buňky se chovají jako při reakci na permanentní hypoxický stimul. Následná akumulace HIF-α způsobuje transkripci genů podílejících se na angiogenezi, glykolýze a buněčné proliferaci. Všechny tyto procesy přispívají ke vzniku fenotypu tumoru.
Schéma 1. Vývoj HIF-α. V normoxii je HIF-α hydroxylován, což umožní rozpoznání VHL, jehož destrukci způsobí. V hypoxii, nebo v případě defektního VHL, se HIF-α akumuluje a přesune do jádra, kde se spolu s dalšími faktory váže na DNA, což vede k transkripci genů podílejících se na tumorogenezi. 
Angiogeneze hraje hlavní roli při patogenezi RCC a je zprostředkována zejména pomocí vaskulárního endoteliálního růstového faktoru (VEGF) a destičkového růstového faktoru (PDGF). Oba růstové faktory byly identifikovány jako cíle HIF [6].
C-MET
Kromě této centrální dráhy tumorogeneze, dochází u RCC často k alteraci genu c-Met. Aktivované mutace c-Met byly pozorovány u hereditárního papilárního renálního karcinomu a u podskupiny sporadických renálních karcinomů [8].
c-Met kóduje receptor tyrozin kinázy. Aktivace tohoto receptoru pomocí růstových faktorů zvyšuje signalizaci buněčné membrány do jádra prostřednictvím dráhy Raf/mitogenem-aktivovaná protein kináza/ extracelulárně regulovaná kináza (Raf/ MEK/ERK). Hlavním důsledkem signalizace v této dráze je buněčná proliferace, snížená buněčná adheze a zvýšená motilita buněk. Všechny tyto procesy se podílejí na vzniku metastáz tumoru in vivo.
PTEN a TSC1/2
Třetí významná molekulární dráha podílející se na vzniku RCC je aktivována ztrátou funkce tumor supresorové fosfatázy a homologu tenzinu odstraněného na chromozomu 10 (PTEN) nebo komplexu tuberózní sklerózy (TSC) 1 a 2 [9,10]. Mutace TSC 1 a 2 tvoří základ pro tuberózní sklerózu, syndrom, který zahrnuje hamartomy CNS, renální angiomyolipomy a příležitostně i RCC. Mutace TSC 1 a 2 nebo PTEN způsobují aktivaci dráhy savčího rapamycinu (mTOR), což vede k inhibici apoptózy a zvýšenému buněčnému růstu. Bylo prokázáno, že mTOR, nonreceptor tyrozin kinázy, zvyšuje HIF-1α na úrovni RNA i na úrovni proteinů [11].
Výše popsané tumorogenní dráhy však nefungují samostatně. Mezi jednotlivými dráhami existuje signifikantní nežádoucí signál, kdy patrně klíčovou roli hraje HIF (schéma 2).
Schéma 2. Genetické a molekulární dráhy RCC. 3 dráhy podílející se na tumorogenezi RCC. Mezi dráhami byl pozorován signifikantní nežádoucí signál, kdy může hrát významnou roli aktivace HIF. 
Nové terapie
Prozkoumání drah podílejících se na tumorogenezi RCC vedlo k objevu několika nových terapeutických agens, která působí na různé části těchto drah. Zajímavou metodou se jeví ovlivnění angiogeneze. Tento proces se vyskytuje v normální tkáni dospělého člověka pouze výjimečně, což by vedlo k pouze omezenému výskytu vedlejších účinků. Angiogeneze tumoru je zprostředkována zejména prostřednictvím VEGF a PDGF. Většina nových preparátů se zaměřuje právě na tyto cytokiny.
Bevacizumab
Bevacizumab je rekombinantní neutralizující protilátka, která působí proti VEGF. Bylo prokázáno, že bavacizumab inhibuje neovaskularizaci a snižuje mikrocévní denzitu in vitro [12,13]. V Evropské unii již byl bevacizumab v kombinaci s 5-fluorouracilem licencován pro léčbu první volby metastazujícího kolorektálního karcinomu.
V randomizované, placebem kontrolované studii II. fáze, v níž bylo 110 pacientů s refrakterním mRCC léčeno pomocí bevacizumabu, bylo prokázáno, že u pacientů užívajících tento preparát došlo k signifikantnímu prodloužení doby do progrese onemocnění (4,8 měsíců vs 2,5 měsíců), nebylo však zaznamenáno zlepšení celkové doby přežití [14]. Studie byla na základě těchto výsledků časně ukončena a v nejbližší době očekáváme výsledky studie III. fáze zkoumající účinek IFN-α versus IFN-α v kombinaci s bevacizumabem u pacientů s mRCC [15].
Obecně lze říci, že je tento preparát velmi dobře snášen. Hlavní vedlejší účinky zahrnují hypertenzi, proteinurii a komplikace při hojení zranění. Z tohoto důvodu se doporučuje s léčbou vyčkat až ł 28 dní po operaci.
Inhibitory kinázy
Inhibitory kinázy jsou malé molekuly, které způsobují inhibici enzymů tyrozin kinázy, které se podílejí na transdukci signálů. Receptorová tyrozin kináza (RTK) obvykle převádí extracelulární signály do nitra buňky, zatímco non-RTK se podílejí na nitrobuněčném přenosu signálů.
Sunitinib
Sunitinib je perorální multireceptorový inhibitor tyrozin kinázy, který účinkuje zejména na receptoru VEGF a PDGF, dále na KIT a FLT-3 [16]. 2 studie II. fáze testovaly aplikaci sunitinibu u pacientů s mRCC refrakterním na aplikaci cytokinů. V 1. studii (n = 63) byla u 37 % pacientů pozorována částečná odpověď [17]. Střední doba do nástupu účinku byla 10 týdnů, střední doba trvání odpovědi 54 týdnů. Ve 2. studii (n = 106) byla částečná odpověď zaznamenána u 26 % pacientů [18].
Obecně lze říci, že je tento preparát velmi dobře snášen. Nejčastěji se vyskytujícími vedlejšími účinky jsou únava (přibližně 40 %) a gastrointestinální komplikace (přibližně 15 %). Tyto slibné výsledky podnítily zahájení randomizované studie III. fáze, zkoumající aplikaci sunitinibu versus IFN-α u dříve neléčených pacientů s mRCC (n = 750) [19]. Polovina pacientů užívala pouze sunitinib, 2. polovina byla léčena pomocí IFN-α. Výsledky analýzy prokázaly, že ve skupině léčené sunitinibem byla signifikantně delší doba do vzniku progrese onemocnění (24,9 týdnů 47,3 týdnů). Ve skupině pacientů užívajících sunitinib byla zaznamenána 24,8% míra objektivní odpovědi, ve skupině léčené pomocí IFN-α byla zaznamenána 4,9% míra odpovědi. Jedná se o 1. studii III. fáze, která prokázala benefit aplikace multireceptorového inhibitoru tyrozin kinázy při léčbě mRCC první volby.
Sorafenib
Sorafenib byl původně vyvinut jako inhibitor receptorových Raf kináz [20], které jsou součástí intracelulární signální dráhy Raf/MEK/ERK, která se podílí na přežití buněk tumoru. Preklinické studie prokázaly, že kromě inhibice dráhy Raf/MEK/ERK sorafenib způsobuje také inhibici receptoru VEGF, receptoru tyrozin kinázy, fms podobné tyrozin kinázy 3, KIT a receptoru PDGF [21]. Dále má sorafenib antiangiogenní a antiproliferativní účinek.
V nedávné době byly uveřejněny výsledky multicentrické randomizované studie II. fáze testující účinek sorafenibu [22]. Všichni pacienti zahrnutí do této studie byli na počátku studie léčeni sorafenibem po dobu 12 týdnů (n = 202). Po uplynutí této doby pacienti s objektivní odpovědí na léčbu (40 %) v aplikaci dále pokračovali, pacienti s progresí onemocnění (30 %) léčbu ukončili. Pacienti se stabilním onemocněním byli randomizováni k užívání placeba (n = 33) nebo dalšímu pokračování terapie (n = 32). U pacientů, kteří pokračovali v aplikaci sorafenibu byla ve srovnání s placebem zaznamenána delší doba přežití bez známek progrese (24 týdnů vs 6 týdnů, p = 0,0087).
Na základě těchto povzbudivých zjištění byly uveřejněny výsledky multicentrické, dvojitě zaslepené, randomizované, placebem kontrolované studie III. fáze testující účinek sorafenibu — TARGET — Treatment Approaches in Renal Cancer Global Evaluation Trial (schéma 3) [23]. Sorafenib signifikantně zvýšil dobu přežití bez progrese na 24 týdnů, ve skupině pacientů užívajících placebo byla tato doba pouze 12 týdnů (p < 0,000001). Na základě předběžné analýzy doby přežití bez progrese onemocnění mohli pacienti přejít z užívání placeba na užívání sorafenibu. Poté bylau pacientů užívajících sorafenib zaznamenána střední hodnota celkové doby přežití 19,3 měsíců, u pacientů užívajících placebo 15,9 měsíců (listopad 2005).
Schéma 3. CT-zobrazení pacienta s mRCC ve studii TARGET. Horní 2 zobrazení byla pořízena v době, kdy pacient užíval placebo. Spodní 2 zobrazení ukazují zmenšení velikosti tumoru poté, co pacient přešel na aplikaci sorafenibu. 
Analýza však nesplňovala předem specifikovaná kritéria pro hranice statistického významu, proto je v plánu další analýza — jakmile budou platná data o přežití.
Obecně lze říci, že je sorafenib velmi dobře snášen, 12 % pacientů však vyžadovalo snížení dávky kvůli vedlejším účinkům. Nejčastějšími vedlejšími účinky byla anémie, únava, hypertenze a průjem. Přibližně u 30 % pacientů byla zaznamenána reakce postihující kůži rukou a chodidel, která se projevuje zvýšenou potivostí, hypersenzitivitou a bolestivostí. Tuto reakci lze minimalizovat včasnou detekcí a přerušením léčby a následnou úpravou dávkování.
Inhibitory mTOR
Aktivace mTOR má několik nežádoucích implikací, jako je například progrese buněčného cyklu, inhibice apoptózy a zvýšená exprese HIF-1α na úrovni mRNA a na úrovni proteinu [11]. Inhibice mTOR představuje potenciální terapeutickou strategii pro léčbu mRCC.
Temsirolimus (CCI-779)
CCI-779 je analog rapamycinu. V preklinických studiích bylo prokázáno, že způsobuje zástavu buněčného cyklu ve fázi G1 [24]. V randomizované studii II. fáze (n = 111) byly intravenózně aplikovány různé dávky CCI-779 pacientům s pokročilým refrakterním RCC [25]. U 7 % pacientů byla zaznamenána objektivní odpověď, u 26 % byla pozorována méně významná odpověď. Nejčastějšími vedlejšími účinky (grade 3 a 4) spojenými s touto léčbou byla hyperglykemie (17 %), hypofosfatemie (13 %), anémie (9 %) a hypertriglyceridemie (6 %). Obecně lze říci, že výskyt vedlejších účinků nezávisel na aplikované dávce. Omezená míra odpovědi při aplikaci CCI-779 ve srovnání s moderními inhibitory kinázy, prokazuje, že samotná aplikace CCI-779 pravděpodobně nepřináší signifikantní klinický benefit. V nedávné době byly publikovány předběžné výsledky randomizované, otevřené studie III. fáze, sestávající ze 3 větví, která testovala aplikaci CCI-779, IFN-α a jejich kombinace, jako léčbu první volby u pacientů s mRCC se špatnou prognózou (n = 626) [26]. U pacientů léčených pouze CCI-779 byla zaznamenána signifikantně delší doba celkového přežití než u pacientů léčených pomocí IFN-α. Mezi skupinou pacientů léčených pomocí IFN-α a skupinou pacientů užívajících kombinovanou terapii však nebyl zaznamenán signifikantní rozdíl v celkové době přežití. Význam těchto výsledků bude markantnější, jakmile dojde k vyzrání dat pro přežití.
Budoucnost
Přestože byl v oblasti vývoje těchto preparátů zaznamenán výrazný pokrok, stále zůstává řada nezodpovězených otázek. Je vhodné tyto preparáty vzájemně kombinovat, nebo je aplikovat v kombinaci s imunoterapeutiky pro dosažení synergního benefitu? Lze je aplikovat v rámci adjuvantní a neoadjuvantní terapie? Probíhající studie III. fáze se pokusí některé z těchto otázek objasnit.
Další důležitá otázka je délka trvání léčby. Tyto preparáty mají cytostatický účinek a je pravděpodobné, že vyžadují dlouhodobou aplikaci. V tomto případě by bylo nezbytné zabývat se otázkami týkajícími se toxicity a kvality života a možnosti vzniku rezistence na léčbu.
Dále je třeba zjistit, zda mohou mutace příslušných onkogenů a genů způsobujících supresi tumoru umožnit predikci individuální odpovědi na konkrétní preparát. Vzhledem k tomu, že různé tumory souvisejí s různými genetickými mutacemi různých drah, se tato možnost jeví jako pravděpodobná, což by lékaři umožnilo volbu konkrétního preparátu u jednotlivých pacientů.
Nezbytné je provedení dalších studií zaměřujících se na ostatní potencionální cíle. HIF představuje potenciální bod prolínání různých drah podílejících se na tumorogenezi RCC (schéma 2) a je pravděpodobné, že jeho inhibice může přinášet benefit. Bylo zaznamenáno několik různých inhibitorů, které však mohou mít omezenou specifitu. Doposud byly prokázány povzbudivé výsledky in vitro, ale pouze nevýznamný benefit in vivo [27]. Další studie zabývající se HIF a biomarkery jeho aktivace tedy mohou poskytnout cenné informace pro diagnostiku, prognózu a léčbu RCC.
Závěr
Americký úřad pro kontrolu léčiv a potravin (FDA) a Evropská unie schválily užívání bevacizumabu, sunitinibu a sorafenibu. Klinické studie prokázaly signifikantní benefit těchto preparátů při léčbě mRCC. Zaznamenána byla zvyšující se míra odpovědi a delší doba do vzniku progrese onemocnění; jednoznačné zlepšení celkové doby přežití je třeba teprve prozkoumat. V kombinaci s orální aplikací inhibitorů kinázy a díky jejich dobré snášenlivosti představují tato agens významný pokrok v dnešní léčbě mRCC. Ve studiích III. fáze byl navíc prokázán benefit sunitinibu a CCI-779 při léčbě první volby mRCC.
Tyto nové preparáty mohou způsobit převrat v dosavadním způsobu léčby mRCC. Urologové by se měli podílet na všech fázích vývoje těchto agens, od laboratorního výzkumu až po klinické studie, s vidinou jejich budoucího využití.
Poděkování
Práce Ravi Baroda je finančně podporována společností Kidney Research UK a The Royal College of Surgeons of England. Laboratorní výzkum je dále financován TheBritish Heart Foundation, Cancer Research UK a EU FP6 Integrated Project ‚Euroxy‘.
Ravi Barod, MD
Patrick H. Maxwell, MD
Renal Research Section, Imperial College London, London, Great Britain
Zdroje
1. Cheville JC, Lohse CM, Zincke H et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003;27 : 612—24.
2. Motzer RJ, Bander NH, Nanus DM. Renal-cell carcinoma. N Engl J Med 1996;335 : 865—75.
3. Interferon-alpha and survival in metastatic renal carcinoma: early results of a randomised controlled trial. Medical Research Council Renal Cancer Collaborators. Lancet 1999;353 : 14—7.
4. McDermott DF, Regan MM, Clark JI et al. Randomized Phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005;23 : 133—41.
5. Kaelin WG Jr. Molecular basis of the VHL hereditary cancer syndrome. Nat Rev Cancer 2002;2 : 673—82.
6. Kaelin WG Jr. The von Hippel-Lindau tumor suppressor gene and kidney cancer. Clin Cancer Res 2004;10 : 6290S—5S.
7. Maxwell PH, Wiesener MS, Chang GW et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature 1999;399 : 271—5.
8. Schmidt L, Duh FM, Chen F et al. Germline and somatic mutations in the tyrosine kinase domain of the MET protooncogene in papillary renal carcinomas. Nat Genet 1997;16 : 68—73.
9. Brenner W, Farber G, Herget T et al. Loss of tumor suppressor protein PTEN during renal carcinogenesis. Int J Cancer 2002;99 : 53—7.
10. Henske EP. The genetic basis of kidney cancer: why is tuberous sclerosis complex often overlooked? Curr Mol Med 2004;4 : 825—31.
11. Hudson CC, Liu M, Chiang GG et al. Regulation of hypoxiainducible factor 1alpha expression and function by the mammalian target of rapamycin. Mol Cell Biol 2002;22 : 7004—14.
12. Lee CG, Heijn M, di Tomaso E et al. Anti-vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions. Cancer Res 2000;60 : 5565—70.
13. Gerber HP, Ferrara N. Pharmacology and pharmacodynamics of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studies. Cancer Res 2005;65 : 671—80.
14. Yang JC, Haworth L, Sherry RM et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med 2003;349 : 427—34.
15. Rini BI, Halabi S, Taylor J et al. Cancer and Leukemia Group B 90206: A randomized Phase III trial of interferon-alpha or interferon-alpha plus anti-vascular endothelial growth factor antibody (bevacizumab) in metastatic renal cell carcinoma. Clin Cancer Res 2004;10 : 2584—6.
16. Mendel DB, Laird AD, Xin X et al. In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors. Clin Cancer Res 2003;9 : 327—37.
17. Motzer RJ, Michaelson MD, Redman BG et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006;24 : 16—24.
18. Motzer RJ, Rini BI, Bukowski RM et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006;295 : 2516—24.
19. Motzer RJ, Hutson TE, Tomczak P et al. ASCO Annual Meeting Proceedings Part I. J Clin Oncol 2006;24(18S):LBA3.
20. Wilhelm S, Chien DS. BAY 43-9006: preclinical data. Curr Pharm Des 2002;8 : 2255—7.
21. Wilhelm SM, Carter C, Tang L et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004;64 : 7099—109.
22. Ratain MJ, Eisen T, Stadler WM et al. Phase II placebocontrolled randomized discontinuation trial of sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol 2006;24 : 2505—12.
23. Escudier B, Szczylik C, Eisen T et al. ASCO Annual Meeting Proceedings. J Clin Oncol 2005;23(16S):4510.
24. Huang S, Bjornsti MA, Houghton PJ. Rapamycins: mechanism of action and cellular resistance. Cancer Biol Ther 2003;2 : 222—32.
25. Atkins MB, Hidalgo M, Stadler WM et al. Randomized Phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol 2004;22 : 909—18.
26. Hudes G, Carducci M, Tomczak P et al. ASCO Annual Meeting Proceedings Part I. J Clin Oncol 2006;24(18S):LBA4.
27. Belozerov VE, Van Meir EG. Hypoxia inducible factor-1: a novel target for cancer therapy. Anticancer Drugs 2005;16 : 901—9.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2007 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Guidelines EAU pro diagnostiku, léčbu a sledování renálního karcinomu
- Kvíz
- Prevence karcinomu prostaty
- Transrektální ultrazvukem vedené biopsie prostaty
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
- Možnosti chemoterapie u pacientů s karcinomem prostaty refrakterním na hormonální léčbu
- Editorial
- Co na publikované články říká profesor Patrik C. Walsh?
- EPCA a EPCA-2 jako potencionální biomarkery karcinomu prostaty
- Přednáška Patricka C. Walshe, MD, u příležitosti udělení doktorátu honoris causa Masarykovou univerzitou
- Patrick Craig Walsh Doctor Honoris Causa Universitatis Masarykianae Brunensis
- Klinické projevy, symptomy a prognostické faktory renálního karcinomu
- Paralýza signální dráhy: identifikace nových terapeutických cílů u renálního karcinomu
- Současné možnosti provedení nefroureterektomie
- Ze zahraničních periodik
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Co nového víme o PSMA (prostatický specifický membránový antigen): z pohledu urologa
- Transrektální ultrazvukem vedené biopsie prostaty
- Současné možnosti provedení nefroureterektomie
- Role operačního řešení při léčbě lokálně pokročilého karcinomu prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



