-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapeutická endourologie: obstrukce ureteropelvické junkce
Therapeutic endourology: ureteropelvic junction obstruction
Endourology has an important role in the diagnosis and management of ureteropelvic junction obstruction. In this review article we discuss the evolution of this role in the face of developing laparoscopic and robotic techniques. We will discuss the relative advantages and disadvantages of balloon dilation; antegrade, retrograde or cutting balloon endopyelotomy; and open or laparoscopic pyeloplasty. We will discuss the current criteria for patient selection using endoscopic inspection and adjunctive imaging modalities, and provide a step-by-step discussion of both the antegrade and retrograde endoscopic approaches to management of this disease.
Key words:
ureteropelvic junction obstruction, endourology, ureteroscopy
Autori: Mihir Desai 1; Bryan Hinck 2; Francis X. Keeley 3; Manoj Monga 2
Pôsobisko autorov: Cleveland Clinic 1; University of Minnesota 2; Bristol Urological Institute 3
Vyšlo v časopise: Urol List 2008; 6(3): 38-42
Súhrn
Endourologie hraje významnou roli při diagnostice a řešení obstrukce ureteropelvické junkce. Autoři tohoto článku hodnotí roli endourologie v souvislosti s rozvojem technik laparoskopické a robotické operace. Autoři uvádějí relativní výhody a nevýhody balónové dilatace, antegrádní, retrográdní nebo balónové endopyelotomie a otevřené nebo laparoskopické pyeloplastiky. Dále uvádějí současná kritéria pro výběr pacientů, která jsou založena na výsledcích endoskopického vyšetření, a dalších zobrazovacích vyšetření, a podrobný popis („krok za krokem“) léčby tohoto onemocnění pomocí antegrádního a retrográdního endoskopického přístupu.
Klíčová slova:
obstrukce ureteropelvické junkce,endourologie, ureteroskopieÚVOD
V současné době máme k dispozici následující možnosti operační léčby obstrukce ureteropelvické junkce (UPJO) – balónovou dilataci, antegrádní a retrográdní endopyelotomii a endopyelotomii pomocí incize provedené balónkem a otevřenou či laparoskopickou pyeloplastiku. Minimálně invazivní endoskopické techniky se díky své nižší morbiditě, kratší délce operace i hospitalizace staly rozšířenou volbou, přestože ve srovnání s otevřenou pyeloplastikou dosahují horšího výsledku [1–3]. Laparoskopická pyeloplastika dosahuje v současné době srovnatelných výsledků jako otevřená operace, je spojena s nižší pooperační morbiditou, ale také delším trváním zákroku [4,5].
Endourologie prodělala v průběhu uplynulých deseti let významný vývoj, který byl umožněn zmenšením velikosti flexibilních ureteroskopů, možností jejich aktivního ohýbání, zlepšením kvality zobrazovacích vyšetření, lepším výběrem malých instrumentů na jedno použití a zavedením holmium (Ho-YAG) laserové litotrypse. Provedení retrográdního ureteroskopického přístupu bylo poprvé popsáno v roce 1986 [6]. Od publikace první studie [7] byla provedena řada modifikací této techniky, které měly za následek zlepšení její bezpečnosti i výsledků. Autoři tohoto článku přinášejí přehled současných možností operačních metod léčby UPJ a jejich indikací pro výběr pacienta.
PŘEDOPERAČNÍ ZOBRAZOVACÍ VYŠETŘENÍ
Provedení předoperačního zobrazovacího vyšetření je nezbytné pro stanovení diagnózy a volbu vhodné léčby. Mezi známky obstrukce UPJ patří hydronefróza a obstrukce. Přítomnost hydronefrózy lze detekovat pomocí různých zobrazovacích metod, jako jsou například počítačová tomografie (CT), renální ultrazvukové vyšetření (US), zobrazovací vyšetření magnetickou rezonancí (MRI) a intravenózní urografie (IVU). Protokol CT pro detekci litiázy umožní odlišit UPJO od obstrukce způsobené přítomností litiázy. MAG-3 diuretická renografie slouží ke zhodnocení relativní funkce ledviny, typu drenážní křivky a celkové funkce. Nevýhodou všech výše uvedených modalit je fakt, že intermitentní obstrukce může být identifikována pouze tehdy, až pacient pociuje bolest.
Zobrazovací vyšetření také umožňuje stanovení etiologie onemocnění a posouzení anatomické charakteristiky pacienta. IVU umožňuje zobrazení lokalizace a délky zúžení ureteru, místa odstupu močovodu a posouzení dalších anatomických souvislostí. Pomocí IVU můžeme detekovat další příčiny hydronefrózy a s ní související bolesti, jako jsou například přítomnost litiázy, karcinomu z přechodných buněk, zevní komprese nebo striktury. Bolest může být vyvolána také kongenitálními abnormalitami (např. reflux). Podezření na přítomnost všech těchto abnormalit lze vyloučit pomocí CT, IVU nebo jiného typu zobrazovacího vyšetření.
Po stanovení diagnózy zvolíme na základě výsledků zobrazovacího vyšetření nejvhodnější druh léčby. Úspěšnost endopyelotomie může být u různých pacientů rozdílná v závislosti na některých faktorech, jako jsou například relativní renální funkce, přítomnost křížící cévy a stupeň hydronefrózy. Tato rozdílná anatomická charakteristika pacientů potvrzuje nezbytnost provedení zobrazovacího vyšetření. řada studií uvádí jako nejvýznamnější rizikový faktor předpovídající selhání endopyelotomie přítomnost křížící cévy [1–3,8]. Mezi zobrazovací techniky umožňující identifikaci křížící cévy patří běžná angiografie, spirální CT, dopplerovské ultrazvukové vyšetření s aplikací kontrastní látky, endoluminální ultrazvukové vyšetření a MRI [9]. Ačkoliv je spirální CT ve srovnání s angiografií méně invazivní a cenově výhodnější, neumožňuje tak přesné zobrazení [10].
Bylo prokázáno, že při detekci křížící cévy [11] a poskytování dalších informací, které mohou být užitečné při volbě místa incize při endopyelotomii, a o anatomické charakteristice pacienta, je endoluminální ultrazvukové vyšetření senzitivnější než CT. Nevýhodou této metody je však fakt, že výše uvedené informace můžeme získat pouze během samotné endopyelotomie. Ačkoliv mělo zlepšení kvality CT zobrazení za následek přesnější zobrazení při CT angiografii, neumožňuje tato metoda tak senzitivní zobrazení jako endoluminální ultrazvukové vyšetření [11]. V případě, že zvažujeme provedení endopyelotomie, provádíme pro detekci křížící cévy jako první skríninkový test spirální CT. Endoluminální ultrazvukové vyšetření provádíme až přímo před endopyelotomií, kdy nám umožní vyloučit přítomnost křížící cévy, která nebyla identifikována pomocí CT.
VÝBĚR PACIENTA – KDY ENDOPYELOTOMII NEPROVÁDĚT?
Je zřejmé, že ne všichni pacienti vyžadující operační léčbu obstrukce UPJ jsou vhodnými kandidáty pro endopyelotomii. Následující faktory předpovídají špatný výsledek endopyelotomie: délka striktury, přítomnost křížící cévy, závažná hydronefróza, špatná renální funkce a předchozí selhání endopyelotomie.
Renální funkce postižené ledviny < 25 % a rozsáhlá hydronefróza
Na úspěšnost endopyelotomie má vliv také stupeň hydronefrózy a relativní renální funkce. Danuser et al zaznamenali ve své studii v závislosti na narůstání hydronefrózy snížení míry úspěšnosti endopyelotomie [12]. U pacientů s objemem kalicho-pánvičkového systému < 50 ml uvádějí 87% míru úspěšnosti, u pacientů s objemem kalicho-pánvičkového systému 50–100 ml a > 100 ml tato míra klesá na pouhých 81 % a 69 %. Gupa et al uvádějí u pacientů s horší renální funkcí pokles míry úspěšnosti z 92 % na 54 % [13].
Křížící céva
Vliv křížící cévy na úspěšnost endopyelotomie stále zůstává rozporuplnou otázkou. Několik studií uvádí u pacientů s křížící cévou nižší míru úspěšnosti endopyelotomie. Van Cangh et al zaznamenali 42% míru úspěšnosti u pacientů s křížící cévou a 86% míru úspěšnosti u pacientů, u nichž nebyla křížící céva přítomna [2]. Nakada et al také uvádějí u pacientů s křížící cévou nižší míru úspěšnosti (64 % až 96 %) Acucise® endopyelotomie [14]. Křížící céva je detekována u mnoha pacientů podstupujících pyeloplastiku z důvodu selhání endopyelotomie až při operaci. Knudsen et al zaznamenali během otevřené revize pacientů, u nichž došlo k selhání endopyelotomie, 83% incidenci křížící cévy [15]. Tyto výsledky jsou v souladu se zjištěním Van Cangha et al, kteří detekovali křížící cévu u 87 % pacientů podstupujících otevřenou pyeloplastiku z důvodu selhání perkutánní endopyelotomie [8]. Gupta et al uvádějí odlišnou zkušenost – ve studii zahrnující 401 pacientů považovali přítomnost křížící cévy za příčinu selhání endopyelotomie pouze u 4 % subjektů [13].
V červnu v roce 2000 jsme u pacientů, u nichž byla detekována přítomnost křížící cévy, změnili léčebný postup. Dříve jsme u těchto pacientů prováděli endopyelotomii (incize provedena na základě informace získané při endoluminálním ultrazvukovém vyšetření). Náš nový postup spočívá v odložení endopyelotomie – v případě, že je detekována signifikantní křížící céva ve vztahu k UPJ – a provedení laparoskopické pyeloplastiky.
Obr. 1. Retrográdní pyelogram ukazuje zahnutí v oblasti UPJ, což vyvolává podezření na přítomnost křížící cévy, která byla následně prokázána během laparoskopické pyeoloplastiky. 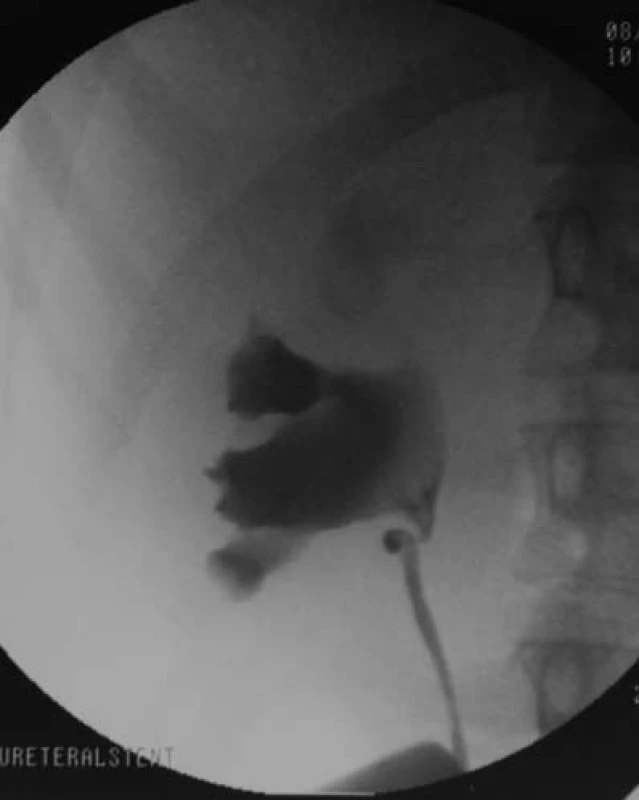
KDY ENDOPYELOTOMII PROVÁDĚT
Existuje několik výběrových kritérií, na jejichž základě se doporučuje upřednostnit ureteroskopický přístup před ostatními druhy léčby. Morbidní obezita a dřívější operace mohou předem vylučovat provedení laparoskopického přístupu. U pacientů se srdečními nebo plicními komorbiditami se doporučuje provedení endourologického přístupu.
O provedení antegrádního nebo ureteroskopického přístupu při endopyelotomii rozhoduje operatér na základě svých preferencí, přítomnosti litiázy a anatomických faktorů. Ve většině případů je upřednostňován ureteroskopický přístup – důvodem je nižší morbidita tohoto přístupu, absence incize a možnost ambulantního provedení tohoto zákroku (ve srovnání s perkutánním přístupem). Perkutánní přístup je upřednostňován u pacientů s litiázou, u nichž lze konkrementy odstranit současně v rámci léčby obstrukce. Provedení perkutánního přístupu se doporučuje také u pacientů, jejichž celkový tělesný habitus nebo anatomické faktory znemožňují optimální přístup k UPJ. Dostupnost flexibilních ureteroskopů a ureteroskopů o menších rozměrech omezila význam anatomických faktorů znesnadňujících provedení ureteroskopické endopyelotomie.
ANTEGRÁDNÍ ENDOPYELOTOMIE
Perkutánní endopyelotomii poprvé popsal Ramsay v roce 1984 [16] a následně Badlani v roce 1986 [17]. Míra úspěšnosti perkutánní endopyelotomie se pohybuje v rozmezí 67–88 %. Při provádění perkutánní endopyelotomie byly popsány různé technické modifikace: incize mezi dvěma drátěnými vodiči, incize přes zavedený stent, invaginace UPJ a zevní incize UPJ pomocí pyelotomie [17–20]. Dále byla popsána celá řada metod provádění incize – např. incize studeným nožem, incize pomocí elektrokauteru a incize provedená pomocí laseru. Nemáme k dispozici žádné údaje, které by vyzdvihovaly konkrétní techniku oproti ostatním. Úspěšnost operace závisí na správném výběru pacientů a provedení incize přes celou tloušku stěny striktury a jejím rozšíření do normální pánvičky a močovodu.
V celkové anestezii zavedeme do ledvinné pánvičky retrográdní drátěný vodič. Přes tento vodič zavedeme balónek, který s pomocí zvětšeného obrazu umístíme přímo pod UPJ. Pacienta umístíme do polohy na břiše a vytvoříme perkutánní kanál. Po vytažení vodiče perkutánním kanálem umístíme na vodič svorku a balónkovou cévku v blízkosti zevního uretrálního meatu. Před provedením incize zatáhneme za vodič tak, abychom UPJ posunuli do pánvičky.
Incizi provedeme Collinsovým skalpelem posteriorně nebo posterolaterálně a dbáme na to, abychom prořízli celou stěnu.
Incizi rozšíříme tak, aby bylo možné balónek volně vtáhnout do pánvičky. Následně balónek odstraníme a přes vodič zavedeme stent.
Perkutánní endopyeloplastika sestává z horizontální sutury standardní vertikální incize, kterou provedeme solitárním perkutánním kanálem pomocí nefroskopu. Horizontální sutura vertikální incize pomocí 2–3 přerušovaných vstřebatelných stehů podle Meineke-Miculikze vytváří Fengerovu plastiku. Tento typ perkutánní intra-renální sutury poprvé popsali Oshinsky et al v roce 1996 při užití běžných laparoskopických instrumentů a sutury [21]. Desai et al v roce 2001 znovu oživili zájem o perkutánní endopyeloplastiku a při této technice využili laparoskopické šicí zařízení (SewRight SR5, LSI Solutions, Victor, NY). Délka a průměr tohoto zařízení byly modifikovány tak, aby umožnily jeho současné užívání spolu s 26 Fr nefroskopem (Karl Storz, Culver City, CA) [22]. Studie prováděná na prasatech prokázala technickou proveditelnost endopyeloplastiky. Tato studie dále prokázala, že po endopyeloplastice se UPJ zahojí primárně zhojením stěny v plné tloušce, což umožňuje vznik širšího kalibru (ve srovnání s běžnou endopyelotomií). Tato zjištění jsou důkazem toho, že endopyeloplastika může vytvořit optimální prostředí pro primární hojení rekonstruované UPJ a tak zabezpečit funkční výhodu (ve srovnání s běžnou endopyelotomií).
Obr. 2. Míra dlouhodobé úspěšnosti antegrádní endopyelotomie. 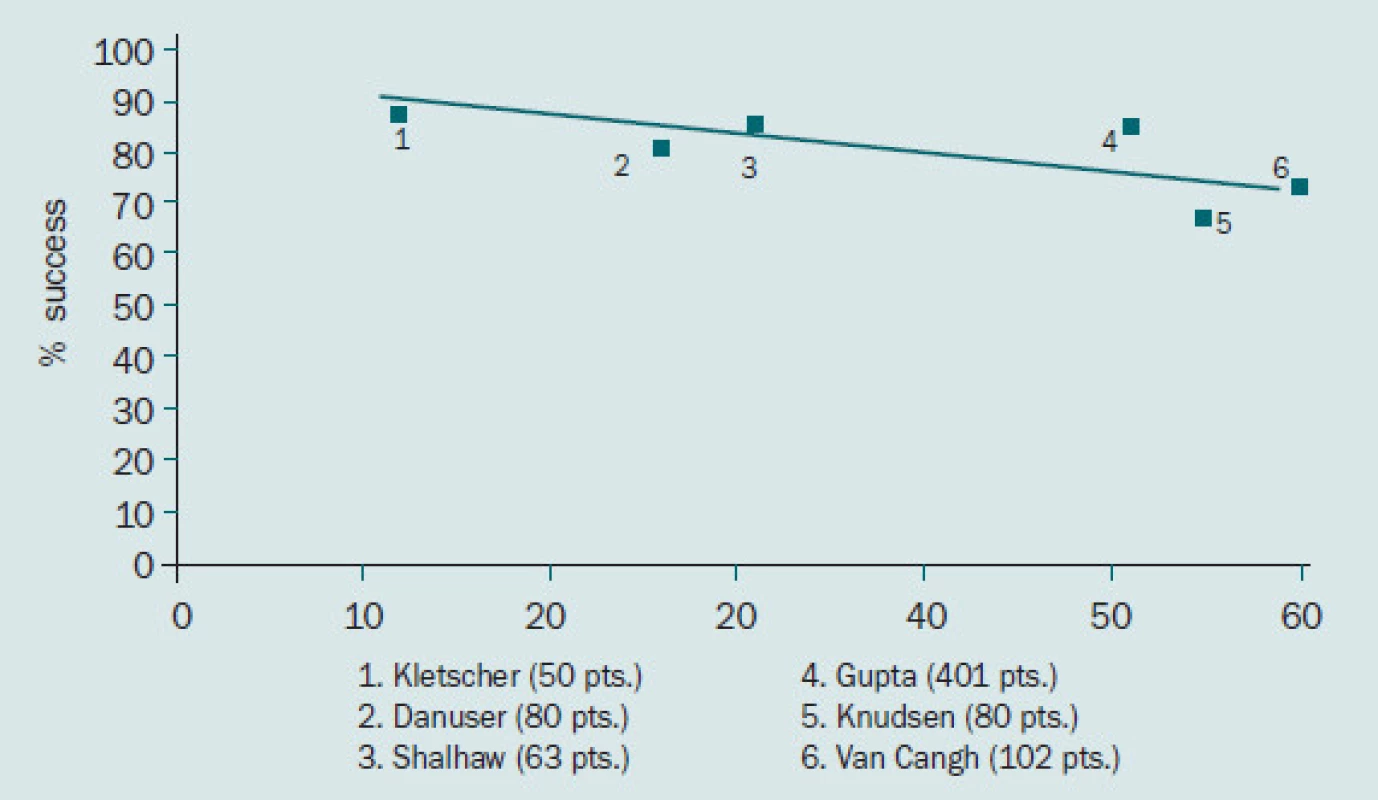
Obr. 3. Míra dlouhodobé úspěšnosti retrográdní endopyelotomie. 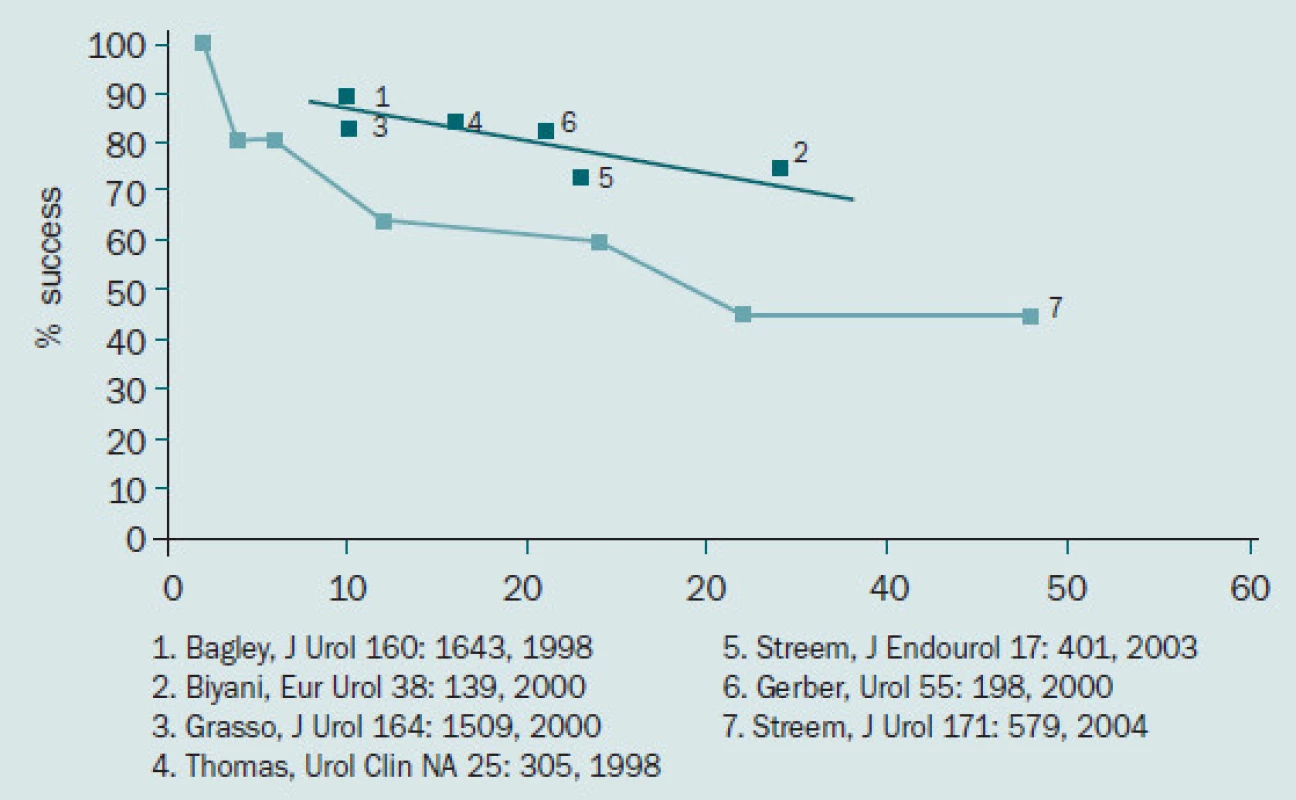
URETEROSKOPICKÁ METODA – V SOUČASNÉ DOBĚ UŽÍVANÁ TECHNIKA
Předoperační hodnocení a příprava
Pacienta je třeba upozornit na všechna potenciální rizika operace (krvácení, infekce, perforace, striktura) a informovat ho o všech benefitech a dostupných možnostech (perkutánní a otevřená procedura). Riziko krvácení vyžadující intervenci a riziko infekce během ureteroskopické endopyelotomie se v současné době pohybuje kolem 1 %. Míra dlouhodobé úspěšnosti zákroku u pacientů s křížící cévou je 50 %, míra dlouhodobé úspěšnosti u pacientů, u nichž není přítomna křížící céva, je 70 % (laparoskopická pyeoloplastika dosahuje 90–95% míry úspěšnosti). Pacienta je třeba informovat o tom, že po dobu 2–4 týdnů po operaci bude zaveden stent a 24–48 hod po zákroku uretrální katétr. Všichni pacienti musejí mít dva týdny před zákrokem negativní kultivaci moči. Ureteroskopická endopyelotomie se provádí v celkové nebo spinální anestezii.
Ureteroskopická technika
Sensor Guidewire (Boston Scientific) užíváme pro kanylaci ústí močovodu pod cystoskopickou kontrolou a do močovodu jej zavádíme pod skiaskopickou kontrolou, dokud se vodič nestočí v ledvinné pánvičce.
V případě, že pociujeme odpor, užijeme pro navigaci směrem k místu striktury a k jejímu překonání Terumo vodič (Glidewire). V této fázi zákroku může být vhodné aplikovat katétrem zavedeným přes vodič kontrastní látku, která nám pomůže vytyčit přesnou lokalizaci a délku striktury. V případě, že užíváme Terumo vodič, je třeba tento vodič vyměnit katétrem s otevřeným koncem za tuhý vodič. Hlavním úkolem v této fázi operace je nevytvořit falešnou cestu.
Při všech ureteroskopických zákrocích užíváme normální fyziologický roztok. Při zákroku, při němž se užívá elektrokauter, aplikujeme místo fyziologického roztoku sorbitol. Optimální kontrolu irigační látky (kdy nedochází k průtoku irigantu v případě, kdy je stříkačka v klidovém stavu) umožňuje pumpa na jedno použití (Microvasive, Natick, MA).
Semirigidní ureteroskop zavedeme podél drátěného vodiče, což umožní dilataci ústí močovodu a detekci případné neočekávané patologie v distálním a středním ureteru. V případě obtíží při zavádění semirigidního ureteroskopu můžeme pracovním kanálem zavést Amplatz tuhý drátěný vodič (Boston Scientific) a ureteroskop následně zavádět přes tento vodič.
U žen je obvykle možné pomocí semi-rigidního ureteroskopu dosáhnout UPJ a provést endopyelotomii. V opačném případě zavádíme ureteroskopem tuhý vodič, dokud pomocí skiaskopie neprokážeme, že se vodič stáčí v ledvinné pánvičce, a následně zahájíme zavádění flexibilního ureteroskopu.
V minulém desetiletí bylo běžnou praxí provádět před zavedením větších flexibilních ureteroskopů dilataci močovodu. Zavedení ohebných ureteroskopů s aktivní flexí o menším poloměru (tj. < 9 F) usnadnilo zavádění instrumentů do močovodu. Dříve prováděná dilatace ústí močovodu pomocí balónkových nebo sekvenčních dilatátorů se tak stala nadbytečnou. Dilataci intramurálního ureteru při zavádění nových ureteroskopů > 10 F je nyní nut-né provádět pouze ve 12 % případů [23]. Zavedení 10 F zaváděcího katétru (např. 8/10 Amplatz set) před zavedením bezpečnostního drátěného vodiče obvykle dostatečně připraví cestu pro průchod menších ohebných ureteroskopů. Balónová dilatace se provádí pouze ve výjimečných případech.
Zavádění flexibilního ureteroskopu podél drátěného vodiče do ústí močovodu může představovat časově velmi náročný krok. Běžná metoda zavádění flexibilního ureteroskopu spočívá v zavedení druhého drátěného vodiče s ohebným koncem do močovodu a zavádění ureteroskopu přes tento drátěný vodič za skiaskopické kontroly.
Obr. 4. Zavedení ureterálního stentu na počátku operace nám pomůže zvolit místo, kde provedeme incizi (bílá šipka) při antegrádní endopyelotomii. 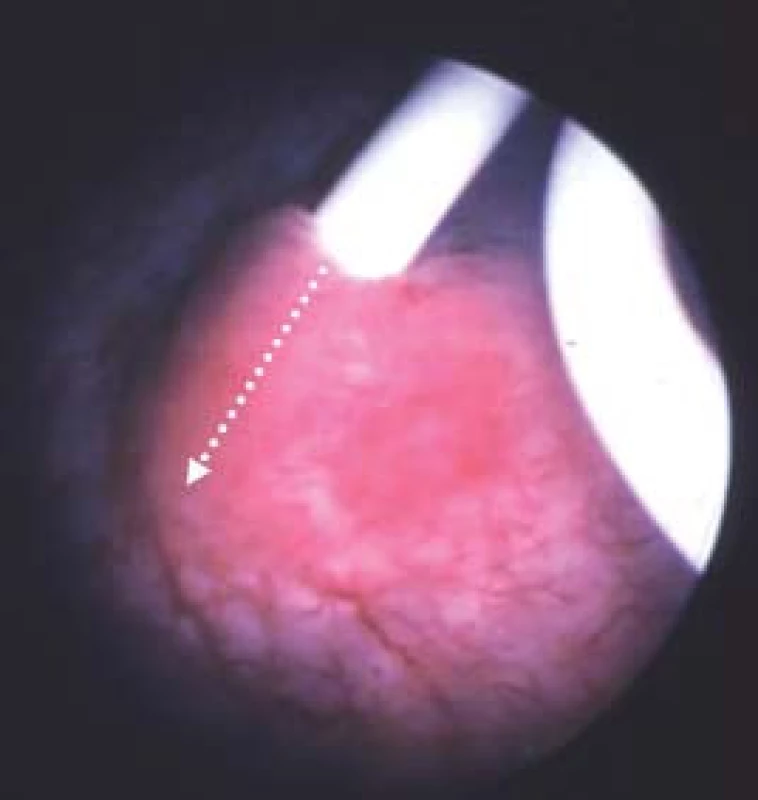
Poškození pracovního kanálu drátěným vodičem však může zkrátit životnost těchto křehkých instrumentů, zvláště pokud se pokoušíme zavést do ureteroskopu tuhý vodič.
Vyvinutí drátěných vodičů s ohebným koncem podstatně zvýšilo bezpečnost tohoto manévru (Sensorwire, Microvasive Inc., Natick, MA). Flexibilní ureteroskopy (FURS) se tedy v současné době zavádějí přes Sensorwire, Amplatz tuhý vodič ponecháme pouze jako bezpečnostní vodič.
Jestliže FURS zavádíme přes drátěný vodič, otáčíme ureteroskop tak, abychom jeho špičku umístili do linie s drátěným vodičem zavedeným v pracovním kanálu v poloze 12 hod, což umožňuje udržet ústí močovodu otevřené. Jakákoliv snaha o násilné zavedení ureteroskopu obvykle vede k ohnutí střední části ureteroskopu do močového měchýře, a tedy snížení rozsahu ohnutí špičky. Alternativní metodou je zavedení ureterální přístupové pochvy (Cook Flexor, 12/14 Fr) přes tuhý vodič, čímž vytvoříme přístupovou cestu pro zavedení flexibilního ureteroskopu, Sensorwire ponecháme pouze jako bezpečnostní vodič.
V případě, že není možné endoskop zavést přes místo striktury, může být užitečné pomocí 4mm nebo 5mm balónku dilatovat oblast striktury, a tak umožnit zavedení ureteroskopu. Následně zavedeme 365mikron laserové vlákno (orientované laterálně ) a provedeme ablaci striktury při pomalém vytahování ureteroskopu. K incizi laserovým vláknem obvykle postačí 1,0 J při 10 Hz. Tento proces opakujeme až do odhalení vazivových vláken. Případně můžeme použít Hulbertovu elektrodu nebo 2F a 3F elektrosondu s použitím 45W čistého řezacího proudu [24]. Je třeba dbát na to, abychom incizi v UPJ orientovali laterálně. Ureteroskop následně vyjmeme. Dilataci provádíme pomocí 5 nebo 6mm Uromax balónku při 20 psi po dobu 5 minut. V případě, že v balónku přetrvává zářez, provedeme opakovanou incizi laserovým vláknem. Ureterální stent kalibru 8 F ponecháme zavedený po dobu 2–3 týdnů, uretrální katétr vyjmeme po uplynutí 24–48 hod.
ZÁVĚR
Nejdůležitějším krokem pro úspěšnou antegrádní či retrográdní endourologickou léčbu obstrukce UPJ je volba vhodného pacienta. Pro pacienty s délkou striktury < 1,5 cm, > 30% renální funkcí, u nichž není přítomna křížící žíla ani závažná hydronefróza, může být vhodnou možností léčby endopyelotomie. Kratší doba hospitalizace a větší bezpečnost mohou vyvážit poměrně nižší míru úspěšnosti endopyelotomie (ve srovnání s laparoskopickou pyeloplastikou).
Mihir Desai1
Bryan Hinck2
Francis X. Keeley3
Manoj Monga2
1Cleveland Clinic
2University of Minnesota
3Bristol Urological Institute
Zdroje
1. Danuser H, Ackermann DK, Böhlen D, Studer UE. Endopyelotomy for primary ureteropelvic junction obstruction: risk factors determine the success rate. J Urol 1998; 159(1): 56–61.
2. Van Cangh PJ, Wilmart JF, Opsomer RJ et al. Long-term results and late recurrence after endoureteropyelotomy: a critical analysis of prognostic factors. J Urol 1994; 151(4): 934–937.
3. Conlin MJ, Bagley DH. Ureteroscopic endopyelotomy at a single setting. J Urol 1998; 159(3): 727–731.
4. Janetschek G, Peschel R, Altarac S, Bartsch G. Laparoscopic and retroperitoneoscopic repair of ureteropelvic junction obstruction. Urology 1996; 47(3): 311–316.
5. Moore RG, Averch TD, Schulam PG et al. Laparoscopic pyeloplasty: experience with the initial 30 cases. J Urol 1997; 157(2): 459–462.
6. Inglis JA, Tolley DA. Ureteroscopic pyelolysis for pelviureteric junction obstruction. Br J Urol 1986; 58(3): 250–252.
7. Meretyk I, Meretyk S, Clayman RV. Endopyelotomy: comparison of ureteroscopic retrograde and antegrade percutaneous techniques. J Urol 1992; 148(3): 775–782.
8. Van Cangh PJ, Nesa S, Galeon M et al. Vessels around the ureteropelvic junction: significance and imaging by conventional radiology. J Endourol 1996; 10(2): 111–119.
9. Martin X, Rouviere O. Radiologic evaluations affecting surgical technique in ureteropelvic junc-tion obstruction. Curr Opin Urol 2001; 11(2): 193–196.
10. Rouviere O, Lyonnet D, Berger P et al. Ureteropelvic junction obstruction: use of helical CT for preoperative assessment – comparison with intraarterial angiography. Radiology 1999; 213(3): 668 – 673.
11. Keeley FX, Moussa SA, Miller J, Tolley DA. A prospective study of endoluminal ultrasound versus computerised tomography angiography for detecting crossing vessels at the ureteropelvic junction. J Urol 1999; 162(6): 1938–1941.
12. Danuser H, Ackermann DK, Böhlen D, Studer UE. Endopyelotomy for primary ureteropelvic junction obstruction: risk factors determine the success rate. J Urol 1998; 159(1): 56–61.
13. Gupta M, Tuncay OL, Smith AD. Open surgical exploration after failed endopyelotomy: A 12-year perspective. J Urol 1997; 157(5): 1613–1619.
14. Nakada SY, Wolf JS Jr, Brink JA et al. Retrospective analysis of the effect of crossing vessels on successful retrograde endopyelotomy outcomes using spiral computerized tomography angiography. J Urol 1998; 159(1): 62–65.
15. Knudsen BE, Cook AJ, Watterson JD et al. Percutaneous antegrade endopyelotomy: long-term results from one institution. Urology 2004; 63(2): 230–234.
16. Ramsay JW, Miller RA, Kellett MJ et al. Percutaneous pyelolysis: indications, complications and results. Br J Urol 1984; 56(6): 586–588.
17. Badlani G, Eshghi M, Smith AD. Percutaneous surgery for ureteropelvic junction obstruction (endopyelotomy): technique and early results. J Urol 1986; 135(1): 26–28.
18. Savage SJ, Streem SB. Simplified approach to percutaneous endopyelotomy. Urology 2000; 56(5): 848–850.
19. Combe M, Gelet A, Abdelrahim AF et al. Ureteropelvic invagination procedure for endopyelotomy (Gelet technique): review of 51 consecutive cases. J Endourol 1996; 10(2): 153–157.
20. Ono Y, Ohshima S, Kinukawa T et al. Endopyeloureterotomy via a transpelvic extraureteral approach. J Urol 1992; 147(2): 352–355.
21. Oshinsky GS, Jarrett TW, Smith AD. New technique in managing ureteropelvic junction obstruction: percutaneous endoscopic pyeloplasty. J Endourol 1996; 10(2): 147–151.
22. Desai MM, Gill IS, Carvalhal EF et al. Percutaneous endopyeloplasty: a novel technique. J Endourol 2002; 16(7): 431–443.
23. Grasso M, Bagley D. Small diameter, actively deflectable, flexible ureteropyeloscopy. J Urol 1998; 160(5): 1648–1653.
24. Tawfiek ER, Liu J, Bagley DH. Ureteroscopic treatment of ureteropelvic junction obstruction. J Urol 1998; 160(5): 1643–1647.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2008 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Dnešní indikace extrakorporální litotrypse v léčbě urolitiázy – co se změnilo?
- Kvíz
- Aktualizace guidelines pro ureterální litiázu
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Terapeutická endourologie: obstrukce ureteropelvické junkce
- Úvodník
- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Terapeutická endourologie: karcinom z přechodných buněk lokalizovaný v horních cestách močových
- Ortotopická neovezika – současný stav
- Kombinovaná léčba BHP – aktuální stav
- Ze zahraničních periodik
-
Guidelines EAU pro karcinom močového měchýře (svalovinu invadujícího a metastazujícího)
verze 2007 - Guidelines EAU pro urolitiázu
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Guidelines EAU pro urolitiázu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



