-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aktuality v andrologické endokrinologii
Update in andrological endocrinology
The aim of the study was to review actual problems and recent findings in andrological endocrinology. Present guidelines for testosterone treatment of hypogonadism, especially in aging males, and for the methodology of androgen determination are discussed. Important andvances higlighted mechanisms for internalisation of SHBG-bound testosterone into the target cell, therapeutic possibilities for paternity of men with Klinefelter’s syndrome, secular trends in decline of testosterone levels, prevention of prostate diseases of aging men, male hormonal contraception, andrological aspect of other diseases, esp. of disturbed thyroid function, and the role of human feromones for gender identity.
Key words:
testosterone, therapy, secular trends, prostate, Klinefelter’s syndrom, male contraception, human feromones
Autori: L. Stárka
Vyšlo v časopise: Urol List 2008; 6(4): 54-58
Súhrn
Cílem přehledu je upozornit na některé aktuální otázky a recentní objevy, které se týkají andrologické endokrinologie. Stručně jsou zmíněna omezení některých současných směrnic pro léčbu testosteronem, zejména u stárnoucích mužů, a pro výběr metod pro stanovení testosteronu. Důležitých pokroků bylo dosaženo v poznání mechanismů internalizace testosteronu vázaného na SHBG v cílových buňkách, v terapeutických možnostech pro získání možnosti paternity u mužů s Klinefelterovým syndromem, v zjištění sekulárních trendů poklesu hladin testosteronu, v postupech pro prevenci onemocnění prostaty u starších mužů, v oblasti mužské hormonální antikoncepce, v poznání andrologických aspektů jiných onemocnění, zejména u poruch funkce štítné žlázy, a v poznání úlohy lidských feromonů pro pohlavní identitu.
Klíčová slova:
testosteron, léčba, sekulární trendy, prostata, Klinefelterův syndrom, tyreopatie, mužská antikoncepce, lidské feromonyÚVOD
Andrologie bude v globalizovaném světě zřejmě hrát stále významnější roli, zejména z důvodu svého blízkého vztahu s populačními krizemi. O andrologickou problematiku se začínají zajímat instituce v Číně [1], a to nikoli jen kvůli otázce kontroly porodnosti, anebo v Rusku, i když asi z opačného důvodu, protože Rusku hrozí demografický pokles o 1 milion obyvatel ročně [2], nebo podle jiných zdrojů o 2 miliony za dekádu.
I když historie andrologie začíná někdy v polovině minulého století a pojem andrologie byl zaveden poprvé v roce 1951 [3], nemá dosud jako medicínský obor dostatečně definované místo v systému výuky, vzdělávání, praxi a ekonomice zdravotnictví, a proto se hlasy, které po upevnění pozice andrologie volají, objevují ve světě [1,2] i u nás [4]. Důležitými kroky jsou směrnice pro léčbu andrologických onemocnění, ať už užšího národního, nebo nadnárodního charakteru. K nim v poslední době patří zejména směrnice americké Endokrinologické společnosti [5,6] a dalších společností (australské a německé) o léčbě hypogonadismu androgeny nebo severské směrnice o léčbě poruch sestupu varlat [7], směrnice o embryologických a andrologických laboratořích [8] nebo o mikrodelecích chromozomu Y [9].
Pro andrologii, která je multidisciplinárním oborem medicíny, je endokrinologie nezbytnou součástí. Hormonální regulační děje mužského reprodukčního systému, ať už z aspektu teoretického, nebo praktického klinického, jsou proto předmětem zájmu andrologů. Proto také v seznamu sledovaných objevů [10] v andrologii stojí na předním místě objev mikro-RNA, genetika v andrologii, využití kmenových buněk v terapii, selektivní androgeny SARM, megalin, SHBG a hypotéza volných androgenů, enviromentální exohormony (disruptory) nebo sekulární trendy poklesu fertility a androgenů u mužů, stejně jako otázky léčebné praxe, jakými jsou vztahy testosteronu a metabolického syndromu, vztah androgenů a prostatických onemocnění, hypogonadismus s pozdním nástupem – andropauza, androgeny a kardiovaskulární onemocnění, mužská antikoncepce nebo možnosti koncepce u Klinefelterova syndromu pomocí in vitro fertilizace.
NÁHRADNÍ ANDROGENNÍ TERAPIE
Vzhledem k tomu, že zájem o vhodnou androgenní substituci u stárnoucího muže s hypogonadismem s pozdním nástupem stále trvá, o čemž svědčí např. skutečnost, že v USA stoupl prodej testosteronových přípravků za poslední desetiletí 15 – 20krát, byl významným počinem americké Endokrinologické společnosti pokus o vydání směrnic k léčbě testosteronem [6]. Z analýzy podkladů plyne, že z hlediska medicíny důkazů nejsou dosud zjištěná data dostatečným důvodem k výraznějšímu doporučení této léčby a že terapie musí být výrazně individuální. Proto jsou směrnice do značné míry vágní, nedefinují ani váhu různých, většinou nespecifických příznaků hypogonadismu, ani hranici, od které je třeba hladiny androgenů považovat za nedostatečné pro stárnoucí muže (tab. 1). Cílem léčby má být udržení hladiny testosteronu stabilně v dolní polovině referenčního rozmezí, což ovšem s dostupnými přípravky není lehký úkol a naděje se vkládá do přípravků transdermálních nebo depotně injekčních.
Tab. 1. Různá kritéria pro diagnózu mužského hypogonadismu. 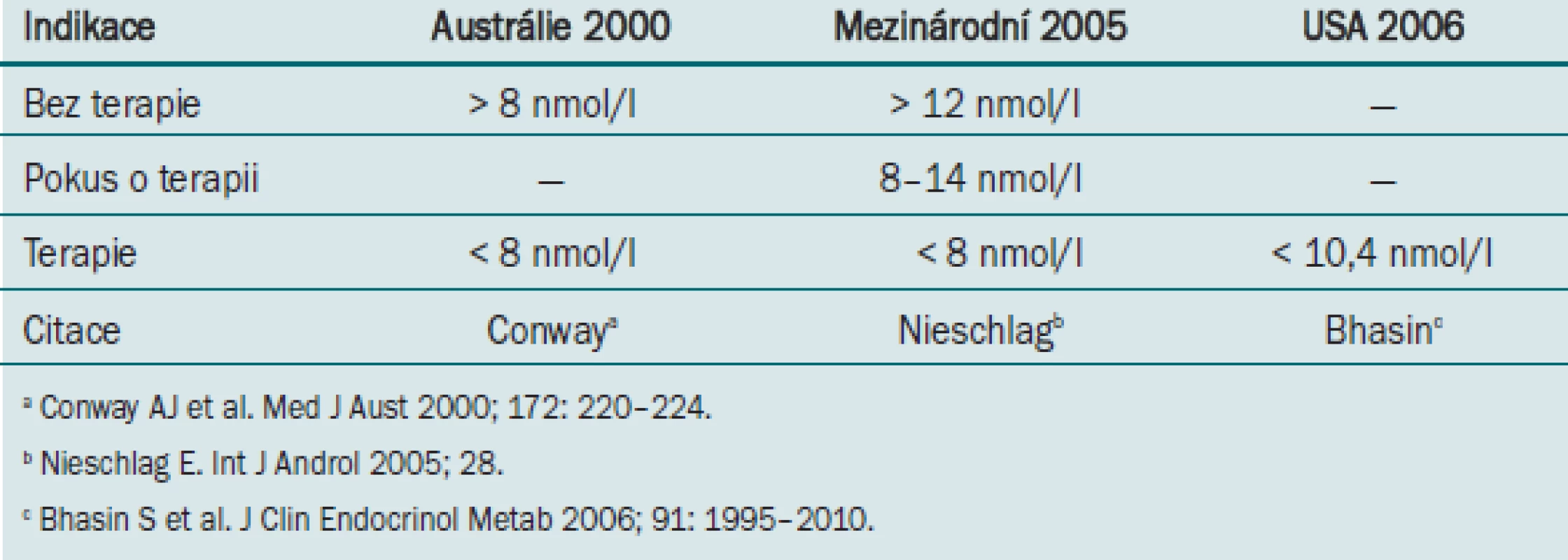
Ne zcela vyjasněnou otázkou stále zůstává riziko benigního nebo maligního onemocnění prostaty při dlouhodobém podávání androgenů. Přestože v Marksově studii [11], ve které bylo podáváno 150 mg testosteronundekanoátu i. m. 2 týdny mužům ve věku 44–78 let a s hladinami endogenního testosteronu pod 10,4 nmol/l, nebyly zjištěny žádné změny obsahu testosteronu nebo dihydrotestosteronu v prostatické tkáni, takže tato poměrně nízká dávka androgenů nevede ke zvýšení intraprostatických androgenů, riziko pro možný následný karcinom prostaty zůstává nejisté. Z pohledu dosavadních snah o léčbu benigní hyperplazie prostaty omezením vzniku dihydrotestosteronu v prostatě použitím inhibitorů steroidní 5 -reduktázy se jeví jako poněkud nekonvenční návrh [12] podávat jako substituční androgen právě dihydrotestosteron s poukazem na neschopnost tohoto steroidu být substrátem pro aromatizaci a tím omezit vznik a efekt estrogenů v prostatě.
PREVENCE ONEMOCNĚNÍ PROSTATY
Léčba benigní hyperplazie prostaty inhibitory steroidní 5α-reduktázy – finasteridem a ještě lépe dutasteridem – je prokazatelně také prevencí karcinomu prostaty [13].
Poměrně hodně pozornosti bylo věnováno prevenci benigní hyperplazie a eventuálně i karcinomu prostaty dietními opatřeními. Zatímco diety omezující oxidační stres nevykazovaly významnější úspěchy, diety měnící metabolické prostředí a dostupnost hormonálně aktivních látek jsou považovány za úspěšnější. Dietní opatření vhodná pro zmírnění metabolického syndromu – u lidí nízkotuková dieta s omega-3-polynenasycenými mastnými kyselinami, bohatá na škrob a spojená s fyzickým cvičením (Pritkinův program) – vedla ke snížení hladin inzulinu, estradiolu, inzulinu podobného růstového faktoru IGF-I, volného testosteronu a vzestupu SHBG a IGF-I - vázajícího proteinu 1 [14]. Hyperinzulinemie stimuluje jaterní produkci IGF-I, a hraje tak roli při rozvoji karcinomu prostaty. Riziko karcinomu prostaty nesnižoval vyšší příjem vitaminu E, C a beta-karotenu, nižší riziko bylo v osmileté studii provedené na téměř 30 tisících mužů pozorováno u mužů, kteří kouřili [15]. Riziko symptomů benigní hyperplazie prostaty podle recentní studie [16] zahrnující téměř 5 tisíc probandů bylo zvýšeno konzumací červeného masa a také při vyšší konzumaci alkoholu. Zatímco vyšší přísun antioxidantů neměl prakticky žádný efekt, mírné snížení rizika bylo asociováno s lykopenem, zinkem a suplementací vitaminem D. Snížení rizika prostatických onemocnění se spojuje s jídelníčkem bohatým na obiloviny, sójové výrobky a ovoce a zeleninu s obsahem beta-karotenů [17]. Vyšší příjem masa snad škodí vyšším obsahem heterocyklických aminů a polycyklických aromatických látek vznikajících při grilování a smažení. Nepříznivý účinek mléčných výrobků byl hledán v aktivitě a-methylacylCoA racemázy, potřebné k beta-oxidaci fytanové kyseliny přítomné v mase a mléce nebo v potlačení aktivity vitaminu D kalciem. Z dietních antioxidantů, jako je kurkumin, genistein, lykopen, polyfenoly z čaje, granátové jablko a lupeol, zaujal nejvíce pozornosti resveratrol [18–21]. U tohoto fenolu odvozeného od trans-3,5,4'-trihydroxystilbenu a obsaženého zejména v hroznech, oříškách a bobulovinách, jehož obsahu v červeném vínu se připisuje efekt „francouzského paradoxu“, nejde jen o antioxidační účinek, ale také o jeho chemopreventivní působení a v prostatě také o přímé působení na down-regulaci androgenních receptorů a postranslační děje [20]. Protože koncentrace resveratrolu v potravinách nevyvolávají dostatečně velký účinek, je v poslední době snaha farmaceutického průmyslu zaměřena na syntetický resveratrol nebo jeho účinná analoga.
VÝBĚR METOD PRO STANOVENÍ TESTOSTERONU
Ve směrnici americké Endokrinologické společnosti o léčbě testosteronem se jako doporučená metoda pro měření koncentrace testosteronu v séru uvádí stanovení celkového testosteronu. Stanovení volného nebo biologicky dostupného testosteronu by sice mělo lépe vystihnout aktivní složku androgenního spektra, ale metodické obtíže a nedostupnost složitějších metod v některých laboratořích vedly k návrhu používat celkový testosteron. Otázkou zůstává, nakolik jsou tyto metody správné a jaká je jejich specifita [22]. Např. pro účel dopingové kontroly nejsou imunoanalytické postupy vůbec akceptovány pro nedostatečnou specifitu, kterou poskytuje pouze hmotová spektrometrie. Pro rutinní klinické účely je to dosud metoda příliš nákladná a náročná na přístrojové vybavení, ale v budoucnosti tomu tak být nemusí. Pro určení diagnózy hypogonadismu je tedy zvolen celkový testosteron, ale dolní mez jeho normálního rozmezí není jednotně přijímána (tab. 1). Nově otevřenou otázkou je, nakolik je pro biologickou aktivitu rozhodující vazba testosteronu na sexuální hormony vázající globulin, SHBG.
HYPOTÉZA VOLNÝCH HORMONŮ
Podle současně uznávané hypotézy se předpokládá, že jen lipofilní a snadno difundovatelné volné steroidní hormony jsou biologicky aktivní a také že jen volné hormony překračují buněčnou membránu a vstupují do buňky pasivní difuzí díky své lipofilní povaze. Nedávno byl popsán protein megalin, který je obrovským endocytickým receptorem z rodiny LDL - receptorů o molekulové hmotnosti asi 600 kDa. Tento receptor působí jako transportní protein na povrchu buněk. Mezi jeho funkce patří také přenos komplexu steroid – globulin přes plazmatickou membránu. Po hydrolýze komplexu steroid – vazebný protein v lysozomech je volný hormon uvolněn a teprve pak může uplatňovat svůj účinek na cílovou buňku. Jiný membránový protein, cubilin, se váže na megalin a jeho interakce s megalinem a AMN (45-50 kDa proteinem amnioless genu) zajišťuje intracelulární stabilitu. Na megalinu nezávislý transportní mechanismus steroidního záchytu je asi také přítomen, protože fenotypy megalin-deficitních myší nejsou zcela totožné s fenotypy myší s vyřazenými receptory pro androgeny nebo estrogeny [23].
Hammes [24] prokázal, že na rozdíl od hypotézy volných hormonů je megalinem zprostředkována cesta k buněčnému záchytu biologicky aktivních androgenů a estrogenů vázaných na SHBG. V souladu s touto funkcí megalinu je pozorování [25], že chybění exprese receptoru u megalin-knockoutovaných myší vede k poruše sestupu varlat do skrota u samců a k blokádě otvírání vaginy u samic. Oba tyto děje jsou přísně závislé na pohlavních steroidních hormonech a podobné poruchy lze nalézt po podávání androgenních, respektive estrogenních antagonistů. Hammesova zjištění tedy potvrzují skutečnost, že existuje endocytická cesta pro androgeny a estrogeny vázané na protein, která je důležitá pro uplatnění jejich klíčové role ve vývoji reprodukčních orgánů.
Internalizace komplexů sexuálních steroidů s SHBG umožněná těmito receptory mění i naše dosavadní představy o mechanismu transportu steroidních hormonů do nitra cílových buněk. Tedy v podstatě převrací současný klinický pohled na význam plazmatických hladin SHBG a volných steroidů.
SEKULÁRNÍ TREND V POKLESU TESTOSTERONEMIE
Začátkem 90. let upozornil Skakkebeak na sekulární pokles počtu spermií u mužů. V Dánsku bylo ve 40. letech minulého století nalézáno v semeni průměrně 100 mil. spermií/ml a 40 mil/ml bylo považováno za podprůměrný počet, který již mohl být příčinou komplikací pro paternitu. Dnes se odhaduje, že 40 % mužské populace má méně než oněch 40 mil/ml [26,27]. Vedle sekulárního poklesu počtu spermií byl však zaznamenán také podobný pokles hladin androgenů. V Massachusetts Male Aging Study [28] bylo sledováno celkem 1700 mužů po dobu 15 let ve třech různých časových úrovních a podobně tomu bylo v dánské studii [29], která zjistila, že zatímco mezi generacemi klesá celkový testosteron, volný testosteron se nemění, snad z důvodu poklesu SHBG (obr. 1). Příčina byla spatřována ve změně zdravotního stavu, životních návycích, nárůstu výskytu endokrinních disruptorů v životním prostředí nebo v metodických faktorech studie. Snad by bylo možné spatřovat podíl na tomto jevu i v socio-biologických vztazích. Vysoká testosteronemie je v přírodě spojena se samčí dominancí, ať již ve skupině, nebo přímo v páru. Uplatnění přirozené dominance se v mužské části současnou civilizací poznamenané populace značně omezuje, až vytrácí.
Obr. 1. Sekulární trend poklesu hladin testosteronu. Podle cit. [29]. ![Sekulární trend poklesu hladin testosteronu. Podle cit. [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ce19d8c1c532c81ff3662afe2d25dfa4.jpg)
MUŽSKÁ HORMONÁLNÍ ANTIKONCEPCE
Liu et al [30] podali meta-analýzu 30 studií o mužské hormonální antikoncepci, v nichž bylo hodnoceno celkem 1549 mužů. U současných mužských antikonceptiv, založených buď na čistých androgenech, nebo na jejich kombinaci s progestiny [31,32], jde především o spolehlivost a reverzibilitu účinku. Hlavní ukazatele sledují ve světě dva hlavní programy zaměřené na tuto problematiku: studie CONRAD NIH a studie WHO. Obě sledují androgen/progestinové přípravky. Nedostatkem je, že se sledují nepřímí ukazatelé, tj. kvalita spermatu pomocí spermiogramu, nikoli selhávání antikoncepce, jako je tomu v testování ženské hormonální antikoncepce. Další brzdou rozvoje mužské hormonální antikoncepce je malý zájem farmaceutických firem, takže v komerčním klinickém zkoušení nejsou zatím žádné přípravky.
KLINEFELTERŮV SYNDROM
Klinefelterův syndrom byl objeven Harry Klinefelterem v roce 1942, rozpoznán byl jako genetická odchylka karyotypu 47,XY v roce 1959. Podle standardizované diagnózy byli muži s Klinefelterovým syndromem vyhledáváni v Dánsku [33] a ve Velké Británii [34] a byla zjištěna prevalence syndromu 156/100 000. Každý třetí muž s hypogonadismem a každý desátý s azoospermií je nositelem Klinefelterova syndromu. Zdá se, že obecně je tento syndrom značně poddiagnostikován. Bylo prokázáno, že celoživotní hypogonadismus má ve svém důsledku redukci úmrtí na ICHS a další kardiovaskulární onemocnění, na karcinom prostaty a na další neoplazie, jako je karcinom plic, lymfomy a karcinom mammy. Klinefelterův syndrom je však pozitivně asociován s diabetem mellitus 1. typu, s epilepsií, kardiálními malformacemi a mozkovou mrtvicí.
U Klinefelterova syndromu se jedná o učebnicový příklad celoživotního hypogonadismu [35], u kterého dochází k zániku gamet již v průběhu puberty a v dospělosti bývá v 92 % azoospermie; u zbytku spermiogram nepřekračuje 0,1 mil. spermií/ml [36]. S výjimkou mozaiky byla sterilita neléčitelná a zbývala jen možnost oplodnění spermatem dárců nebo adopce. Dnes je paternita možná, nejedná se však o rutinní záležitost. První úspěšná intracytoplazmatická injekce spermií po TESE u nemozaikového Klinefelterova syndromu byla provedena v roce 1998. Dnes se uvádí úspěch při mikro-TESE v 70 %, při makro-TESE v 30 % [37]. Důležitými a nezodpovězenými otázkami je, zda předchozí běžná substituce androgeny nesnižuje prognózu úspěšné in vitro fertilizace nebo zda by se nemělo u chlapců s Klinefelterovým syndromem přistoupit ke kryoprezervaci semene již v nastupující pubertě, v období, kdy ještě nedošlo k úplné azoospermii.
ANDROLOGICKÉ ASPEKTY JINÝCH ONEMOCNĚNÍ
Pro svou častou asociaci s hypogonadismem nebo sexuální dysfunkcí byla v posledních letech také intenzivně studována onemocnění štítné žlázy [38,39]. Bylo zjištěno [38], že u hypertyroidních mužů je zvýšena prevalence hypoaktivního libida, předčasné ejakulace a erektilní dysfunkce a že každý druhý muž s hypertyreózou má předčasnou ejakulaci. U hypotyreózy byla sexuální dysfunkce pozorována v 2/3 případů. Důležitou skutečností bylo, že po normalizaci hladin hormonů štítné žlázy u hypertyroidních mužů klesla prevalence předčasné ejakulace z 50 % na 15 % a opožděná ejakulace u hypotyreózy se zlepšila u každého druhého pacienta. V jiné práci [40] byla zjištěna dvojnásobně vysoká prevalence erektilní dysfunkce u tyreopatií proti kontrolám ve stejné věkové skupině. Pro praxi je důležité ověřit u sexuálních poruch i funkci štítné žlázy, protože normalizace její funkce může pomoci zvládat i potíže sexuální. Pro poznání fyziologie mužské reprodukce je důležité uvědomit si na základě těchto poznatků i důležitost hormonů štítné žlázy, která se projevuje také např. v pozorování, že volný tyroxin je v pozitivní korelaci s koncentrací spermií v semeni [39] a že ve skutečnosti by tyroxin měl patřit do řady farmak, použitelných pro medikamentózní léčbu infertility [41].
Také další endokrinopatie a metabolická onemocnění v pořadí obezita, tyreopatie, diabetes mellitus zvyšují riziko sexuální dysfunkce [40–43]. Často je se sexuální dysfunkcí asociován metabolický syndrom [40,42].
FEROMONY U LIDÍ
I u lidí zasluhuje pozornost interpersonální signalizace cestou feromonů a prostřednictvím vomeronasálního, případně olfaktorického systému. Zpracování těchto signálů v CNS bylo sledováno zobrazovací technikou pozitronové emisní tomografie a jako signální látka pro aktivaci různých mozkových oblastí byl studován 4,16-androstadien-3-on (AND) a estrogenům blízký steroid estra-1,3,5(10),16-tetraen-3-ol (EST). Prvý z nich se nachází v mužském potu, druhý v moči žen. Bylo zjištěno, že čichání AND a EST aktivuje oblasti sexuálně dimorfických jader předního hypotalamu a že tato aktivace se liší podle pohlaví pokusné osoby a testované látky. Signál neprobíhá cestami olfaktorického vnímání vůní a pachů.
U heterosexuálních mužů je hypotalamus aktivován vnímáním EST, a nikoli AND, u heterosexuálních žen vnímáním AND, a nikoli EST. Bylo zjištěno, že na rozdíl od heterosexuálních mužů, ale stejně jako u heterosexuálních žen, homosexuální muži vykazují hypotalamickou aktivaci v odpovědi na AND [45]. U lesbických žen na rozdíl od heterosexuálních žen je signál AND zpracován olfaktorickými cestami, nikoli předním hypotalamem. Navíc je-li signálním feromonem EST, dojde u lesbiček k aktivaci předního hypotalamu podobně jako u heterosexuálních mužů [46]. U transsexuálů male-to-female je podobně jako u žen aktivován hypotalamus na signál AND, EST aktivuje amygdalu a kortex piriformis, ale částečně i hypotalamus, takže jeho aktivace má společné rysy aktivace jako u heterosexuálních mužů i heterosexuálních žen [47].
Poděkování: Práce vznikla v rámci grantu IGA NR/8525 - 5.
prof. MUDr. RNDr. Luboslav Stárka, DrSc.
Endokrinologický ústav Praha
Národní 8, Praha 1, 116 94
lstarka@endo.cz
Zdroje
1. Hu LQ. Future development of andrology in China. Zhonghua Nan Ke Xue 2005; 11(1): 3–6.
2. Artiukhin AA. The role of andrology as a field of reproductive medicine in the solution of demographic problems in Russia. Vestn Ross Akad Med Nauk 2007; (11): 50–52.
3. Isidori A. The history of modern andrology. Med Secoli 2001; 13(2): 255–268.
4. Kubícek V. The present status of andrology in the Czech Republic. Cas Lek Cesk 2002; 141(2): 61–64.
5. Bhasin S, Cunnigham GR, Hayes FJ, Matsumoto AM, Snyder PJ, Swerdloff RS, Montori VM. Testosterone therapy in adult men with androgen deficiency syndromes: an Endocrine society clinical practice guideline. J Clin Endocrinol Metab 2006; 91 : 1995 – 2010.
6. The Practice Committee of the American Society for Reproductive Medicine. Treatment of androgen deficiency in the aging male. Fertil Steril. 2004; 82 Suppl 1: S46–50.
7. Ritzén EM, Bergh A, Bjerknes R, Christiansen P, Cortes D, Haugen SE, Jörgensen N, Kollin C, Lindahl S, Läckgren G, Main KM, Nordenskjöld A, Rajpert-De Meyts E, Söder O, Taskinen S, Thorsson A, Thorup J, Toppari J, Virtanen H. Nordic consensus on treatment of undescended testes. Acta Paediatr. 2007; 96(5): 638–643.
8. Practice Committee of the American Society for Reproductive Medicine; Practice Committee of the Society for Assisted Reproductive Technology. Revised guidelines for human embryology and andrology laboratories. Fertil Steril. 2006; 86(5 Suppl): S57–72.
9. Simoni M, Bakker E, Krausz C. EAA/EMQN best practice guidelines for molecular diagnosis of y-chromosomal microdeletions. State of the art 2004. Int J Androl 2004; 27(4): 240–249.
10. Handelsman DJ. Update in andrology. J Clin Endocrinol Metab 2007; 92(12): 4505–4511.
11. Marks LS, Mazer NA, Mostaghel E, Hess DL, Dorey FJ, Epstein JI, Veltri RW, Makarov DV, Partin AW, Bostwick DG, Macairan ML, Nelson PS. Effect of testosterone replacement therapy on prostate tissue in men with late-onset hypogonadism: a randomized controlled trial. JAMA. 2006; 296(19): 2351–2361.
12. Sakhri S, Gooren LJ. Safety aspects of androgen treatment with 5alpha-dihydrotestosterone. Andrologia 2007; 39(6): 216–222.
13. Tindall Dj, Rittmaster RS. Rationale for Inhibiting 5alpha-Reductase Isoenzymes in the Prevention and Treatment of Prostate Cancer. J Urol. 2008; 179(4): 1235–1242.
14. Barnard RJ. Prostate cancer prevention by nutritional means to alleviate metabolic syndrome. Am J Clin Nutr. 2007; 86(3): 889–893.
15. Kirsh VA, Hayes RB, Mayne ST, Chatterjee N, Subar AF, Dixon LB, Albanes D, Andriole GL, Urban DA, Peters U. PLCO Trial. Supplemental and dietary vitamin E, beta-carotene, and vitamin C intakes and prostate cancer risk. J Natl Cancer Inst 2006; 98(4): 245–254.
16. Kristal AR, Arnold KB, Schenk JM, Neuhouser ML, Goodman P, Penson DF, Thompson IM. Dietary patterns, supplement use, and the risk of symptomatic benign prostatic hyperplasia: Results from the Prostate Cancer Prevention Trial. Am J Epdemiol 2008; 167(8): 925–934.
17. Stacewicz-Sapuntzakis M, Borthakur G, Burns JL, Bowen PE. Correlations of dietary patterns with prostate health. Mol Nutr Food Res 2008; 52(1): 114–130.
18. Khan N, Afaq F, Mukhtar H. Cancer Chemoprevention through dietary antioxidants: Progress and Promise. Antioxid Redox Signal 2008; 10(3): 475–510.
19. Shankar S, Singh G, Srivastava RK. Chemoprevention by resveratrol: molecular mechanisms and therapeutic potential. Front Biosci. 2007; 12 : 4839–4854.
20. Harada N, Murata Y, Yamaji R, Miura T, Inui H, Nakano Y. Resveratrol down-regulates the androgen receptor at the post-translational level in prostate cancer cells. J Nutr Sci Vitaminol (Tokyo) 2008; 53(6): 556–560.
21. Aggarwal BB, Bhardwaj A, Aggarwal RS, Seeram NP, Shishodia S, Takada Y. Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res 2004; 24(5A): 2783–2840.
22. Rosner W, Auchus RJ, Azziz R, Sluss PM, Raff H. Position statement: Utility, limitations, and pitfalls in measuring testosterone: an Endocrine Society position statement. J Clin Endocrinol Metab 2007; 92(2): 405–413.
23. Lin BC, Scanlan TS. Few things in life are „free“: cellular uptake of steroid hormones by an active transport mechanism. Mol Interv. 2005; 5(6): 338–340.
24. Hammes A, Andreassen TK, Spoelgen R et al. Role of endocytosis in cellular uptake of sex steroids. Cell 2005; 122(5): 751–762.
25. Kozyraki R, Goffolt F. Multiligand endocytosis and congenital defects: roles of cubilin, megalin and amnionless. Curr Pharm Des 2007; 13(29): 3038-3046.
26. Skakkebaek NE, Jorgensen N, Main KM, Rajpert-De Meyts E, Leffers H, Andersson AM, Juul A, Carlsen E, Mortensen GK, Jensen TK, Toppari J. Is human fecundity declining? Int J Androl 2006; 29(1): 2–11.
27. Andersson AM, Jorgensen N, Main KM, Toppari J, Rajpert-De Meyts E, Leffers H, Juul A, Jensen TK, Skakkebaek NE. Adverse trends in male reproductive health: we may have reached a crucial 'tipping point'. Int J Androl 2008; 31(2): 74–80.
28. Travison TG, Araujo AB, O'Donnell AB, Kupelian V, McKinlay JB. A population-level decline in serum testosterone levels in American men. J Clin Endocrinol Metab 2007; 92(1): 196–202.
29. Andersson AM, Jensen TK, Juul A, Petersen JH, Jorgensen T, Skakkebaek NE. Secular decline in male testosterone and sex hormone binding globulin serum levels in Danish population surveys. J Clin Endocrinol Metab 2007; 92(12): 4696–4705.
30. Liu PY, Swerdloff RS, Christenson PD, Handelsman DJ, Wang C. Hormonal Male Contraception Summit Group. Rate, extent and modifiers of spermatogenic recovery after hormonal male contraception: an integrated analysis. Lancet 2006; 367 : 1412–1420.
31. Heráček J, Urban M, Sobotka V, Lukeš M, Bittner L, Novotný T, Otava Z. Mužská antikoncepce. Urol Listy 2007; 5 : 2–33.
32. Amory JK. Contraceptive developments for men. Drugs Today (Barc). 2007; 43(3): 179–192.
33. Bojensen A, Juul S, Birkebaek NH, Gravholt CH. Morbidity in Klinefelter syndrome; a Danish register study based on hospital discharge diagnoses. Clin Endocrinol Metab 2006; 91 : 1254–1260.
34. Swerdlow AJ, Higgins CD, Schoemaker MJ, Wright AF, Jacobs PA. Mortality in patients with Klinefelter syndrome in Britain: a cohort study. J Clin Endocrinol Metab 2005; 88 : 6516–6522.
35. Handelsman DJ, Liu PY. Klinefelters syndrome: a microcosmos of male reproductive health. J Clin Endocrinol Metab 2006; 91 : 1220–1222.
36. Lafranco F, Kamischke A, Zitzmann M, Nieschalg E. Klinefelters syndrome. Lancet 2004; 364 : 273–283.
37. Schiff JD, Palermo GD, Veeck LL, Goldstein M, Rosenwaks Z, Schlegel PN. Success of testicular sperm injection and intracytoplasmic sperm injection in men with Klinefelter syndrome. J Clin Endocrinol Metab 2005; 90 : 6263–6267.
38. Carani C, Isidori AM, Granata A, Carosa E, Maggi M, Lenzi A, Jannini EA. Multicenter study on the prevalence of sexual symptoms in male hypo - and hyperthyroid patients. J Clin Endocrinol Metab 2005; 90(12): 6472–6479.
39. Meeker JD, Godfrey-Bailey L, Hauser R. Relationships between serum hormone levels and semen quality among men from an infertility clinic. J Androl. 2007; 28(3): 397–406.
40. Veronelli A, Masu A, Ranieri R, Rognoni C, Laneri M, Pontiroli AE. Prevalence of erectile dysfunction in thyroid disorders: comparison with control subjects and with obese and diabetic patients. Int J Impot Res 2006; 18(1): 111–114.
41. Chatterjee S, Chowdhury RG, Khan B. Medical management of male infertility. J Indian Med Assoc. 2006; 104(2): 74, 76–77.
42. Shabsigh R, Arver S, Channer KS, Eardley I, Fabbri A, Gooren L, Heufelder A, Jones H, Meryn S, Zitzmann M. The triad of erectile dysfunction, hypogonadism and the metabolic syndrome. Int J Clin Pract 2008; 62(5): 791–798.
43. Balercia G, Boscaro M, Lombardo F, Carosa E, Lenzi A, Jannini EA. Sexual symptoms in endocrine diseases: psychosomatic perspectives. Psychother Psychosom 2007; 76(3): 134–140.
44. Bhasin S, Enzlin P, Coviello A, Basson R. Sexual dysfunction in men and women with endocrine disorders. Lancet. 2007; 369(9561): 597–611.
45. Savic I, Berglund H, Lindström P. Brain response to putative pheromones in homosexual men. Proc Natl Acad Sci U S A 2005; 102(20): 7356-7361.
46. Berglund H, Lindström P, Savic I. Brain response to putative pheromones in lesbian women. Proc Natl Acad Sci U S A. 2006; 103(21): 8269–8274.
47. Berglund H, Lindström P, Dhejne-Helmy C, Savic I. Male-to-female transsexuals show sex-atypical hypothalamus activation when smelling odorous steroids. Cereb Cortex 2007 Dec 3.Metab 2006; 91 : 1995 – 2010.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2008 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Priapismus
- Sexuální dysfunkce: nejdůležitější zprávy z AUA 2008
- Systém hodnocení erektilní dysfunkce pomocí stupnice EHS
- Úvodník
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
- Peyronieho choroba
- Aktuality v andrologické endokrinologii
- Dlouhodobé následky léčby testikulárního karcinomu
- Role retroperitoneální lymfadenektomie u pacientů s nonseminomovými germinálními tumory varlat a poruchy ejakulace
- Klinická praxe založená na důkazech: Úvod do problematiky pro urology
- Klinická aplikace projektu Early Prostate Cancer Program
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Peyronieho choroba
- Priapismus
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



