-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
Key words:
POP, reconstruction, augmentation, synthetic mesh, interposition graft
Autori: A. Gomelsky; R. R. Dmochowski
Pôsobisko autorov: Vanderbilt University Medical Center, Nashville, TN, USA ; Louisiana State University Health Sciences Center, Shreveport, LA
Vyšlo v časopise: Urol List 2011; 9(2): 58-67
Súhrn
Klíčová slova:
POP, rekonstrukce, augmentace, syntetická síťka, vložení štěpuNejnovější studie uvádí, že incidence prolapsu pánevních orgánů (POP) a dalších poruch svaloviny pánevního dna se postupně zvyšuje. Autoři retrospektivní studie zahrnující členky společnosti Kaiser Permanente Northwest (Portland, OR, USA), které podstoupily operační léčbu prolapsu nebo inkontinence v roce 1995, odhadují, že ženy mají v průběhu celého života (do věku 80 let) 11,1% riziko, že budou muset podstoupit (alespoň) jeden operační výkon pro léčbu prolapsu nebo inkontinence. Dále odhadují, že každý rok bude v USA provedeno více než 250 000 operačních rekonstrukcí prolapsu pánevních orgánů [11]. Téměř ve 30 % případů je nutné výkon opakovat – spolu s každým dalším výkonem se interval mezi rekonstrukčními operacemi zkracuje. Tyto výsledky jsou významné s přihlédnutím ke skutečnosti, že v letech 2010–2050 lze v USA očekávat zvýšení populace žen ve věku ≥ 65 let ze 14,8 % na 22,6 % [2]. Lze tedy předpokládat, že v roce 2050 populace žen ve věku ≥ 65 let přesáhne 48 mil. Vzhledem ke stárnutí populace a vzhledem k tomu, že velký počet žen každý rok podstoupí operační korekci POP, je žádoucí provádět výkony, které budou dosahovat optimálního výsledku při minimálním výskytu komplikací. Míra recidivy při užívání současných technik je vysoká, což jasně nasvědčuje tomu, že tradiční metody užívané při korekci POP (s užitím přirozené tkáně), jsou v řadě případů nedostačující [1,3–6].
Vzhledem k omezeným vlastnostem přirozené tkáně se doplnění tradičních technik plikace o implantaci štěpu (interposition graft) jeví jako lákavá volba. Byla popsána celá řada technik s užitím alograftů, xenograftů a syntetických materiálů [7–11], v otázce nejvhodnějšího materiálu či techniky však dosud nebylo dosaženo konsenzu. Obrovské množství komerčně dostupných souprav pro korekci prolapsu, jež se objevilo na trhu v posledních několika letech, vedlo ke vzniku nových metod pro implantaci štěpu a dále znepřehlednilo již tak nepřehledné množství informací. Cílem tohoto článku je hodnocení výsledků současně dostupných chirurgických technik pro korekci prolapsu a s nimi spojených komplikací. Autoři se zaměřují zejména na techniky implantace syntetické síťky vaginálním cestou.
ANATOMIE PÁNVE
Prolaps předního kompartmentu (cystokéla) vzniká v důsledku oslabení pánevního dna tvořeného levatorem a herniace močového měchýře a uretry skrze vaginu [12]. Vaginální část této fascie je označována jako pubocervikální fascie a dále se dělí na perivezikální fascii (na úrovni báze močového měchýře) a periuretrální fascii (na úrovni hrdla močového měchýře). Obě fascie se spojují laterálně v místě ústí do arcus tendineus fascie pelvis (ATFP), jež představuje místo ukotvení těchto struktur ve stěně pánve.
Při hodnocení vaginální podpory kranio - -kaudálně, ligamenta cardinale ukotvují horní část vaginy a čípek ke stěně pánve (I. etáž) [13]. Ve střední části vaginy se vezikopánevní ligamentum rozšiřuje z ATFP a podpírá bázi močového měchýře a přední poševní stěnu (II. etáž), zatímco zadní poševní stěna je připevněna laterálně k fascii překrývající m. levator ani. V přední části pochvy vychází III. etáž z uretro-pánevních ligament, jež poskytují podporu močové trubice od uretrálního meatu až po hrdlo močového měchýře. Defekt v předním kompartmentu tak může vést k narušení podpory močové trubice nebo močového měchýře. Narušení podpory močové trubice může způsobovat hypermobilitu močové trubice i bez současného výskytu cystokély. Cystokéla se dělí na základě lokalizace defektu na cystokélu s centrálním fasciálním defektem, laterálním fasciálním defektem nebo kombinaci obou defektů. Cystokéla s centrálním fasciálním defektem vzniká v důsledku oslabení pubocervikální fascie při současném intaktním laterálním připojení vezikopánevního ligamenta k ATFP. Cystokéla s laterálním fasciálním defektem vzniká v důsledku intaktní pubocervikální fascie a narušení připojení vezikopánevního ligamenta k ATFP na jedné ze dvou stran vaginy. Cystokéla s centrálním defektem je často spojena s narušením podpory v I. etáži v ligamentum cardinale a může se vyskytovat současně s enterokélou. Nejčastější formu představuje kombinovaná cystokéla s centrálním a laterálním defektem.
V zadním kompartmentu je pochva oddělena od rekta rektovaginálním septem a podobně jako pubocervikální fascie v předním kompartmentu septum probíhá lichoběžně s úzkým koncem lokalizovaným distálně [14]. Rektovaginální septum se napojuje distálně na urogenitální diafragma a proximální část perinea (III. etáž). Septum je připojeno laterálně k arcus tendineus fasciae rectovaginalis v distální třetině vaginy a k ATFP v proximálních dvou třetinách [13,15]. Proximálně se septum spojuje s uretrosakrálními ligamenty laterálně a s pericervikálním prstencem centrálně. Stejně jako v předním kompartmentu se defekt v rektovaginálním septu (rektokéla) v zadním kompartmentu dělí na centrální a laterální. Proximální přerušení rektovaginálního septa z uterosakrálního ligamenta může souviset s enterokélou, zatímco defekt distálního připojení k perineu může vést ke vzniku perineokély a oslabení samotného perinea.
VÝSLEDKY STANDARDNÍ KOREKCE PROLAPSU
Stejně jako u ostatních rekonstrukčních technik v pánvi je srovnání jednotlivých výsledků obtížné vzhledem k rozmanitosti užitých technik, různých populací pacientů, různých definic úspěšného výsledku a různých indikací pro operaci. Srovnání operačních výsledků dále znesnadňuje současné provádění dalších výkonů pro léčbu stresové močové inkontinence (SUI) a prolapsu v dalších kompartmentech, výskyt nepříznivých příhod a komplikací [16]. Publikované výsledky anteriorní kolporafie (přední poševní plastika) jsou tedy značně rozdílné. Beck et al v retrospektivní studii zahrnující více než 500 pacientek zaznamenali recidivu cystokély v 3,3 % případů [17], jiní autoři zaznamenali recidivu v předním kompartmentu až u 40 % žen [18,19]. Několik přehledů zahrnujících velký počet pacientek nasvědčuje tomu, že míra anatomické recidivy může být dokonce ještě vyšší [3]. Ačkoli tato problematika nebyla hodnocena v žádné dlouhodobé, prospektivní studii, míra vyléčení onemocnění po korekci předního kompartmentu je poměrně vysoká, při užití tradiční posteriorní kolporafie (zadní poševní plastika) a lokální korekci > 85 % [20–23]. Optimální technika pro korekci rektokély je diskutabilní. Prospektivní srovnání posteriorní kolporafie (zadní poševní plastiky) a lokální korekce ukazuje, že oba přístupy dosahují srovnatelných výsledků po 12 měsících sledování [24]. Nedávný systematický přehled publikovaných údajů ukazuje, že plikace fascie ve střední čáře může dosahovat lepších anatomických i funkčních výsledků než lokální korekce fascie [25].
VLOŽENÍ ŠTĚPU
Anatomický úspěch standardní korekce prolapsu spočívá v účinném znovunapojení nebo plikaci vrstev přirozené tkáně. Vzhledem k tomu, že přirozená tkáň je poměrně slabá, doporučuje se vložení štěpu pro podporu nebo náhradu slabé přirozené tkáně. Vložení štěpu umožňuje augmentovat slabou tkáň na druhé etáži v předním i zadním kompartmentu prostřednictvím obnovy pubocervikálních a rektovaginálních vrstev. Přišitím štěpu k hlavním bodům laterální pánevní stěny (např. komplex levator ani, ATFP a fascia obturator internus) lze korigovat současně centrální i laterální defekt v předním i zadním kompartmentu. Pro korekci apikálního defektu a zlepšení podpory na I. etáži lze štěp připevnit ke komplexu uterosakrálního ligamenta, sakrospinózního ligamenta nebo iliokokcygenózní fascie.
Julian jako první popsal vložení štěpu při korekci defektu předního kompartmentu, která spočívala v bilaterální sutuře polypropylenové síťky (Marlex, C.R. Bard Inc, Murray Hill, NJ, USA) k fascii m. obturator/ /levator [11]. Po dvou letech sledování zaznamenali autoři 0% míru recidivy. Několik autorů uvádí retrospektivní výsledky korekce předního kompartmentu s užitím nejrůznějších materiálů (alo-grafty, xenografty a syntetické materiály) [7,26–30]. V nedávné době publikovaná randomizovaná kontrolovaná studie srovnávající standardní přední kolporafii a korekci s užitím štěpu z perikardu hovězího dobytka uvádí po jednom i dvou letech sledování srovnatelné výsledky [8]. U obou skupin bylo rovněž zaznamenáno zlepšení skóre v doménách QoL (při užití validovaných instrumentů). Interpozice štěpu do zadního kompartmentu byla poprvé popsána v roce 1981 a (stejně jako tomu je u technik v předním kompartmentu) při ní byly vyzkoušeny nejrůznější biologické i syntetické materiály [31–37]. Navzdory rozdílným definicím úspěšnosti léčby se krátkodobá míra vyléčení pacientů po korekci s užitím graftu blíží 90 %, při dlouhodobém sledování pacientů (jimž byl implantován štěp z biologického materiálu) se však tato míra snižuje. Paraiso et al prospektivně prokázali, že implantace biologického štěpu nemusí nutně vést ke zlepšení anatomických výsledků běžné zadní kolporafie nebo lokální korekce [24]. Po jednom roce byla u žen, které podstoupily augmentaci s užitím sliznice z tenkého střeva prasete, zaznamenána významně vyšší míra selhání než u pacientek, které podstoupily samotnou lokální korekci nebo zadní kolporafii.
V nedávné době provedené meta-analýze se autoři pokouší shrnout účinnost a bezpečnost vkládání štěpu při korekci vaginálního prolapsu [38]. Krátkodobé údaje ukazují, že v rámci korekce předního kompartmentu jakýkoli typ interpozice štěpu významně snižuje objektivní míru recidivy ve srovnání se standardní kolporafií. Při užití nevstřebatelné syntetické síťky byla zaznamenána významně nižší míra objektivní recidivy prolapsu než při užití vstřebatelné syntetické síťky a štěpu z biologického materiálu, ale na druhou stranu rovněž častější eroze/extruze síťky než při užití vstřebatelného a biologického materiálu. Data z jiného systematického přehledu publikací, které hodnotí užití graftu při korekčních operacích v zadním a apikálním kompartmentu, a užití biologického nebo syntetického vstřebatelného graftu při korekčních operacích v předním kompartmentu nemají dostatečnou sílu na to, aby prokázaly účinnost těchto technik [39]. Podobné studie poukazují na nedostatek kvalitních randomizovaných studií, které by srovnávaly výsledky a komplikace standardních korekčních operací prolapsu a technik s vkládáním štěpu.
UŽITÍ SYNTETICKÉ SÍŤKY PŘI KOREKCI PROLAPSU
Publikace zabývající se technikami implantace pubovaginálního slingu uvádí řadu důkazů o nepředvídatelné povaze biologických preparátů užívaných při korekci SUI [40]. U řady alograftů ze zemřelých pacientů může dojít v průběhu času k degradaci materiálu, u xenograftů může dojít k zapouzdření, případně mohou vyvolat závažnou zánětlivou reakci vedoucí k extruzi graftu. Polymery se využívají v rámci sligových technik již od 50. let minulého století, při korekci herniace stěny břišní dokonce ještě mnohem déle [41]. Atraktivní vlastností všech syntetických síťek je jejich odolnost a trvanlivost, přesto se však jednotlivé druhy liší typem užitého vlákna a velikostí pórů (tab. 1) [42].
Tab. 1. Klasifikace typů syntetické síťky podle Amida [42]. ![Klasifikace typů syntetické síťky podle Amida [42].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/74542f36af219017209083c411515afa.jpg)
Síťky mohou být tkané nebo pletené a mohou se významně lišit svou tuhostí a hmotností. Síťky mohou být impregnované nejrůznějšími látkami nebo potaženy filmem (např. antibiotiky nebo kolagenem), což může mít dopad na profil biokompatibility [41]. Díky všem výše popsaným faktorům je každý typ síťky specifický a každý z faktorů může mít významný vliv na schopnost síťky poskytovat dlouhodobou podporu při rekonstrukci pánevního dna.
Bohaté zkušenosti s prováděním slingových operací v oblasti střední uretry (MUS) prokazují, že nejpříznivější profil biokompatibility ze všech v současné době užívaných syntetických materiálů vykazuje makroporézní, monofilamentózní, propylenová síťka. Absence mezer umožňuje zarůstání nativního kolagenu a póry mají dostatečnou velikost, aby umožňovaly průnik makrofágů a dalších imunitních mediátorů.
Ovšem i nejvíce biokompatibilní syntetické materiály mohou v průběhu jednoho roku po implantaci vyvolat potenciálně přetrvávající reakci mastocytů nebo vznik granulomu [43].
ANATOMIE KOMERČNĚ DOSTUPNÝCH SETŮ K REKONSTRUKCI PROLAPSU
Vývoj komerčních setů pro korekci prolapsu pánevních orgánů lze připisovat několika faktorům. Zaprvé – proměnlivá míra úspěšnosti standardních rekonstrukčních technik podporuje zájem o techniky s implantací štěpu. Zadruhé – účinnost MUS zvyšuje důvěru v tzv. „minimálně invazivní“ techniky rekonstrukce prolapsu pánevních orgánů. Díky standardizované technice, užívání jasných orientačních anatomických bodů a „all-inclusive“ setům otevřela MUS přístup k provádění slingových technik většímu počtu lékařů. Benefit snadné, reprodukovatelné a účinné rekonstrukce apikálního prolapsu vaginální cestou vzbudil o tyto komerční sety další zájem.
V roce 2001 byla představena posteriorní intravaginální slingplastika (IVS, Tyco Healthcare Group, Norwalk, CT, USA), jež představuje první sadu umožňující dosáhnout podpory I. etáže tunelizací nylonové pásky skrze ischiorektální fossa do incize v posteriorním vaginálním fornix [44].
Tunel vystupuje skrze m. iliococcygeus a páska je suturou připevněna k poševní klenbě. Při nahrazení nylonu multifilamentózní polypropylenovou páskou se riziko recidivy prolapsu po 4,5 letech sledování pohybuje kolem 6 % [44]. U 5,3 % pacientek došlo k extruzi síťky a ve dvou případech k perforaci rekta. Další studie uvádí (při sledování 12 měsíců) > 90% úspěšnost při korekci apikálního prolapsu [45,46]. Nenovější přehledy však bohužel uvádí výskyt velmi nepříznivých vedlejších účinků při užívání IVS: retropubický absces, vezikovaginální píštěl, dyschezie, dyspareunie, gluteovaginální píštěl, rektovaginální píštěl a vznik sinu v oblasti od pánve směrem k dolní části stehen [47–50]. K extruzi pásky došlo téměř u 20 % pacientek a u 25 % pacientek bylo nutné provedení opakovaného výkonu [51–53]. Tyto komplikace jsou připisovány kombinaci užití multifilamentózní síťky a pararektálního přístupu [37].
Jako první souprava pro léčbu vaginálního prolapsu byl v roce 2004 v USA představen set Apogee™/Perigee™ (American Medical Systems Inc, Minnetonka, MN, USA). Kromě tohoto setu se na trhu objevilo několik dalších souprav od komerčních výrobců (tab. 2). Všechny v současné době dostupné soupravy jsou vytvořeny z monofilamentózního polypropylenu, síťky se však mohou lišit celou řadou vlastností (tab. 3). Dosud nebyla zkoumána souvislost mezi větší tvrdostí síťky a rizikem vzniku vaginální extruze, tužší formy polypropylenu (např. Marlex) jsou však i navzdory monofilamentóznímu makroporéznímu povrchu hůře snášeny [41]. Rovněž nebyla zkoumána spojitost mezi hmotností, tloušťkou a celkovou velikostí síťky a rizikem eroze či extruze.
Tab. 2. V současné době dostupné komerční soupravy. Některé z těchto setů jsou k dostání v alternativní verzi s biologickým nebo biosyntetickým materiálem. 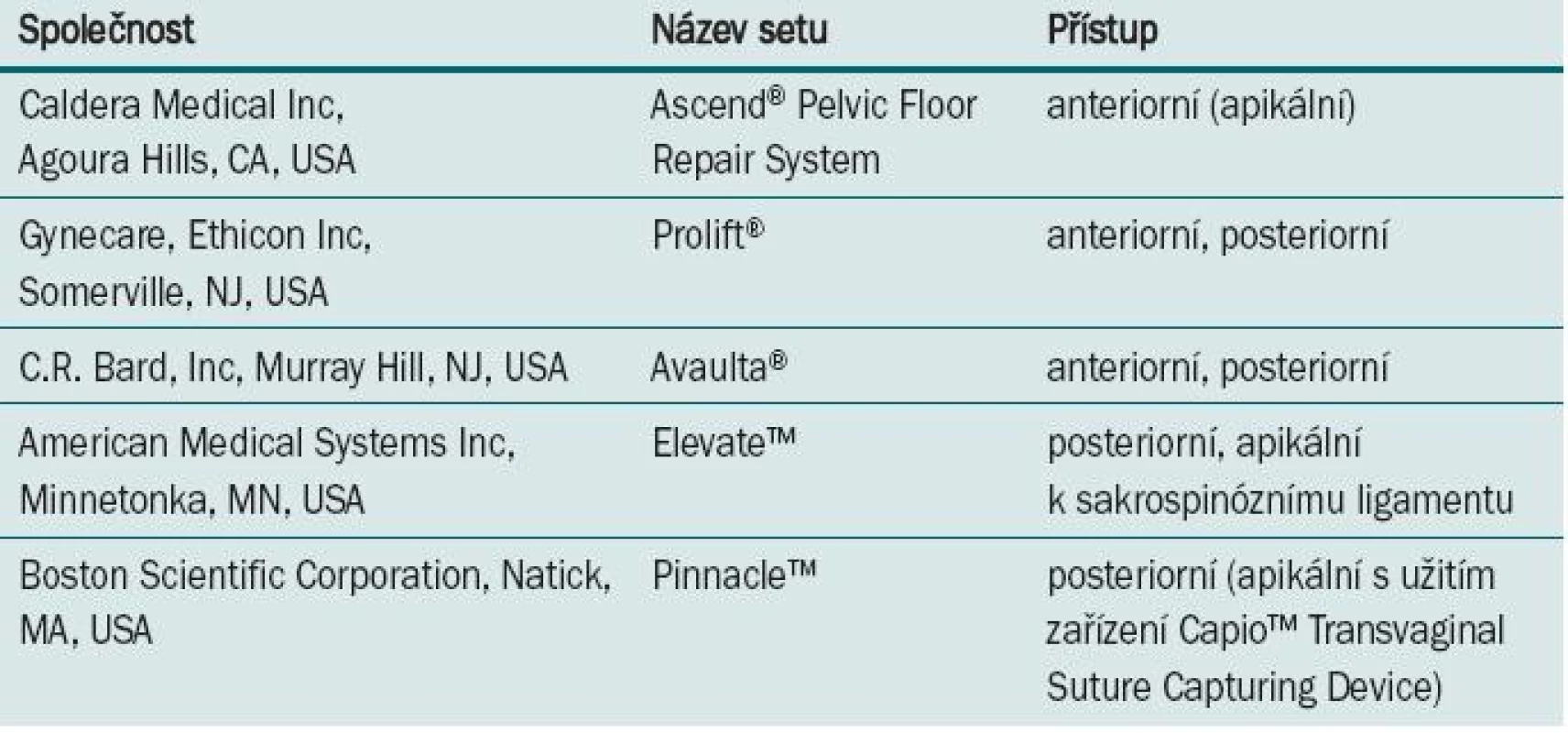
Tab. 3. Specifické vlastnosti vybraných komerčně dostupných setů [54]. ![Specifické vlastnosti vybraných komerčně dostupných setů [54].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8bbb10dbecf79a2cea9ec5024f2a9a6e.jpg)
Při implantaci síťky do předního kompartmentu jsou perkutánně (skrze kůži překrývající ústí obturátoru) zavedeny dva sety trokarů do vaginální incize. Trokary umístěné superiorně vystupují v blízkosti hrdla močového měchýře, zatímco trokary umístěné inferiorně vystupují podél bílé linie v blízkosti spina ischiadica. Okraje síťky jsou připevněny k trokarům a protaženy kůží tak, aby síťka zmenšila přední kompartment bez tahu. Při zavádění síťky posteriorním přístupem je trokar zaveden bilaterální perianální incizí a vystupuje v blízkosti spina ischiadica. Okraje síťky jsou připevněny k trokaru a proximální strana síťky je vytažena do pozice bez tahu. Ačkoli tyto soupravy umožňují zlepšení podpory na II. etáži, nemusí umožňovat současnou korekci defektů v apexu vaginy (na I. etáži). Soupravy poslední generace umožňují připevnit okraje síťky do oblasti apexu pomocí preparace pod přímou vizuální kontrolou. Při implantaci soupravy Pinnacle® (Boston Scientific Corporation, Natick, MA, USA) pomocí anteriorního přístupu lze k připevnění okrajů síťky ke každému ze sakrospinózních ligament a arcus tendineus vedle obou spina ischiadica užít zařízení Capio™ (Boston Scientific Corporation) (které je součástí tohoto setu). Podobně i sada Elevate™ (American Medical Systems Inc) obsahuje samodržicí polypropylenové závěsy, jež umožňují připevnit okraje síťky k sakrospinóznímu ligamentu prostřednictvím jediné posteriorní incize. Po zajištění okrajů lze síťku zastřihnout a přišít distálně, abychom zajistili hladký povrch bez tahu.
VÝSLEDKY OPERAČNÍ KOREKCE PROLAPSU S UŽITÍM SPECIÁLNÍCH SETŮ
Jak již bylo uvedeno, publikované studie uvádí nejrůznější kategorie výsledků. Anatomická úspěšnost je často definována jako minimální nebo žádná recidiva v kompartmentu, v němž byla provedena rekonstrukce. Pro klasifikaci lze užít systém Baden-Walker Halfway Scoring System nebo Pelvic Organ Prolapse Quantification. Dále lze hodnotit funkční výsledek, tzn. úlevu symptomů spojených s pánevním tlakem a eliminaci dysfunkce (eliminace symptomů souvisejících s polohou, symptomy související s plnicí fází, obstrukční symptomy). Úspěch léčby lze rovněž hodnotit na základě signifikantního zlepšení QoL skóre. Je třeba zdůraznit, že anatomická úspěšnost léčby (objektivní) nemusí vždy odpovídat funkční úspěšnosti (subjektivní) a naopak. V případě trvalé úspěšnosti léčby v daném kompartmentu však může dojít k recidivě v ostatních kompartmentech. Barber et al prokázali rozdíl v uváděné míře úspěšnosti v nedávném hodnocení 322 žen zařazených do studie CARE (Colpopexy and Urinary Reduction Efforts) [55]. Autoři hodnotili 18 různých definic pro úspěšnou léčbu a zjistili, že míra úspěšnosti se liší na základě užité definice (19–97 %). Nejmenší úspěšnost byla zaznamenána v případě, že byla „úspěšnost operace“ definována jako veškerá anatomická podpora proximálně k hymen (19–58 %), při definici „úspěšnosti operace“ jako absence prolapsu za hymen byla léčba účinná u přibližně 94 % pacientek.
Subjektivní pocit vyléčení (absence symptomů spojených s vyklenutím prolapsu) uvedlo 92 % pacientek, u 97 % pacientek nebylo nutné výkon opakovat. Absence symptomů spojených s vyklenutím prolapsu po operaci se významně promítla v pacientčině hodnocení celkového zlepšení, zatímco samotná anatomická úspěšnost operace nikoli.
V databázi MEDLINE jsme vyhledali všechny publikace popisující výsledky a výskyt komplikací operace prolapsu s užitím komerčních sad. Přehled výsledků je shrnut do tab. 4 [56–66]. Do přehledu jsme zařadili vždy pouze nejnovější výsledky dané skupiny autorů.
Tab. 4. Míra úspěšnosti při užití soupravy pro korekci prolapsu. 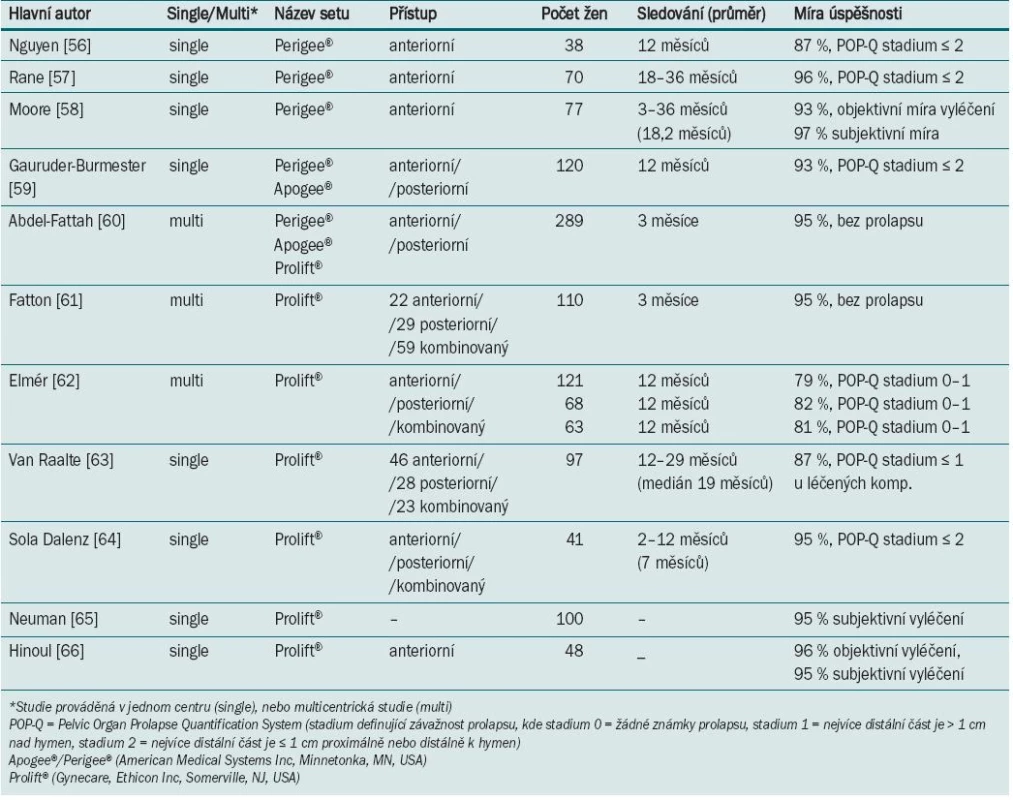
KOMPLIKACE SPOJENÉ S OPERAČNÍ KOREKCÍ PROLAPSU S UŽITÍM SPECIÁLNÍCH SETŮ
S komplikacemi v podobě krvácení a poranění pánevních orgánů se setkáváme při jakémkoli typu korekce prolapsu. Implantace syntetických materiálů (a zejména užívání speciálních setů) je spojena s výskytem dalších specifických komplikací. V nedávné době provedená metaanalýza > 70 studií a kazuistik hodnotí míru výskytu a spektrum komplikací spojených s implantací graftu [39]. Tyto komplikace zahrnovaly krvácení (0–3 %), poranění viscerálních orgánů (1–4 %), infekci močových cest (0–19 %), extruzi graftu (0–30 %) a vznik píštěle (1 %). Pro hodnocení výskytu dyspareunie, sexuální dysfunkce, mikční dysfunkce a dysfunkce defekace nebylo k dispozici dostatečné množství údajů. Komplikace spojené s tímto typem rekonstrukce prolapsu lze rozdělit do následujících kategorií: per-operační (např. poranění viscerálních orgánů nebo neurovaskulárních struktur spojené se zaváděním síťky), krátkodobé (např. vaginální extruze, špatné hojení) a dlouhodobé (např. bolestivé syndromy a dyspareunie). Přehled výskytu komplikací v jednotlivých studiích je uveden v tab. 5 [56–59]. Dyspareunii a léčbě komplikací je věnována další část článku.
Tab. 5. Míra výskytu komplikací po rekonstrukci s užitím soupravy pro korekci prolapsu. 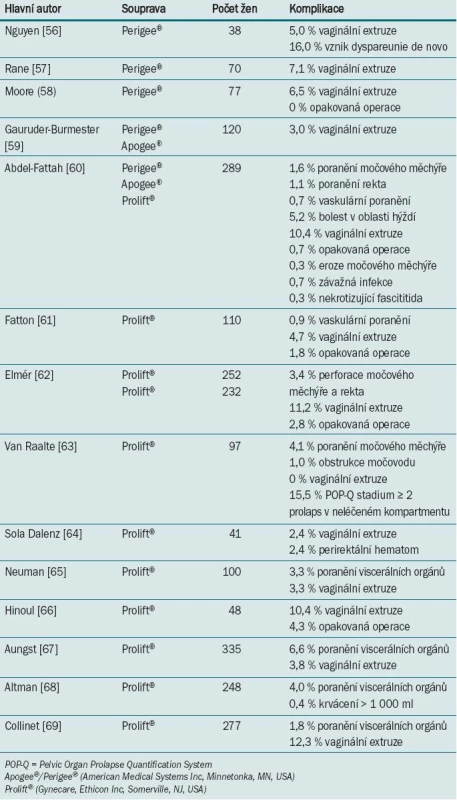
Vzhledem k rozšiřujícímu se užívání syntetických materiálů v rámci léčby pánevního prolapsu varují nejrůznější autoři před výskytem ojedinělých komplikací. Studie French National Authority for Health publikovaná v listopadu roku 2006 uvádí, že užívání síťky v rámci transvaginální rekonstrukce prolapsu pánevních orgánů je vhodné omezit pouze na klinický výzkum [70]. Skupina Systematic Review Group společnosti Society of Gynecologic Surgeons dospěla k závěru, že implantace nevstřebatelného syntetického štěpu může zlepšovat anatomické výsledky rekonstrukce přední poševní stěny, ovšem za cenu dalších rizik [71]. Autoři doporučují tato rizika zvážit před volbou léčby u pacientek, u nichž je indiko-vána implantace štěpu vaginální cestou. V říjnu roku 2008 uveřejnil varování i americký Úřad pro kontrolu potravin a léčiv (FDA) [72]. Na základě více než 1 000 zpráv o výskytu komplikací u pacientek po implantaci síťky (celkem od devíti různých výrobců) v rámci léčby POP a SUI, FDA doporučuje následující kroky:
- pro každou techniku implantace je nutné podstoupit specializovaný trénink
- informovat pacientku o skutečnosti, že implantace síťky je trvalá a že v některých případech může být z důvodu výskytu komplikací nutné výkon opakovat
- poskytnout pacientce kopii informacío implantátu od výrobce (pakliže je to možné)
DYSPAREUNIE A PÁNEVNÍ BOLEST
Na vzniku pánevní bolesti a dyspareunie po rekonstrukční operaci prolapsu se podílí celá řada faktorů, významná role je připisována nedostatečnosti estrogenu, zkrácení vaginy a zúžení v důsledku předchozí operace. Předpokládá se, že míra výskytu dyspareunie po neaugmentované korekci prolapsu (a operaci zadního kompartmentu zvláště) se může blížit až 40 % [73], což je více než uváděných 10–13 % po korekci prolapsu s augmentací [61,74, 75]. Vzhledem k tomu, že při jednom výkonu se často provádí rekonstrukce několika míst prolapsu současně, může být obtížné správně stanovit problémový kompartment [37].
Míra výskytu dyspareunie u pacientek, které podstoupily rekonstrukci prolapsu s užitím speciálního setu, se v nejrůznějších publikacích liší. Nguyen a Burchette uvádí, že incidence de novo dyspareunie se u žen randomizovaných k přední poševní plastice nebo rekonstrukci s užitím setu Perigree významně neliší [56]. Podobně ani Gauruder-Burmester et al nezaznamenali jediný případ de novo dyspareunie u 120 žen, které podstoupily rekonstrukci prolapsu s užitím setu Perigree/ /Apogee [59]. Nordic Transvaginal Mesh Group hodnotí sexuální funkci pomocí zkrácené verze dotazníku POP/UISQ-12 (Pelvic Prolapse/Urinary Incontinence Sexual Questionnaire-12 [76]. Pacientky uvádí po rekonstrukční operaci výrazně horší skóre v doménách celkové sexuální funkce – toto zhoršení je srovnatelné při užití anteriorního, posteriorního i kombinovaného přístupu. Rovněž bylo zaznamenáno celkové zhoršení všech symptomů v behaviorálně-emocionální doméně a doméně týkající se partnera pacientky. Naopak zlepšení bylo zaznamenáno v doméně fyzické funkce. Po výkonu pacientky neuvádí ani zlepšení ani vý-znamné zhoršení (a zvýšení incidence) dyspareunie.
Dalším významným faktorem, který je nutné zvážit u pacientek trpících dyspareunií, je možnost kontrakce síťky [37]. Transvaginální ultrazvukové vyšetření prokázalo retrakci rozměrů polypropylenové síťky na 66 % její původní velikosti [59]. Byla zaznamenána jak podélná kontrakce, tak kontrakce v šířce síťky, což nasvědčuje tomu, že mohlo dojít k deformaci celkové délky a obvodu vaginy. Vzhledem k tomu, že není jasné, zda tato kontrakce může ovlivňovat koitus a vznik dyspareunie, je nutné se na tuto problematiku dále zaměřit. Podrobnější studium vlastností implantátu, jako je jeho hmotnost, elasticita a flexibilita mohou pomoci minimalizovat vznik těchto komplikací.
Před indikací korekční operace je rovněž vhodné posoudit současný výskyt pánevního prolapsu a dalších poruch pánevního dna (kromě čistě kauzální souvislosti). V nedávné době publikovaný komentář editora uvádí hypotézu, že pánevní bolest (před operací) může souviset s významnou hypertonicitou svaloviny pánevního dna a/nebo bolestí myofasciálního původu. Tuto možnost je nutné zvážit u pacientek s absencí prolapsu v introitu nebo za ním [77]. Butrick v této souvislosti uvádí, že ukotvení síťky do hypertonické a spastické svaloviny může jen zhoršit již přítomnou dyspareunii. Tato skutečnost jen podtrhuje význam pečlivé volby pacientek pro korekci prolapsu pomocí techniky s implantací síťky a potřebu podrobného informování pacientky.
ŘEŠENÍ A LÉČBA KOMPLIKACÍ
Obecné informace
Abychom mohli minimalizovat výskyt komplikací, je nutné dobře porozumět všem faktorům týkajícím se pacientky, implantátu i operační techniky. Na konferenci IUGA (International Urogynecological Association), která se konala v roce 2005, bylo doporučeno několik faktorů, které mohou sloužit jako kontraindikace pro implantaci štěpu [78]. Členové panelu se domnívají, že ozařování pánve, závažná atrofie v močopohlavním systému, užívání imunosupresiv, aktivní infekce a přítomnost komorbidit (např. špatně kontrolovaný diabetes, morbidní obezita a těžké kuřáctví) mohou představovat relativní kontra-indikace pro užívání biomateriálu při rekonstrukčních technikách svaloviny pánevního dna. Další autoři rovněž zdůrazňují význam správné volby pacientek. Moore a Miklos uvádí, že implantace síťky není nejvhodnější modalitou u mladých žen s primárním prolapsem [79]. To představuje dilema, neboť ženy, které mohou mít největší benefit z implantace síťky, mohou mít rovněž nejvyšší riziko vzniku komplikací v důsledku hypoestrogenizmu, komorbidit a horší kvality tkáně. Nelze tedy více zdůraznit význam získání podrobného informovaného souhlasu a informování pacientky o rizicích a benefitech léčby.
Většina síťek užívaných při korekci prolapsu se v současné době vyrábí z monofilamentózního, makroporézního polypropylenu, hmotnost, flexibilita a tkanina síťky se však u různých produktů mohou lišit. Jak uvádí IUGA, dosud nebyla vytvořena žádná vhodná klasifikace materiálu v současné době užívaného při rekonstrukčních operacích pánve, každou ze síťek je nutné hodnotit individuálně [78].
Volba operační techniky hraje významnou roli v rámci prevence komplikací. Zkušenosti s operací svaloviny pánevního dna mají nesmírný význam – pakliže operatér umí zvolit adekvátní vrstvu preparace a disponuje precizní znalostí o základních orientačních bodech v pánvi, může dosahovat konzistentnějších výsledků. Moore a Miklos doporučují několik pomocných kroků pro zlepšení techniky implantace síťky a minimalizace výskytu komplikací [79]. Vzhledem k tomu, že existuje pouze minimum důkazů I. úrovně o léčbě komplikací, nejsou tato doporučení založena na důkazech, ovšem vychází ze zkušeností operatérů, kteří mají zkušenosti s nejrůznějšími typy a přístupy korekčních operací v pánvi. Aplikace masti s obsahem estrogenu před léčbou může zlepšit kvalitu tkáně a kvalitní hydrodisekce s použitím hemostatického preparátu může být užitečná pro vytvoření silné vrstvy. Incize do poševní sliznice by měla být minimální s vytvořením tunelu, abychom minimalizovali styčnou plochu incize a síťky. Rovněž další autoři doporučují neprovádět incizi poševní sliznice do pahýlu vaginy (při anteriorním i posteriorním přístupu), abychom se vyhnuli incizi ve tvaru písmene T při současné implantaci síťky a provádění hysterektomie [69]. Silnější vrstva preparace do skutečně vezikovaginálního a rektovaginálního prostoru pomůže překrýt síťku a pečlivá hemostáza snižuje pravděpodobnost vzniku hematomu a natržení incize. Síťka by měla být umístěna rovně, bez boulí nebo nadměrného tahu. Před uzavřením by mělo být excidováno pouze minimum (nebo žádný) poševního epitelu vzhledem k tomu, že může dojít k jeho retrakci o 10–15 %. Incizi lze uzavřít pomocí jednotlivých stehů s přihlédnutím k tomu, abychom předešli strangulaci tkáně. K lepšímu hojení rány může přispívat aplikace krému s obsahem estrogenu.
ŘEŠENÍ EXTRUZE A EROZE
Moore a Miklos uvádí několik doporučení (vycházejících ze zkušeností), jak postupovat v případě, že dojde k extruzi vaginální síťky [79]. Přestože může být zasažena celá síťka (protože leží v jedné vrstvě), autoři se domnívají, že není nutné odstraňovat celý implantát (pakliže je užit monofilamentózní materiál). Malou extruzi síťky o průměru < 1 cm ve střední části pochvy lze léčit aplikací masti s estrogenem, kterou pacientka aplikuje po dobu jednoho měsíce, a masti obsahující antibiotika (clindamycin nebo metronidazol) po dobu jednoho týdne. V případě, že velikost extruze přesahuje 1 cm v průměru nebo nelze dosáhnout reepitalizace pomocí konzervativní léčby, lze provést debridement v lokální anestezii s excizí síťky. Po excizi síťky je vhodné okraje incize pochvy oživit, podminovat a uzavřít pomocí vstřebatelných, přerušovaných stehů. Pakliže se síťka nalézá laterálně přes vaginální sulcus nebo pakliže došlo k extruzi jednoho ze zaváděcích okrajů síťky, je nutné provedení formální debridement. Toto řešení je nutné rovněž v případě, že došlo k rozsáhlé extruzi, zvrásnění v důsledku vyboulení síťky nebo vzniku poševní striktury. Moore a Miklos uvádí, že jestliže partner pacientky pociťuje bolest v penisu během koitu nebo v případě pálení v pochvě, nebude pravděpodobně pouhá aplikace estrogenové masti a zastřižení síťky účinné. Někdy může excize rozsáhlé extruze zabránit přiblížení okrajů epitelu. V takovém případě mohou být okraje sliznice připevněny ke tkáni a incize se zhojí sekundární reepitelizací.
I po excizi síťky může dojít k opakované extruzi, která vyžaduje provedení rozsáhlejší excize.
Ačkoli skutečný mechanizmus vzniku eroze je předmětem debaty, většina operatérů se domnívá, že eroze vzniká v důsledku preparace v nesprávné vrstvě, jež se příliš přibližuje k poškozenému orgánu nebo v důsledku nerozpoznaného poranění. Erozi do pánevních útrob je nutné léčit jako píštěl. Erozi močového měchýře lze řešit pomocí abdominálního nebo vaginálního přístupu v závislosti na zkušenosti operatéra. Korekce spočívá v excizi všech komponentů síťky a uzavření pomocí postupně vstřebatelné sutury bez tahu (v několika vrstvách). Riziko recidivy lze minimalizovat užitím štěpu z omenta, peritonea nebo laloku na stopce. Klíčovou roli hraje derivace moči prostřednictvím suprapubického nebo uretrálního katétru, který je zaveden po dobu minimálně dvou týdnů. Stejná pravidla platí pro erozi močové trubice, eroze střeva může vyžadovat další konzultaci chirurga a případnou derivaci stolice.
Léčba dyspareunie
Jak již bylo zmíněno, minimalizace předoperačních rizikových faktorů pro vznik dyspareunie má zásadní význam pro prevenci jejího vzniku po výkonu. Moore a Miklos navrhují, že eliminace plikace rektovaginálního septa ve střední čáře a levatoru během rekonstrukce teoreticky působí menší tah na svalovinu pánevního dna, a je tedy spojena s menším rizikem vzniku dyspareunie [79]. Konzervativní metody léčby zahrnují posilování svaloviny pánevního dna, biofeedback, užívání protizánětlivých agens, suplementaci estrogenu a injekce do místa dráždivých bodů.
Operační řešení zahrnuje uvolnění tahu síťky a excizi případného vyboulení zejména v oblasti apexu. Moore a Miklos se domnívají, že excize celého implantátu není nutná a že i po jeho odstranění je užitečné pokračovat v posilování pánevního dna. Vzhledem k tomu, že časem může dojít k určité kontrakci implantátu, není dlouhodobý efekt implantace síťky na koitus a vznik dyspareunie znám.
ZÁVĚR
Volba optimální techniky pro korekci prolapsu je často náročný úkol i pro nejzkušenějšího operatéra. Při běžné lokální rekonstrukci se obvykla užívá oslabená poševní tkáň, tato technika však dosahuje nekonzistentních anatomických výsledků. Při užívání přirozené tkáně však není nutné zavádět do pánve cizorodý materiál, což je spojeno s rizikem extruze nebo eroze.
Korekce prolapsu pomocí augmentace s vložením štěpu umožňuje posílit oslabenou tkáň, a pravděpodobně tedy snižuje riziko anatomické recidivy. Tato technika však dosahuje proměnlivých výsledků a může být spojena (v závislosti na použitém materiálu) s extruzí nebo zarůstáním graftu.
Na základě celosvětového rozšíření MUS se jako nejvhodnější syntetický materiál pro tuto techniku jeví monofilamentózní, makroporézní polypropylenová síťka. Nejnovější sady pro korekci prolapsu využívají minimálně invazivní povahu MUS. Ačkoli se stále častěji objevují studie uvádějící dobré výsledky korekce prolapsu s užitím komerčních setů, výsledky je třeba interpretovat obezřetně. Stále nejsou k dispozici žádné dlouhodobé výsledky a většina údajů vychází z retro-spektivních, nerandomizovaných studií. Definice anatomické úspěšnosti léčby se mezi jednotlivými studiemi liší, informace týkající se funkčních výsledků a výskytu komplikací jsou často neúplné. Byly zaznamenány závažné komplikace související se zaváděním trokarů. Mezi nepříznivé důsledky výkonu patří rovněž extruze síťky do vaginy a dyspareunie. Dopad implantace síťky vaginální cestou v dlouhodobém horizontu rovněž není dosud znám.
Ačkoli komerční sady jistě mají svou roli v rámci operačních technik pro léčbu prolapsu, tato role není zatím zcela jednoznačná. Je třeba mít na paměti, že každý produkt má jiné parametry a vlastnosti a že biokompatabilita dané sítky často závisí na zkušenosti operatéra s technikami rekonstrukce břišní stěny. Dosud nebylo prokázáno, zda hmotnost síťky a flexibilita ovlivňují anatomický výsledek léčby a výskyt komplikací, nebo nikoli. Adekvátní trénink a precizní znalost anatomie pánve má tedy nesmírný význam. Operatér by měl rovněž být schopen řešit případné komplikace, k nimž může docházet i u nejzkušenějších operatérů. Zásadní roli pro úspěch operace má pečlivá volba pacientů a důkladné informování.
Alex Gomelsky, MD1
Roger R Dmochowski, MD, FACS21Louisiana State University Health Sciences Center, Shreveport, LA
2Vanderbilt University Medical Center, Nashville, TN, USA
roger.dmochowski@vanderbilt.edu
agomel@lsuhsc.edu
Zdroje
1. Olsen AL, Smith VJ, Bergstrom JO et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstet Gynecol 1997; 89(4): 501–506.
2. US Census Bureau. U.S. Interim Projections by Age, Sex, Race, and Hispanic Origin: 2000–2050. http:// www.census.gov/ipc/www/usinterimproj Census conducted in 2004.
3. Maher C, Baessler K. Surgical management of anterior vaginal wall prolapse: an evidence based literature review. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17(2): 195–201.
4. Weber AM, Walters MD, Piedmonte MR et al. Anterior colporrhaphy: a randomized trial of three surgical techniques. Am J Obstet Gynecol 2001; 185(6): 1299–1304.
5. Sand PK, Koduri S, Lobel RW et al. Prospective randomized trial of polyglactin 910 mesh to prevent recurrence of cystoceles and rectoceles. Am J Obstet Gynecol 2001; 184(7): 1357–1362.
6. Ridgeway B, Chen CC, Paraiso MF. The use of synthetic mesh in pelvic reconstructive surgery. Clin Obstet Gynecol 2008; 51(1): 136–152.
7. Gomelsky A, Rudy DC, Dmochowski RR. Porcine dermis interposition graft for repair of high grade anterior compartment defects with or without concomitant pelvic organ prolapse procedures. J Urol 2004; 171(4): 1581–1584.
8. Guerette NL, Peterson TV, Aguirre OA et al. Anterior repair with or without collagen matrix reinforcement: a randomized controlled trial. Obstet Gynecol 2009; 114(1): 59–65.
9. Botros SM, Sand PK, Beaumont JL et al. Arcus-anchored acellular dermal graft compared to anterior colporrhaphy for stage II cystoceles and beyond. Int Urogynecol J Pelvic Floor Dysfunct 2009; 20(10): 1265–1271.
10. Gandhi S, Goldberg RP, Kwon C et al. A prospective randomized trial using solvent dehydrated fascia lata for the prevention of recurrent anterior vaginal wall prolapse. Am J Obstet Gynecol 2005; 192(5): 1649–1654.
11. Julian TM. Efficacy of Marlex mesh in the repair of severe, recurrent vaginal prolapse of the anterior midvaginal wall. Am J Obstet Gynecol 1996; 175(6): 1472–1475.
12. Dmochowski RR, Gomelsky A. Cystocele and anterior vaginal prolapse. In: Graham SD, Glenn JF, Keane TE eds. Glenn’s Urologic Surgery, 6th Edition. Philadelphia, PA, USA: Lippincott Williams & Wilkins; 2004 : 339–348.
13. DeLancey JO. Anatomic aspects of vaginal eversion after hysterectomy. Am J Obstet Gynecol 1992; 166 (6 Pt 1): 1717–1724.
14. Zimmerman CW. Pelvic organ prolapse. In: Rock JA, Jones HW eds. TeLinde’s Operative Gynecology, 9th Edition. Philadelphia, PA, USA: Lippincott Williams & Wilkins; 2003 : 927–948.
15. Leffler KS, Thompson JR, Cundiff GW et al. Attachment of the rectovaginal septum to the pelvic sidewall. Am J Obstet Gynecol 2001; 185(1): 41–43.
16. Cespedes RD, Dmochowski RR. The diagnosis and treatment of vaginal prolapse conditions. Part I: Pelvic anatomy, cystocele, rectocele. AUA Update Series, Volume XXI, Lesson 23, 2002.
17. Beck RP, McCormick S, Nordstrum L. A 25-year experience with 519 anterior colporrhaphy procedures. Obstet Gynecol 1991; 78(6): 1011–1014.
18. Paraiso MFR, Ballard LA, Walters MD et al. Pelvic support defects and visceral and sexual function in women treated with sacrospinous ligament suspension and pelvic reconstruction. Am J Obstet Gynecol 1996; 175(6): 1423–1431.
19. Shull BL, Capen CV, Riggs MW et al. Preopera-tive and postoperative analysis of site-specific pelvic support defects in 81 women treated with sacrospinous ligament suspension and pelvic reconstruction. Am J Obstet Gynecol 1992; 166 (6 Pt 1): 1764–1771.
20. Singh K, Cortes E, Reid WM. Evaluation of the fascial technique for surgical repair of the isolated posterior vaginal wall prolapse. Obstet Gynecol 2003; 101(2): 320–324.
21. Maher CF, Qatawneh A, Baessler K et al. Midline rectovaginal fascial plication for repair of rectocele and obstructed defecation. Obstet Gynecol 2004; 104(4): 685–689.
22. Kenton K, Shott S, Brubaker L. Outcome after rectovaginal fascia reattachment for rectocele repair. Am J Obstet Gynecol 1999; 181(6): 1360–1363.
23. Cundiff GW, Weidner AC, Visco AG et al. An anatomic and functional assessment of the discrete defect rectocele repair. Am J Obstet Gynecol 1998; 179 (6 Pt 1): 1451–1456.
24. Paraiso MF, Barber MD, Muir TW et al. Rectocele repair: a randomized trial of three surgical techniques including graft augmentation. Am J Obstet Gynecol 2006; 195(6): 1762–1771.
25. Maher C, Baessler K. Surgical management of posterior vaginal wall prolapse: an evidence-based literature review. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17(1): 84–88.
26. Groutz A, Chaikin DC, Theusen E et al. Use of cadaveric solvent-dehydrated fascia lata for cystocele repair-preliminary results. Urology 2001; 58(2): 179–183.
27. Chung SY, Franks M, Smith CP et al. Technique of combined pubovaginal sling and cystocele repair using a single piece of cadaveric dermal graft. Urology 2002; 59(4): 538–541.
28. Frederick RW, Leach GE. Cadaveric prolapse repair with sling: intermediate outcomes with 6 months to 5 years of followup. J Urol 2005; 173(4): 1229–1233.
29. Safir MH, Gousse AE, Rovner ES et al. 4-Defect repair of grade 4 cystocele. J Urol 1999; 161(2): 587–594.
30. Migliari R, Usai E. Treatment results using a mixed fiber mesh in patients with grade IV cystocele. J Urol 1999; 161(4): 1255–1258.
31. Oster S, Astrup A. A new vaginal operation for recurrent and large rectocele using dermis transplant. Acta Obstet Gynecol Scand 1981; 60(5): 493–495.
32. Altman D, Zetterstrom J, Lopez A et al. Functional and anatomic outcome after transvaginal rectocele repair using collagen mesh: a prospective study. Dis Colon Rectum 2005; 48(6): 1233–1241.
33. Altman D, Zetterstrom J, Mellgren A et al. A three-year prospective assessment of rectocele repair using porcine xenograft. Obstet Gynecol 2006; 107(1): 59–65.
34. Leventoglu S, Mentes BB, Akin M et al. Transperineal Rectocele repair with polyglycolic acid mesh: a case series. Dis Colon Rectum 2007; 50(12): 2085–2092.
35. de Tayrac R, Picone O, Chauveaud-Lambling A et al. A 2-year anatomical and functional assessment of transvaginal rectocele repair using a polypropylene mesh. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17(2): 100–105.
36. Biehl RC, Moore RD, Miklos JR et al. Site-specific rectocele repair with dermal graft augmentation: comparison of porcine dermal xenograft (Pelvicol) and human dermal allograft. Surg Technol Int 2008; 17 : 174–180.
37. Starkman JS, Togami J, Winters JC et al. Augmented repairs and use of interposition grafts in pelvic reconstructive surgery. Curr Blad Dysf Rep 2007; 2 : 143–154.
38. Jia X, Glazener C, Mowatt G et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG 2008; 115(11): 1350–1361.
39. Sung VW, Rogers RG, Schaffer JI et al.; Society of Gynecologic Surgeons Systematic Review Group. Graft use in transvaginal pelvic organ prolapse repair: a systematic review. Obstet Gynecol 2008; 112(5): 1131–1142.
40. Gomelsky A, Scarpero HM, Dmochowski RR. Sling surgery for stress urinary incontinence in the female: what surgery, which material? AUA Update Series, Volume XXII, Lesson 34, 2004.
41. Gomelsky A, Dmochowski RR. Biocompatibility assessment of synthetic sling materials for female stress urinary incontinence. J Urol 2007; 178 (4 Pt 1): 1171–1181.
42. Amid PK. Classification of biomaterials and their related complication in abdominal wall hernia surgery. Hernia 1997; 1 : 15–21.
43. Elmer C, Blomgren B, Falconer C et al. Histological inflammatory response to transvaginal polypropylene mesh for pelvic reconstructive surgery. J Urol 2009; 181(3): 1189–1195.
44. Petros PE. Vault prolapse II: Restoration of dynamic vaginal supports by infracoccygeal sacropexy, an axial day-case vaginal procedure. Int Urogynecol J Pelvic Floor Dysfunct 2001; 12(5): 296–303.
45. Farnsworth BN. Posterior intravaginal slingplasty (infracoccygeal sacropexy) for severe posthysterectomy vaginal vault prolapse: a preliminary report on efficacy and safety. Int Urogynecol J Pelvic Floor Dysfunct 2002; 13(1): 4–8.
46. Biertho I, Dallemagne B, Dewandre JM et al. Intravaginal slingplasty: short-term results. Acta Chir Belg 2004; 104(6): 700–704.
47. Baessler K, Hewson AD, Tunn R et al. Severe mesh complications following intravaginal slingplasty. Obstet Gynecol 2005; 106(4): 713–716.
48. Grynberg M, Teyssedre J, Staerman F. Gluteo-vaginal fistula after posterior intravaginal slingplasty: a case report. Int Urogynecol J Pelvic Floor Dysfunct 2009; 20(7): 877–879.
49. Hilger WS, Cornella JL. Rectovaginal fistula after posterior intravaginal slingplasty and polypropylene mesh augmented rectocele repair. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17(1): 89–92.
50. Karp D, Apostolis C, Lefevre R et al. Atypical graft infection presenting as a remote draining sinus. Obstet Gynecol 2009; 114 (2 Pt 1): 443–445.
51. Hefni M, Yousri N, El-Toukhy T et al. Morbidity associated with posterior intravaginal slingplasty for uterovaginal and vault prolapse. Arch Gynecol Obstet 2007; 276(5): 499–504.
52. Siegel AL, Kim M, Goldstein M et al. High incidence of vaginal mesh extrusion using the intravaginal slingplasty sling. J Urol 2005; 174 (4 Pt 1): 1308–1311.
53. Luck AM, Steele AC, Leong FC et al. Short-term efficacy and complications of intravaginal slingplasty. Int Urogynecol J Pelvic Floor Dysfunct 2008; 19(6): 795–799.
54. Niesel A, Gramalla O, Rohne A. A preliminary report on the use of a partially absorbable mesh in pelvic reconstructive surgery. Pelviperineology 2008; 27 : 22–25.
55. Barber MD, Brubaker L, Nygaard I et al. Defining success after surgery for pelvic organ prolapse. Obstet Gynecol 2009; 114(3): 600–609.
56. Nguyen JN, Burchette RJ. Outcome after anterior vaginal prolapse repair: a randomized controlled trial. Obstet Gynecol 2008; 111(4): 891–898.
57. Rane A, Kannan K, Barry C et al. Prospective study of the Perigee system for the management of cystocoeles – medium-term follow up. Aust N Z J Obstet Gynaecol 2008; 48(4): 427–432.
58. Moore RD, Miklos JR. Vaginal repair of cystocele with anterior wall mesh via transobturator route: efficacy and complications with up to 3-year followup. Adv Urol 2009;743831.
59. Gauruder-Burmester A, Koutouzidou P, Rohne J et al. Follow-up after polypropylene mesh repair of anterior and posterior compartments with recurrent prolapse. Int Urogynecol J Pelvic Floor Dysfunct 2007; 18(9): 1059–1064.
60. Abdel-Fattah M, Ramsay I. West of Scotland Study Group. Retrospective multicentre study of the new minimally invasive mesh repair devices for pelvic organ prolapse. BJOG 2008; 115 : 22–30.
61. Fatton B, Amblard J, Debodinance P et al. Transvaginal repair of genital prolapse: preliminary results of a new tension-free vaginal mesh (Prolift technique) – a case series multicentric study. Int Urogynecol J Pelvic Floor Dysfunct 2007; 18(7): 743–752.
62. Elmér C, Altman D, Engh ME et al. Nordic Transvaginal Mesh Group. Trocar-guided transvaginal mesh repair of pelvic organ prolapse. Obstet Gynecol 2009; 113(1): 117–126.
63. van Raalte HM, Lucente VR, Molden SM et al. One-year anatomic and quality-of-life outcomes after the Prolift procedure for treatment of posthysterectomy prolapse. Am J Obstet Gynecol 2008; 199(6): 694.e1–6.
64. Solà Dalenz V, Pardo Schanz J, Ricci Arriola P et al. [Prolift system in the correction of female genital prolapse.] Actas Urol Esp 2007; 31(8): 850–857. In Spanish.
65. Neuman M, Friedman M. [Advanced mesh implants for vaginal pelvic floor reconstruction: report of 100 Prolift operations.] Harefuah 2007; 146(12): 923–927. In Hebrew.
66. Hinoul P, Ombelet WU, Burger MP et al. A prospective study to evaluate the anatomic and functional outcome of a transobturator mesh kit (prolift anterior) for symptomatic cystocele repair. J Minim Invasive Gynecol 2008; 15(5): 615–620.
67. Aungst MJ, Friedman EB, von Pechmann WS et al. De novo stress incontinence and pelvic muscle symptoms after transvaginal mesh repair. Am J Obstet Gynecol 2009; 201(1): 73.e1–7.
68. Altman D, Falconer C. Perioperative morbidity using transvaginal mesh in pelvic organ prolapse repair. Obstet Gynecol 2007; 109 (2 Pt 1): 303–308.
69. Collinet P, Belot F, Debodinance P et al. Transvaginal mesh technique for pelvic organ prolapse repair: mesh exposure management and risk factors. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17(4): 315–320.
70. Évaluation des implants de renfort posés par voie vaginale dans le traitement des prolapsus génitaux. The French National Authority for Health. Available at: http://www.has-sante.fr/portail/upload/docs/application/pdf/synthese_implant__prolapsus_voie_vaginale.pdf Accessed August 2010.
71. Murphy M. Society of Gynecologic Surgeons Systematic Review Group. Clinical practice guidelines on vaginal graft use from the society of gyneco-logic surgeons. Obstet Gynecol 2008; 112(5): 1123–1130.
72. FDA Public Health Notification: Serious Complications Associated with Transvaginal Placement of Surgical Mesh in Repair of Pelvic Organ Prolapse and Stress Urinary Incontinence. Issued: October 20, 2008. Available at: http://www.fda.gov/MedicalDevices/ Safety/AlertsandNotices/PublicHealthNotifications/UCM061976 Accessed August 2010.
73. Weber AM, Walters MD, Piedmonte MR. Sexual function and vaginal anatomy in women before and after surgery for pelvic organ prolapse and urinary incontinence. Am J Obstet Gynecol 2000; 182(6): 1610–1615.
74. Amrute KV, Eisenberg ER, Rastinehad AR et al. Analysis of outcomes of single polypropylene mesh in total pelvic floor reconstruction. Neurourol Urodyn 2007; 26(1): 53–58.
75. de Tayrac R, Devoldere G, Renaudie J et al. Prolapse repair by vaginal route using a new protected low-weight polypropylene mesh: 1-year functional and anatomical outcome in a prospective multicentre study. Int Urogynecol J Pelvic Floor Dysfunct 2007; 18(3): 251–256.
76. Altman D, Elmér C, Kiilholma P et al; Nordic Transvaginal Mesh Group. Sexual dysfunction after trocar-guided transvaginal mesh repair of pelvic organ prolapse. Obstet Gynecol 2009; 113(1): 127–133.
77. Butrick CW. Do guns kill people or…? The mesh dilemma. Int Urogynecol J 2010; 21(2): 133–134.
78. Davila GW, Drutz H, Deprest J. Clinical implications of the biology of grafts: conclusions of the 2005 IUGA Grafts Roundtable. Int Urogynecol J Pelvic Floor Dysfunct 2006; 17 (Suppl 1): S51–55.
79. Moore RD, Miklos JR. Vaginal mesh kits for pelvic organ prolapse, friend or foe: a comprehensive review. Sci World J 2009; 9 : 163–189.
Štítky
Detská urológia Urológia
Článek Screening karcinomu prostatyČlánek Ze zahraničních periodik
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2011 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Screening karcinomu prostaty
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Budou dosaženy očekávané počty nádorů ledvin a močového měchýře?
- Zanedbání profesionální péče při výkonu lékařského povolání v urologické praxi v USA: trendy a analýza
- Antimuskarinika při léčbě OAB
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Zpráva z konference AUA Annual Meeting 2011, Washington, D.C., USA
- Možnosti primární prevence karcinomu prostaty – běžná klinická praxe, nereálná fikce nebo blízká budoucnost?
- Ze zahraničních periodik
- EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
- EAU Guidelines pro léčbu karcinomu prostaty - Část druhá: Léčba pokročilého, recidivujícího karcinomu prostaty rezistentního vůči kastraci
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



