-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Radikální operace a radioterapie – jaký smysl a výsledky mají tyto modality u pacientů s karcinomem prostaty vyšších stadií
Radical surgery and radiotherapy – purpose and results of these treatment options in patients with higher stage prostate cancer
Prostate cancer – one of the most common malignant tumours and cause of death in men – represents very significant medical but also social and economic problem. Diagnostics and ensuing treatment (both curative treatment and treatment of advanced stages, including associated complications) is a very complex process, not only for patients (because early detection of prostate cancer affects large numbers of men) but also for healthcare systems, because continuously increasing incidence and prevalence have significant organizational, HR and last but not at least economic demands. Owing to the heterogeneous nature of prostate cancer the optimal therapy is not clear. But we can try to determine the best treatment in an individual patient and assess if it is feasible and justified considering the individual prostate cancer stage. The author focuses on higher stage prostate cancer and higher risk groups and evaluates the feasibility and results of individual treatment options – radical surgery and radiotherapy.
Key words:
prostate cancer, radical prostatectomy, radiotherapy
Autoři: V. Vít; A. Čermák; D. Pacík
Působiště autorů: Urologická klinika LF MU a FN Brno
Vyšlo v časopise: Urol List 2014; 12(3): 32-39
Souhrn
Karcinom prostaty jako jeden z nejčastějších zhoubných nádorů a příčina smrti u mužů představuje vysoce závažný medicínský, ale i společenský a ekonomický problém. Diagnostika a následná léčba – jak kurativní, tak především léčba pokročilých stadií, včetně jejich komplikací – je proces, který je velmi náročný. Jednak pro pacienty, protože zejména časná detekce karcinomu prostaty se týká obrovské cílové skupiny mužů, jednak pro zdravotnictví, protože stále rostoucí incidence a prevalence karcinomu prostaty klade na systém nesmírné nároky organizační, personální a v neposlední řadě i ekonomické. Není možno říci, jaká je optimální léčba, protože onemocnění představuje velmi heterogenní skupinu, ale je třeba se pokusit odpovědět na otázku, jaká je optimální léčba u konkrétního pacienta a zda vzhledem ke stadiu onemocnění je ta která léčebná modalita možná a hlavně smysluplná. Autor se zaměřil na karcinom prostaty vyšších stadií a rizikových skupin a hodnotí možnosti provedení a výsledky jednotlivých léčebných modalit – radikální operace a radioterapie.
Klíčová slova:
karcinom prostaty, radikální prostatektomie, radioterapieÚvod
Karcinom prostaty (KP) je v současné době považován za jeden z hlavních medicínských problémů týkajících se mužské populace. Představuje nejen zdravotní, ale i společenský a ekonomický problém. Incidence onemocnění v ČR se zvýšila z 2 228 nových případů v roce 1995 (tj. 45,6/ 100 000 mužů; mortalita 25,2/ 100 000) na 6 771 nových případů v roce 2010 (tj. 131,0/ 100 000 mužů; mortalita 28,4/ 100 000). Nárůst incidence za toto období činí 187,2 %, ale nárůst mortality za stejné období byl pouze 12,7 % [1]. Kromě celkového dramatického nárůstu incidence dochází i k posunu detekce KP směrem k mladším věkovým kategoriím. To je dáno především zavedením vyšetřování prostatického specifického antigenu (PSA) do rutinní klinické praxe a v posledních letech i změnami strategie provádění biopsií prostaty. Ty jsou indikovány při nižších hladinách PSA a je i vyšší počet odebíraných vzorků. To vede v řadě případů k časnější detekci KP a k nárůstu počtu pacientů s lokalizovaným onemocněním – tedy pacientů, u kterých můžeme volit postup s kurativním záměrem. Z hlediska řešení KP je základním problémem rozlišení karcinomů signifikantních (tedy těch, které pacienta ohrozí na životě svou progresí) a nesignifikantních (kdy pacient zemře s karcinomem prostaty, ale ne na něj). Z tohoto pohledu stojíme v řadě případů před otázkou: koho vůbec léčit, a pokud ano, jak léčit. V případě lokalizovaného nebo lokálně pokročilého KP má dnes pacient v zásadě tři možnosti – konzervativní postup – kdy se může jednat o tzv. aktivní sledování (active surveillance), kdy odkládáme radikální řešení, nebo o pozorné vyčkávání (watchfull waiting – WW), kdy počítáme s nasazením paliativní léčby až ve chvíli prokázané progrese nádoru. Dalšími variantami jsou operační řešení nebo radioterapie. Při volbě léčebné modality je nutno vždy postupovat individuálně a vždy je třeba zvážit tyto faktory:
- stadium nádorového onemocnění,
- věk pacienta a předpokládaná délka životní exspektace,
- jeho celkový zdravotní stav,
- komplikace a rizika jednotlivých léčebných modalit,
- přání a názor dokonale informovaného pacienta.
Není možno říci, jaká je optimální léčba KP, protože onemocnění představuje velmi heterogenní skupinu, ale je třeba se pokusit odpovědět na otázku, jaká je optimální léčba u konkrétního pacienta a zda vzhledem ke stadiu onemocnění je ta která léčebná modalita možná a hlavně smysluplná.
Pacienti s lokalizovaným KP s nízkým rizikem: cT1 – T2a a GS 2 – 6 a PSA < 10 ng/ ml
Tito pacienti by měli být informováni o výsledcích dvou randomizovaných studií srovnávajících RRP a WW u lokalizovaného KP. Ve studii SPCG ‑ 4 byla během 15letého sledování prokázána statisticky významně vyšší úmrtnost způsobená KP u skupiny WW ve srovnání se skupinou RAPE (20,7 vs 14,6 %). U mužů mladších 65 let byl tento rozdíl v úmrtnosti ještě významnější. Studie prokazuje, že provedení RAPE vede ke snížení rizika úmrtí na KP [2]. Naproti tomu analýza podskupin ve studii PIVOT nepotvrdila signifikantní redukci celkové mortality [3].
Pacienti s KP ve stadiu T1a – T1b: incidentální nádory do 5 % (T1a) a nad 5 % (T1b) nádorové tkáně v histologickém preparátu po TURP/ PE
Švédská studie hodnotící registr 23 288 mužů s incidentálními KP ukázala desetiletou KP mortalitu 26,6 %, nejsou však k dispozici detaily hodnot PSA a GS ani zastoupení stadií T1a/ T1b [4]. Jiné starší studie ukázaly, že u nádorů T1a došlo k progresi v 5 % po pěti letech a cca v 50 % po 10 – 13 letech. Je tedy zřejmé, že mladší pacienti s expektací života > 15 let jsou reálně ohroženi progresí onemocnění. U pacientů s T1b nálezem lze očekávat progresi onemocnění již v průběhu pěti let a těmto pacientům, pokud mají expektaci života delší než 10 let, bychom měli nabídnout RAPE [5]. Byl navržen prediktivní model, který zahrnuje hodnoty PSA před operací a po operaci a GS po operaci pro BPH. Model má prediktivní přesnost 83,2 % pro odhad zbytkového nádoru a 87,5 % pro odhad biochemické progrese, ale potřebuje ještě externí validace před tím, než může být použit v klinické praxi [4].
Stadium T1c a T2 KP
Klinicky nemanifestní tumor, který lze identifikovat punkční biopsií na základě patologického nálezu při vyšetření PSA (cT1c) se stal v současnosti nejrozšířenějším typem KP. Většina prací uvádí, že cT1c nádory jsou většinou signifikantní a neměly by být „podléčeny“, protože až 30 % cT1c nádorů jsou lokálně pokročilé v definitivním histopatologickém vyšetření [6]. Podíl nesignifikantních nádorů se pohybuje mezi 11 a 16 % [7,8]. Byly určité obavy, že zvýšení počtu biopsií může nést riziko detekce vyššího počtu nesignifikantních KP, nicméně nedávné studie ukázaly, že zvýšení počtu odebíraných biopsií na 12 a více nezvyšuje počet detekovaných nesignifikantních nádorů [9]. Hlavním problémem je, jak rozpoznat ty nádory, které nepotřebují RAPE. Bioptické nálezy a PSA poměr jsou užitečné při predikci nesignifikantních onemocnění [10]. Důležitou pomůckou v klinické praxi jsou Partinovy nomogramy, pomocí nichž můžeme odhadnout konečné patologické stadium a které tak mohou usnadnit výběr pacientů, kteří vyžadují chirurgickou léčbu [11]. Někteří autoři doporučují využít informace z biopsie – počet vzorků s KP a procento postižení jednotlivých vzorků [12]. Pokud je detekce KP pouze v jednom nebo několika málo vzorcích a procento postižení jednotlivých vzorků je nízké, je šance na detekci nesignifikantního KP vyšší, zejména pokud je současně nízká hodnota GS [13].
Pacientům ve stadiu cT2 s očekávanou délkou života 10 let by měla být rovněž nabídnuta RAPE, protože u neléčených pacientů dojde k progresi onemocnění po pěti letech v 35 – 55 %. Pokud u low ‑ grade karcinomu T2 zvažujeme aktivní sledování, je třeba myslet i na to, že předoperační hodnota gradingu tumoru z punkční biopsie nemusí být spolehlivá [14]. Rozšířená pánevní lymfadenektomie není u lokalizovaného KP s nízkým rizikem nutná, protože riziko postižení LU nepřesahuje 5 % [15].
Pacienti s lokalizovaným KP se středním rizikem: cT2b–T2c nebo GS 7 nebo PSA 10 – 20 ng/ ml
Pro tuto skupinu pacientů je RAPE jediným doporučeným léčebným standardem za předpokladu expektace života > 10 let. Prognóza je dobrá, pokud je tumor ohraničený na prostatu při patologickém vyšetření. Medián do progrese u neléčených pacientů stadia T2 se udává 6 – 10 let. U stadia T2b je progrese udávána až v 70 % během pěti let [16]. Tato fakta jsou podpořena výsledky některých velkých klinických studií, které srovnávaly výsledky léčby T2 KP jednak RAPE a jednak WW. Výsledky ukázaly signifikantní snížení KP specifické mortality ve prospěch RAPE [2,3]. Měla by být provedena eLND, pokud odhad postižení LU je vyšší než 5 % (tab. 1) [15].
Tab. 1. Onkologické výsledky RAPE u KP s nízkým a středním rizikem. 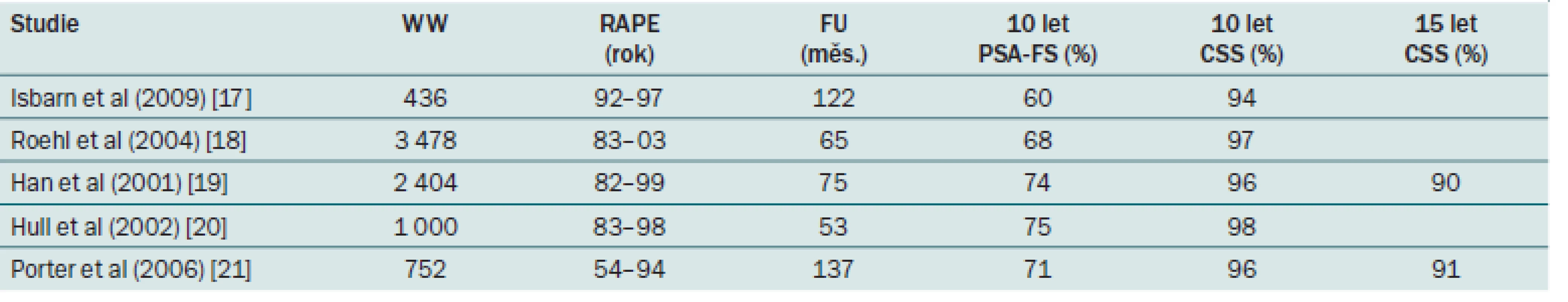
U lokalizovaných KP není ve většině případů problém s indikací radikálního operačního řešení. Limitujícími faktory jsou možnosti pracoviště, kde je pacient léčen, schopnost konkrétního pacienta operaci podstoupit z hlediska jeho celkového stavu a v neposlední řadě i volba léčebného postupu ze strany poučeného pacienta.
Poněkud rozporuplnější je otázka postavení radikální prostatektomie u lokálně pokročilého KP. Jedná se o heterogenní skupinu s poměrně špatnou prognózou, kdy většina urologů neindikuje radikální operační řešení jako předem odsouzené k neúspěchu. Je tomu ale skutečně vždy tak?
Pacienti s lokalizovaným a lokálně pokročilým KP s vysokým rizikem: cT3a nebo GS 8 – 10 nebo PSA > 20 ng/ ml
Díky širokému užití PSA v diagnostice KP došlo k výrazné migraci jak stadií, tak i diferenciace detekovaných nádorů, kdy více než 90 % mužů má v současné době diagnostikované lokalizované onemocnění [11]. Navzdory těmto trendům 20 – 35 % pacientů s nově detekovaným KP je klasifikováno jako vysoce rizikové díky PSA > 20 ng/ ml, GS > 8 nebo pokročilému klinickému stadiu [22]. Tito pacienti mají riziko biochemické recidivy, nutnosti další terapie, metastatické progrese a úmrtí na KP. Na druhou stranu ne všichni vysoce rizikoví pacienti mají stejně špatnou prognózu po RAPE [23]. Není žádný konsenzus ohledně optimální léčby pacientů s vysoce rizikovým KP. Rozhodnutí, zda zvolíme RAPE jako metodu volby, by mělo být založeno na co nejlepších klinických nálezech (malý objem nádoru, vyloučení fixace nádoru k pánevní stěně, vyloučení infiltrace svěrače apod.). Postup by měl být projednán v rámci multidisciplinárního týmu (urolog, klinický onkolog, radiační onkolog, radiolog, patolog) a teprve po zvážení benefitu a vedlejších efektů všech použitelných léčebných modalit je možno diskutovat s pacientem další postup s ohledem na jeho individuální přístup.
Stadium cT3a
Je definováno jako KP penetrující prostatickou kapsulu. Chirurgické řešení onemocnění v tomto stadiu nebylo v minulosti preferováno především proto, že bylo riziko pozitivních chirurgických okrajů, postižení LU a/ nebo vzdálené diseminace [24,25].
Existují randomizované studie hodnotící radioterapii v kombinaci s ADT ve srovnání se samotnou radioterapií, které prokázaly jasnou výhodu kombinované léčby, ale žádná studie neprokázala výhodu kombinované léčby ve srovnání s RAPE [26]. Analýzu i srovnání studií komplikuje různý podíl pacientů s následnou léčbou. Výsledky ukazují desetileté přežití bez biochemické recidivy u 43 – 51,1 % pacientů a desetileté nádorově specifické přežití u 57 – 92 % sledovaných pacientů. U 56 – 78 % však byla nutná další onkologická léčba v podobě radioterapie nebo hormonální terapie [27 – 29]. Jedním z významných argumentů podporujících indikaci chirurgického řešení u těchto pacientů je 13 – 27% pravděpodobnost klinického nadhodnocení rozsahu onemocnění, kdy je výsledný nádor při definitivním patologickém zhodnocení ohraničený na žlázu (pT2) [30 – 32].
Při analýze výsledků se zdá, že u vybraných pacientů, zvláště s nádorem cT3a a s příznivou hodnotou GS (< 7), lze dosáhnout velmi dobrých výsledků samotnou radikální prostatektomií jako monoterapií. U špatně diferencovaných nádorů je nutno počítat s nezbytností multimodálního přístupu (tab. 2) [33].
Tab. 2. Celkové a tumor-specifické přežití u lokálně pokročilého KP. 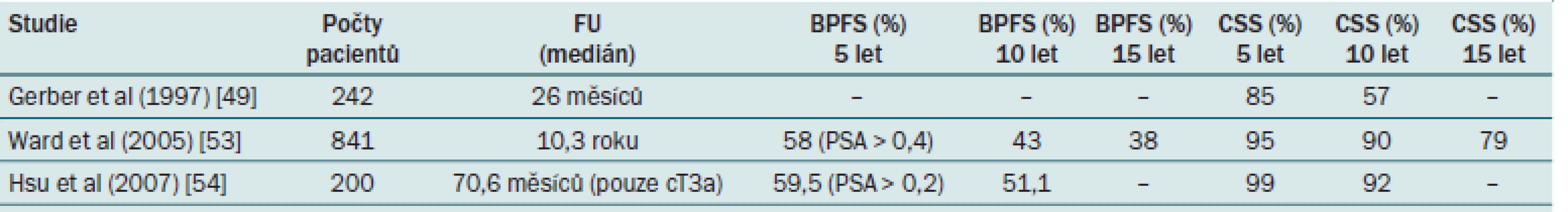
BPFS – biochemical progression-free survival Problémem zůstává výběr pacientů před operací. Nomogramy zahrnující PSA, T a GS mohou být užitečné při predikci patologického stadia onemocnění – Partinovy nomogramy [11,34]. Kromě toho zobrazení LU (CT), SV (NMR) nebo punkční biopsie uzlin nebo SV mohou pomoci při identifikaci těch pacientů, kteří by z chirurgického postupu neprofitovali [28]. Provádění RAPE u klinického karcinomu T3 vyžaduje dostatečnou chirurgickou erudici, která umožní udržet přijatelnou míru morbidity. To souvisí s požadavkem na koncentraci pacientů s lokálně pokročilými KP do specializovaných center, kde právě dostatečná celková chirurgická erudice a zkušenost může vést ke snížení operační morbidity a ke zlepšení funkčních výsledků po RAPE u KP klinického stadia T3 [29]. Bylo prokázáno, že kontinence může být zachována ve většině případů a u vybraných případů může být zachována i potence [35].
GS 8 – 10
Ačkoli většina špatně diferencovaných tumorů penetruje mimo prostatu, četnost onemocnění ohraničeného na prostatu je 26 – 31 %. Pacienti se špatně diferencovanými tumory ohraničenými na prostatu při histopatologickém vyšetření mají stále dobrou prognózu po RAPE. Kromě toho až jedna třetina pacientů s biopsií GS > 8 může ve skutečnosti mít v definitivním hodnocení preparátu GS < 7 s lepšími prognostickými charakteristikami. Hodnota PSA a procento pozitivních vzorků při biopsii prostaty může pomoci vybrat muže s high‑grade karcinomem prostaty, kteří mohou s největší pravděpodobností profitovat z RAPE [33].
PSA > 20 ng/ ml
Yossepowitch et al prezentovali výsledky RAPE jako monoterapie u mužů s PSA > 20 ng/ ml v souboru s většinou klinicky lokalizovaným tumorem. Zjistili četnost PSA recidivy 44 %/ 5 let a 53 %/ 10 let [23]. D’Amico et al zjistili, že muži s PSA > 20 ng/ ml mají 50% riziko PSA progrese/ 5 let po RAPE [36]. Spahn et al – soubor 712 pacientů s PSA > 20 ng/ ml: CSS 90 %/ 10 let a 85 %/ 15 let. Současně prokázali, že kombinace PSA > 20 ng/ ml + cT3 a/ nebo GS 8 – 10 signifikantně snižuje CSS [37]. Pozdější subanalýza tohoto souboru (Gontoro et al) – 10 let CSS: PSA > 100 ng/ ml = 80 %; PSA 50,1 – 100 ng/ ml = 85 %; PSA 20,1 – 50 ng/ ml = 91 %. Tyto výsledky jsou argumentem pro agresivní přístup s RAPE jako iniciálním krokem v léčbě [38]. Extenzivní LND by měla být provedena ve všech případech vysoce rizikového KP, protože pravděpodobnost pozitivních LU je v těchto případech 15 – 40 % [15].
Pacienti s lokalizovaným KP s velmi vysokým rizikem: cT3b–T4 N0 nebo jakékoli TN1
Tito pacienti, pokud nejsou léčeni, mají obecně signifikantní riziko progrese onemocnění a úmrtí na KP. Nádory tohoto stadia mají dva specifické problémy. Jednak je to lokální kontrola nádoru, jednak léčba mikroskopických metastáz, které mohou být přítomné, ale nejsou detekovatelné, dokud nedojde k progresi onemocnění. Johnstone et al publikovali studii 72 pacientů po RAPE pro cT4 KP. Tito pacienti vykazovali lepší přežití než pacienti léčení HT nebo RT samotnou a vykazovali srovnatelné přežití s pacienty léčenými kombinací HT + RT [39]. Jiná studie srovnává výsledky RAPE u vysoce rizikových KP (T3 – 4 N0 – 1, N1, M1a). Celkové přežití/ CSS po sedmi letech sledování bylo 76,69 %/ 90,2 % u pacientů s lokálně pokročilými stadii a 88,4 %/ 99,3 % u pacientů s lokalizovaným onemocněním [40]. Optimální léčebný postup často vyžaduje multimodální přístup. Správná kombinace a načasování jednotlivých léčebných modalit by měla být diskutována v rámci multidisciplinárního týmu a indikace by měla být přísně individuální. Kombinace RAPE a časné adjuvantní HT u pN + KP vedla k dosažení desetiletého CSS 80 % [41,42]. Většina urologů není ochotna pokračovat v operaci poté, co je peroperačně zjištěno postižení LU. Nicméně retrospektivní studie ukázaly signifikantní zlepšení CSS i OS u pacientů po RAPE ve srovnání s těmi, u kterých bylo od výkonu upuštěno pro detekci postižení LU. Tyto výsledky ukazují, že RAPE může přinášet prospěch ve smyslu zlepšení přežití a neprovedení RAPE pro nález postižení LU nemusí být odůvodnitelné. Nálezy z klinických studií podporují postavení RAPE jako důležité součásti multimodálního přístupu k N + KP (tab. 3 a 4) [43].
Tab. 3. Závěry a doporučení EAU pro RAPE. 
Léčba ozářením (radioterapie – RT)
RT představuje excelentní terapeutickou možnost pro celou řadu mužů s KP. Je lepší alternativou pro muže, který je starší a jehož šance na definitivní vyléčení operací jsou nižší. Tímto způsobem jsou kandidáti této léčby „negativně vyselektováni“ a patří sem především starší muži v horším celkovém zdravotním stavu, pro které by operace představovala nepřiměřené riziko, muži, jejichž KP se stal lokálně pokročilým a v tomto stadiu lokálně chirurgicky neodstranitelným, a samozřejmě muži, kteří rizika operace prostě podstoupit nechtějí. Největší výhodou radioterapie je, že se nejedná o operaci, největší nevýhodou (zejména u mladšího pacienta) je to, že schopnost vyléčit nádor nemusí být trvalá. Výskyt nežádoucích účinků je méně závislý na lékaři provádějícím terapii při dodržení všech principů a metodiky léčby a vybavení odpovídající technologií.
Otázkou je ovšem volba léčby u muže, který spadá někam mezi tyto dvě krajní skupiny, do jakési „šedé zóny“, a může být potenciálním kandidátem jak operace, tak radioterapie. Zde je nepochybně nezbytné zvážit znovu všechna fakta, možný scénář horšího výsledného efektu, který se může dostavit – co když po operaci bude pacient bez nádoru, ale s trvalými komplikacemi, nebo co když po prodělané RT bude zprvu bez obtíží, ale s trvale rostoucím PSA ukazujícím na recidivu nádoru – která varianta (a k oběma může dojít) by byla přijatelnější? Důležitou a logickou otázkou je také otázka kombinované léčby. RAPE po neúspěšné RT je provázena rizikem komplikací s velmi spornou šancí na trvalé vyléčení. RT po RAPE je u určité skupiny pacientů (s nepříznivými charakteristikami nádoru a známkami, že lokálně bohužel zůstal po operaci stále přítomný nádor) indikována.
Bylo prokázáno, že úspěšnost léčby je závislá na výši dávky ozáření (čím větší dávka, tím větší pravděpodobnost úspěšné léčby, ale také tím vyšší pravděpodobnost výskytu nežádoucích účinků). Pokrok současných technologií (zobrazení, počítačová kalkulace dávky, specifické zastínění...) umožnil zdokonalit současnou RT ve smyslu přesného ozáření nádoru vysokou dávkou a přitom šetření okolních tkání. Tvar prostaty je individuálně velmi rozdílný a individualizace kalkulace dávky ozáření je naprosto nezbytná.
Není předmětem tohoto sdělení zabývat se technologiemi a vlastním prováděním RT – to je v kompetenci radiačního onkologa. V této oblasti jenom několik poznámek, které se týkají urologa jako nositele odpovědnosti za celkovou léčbu karcinomu prostaty.
Neadjuvantní a adjuvantní hormonální terapie v kombinaci s RT
Některé randomizované studie jasně ukázaly, že u některých pacientů s nemetastatickým KP je samotná RT méně účinná ve srovnání s kombinací RT + ADT.
Studie EORTC 22863 – 415 pacientů s T1 – 2 GS/ T3 – 4 N0M0 + jakékoli G. Srovnání RT vs RT + ADT (LHRH + AA). ADT byla zahájena současně s RT. RT – 50 Gy (pánev) + 20 Gy (prostata). Přežití (med. 66 měsíců) – RT + ADT: 78 %; RT: 62 %. Desetileté OS/ PFS – RT + ADT: 58,1 %/ 47,7 %; RT: 39,8 %/ 22,7 %. Kardiovaskulární mortalita 11,1 vs 8,2 % [44].
Studie RTOG 8531 : 8 531 pacientů T3 – 4 N0 – 1 M0 nebo pT3 po RAPE. ADT (LHRH) byla zahájena týden před ukončením RT a pokračovala do relapsu KP (skupina I) nebo byla zahájena při progresi (skupina II). Skupina I: 15 % po RAPE, 14 % N1; skupina II: 29 % po RAPE, 26 % N1. RT: 45 Gy pánev + 20 – 25 Gy prostata/ lůžko. Desetileté OS: I – 49 %; II – 39 % [45].
Studie RTOG 86 – 10 : 471 pacientů s KP T2 – 4 N0 – X M0. ADT (LHRH + AA) byla zahájena dva měsíce před RT a pokračovala do ukončení RT (I) nebo zahájení při relapsu KP (II). RT: 45 Gy (pánev) + 20 – 25 Gy (prostata). Desetileté OS: 43 % (I) vs 34 % (II); 10 let tumor specifická mortalita: 23 % (I) vs 36 % (II). Nebyl signifikantní rozdíl v četnosti kardiovaskulárních komplikací [46].
Řada dalších klinických studií se zabývala především posuzováním optimálního načasování a doby trvání neoadjuvantní/ adjuvantní léčby. Výstupem z těchto studií jsou následující doporučení:
- KP s nízkým rizikem: RT s modulovanou intenzitou s eskalací dávky bez ADT. Alternativou může být brachyterapie.
- KP se středním rizikem: pacienti, u kterých je možná ADT – IMRT v kombinaci s ADT (4– 6 měsíců). U pacientů, kterým nelze aplikovat ADT (komorbidity, nesouhlas pro preferenci sexuální aktivity) – IMRT (80 Gy) nebo kombinace IMRT + brachyterapie [47,48].
- KP s vysokým rizikem: T1– 2 N0– X M0 s PSA > 20 ng/ ml a/ nebo GS 8– 10, krátkodobé podání ADT nemá vliv na OS.Je vysoké riziko relapsu mimo ozařovanou oblast, a je tedy doporučen kombinovaný postup – IMRT s eskalací dávky vč. ozáření oblasti pánevní LU + dlouhodobá ADT. Délka trvání ADT se řídí podle WHO performance statusu, komorbidit a počtu špatných prognostických faktorů (cT > T2c; GS 8– 10; PSA > 20 ng/ ml).
- KP T3– 4 N0– 1 M0: provedené studie potvrzují jednoznačný benefit kombinace RT a ADT ve srovnání s ADT samotnou. Kombinovaná léčba snižuje riziko úmrtí o 23 % a riziko úmrtí na KP o 46 % [49,50]. V jiné studii byla při mediánu sledování 7,6 roku tumor specifická mortalita 23,9 % u ADT samotné a 11,9 % u kombinované léčby, celková mortalita po 10 letech byla 39,4 % u ADT a 29,6 u kombinace ADT + RT [51].
Pooperační (adjuvantní) radioterapie (ART) po RAPE: stadium pT3, GS > 7 a pozitivní chirurgické okraje (R1) jsou spojeny s rizikem lokální recidivy ve více než 50 % během pěti let [52,53]. Některé prospektivní klinické studie se zabývaly přínosem ART po RAPE (EORTC 22911, ARO 96 – 02, SWOG 8794). Z jejich analýz rezultovalo doporučení pro postup u pacientů s pT3 KP s rizikovými faktory lokální progrese (R1, ruptura kapsuly a/ nebo invaze do SV s PSA < 1 ng/ ml):
- adjuvantní RT lůžka prostaty po restituci močových funkcí,
- klinické a biologické sledování se záchrannou RT před dosažením hodnoty PSA 0,5 ng/ ml [54– 59].
Odložená (záchranná) radioterapie po RAPE (SRT): SRT nabízí možnost léčby u pacientů s perzistující nebo progredující hladinou PSA po RAPE. U více než 60 % pacientů, kteří jsou zaléčeni před dosažením hodnoty PSA 0,5 ng/ ml, je dosaženo nedetekovatelné hodnoty PSA, a je tak šance přibližně 80 % PFI během pěti let [58,59].
Rozhodnutí, zda zvolíme u vysoce rizikového pacienta s KP pT3 – 4N0M0 s nedetekovatelným PSA ART nebo vyčkáme indikce SRT, je obtížné. V praxi by měl urolog pacienta před RAPE poučit o možnosti následné RT v případě přítomnosti rizikových faktorů progrese, a pokud tato situace nastane, diskuze o volbě postupu a načasování další terapie by se měl účastnit i poučený pacient.
Toxicita radioterapie: pacient musí být poučen o možné urogenitální a gastrointestinální toxicitě radioterapie (tab. 5).
Tab. 5. Četnost projevů pozdní toxicity RT – EORTC 22863 [60]. ![Četnost projevů pozdní toxicity RT – EORTC 22863 [60].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7eb3631c50e120738b3f98d941fe1d41.png)
Pokud jde o erektilní funkce, poškození v souvislosti s RT je menší než u RAPE. Metaanalýzy studií prokázaly, že pravděpodobnost zachování erektilní funkce po jednom roce od terapie je 0,76 po brachyterapii, 0,60 po kombinaci brachyterapie a EBRT, 0,55 po EBRT, 0,34 po nervy šetřící RAPE a 0,25 po standardní RAPE [61].
Je třeba zmínit i riziko indukce sekundárních malignit (rektum, močový měchýř) po RT, které bylo prokázáno v některých studiích. V retrospektivní studii hodnotící 30 552 mužů po RT a 55 552 mužů po RAPE bylo zjištěno 1,7krát vyšší riziko vzniku karcinomu rekta ve skupině po RT a 2,34krát vyšší riziko vzniku karcinomu močového měchýře [62,63].
Pacienti léčení RAPE s vyšším rizikem onemocnění měli nižší riziko vzniku metastáz a nádorově specifického úmrtí oproti pacientům léčeným RT (tab. 6).
Tab. 6. Výskyt metastáz po RAPE vs RT u pacientů s klinicky lokalizovaným KP [64]. ![Výskyt metastáz po RAPE vs RT u pacientů s klinicky lokalizovaným KP [64].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0233ba7361e0080efe416b1ba1225da5.png)
Doporučení EAU pro radioterapii s kurativním záměrem (tab. 7).
Tab. 7. Doporučení EAU pro radioterapii s kurativním záměrem. 
Závěr
KP s vysokým rizikem není zcela jednoznačně definován. Je však zřejmé, že PSA > 20 ng/ ml, cT3 – 4 a GS 8 – 10 jsou charakteristiky, které vymezují část populace s nejvyšším rizikem progrese onemocnění a nádorově specifickou mortalitu.
U KP s vysokým rizikem je standardní způsob léčby RT + ADT. Chirurgický přístup (RAPE) je možný, avšak velmi častá je potřeba multimodální terapie.
Nelze jednoznačně definovat, která léčba je „lepší“. Proto je doporučena pečlivá rozvaha a multidisciplinární diskuze včetně informování pacienta o rizicích a benefitech a přihlédnutí k jeho preferencím.
MUDr. Vítězslav Vít
Urologická klinika LF MU a FN Brno
Jihlavská 20, 625 00
vvit@fnbrno.cz
Zdroje
1. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www.svod.cz.
2. Bill ‑ Axelson A, Holmberg L, Ruutu M et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 2011; 364(18): 1708 – 1717. doi: 10.1056/ NEJMoa1011967.
3. Wilt TJ, Brawer MK, Jones KM et al. Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 2012; 367(3): 203 – 213. doi: 10.1056/ NEJMoa1113162.
4. Capitanio U, Scattoni V, Freschi M et al. Radical prostatectomy for incidental (stage T1a ‑ T1b) prostate cancer: analysis of predictors for residual disease and biochemical recurrence. Eur Urol 2008; 54(1): 118 – 125. doi: 10.1016/ j.eururo.2008.02.018.
5. Lowe BA, Listrom MB. Incidental carcinoma of the prostate: an analysis of the predictors of progression. J Urol 1988; 140(6): 1340 – 1344.
6. Elgamal AA, Van Poppel HP, Van de Voorde WM et al.Impalpable invisible stage T1c prostate cancer: characteristics and clinical relevance in 100 radical prostatectomy specimens – a different view. J Urol 1997; 157(1): 244 – 250.
7. Oesterling JE, Suman VJ, Zincke H et al. PSA ‑ detected (clinical stage T1c or B0) prostate cancer. Pathologically significant tumors. Urol Clin North Am 1993; 20(4): 687 – 693.
8. Epstein JI, Walsh PC, Brendler CB. Radical prostatectomy for impalpable prostate cancer: the Johns Hopkins experience with tumors found on transurethral resection (stages T1A and T1B) and on needle biopsy (stage T1C). J Urol 1994; 152(5 Pt 2): 1721 – 1729.
9. Singh H, Canto EI, Shariat SF et al. Improved detection of clinically significant, curable prostate cancer with systematic 12 – core biopsy. J Urol 2004; 171(3): 1089 – 1092.
10. Epstein JI, Chan DW, Sokoll LJ et al. Nonpalpable stage T1c prostate cancer: prediction of insignificant disease using free/ total prostate specific antigen levels and needle biopsy findings. J Urol 1998; 160(6 Pt 2): 2407 – 2411.
11. Makarov DV, Trock BJ, Humphreys EB et al. Updated nomogram to predict pathologic stage of prostate cancer given prostate ‑ specific antigen level, clinical stage, and biopsy Gleason score (Partin tables) based on cases from 2000 to 2005. Urology 2007; 69(6): 1095 – 1101.
12. D’Amico AV, Whittington R, Malkowicz SB et al. Combination of the preoperative PSA level, biopsy gleason score, percentage of positive biopsies and MRI T‑stage to predict early PSA failure in men with clinically localized prostate cancer. Urology 2000; 55(4): 572 – 577.
13. Epstein JI. Gleason score 2 – 4 adenocarcinoma of the prostate on needle biopsy: a diagnosis that should not be made. Am J Surg Pathol 2000; 24(4): 477 – 478.
14. Epstein JI, Steinberg GD. The significance of low ‑ grade prostate cancer on needle biopsy. A radical prostatectomy study of tumor grade, volume, and stage of the biopsied and multifocal tumor. Cancer 1990; 66(9): 1927 – 1932.
15. Briganti A, Larcher A, Abdollah F et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 2012; 61(3): 480 – 487. doi: 10.1016/ j.eururo.2011.10.044.
16. Graversen PH, Nielsen KT, Gasser TC et al. Radical prostatectomy versus expectant primary treatment in stages I and II prostatic cancer. A fifteen‑year follow‑up. Urology 1990; 36(6): 493 – 498.
17. Isbarn H, Wanner M, Salomon G et al. Long‑term data on the survival of patients with prostate cancer treated with radical prostatectomy in the prostate ‑ specific antigen era. BJU Int 2010; 106(1): 37 – 43. doi: 10.1111/ j.1464 ‑ 410X.2009.09134.x.
18. Roehl KA, Han M, Ramos CG et al. Cancer progression and survival rates following anatomical radical retropubic prostatectomy in 3,478 consecutive patients: long‑term results. J Urol 2004; 172(3): 910 – 914.
19. Han M, Partin AW, Pound CR et al. Long‑term biochemical disease‑free and cancer ‑ specific survival following anatomic radical retropubic prostatectomy. The 15‑year Johns Hopkins experience. Urol Clin North Am 2001; 28(3): 555 – 565.
20. Hull GW, Rabbani F, Abbas F et al. Cancer control with radical prostatectomy alone in 1,000 consecutive patients. J Urol 2002; 167(2 Pt 1): 528 – 534.
21. Porter CR, Kodama K, Gibbons RP et al. 25‑year prostate cancer control and survival outcomes: a 40‑year radical prostatectomy single institution series. J Urol 2006; 176(2): 569 – 574.
22. Shao YH, Demissie K, Shih W et al. Contemporary risk profile of prostate cancer in the United States. J Natl Cancer Inst 2009; 101(18): 1280 – 1283. doi: 10.1093/ jnci/ djp262.
23. Yossepowitch O, Eggener SE, Bianco FJ Jr et al. Radical prostatectomy for clinically localized, high risk prostate cancer: critical analysis of risk assessment methods. J Urol 2007; 178(2): 493 – 499, discussion: 499.
24. Fallon B, Williams RD. Current options in the management of clinical stage C prostatic carcinoma. Urol Clin North Am 1990; 17(4): 853 – 866.
25. Boccon ‑ Gibod L, Bertaccini A, Bono AV et al. Management of locally advanced prostate cancer: a European consensus. Int J Clin Pract 2003; 57(3): 187 – 194.
26. Bolla M, Collette L, Blank L et al. Long‑term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360(9327): 103 – 106.
27. Gerber GS, Thisted RA, Chodak GW et al. Results of radical prostatectomy in men with locally advanced prostate cancer: multi‑institutional pooled analysis. Eur Urol 1997; 32(4): 385 – 390.
28. Van Poppel H, Ameye F, Oyen R et al. Accuracy of combined computerized tomography and fine needle aspiration cytology in lymph node staging of localized prostatic carcinoma. J Urol 1994; 151(5): 1310 – 1314.
29. Van Poppel H, Vekemans K, Da Pozzo L et al. Radical prostatectomy for locally advanced prostate cancer: results of a feasibility study (EORTC 30001). Eur J Cancer 2006; 42(8): 1062 – 1067.
30. Ward JF, Slezak JM, Blute ML et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate ‑ specific antigen testing: 15‑year outcome. BJU Int 2005; 95(6): 751 – 756.
31. Carver BS, Bianco FJ Jr, Scardino PT et al. Long‑term outcome following radical prostatectomy in men with clinical stage T3 prostate cancer. J Urol 2006; 176(2): 564 – 568.
32. Hsu CY, Joniau S, Oyen R et al. Outcome of surgery for clinical unilateral T3a prostate cancer: a single‑institution experience. Eur Urol 2007; 51(1): 121 – 128, discussion: 128 – 129.
33. Van Poppel H, Joniau S. An analysis of radical prostatectomy in advanced stage and high‑grade prostate cancer. Eur Urol 2008; 53(2): 253 – 259.
34. Joniau S, Hsu CY, Lerut E et al. A pretreatment table for the prediction of final histopathology after radical prostatectomy in clinical unilateral T3a prostate cancer. Eur Urol 2007; 51(2): 388 – 394, discussion: 395 – 396.
35. Loeb S, Smith ND, Roehl KA et al. Intermediate ‑ -term potency, continence, and survival outcomes of radical prostatectomy for clinically high‑risk or locally advanced prostate cancer. Urology 2007; 69(6): 1170 – 1175.
36. D’Amico AV, Whittington R, Malkowicz SB et al. Pretreatment nomogram for prostate ‑ specific antigen recurrence after radical prostatectomy or external ‑ beam radiation therapy for clinically localized prostate cancer. J Clin Oncol 1999; 17(1): 168 – 172.
37. Spahn M, Joniau S, Gontero P et al. Outcome predictors of radical prostatectomy in patients with prostate ‑ specific antigen greater than 20 ng/ ml: a European multi‑institutional study of 712 patients. Eur Urol 2010; 58(1): 1 – 7, discussion: 10 – 11. doi: 10.1016/ j.eururo.2010.03.001.
38. Gontero P, Spahn M, Tombal B et al. Is there a prostate ‑ specific antigen upper limit for radical prostatectomy? BJU Int 2011; 108(7): 1093 – 1100. doi: 10.1111/ j.1464 ‑ 410X.2011.10076.x.
39. Johnstone PA, Ward KC, Goodman M et al. Radical prostatectomy for clinical T4 prostate cancer. Cancer 2006; 106(12): 2603 – 2609.
40. Gontero P, Marchioro G, Pisani R et al. Is radical prostatectomy feasible in all cases of locally advanced non‑bone metastatic prostate cancer? Results of a single‑institution study. Eur Urol 2007; 51(4): 922 – 929, discussion: 929 – 930.
41. Ghavamian R, Bergstralh EJ, Blute ML et al. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN+ prostate cancer: a matched comparison. J Urol 1999; 161(4): 1223 – 1227, discussion: 1277 – 1278.
42. Messing EM, Manola J, Yao J et al. Immediate versus deferred androgen deprivation treatment in patients with node ‑ positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006; 7(6): 472 – 479.
43. Engel J, Bastian PJ, Baur H et al. Survival benefit of radical prostatectomy in lymph node ‑ positive patients with prostate cancer. Eur Urol 2010; 57(5): 754 – 761. doi: 10.1016/ j.eururo.2009.12.034.
44. Bolla M, Van Tienhoven G, Warde P et al. External irradiation with or without long‑term androgen suppression for prostate cancer with high metastatic risk: 10‑year results of an EORTC randomised study. Lancet Oncol 2010; 11(11): 1066 – 1073. doi: 10.1016/ S1470 ‑ 2045(10)70223 ‑ 0.
45. Pilepich MV, Winter K, Lawton CA et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma – long‑term results of phase IIIRTOG 85 – 31. Int J Radiat Oncol Biol Phys 2005; 61(5): 1285 – 1290.
46. Roach M 3rd, Bae K, Speight J et al. Short‑term neoadjuvant androgen deprivation therapy and external ‑ beam radiotherapy for locally advanced prostate cancer: long‑term results of RTOG 8610. J Clin Oncol 2008; 26(4): 585 – 591. doi: 10.1200/ JCO.2007.13.9881.
47. Krauss D, Kestin L, Ye H et al. Lack of benefit for the addition of androgen deprivation therapy to dose‑escalated radiotherapy in the treatment of intermediate ‑ and high‑risk prostate cancer. Int J Radiat Oncol Biol Phys 2011; 80(4): 1064 – 1071. doi: 10.1016/ j.ijrobp.2010.04.004.
48. Kupelian PA, Ciezki J, Reddy CA et al. Effect of increasing radiation doses on local and distant failures in patients with localized prostate cancer. Int J Radiat Oncol Biol Phys 2008; 71(1): 16 – 22.
49. Warde P, Mason M, Ding K et al. Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 2011; 378(9809): 2104 – 2111. doi: 10.1016/ S0140 ‑ 6736(11)61095 ‑ 7.
50. Mason M, Warde P, Sydes M et al. Defining the need for local therapy in locally advanced prostate cancer: an appraisal of the MRC PR07 study. Clin Oncol (R Coll Radiol) 2005; 17(4): 217 – 218.
51. Widmark A, Klepp O, Solberg A et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG ‑ 7/ SFUO ‑ 3): an open randomised phase III trial. Lancet 2009; 373(9660): 301 – 308. doi: 10.1016/ S0140 ‑ 6736(08)61815 ‑ 2.
52. Hanks GE. External ‑ beam radiation therapy for clinically localized prostate cancer: patterns of care studies in the United States. NCI Monogr 1988; (7): 75 – 84.
53. Swanson GP, Thompson IM. Adjuvant radiotherapy for high‑risk patients following radical prostatectomy. Urol Oncol 2007; 25(6): 515 – 519.
54. Bolla M, van Poppel H, Tombal B et al. Postoperative radiotherapy after radical prostatectomy for high‑risk prostate cancer: long‑term results of a randomised controlled trial (EORTC trial 22911). Lancet 2012; 380(9858): 2018 – 2027. doi: 10.1016/ S0140 ‑ 6736(12)61253 ‑ 7.
55. Wiegel T, Bottke D, Steiner U et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate ‑ specific antigen: ARO 96 – 02/ AUO AP 09/ 95. J Clin Oncol 2009; 27(18): 2924 – 2930. doi: 10.1200/ JCO.2008.18.9563.
56. Swanson GP, Thompson IM, Tangen C et al. Update of SWOG 8794: adjuvant radiotherapy for pT3 prostate cancer improves metastasis free survival. Int J Radiat Oncol Biol Phys 2008; 72: S31.
57. Thompson IM, Tangen CM, Paradelo J et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long‑term followup of a randomized clinical trial. J Urol 2009; 181(3): 956 – 962. doi: 10.1016/ j.juro.2008.11.032.
58. Stephenson AJ, Scardino PT, Kattan MW et al. Predicting the outcome of salvage radiation therapy for recurrent prostate cancer after radical prostatectomy. J Clin Oncol 2007; 25(15): 2035 – 2041.
59. Siegmann A, Bottke D, Faehndrich J et al. Salvage radiotherapy after prostatectomy – what is the best time to treat? Radiother Oncol 2012; 103(2): 239 – 243. doi: 10.1016/ j.radonc.2011.10.024.
60. Ataman F, Zurlo A, Artignan X et al. Late toxicity following conventional radiotherapy for prostate cancer: analysis of the EORTC trial 22863. Eur J Cancer 2004; 40(11): 1674 – 1681.
61. Robinson JW, Moritz S, Fung T. Meta‑analysis of rates of erectile function after treatment of localized prostate carcinoma. Int J Radiat Oncol Biol Phys 2002; 54(4): 1063 – 1068.
62. Baxter NN, Tepper JE, Durham SB et al. Increased risk of rectal cancer after prostate radiation: a population‑based study. Gastroenterology 2005; 128(4): 819 – 824.
63. Liauw SL, Sylvester JE, Morris CG et al. Second malignancies after prostate brachytherapy: incidence of bladder and colorectal cancers in patients with 15 years of potential follow‑up. Int J Radiat Oncol Biol Phys 2006; 66(3): 669 – 673.
64. Zelefsky MJ, Eastham JA, Cronin AM et al. Metastasis after radical prostatectomy or external beam radiotherapy for patients with clinically localized prostate cancer: a comparison of clinical cohorts adjusted for case mix. J Clin Oncol 2010; 28(9): 1508 – 1513. doi: 10.1200/JCO.2009.22.2265.
Štítky
Detská urológia Urológia
Článek Editorial
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2014 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Vývoj robotické technologie v urologické operativě
- Suspenze přední poševní stěny – popis techniky
- Je potřeba stanovit frekvenci urodynamického vyšetření u pacientů postižených dysfunkcí dolních močových cest v důsledku roztroušené sklerózy?
- Editorial
- Radikální operace a radioterapie – jaký smysl a výsledky mají tyto modality u pacientů s karcinomem prostaty vyšších stadií
- Priapizmus – čas jako limitující faktor
- Guidelines pro léčbu karcinomu prostaty 2. část
- EAU – Léčba LUTS u mužů by měla být především kombinační
- Řešení infekcí močových cest souvisejících s katetrizací (založené na důkazech)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- EAU – Léčba LUTS u mužů by měla být především kombinační
- Řešení infekcí močových cest souvisejících s katetrizací (založené na důkazech)
- Suspenze přední poševní stěny – popis techniky
- Radikální operace a radioterapie – jaký smysl a výsledky mají tyto modality u pacientů s karcinomem prostaty vyšších stadií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy