-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Autoimunitní hemolytické anémie
Autoimmune haemolytic anaemias
Immune hemolytic anemia results from a dysregulation of cooperation between T ‑ and B‑lymphocytes in a process of „self tolerance“ of autologous antigens. Antibodies of IgG‑subtype lead to the hemolysis at 37 ºC which is mainly extravascular, an optimal temperature for hemolysis of IgM subtype antibodies is 4 ºC and the hemolysis may have either intravascular or extravascular character. The agent evoking hemolysis is often undetectable, a part of immune hemolytic anemias may occur as a secondary disease in the course of infections, inflammations, autoimmune disorders or tumors. An antiglobulin test represents an essential tool for diagnosis of immune hemolytic anemia; the patients are mostly treated with corticosteroids as a single agent or in combination with other immunosuppressive agents (cyclophosphamide, cyclosprorin A). New treatment approaches (eg. i.v. immunoglobulins or rituximab) are indicated in patients resistant to conventional treatment. Severe hemolytic anemia represents a life threatening disease requesting a complex treatment at the intensive care unit.
Key words:
anemia - hemolytic - immune - diagnosis - treatment - immunosuppression
Autori: J. Čermák
Pôsobisko autorov: Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc.
Vyšlo v časopise: Vnitř Lék 2005; 91(7 a 8): 881-885
Kategória: 128. internistický den – XXI. Vanýskův den, Brno 2005
Súhrn
Autoimunitní hemolytické anémie vznikají jako důsledek dysregulace kooperace mezi T ‑ a B‑lymfocyty při procesu tzv. autotolerance, tj. rozpoznávání antigenů organizmu vlastních a cizích. Při tvorbě protilátek třídy IgG dochází k hemolýze při teplotě 37 ºC, jež má většinou extravaskulární charakter, při tvorbě protilátek třídy IgM je optimum hemolýzy při 4 ºC a hemolýza může mít jak intravaskulární, tak extravaskulární charakter. Příčina hemolýzy často není zjistitelná, část hemolytických anémií může být sekundární při infekcích, zánětech, systémových onemocněních či nádorech. Základním diagnostickým testem je antiglobulinový test, v léčbě se uplatňují kortikosteroidy v monoterapii či v kombinaci s dalšími imunosupresivy (cyklofosfamid, cyklosporin A), u rezistentních forem je možno použít nové postupy (i.v. imunoglobuliny, rituximab), těžký stupeň hemolytické anémie představuje život ohrožující onemocnění, vyžadující hospitalizaci na jednotce intenzivní péče.
Klíčová slova:
anémie - hemolýza - imunitní - diagnostika - léčba - imunosupreseÚvod
Základním momentem při vzniku autoimunitní hemolytické anémie je zřejmě porucha kooperace mezi pomocnými a supresorickými T‑lymfocyty a B‑lymfocyty, jež se uplatňuje v procesu imunitního dozoru, tj. v rozpoznávání organizmu vlastních a cizích antigenů [3,4]. Dysregulace tohoto procesu vede k nedostatečné supresi tvorby protilátek proti vlastním antigenům či paradoxně ke stimulaci jejich tvorby. Antigenní podnět může představovat bakteriální, virová či mykoplazmová infekce, vyvolávajícím podnětem pak může být i destrukce tkání způsobená infekcí či zánětem, jež vede k vyplavení tkáňových antigenů, které se jen zřídka dostávají do cirkulace a nepodléhají procesu autotolerance (self-tolerance), či antigenů, které nejsou exprimovány v časné ontogenezi, kdy výše zmíněný proces tolerance probíhá (např. Ii‑antigenní systém erytrocytů). Monocyty, makrofágy či B‑lymfocyty tvoří tzv. antigen prezentující buňky, jež nabízejí antigen po jeho digesci na peptidy a vazbě na molekuly hlavního histokompatibilního systému (MHC) II. třídy za spoluúčasti stimulačních molekul Th0 pomocným lymfocytům. Th0‑lymfocyty se po kontaktu s antigenem mohou přeměnit účinkem cytokinů na Th1‑lymfocyty, účastnící se autoimunní a zánětlivé reakce, či na Th2‑lymfocyty, mající důležitou úlohu v autoimunní protekci [3,4]. Dysregulace poměru mezi oběma typy lymfocytů může mít za následek tvorbu autoprotilátek.
Vazba protilátek namířených proti některému z membránových antigenů červené krvinky vede k intravaskulární hemolýze aktivací komplementu, či k zániku erytrocytů s navázanou protilátkou v monocytomakrofágovém systému. Na Fc‑části protilátky je přítomno receptorové místo pro vazbu C1q‑složky komplementu. K aktivaci komplementu je zapotřebí vazby C1q‑složky se dvěma receptory na Fc‑části imunoglobulinu. Protilátky třídy IgG se váží na erytrocyty při teplotním optimu 37 ºC, mluvíme o tepelných autoprotilátkách. Vzhledem k tomu, že IgG‑protilátka je monomer, dochází k aktivaci komplementu, jež vede k intravaskulární hemolýze jen při vysokém titru protilátek zajišťujícím jejich vazbu na těsná sousední místa erytrocytu (obr. 1). Většinou dochází k vazbě komplexu protilátka‑erytrocyt s receptorem pro Fc‑fragment na povrchu zejména makrofágů ve slezině. Hemolýza má tedy při přítomnosti tepelných protilátek převážně extravaskulární charakter a v současné době se ukazuje, že právě stimulace tvorby a exprese receptorů pro Fc‑fragment gamaglobulinu antigenními podněty je jedním z dalších důležitých faktorů v rozvoji anémie [2].
Obr. 1. Charakteristika protilátek třídy IgG a IgM a jejich vazba na membránu erytrocytu. 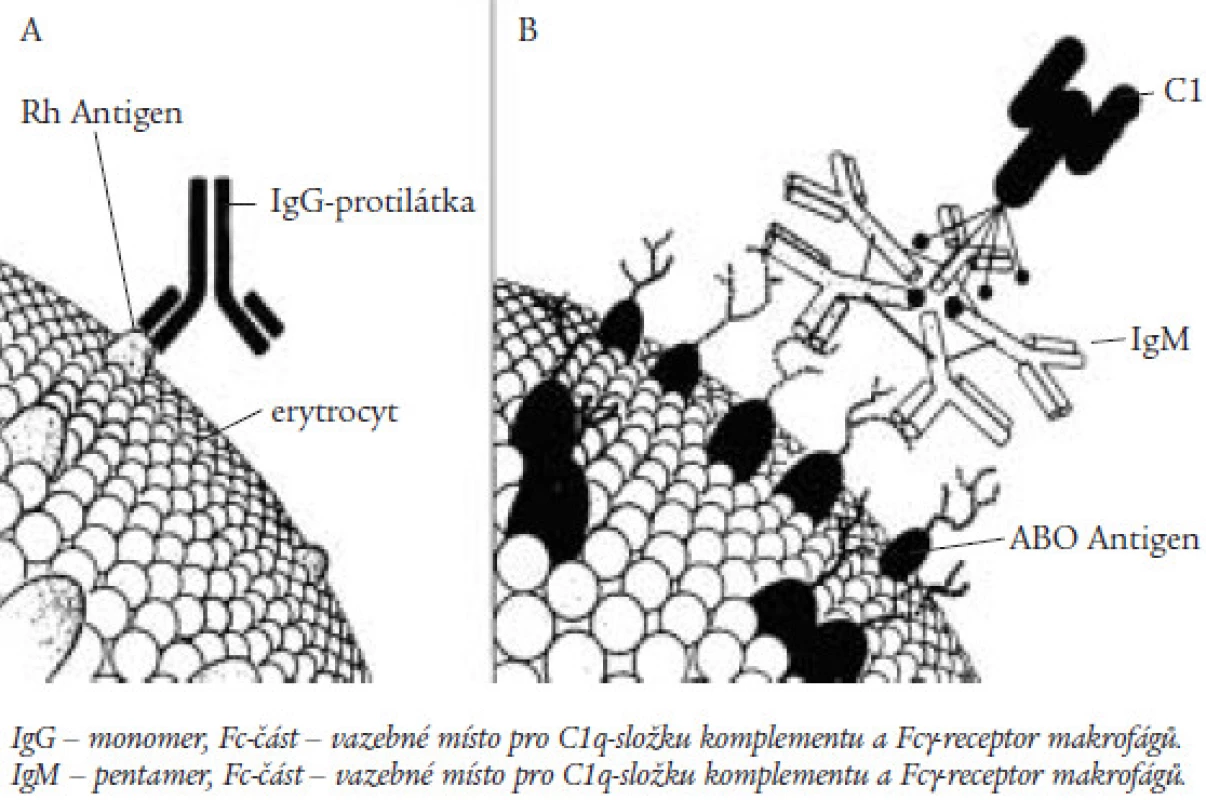
Protilátky třídy IgM
Protilátky třídy IgM se vážou při teplotním optimu 4 ºC, a mají tudíž charakter chladových autoprotilátek. K vazbě protilátek na erytrocyty dochází v chladnějších akrálních partiích organizmu. Vzhledem k tomu, že protilátky třídy IgM tvoří pentamery, je jejich přítomnost spojena s vyšší pravděpodobností aktivace komplementu a rozvoje intravaskulární hemolýzy (obr. 1). Většinou však není vazba na erytrocyt pevná a v oblastech s vyšší teplotou je část protilátek opět uvolněna, aniž došlo k lýze erytrocytů. Na krvinkách však zůstává navázána C3b‑složka komplementu, jež se váže na receptor makrofágů sleziny, hemolýza má tedy současně i extravaskulární charakter [6].
Hemolytické anémie
Hemolytické anémie s tepelnými i chladovými protilátkami mohou vznikat jako idiopatické bez prokazatelné vyvolávající příčiny, či jako sekundární v návaznosti na infekci nebo v průběhu zejména nádorových či autoimunních onemocnění. Klasifikace autoimunitních hemolytických anémií je uvedena v tab. 1. Zvláštním skupinu tvoří polékové autoimunní hemolytické anémie, kde lék působí jako hapten, či tvoří imunokomplexy vážící se na povrch erytrocytů nebo působí jako stimulátor tvorby protilátek proti některým antigenům erytrocytární membrány (tab. 2).
Tab. 1. Klasifikace autoimunitních hemolytických anémií. 
Tab. 2. Polékové imunitní hemolytické anémie. 
Klinický obraz onemocnění
Klinický obraz onemocnění závisí na rychlosti vzniku a stupni anémie a kombinují se v něm obecně anemické příznaky (únava, slabost, podrážděnost, dušnost) se známkami hemolýzy (ikterus, zvětšení sleziny a méně často jater, tmavá moč). V laboratorním nálezu dominuje makrocytární anémie se zvýšeným počtem retikulocytů, je přítomna zvýšená hladina přímého i nepřímého bilirubinu v séru, v moči je přítomen urobilinogen. Základním testem sloužícím k průkazu protilátek je přímý a nepřímý antiglobulinový (Coombsův) test (obr. 2 a 3). Pro přítomnost intravaskulární hemolýzy svědčí krom zvýšeného množství volného hemoglobinu v plazmě a přítomnosti hemoglobinurie i snížená hladina sérového haptoglobinu, jenž váže disociované dimery globinu a hemopexinu, jenž slouží k vazbě uvolněného hemu. Vzhledem k tomu, že autoimunitní hemolytická anémie může být často prvým příznakem jiného, zejména nádorového onemocnění, je třeba vždy provést pečlivé celkové vyšetření nemocného.
Obr. 2. Přímý Coombsův test slouží k průkazu protilátek vázaných na erytrocyt, při dodání antiIgG-protilátky dochází k aglutinaci erytrocytů s navázanou protilátkou. 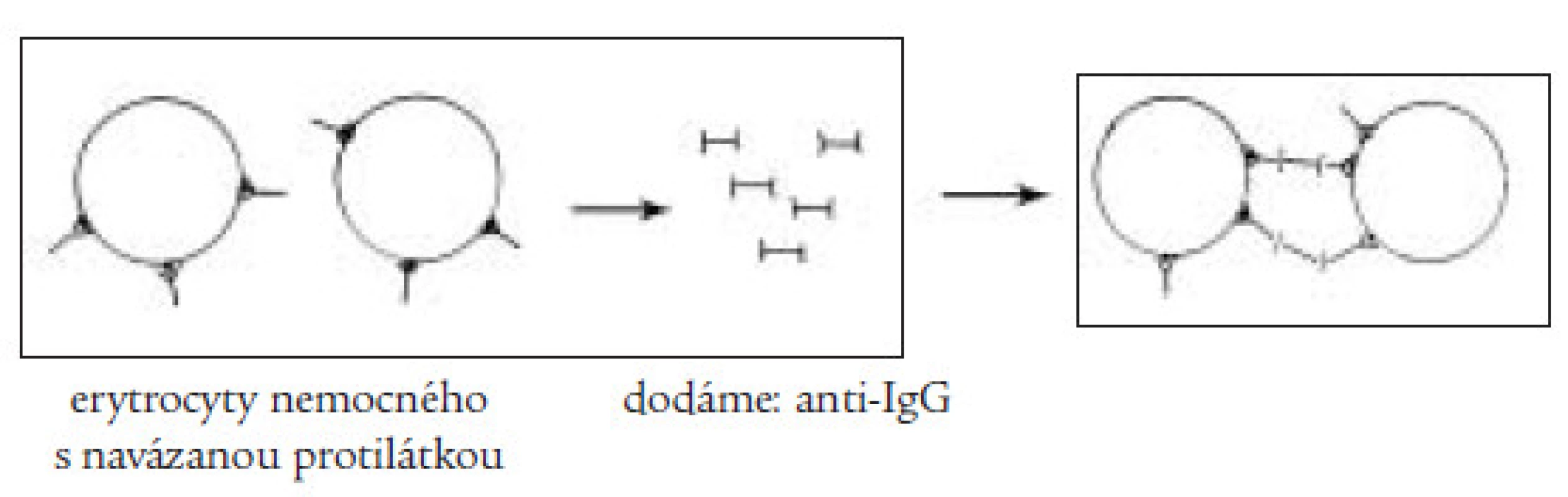
Obr. 3. Nepřímý Coombsův test slouží k průkazu volných cirkulujících protilátek, v prvé fázi dochází k navázání těchto protilátek na dodané skupinové erytrocyty, v druhé fázi pak dochází k aglutinaci erytrocytů po přidání antiIgG- či antiC3b-protilátky stejně jako v přímém testu. 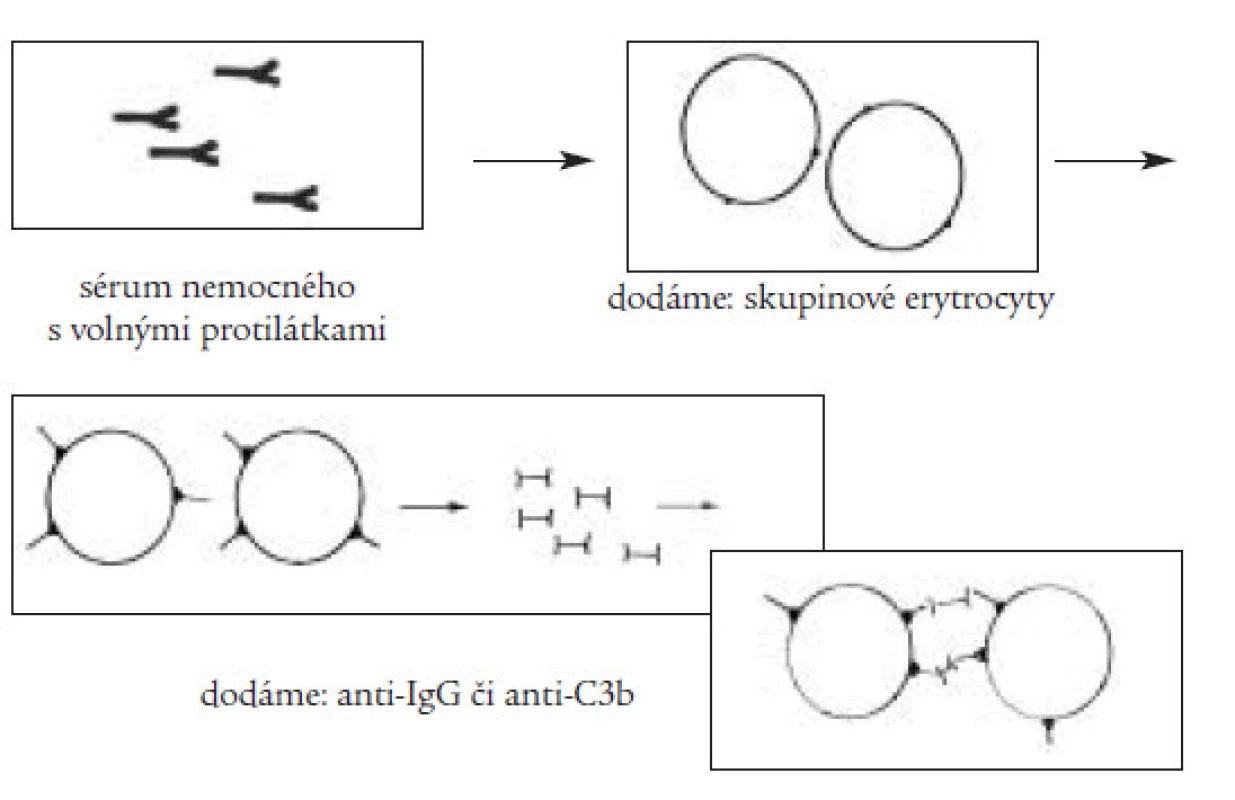
Diferenciální diagnostika
Diferenciálně diagnosticky je třeba odlišit zejména skupinu korpuskulárních hemolytických anémií, u nichž není přítomna pozitivita Coombsova testu, a bývají nalézány jiné abnormity (snížená hladina erytrocytárních enzymů, deficit některých membránových proteinů, abnormální elektroforéza hemoglobinů), méně často je třeba odlišit paroxyzmální noční hemoglobinurii a některé formy myelodysplazie s výraznou hemolytickou komponentou. V některých případech může pomoci i výsledek vyšetření délky přežití značených erytrocytů, u anémií korpuskulárních je zkráceno přežití pouze autologních, nikoli rádcovských erytrocytů. Antiglobulinový test je negativní i u Gilbertovy choroby, z celé skupiny neimunitních získaných hemolytických anémií vyvolaných mechanickými, fyzikálními, chemickými vlivy či infekcí je nejčastější mikroangiopatická hemolytická anémie s charakteristickou přítomností schistocytů, postižením ledvin a CNS. Základní diferenciální diagnostika autoimunitní hemolytické anémie je uvedena v tab. 3.
Tab. 3. Diferenciální diagnostika autoimunitní hemolytické anémie. 
Léčba
Tradiční postupy
Tradičním přístupem k léčbě nemocných s autoimunitní hemolytickou anémií je podávání kortikosteroidů. Účinek kortikosteroidů spočívá v útlumu tvorby protilátek a snížení jejich afinity k antigenu a v redukci počtu receptorů pro Fc‑fragment imunoglobulinů a C3b‑složku komplementu na povrchu makrofágů. Monoterapie prednisonem v dávce 1 mg/kg/den je však většinou postačující pouze u lehčího stupně hemolýzy s iniciálními hodnotami Hb > 70-80 g/l, kdy je při dobré odpovědi s trvalým vzestupem hodnot Hb nad 90 g/l možno po 3 týdnech dávku postupně snižovat každý 3. či 4. den až do dávky 20 mg denně. Další snižování dávky je třeba provádět velmi pomalu (o 5 mg v 2týdenních intervalech) až na udržovací dávku 2,5-5 mg denně, kterou vysazujeme až při opakovaně negativním sérologickém nálezu v přímém antiglobulinovém testu. Zhruba polovina nemocných však vyžaduje kombinaci prednisonu s jiným imunosupresivem, nejčastěji cyklofosfamidem v dávce 50-150 mg/den. Nemocní s těžkou hemolýzou s hodnotami Hb < 60 g/l jsou indikováni k léčbě na lůžkovém hematologickém oddělení kombinovanou imunosupresí vysokými dávkami kortikosteroidů (5-10 mg/kg/den) s cyklofosfamidem a eventuálně mechanickým odstraněním cirkulujících volných protilátek plazmaferézou. Podávání transfuzí erytrocytů u akutní hemolýzy je indikováno pouze za hospitalizace a přísně individuálně dle stupně anémie a klinického stavu nemocného. Vždy je nutno podávat transfuzi pomalu pod clonou kortikoidů za přísné monitorace nemocného, a ne více než 1 transfuzní jednotku denně, pokud nejde o vitální indikaci.
Nové postupy
Z nových léčebných postupů je nejčastěji používáno podávání vysokých dávek i.v. imunoglobulinů (0,5 g/kg/den). Smyslem léčby je kompetice o vazbu na Fc‑receptor makrofágu s protilátkami třídy IgG [5]. V tab. 4 jsou uvedeny výsledky randomizované studie z našeho pracoviště, ve které bylo 8 nemocných s hemolýzou těžkého stupně léčeno kombinací vysokých dávek kortikosteroidů (Solu-Medrol 15 mg/kg/den) s cyklofosfamidem (2 mg/kg/den), 8 nemocným byl k této kombinaci přidán i.v. imunoglobulin v dávce 0,5 g/kg/den, průměrná délka podávání i.v. imunoglobulinů byla 13 dní. Přidání i.v. imunoglobulinů ke kombinované imunosupresi vedlo ke zkrácení doby potřebné ke snížení dávky kortikoidů na 0,5 mg/kg/den, ke snížení počtu podaných transfuzí i počtu infekčních komplikací, došlo i ke zkrácení doby nutné k dosažení stabilních hodnot Hb > 100 g/l. Nicméně, rozdíly byly pod hranicí statistické významnosti.
Tab. 4. Výsledky srovnávací studie podávání intravenózních imunoglobulinů spolu s vysokými dávkami kortikosteroidů a s cyklofosfamidem a vysokých dávek kortikosteroidů s cyklofosfamidem bez imunoglobulinů i.v. u nemocných s autoimunitní hemolytickou anémií těžkého stupně. 
Další postupy
Jinými léčebnými možnostmi je kombinace kortikosteroidů s jinými imunosupresivy (cyklosporin A, Azamun) či podání monoklonální protilátky proti CD20‑antigenu (rituximab) [1]. Na obr. 4 a 5 jsou uvedeny výsledky podání 4 injekcí této látky v dávce 375 mg/m2 v týdenních intervalech 2 našim nemocným s hemolýzou rezistentní na kombinovanou imunosupresi. Podání rituximabu mělo u obou nemocných prolongovaný účinek, oba jsou nezávislí na podávání transfuzí 10, resp. 26 měsíců, u obou nemocných byl pozorován postupný vzestup hodnot hemoglobinu a pokles počtu retikulocytů a bylo u nich možno postupně snižovat dávku imunosupresiv.
Graf 4 a 5. Efekt podání rituximabu v dávce 375 mg/m2 ve 4 dávkách v týdenních intervalech u 2 nemocných s recidivujícími atakami autoimunitní anémie se smíšenými chladovými a tepelnými protilátkami (graf 4) a s tepelnými protilátkami (graf 5). Jsou uvedeny hodnoty hemoglobinu, počty retikulocytů a dávky imunosupresiv – prednisonu a cyklofosfamidu. 
prim. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 14. 3. 2005
Přijato k otištění: 14. 3. 2005
Zdroje
1. Berentsen S, Ulvestad E, Gjortsen BT et al. Rituximab for primary cold agglutinin disease: a prospective study of 37 courses in therapy in 27 patients. Blood 2004; 103 : 2925-2938.
2. Berney T, Shibata T, Merino R et al. Murine autoimmune hemolytic anemia resulting from Fc gamma receptor-mediated erythrophagocytosis: protection by erythropoietin but by interleukin-3, and aggravation by granulocyte-macrophage colony-stimulating factor. Blood 1992; 79 : 2960-2964.
3. Mackay IR. Tolerance and autoimmunity. BMJ 2000; 321 : 93-96.
4. Ring GH, Lakkis FG. Breakdown of self-tolerance and the pathogenesis of autoimmunity. Semin Nephrol 1999; 19 : 25-33.
5. Samuelsson A, Towers TL, Ravetch JV. Anti-inflammatory activity of IVIG mediated through the inhibitory Fc receptor. Science 2001; 291 : 484-486.
6. Zilow G, Kirschfink M, Roelcke D. Red-cell destruction in cold agglutinin disease. Infusionther Transfusionsmed 1994; 21 : 410-415.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Trombocytopenické purpuryČlánek Trombocytózy a trombocytemieČlánek Anémie chronických chorobČlánek Trombofilní stavyČlánek Protidestičková léčbaČlánek Potransfuzní reakceČlánek HemovigilanceČlánek Z odborné literatury
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 7 a 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodní slovo k přednáškám z XXI. Vanýskova dne
- Ohlédnutí a perspektivy současné hematologie
- Primární antitrombotická prevence žilní trombózy ve vnitřním lékařství
- Antikoagulační léčba flebotrombóz v ambulantní praxi
- Invazivní kontrolovaná léčba hluboké žilní trombózy
- Sepsa a Československé fórum pre sepsu
- Fenotypová a genotypová analýza vrodenej hypofibrinogenémie a dysfibrinogenémie
- Antifosfolipidový syndrom – diagnostika a léčba
- Trombofilní stavy
- Protidestičková léčba
- Glykoproteiny destičkové membrány z hlediska jejich genetických změn
- Glykoprotein Ia/IIa destičkové membrány z hlediska jeho genetických změn
- Glykoprotein IIb/IIIa destičkové membrány z hlediska jeho genetických změn
- Trombocytopenické purpury
- Trombocytózy a trombocytemie
- Antitrombotická léčba v etiologii akutní posthemoragické anémie
- Anémie chronických chorob
- Autoimunitní hemolytické anémie
- Některé vzácnější formy hereditárních anémií vyskytující se v dospělé populaci v ČR - β-talasemie a nestabilní hemoglobinové varianty
- Zajištění spolehlivosti vyšetření krevních obrazů
- Hemoterapie a její bezpečnost
- Potransfuzní reakce
- Refrakterita k trombocytovým transfuzním přípravkům
- Hemovigilance
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Potransfuzní reakce
- Trombocytózy a trombocytemie
- Antifosfolipidový syndrom – diagnostika a léčba
- Protidestičková léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




