-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
Treatment of adult acute lymphoblastic leukemia according to GMALL 07/ 2003 study protocol in the Czech Republic – the first experience
Introduction:
We present two years’ experience in the treatment of adult acute lymphoblastic leukemia (ALL) according to the German GMALL 07/ 2003 study protocol at CELL (Czech leukemia study group – for life) hematological centers in the Czech Republic.Methods:
A total number of 37 patients were included in this analysis. We evaluated complete remission and molecular remission rate, incidence of relapse, patients’ status at the end of the follow‑up period, incidence of chemotherapy‑related adverse events and causes of death. A statistical analysis of risk factors affecting survival was carried out.Results:
Complete remission was achieved in 36 (97%) patients and molecular remission in 16 (62%) of 26 evaluable patients. Disease relapse occurred in 5 (14%) patients. At the end of the follow‑up period with a median of 261 days, 28 (76%) patients were alive in complete remission, one (3%) with relapsed disease and 8 (22%) dead. Treatment toxicity resulted in death in 5 cases, relapse or progression of ALL in 3 patients. Adverse events most often followed consolidation I, induction phase I, consolidation II and induction phase II. Infectious complications in the context of febrile neutropenia, GIT mucositis and side effects of PEG ‑ asparaginase were the most common adverse events observed. The toxicity of allogeneic transplantation was not unexpected, four (25%) patients died after transplantation. Two‑year progression‑free and overall survival were 66% and 70%, respectively. High risk ALL, age over 35 years, CNS infiltration, disease relapse and permanent minimal residual disease were identified as the major adverse prognostic risk factors. Practical experiences and possible pitfalls of the protocol are described in the discussion.Conclusion:
Our initial impression is promising. The treatment is feasible, the results very good and the toxicity acceptable. Patients at high risk should be headed to allogeneic transplantation, since the results of consolidation chemotherapy alone are very poor in this group. We believe that this study protocol could become a standard adult acute lymphoblastic leukemia treatment in the Czech Republic.Key words:
acute lymphoblastic leukemia – adults – chemotherapy – hematopoietic stem cell transplantation – adverse events – risk factors – GMALL 07/ 2003 trial
Autori: F. Folber 1; C. Šálek 2; M. Doubek 1; J. Soukupová Maaloufová 2; T. Valová 3; J. Trka 3; N. Gökbuget 4; J. Vydra 5; T. Kozák 5; J. M. Horáček 6; P. Žák 6; P. Cetkovský 2; D. Hoelzer 4; J. Mayer 1
Pôsobisko autorov: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2Klinický úsek Ústavu hematologie a krevní transfuze Praha, přednosta doc. MU Dr. Petr Cetkovský, Ph. D. 3Childhood leukaemia 1
Vyšlo v časopise: Vnitř Lék 2010; 56(3): 176-182
Kategória: Původní práce
Súhrn
Úvod:
V této analýze prezentujeme dvouleté zkušenosti s léčbou akutní lymfoblastické leukemie dospělých (ALL) dle protokolu německé studie GMALL 07/ 2003 na hematologických pracovištích skupiny CELL (Česká leukemická skupina – pro život).Metody:
Do analýzy bylo zařazeno celkem 37 pacientů. Hodnotili jsme dosažení kompletní a molekulární remise, výskyt relapsu a stav pacientů na konci sledovaného období. Byl sledován výskyt nežádoucích účinků po jednotlivých cyklech chemoterapie a příčiny úmrtí. Byla provedena statistická analýza rizikových faktorů ovlivňujících přežití pacientů.Výsledky:
Kompletní remise bylo dosaženo u 36 (97 %) pacientů, molekulární remise u 16 (62 %) z 26 vyšetřitelných pacientů. Relaps onemocnění byl pozorován u 5 (14 %) pacientů. Na konci období sledování s mediánem 261 dní bylo 28 (76 %) pacientů živých v kompletní remisi, jeden (3 %) s relabovaným onemocněním a 8 (22 %) zemřelo. Příčinou smrti byla v 5 případech toxicita léčby a u 3 pacientů relaps či progrese ALL. Nežádoucí účinky léčby následovaly nejčastěji po 1. konsolidaci, 1. fázi indukce, 2. konsolidaci a 2. fázi indukce. Šlo většinou o infekční komplikace v rámci febrilní neutropenie, mukositidu gastrointestinálního traktu a nežádoucí účinky PEG ‑ asparaginázy. Toxicita alogenní transplantace byla obvyklá, 4 (25 %) pacienti po transplantaci zemřeli. Dvouleté přežití bez progrese bylo 66 %, dvouleté celkové přežití 70 %. Jako prognosticky nepříznivé rizikové faktory byly identifikovány vysoké riziko, věk pacientů nad 35 let, infiltrace CNS, relaps onemocnění a přetrvávající pozitivita minimální zbytkové nemoci. V diskuzi dále popisujeme praktické zkušenosti a možná úskalí tohoto protokolu.Závěr:
Naše počáteční zkušenosti jsou pozitivní. Léčba je proveditelná, dosavadní výsledky velmi dobré a toxicita přijatelná. Pacienti s vysokým rizikem by měli být směřováni k alogenní transplantaci, jelikož výsledky samotné konsolidační chemoterapie jsou v této skupině velmi špatné. Myslíme si, že tento léčebný protokol by se mohl stát standardem léčby akutní lymfoblastické leukemie dospělých v České republice.Klíčová slova:
akutní lymfoblastická leukemie – dospělí – chemoterapie – transplantace krvetvorných buněk – nežádoucí účinky – rizikové faktory – studie GMALL 07/ 2003Za podpory CELL (Česká leukemická skupina – pro život, www.leukemia - cell.org)
Úvod
Výsledky léčby akutní lymfoblastické leukemie (ALL) dospělých jsou stále neuspokojivé. I přes vysoké procento dosažených kompletních remisí (CR) přesahující 80 % [1] a použití moderních léčebných protokolů [2] se dlouhodobé přežití pohybuje pouze okolo 40 % [3,4]. Tento nedostatek se snaží napravit intenzifikace postremisní léčby, částečně inspirovaná protokoly pro léčbu pediatrických pacientů [5,6]. Podstata ALL dospělých se však od dětí liší, mimo logicky vyššího věku pacientů s komorbiditami je provázena i častějším výskytem cytogenetických a molekulárně genetických změn, spojených s vyšším rizikem a horšími léčebnými výsledky [7].
V této analýze prezentujeme první zkušenosti s léčbou ALL dospělých na hematologických pracovištích v České republice, která v rámci České leukemické skupiny – pro život (CELL) aktivně spolupracují s Evropskou pracovní skupinou pro léčbu ALL (EWALL) a Německou pracovní skupinou pro léčbu ALL (GMALL).
Metody
Do této analýzy byli zařazeni všichni pacienti léčení dle protokolu GMALL 07/ 2003 na našich pracovištích v letech 2006 – 2008. Jedná se o mezinárodní multicentrickou studii fáze 4 s cí-lem zlepšení bezpříznakového a celkového přežití pacientů s ALL a sledování minimální zbytkové nemoci.
Po splnění vstupních kritérií (potvrzení diagnózy ALL, věk 18 – 65 let, podepsaný informovaný souhlas) je léčba zahájena prefází a první a druhou fází indukční chemoterapie. U pacientů se zjištěnou bcr/ abl pozitivitou je již od 1. dne přidán k chemoterapii imatinib v dávce 600 mg/ den [8]. V případě nálezu více než 20 % CD20+ blastů je k indukční a 1. konsolidační chemoterapii přidán rituximab. Společně s 2. fází indukce je provedeno profylaktické ozáření lebky. U všech pacientů následuje první konsolidační chemoterapie.
Do skupiny standardního rizika (SR)jsou zařazeni pacienti s B-ALL, kteří mají vstupně méně než 30 × 109/ l leukocytů a dosáhli CR do 26. dne indukční chemoterapie, a pacienti s thymocytární T-ALL. Jako vysoké riziko (HR) jsou klasifikováni pacienti s B-ALL, kteří mají vstupně více než 30 × 109/ l leukocytů nebo dosáhli CR po 26. dni indukční chemoterapie nebo mají pro B-ALL nebo pozitivitu MLL, a ostatní pacienti s T-ALL. Velmi vysoké riziko (VHR) pak značí bcr/ abl pozitivní ALL. U pacientů HR a VHR následuje po 1. konsolidaci alogenní transplantace krvetvorby. Pokud není dostupný dárce, pokračuje léčba druhou, intenzivní konsolidací a autologní transplantací, nebo dalšími konsolidacemi stejně jako v případě SR. Během celé indukční a konsolidační léčby probíhá intratékální profylaxe infiltrace centrálního nervového systému (CNS) [9] a monitorace minimální zbytkové nemoci (MRD). V případě přetrvávající pozitivity MRD před 1. konsolidační chemoterapií jsou pacienti standardního rizika přeřazeni do větve HR a směřováni k alogenní transplantaci.
Léčba je ukončena po transplantaci krvetvorby nebo při setrvalé negativitě MRD po 6. konsolidační chemoterapii. Průběh léčebného protokolu ilustruje obr. 1. Protokol na přání pracovní skupiny GMALL nepublikujeme v plném znění, pro zájemce je k dispozici u autorů práce.
Obr. 1. Léčebný protokol GMALL 07/2003. 
Vzorky k vyšetření MRD jsou dle písemné dohody s centrálou studie GMALL zpracovány v akreditované laboratoři Childhood leukaemia investigation Prague (CLIP) FN Motol Praha [10].
Hodnocení výsledků léčby zahrnovalo procento dosažených kompletních a molekulárních remisí, výskyt relapsů a stav pacientů na konci sledovaného období. Molekulární remise je definována jako pokles sledovaného molekulárně genetického markeru (přestavba IgH/ TCR nebo bcr/ abl) pod 10–4, tedy jako jeho přítomnost v méně než 1/ 10 000 z celkového počtu alespoň 5 milionů vyšetřených buněk periferní krve nebo kostní dřeně [10].
Dále jsme sledovali výskyt nežádoucích účinků po jednotlivých částech chemoterapie dle CTCAE NCI verze 3 (Common Terminology Criteria for Adverse Events, National Cancer Institute) a příčiny úmrtí. Byla též provedena statistická analýza vlivu rizikových faktorů na sledované parametry přežití dle Kaplan-Meiera v různých skupinách pacientů, a to jak na přežití bez progrese onemocnění (PFS; doba od data diagnózy do progrese, relapsu nebo úmrtí), tak na celkové přežití (OS; doba od data diagnózy do úmrtí z jakékoliv příčiny).
Výsledky
Od října roku 2006 do prosince roku 2008 bylo léčeno celkem 37 pacientů s průměrným věkem 39 let v době diagnózy. Do skupiny standardního rizika bylo zařazeno 17 (46 %) pacientů, 11 (30 %) do vysokého rizika a 9 (24 %) do skupiny s velmi vysokým rizikem. Postižení centrálního nervového systému bylo pomocí cytologie a imunofenotypizace diagnostikováno u 4 (11 %) pacientů. Extramedulární infiltrace byla zjištěna u 6 (16 %) pacientů (5krát mediastinální lymfadenopatie, 1krát infiltrace Waldayerova mízního okruhu). Vstupní charakteristika pacientů je uvedena v tab. 1.
Tab. 1. Vstupní charakteristika pacientů. 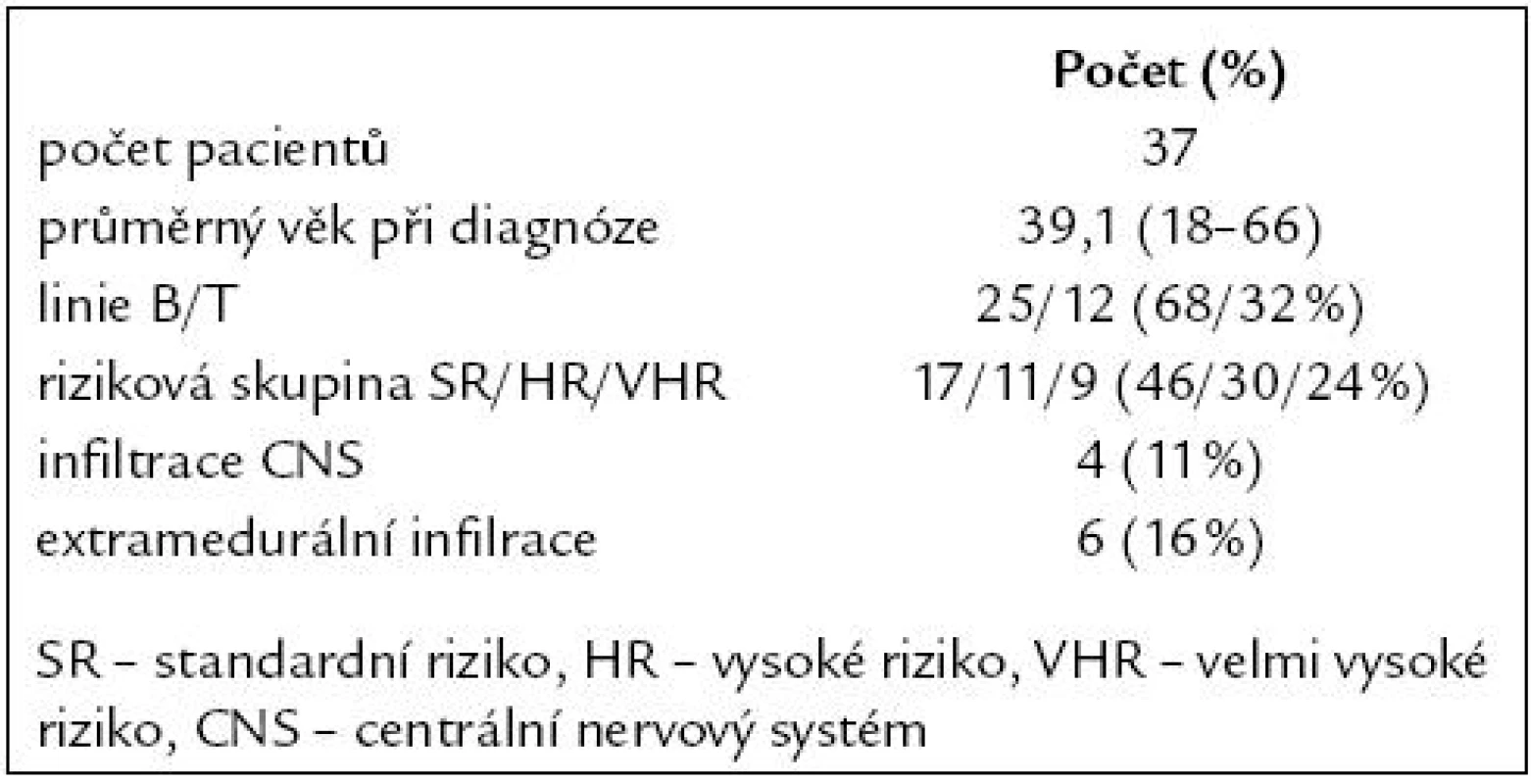
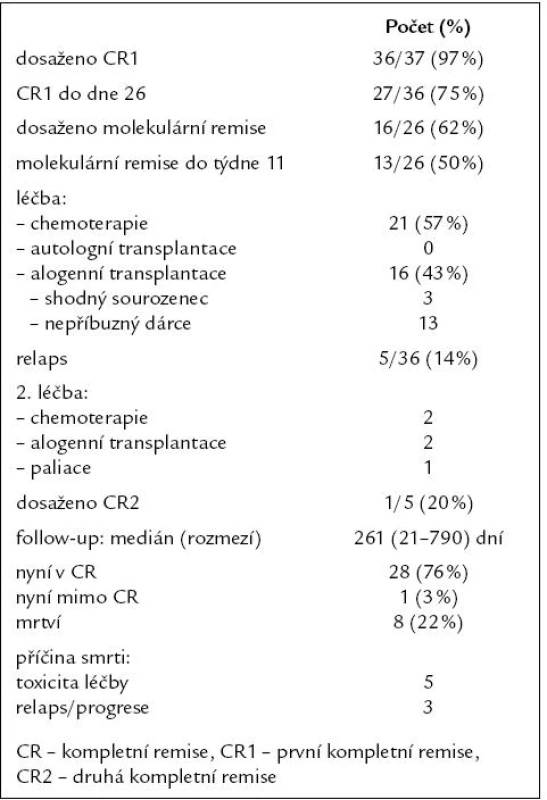
První kompletní remise (CR1) bylo dosaženo u 36 (97 %) pacientů, pouze ve 27 případech (75 %) však do 26. dne od zahájení indukční chemoterapie. Molekulární remise onemocnění bylo dosaženo u 16 (62 %) z 26 vyšetřitelných a sledovatelných pacientů, u 13 (50 %) k ní došlo do 11. týdne léčby. Postremisní léčba obsahovala u 21 (57 %) pacientů pouze konsolidační chemoterapii, autologně nebyl transplantován žádný pacient, alogenní transplantaci krvetvorby podstoupilo 16 (43 %) pacientů (dárcem byl 3krát shodný sourozenec a 13krát nepříbuzný dárce). Relaps onemocnění po dosažení CR1 byl pozorován u 5 (14 %) pacientů, pouze u 1 (20 %) z nich však bylo dosaženo 2. kompletní remise (CR2). Na konci období sledování s mediánem 261 dní bylo 28 (76 %) pacientů živých v kompletní remisi, 1 (3 %) mimo CR (relaps onemocnění na paliativní léčbě) a 8 (22 %) zemřelo. Příčinou smrti byla v 5 případech toxicita léčby a u 3 pacientů relaps či progrese ALL. Kompletní výsledky léčby jsou uvedeny v tab. 2.
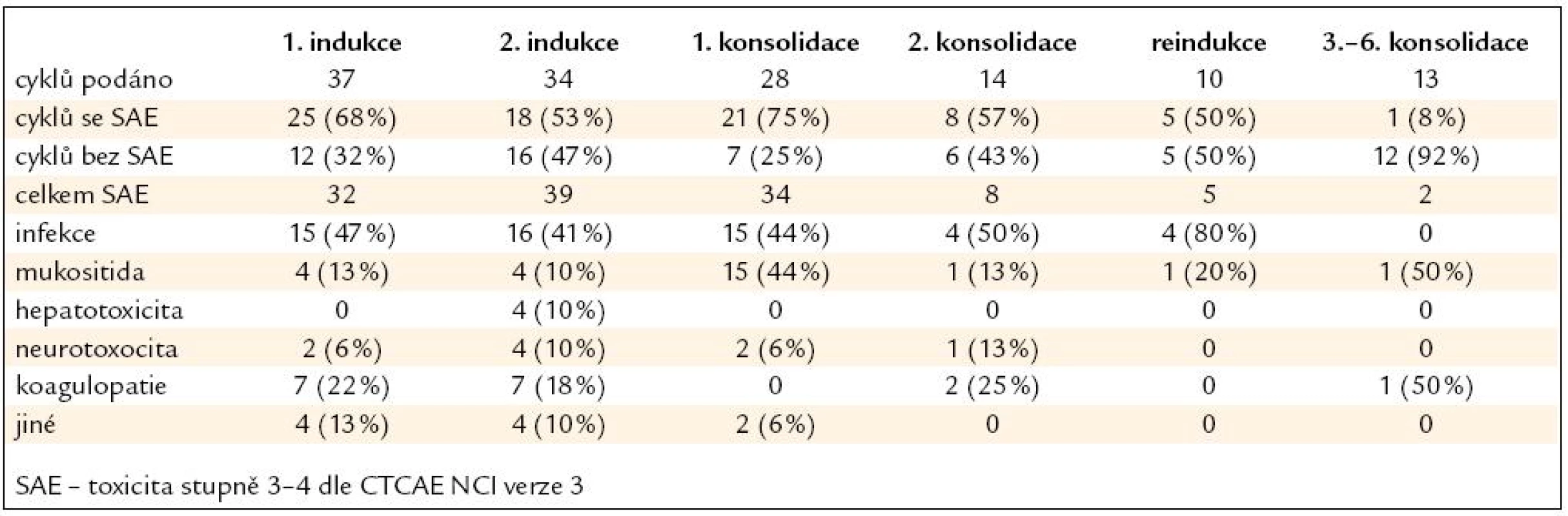
Nežádoucí účinky léčby následovaly nejčastěji po 1. konsolidaci (75 % podaných cyklů), 1. fázi indukce (68 % cyklů), 2. konsolidaci (57 % cyklů) a 2. fázi indukce (53 % cyklů). Šlo většinou o infekční komplikace v rámci febrilní neutropenie, mukositidu gastrointestinálního traktu (GIT) a nežádoucí účinky PEG-asparaginázy (hepatotoxicita, neurotoxicita, koagulopatie). Výskyt toxicity po jednotlivých součástech léčby je uveden v tab. 3 a na obr. 2 a 3. Toxicita alogenní transplantace byla obvyklá, svou kvalitou ani kvantitou nevybočovala z toxicity běžně pozorované na našich pracovištích. 4 (25 %) pacienti po alogenní transplantaci zemřeli, 3 z nich (75 %) v důsledku toxicity související s léčbou.
Obr. 2. Výskyt nežádoucích účinků léčby. 
Obr. 3. Typ nežádoucích účinků léčby. 
Dvouleté přežití bez progrese onemocnění (PFS) činilo v celém souboru 66 %, dvouleté celkové přežití (OS) pak 70 %. Medián přežití nebyl zatím v naprosté většině případů dosažen, po 12. měsíci sledování nebyly zatím zaznamenány žádné relapsy ani úmrtí. Jako statisticky významné prognosticky negativní faktory byly v našem souboru pacientů identifikovány: vysoké riziko (HR), věk pacientů nad 35 let a infiltrace CNS. Dále je patrný trend ke kratšímu přežití, pokud dojde k relapsu onemocnění anebo není dosaženo molekulární remise. Křivky přežití znázorňuje obr. 4.
Diskuze
Po zkušenostech s vlastními protokoly pro léčbu ALL [11 – 13] jsme se na našich pracovištích rozhodli, vzhledem k relativně malému počtu pacientů, použít léčebný protokol velké zahraniční pracovní skupiny s reprodukovatelnými a mezinárodně uznávanými výsledky [14].
Naše počáteční dvouleté zkušenosti jsou v zásadě pozitivní. Léčba je proveditelná a dobře tolerovaná, toxicita zvladatelná a očekávatelná; nejčastěji se jedná o infekční komplikace v rámci febrilní neutropenie, mukositidu GIT po metotrexátu a nežádoucí účinky PEG-asparaginázy. Přidání imatinibu k asparagináze nevedlo ke zvýšenému výskytu jejích nežádoucích účinků, čehož se některé zahraniční pracovní skupiny (PETHEMA, GRALL) obávají.
Léčebné výsledky a zkušenosti našich pracovišť jsou srovnatelné. U některých pacientů byl pozorován vyšší výskyt komplikací po PEG-asparagináze (Oncaspar, Medac), včetně těžké hepatotoxicity a neurotoxicity, mimo jinak běžné koagulopatie, snadno zvladatelné prostou substitucí koagulačních faktorů. Tuto potíž by mohlo vyjasnit plánované měření hladiny asparaginázy [15].
Zaznamenali jsme také problémy se separací periferních kmenových buněk, kdy často dochází k nedostatečnému nebo pozdnímu vyplavení buněk do periferní krve. V některých případech provádíme odběr kostní dřeně z lopat kostí kyčelních v celkové anestezii, jindy se pokoušíme o stimulaci, byť často neúspěšně. V současné době hledáme vhodný postup ke sběru kmenových buněk, abychom se mohli vyhnout odběru dřeňové krve.
Potvrdili jsme předpokládaný vliv známých rizikových faktorů (vyšší věk, riziko, infiltrace CNS, relaps a pozitivita MRD). Zarážející jsou velmi nepříznivé výsledky pacientů s vysokým rizikem (HR). Příčin je pravděpodobně více – již samotná podstata ALL vysokého rizika a z ní plynoucí nutnost intenzifikace konsolidační léčby pomocí transplantace krvetvorných buněk, která s sebou nese zásadní zvýšení morbidity i mortality. V porovnání s celým souborem měli pacienti vysokého rizika vyšší průměrný věk, dosáhli později kompletní remise a méně často molekulární remise a také častěji relabovali, rovněž sem byli zařazeni všichni pacienti, kteří měli při diagnóze zjištěnou infiltraci CNS. Tyto rozdíly překvapivě platí i při srovnání s pacienty velmi vysokého rizika (VHR), kde je však léčba dále intenzifikována v podobě imatinibu a alogenní transplantace provedené u všech pacientů. Pacienti s vysokým rizikem (HR) by tedy měli být léčeni intenzivně a pokud možno směřováni k alogenní transplantaci, jelikož výsledky samotné konsolidační chemoterapie jsou v této skupině velmi špatné [16].
Zásadním problémem, se kterým se setkáváme, je toxicita CNS v průběhu 2. indukčního cyklu, kdy 4 pacienti dospěli do komatózního stavu. Dva z nich byli starší 55 let, u 2 byla vstupně prokázána leukemická infiltrace CNS, stav 2 pacientů si vyžádal 4denní umělou plicní ventilaci. Všichni pacienti po odeznění komatu restituovali nervové funkce ad integrum. Ačkoliv podobné zkušenosti byly referovány z pediatrických pracovišť užívajících protokoly obdobného složení, zůstává příčina námi zaznamenané vysoké CNS toxicity neobjasněna. Toho času jsou uvedené případy konzultovány se studijní centrálou a prozatím byly časově posunuty profylaktické intratékální aplikace cytostatik na dobu po vyloučení potenciálně neurotoxických léčiv podávaných systémově.
K analýze MRD zatím nemáme dostatek dat a dlouhou dobu sledování. Tyto parametry budou hodnoceny jako jedny z hlavních cílů v kontextu celé studie GMALL [17].
Porovnání výsledků s našimi staršími protokoly a daty předchozí studie GMALL 05/ 93 je uvedeno v tab. 4. Stále se však naše ani zahraniční data nemohou srovnávat s úžasnými výsledky v léčbě ALL u dětí, což je jistě velkou výzvou do budoucna.
Tab. 4. Srovnání s předchozími léčebnými protokoly. 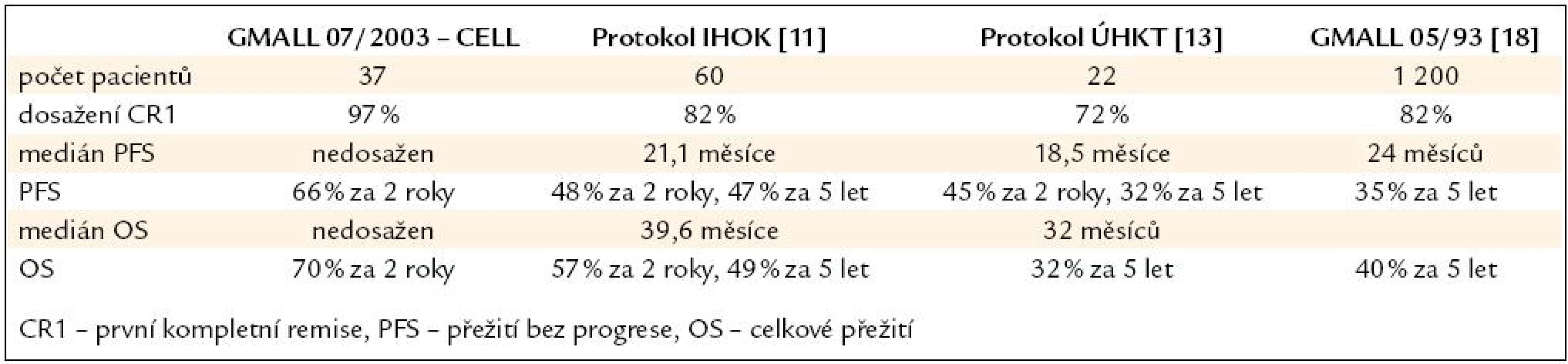
Závěr
Přestože jsme si vědomi krátké doby sledování do běžně dosahovaného mediánu přežití, dosavadní výsledky léčby jsou vynikající a toxicita přijatelná. Zařazování nových pacientů stále probíhá, sledování těch již léčených bude samozřejmě dále pokračovat. Podle našich prvních praktických zkušeností s tímto protokolem si myslíme, že by se mohl stát standardem léčby akutní lymfoblastické leukemie dospělých v České republice i Evropě.
Hematoonkologická centra, která mají zájem léčit pacienty dle této studie, mohou kontaktovat pracovní skupinu CELL.
MUDr. František Folber
www.fnbrno.cz/ihok
e-mail: ffolber@fnbrno.czDoručeno do redakce: 24. 4. 2009
Přijato po recenzi: 10. 12. 2009
Zdroje
1. Fielding AK, Rowe JM, Richards SM et al. Prospective outcome data on 267 unselected adult patients with Philadelphia ‑ chromosome positive acute lymphoblastic leukaemia confirms superiority of allogeneic transplant over chemotherapy in the pre‑imatinib era: Results from the international ALL trial MRC UKALLXII/ ECOG2993. Blood 2009; 113 : 4489 – 4496.
2. Rowe JM. Optimal management of adults with ALL. Br J Haematol 2009; 144 : 468 – 483.
3. Gökbuget N, Hoelzer D. Treatment of adult acute lymphoblastic leukemia. Semin Hematol 2009; 46 : 64 – 75.
4. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354 : 166 – 178.
5. Huguet F, Leguay T, Raffoux E et al. Pediatric ‑ inspired therapy in adults with Philadelphia chromosome ‑ negative acute lymphoblastic leukemia: the GRAALL ‑ 2003 study. J Clin Oncol 2009; 27 : 911 – 918.
6. Barry E, DeAngelo DJ, Neuberg D et al. Favorable outcome for adolescents with acute lymphoblastic leukemia treated on Dana ‑ Farber Cancer Institute Acute Lymphoblastic Leukemia Consortium Protocols. J Clin Oncol 2007; 25 : 813 – 819.
7. Hoelzer D, Thiel E, Löffler H et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. Blood 1988; 71 : 123 – 131.
8. De Labarthe A, Rousselot P, Huguet ‑ Rigal Fet al. Imatinib combined with induction or consolidation chemotherapy in patients with de novo Philadelphia chromosome ‑ positive acute lymphoblastic leukemia: results of the GRAAPH ‑ 2003 study. Blood 2007; 109 : 1408 – 1413.
9. Pui CH. Central nervous system disease in acute lymphoblastic leukemia: prophylaxis and treatment. Hematology Am Soc Hematol Educ Program 2006 : 142 – 146.
10. van der Velden VH, Cazzaniga G, Schrauder A et al. European Study Group on MRD detection in ALL (ESG ‑ MRD ‑ ALL). Analysis of minimal residual disease by Ig/ TCR gene rearrangements: guidelines for interpretation of real ‑ time quantitative PCR data. Leukemia 2007; 21 : 604 – 611.
11. Doubek M, Mayer J, Kořístek Z et al. Terapie akutní lymfoblastické leukemie dospělých kombinací sedmi chemoterapeutik v indukční léčbě, intenzivní konsolidací s autologní transplatací kmenových buněk krvetvorby nebo bez ní a s následnou udržovací léčbou: zkušenosti jednoho centra. Čas Lék Česk 2002; 141 : 122 – 126.
12. Doubek M, Folber F, Koristek Z et al. Autologous hematopoietic stem cell transplantation in adult acute lymphoblastic leukemia: still not out of fashion. Ann Hematol 2009; 88 : 881 – 887.
13. Linker C, Damon L, Ries C et al. Intensified and shortened cyclical chemotherapy for adult acute lymphoblastic leukemia. J Clin Oncol 2002; 20 : 2464 – 2471.
14. Gökbuget N, Hoelzer D, Arnold R et al. Treatment of Adult ALL according to protocols of the German Multicenter Study Group for Adult ALL (GMALL). Hematol Oncol Clin North Am 2000; 14 : 1307 – 1325.
15. Douer D. Is asparaginase a critical component in the treatment of acute lymphoblastic leukemia? Best Pract Res Clin Haematol 2008; 21 : 647 – 658.
16. Yanada M, Matsuo K, Suzuki T et al. Allogeneic hematopoietic stem Cell transplantation as part of postremission therapy improves survival for adult patients with high‑risk acute lymphoblastic leukemia. Cancer 2006; 106 : 2657 – 2663.
17. Gökbuget N, Raff R, Brügge ‑ Mann M et al. Risk/ MRD adapted GMALL trials in adult ALL. Ann Hematol 2004; 83 (Suppl 1): S129 – S131.
18. Gökbuget N, Hoelzer D. Treatment of adult acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program 2006 : 133 – 141.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Nealkoholová steatóza a steatohepatitida – editorial
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Prevalencia markerov poškodenia pečene u pacientov s metabolickými rizikovými faktormi
- Léčba AL‑ amyloidózy – výsledky jednoho pracoviště a přehled publikovaných zkušeností s novými léky (bortezomibem, thalidomidem a lenalidomidem) u AL‑ amyloidózy
- Kombinační léčba hypertenze v běžné klinické praxi. Výsledky studie KOHYBA
- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Myokardiální dysfunkce v sepsi – charakteristika a patogenetické mechanizmy
- Myokardiální dysfunkce v sepsi – diagnostika a terapie
- Kardiovaskulárne následky po transplantácii kmeňových krvotvorných buniek
- Více než 10 let trvající kompletní remise monoklonální gamapatie nejistého významu a vymizení nefrotického syndromu vzniklého na podkladně light chain deposition disease po léčbě vinkristinem, adriamycinem a vysokými dávkami dexametazonu (VAD)
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
-
9. kongres Spoločnosti balkánskych miest pre nefrológiu, dialýzu, transplantáciu a umelé orgány
(BANTAO), 18.– 22. novembra 2009, Antalya (Turecko) - V. jubilejný medicínsko‑literárny memoriál Franza Kafku, 18. septembra 2009, Tatranské Matliare a Tatranská Lomnica, Vysoké Tatry
- In memoriam – za docentem MUDr. Zdeňkem Churým, CSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Nealkoholová steatóza a steatohepatitida – editorial
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy