-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Incidentalom nadledviny
Adrenal incidentaloma
Incidentaloma is an adrenal mass discovered serendipitously. Because of increasing use of imaging techniques it is a common finding, being present in more than 1 % of adults. During work-up malignancy has to be ruled out. Classically imaging using CT or MRI is used. Recently PET-CT with FDG has been used more often as its sensitivity for diagnosis of malignancy is about 97 % and specificity 91 %. Hormonal evaluation should diagnose subclinical hypercortisolism. (Dexamethasone Suppression Test is the method of choice). Aldosterone and Renin should be measured only in patients with hypertension and catecholamines in tumours with higher native density than 10 HU. During follow-up repeated CT scan are needed only in selected patients and the need of routine biochemical follow-up has been questioned as well.
Key words:
adrenal adenoma – adrenal incidentaloma – hormonal tests – imaging – pheochromocytoma
Autori: Jan Čáp; Filip Gabalec
Pôsobisko autorov: IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, CSc.
Vyšlo v časopise: Vnitř Lék 2015; 61(10): 852-857
Kategória: Přehledné referáty
Súhrn
Jako incidentalom se označuje náhodně zjištěná expanze nadledviny. Vzhledem k rozvoji zobrazovacích technik se s ní setkáváme stále častěji. Její prevalence je totiž více než 1 % dospělých a roste s věkem. Při vyšetření je nutno vyloučit malignitu. K tomu slouží klasicky vyšetření CT, ev. MRI. Nověji se stále více uplatňuje PET-CT, která má senzitivitu asi 97 % a specificitu 91 %. Hormonální vyšetření má vyloučit i subklinickou nadprodukci kortizolu (optimální je dexametazonový supresní test). Aldosteron je nutno vyšetřovat jen u nemocných s hypertenzí a katecholaminy u nádorů s vyšší nativní denzitou než 10 HU. Při sledování je nutnost opakovaných CT vyhrazena jen pro vybrané případy a rutinní kontrolní laboratorní vyšetření jsou také zpochybněna.
Klíčová slova:
feochromocytom – hormonální vyšetření – incidentalom nadledviny – korový adenom – zobrazovací metodyÚvod
Jako incidentalom se označuje expanze objevená náhodně při vyšetření z jiné indikace než pro podezření na onemocnění nadledvin a u nemocných bez klinických známek poruchy nadledvinové funkce. Většinou (ale ne ve všech souborech) takto není označen nález expanze u pacientů vyšetřovaných v rámci zjištění rozsahu známé extraadrenální malignity.
Prevalence
Do roku 1974 bylo popsáno ve světové literatuře 174 případů afunkčních adenomů kůry nadledviny [1]. S rozvojem zobrazovacích metod, zejména ultrazvuku, CT a nejnověji magnetické rezonance a PET, začalo od počátku 80. let minulého století přibývat případů náhodně objevených expanzí nadledviny – incidentalomů – geometrickou řadou. Již v roce 1994 hovoří Griffing ve svém editorialu o epidemii AIDS – Adrenal Incidentalomas Discovered Serendipitously [2].
Prevalence tumorů nadledviny v pitevních studiích se pohybuje v rozmezí 1–8 % [3], v největších publikovaných sestavách byla 1,45 % z 9 000 pitev [4] a 1,92 % z 35 000 pitev [5]. Výskyt narůstá s věkem a je stejný u obou pohlaví. Na výpočetní tomografii (computed tomography – CT) je zjištěna expanze nadledviny v 0,35–4,36 % vyšetření z jiné indikace než podezření na onemocnění nadledvin [3]. Záleží samozřejmě na výběru souboru. Harrera et al zjistili expanzi nadledviny ve 3,38 % ze všech 61 054 vyšetření. Po vyloučení nemocných se známou extraadrenální malignitou nebo s klinickými známkami hyperfunkce nadledvin byla frekvence jen 0,42 % [6]. V novějším souboru z Royal Free London Hospital [7] byla prevalence více než 6,7 %, ale po vyloučení nemocných se známou malignitou 2,06 % a nových expanzí 0,95 %. Výskyt je poněkud častější u žen, což je vysvětlováno častějším rentgenovým vyšetřením a největší frekvence je v 6. decenniu. Vzhledem k lepšímu rozlišení a častější indikaci CT vyšetření může být dnes výskyt častější, ale recentní soubor z roku 2011 prokázal frekvenci 0,98 % u abdominálního CT a 0,81 % u CT hrudníku [8].
Příčina expanze nadledviny
Histologická klasifikace expanzí je uvedena v tab. 1.
Tab. 1. Histologická klasifikace operovaných případů expanze nadledviny. Upraveno podle [9] ![Histologická klasifikace operovaných případů expanze nadledviny. Upraveno podle [9]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/94f7ef4a048e20ae72ce49a47204cbf4.jpg)
Daleko nejčastější je benigní korový adenom. V sekčních souborech představuje téměř 100 %, v chirurgickém materiálu je vyšší zastoupení karcinomu jistě způsobeno výběrem nemocných k operaci.
Jako pseudoadrenální expanze jsou označovány afekce, které se peroperačně ukáží být tumorem ledviny, nádorem, zánětlivou expanzí nebo pseudocystou pankreatu, přídatnou slezinou, nádorem žaludku, nádorem nebo regeneračním uzlem jater, uzlinou či cévním útvarem.
Hormonální stav
Většina incidentalomů nadledvin nevykazuje žádnou hormonální aktivitu. Asi 10 % korových adenomů však jeví laboratorní známky autonomní sekrece kortizolu. Protože klinicky manifestní Cushingův syndrom z definice nepatří mezi incidentalomy, označuje se tento stav jako subklinický Cushingův syndrom. Je charakterizován zpětnovazebně sníženou hladinou adrenokortikotropního hormonu (adrenocorticotropic hormone – ACTH), chyběním suprese sérového nebo močového kortizolu dexametazonem a setřením diurnálního rytmu kortizolu. Do této kategorie patří i případy, u nichž je zjištěno zvýšené vylučování volného kortizolu močí za 24 hod, pokud u nich nejsou přítomny klinické příznaky Cushingova syndromu. Je též snížená odpověď ACTH a kortizolu na podání kortikoliberinu (hormon uvolňující kortikotropin/corticotropin-releasing hormone – CRH) a nízký dehydroepiandrosteron sulfát (DHEA-S) v séru [10]. Diagnostická kritéria uváděná v literatuře nejsou jednotná, většinou vyžadují přítomnost 2 z výše uvedených známek. Nejcitlivější se zdá být dexametazonový supresní test (DST) [11]. Klinický význam subklinického hyperkortizolizmu není zcela jasný. V poslední době se však množí zprávy, že je spojený s osteoporózou, obezitou, hypertenzí a inzulinovou rezistencí. Incidence osteoporotických fraktur, hypertenze, diabetu 2. typu, ale i cévních mozkových příhod progresivně roste se stupněm hypersekrece kortizolu [12]. Nejnověji se objevila nevelká sestava prokazující zlepšení hypertenze, kontroly diabetu a obezity po adrenalektomii [13]. Jiní naopak existenci této jednotky zpochybňují [14]. I subklinický hyperkortizolizmus vede k atrofii kontralaterální nadledviny a útlumu osy hypotalamus-hypofýza-nadledviny. Po operaci adenomu je proto nutno zajistit přechodně substituci hydrokortizonem.
Nadprodukce katecholaminů
Nemocní s klinickými příznaky feochromocytomu z definice nepatří mezi incidentalomy. Přesto v sestavách náhodně zjištěných expanzí nadledviny je feochromocytom zjištěn v 5–10 % případů (tab. 1). Polovina z těchto nemocných nemá hypertenzi [15]. I asymptomatický feochromocytom ovšem ohrožuje nemocného možnými až fatálními komplikacemi při podání některých léků při úvodu do anestezie, a je proto jasnou indikací k chirurgickému odstranění. Předoperační znalost diagnózy je důležitá pro anesteziologa a urologa, a proto je nutno feochromocytom vyloučit u každé zjištěné expanze nadledviny.
Nadprodukce mineralokortikoidů
Jakkoliv není vzácný primární hyperaldosteronizmus s normálními hladinami kalia, hypertenze je přítomna prakticky vždy [15].
Diagnostika malignity
Základní otázkou při rozhodování o dalším postupu po náhodném zjištění nadledvinové expanze je pravděpodobnost maligního nádoru – karcinomu kůry nadledviny nebo metastázy. Tradičním kritériem je velikost incidentalomu. Velikost tumoru je zejména důležitá pro rozpoznání karcinomu kůry nadledviny. Při velikosti < 4 cm je nebezpečí korového karcinomu 1,4–2 %, při velikosti > 6 cm je již okolo 25 % [15,16]. Tento vztah neplatí pro metastázy maligních nádorů. Kritérium velikosti není tedy absolutní ani pro karcinom kůry nadledviny a zcela selhává při rozpoznávání nádorů sekundárních [17].
Důležitým vodítkem je RTG charakteristika nádoru. Ta vychází z určení obsahu tuku. Benigní korové adenomy jsou většinou tukem bohaté a na CT hypodenzní. Homogenní tumory o denzitě < 10 Hounsfieldových jednotek (HU) jsou považovány za benigní adenomy (senzitivita byla určena na 71 % při zachování vysoké specificity – 98 %) [18]. Je však třeba si uvědomit, že denzita může kolísat při vyšetření na různých přístrojích až o 9 HU [19]. Pokud je obsah tuku nižší, a tedy denzita vyšší, je nutné provést dynamické skeny po podání kontrastní látky a zjistit denzitu na vrcholu sycení a za 10 nebo 15 min potom. Zatímco u adenomů dochází k rychlému vyplavení kontrastu, maligní léze zůstávají obarveny déle [20]. Počítáme absolutní a relativní vyplavení kontrastu:
Technika za 15 min má při použití hranice 60 % pro APW senzitivitu 86–88 % a specificitu 92–96 % pro diagnózu adenomu a při použití hranice 40 % pro RPW má senzitivitu 96 % a specificitu 100 % [21]. Často se používá pro úsporu času protokol s měřením vyplavení kontrastu za 10 min. S použitím hranice APW > 52 % a RPW > 38–40 % byly popsány podobné výsledky [22], ale Sangwaiya et al [23] zjistili horší senzitivitu. Na druhou stranu byl doporučen i protokol 5minutový [24].
Zobrazení magnetickou rezonancí (magnetic resonance imaging – MRI) využívá k posouzení benignity „chemického posunu“ (chemical shift MRI) a v podstatě hodnotí také obsah tuku. Využívá se toho, že protony vody mají opačnou polaritu než protony tuku. Při vyšetření v opačné fázi se potom intenzita signálu tuku výrazně sníží. Lze počítat různé indexy, ale hodnocení je prováděno v praxi vizuálně, v porovnání s poklesem intenzity svalu nebo sleziny. V současné době se zdá, že magnetická rezonance (a to i po použití kontrastní látky) neodliší korový adenom od jiných expanzí nadledviny s větší přesností než CT, výhodu je chybění radiační zátěže [20].
Tab. 2. Indikace k epinefrektomii. Upraveno podle závěrů konference NIH z roku 2002 [35] ![Indikace k epinefrektomii. Upraveno podle závěrů konference NIH z roku 2002 [35]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ef7db331fa52deed0653e2441d9a8502.jpg)
Scintigrafické zobrazení korových adenomů s použitím derivátů cholesterolu (nejčastěji 131I-6β-iodomethyl-19-norcholesterolu – NP-59) se již u nás nepoužívá. Hlavním přínosem scintigrafie metabolitem cholesterolu bylo potvrzení diagnózy (benigního) korového adenomu (který akumuluje více než druhá nadledvina) od jiné expanze, včetně karcinomu kůry nadledviny, při němž je akumulace na postižené straně nižší. K zobrazení feochromocytomu (a jiných tumorů dřeně) je možno použít metaiodobenzylguanidin (MIBG), označený jodem 131. Octreoscan má senzitivitu nižší.
Pozitronová emisní tomografie (PET) za použití 2-[fluorine-18]-fluoro-2-deoxy-D-gluózy (FDG) je velmi přínosná v odlišení benigní a maligní expanze nadledviny. V nedávné metaanalýze byla senzitivita pro diagnózu malignity 97 % a specificita 91 % [25]. Nezáleželo přitom na tom, zda bylo hodnocení prováděno vizuálně nebo byly počítány kvantitativní indexy vychytávání. Nižší specifita je dána tím, že některé adenomy jsou PET pozitivní. I když PET může být falešně negativní u nádorů nekrotických, malých, nebo u metastáz nádorů, které nejsou FDG avidní, podobně jako krátce po chemoterapii [26] není falešná negativita častější než 3 %, a to dává možnost postupovat konzervativně u pacientů, pro něž by operace představovala velkou zátěž.
K zobrazení feochromocytomů lze využít PET-CT s 18F značeným dihydroxyfenylalaninem nebo dopaminem.
Biopsie může být provedena tenkou jehlou jako aspirační cytologie nebo jde o biopsii silnou jehlou. Provádí se pod kontrolou CT nebo ultrasonografie (USG) a představuje určité riziko. Nejčastější komplikací je krvácení (2,6 % případů) a pneumotorax (0,7 %). Popsány byly také pankreatitida, hemotorax, hematurie a metastatický rozsev po punkci. Cytologie není schopna odlišit maligní a benigní lézi kůry nadledviny, a tak indikací je jen podezření na metastatický nádor.
Laboratorní markery jsou pro určení biologické povahy expanze nadledviny nespolehlivé, diskutován je jen význam DHEA-S pro odlišení adenomu a karcinomu kůry nadledviny. Značná část adenomů má hladinu DHEA-S sníženou, a to buď v důsledku suprimovaného ACTH při subklinickém hyperkortizolizmu, nebo pro sníženou aktivitu 17–20 lyázy. Korové karcinomy mívají hladinu DHEA-S zvýšenou. Nízká hladina DHEA-S tedy činí diagnózu korového karcinomu velmi nepravděpodobnou, i když takové případy byly rovněž popsány a nízká hladina samozřejmě nevylučuje metastázu do nadledviny [27].
Doporučená vyšetření
Vyšetření má zodpovědět 2 otázky:
- je možno vyloučit malignitu?
- není přítomna hormonální aktivita?
První otázka záleží na radiologických vyšetřeních a postup shrnuje schéma 1. U expanzí větších než 4 cm nebo s nedostatečně rychlým vyplavením kontrastu volíme většinou chirurgické řešení. Stále častěji bude používána ve sporných případech PET-CT. Výjimku tvoří angiomyelolipom, který bývá větší než 4 cm a je bezpečně odlišitelný na CT.
Schéma 1. Zobrazovací vyšetření u incidentalomu nadledviny 
HU – CT denzita v Hounsfieldových jednotkách APW – absolutní vyplavení kontrastu v % (Absolute Percent Washout) RPW – relativní vyplavení kontrastu v % (Relative Percent Washout) PET-CT – pozitronová emisní tomografie s CT vyšetřením Druhou otázku zodpoví laboratorní vyšetření. Subklinický Cushingův syndrom je nejednotně definován, nejpřínosnějším testem je zřejmě chybění suprese kortizolu po dexametazonu. Kromě standardní dávky (1 mg ve 23 hod před odběrem krve na stanovení kortizolemie v 8 hod ráno následujícího dne) doporučují někteří autoři vyšší dávku (3–8 mg) s poukazem na skutečnost, že běží o autonomní sekreci z nadledviny [11,28]. Protože dnes je u nás dostupný jen Fortecortin® 4 mg tbl., je možno použít 2 mg, tj. půl tablety. Liší se také hodnota kortizolemie, od níž je test považován za pozitivní. Klasická hranice 135 nmol/l (5 µg/dl) má vysokou senzitivitu, ale malou specificitu, a proto bývá doporučována hladina nižší, 100 nebo 50 nmol/l. Normální suprese vylučuje Cushingův syndrom, abnormální je indikací k dalšímu vyšetření. Cenné je u každého korového adenomu vyšetřit vylučování kortizolu močí, protože v případě subklinického Cushingova syndromu odráží nejlépe míru hypersekrece. Suprimovaná hladina ACTH (ev. abnormální CRH test) jsou známkou zpětnovazebné suprese na úrovni hypotalamu (a indikací k substituci hydrokortizonem po operaci).
Stanovení výdeje kyseliny vanilmandlové je pro diagnózu feochromocytomu nespolehlivé, senzitivita se pohybuje okolo 50 %, tedy 1/2 histologicky ověřených případů není diagnostikována [29,30]. Vyšetření výdeje metanefrinů, adrenalinu a noradrenalinu v moči za 24 hod vyžaduje sběr do kyseliny chlorovodíkové (pH nesmí přesáhnout 1,0) a je spolehlivější. V posledních letech se ukazuje, že daleko nejspolehlivějším vyšetřením je stanovení hladiny volného metanefrinu a zejména normetanefrinu v séru, které má senzitivitu prakticky 100 % [31]. Zdrojem falešně pozitivních výsledků může být chyba odběru (má být nalačno a po půlhodinovém klidu vleže), dieta (vyloučit se má káva i bezkofeinová) a léky (labetalol, sotalol, acetaminofen, metyldopa, antidepresiva včetně SSRI a tricyklických). Hladinu zvyšuje nikotin, kokain a amfetamin.
Feochromocytom má typické RTG charakteristiky, zejména nemá prakticky nikdy vysoký obsah tuku, a tak nemá denzitu < 10 HU [32], a proto někteří autoři považují biochemické testy k vyloučení nadprodukce katecholaminů při tomto RTG obrazu za zbytečné [33]. Jak ukazuje schéma 2, u nemocného s typickým korovým adenomem bez hypertenze stačí vyšetřit sekreci kortizolu, při hypertenzi také poměr aldosteron/renin a jen u expanzí > 10 HU katecholaminy.
Schéma 2. Hormonální vyšetření u incidentalomu nadledviny 
ACTH – hladina ACTH v séru DST – dexametazonový supresní test HU – CT denzita v Hounsfieldových jednotkách nefriny – plazmatický metanefrin a normetanefrin po půlhodině v klidu na lůžku poměr aldost/renin – poměr hladin aldosteronu a aktivního reninu ve stoje UFC – výdej volného kortizolu močí za 24 hod (Urinary Free Cortisol) Protože při primárním hyperaldosteronizmu je přítomna hypertenze prakticky vždy, je vyšetření poměru reninu a aldosteronu ve stoje, jako screening hyperaldosteronizmu, potřebné jen u nemocných s hypertenzí nebo hypokalemií. Tento poměr je samozřejmě ovlivněn jednak polohou (optimální je vyšetřovat po příchodu nemocného, kdy byl ve vzpřímené poloze). Poměr ovlivňují hypotenziva. Optimální je nemocného převést na verapamil a alfablokátor (které ovlivňují poměr nejméně), asi v 1/2 případů se to však nedaří, a tak se v praxi první test provádí beze změny medikace. Antagonisty aldosteronu (spironolakton a eplerenon) je ovšem nutné vysadit vždy [34].
Indikace k operaci
Jasnou indikací k epinefrektomii je i klinicky němý feochromocytom, primární hyperaldosteronizmus a manifestní Cushingův syndrom. Indikovaní jsou většinou nemocní s RTG podezřením na malignitu (alternativou je provedení biopsie) a tumory > 6 cm (s výjimkou tenkostěnných cyst a myelolipomu, jehož radiologické známky jsou tak charakteristické, že nevyžadují histologické ověření). Naopak expanze ≤ 4 cm, které splňují RTG charakteristiky korového adenomu a nejsou spojeny s endokrinní odchylkou, operaci nevyžadují. Mezi těmito dvěma póly je šedá zóna expanzí o velikosti 4–6 cm, nebo se známkami subklinické autonomní produkce kortizolu, u nichž je vhodné epinefrektomii uvážit, postupujeme však s ohledem na věk pacienta a jeho stav.
Dispenzarizace
Dispenzarizace pomocí CT (pokud není adenom zobrazitelný na USG vyšetření), doporučovaná v recentních guidelines, shrnuje tab. 3. Nedojde-li ke zvětšení expanze za 12 měsíců, je malignita prakticky vyloučena a význam dalšího RTG sledování není doložen [16]. Objevil se i názor, že radiační zátěž způsobená opakováním CT je nebezpečnější pro vznik dalšího nádoru než zanedbatelné riziko zjištění maligního nádoru v nadledvině [41]. I benigní adenomy a myelolipomy pomalu rostou. Jaké zvětšení by mělo být při kontrole považováno za znepokojivé, ukázala výjimečná studie Pantelone et al [42], kteří retrospektivně zpracovali 136 adrenalektomií nebo biopsií u 132 pacientů, kteří měli 2 zobrazovací studie provedené v odstupu více než 2 měsíců. Kritérium absolutního růstu o více než 0,8 cm mělo největší senzitivitu (72 %) a specificitu (81,1 %).
Tab. 3. Doporučené sledování na CT podle recentních guidelines 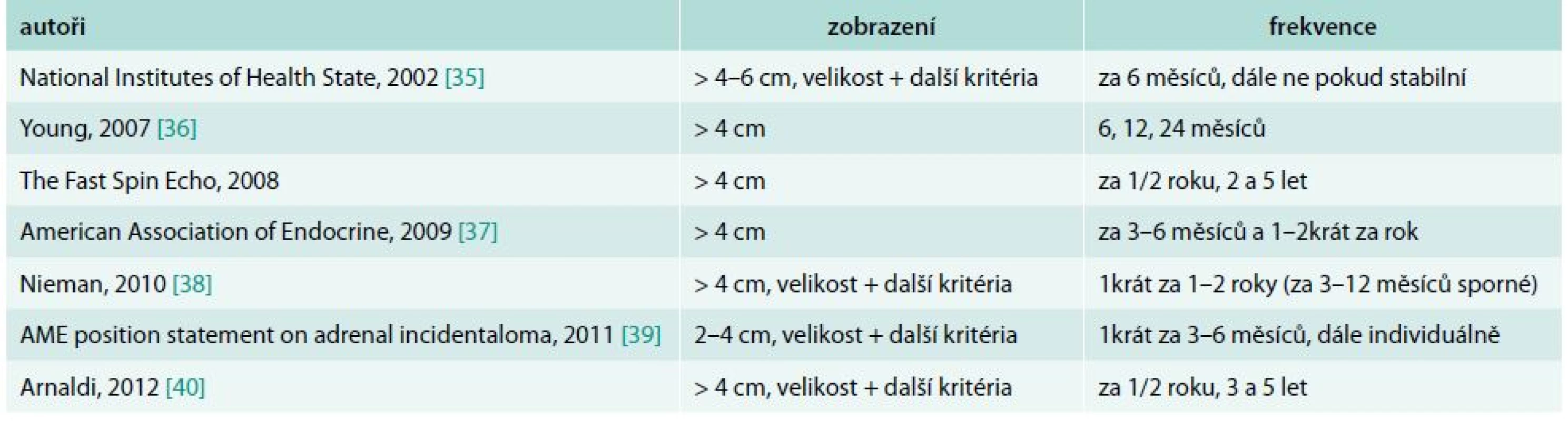
Doporučení pro hormonální kontroly uvádí tab. 4.
Tab. 4. Doporučená laboratorní sledování 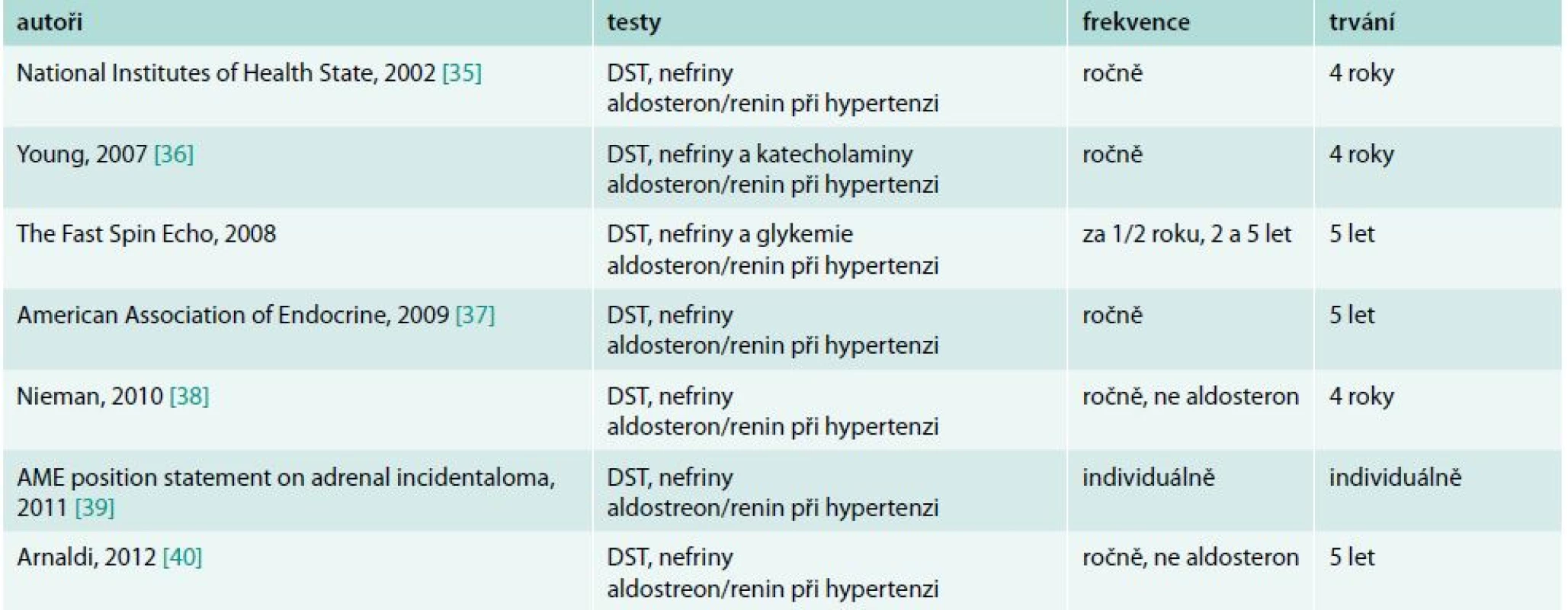
I nutnost pravidelných laboratorních kontrol po dobu 4–5 let byla zpochybněna jako ekonomicky neefektivní a její falešně pozitivní výsledky jsou častější než vznik hyperfunkce během sledování [41]. Zejména vznik feochromocytomu je zcela raritní. Komise italských endokrinologů proto doporučuje individuální postup [39]. Tomuto závěru nahrává nejnovější práce chorvatských autorů, v níž při sledování 174 nemocných po dobu delší než 2 roky nebyla změněna počáteční RTG charakteristika a zaznamenali jen klinicky nevýznamné změny v diagnostice subklinického hyperkortizolizmu, který se objevil v 6 a naopak vymizel ve 14 případech, což se zdá spíše odrážet variabilitu testů [43].
Předneseno na IV. postgraduálním kurzu v endokrinologii v Hradci Králové 15.–17. 5. 2014
Doručeno do redakce 17. 8. 2015
Přijato po recenzi 25. 9. 2015
prof. MUDr. Jan Čáp, CSc.
capj@lfhk.cuni.cz
IV. interní klinika LF UK a FN Hradec Králové
www.fnhk.cz
Zdroje
1. Lewinsky BS, Grigor KM, Symington T et al. The clinical and pathologic features of “non-hormonal” adrenocortical tumors. Report of twenty new cases and review of the literature. Cancer 1974; 33(3): 778–790.
2. Griffing GT. A-I-D-S: the new endocrine epidemic. J Clin Endocrinol Metab 1994; 79(6): 1530–1531.
3. Kloos RT, Gross MD, Francis IR et al. Incidentally discovered adrenal masses. Endocr Rev 1995; 16(4): 460–484.
4. Russi S, Blumenthal HT. Small adenomas of the adrenal cortex in hypertension and diabetes. Arch Intern Med 1945; 76 : 284–291.
5. Russell RP, Masi AT, Richter ED. Adrenal cortical adenomas and hypertension. A clinical pathologic analysis of 690 cases with matched controls and a review of the literature. Medicine (Baltimore) 1972; 51(3): 211–225.
6. Herrera MF, Grant CS, van Heerden JA et al. Incidentally discovered adrenal tumors: an institutional perspective. Surgery 1991; 110(6): 1014–1021.
7. Paterson F, Theodoraki A, Amajuoyi A et al. Radiology reporting of adrenal incidentalomas – who requires further testing? Clin Med 2014; 14(1): 16–21.
8. Davenport C, Liew A, Doherty B et al. The prevalence of adrenal incidentaloma in routine clinical practice. Endocrine 2011; 40(1): 80–83.
9. Annamalai AK, Gurnell M. Adrenal incidentaloma, What‘s new?, Practice points. Medicine 2013; 41(9): 532–535.
10. De Leo M, Cozzolino A, Colao A et al. Subclinical Cushing‘s syndrome. Best Pract Res Clin Endocrinol Metab 2012; 26(4): 497–505.
11. Reincke M. Subclinical Cushing‘s syndrome. Endocrinol Metab Clin North Am 2000; 29(1): 43–56.
12. Di Dalmazi G, Vicennati V, Rinaldi E et al. Progressively increased patterns of subclinical cortisol hypersecretion in adrenal incidentalomas differently predict major metabolic and cardiovascular outcomes: a large cross-sectional study. Eur J Endocrinol 2012; 166(4): 669–677.
13. Iacobone M, Citton M, Viel G et al. Adrenalectomy may improve cardiovascular and metabolic impairment and ameliorate quality of life in patients with adrenal incidentalomas and subclinical Cushing‘s syndrome. Surgery 2012; 152(6): 991–997.
14. Stewart PM. Is Subclinical Cushing’s Syndrome an Entity or a Statistical Fallout from Diagnostic Testing? Consensus Surrounding the Diagnosis Is Required before Optimal Treatment Can Be Defined. J Clin Endocrinol Metab 2010; 95(6): 2618–2620.
15. Mantero F, Terzolo M, Arnaldi G et al. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab 2000; 85(2): 637–644.
16. Lau J, Balk E, Rothberg M et al. Management of clinically inapparent adrenal mass. Evid Rep Technol Assess (Summ) 2002; (56): 1–5.
17. Mansmann G, Lau J, Balk E et al. The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev 2004; 25(2): 309–340.
18. Boland GW, Lee MJ, Gazelle GS et al. Characterization of adrenal masses using unenhanced CT: an analysis of the CT literature. AJR Am J Roentgenol 1998; 171(1): 201–204.
19. Hammarstedt L, Thilander-Klang A, Muth A et al. Adrenal lesions: variability in attenuation over time, between scanners, and between observers. Acta Radiol 2013; 54(7): 817–826.
20. McDermott S, O’Connor OJ, Cronin CG et al. Radiological evaluation of adrenal incidentalomas – Current methods and future prospects. Best Pract Res Clin Endocrinol Metab 2012; 26(1): 21–33.
21. Caoili EM, Korobkin M, Francis IR et al. Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology 2002; 222(3): 629–633.
22. Blake MA, Kalra MK, Sweeney AT et al. Distinguishing benign from malignant adrenal masses: multi-detector row CT protocol with 10-minute delay. Radiology 2006; 238(2): 578–585.
23. Sangwaiya MJ, Boland GW, Cronin CG et al. Incidental adrenal lesions: accuracy of characterization with contrast-enhanced washout multidetector CT – 10-minute delayed imaging protocol revisited in a large patient cohort. Radiology 2010; 256(2): 504–510.
24. Kamiyama T, Fukukura Y, Yoneyama T et al. Distinguishing adrenal adenomas from nonadenomas: combined use of diagnostic parameters of unenhanced and short 5-minute dynamic enhanced CT protocol. Radiology 2009; 250(2): 474–481.
25. Boland GW, Dwamena BA, Jagtiani Sangwaiya M et al. Characterization of adrenal masses by using FDG PET: a systematic review and meta-analysis of diagnostic test performance. Radiology 2011; 259(1): 117–126.
26. Kandathil A, Wong KK, Wale DJ et al. Metabolic and anatomic characteristics of benign and malignant adrenal masses on positron emission tomography/computed tomography: a review of literature. Endocrine 2015; 49(1): 6–26.
27. Bencsik Z, Szabolcs I, Kovacs Z et al. Low dehydroepiandrosterone sulfate (DHEA-S) level is not a good predictor of hormonal activity in nonselected patients with incidentally detected adrenal tumors. J Clin Endocrinol Metab 1996; 81(5): 1726–1729.
28. Tanabe A, Naruse M, Nishikawa T et al. Autonomy of cortisol secretion in clinically silent adrenal incidentaloma. Horm Metab Res 2001; 33(7): 444–450.
29. Eisenhofer G, Lenders JW, Linehan WM et al. Plasma normetanephrine and metanephrine for detecting pheochromocytoma in von Hippel-Lindau disease and multiple endocrine neoplasia type 2. N Engl J Med 1999; 340(24): 1872–1879.
30. Masumori N, Adachi H, Noda Y et al. Detection of adrenal and retroperitoneal masses in a general health examination system. Urology 1998; 52(4): 572–576.
31. van Berkel A, Lenders JW, Timmers HJ. Diagnosis of endocrine disease: Biochemical diagnosis of phaeochromocytoma and paraganglioma. Eur J Endocrinol 2014; 170(3): R109-R119.
32. Leung K, Stamm M, Raja A et al. Pheochromocytoma: The Range of Appearances on Ultrasound, CT, MRI, and Functional Imaging. AJR Am J Roentgenol 2013; 200(2): 370–378. Erratum in AJR Am J Roentgenol 2013; 200(3):705.
33. Sane T, Schalin-Jantti C, Raade M. Is biochemical screening for pheochromocytoma in adrenal incidentalomas expressing low unenhanced attenuation on computed tomography necessary? J Clin Endocrinol Metab 2012; 97(6): 2077–2083.
34. Fischer E, Beuschlein F, Bidlingmaier M et al. Commentary on the Endocrine Society Practice Guidelines: Consequences of adjustment of antihypertensive medication in screening of primary aldosteronism. Rev Endocr Metab Disord 2011; 12(1): 43–48.
35. NIH state-of-the-science statement on management of the clinically inapparent adrenal mass („incidentaloma“). NIH Consens State Sci Statements 2002; 19(2).
36. Young WF Jr. Clinical practice. The incidentally discovered adrenal mass. N Engl J Med 2007; 356(6): 601–610.
37. Zeiger MA, Thompson GB, Duh QY et al. American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons Medical Guidelines for the Management of Adrenal Incidentalomas: executive summary of recommendations. Endocr Pract 2009; 15(5): 450–453.
38. Nieman LK. Approach to the patient with an adrenal incidentaloma. J Clin Endocrinol Metab 2010; 95(9): 4106–4113.
39. Terzolo M, Stigliano A, Chiodini I et al. AME position statement on adrenal incidentaloma. Eur J Endocrinol 2011; 164(6): 851–870.
40. Arnaldi G, Boscaro M. Adrenal incidentaloma. Best Pract Res Clin Endocrinol Metab 2012; 26(4): 405–419.
41. Cawood TJ, Hunt PJ, O‘Shea D et al. Recommended evaluation of adrenal incidentalomas is costly, has high false-positive rates and confers a risk of fatal cancer that is similar to the risk of the adrenal lesion becoming malignant; time for a rethink? Eur J Endocrinol 2009; 161(4): 513–527.
42. Pantalone KM, Gopan T, Remer EM et al. Change in adrenal mass size as a predictor of a malignant tumor. Endocr Pract 2010; 16(4): 577–587.
43. Kastelan D, Kraljevic I, Dusek T et al. The clinical course of patients with adrenal incidentaloma: is it time to reconsider the current recommendations? Eur J Endocrinol 2015; 173(2): 275–282.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2015 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
-
Všetky články tohto čísla
- Významné životní jubileum prof. MUDr. Josefa Marka, DrSc.
- Náš pan profesor Marek
-
Úvodní slovo prof. MUDr. Michala Krška, CSc.,
editora tohoto vydání časopisu Vnitřní lékařství - Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




