-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prieskum „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“ so zameraním na srdcovú frekvenciu
“3P (Patient-Pulse-Prognosis) in heart failure” survey: focus on heart rate
Background:
The data on heart rate in chronic heart failure in the real-world practice in Slovakia are not sufficiently known. The objective of the “3P (Patient-Pulse-Prognosis) in heart failure” survey was to collect epidemiological data with particular emphasis on heart rate control in sinus rhythm.Methods:
The survey was performed by 162 cardiologists and internists. Outpatients or clinically stable hospitalized patients diagnosed with chronic heart failure were included in the survey. No exclusion criteria for patients enrollment were used. A total of 4738 patients were prospectively included.Results:
93.6% of patients with heart failure were taking beta-blockers. At least 50% of the target dose according to ESC had 48.1% of patients receiving beta-blockers. Heart rate ≥ 70 bpm was present in 55.3% of all patients and in 48.1% of patients with sinus rhythm. Out of the total unselected study population we identified 28.0% of patients with symptomatic heart failure (NYHA class II-IV), sinus rhythm, and suboptimal heart rate ≥ 70 bpm. The prevalence of heart rate ≥ 70 bpm was significantly higher in patients with beta-blocker dose < 50% of the target dose according to ESC compared with patients receiving ≥ 50% of the target dose (58.0% vs 52.4%, p < 0.001). Heart rate ≥ 70 bpm was significantly more common in patients with history of hospitalization for heart failure compared with patients who have not been hospitalized (56.8% vs 53.7%, p < 0.05). The physicians planned up-titration of the dose only in 20.2% of patients treated with beta-blockers.Conclusions:
Despite extensive beta-blockers therapy we found suboptimal heart rate control in chronic heart failure. Patients on lower doses of beta-blockers (< 50 % of the target dose according to ESC) and patients with history of hospitalization for heart failure were noted to be in significantly higher risk of unsatisfactory heart rate. The proportion of patients with intended up-titration of the beta-blocker dose was low. Therefore it is necessary to reduce heart rate by alternative or complementary pharmacotherapy.Key words:
beta-blockers – heart failure – heart rate – ivabradine
Autori: Juraj Dúbrava
Pôsobisko autorov: Oddelenie neinvazívnej kardiológie Nemocnice sv. Cyrila a Metoda, UN Bratislava, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2016; 62(1): 17-24
Kategória: Původní práce
Súhrn
Úvod:
Údaje o srdcovej frekvencii pri chronickom srdcovom zlyhávaní v reálnej praxi na Slovensku nie sú dostatočne známe. Cieľom prieskumu „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“ bolo získať epidemiologické dáta najmä so zameraním na kontrolu srdcovej frekvencie pri sínusovom rytme.Metodika:
Prieskum realizovalo spolu 162 kardiológov a internistov. Lekári konsekutívne zaraďovali ambulantných alebo klinicky stabilizovaných hospitalizovaných pacientov s diagnózou chronického srdcového zlyhávania. Neexistovali žiadne exklúzne kritériá pre zaradenie pacientov. Spolu bolo prospektívne zaradených 4 738 pacientov.Výsledky:
Betablokátory užívalo 93,6 % pacientov so srdcovým zlyhávaním. Aspoň 50 % cieľovej dávky podľa ESC malo 48,1 % pacientov liečených betablokátorom. Hodnoty srdcovej frekvencie ≥ 70/min malo 55,3 % všetkých pacientov a 48,1 % pacientov so sínusovým rytmom. Z celkového neselektovaného súboru sme identifikovali 28,0 % pacientov, ktorí boli symptomatickí (NYHA II–IV), mali sínusový rytmus a suboptimálnu srdcovú frekvenciu ≥ 70/min. Srdcová frekvencia ≥ 70/min bola významne častejšia u pacientov, ktorí mali dávku betablokátora < 50 % cieľovej dávky podľa ESC v porovnaní s pacientami s dávkou ≥ 50 % (58,0 % vs 52,4 %; p < 0,001). Podiel srdcovej frekvencie ≥ 70/min bol signifikantne vyšší u pacientov s anamnézou hospitalizácie pre srdcové zlyhávanie oproti dosiaľ nehospitalizovaným pacientom (56,8 % vs 53,7 %; p < 0,05). Up-titráciu dávky plánovali lekári len u 20,2 % pacientov liečených betablokátorom.Záver:
Napriek extenzívnej liečbe betablokátormi sme zistili suboptimálnu kontrolu srdcovej frekvencie pri chronickom srdcovom zlyhávaní. Významne rizikovejšou skupinou z hľadiska neuspokojivej srdcovej frekvencie boli pacienti s nižšou dávkou betablokátora (< 50 % cieľovej dávky podľa ESC) a pacienti s anamnézou hospitalizácie pre srdcové zlyhávanie. Podiel pacientov, u ktorých sa plánovala up-titrácia dávky betablokátora, bol nízky. Existuje preto potreba redukovať srdcovú frekvenciu alternatívnou, resp. komplementárnou farmakoterapiou.Kľúčové slová:
betablokátory – ivabradín – srdcová frekvencia – srdcové zlyhávanieÚvod
Zvýšená srdcová frekvencia (SF) pri sínusovom rytme je všeobecne akceptovaný nepriaznivý prognostický faktor pri srdcovom zlyhávaní s redukovanou ejekčnou frakciou ľavej komory (SZREF)[1–3]. Prognostický význam zvýšenej SF pri sínusovom rytme u pacientov so srdcovým zlyhávaním so zachovanou ejekčnou frakciou ľavej komory (SZZEF) je menej známy. Údaje z veľkých štúdií CHARM [2], I-PRESERVE [4], CHART-2 [5], DIG [6] poukazujú na signifikantne zvýšené morbimortalitné riziko aj u týchto pacientov.
Údaje o SF pri srdcovom zlyhávaní (SZ) v reálnej praxi na Slovensku nie sú dostatočne známe. Preto sme realizovali prieskum „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“. Cieľom bolo získať epidemiologické dáta o chronickom SZ najmä so zameraním na kontrolu SF pri sínusovom rytme. Prieskum nebol zameraný na žiadny špecifický liek.
Pacienti a metodika
Pacienti
Prieskum „3P v srdcovom zlyhávaní“ realizovalo 162 ambulantných a nemocničných kardiológov a internistov na Slovensku. Každý lekár mal prospektívne zaradiť 30 následných pacientov s diagnózou chronického SZ. Šlo o ambulantných pacientov alebo klinicky stabilizovaných hospitalizovaných pacientov. Diagnózu SZ stanovil lekár podľa anamnézy, fyzikálneho nálezu, RTG snímky hrudníka, echokardiografického nálezu a hladiny natriuretických peptidov (takmer výlučne NT-proBNP). Pacient mohol byť zaradený nezávisle od liečby. Neexistovali žiadne exklúzne kritériá pre zaradenie pacientov. Nábor pacientov sa realizoval v marci roku 2014.
Prieskum sa realizoval dotazníkovou formou. Lekári získavali jednorazovo nasledovné epidemiologické a klinické dáta:
- základné demografické údaje
- aktuálna funkčná trieda podľa NYHA
- etiológia srdcového zlyhávania (v prípade nejednoznačnej etiológie bolo možné uviesť 2 príčiny)
- aktuálny typ srdcového rytmu podľa EKG
- tlak krvi a srdcová frekvencia (stanovená podľa EKG)
- predchádzajúca hospitalizácia pre SZ podľa dokumentácie (áno/nie)
- terapia SZ (po ukončení vizity)
- u pacientov liečených betablokátorom % jeho dennej cieľovej dávky podľa Európskej kardiologickej spoločnosti (ESC) (< 50 %, resp. ≥ 50 %). Cieľová dávka bola nasledovná: bisoprolol 10 mg, karvedilol 50 mg, metoprolol sukcinát 200 mg, nebivolol 10 mg [7]
- plánovaná up-titrácia alebo iniciácia liečby betablokátorom (áno/nie)
V prieskume sa nezískavali iné údaje (vrátane EF ĽK – ejekčnej frakcie ľavej komory)
Štatistická analýza
Kategorické dáta sú vyjadrené percentuálnym zastúpením kategórií. Pri spojitých dátach sme hodnotili normálnosť rozdelenia. Vzhľadom na to, že žiadna kategória spojitých dát nemala normálne rozdelenie hodnôt, špecifikujeme ich mediánom a interkvartilovým rozpätím. Frekvenciu výskytu kategorických dát sme porovnali Pearsonovým χ2 testom nezávislosti. Ako hranicu štatistickej významnosti sme zvolili hodnotu p < 0,05. Štatistickú analýzu sme vykonali pomocou softwaru Excel v. 15.0 v MS Office 2013.
Výsledky
Charakteristika súboru pacientov so srdcovým zlyhávaním
Do prieskumu bolo zaradených 4 738 pacientov (priemer 29,2 pacientov/lekár). Základné charakteristiky súboru sú v tab. 1. Podiel mužov bol ľahko nadpolovičný.
Tab. 1. Základná charakteristika súboru 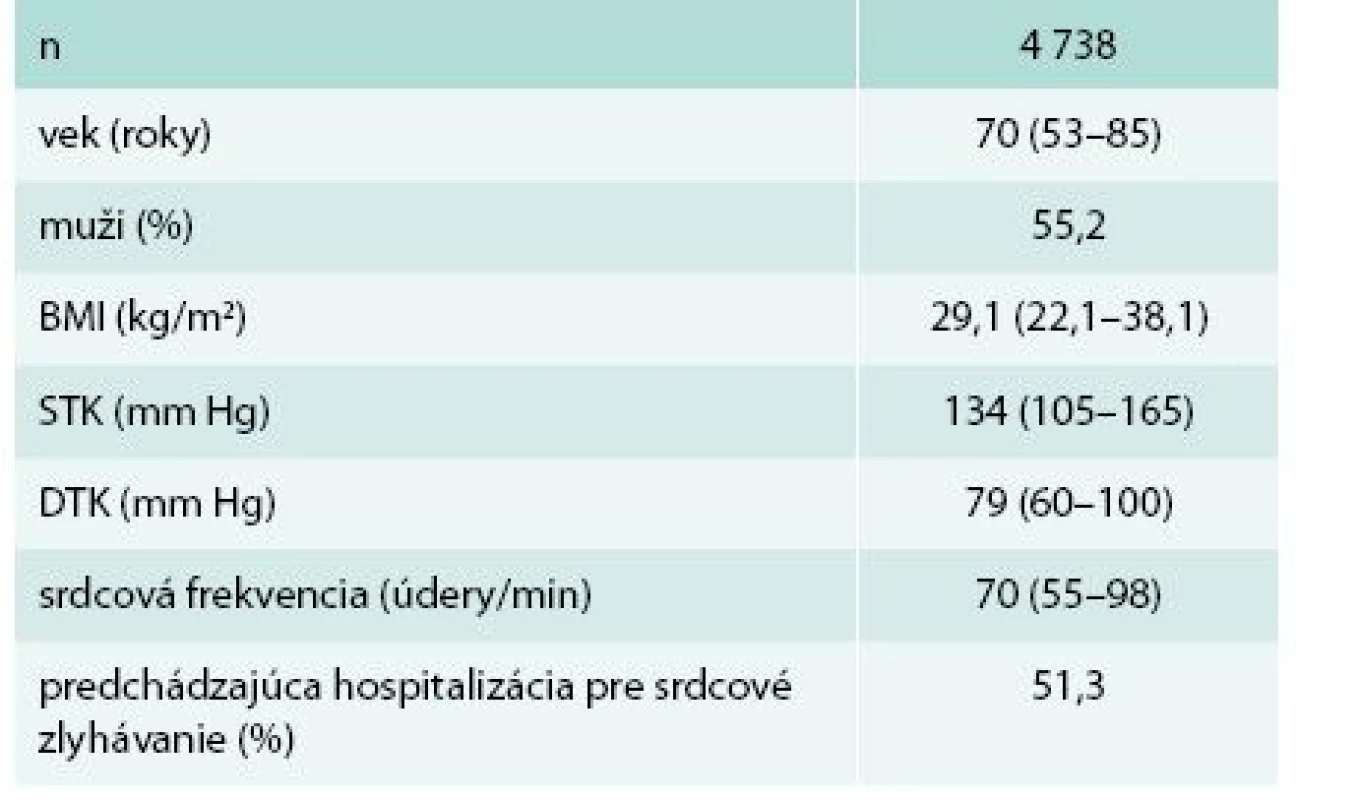
BMI – body mass index DTK – diastolický tlak krvi STK – systolický tlak krvi Medián tlaku krvi (TK) bol normotenzný. TK bol významne lepšie kontrolovaný u mužov ako u žien (kumulatívny podiel optimálneho, normálneho a vysokého normálneho TK 58 % vs 52 %; p < 0,001). Hypertenzné hodnoty TK malo 45 % pacientov. Z toho v pásme ľahkej hypertenzie (< 160/100 mm Hg) 33 %, v pásme stredne ťažkej hypertenzie (160–179/100–109 mm Hg) 10 % a v pásme ťažkej hypertenzie (≥ 180/110 mm Hg) 2 % pacientov.
Normálnu hmotnosť malo len 18,6 % pacientov. Dominovala nadhmotnosť (BMI – body mass index 25,0–29,9), prítomná u 44,0 % pacientov (40,8 % žien a 46,5 % mužov; p < 0,001). Obéznych bolo 37,0 % pacientov (38,9 % žien a 35,5 % mužov; p < 0,05). Z toho ľahko obéznych bolo 26,4 % (BMI 30,0–34,9), stredne obéznych 7,8 % (BMI 35,0–39,9) a ťažko obéznych 2,9 % (BMI ≥ 40,0).
Absolútna väčšina pacientov (90,4 %) bola vo funkčnej triede NYHA II alebo III. Podiel jednotlivých tried podľa NYHA bol takmer identický u mužov a žien: NYHA I – 6,2 % vs 5,3 %, NYHA II – 51,5 % vs 52,5 %, NYHA III – 38,0 % vs 39,0 %, NYHA IV – 4,3 % vs 3,3 %.
V tab. 2 je etiológia SZ podľa veku. Lekári považovali dominantne za príčinu SZ ischemickú chorobu srdca (66 % u mužov a 63 % u žien; p < 0,05). Za druhú najčastejšiu príčinu považovali artériovú hypertenziu (30 % vs 39 %; p < 0,001). Nasledovali dilatačná kardiomyopatia (16 % vs 8 %; p < 0,001) a chlopňové chyby (10 % vs 13 %; p < 0,001). Podiel ICHS zjavne plynulo stúpal s narastajúcim vekom, kým podiel dilatačnej kardiomyopatie plynulo vekom klesal. Podiel hypertenzie a chlopňových chýb sa vekom významne nemenil.
Tab. 2. Etiológia srdcového zlyhávania podľa veku (údaje sú uvedené v %) 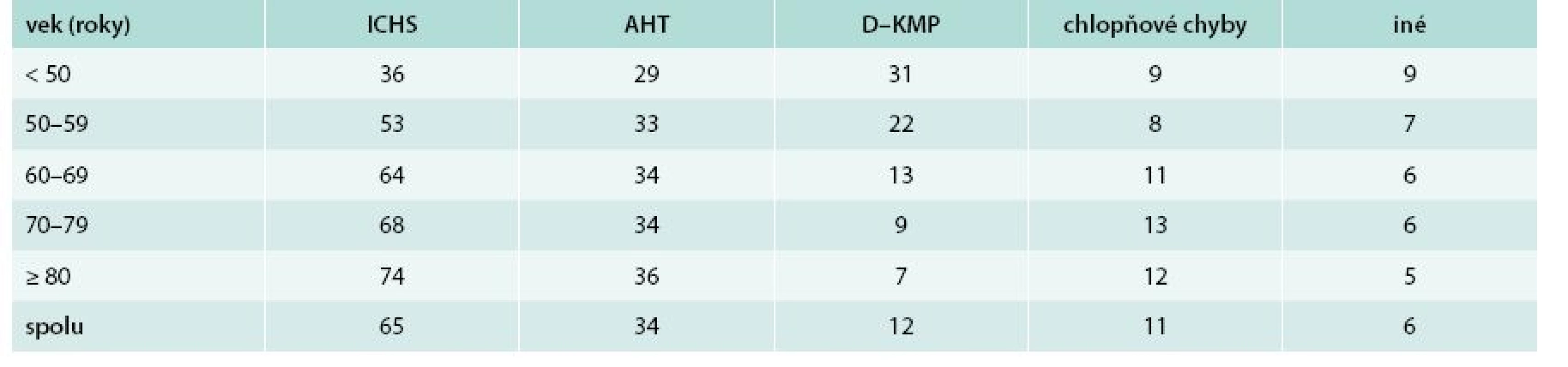
AHT – artériová hypertenzia D–KMP – dilatačná kardiomyopatia ICHS – ichemická choroba srdca Podiel sínusového rytmu bol identický u oboch pohlaví (65,2 %). U žien bol nesignifikantne vyšší podiel fibrilácie/flutteru predsiení ako u mužov (30,2 % vs 28,2 %). U mužov bol častejší rytmus kardiostimulátora (6,4 % vs 4,4 %; p < 0,01). Vekom plynulo klesal podiel pacientov so sínusovým rytmom a plynulo stúpal podiel pacientov s fibriláciou/flutterom predsiení (graf 1).
Graf 1. Typy srdcového rytmu podľa veku 
Polovica pacientov mala anamnézu hospitalizácie pre srdcové zlyhávanie (signifikantne viac muži ako ženy: 54,5 % vs 47,3 %; p < 0,001).
Liečba
V tab. 3 je uvedená liečba SZ. Najčastejšou medikáciou boli betablokátory s mimoriadne vysokým podielom 93,6 %. Aspoň 50 % cieľovej dávky podľa ESC malo len 48,1 % pacientov (49,3 % mužov a 46,6 % žien; nesignifikantný rozdiel). Lekári plánovali pro futuro up-titráciu dávky len u 20,2 % pacientov na liečbe betablokátorom, signifikantne častejšie u žien ako u mužov (21,7 % vs 19,1 %; p < 0,05). S tým kontrastuje fakt, že 55,3 % všetkých pacientov so SZ a 48,1 % pacientov so SZ a sínusovým rytmom malo frekvenciu ≥ 70/min.
Tab. 3. Liečba srdcového zlyhávania 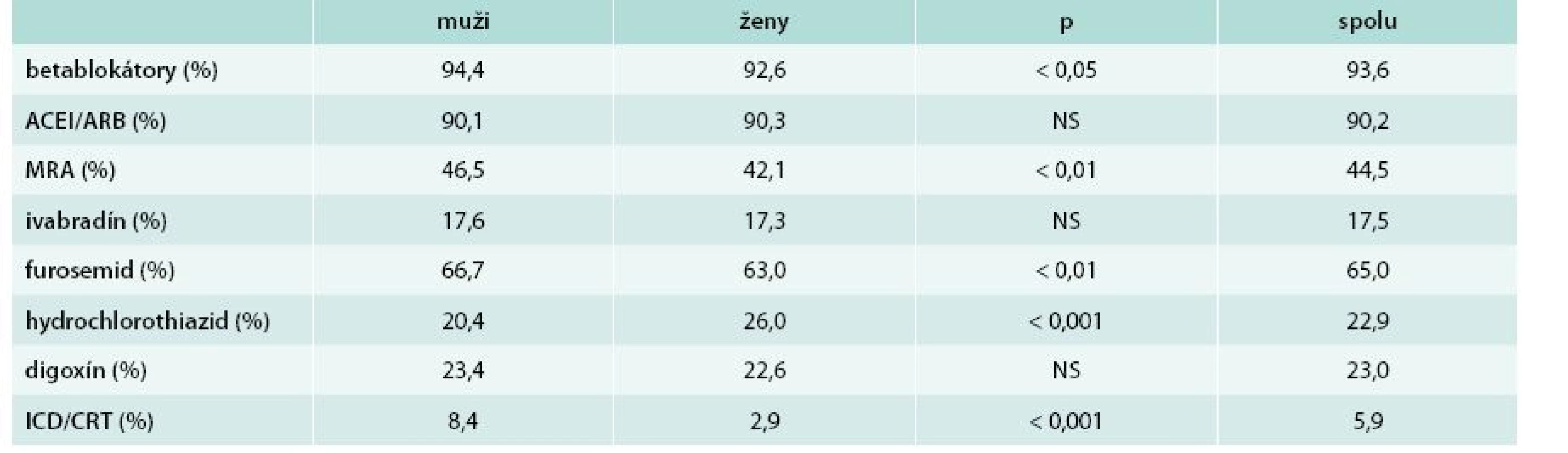
ACEI – antagonisti angiotenzín konvertujúceho enzýmu ARB – antagonisti AT1 receptora pre angiotenzín II MRA – antagonisty aldosterónu ICD – implantovateľný kardioverter–defibrilátor CRT – srdcová resynchronizačná liečba NS – nesignifikantný rozdiel Vysoký podiel liečby inhibítormi angiotenzín konvertujúceho enzýmu/sartanmi a antagonistami aldosterónu zodpovedal medzinárodným štandardom. Podiel pacientov liečených ivabradínom bol vysoký (cca každý 6. pacient). U 43 % lekárov bol však podiel pacientov so SZ, liečených ivabradínom, nižší ako 10 %. Podiel elektroimpulznej terapie (CRT, ICD) bol nízky.
Srdcová frekvencia
Medián SF 70/min bol rovnaký u oboch pohlaví. Sínusový rytmus malo 65,2 % pacientov. Graf 2 znázorňuje rozloženie hodnôt SF v celom súbore a v podsúbore pacientov so sínusovým rytmom (n = 3 091). Podiel pacientov so SF 50–69/min bol 44,1 %, resp. 51,2 %. Približne polovica pacientov mala suboptimálne hodnoty SF 70–99/min (51,0 %, resp. 46,0 %). Prevalencia tachykardie ≥ 100/min bola pomerne nízka a podiel pacientov s bradykardiou < 50/min bol zanedbateľný.
Graf 2. Srdcová frekvencia v celom súbore a u pacientov so sínusovým rytmom 
V celom súbore pacientov so SZ sme hodnotili vzťah SF a predchádzajúcej hospitalizácie pre SZ. Podiel pacientov so SF ≥ 70/min bol významne vyšší u pacientov, ktorí už boli hospitalizovaní pre SZ ako u pacientov, ktorí neboli hospitalizovaní pre SZ (56,8 % vs 53,7 %; p < 0,05).
Analogicky sme zistili, že podiel pacientov so SF ≥ 70/min bol signifikantne vyšší u pacientov liečených betablokátormi v dávke < 50 % cieľovej dávky oproti pacientom s dávkou betablokátora ≥ 50 % cieľovej dávky (58,0 % vs 52,4 %; p < 0,001). Graf 3 ukazuje distribúciu hodnôt SF podľa dávky betablokátora. Hodnoty SF v rozmedzí 50–69/min malo významne viac pacientov s vyššou ako nižšou dávkou betablokátora (≥ 50 % vs < 50 % cieľovej dávky) – 46,9 % vs 41,5 %; p < 0,001.
Graf 3. Srdcová frekvencia podľa dávky betablokátora 
Schéma znázorňuje postupnú identifikáciu subpopulácie pacientov so SZ, ktorí boli vo funkčnej triede NYHA II–IV, mali sínusový rytmus a srdcovú frekvenciu ≥ 70/min napriek štandardnej terapii. Zistili sme, že 28,0 % takto definovaných pacientov so SZ má suboptimálnu frekvenciu.
Schéma. Identifikácia subpopulácie pacientov so srdcovým zlyhávaním v triede NYHA II–IV, sínusovým rytmom a suboptimálne kontrolovanou srdcovou frekvenciou (SF) 
Diskusia
V prieskume „3P v srdcovom zlyhávaní“ sme zvolili neselektovanú populáciu pacientov so SZ bez ohľadu na EF ĽK z 2 dôvodov:
- prognóza je vysoko riziková pri oboch typoch SZ – SZREF aj SZZEF
- existujú dáta o negatívnom prognostickom vplyve zvýšenej SF pri sínusovom rytme u pacientov so SZREF, SZZEF ale aj v neselektovaných populáciách podľa EF ĽK
Vysoký stupeň rizika neselektovanej populácie pacientov so SZ bol dokumentovaný vo viacerých registroch pacientov, zaradených nezávisle od EF ĽK. Austrian Heart Failure register mal podobné charakteristiky ako náš súbor. Šlo o 1 904 pacientov. Z nich 72 % malo sínusový rytmus a 58 % malo SF ≥ 70/min. Nezávislým prediktorom celkovej mortality počas priemerného 12-mesačného sledovania bola SF ≥ 70/min a funkčná trieda NYHA III a IV [8]. V registri IMPACT-HF bola 60-dňová miera mortality alebo rehospitalizácie pre SZ až 31 % [9]. V americkom registri OPTIMIZE-HF sa významne nelíšila celková mortalita do 60 až 90 dní od hospitalizácie pre SZ u pacientov so SZZEF a SZREF (9,5 % vs 9,8 %) [10]. V neselektovanej populácii pacientov so SZ v nemocniciach v USA sa uvádza medián rehospitalizácie pre SZ do 30 dní až 24,6 % [11].
Prieskum „3P v srdcovom zlyhávaní“ sa venoval epidemiologickým dátam pri chronickom SZ. Prevalencia jednotlivých typov srdcového rytmu bola v našom súbore prakticky identická ako v nemeckom registri EVITA-HF (EVIdence based TreAtment in Heart Failure) u 1 853 pacientov so SZ a EF ĽK < 40 % – sínusový rytmus 65 % vs 64 %, fibrilácia/flutter predsiení 29 % vs 28 % [12]. Naproti tomu vo veľkom Swedish HF registry (n = 16 117) bol vyšší podiel fibrilácie/flutteru predsiení a nižší podiel sínusového rytmu – 38 % vs 58 % [13]. Prevalenčný rozdiel iste závisí od podielu pacientov so SZZEF. Je známe, že pri vyššej prevalencii SZZEF je aj vyšší relatívny podiel fibrilácie predsiení.
Liečbu základnými triedami farmák, ktoré významne zlepšujú prognózu SZ, sme porovnali s komparabilnými registrami, do ktorých boli zahrnutí pacienti bez ohľadu na EF ĽK. Šlo o IMPACT-HF Registry (USA, pacienti hospitalizovaní pre SZ; n = 567) [9], Norwegian HF Registry (ambulantní pacienti so SZ; n = 3 632) [14], Swedish HF Registry (neselektovaní pacienti so SZ; n = 16 117) [13], ESC Heart Failure Long-Term Registry (neselektovaní pacienti so SZ; n = 7 041) [15]. Z aspektu percentuálneho podielu boli naši pacienti liečení veľmi dobre, zväčša lepšie ako v uvedených registroch: betablokátory 94 % vs 62–89 %, inhibítory angiotenzín konvertujúceho enzýmu, resp. sartany 90 % vs 71–89 %, antagonisty mineralokortikoidných receptorov 45 % vs 59–87 %. Podiel pacientov liečených ivabradínom bol v našom súbore až prekvapivo vysoký – 18 %, čo bolo významne viac ako v nemeckom registri REFLECT-HF, hoci zahŕňal len pacientov s EF ĽK < 50 %. Nemeckí ambulantní kardiológovia použili ivabradín u 11 % pacientov a nemocniční kardiológovia len u 5 % pacientov [16].
Až 51 % našich pacientov malo v anamnéze hospitalizáciu pre SZ. V americkom registri OPTIMIZE-HF sa neodlišovala miera rehospitalizácií pre SZ do 90 dní u pacientov so SZZEF a SZREF (29,2 % vs 29,9 %) [10]. Počet hospitalizácií pre SZ je silný prediktor celkovej mortality. Setoguchi et al analyzovali súbor 14 374 kanadských pacientov po prvý raz hospitalizovaných pre SZ. Medián prežitia po prvej, druhej, tretej a štvrtej hospitalizácii pre SZ postupne významne klesal: 2,4 – 1,4 – 1,0 – 0,6 roka [17]. Štúdia SHIFT poskytla klinicky významný údaj, že ivabradín po pridaní k najlepšej možnej liečbe u pacientov so SZREF významne redukoval prvú aj druhú rehospitalizáciu pre SZ počas 23-mesačného mediánu sledovania o 34 %, resp. 29 % [18].
Kontrola srdcovej frekvencie
Základným cieľom prieskumu „3P v srdcovom zlyhávaní“ bolo posúdiť kontrolu SF u pacientov so SZ. Negatívny prognostický význam zvýšenej SF pri sínusovom rytme presvedčivo dokumentovali u pacientov so SZREF, resp. u pacientov so systolickou dysfunkciou ľavej komory najmä štúdie SHIFT [18] a BEAUTIFUL [1]. Menej známy je význam zvýšenej SF u pacientov so SZZEF a sínusovým rytmom, ktorý preto ilustrujeme podrobnejšie. Do štúdie I-PRESERVE bolo zahrnutých 3 967 pacientov so SZZEF (EF ĽK > 45 %). Z nich 82 % malo sínusový rytmus a 18 % fibriláciu predsiení. Zaujímavým zistením je fakt, že zvýšená SF bola nepriaznivým prediktorom len pri sínusovom rytme. Každý nárast SF o jednu smerodajnú odchýlku (12,4 úderov/min) znamenal u pacientov so sínusovým rytmom signifikantný nárast rizika kardiovaskulárnej mortality alebo hospitalizácie pre SZ o 13 %. Naproti tomu pri fibrilácii predsiení sa nezistil žiadny vzťah medzi SF a klinickými ukazovateľmi [4]. Aj v štúdii CHART-2 u pacientov so SZZEF (EF ĽK > 50 %) a sínusovým rytmom sa zistila významná asociácia zvýšenej vstupnej SF a celkovej mortality, kardiovaskulárnej mortality a mortality na SZ [5]. Kapoor et al analyzovali význam SF u 685 pacientov so SZZEF (EF ĽK > 50 %) a sínusovým rytmom. Celková ročná mortalita bola signifikantne nižšia u pacientov so SF < 60/min (10 %) oproti pacientom so SF 60–70/min (18 %), 71–90/min (20 %) a > 90/min (35 %). Tento záver sa potvrdil aj po adjustácii na demografické dáta a laboratórne hodnoty, s relatívnym rizikom celkovej mortality u vyššie uvedených podskupín oproti skupine so SF < 60/min 1,26, resp. 1,47, resp. 2,0 [19]. Castagno et al zistili v súbore 7 599 pacientov zo štúdie CHARM, že u pacientov so SR každý nárast SF o 10/min zvyšoval riziko úmrtia o 6 %. Pozitívna korelácia zvýšenej SF a celkovej mortality bola prítomná tak u pacientov so SZREF ako aj u pacientov so SZZEF. Nepriaznivý vplyv zvýšenej SF na celkovú mortalitu bol jednoznačný v podsúboroch s aj bez liečby betablokátorom. Je zaujímavé, že u pacientov s fibriláciou predsiení nemala SF prognostický význam [2].
Z uvedených dát vyplýva, že v praxi treba redukovať zvýšenú SF pri sínusovom rytme tak pri SZREF ako aj pri SZZEF. Pri fibrilácii predsiení nie je asociácia zvýšenej SF a nepriaznivej prognózy jednoznačne dokázaná ani pri SZREF ani pri SZZEF.
Hodnoty SF > 70/min malo až 55 % všetkých našich pacientov a 48 % pacientov so sínusovým rytmom. Výsledky však nie sú lepšie ani v iných registroch. V našom súbore boli dokonca lepšie ako v zemepisne blízkych krajinách. V nemeckej štúdii INTENSIFY pri chronickom systolickom SZ (n = 1 956) bola priemerná vstupná hodnota SF 85/min [20]. V neselektovanom registri Austrian Heart Failure (n = 1 904) malo 58 % pacientov SF > 70/min [8]. V nemeckom registri EVITA-HF u pacientov so SZREF (n = 1 853) bol medián SF 80/min [12]. V našom súbore mali významne vyššiu SF pacienti, ktorí už boli hospitalizovaní pre SZ a pacienti, ktorí mali dávku betablokátora < 50 % cieľovej dávky.
Dávky betablokátorov a zmena nazerania na kontrolu srdcovej frekvencie
Odporúčania ESC z roku 2012 pre liečbu SZ uvádzajú snahu o dosiahnutie cieľových dávok betablokátorov [7]. Reálna prax je však značne odlišná najmä pre ich intoleranciu. Skutočne dosiahnuté dávky betablokátorov sú podstatne nižšie ako cieľové. Napr. vo francúzskom registri IMPACT RECO dosiahlo cieľovú dávku betablokátorov len 18 % z 1 919 ambulantných pacientov so SZ a hodnotu SF > 70/min malo až 55 % pacientov [21]. V našom súbore až 52 % pacientov malo dávku betablokátora < 50 % odporúčanej cieľovej dávky. Takmer identický výsledok 54 % zistili Jensen et al [22].
McAlister et al vykonali metaanalýzu 23 štúdií zameraných na liečbu betablokátormi u pacientov so SZ. Systolickú dysfunkciu ĽK malo 95 % z 19 209 pacientov. Rozptyl priemerných hodnôt EF ĽK bol v jednotlivých štúdiách 17–36 %. Zistili, že každá redukcia SF o 5 úderov/min redukovala celkovú mortalitu o 18 %. Naproti tomu sa nezistil signifikantný vzťah medzi celkovou mortalitou a dávkou betablokátora [23]. Metaanalýza priniesla zásadnú zmenu nazerania na liečbu betablokátormi pri chronickom SZ – mortalitný benefit liečby betablokátormi signifikantne asociuje s rozsahom redukcie SF, ale nie s dávkou betablokátora [23].
Swedberg et al vykonali subanalýzu štúdie SHIFT u pacientov so systolickým SZ a sínusovým rytmom v závislosti od maximálne tolerovanej dávky betablokátora: žiadny betablokátor, < 25 %, 25–49 %, 50–99 % a 100 % cieľovej dávky betablokátora podľa ESC. Skúmali vplyv dávky betablokátora na primárny ukazovateľ, t.j. kardiovaskulárnu mortalitu + hospitalizácie pre SZ. Zistili len hranične významný trend magnitúdy efektu betablokátora vo vzťahu k jeho dávke. Podstatným zistením bol fakt, že klinický profit v štúdii SHIFT bol primárne daný mierou redukcie SF pomocou betablokátora a ivabradínu a nie samotnou dávkou betablokátora [24].
Pre prax je zásadný nasledujúci záver. Donedávna bola cieľom v liečbe chronického SZ maximálne tolerovaná dávka betablokátora, čím bližšia k cieľovej dávke podľa odporúčaní ESC, resp. podľa protokolov veľkých štúdií. Naproti tomu v súčasnosti nie je cieľom dávka betablokátora, ale účinok, hodnotený cieľovou SF. Optimálna hodnota SF u pacientov so SZ nebola dosiaľ v odporúčaniach mienkotvorných spoločností exaktne stanovená. V praxi sa u pacientov so SZREF a sínusovým rytmom snažíme najmä podľa výsledkov štúdií SHIFT a BEATIFUL, aby hodnota SF nepresahovala 70/min [25].
Treba zdôrazniť, že betablokátory sú základom farmakoterapie pri SZREF. Naproti tomu pri SZZEF neexistujú definitívne dáta o profite z liečby betablokátormi. Do amerického registra OPTIMIZE-HF boli zahrnutí pacienti hospitalizovaní pre SZ a vhodní na liečbu betablokátormi. U pacientov so systolickou dysfunkciou ĽK (n = 3 001) betablokátory signifikantne redukovali celkovú mortalitu počas ročného sledovania o 23 % a rehospitalizácie pre SZ o 11 %. Naproti tomu efekt betablokátorov pri SZZEF (n = 4 153) bol len diskrétny a nesignifikantný, s mierou redukcie 6 %, resp. 2 % [26]. Analogicky v štúdii I-PRESERVE u pacientov so SZZEF liečba betablokátormi neredukovala klinické riziko [4]. Aj v štúdii CHART-2 zlyhala liečba betablokátormi v redukcii mortality na SZ u pacientov so SZZEF na rozdiel od pacientov so SZREF [5].
Výhodný spôsob redukcie SF pri chronickom SZ ponúka u pacientov so sínusovým rytmom inhibícia If prúdu ivabradínom. Zo štúdie SHIFT je známe, že ivabradín významne zlepšuje prognózu u symptomatických pacientov so SZREF, sínusovým rytmom a SF ≥ 70/min, pretože významne redukoval kardiovaskulárnu mortalitu alebo hospitalizácie pre SZ o 18 %, samotné hospitalizácie pre SZ o 26 % a mortalitu na SZ o 26 % [27]. Najvyšší profit z liečby ivabradínom bol u pacientov so vstupnou SF ≥ 75/min, pretože u nich významne redukoval nielen mortalitu na SZ, ale aj celkovú mortalitu a kardiovaskulárnu mortalitu. Najväčšia redukcia rizika bola u tých pacientov, u ktorých po 28 dňoch liečby klesla SF pod 60/min alebo poklesla o vyše 10 úderov/min [28]. Klinická prax potvrdila výhodnosť kombinácie BB a ivabradínu pri SZREF.
Ivabradín významne zlepšuje prognózu nezávisle od závažnosti SZREF. Významne redukuje celkovú mortalitu, kardiovaskulárnu mortalitu, úmrtia na SZ a hospitalizácie pre SZ aj u najťažších pacientov so SZ, t.j. s EF ĽK ≤ 20 % alebo v triede NYHA IV [29]. Existujú dáta, že z liečby ivabradínom môžu profitovať aj pacienti so SZZEF. Krátkodobá liečba ivabradínom u nich zlepšuje záťažovú kapacitu [30]. Definitívna indikácia na liečbu ivabradínom pri SZZEF však t.č. neexistuje. Optimalizácia diastolického plniaceho času však dáva logický predpoklad pre plánovanie klinických štúdií s ivabradínom u týchto pacientov.
Vzniká otázka, aký je podiel pacientov so SZREF, u ktorých je vhodná špecifická inhibícia If prúdu ivabradínom. Cullington et al definovali vhodnosť na liečbu inklúznymi kritériami štúdie SHIFT, t.j. EF ĽK ≤ 35 % a sínusový rytmus so SF ≥ 70/min. Súbor tvorilo 2 211 pacientov s EF ĽK ≤ 50 %. Uvedené kritériá spĺňalo z nich 19,4 % [31]. V našom neselektovanom súbore 4 738 pacientov s chronickým SZ sme identifikovali 28 % pacientov, ktorí boli symptomatickí (NYHA II–IV), mali sínusový rytmus a suboptimálnu SF ≥ 70/min. U nich je potrebné individuálne optimalizovať dávku betablokátora alebo ivabradínu.
Limitácie
Limitáciou práce je fakt, že súbor nebol diferencovaný na podsúbory pacientov so srdcovým zlyhávaním a redukovanou, resp. zachovanou EF ĽK. V práci sa nezisťovali konkrétne limitácie liečby betablokátorom.
Záver
Napriek extenzívnej liečbe betablokátormi (94 % celého súboru) sme zistili vysoký podiel suboptimálnej SF pri chronickom SZ. Hodnoty SF ≥ 70/min malo 55,3 % všetkých pacientov a 48,1 % pacientov so sínusovým rytmom. Z neselektovaného súboru sme identifikovali 28 % pacientov, ktorí boli symptomatickí (NYHA II–IV), mali sínusový rytmus a neuspokojivú SF ≥ 70/min. Hodnoty SF ≥ 70/min boli významne častejšie u pacientov, ktorí mali dávku betablokátora < 50 % cieľovej dávky podľa ESC v porovnaní s pacientami s dávkou ≥ 50 % (58,0 % vs 52,4 %; p < 0,001). Podiel SF ≥ 70/min bol signifikantne vyšší u pacientov s anamnézou hospitalizácie pre SZ oproti dosiaľ nehospitalizovaným pacientom (56,8 % vs 53,7 %, p < 0,05). Up-titráciu dávky plánovali lekári len u 20,2 % pacientov liečených betablokátorom. Tento fakt poukazuje na potrebu kombinovanej bradykardizujúcej liečby.
Práca bola podporená edukačným grantom spoločnosti Servier Slovensko, spol. s r.o.
prim. MUDr. Juraj Dúbrava, PhD., FESC
dubrava@pe.unb.sk
Oddelenie neinvazívnej kardiológie Nemocnice sv. Cyrila a Metoda, UN Bratislava, Slovenská republika
www.unb.sk
Doručeno do redakce 5. 7. 2015
Přijato po recenzi 1. 10. 2015
Zdroje
1. Fox K, Ford I, Steg PG et al. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised controlled trial. Lancet 2008; 372(9641): 817–821.
2. Castagno D, Skali H, Takeuchi M et al. Association of heart rate and outcomes in a broad spectrum of patients with chronic heart failure: results from the CHARM (Candesartan in Heart Failure: Assessment of Reduction in Mortality and morbidity) program. J Am Coll Cardiol 2012; 59(20): 1785–1795.
3. Špinar J, Vítovec J, Špinarová L. Farmakoterapie chronického srdečního selhání po prvních 10 letech 21. století. Vnitř Lék 2011; 57(11): 959–965.
4. Böhm M, Perez AC, Jhund PS et al. Relationship between heart rate and mortality and morbidity in the irbesartan patients with heart failure and preserved systolic function trial (I-Preserve). Eur J Heart Fail 2014; 16(7): 778–787.
5. Takada T, Sakata Y, Miyata S et al. Impact of elevated heart rate on clinical outcomes in patients with heart failure with reduced and preserved ejection fraction: a report from the CHART-2 Study. Eur J Heart Fail 2014; 16(3): 309–316.
6. Maeder MT, Kaye DM. Differential impact of heart rate and blood pressure on outcome in patients with heart failure with reduced versus preserved left ventricular ejection fraction. Int J Cardiol 2012; 155(2): 249–256.
7. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33(14): 1787–1847.
8. Fruhwald FM, Ulmer H, Pacher R et al. Heart rate and functional impairment are predictors of outcome in heart failure patients in the real world. Data from the Austrian Heart Failure registry. Wien Klin Wochenschr 2011; 123(11–12): 378–383.
9. O’Connor CM, Stough WG, Gallup DS et al. Demographics, clinical characteristics, and outcomes of patients hospitalized for decompensated heart failure: observations from the IMPACT-HF registry. J Card Fail 2005; 11(3): 200–205.
10. Fonarow GC, Stough WG, Abraham WT et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure: a report from the OPTIMIZE-HF Registry. J Am Coll Cardiol 2007; 50(8): 768–777.
11. Kociol RD, Peterson ED, Hammill BG et al. National survey of hospital strategies to reduce heart failure readmissions: findings from the Get with the Guidelines-Heart Failure registry. Circ Heart Fail 2012; 5(6): 680–687.
12. von Scheidt W, Zugck C, Pauschinger M et al. Characteristics, management modalities and outcome in chronic systolic heart failure patients treated in tertiary care centers: results from the EVIdence based TreAtment in Heart Failure (EVITA-HF) registry. Clin Res Cardiol 2014; 103(13): 1006–1014.
13. Jonsson A, Edner M, Alehagen U et al. Heart failure registry: a valuable tool for improving the management of patients with heart failure. Eur J Heart Fail 2010; 12(1): 25–31.
14. Grundtvig M, Gullestad L, Hole T et al. Characteristics, implementation of evidence-based management and outcome in patients with chronic heart failure: results from the Norwegian heart failure registry. Eur J Cardiovasc Nurs 2011; 10(1): 44–49.
15. Maggioni AP, Anker SD, Dahlström U et al. Are hospitalized or ambulatory patients with heart failure treated in accordance with European Society of Cardiology guidelines? Evidence from 12,440 patients of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2013; 15(10): 1173–1184.
16. Tebbe U, Tschöpe C, Wirtz JH et al. Registry in Germany focusing on level-specific and evidence-based decision finding in the treatment of heart failure: REFLECT-HF. Clin Res Cardiol 2014; 103(8): 665–673.
17. Setoguchi S, Stevenson LW, Schneeweiss S. Repeated hospitalizations predict mortality in the community population with heart failure. Am Heart J 2007; 154(2): 260–266.
18. Borer JS, Böhm M, Ford I et al. Effect of ivabradine on recurrent hospitalization for worsening heart failure in patients with chronic systolic heart failure: the SHIFT Study. Eur Heart J 2012; 33(22): 2813–2820.
19. Kapoor JR, Heidenreich PA. Heart rate predicts mortality in patients with heart failure and preserved systolic function. J Card Fail. 2010; 16(10): 806–811.
20. Zugck C, Martinka P, Stöckl G. Ivabradine treatment in a chronic heart failure patient cohort: symptom reduction and improvement in quality of life in clinical practice. Adv Ther 2014; 31(9): 961–974.
21. de Groote P, Isnard R, Assyag P et al. Is the gap between guidelines and clinical practice in heart failure treatment being filled? Insights from the IMPACT RECO survey. Eur J Heart Fail 2007; 9(12): 1205–1211.
22. Jensen J, Hedin L, Widell C et al. Characteristics of heart failure in the elderly-a hospital cohort registry-based study. Int J Cardiol 2008; 125(12): 191–196.
23. McAlister FA, Wiebe N, Ezekowitz JA et al. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med 2009; 150(11): 784–794.
24. Swedberg K, Komajda M, Böhm M et al. Effects on outcomes of heart rate reduction by ivabradine in patients with congestive heart failure: is there an influence of beta-blocker dose? Findings from the SHIFT (Systolic Heart failure treatment with the I(f) inhibitor ivabradine Trial) study. J Am Coll Cardiol 2012; 59(22): 1938–1945.
25. Špinar J, Špinarová L, Vítovec J et al. Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání. Vnitř Lék 2014; 60(4): 366–374.
26. Hernandez AF, Hammill BG, O’Connor CM et al. Clinical effectiveness of beta-blockers in heart failure: findings from the OPTIMIZE-HF (Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure) Registry. J Am Coll Cardiol 2009; 53(2): 184–192.
27. Swedberg K, Komajda M, Böhm M et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010; 376(9744): 875–885.
28. Böhm M, Borer J, Ford I et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study. Clin Res Cardiol 2013; 102(1): 11–22.
29. Borer JS, Böhm M, Ford I et al. Efficacy and safety of ivabradine in patients with severe chronic systolic heart failure (from the SHIFT study). Am J Cardiol 2014; 113(3): 497–503.
30. Santos M, Leite-Moreira AF. Effect of ivabradine on heart failure with preserved ejection fraction. J Am Coll Cardiol 2014; 63(6): 608–609.
31. Cullington D, Goode KM, Cleland JG et al. Limited role for ivabradine in the treatment of chronic heart failure. Heart 2011; 97(23): 1961–1966.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prieskum „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“ so zameraním na srdcovú frekvenciu
- Změny v prognóze a v léčbě Waldenströmovy makroglobulinemie: přehled literatury a vlastní zkušenosti
- Genetické změny u Waldenströmovy makroglobulinemie
- Studie SPRINT. Randomizovaná studie porovnávající intenzivní kontrolu systolického tlaku s kontrolou standardní
- Raritná diagnostika infekčnej endokarditídy po transplantácii obličky
- Moudře a pomalu – editorial
- Vzácný případ mobilního aterosklerotického plátu ve femorální tepně s vysokým embolizačním potenciálem
- Nebezpečné okurky – Leyllův syndrom
- Toxická epidermální nekrolýza
- Toxická epidermální nekrolýza – editorial
- Korespondence ke článku
- EASD Postgraduate Course of Clinical Diabetes and its Complications, Prague 2015
- Poslední rozloučení s panem profesorem MUDr. Vratislavem Schreiberem, DrSc.
- Z odborné literatury
- Lyellův syndrom – editorial
- Význam vyšetrovania alanínaminotransferázy u darcov krvi pre redukciu rizika prenosu hepatitíd B a C hemoterapiou
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Toxická epidermální nekrolýza
- Změny v prognóze a v léčbě Waldenströmovy makroglobulinemie: přehled literatury a vlastní zkušenosti
- Význam vyšetrovania alanínaminotransferázy u darcov krvi pre redukciu rizika prenosu hepatitíd B a C hemoterapiou
- Genetické změny u Waldenströmovy makroglobulinemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



