-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dokáže rybí olej zlepšit hojení ran v chirurgii?
Can fish oil improve wound healing in surgery?
A surgical insult induces both local and systemic inflammatory responses which, if inappropriate, could impair wound healing. According to many studies ω-3 polyunsaturated fatty acids from fish oil improve the process of wound healing by their immunomodulatory effect. In contrast to current anti-inflammatory drugs, which could alter immune defence and impair the resolution of inflammation, ω-3 fatty acids have a simultaneous anti-inflammatory pro-resolution effect which is not immunosuppressive. Besides that they improve cicatrix quality. With regard to this effect they prevent excessive or prolonged inflammation and wound complications.
Key words:
anti-inflammatory agent – cicatrix – fish oil – macrophage – ω-3 fatty acid – resolution of inflammation – Toll-like receptor – wound healing
Autori: Jana Neuwirthová; Břetislav Gál; Pavla Urbánková; Pavel Smilek
Pôsobisko autorov: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně
Vyšlo v časopise: Vnitř Lék 2016; 62(5): 406-412
Kategória: Přehledné referáty
Súhrn
Chirurgický zákrok vyvolává jak lokální, tak i systémovou zánětlivou odezvu, která pokud je nepřiměřená, naruší hojení ran. Na základě dostupných studií bylo zjištěno, že ω-3 polynenasycené mastné kyseliny z rybího oleje zlepšují mechanizmus hojení tkání skrze svůj imunomodulační účinek. Na rozdíl od standardních protizánětlivých léků, které mohou narušit imunitní obranyschopnost proti infekcím i zpomalit vstřebání zánětu, ω-3 mastné kyseliny mají výhodu v protizánětlivém a resorpci zánětu podporujícím účinku bez nežádoucí imunosuprese. Vedle toho také zlepšují kvalitu jizvy. Díky tomu jsou slibné v prevenci protrahovaných zánětů a ranných komplikací.
Klíčová slova:
hojení ran – jizva – makrofág – ω-3 mastná kyselina – protizánětlivá látka – rybí olej – Toll-like receptor – vstřebání zánětuÚvod
Chirurgický zákrok vyvolává lokální i systémovou zánětlivou odpověď s cílem boje s infekcí a zahojení ran, což je fylogeneticky daná reakce všem savcům. V mnoha případech zánětlivých stavů však chybí dostatečná regulační protizánětlivá odpověď, což vede ke zvýšení morbidity a mortality. Je třeba si uvědomit, že se jedná nejen o komplikace, spojené s nadměrnou systémovou zánětlivou odpovědí, kam patří inzulinová rezistence, multiorgánové selhání a oslabení obranyschopnosti proti infekcím, ale i o lokální následky ve smyslu poruch hojení ran. Imunitní dysregulace prozánětlivým směrem tedy může významně negativně ovlivnit pooperační průběh.
Vedle toho je známo, že chronický zánět, který nemá tendenci k resorpci, je skrytým pojítkem různých civilizačních onemocnění, a velký vliv na něj mají lipidy a z nich vznikající specifické tkáňové mediátory [1]. Problém imunitní dysregulace s tendencí k prozánětlivému prostředí tak v obecném smyslu doprovází mnoho polymorbidních pacientů, diabetiky [2], ale třeba i jen případy obezity anebo podvýživy [3].
V současné době se často diskutuje o možnostech tzv. farmakonutrice, kdy jsme určitou přirozenou složkou stravy schopni léčebně zasáhnout do etiopatogeneze onemocnění [4]. Za účelem ovlivnění imunitního stavu a zlepšení pooperačního průběhu byla do chirurgických oborů zavedena tzv. imunonutrice, která je založena na směsi imunitně aktivních nutričních složek. Indikuje se zejména před rozsáhlými operacemi v oblasti gastrointestinální a v chirurgii karcinomů hlavy a krku. Důležitou její součástí jsou polynenasycené ω-3 mastné kyseliny (ω-3 MK) z rybího oleje.
Rybí olej je vedle toho využíván i v intenzivní medicíně u pacientů v kritickém stavu ve směsích parenterální výživy jak k imunomodulaci, tak k ochraně vnitřních orgánů. Poslední léta studií i klinické praxe potvrdila, že změna složení tuků má imunomodulační efekt [12,13,54] a přidání ω-3 MK do výživy pacientů tak může významně ovlivnit pooperační průběh. V tomto článku se proto zaměříme specificky na hojení ran ve vztahu k polynenasyceným mastným kyselinám a jejich mediátorům.
Jak známo, typická česká strava je chudá na ω-3 MK, které jsou prekurzory mediátorů zmírňujících prozánětlivé prostředí a startujících regenerační procesy, a naopak v ní převažují prozánětlivě působící MK, tedy ω-6 MK a nasycené MK s dlouhým řetězcem (tab.). Mezi biologicky účinné formy ω-3 MK patří EPA (kyselina eikosapentaenová) a DHA (kyselina dokosahexaenová), jejichž nejvýznamnějším zdrojem ve stravě je rybí tuk. Rostlinná forma ω-3 MK, tzv. ALA (kyselina α-linolenová), se vyskytuje ve vyšším množství např. ve lněném oleji, ale je potřeba si pro praxi uvědomit, že na biologicky účinné formy se přeměňuje v organizmu pouze v minimálním procentu, a nelze ji proto co do účinnosti srovnávat s EPA a DHA.
Tab. 1. Přehled základních ω-3 a ω-6 MK [56] ![Přehled základních ω-3 a ω-6 MK [56]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9eba87e326f88d77208e6227564a40b7.jpg)
Typický český člověk je tedy již před operací v určitém chronickém prozánětlivém stavu vzhledem k typu stravy, ale i např. k přítomnosti obezity a nejrůznějších komorbidit. Nasedající rozsáhlý chirurgický výkon je pak pro organizmus velkým stresovým a prozánětlivým inzultem, který, pokud je již primárně vytvořeno prozánětlivé prostředí a dyregulace imunitní reaktivity s neschopností tvorby dostatku protizánětlivých prekurozorů, může vést k mnoha komplikacím v pooperačním období. Současné protizánětlivé léky tento stav nejsou schopny efektivně vyřešit, neboť zabraňují fázi vstřebání zánětu a tvorbě kolagenu.
Bylo by tedy východiskem (na základě dostupných informací) zaměřit se na možnosti imunomodulace pomocí ω-3 MK, které prokázaly jak protizánětlivý, tak i proresorpční účinek současně? Další otázkou je, zdali budou současně užívané dávky ω-3 MK stačit k dosažení klinického efektu. A jak je to s protiinfekční imunitou? Jsou oprávněné obavy z oslabení obranyschopnosti, nebo studie s rybím olejem v praxi prokazují opak, tedy snížení incidence infekcí a nižší spotřebu antibiotik? Následující přehledový článek by měl odhalit nejen vlastní mechanizmy, kterými rybí olej zasahuje do pooperačního hojení, ale také se pokusit dát odpověď na některé kontroverzní otázky v této oblasti.
Chronické prozánětlivé prostředí jako příčina poruchy hojení ran
Jak známo, hojení ran má několik fází a do všech z nich mohou ω-3 MK příznivě zasáhnout. První fáze je charakterizována prozánětlivou reakcí a je následována fází rezoluce, jinými slovy fází vstřebání zánětu. Úspěšný průběh prvních dvou fází je poté podmínkou fáze třetí, tedy tvorby kvalitní a současně minimální jizvy, jejíž definitivní zrání probíhá mnoho měsíců. Vlastních příčin poruch hojení ran je v praxi mnoho, v tomto příspěvku se proto zaměříme pouze na vliv imunitního systému v souvislosti s polynenasycenými MK a jejich lipidovými mediátory.
Jak je známo, nadbytek lipidových mediátorů z ω-6 a naopak nedostatek ω-3 MK narušuje hojení ran ve všech jeho fázích. V 1. fázi vede vyšší poměr ω-6 vůči ω-3 MK k nadměrné prozánětlivé reakci. V 2. fázi pak tento stav může způsobit neschopnost organizmu „přepnout“ z fáze zánětu do fáze rezoluce, tedy neschopnost zajištění rychlého a účinného vstřebání zánětu. A v neposlední řadě ve fázi 3 bylo popsáno narušení tvorby fibrinu. Klinicky pak těmito mechanizmy dochází k nadměrnému otoku, bolestivosti, infekčním komplikacím, trombotizacím, nekrózám, rozpadům ran, prodlouženému hojení a patologickému jizvení.
Z výše uvedeného plyne, že podobně jako jsme tomu svědky u systémové zánětlivé reakce, je i v případě hojení ran nutná rovnováha mezi prozánětlivými a protizánětlivými mechanizmy. Jinými slovy jak nedostatečná, tak i nadměrná zánětlivá reakce je v organizmu ke škodě. Ztráta regulačních protizánětlivých schopností, které zajišťují mediátory z ω-3 MK, tak může vést na straně jedné k nadměrné systémové zánětlivé odezvě s poruchou funkce vnitřních orgánů, ale na straně druhé lze v tomto stavu najít i skryté pojítko s některými lokálními komplikacemi v pooperační péči.
Mechanizmy protizánětlivého a tkáně regenerujícího účinku ω-3 MK
Studie prokázaly, že ω-3 MK působí v organizmu mnoha způsoby od inkorporace do buněčných membrán se změnou jejich struktury a funkce, přes vazbu na receptory, až po ovlivnění exprese genů. DHA a EPA jsou i prekurzory specifických protizánětlivých a proresorpčních tkáňových mediátorů, tzv. resolvinů, protektinů a maresinů. Předpokládané jednotlivé molekulární mechanizmy, kterými ω-3 MK příznivě zasahují do hojení ran, budou spolu s proběhlými studiemi rozebrány níže.
Snížení reaktivity prozánětlivé signální cesty Toll-like receptorů
ω-3 MK po inkorporaci do buněčných membrán mění složení jejich mikrodomén, tzv. lipidových raftů. Snížení obsahu cholesterolu v nich vyvolá další změny s důležitou signální úlohou v zánětlivém procesu. Tímto způsobem ovlivňují tzv. Toll-like receptory (TLRs), které jsou fylogeneticky u všech savců na imunitních buňkách aktivovány bakteriálními lipopolysacharidy (LPS) a spouští prozánětlivý proces. TLRs aktivují NF-κB, což je transkripční faktor, vedoucí k expresi prozánětlivých cytokinů TNFα, IL1 a IL6. Ty pak vyvolávají lokální příznaky zánětu, jako je vazodilatace, chemotaxe imunitních buněk, zvýšená cévní propustnost, bolest, ale vedou i k systémové zánětlivé odpovědi a inzulinové rezistenci. Pro pochopení rozdílného vlivu jednotlivých tuků na zánětlivý proces je potřeba uvést fakt, že součástí bakteriálního lipopolysacharidu (LPS) jsou nasycené MK, a právě skrze ně probíhá vazba na TLRs. Z tohoto důvodu jsou některé tuky schopny aktivace imunitního systému. Bylo prokázáno, že zatímco bakteriální LPS a nasycené MK aktivují, ω-3 MK naopak inhibují homodimerizaci TLRs, čímž protichůdně ovlivňují zánětlivou kaskádu [5]. ω-3 MK tlumí nadměrnou prozánětlivou aktivaci a produkci TNFα makrofágy v reakci na infekci [6]. Jinými slovy, nasycené MK tím, že jsou fylogeneticky součástí bakteriálních LPS, jsou podobně jako LPS naším organizmem rozpoznávány a aktivují imunitní systém. Díky tomu většina saturovaných MK i bez infekčního agens, zejména pak kyselina laurová (C 12 : 0), ale i myristová (C 14 : 0), palmitová (C 16 : 0) a stearová (C 18 : 0), aktivují TLR2 a TLR4 na imunitních buňkách, skrze něž spouštějí prozánětlivou signální kaskádu. Na rozdíl od toho MK s krátkým řetězcem (C 2–5), ω-9 mononenasycené a ω-3 polynenasycené tento zánět aktivační efekt nemají. ω-3 MK jsou dokonce naopak schopny modulovat reaktivitu imunitního systému ve smyslu snížení reaktivity, tedy zabránit nadměrné aktivaci TLRs vlivem saturovaných tuků či mikrobiálních endotoxinů (obr) [7,8].
Obr. 1. Modulace reaktivity imunitního systému působením ω-3 MK. 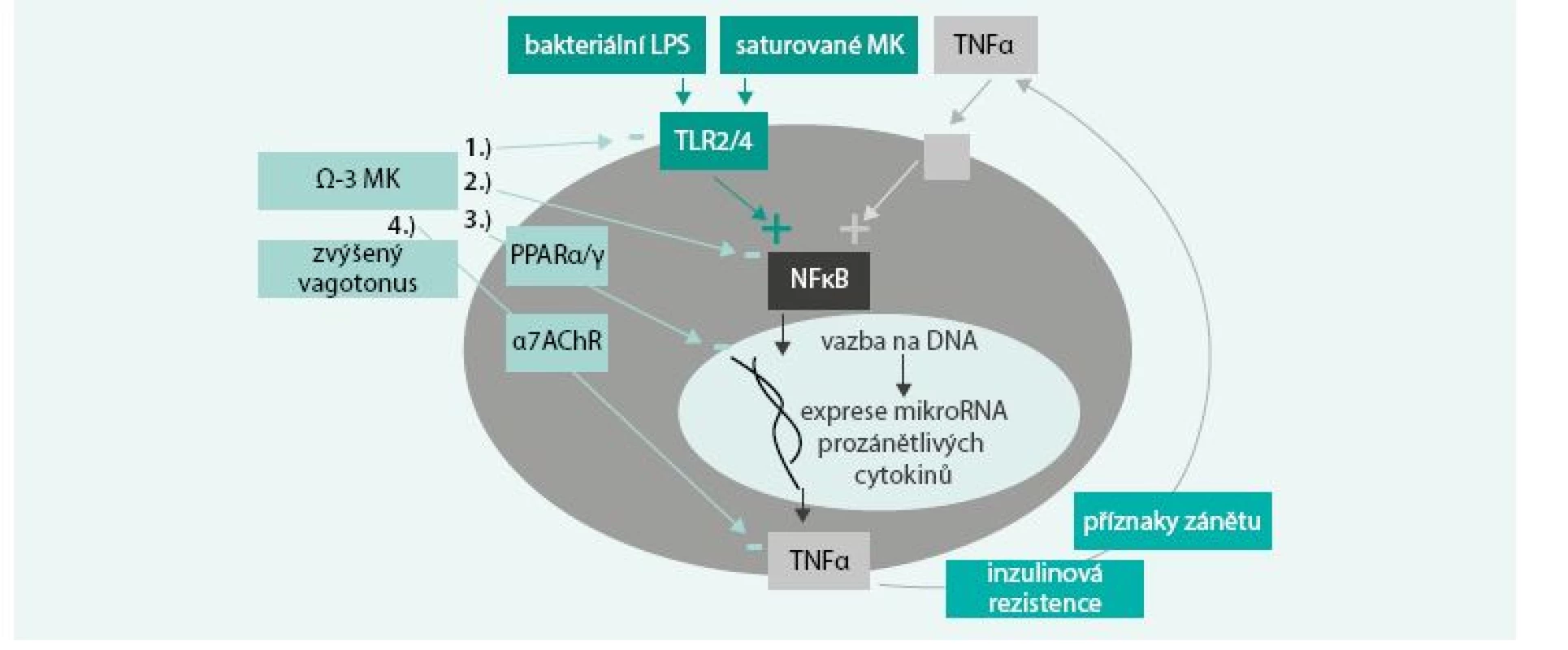
ω-3 MK představují ochranu před nadměrnou prozánětlivou aktivací a inzulinovou rezistencí, danou přítomností bakterií (příklad akutního prozánětlivého stavu – sepse) anebo nasycených MK (příklad chronického mírného prozánětlivého stavu – dietní faktory). Bakteriální LPS anebo i jen volné nasycené MK aktivují TLRs, což spouští prozánětlivou signální kaskádu skrze NF-κB s následkem exprese prozánětlivých cytokinů. EPA a DHA zasahují svým tlumícím vlivem do tohoto procesu hned na několika úrovních: ▪ ω-3 MK tlumí dimerizaci, a tím aktivaci TLRs ▪ ω-3 MK tlumí fosforylaci, a tím aktivaci NF-κB ▪ oxidované formy ω-3 MK jsou agonisty PPAR (receptoru aktivovaného peroxizomovými proliferátory), který zabraňuje vazbě NF-κB na DNA, a tím transkripci prozánětlivých cytokinů ▪ ω-3 MK zvyšují tonus vagu, což vede skrze aktivaci nikotinového acetylcholinového receptoru k posttranskripční redukci sekrece prozánětlivého TNFα v makrofázích Upraveno podle [57] Vazba na protizánětlivý receptor spojený s G proteinem
V nedávných letech bylo navíc zjištěno, že protizánětlivý efekt ω-3 MK je zprostředkován i vazbou na receptor spojený s G proteinem 120 (GPR 120). Vazba na GPR 120 má jak známo protizánětlivý a inzulin senzibilizující efekt [9,10].
Útlum cévní propustnosti a snížení krevní srážlivosti
ω-6 MK jsou protrombogenní, zvyšují cévní propustnost a otok. ω-3 MK působí proti nim antitrombogenně a svým tlumícím vlivem na zvýšenou cévní permeabilitu a chemotaxi snižují otok v ráně. ω-3 MK aktivují vyšší tvorbu prostacyklinu PGI2, který má jak známo lokální vazodilatační a antiagregační efekt. Současně snižují hladiny proagregačního tromboxanu TXA2. Zábrana vaskulárních trombóz je jedním z mechanizmů prevence nekróz a rozpadů rány [29,30].
Změna fenotypu makrofágů na protizánětlivý a proresorpční typ
Makrofágy se účastní klíčových procesů resorpce zánětu skrze útlum prozánětlivých procesů a zajištění odklízení apoptotických buněk a detritu. Podporují také novotvorbu cév v poraněné tkáni. Bylo prokázáno, že lipidové mediátory z ω-3 MK stimulují fagocytární aktivitu makrofágů a zkracují tak dobu hojení [11,12]. ω-3 MK reprogramují makrofágy na fenotyp M2, pro který je charakteristická protizánětlivá a tkáň obnovující proresorpční aktivita urychlující vyhojení zánětu v ráně a zabraňující následné patologické fibrotizaci [13]. Klíčovost „přepnutí“ makrofágů do protizánětlivého a fagocytujícího fenotypu M2 prokazují i studie u diabetiků, u kterých tato schopnost chybí, a proto přetrvává chronické prozánětlivé prostředí, tedy stav způsobující nehojící se ránu [14]. V obecném smyslu změna ve spektru lipidových mediátorů s posunem od prozánětlivých k protizánětlivým a současně proresorpčním je kritickým bodem přesunu od první zánětlivé fáze hojení do druhé fáze rezoluce, tedy do fáze vstřebání zánětu. Při selhání v tomto kritickém bodě dochází k prodlouženému hojení ran s následkem poškození tkání patologickou fibrotizací.
Jaké farmakologické metody ovlivnění protrahovaného zánětu jsou v současnosti dostupné? Standardní protizánětlivé léky mají nedostatek v tom, že sice mohou utlumit nadměrné prozánětlivé prostředí, ale vedle toho brání fázi rezoluce, čímž mohou vlastní zánětlivý proces sice zmírnit, ale i prodloužit. Naopak ω-3 MK, které také mají protizánětlivý účinek, jsou současně proresorpční, podporují tedy vstřebání zánětu a brání tak progresi do chronického zánětlivého stavu. Tímto jejich specifickým účinkem se otevírá ve výzkumu pole pro nový druh protizánětlivých léků podporujících fázi rezoluce [15–17].
Podpora tvorby kolagenu v ráně
Vlastní prozánětlivé cytokiny jsou důležité nejen pro boj s infekcí v první fázi hojení ran, ale i pro následné nastartování tvorby kolagenu. To lze potvrdit pozorováním, že protizánětlivé hormony glukokortikoidy vedou ke tvorbě nekvalitní atrofické jizvy [18]. Podobným způsobem jako kortikoterapie dokáže zpomalit hojení ran např. i psychogenní stres, tedy endogenní glukokortikoidy [19,20]. Na straně druhé víme, že ani nadměrná aktivace zánětlivé cesty není příznivá, neboť může vést k protrahovanému hojení a nežádoucí hyperproliferaci.
Lze tedy vůbec farmakologicky zasáhnout do zánětlivého procesu hojení tkání a současně zachovat rovnováhu přirozených pro - a protizánětlivých mechanizmů?
Právě v tomto smyslu se ω-3 MK zdají být výhodné, neboť oproti standardním protizánětlivým lékům působí ne imunosupresivně, ale imunomodulačně, kdy kromě útlumu zánětu navíc podporují i jeho vstřebání a vedou k zábraně patologického jizvení ve tkáních. Důležité pro pochopení vlastního imunomodulačního a současně rány hojícího mechanizmu ω-3 MK bylo zjištění, že jejich efekt závisí na druhu imunitních buněk. Mnoho studií totiž prokázalo korelaci hladin ω-3 MK se sníženou produkcí prozánětlivých cytokinů periferními monocyty a v plazmě, ale na straně druhé existují studie popisující naopak zvýšení produkce prozánětlivých cytokinů, a sice fibroblasty a peritoneálními makrofágy [21–23]. Průkaz rozdílného účinku ω-3 MK na produkci prozánětlivých cytokinů v závislosti na druhu imunitních buněk pomohla odhalit odpověď na kontroverzní otázky v této oblasti. U ω-3 MK tak byla nalezena přímá pozitivní korelace k produkci kolagenu fibroblasty. V experimentální studii bylo prokázáno, že zatímco ω-6 MK redukují, tak ω-3 MK naopak zvyšují produkci kolagenových vláken. Ve vztahu k ω-3 MK byla nalezena lineární korelace mezi množstvím kolagenu a prozánětlivým cytokinem IL6, který jeho produkci podporuje [24]. Potvrdily to i jiné studie, které v tomto smyslu odhalily i klíčovost vlastního poměru ω-3 MK vůči ω-6 MK, které jak známo spolu kompetitivně soutěží o stejná vazebná místa a enzymové systémy. Při nadmíře ω-6 MK tak dochází k vyšší produkci prostaglandinu E2 (PGE2) a ten kromě jiných účinků snižuje produkci kolagenu. ω-3 MK pak působí opačně, tedy potlačují produkci PGE2 a aktivují tvorbu kolagenu [25]. Studie na akutních lidských ranách prokázala, že ω-3 MK urychlují vstřebání zánětu, a tím reepitelizaci a regeneraci rány [26]. Randomizovaná studie na pacientech s dekubity zase upozornila na menší progresi kožních vředů i pokles CRP [27]. ω-3 MK mají tedy z hlediska tvorby kolagenu zajímavý modulační efekt, který na straně jedné podporuje jeho tvorbu po poranění, ale současně i zamezuje nežádoucí nadměrné fibrotizaci tkání. Ochrana tkání před patologickou fibrotizací byla vysledována i na příkladu vnitřních orgánů [28], což je výhodou zejména u pacientů v kritickém stavu. V souhrnu uvedené studie demonstrují komplexnost účinku ω-3 MK: současně s útlumem zánětu dochází i k urychlení jeho resorpce ve tkáni a tvorbě kvalitní a přitom minimální jizvy. Urychlení fáze vstřebání zánětu a zachovaná kvalita jizvy je tak klíčový rozdíl ve srovnání se standardními protizánětlivými léky.
Útlum osteolýzy a podpora osteogeneze
ω-3 MK a jejich specifické tkáňové mediátory již opakovaně prokázaly protizánětlivý a zánět resorbující účinek s podporou hojení různých druhů tkání včetně kosti. Konkrétně resolviny třídy E (RvE) mají schopnost jak vstřebání zánětu, tak i útlumu osteolýzy a nastartování procesu novotvorby kosti. RvE1 stimuluje regeneraci jak měkkých tkání, tak i kosti destruované leukocyty a osteoklasty [31]. I mnohé další studie ukazují na vliv resolvinů na útlum osteoklastů a aktivaci osteoblastů [32–34]. Lokální aplikace RvE1 má regenerační účinek na modelu kraniotomie [35]. Je vhodné zmínit, že oblast chirurgie hlavy a krku se zdá pro možnosti využití rybího oleje v perioperační péči obecně velmi výhodná, navíc s potenciálem využití i v období následné radioterapie, ve kterém se často potýkáme s patologickou fibrotizací kůže a osteoradionekrózami.
Regenerace střevní sliznice a změna střevní mikroflóry
ω-3 MK jsou indikovány v rámci imunonutrice primárně v gastrointestinální chirurgii. Byla popsána stimulace regenerace střevního endotelu [36], a to i v podmínkách střevní ischemie [37]. Obecně proběhla v tomto smyslu již řada experimentálních i klinických studií s potenciálem využití pro praxi. Poměrně nedávno byl navíc odhalen další z protizánětlivých mechanizmů ω-3 MK spočívající ve změně střevní mikroflóry se snížením produkce bakteriálních LPS a ve snížení střevní propustnosti pro ně. Vlivem ω-3 MK bylo ve střevě zaznamenáno zvýšení zastoupení „protizánětlivých bakterií“, jako jsou Bifidobacteriae, Lactobacillus aj., a naopak snížení zastoupení „prozánětlivých bakterií“, kam patří Escherichia coli, Proteobacteriae, Enterobacteriae, Fusobacteriae apod, čímž dochází ke snížení produkce bakteriálních LPS. Předpokládaným mechanizmem ovlivnění střevní mikroflóry prostřednictvím ω-3 MK je vyšší produkce střevní alkalické fosfatázy (IAP), která je supresorem růstu Escherichia coli a dalších prozánětlivě působících bakterií. ω-6 MK v tomto smyslu pak působí přesně naopak, tedy zvyšují zastoupení více LPS produkujících bakterií a ovlivňují tak střevní mikroflóru prozánětlivým směrem. Vedle specifické změny mikroflóry se snížením produkce bakteriálních LPS bylo popsáno i vyšší zastoupení proteinů mezibuněčných spojení (tzv. tight junctions), a tím menší propustnost střevní sliznice pro endotoxiny, což je další mechanizmus, kterým ω-3 MK vedou ke snížení bakteriální endotoxemie, která je jak známo jednou z příčin prozánětlivého prostředí v organizmu [38].
Potenciál snížení nároků na antibiotickou a analgetickou léčbu u chirurgických pacientů
Kontroverzní otázkou byl dlouhou dobu možný vliv ω-3 MK na protiinfekční obranyschopnost. Obavy z oslabení imunity se však díky specifickému imunomodulačnímu účinku ukázaly být liché, a to i přes některé rozporuplné výsledky studií. Rybí olej naopak prokázal menší výskyt infekcí, a dokonce i nižší spotřebu antibiotik [39,40]. Vedle toho je pro chirurgickou oblast příznivý i jejich prokázaný analgetický účinek, zejména u zánětlivé a pooperační bolesti. Molekulární mechanizmy analgetického účinku ω-3 MK byly mnoha studiemi popsány jak na periferní, tak i na centrální úrovni [41–44]. Nedávno vysledovaný synergizmus s opiáty ukázal také na potenciál možnosti případného snížení dávek analgetik a omezení výskytu tolerance k opiátům [45].
Klíčovost poměru ω-6 vůči ω-3 MK na výsledný efekt v organizmu
Rybí olej, který je bohatým zdrojem ω-3 MK, je široce dostupný a výše uvedené výsledky studií jsou pro zavedení do praxe atraktivní, ale jak už to bývá, nic není tak jednoduché. Ukázalo se, že k dosažení žádoucího efektu je zapotřebí dalších dietních opatření, zejména je nutné omezit příjem opačně působících ω-6 MK, které kompetitivním způsobem soutěží o stejná vazebná místa a enzymové systémy. Jak známo, ω-6 MK jsou prekurzory kyseliny arachidonové, ze kterých se tvoří prozánětlivé eikosanoidy, a při nadbytku ω-6 MK dochází jak ke snížení tvorby protizánětlivých eikosanoidů z ω-3 MK, tak i ke snížení konverze rostlinné formy ω-3 ALA na účinné živočišné formy EPA a DHA. Vedle toho oxidované formy ω-6 MK působí i samy o sobě prozánětlivě. Výsledný účinek proto v praxi dokonce ještě více než na jednotlivé dávce závisí na vlastním poměru obou druhů ω MK [46]. Potřeba současného snížení konzumace ω-6 MK, kterých je v české stravě nadbytek, je tedy pro projev vlastního efektu ω-3 MK klíčová.
Otázka optimálního načasování a dávkování ω-3 MK pro perioperační období
Konzumace rybího oleje je schopna zvýšit koncentraci EPA a DHA v krevních lipidech a fosfolipidech membrán buněk během několika dnů. Dle studií dochází k nárůstu s maximem vysycení přibližně za 14 dnů. Z toho důvodu spadá ideální načasování imunonutrice do období 2 týdnů před operací. Po vysazení ω-3 MK se drží hladiny v séru sice pouze 3 dny, ale v buněčných membránách přetrvávají dokonce 1–2 měsíce a po tuto dobu jsou stále schopny svého biologického účinku [47]. Z těchto dat plyne, že pro použití ω-3 MK je důležitá především předoperační příprava, která, pokud je dostatečná, je schopna i při vysazení suplementace před operací dostatečně vykrýt dlouhý interval pooperačního období a hojení ran.
Problémem mnoha studií je otázka optimálního dávkování ω-3 MK. Ukazuje se, že standardní preventivní dávky 1–2 g denně nemusejí být dostatečné pro chirurgické pacienty, a už vůbec ne pro pacienty v kritickém stavu. V budoucnu se proto očekávají další studie s vyššími dávkami. Pokud vycházíme z poznatků ze studií na zvířecích modelech, je potřeba si uvědomit, že myší imunitní buňky se ω-3 MK nasycují mnohem snáze než lidské, které potřebují relativně vyšší koncentrace k dosažení srovnatelného biologického účinku. Prokázalo se, že protizánětlivý účinek ω-3 MK je závislý na dávce a u lidí se projevuje až při dávkách > 2 g/den [48,55], tedy v dávkách vyšších než standardních. Důvodem zvažování zvýšení dávkování jsou mnohé studie, které neprokázaly efekt běžně užívaných dávek, a nalezly jej často až při několikanásobně vyšším dávkování, zejména pokud se jedná o útlum systémové zánětlivé reakce. Např. studie na pacientech v kritickém stavu neprokázala účinek při 3 g/den, zatímco denní dávka 9 g ω-3 MK dokázala snížit prozánětlivé parametry i nutnost ventilační podpory u pacientů v sepsi [49]. Jiná velká prospektivní studie sledovala efekt parenterálně podaného rybího oleje v heterogenní skupině 661 pacientů v kritickém stavu. Popsáno bylo o 1/4 méně infekčních komplikací a menší spotřeba antibiotik v závislosti na vysoké dávce ω-3 MK (150 mg/kg tělesné váhy) ve srovnání s nízkými dávkami (< 50 mg/kg). K tomu byla zaznamenána kratší doba na JIP, kratší celková doba hospitalizace i nižší mortalita [50]. A existují i mnohé další studie podporující u ω-3 MK jev závislosti na vyšším dávkování.
Obavy z nežádoucích účinků při zvýšení dávek ω-3 MK se neprokázaly jako oprávněné. V klinických studiích v denních dávkách v rozmezí 1–7,5 g nebyly hlášeny žádné závažné nežádoucí účinky, co se týče funkce trombocytů, oxidačního stavu, imunity a metabolizmu [51]. Zdraví dobrovolníci, kteří užívali dávky 6 g/den (tj. přibližně 100 mg/kg tělesné váhy), nevykazovali patologie v obávané složce krevní srážlivosti [52]. Dokonce ani dávky v rozmezí od 3 až po 15 g/den nevedly ke krvácivosti. V metaanalýze 9 randomizovaných studií, která zahrnovala celkem 2 612 pacientů, nebylo nalezeno riziko zvýšeného krvácení při vysokých dávkách, a to dokonce ani u pacientů sledovaných pro kardiovaskulární onemocnění se současnou léčbou aspirinem nebo warfarinem [53].
Závěr
ω-3 mastné kyseliny z rybího oleje jsou v perioperačním období využitelné nejen k útlumu systémových komplikací nadměrné zánětlivé reakce, ale i ke zlepšení hojení poraněných tkání. Studie odhalily, že díky svému specifickému imunomodulačnímu účinku příznivě zasahují do všech fází hojení ran. V první fázi akutního zánětu zabraňují nadměrné lokální infiltraci neutrofily, otoku, trombotickým komplikacím a bolesti. Následně jsou klíčové pro přesmyk do druhé fáze vstřebání zánětu, ve které aktivují fagocytární schopnosti makrofágů. Příznivě ovlivňují také poslední fázi hojení, tedy tvorbu kolagenu. V obecném smyslu podporují hojení různých druhů tkání včetně diabetických ran, střevní sliznice, kosti a jiných. ω-3 mastné kyseliny proto mají potenciál pro mnoho chirurgických oborů. V rámci směsí imunonutriční předoperační přípravy jsou v současné době využívány zejména v gastrointestinální chirurgii a před rozsáhlými resekcemi karcinomů hlavy a krku. Co se týče dietních doporučení, nemělo by se zapomínat na existenci negativního vlivu kompetitivně opačně působících ω-6 mastných kyselin, kterých je v naší stravě nadbytek a které mohou příznivé účinky rybího oleje vyrušit. Další studie by se měly zaměřit jak na možnost rozšíření indikací, tak i na stále nejasnou otázku optimálního dávkování ω-3 mastných kyselin.
MUDr. Jana Neuwirthová, Ph.D.
janeuwi@gmail.com
Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 19. 12. 2015
Přijato po recenzi 4. 3. 2016
Zdroje
1. Roy S, Das A, Ganesh K et al. Wound inflammation. In: Aggarwal BB, Krishnan S, Guha S (eds). Inflammation, Lifestyle and Chronic Diseases: The Silent Link. CRC Press 2011 : 183–201. ISBN 9781439839898.
2. Jirkovská A. Hojení kožních afekcí u syndromu diabetické nohy při hospitalizaci. Vnitř Lék 2006; 52(5): 459–464.
3. Yehuda S, Rabinovitz S. The Role of Essential Fatty Acids in Anorexia Nervosa and in Obesity. Crit Rev Food Sci Nutr. Published online: 11 Jun 2015. Dostupné z DOI: <http://doi:10.1080/10408398.2013.809690>.
4. Zadák Z, Tichá A, Hronek M et al. Pokroky v metabolizmu a výživě 2011 a cesta k personalizované léčbě. Vnitř Lék 2011; 57(11): 970–974.
5. Wong SW, Kwon MJ, Choi AM et al. Fatty acids modulate Toll-like receptor 4 activation through regulation of receptor dimerization and recruitment into lipid rafts in a reactive oxygen species-dependent manner. J Biol Chem 2009; 284(40): 27384–27392.
6. Novak TE, Babcock TA, Jho DH et al. NF-kappa B inhibition by omega -3 fatty acids modulates LPS-stimulated macrophage TNF-alpha transcription. Am J Physiol Lung Cell Mol Physiol 2003; 284(1): L84-L89.
7. Lee JY, Sohn KH, Rhee SH et al. Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through Toll-like receptor 4. J Biol Chem 2001; 276(20): 16683–16689.
8. Lee JY, Zhao L, Youn HS et al. Saturated fatty acid activates but polyunsaturated fatty acid inhibits Toll-like receptor 2 dimerized with Toll-like receptor 6 or 1. J Biol Chem 2004; 279(17): 16971–16979.
9. Oh DY, Talukdar S, Bae EJ et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell 2010; 142(5): 687–698.
10. Im DS. Omega-3 fatty acids in anti-inflammation (pro-resolution) and GPCRs. Prog Lipid Res 2012; 51(3): 232–237.
11. Schwab JM, Chiang N, Arita M et al. Resolvin E1 and protectin D1 activate inflammation-resolution programmes. Nature 2007; 447(7146): 869–874.
12. Gorjão R, Verlengia R, Lima TM et al. Effect of docosahexaenoic acid-rich fish oil supplementation on human leukocyte function. Clin Nutr 2006; 25(6): 923–938.
13. Keeren K, Huang D, Smyl C et al. Effect of different omega-6/omega-3 polyunsaturated fatty acid ratios on the formation of monohydroxylated fatty acids in THP-1 derived macrophages. Biology (Basel) 2015; 4(2): 314–326.
14. Khanna S, Biswas S, Shang Y et al. Macrophage dysfunction impairs resolution of inflammation in the wounds of diabetic mice. PLoS One 2010; 5(3): e9539. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0009539>.
15. Lee HN, Surh YJ. Therapeutic potential of resolvins in the prevention and treatment of inflammatory disorders. Biochem Pharmacol 2012; 84(10): 1340–1350.
16. Sousa LP, Alessandri AL, Pinho V et al. Pharmacological strategies to resolve acute inflammation. Curr Opin Pharmacol 2013; 13(4): 625–631.
17. Alessandri AL, Sousa LP, Lucas CD et al. Resolution of inflammation: mechanisms and opportunity for drug development. Pharmacol Ther 2013; 139(2): 189–212.
18. Hübner G, Brauchle M, Smola H et al. Differential regulation of pro-inflammatory cytokines during wound healing in normal and glucocorticoid-treated mice. Cytokine 1996; 8(7): 548–556.
19. Glaser R, Kiecolt-Glaser JK, Marucha PT et al. Stress-related changes in proinflammatory cytokine production in wounds. Arch Gen Psychiatry 1999; 56(5): 450–456.
20. Head CC, Farrow MJ, Sheridan JF et al. Androstenediol reduces the anti-inflammatory effects of restraint stress during wound healing. Brain Behav Immun 2006; 20(6): 590–596.
21. Jia Y, Turek JJ. Inducible nitric oxide synthase links NF-kappaB to PGE2 in polyunsaturated fatty acid altered fibroblast in-vitro wound healing. Lipi Health Dis 2005; 4 : 14.
22. Hardardottir I, Kinsella JE. Tumor necrosis factor production by murine resident peritoneal macrophages is enhanced by dietary n-3 polyunsaturated fatty acids. Biochim Biophys Acta 1991; 1095(3): 187–195.
23. Petursdottir DH, Olafsdottir I, Hardardottir I. Dietary fish oil increases tumor necrosis factor secretion but decreases interleukin-10 secretion by murine peritoneal macrophages. J Nutr 2002; 132(12): 3740–3743.
24. Hankenson KD, Watkins BA, Schoenlein IA et al. Omega-3 fatty acids enhance ligament fibroblast collagen formation in association with changes in interleukin-6 production. Proc Soc Exp Biol Med 2000; 223(1): 88–95.
25. Jia Y, Turek JJ. Polyenoic fatty acid ratios alter fibroblast collagen production via PGE2 and PGE receptor subtype response. Exp Biol Med 2004; 229(7): 676–683.
26. McDaniel JC, Massey K, Nicolaou A. Fish oil supplementation alters levels of lipid mediators of inflammation in microenvironment of acute human wounds. Wound Repair Regen 2011; 19(2): 189–200.
27. Theilla M, Schwartz B, Cohen J et al. Impact of a nutritional formula enriched in fish oil and micronutrients on pressure ulcers in critical care patients. Am J Crit Care 2012; 21(4): e102-e109. Dostupné z DOI: <http://dx.doi.org/10.4037/ajcc2012187>.
28. Qu X, Zhang X, Yao J et al. Resolvins E1 and D1 inhibit interstitial fibrosis in the obstructed kidney via inhibition of local fibroblast proliferation. J Pathol 2012; 228(4): 506–519.
29. Bohr S, Patel SJ, Sarin D et al. Resolvin D2 prevents secondary thrombosis and necrosis in a mouse burn wound model. Wound Repair Regen 2013; 21(1): 35–43.
30. Kalish BT, Kieran MW, Puder M et al. The growing role of eicosanoids in tissue regeneration, repair, and wound healing. Prostaglandins Other Lipid Mediat 2013; 104–105 : 130–138.
31. Hasturk H, Kantarci A, Goguet-Surmenian E et al. Resolvin E1 regulates inflammation at the cellular and tissue level and restores tissue homeostasis in vivo. J Immunol 2007; 179(10): 7021–7029.
32. Herrera BS, Ohira T, Gao L et al. An endogenous regulator of inflammation, resolvin E1, modulates osteoclast differentiation and bone resorption. Br J Pharmacol 2008; 155(8): 1214–1223.
33. Hasturk H, Kantarci A, Ohira T et al. RvE1 protects from local inflammation and osteoclast-mediated bone destruction in periodontitis. FASEB J 2006; 20(2): 401–403.
34. Bannenberg G, Serhan CN. Specialized pro-resolving lipid mediators in the inflammatory response: an update. Biochem Biophys Acta 2010; 1801(12): 1260–1273.
35. Gao L, Faibish D, Fredman G et al. Resolvin E1 and chemokine-like receptor 1 mediate bone preservation. J Immunol 2013; 190(2): 689–694.
36. Ruthig DJ, Meckling-Gill KA. Both (n-3) and (n-6) fatty acids stimulate wound healing in the rat intestinal epithelial cell line, IEC-6. J Nutr 1999; 129(10): 1791–1798.
37. Jacobi SK, Moeser AJ, Corl BA et al. Dietary long-chain PUFA enhance acute repair of ischemia-injured intestine of suckling pigs. J Nutr 2012; 142(7): 1266–1271.
38. Kaliannan K, Wang B, Li XY et al. A host-microbiome interaction mediates the opposing effects of omega-6 and omega-3 fatty acids on metabolic endotoxemia. Sci Rep 2015; 5 : 11276. Dostupné z DOI: <http://dx.doi.org/10.1038/srep11276>.
39. Chiang N, Fredman G, Backhed F et al. Infection regulates pro-resolving mediators that lower antibiotic requirements. Nature 2012; 484(7395): 524–528.
40. Serhan CN, Chiang N. Resolution phase lipid mediators of inflammation: agonists of resolution. Curr Opin Pharmacol 2013; 13(4): 632–640.
41. Shapiro H. Could n-3 polyunsaturated fatty acids reduce pathological pain by direct actions on the nervous system? Prostaglandins Leukot Essent Fatty Acids 2003; 68(3): 219–224.
42. Xu ZZ, Zhang L, Liu T et al. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med 2010; 16(5): 592–597.
43. Huang L, Wang CF, Serhan CN et al. Enduring prevention and transient reduction of postoperative pain by intrathecal resolvin D1. Pain 2011; 152(3): 557–565.
44. Xu ZZ, Berta T, Ji RR. Resolvin E1 inhibits neuropathic pain and spinal cord microglial activation following peripheral nerve injury. J Neuroimmune Pharmacol 2012; 8(1): 37–41.
45. Escudero GE, Romañuk CB, Toledo ME et al. Analgesia enhancement and prevention of tolerance to morphine: beneficial effects of combined therapy with omega-3 fatty acids. J Pharm Pharmacol 2015; 67(9): 1251–1262.
46. Fritsche KL. The Science of Fatty Acids and Inflammation. Adv Nutr 2015; 6(3): 293S-301S.
47. Masson S, Latini R, Tacconi M et al. Incorporation and washout of n-3 polyunsaturated fatty acids after diet supplementation in clinical studies. J Cardiovasc Med (Hagerstown) 2007; 8(Suppl 1): S4-S10.
48. Calder PC. Mechanisms of action of (n-3) fatty acids. J Nutr 2012; 142(3): S592-S599.
49. Hosny M, Nahas R, Ali S et al. Impact of oral omega-3 fatty acids supplementation in early sepsis on clinical outcome and immunomodulation. Egyptian J Critical Care Med 2013; 1(3): 119–126.
50. Heller AR, Rössler S, Litz RJ et al. Omega-3 fatty acids improve the diagnosis-related clinical outcome. Crit Care Med 2006; 34(4): 972–979.
51. Lien EL. Toxicology and safety of DHA. Prostaglandins Leukot Essent Fatty Acids 2009; 81(2–3): 125–132.
52. Nelson GJ, Schmidt PS, Bartolini GL et al. The effect of dietary docosahexaenoic acid on platelet function, platelet fatty acid composition, and blood coagulation in humans. Lipids 1997; 32(11): 1129–1136.
53. Wang C, Harris WS, Chung M et al. N-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary - and secondary-prevention studies: a systematic review. Am J Clin Nutr 2006; 84(1): 5–17.
54. Calder PC. Immunomodulation by omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids 2007; 77(5–6): 327–335.
55. Calder PC. Omega-3 polyunsaturated fatty acids and inflammatory processes: nutrition or pharmacology? Br J Clin Pharmacol 2013; 75(3): 645–662.
56. Jirák R, Zeman M. Vliv omega-3 a omega-6 nenasycených mastných kyselin na psychické poruchy. Čes a Slov Psychiat 2007; 103(8): 420–426.
57. Singer P, Shapiro H, Theilla M Anti-inflammatory properties of omega-3 fatty acids in critical illness: novel mechanisms and an integrative perspective. Intensive Care Med 2008; 34(9): 1580–1592.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Cystická fibróza – editorial
- Imunitní systém a zpracování informací – editorial
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
-
Richard Rokyta, Cyril Höschl (eds).
Bolest a regenerace v medicíně -
Milan Halenka, Zdeněk Fryšák.
Atlas ultrasonografie štítné žlázy -
Petra Svozílková et al.
Uveitidy v kazuistikách
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



