-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sarkoidóza – nadále záhadné onemocnění
Sarcoidosis – enigmatic disease still unresolved
Sarcoidosis is a systemic disease of unknown etiology, characterized by the presence of granulomatous inflammation in affected tissues. In about 90 % it affects the lungs, but it may basically affect any organ, the most frequently the skin, lymph nodes and eyes. In the case of classic lung manifestation this disease is not difficult to diagnose. When dealing with extrapulmonary manifestations, interdisciplinary cooperation is necessary. The treatment of sarcoidosis is needed in about half of the cases, in some 30 % of patients it may change into a chronic stage and possibly lead to serious health problems or premature death. Treatment is commenced following individual evaluation of the extent of the disease and considering its benefit against possible secondary effects. Corticosteroids remain the systemic drugs of first choice. When ineffective or not tolerated, the drugs of second choice are given, these are corticosteroid replacement drugs such as methotrexate, antimalarial drugs and immunosuppressive drugs. For refractory forms, biological therapy is administered, in particular infliximab or adalimumab.
Key words:
biological therapy – corticosteroids – corticosteroid replacement treatment – extrapulmonary lesions – sarcoidosis
Autori: Vítězslav Kolek; Monika Žurková; Vladimíra Lošťáková
Pôsobisko autorov: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Vyšlo v časopise: Vnitř Lék 2017; 63(11): 807-814
Kategória: Přehledné referáty
Súhrn
Sarkoidóza je systémové onemocnění neznámé etiologie, které je charakterizováno přítomností granulomatózního zánětu v postižených tkáních. Asi v 90 % postihuje plíce, ale může postihovat v zásadě kterýkoliv orgán, nejčastěji kůži, lymfatické uzliny a oči. Při klasické plicní manifestaci nečiní toto onemocnění velké diagnostické potíže. Při řešení mimoplicních manifestací je nezbytná mezioborová spolupráce. Léčba sarkoidózy je potřebná asi v polovině případů, asi u 30 % nemocných může přejít do chronického stadia a případně vést k závažným poruchám zdraví či předčasné smrti. K léčbě se přistupuje po individuálním posouzení rozsahu nemoci a po zvážení přínosu a možných vedlejších účinků. Lékem volby jsou nadále systémově kortikosteroidy. Při neúčinnosti nebo intoleranci se podávají léky druhé volby, což jsou kortikosteroidy šetřící léky jako metotrexát, antimalarika a imunosupresiva. U refrakterních forem se podává biologická léčba, především infliximab nebo adalimumab.
Klíčová slova:
biologická léčba – kortikosteroidy – kortikosteroidy šetřící léčba – mimoplicní postižení – sarkoidózaÚvod
Sarkoidóza je systémové onemocnění neznámé etiologie, které je charakterizováno přítomností granulomatózního zánětu v postižených tkáních [1]. Může postihovat v zásadě kterýkoliv orgán, plíce jsou však postiženy asi v 90 % případů a respirační příznaky přivádějí nemocné především k pneumologům. Bývá postižena také kůže, periferní uzliny, oči, nervová soustava nebo další orgány, a v těchto případech diagnostika vyžaduje mezioborový přístup. Jak plicní, tak mimoplicní postižení nemusí být symptomatické a bývá tak náhodným nálezem při vyšetřování z jiných důvodů. Nemocní jsou jedinci mladšího a středního věku, častěji ženy, více z nich je nekuřáků než kuřáků [2]. Onemocnění se vyskytuje celosvětově, spíše v mírném klimatickém pásmu, prevalence je obtížně hodnotitelná v oblastech s vysokým výskytem tuberkulózy nebo pneumokonióz a také v oblastech, v nichž není dostatečná úroveň diferenciální diagnostiky plicních nemocí. Výskyt sarkoidózy závisí na rase, je vyšší u amerických černochů než u bělochů, podobně je tomu v jižní Africe. Prevalence kolísá mezi 6–20/100 000 obyvatel, vysoká je ve Skandinávii a nízká např. v Japonsku [2]. V České republice byla incidence naposledy zjišťována v 80. letech minulého století a dosahovala 3,1/100 000. Prevalence se dle údajů ÚZIS pohybuje kolem 70/100 000 obyvatel [3,4]. K familiárnímu výskytu dochází asi u 4 % případů [2].
Příčina vzniku
Příčina vzniku sarkoidózy není stále objasněna. Podstatou nemoci je tvorba epiteloidních nekazeifikujících granulomů, které mohou vznikat jako reakce na neznámou noxu imunologické povahy u geneticky predisponovaného jedince (obr.1) [1]. Vzniká oligoklonální buněčná odpověď s typickou akumulací CD4+ Th1-lymfocytů a aktivovaných makrofágů v místě postižení. Současné poznatky poukazují na zásadní význam Th17.1 buněk produkujících INFγ [5–7]. Během rozvoje granulomu, alveolitidy a resorpce nebo progrese k fibróze je detekována produkce celé řady cytokinů (IL2, IL12, IL18, INFγ a TNFα), chemokinů (CCL5, CXCR3, CXCR6 atd), jejichž přítomnost koreluje s aktivitou onemocnění, ale jejich dílčí význam v cytokinové síti není přesně znám [1]. Jako potenciální původce sarkoidózy se v literatuře diskutují nejčastěji tuberkulózní nebo netuberkulózní mykobakterie. Kromě průkazu DNA a RNA mykobakterií byl v granulomech identifikován i KatG peptid (mykobakteriální kataláza-peroxidový protein), který je jedním z faktorů virulence Mycobacterium tuberculosis komplex. Především japonští autoři uvažují o významu všudypřítomného mikroorganizmu Propionibacterium acnes, které také může vyvolávat tvorbu granulomů. Za další možné původce je označována Borrelia burgdorferi a mezi viry herpes virus HHV 8. Rozsáhlá metaanalýza se zabývala častějšími nálezy uvedených patogenů u sarkoidózy ve srovnání se zdravými kontrolními skupinami a našla signifikantní rozdíly výskytu mykobakterií (HR 6,8), Propionibacterium acnes (HR 18,8), Borrelia burgdorferi (HR 4,8) a HHV 8 (HR 1,5) [8]. Ojediněle byly detekovány protilátky proti jiným patogenům, nicméně studium mikrobiomu u nemocných se sarkoidózou nepřineslo zatím zásadní výsledky [9]. Základním problémem úvah o významu infekčních agens je fakt, že přenos onemocnění nebyl prokázán. Zvažuje se i možnost alergické imunitní reakce na některé kovy (berylium, nikl, hliník), talek, pyl borovic, jíl nebo škrob. Studium granulomatózní nemoci u záchranářů pracujících v prachu při zřícení Světového obchodního centra v New Yorku ukázalo, že roli mohou mít uhlíkové zplodiny (karbonáty) [10]. Tvorbu granulomů může vyvolat i celá řada léků, je však otázka, zda tyto reakce označovat za sarkoidózu nebo jen za nespecifickou sarkoidní reakci [11]. Není vyloučen ani mechanizmus autoimunitního procesu proti receptorovým strukturám lymfocytů a HLA antigenů [12].
Obr. 1. Typický nekazeifikující granulom v uzlině 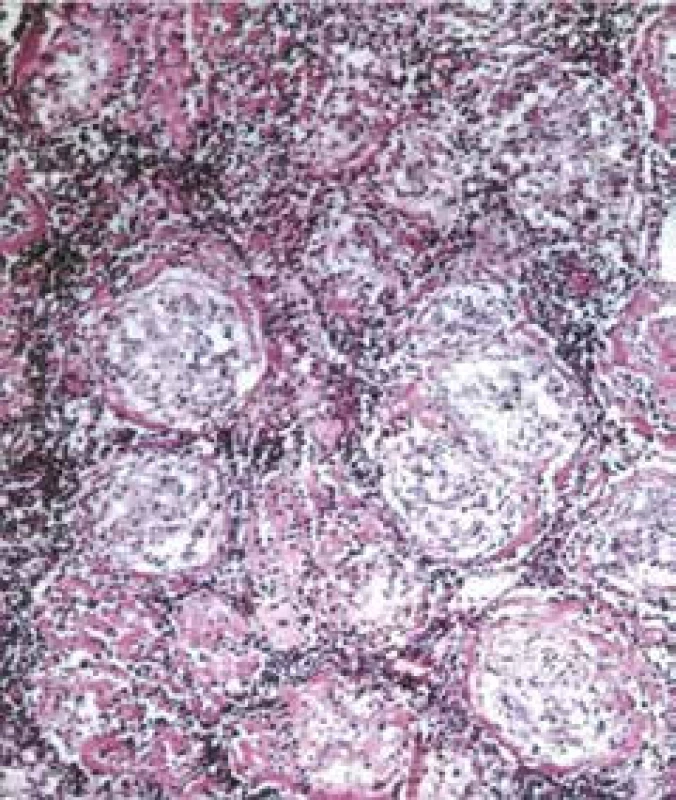
Genetická predispozice je studována řadu let. U pacientů se sarkoidózou byl popsán vyšší výskyt HLA A1, B8, B13, B27, DR3 a HLA-DRB1*0301/DQB1*0201 ve srovnání se zdravými jedinci [13]. Pozornost vzbudila současná přítomnost některých DR antigenů (DR 17+) a specifického receptoru na T buňkách (TCR AV2S3+), zjištěná u skandinávské populace s Löfgrenovým syndromem. V poslední době se více sledují asociace s MHC antigeny II. třídy. Progrese nemoci je asociována s HLA-DRB1*1501, naopak s dobrou prognózou se asociuje HLA-DRB1*0301/DQB1*0201 a s mimoplicní lokalizací HLA-DRB1*11 [14]. Byla popsána i řada polymorfizmů modifikujících onemocnění, kromě genů imunohistokompatibilního komplexu jde o geny řady cytokinů a jejich receptorů TNFα, IL6, IL1β, IL2, CCR5, CCR2, TGFβ aj [7]. Skupinová genová analýza na receptorech periferních T-lymfocytů ukázala signifikantní rozdíly mezi komplikovanou a nekomplikovanou formou nemoci [15]. Další studie běží formou GWAS (genome-wide association study), paralelně se sleduje velké množství nukleotidových polymorfizmů a jiných genetických znaků [16].
Plicní a mimoplicní klinické příznaky
Symptomatologie sarkoidózy je velmi pestrá, časté jsou ale formy zcela asymptomatické, při nichž není výkonnost organizmu vůbec postižena. Sarkoidóza má akutní a chronickou formu. Typická forma akutní sarkoidózy je Löfgrenův syndrom, chronická forma trvá déle než 2 roky a může vést k fibróznímu poškození plic [1]. Z plicních příznaků dominuje suchý kašel a dušnost, někdy retrosternální bolest nebo hemoptýza [2]. Mohou se objevit i pískoty nebo projevy virózy. Jako nespecifické celkové příznaky se objevují únava, subfebrilie až teploty, malátnost, pocení a váhový úbytek. Dlouhodobé potíže spojené s poruchou plicních funkcí má asi 30 % nemocných, přetrvávající aktivita nemoci při léčbě pokračuje asi u 10 % pacientů [17]. Za refrakterní sarkoidózu se považuje nemoc progredující při minimálně 3 měsíce trvající léčbě kortikosteroidy [17]. Komplikací plicní sarkoidózy jsou bronchiektázie, pleurální výpotek, pneumotorax, aspergilóza a jiné infekce ve fibrózním terénu. Velmi vzácnou komplikací je plicní hypertenze s výraznou dušností. Nemocní umírají na respirační insuficienci, vzácněji na sarkoidózu srdce, CNS nebo jater [17].
Löfgrenův syndrom je zřejmě geneticky vyhraněná akutní forma nemoci, v české populaci se vyskytuje až u 30 % nemocných [2]. Postihuje mladší pacienty, u nichž se objevují teploty a nejčastěji na bércích nodózní erytém, který je spojený s polyartralgiemi a otoky s možností artritidy talokrurálního skloubení. Bolestivost může být tak značná, že někdy znemožňuje chůzi. Radiologicky bývá přítomna bilaterální hilová lymfadenopatie a negativní kožní tuberkulinový test.
Mimoplicní příznaky
I mimoplicní postižení sarkoidózy probíhá často asymptomaticky [3]. Zjišťují se pozitivní jaterní testy, hyperkalciurie, leukopenie, anémie, zánětlivá infiltrace slinných a příušních žláz, zvětšení břišních uzlin nebo zvětšená slezina. Klinicky významné multiorgánové postižení bývá méně časté. Většinou se vyskytuje i se sarkoidózou plicní, výjimečně samostatně. Mezi orgány s výskytem postižení až do 30 % patří kůže, periferní uzliny, oči nebo pohybové ústrojí, mnohem vzácněji je postižen nervový systém, srdce, endokrinní systém, zažívací a uropoetický trakt [17,18]. Sarkoidóza v těchto orgánech často imituje jiné nemoci a nález granulomu při biopsii bývá překvapením.
Mimoplicní orgánové postižení
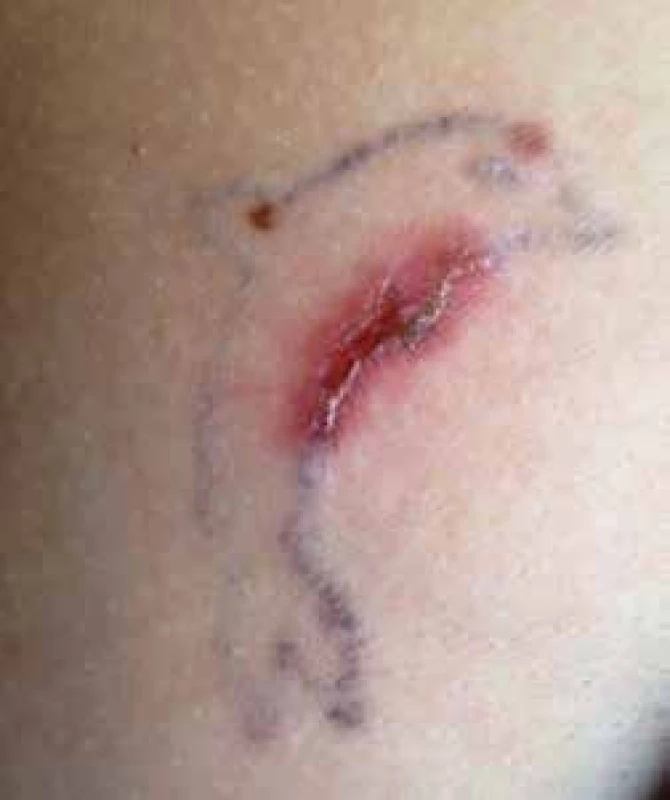
Kromě nodózního erytému dochází k pestrým méně specifickým kožním projevům, jako je malouzlová nebo velkouzlová sarkoidóza s červenohnědými papulami průměru až 5 cm, k jejichž výsevu dochází nejčastěji v obličeji, na pažích a trupu. Dále se mohou objevit subkutánní zatvrdliny. Za akutní projev sarkoidózy se také považuje vysoce specifický sarkoid v jizvě (zčervenání a zduření starých jizev) [3]. V poslední době jej vídáme především v tetovážích (obr. 2). Projevem torpidní chronické formy sarkoidózy kůže je lupus pernio. Jedná se o indurované plaky nejčastěji destruující oblast nosu, čela nebo boltce. V naší populaci se však téměř nevyskytuje. Postižené periferní lymfatické uzliny bývají nebolestivé, pohyblivé, bez zarudnutí a nemají sklon k ulceraci. Nejběžnějším očním postižením je akutní uveitida a konjunktivitida, chronické postižení může vést k adhezím mezi duhovkou a čočkou, může se rozvinout katarakta, glaukom nebo atrofie optického nervu s následnou slepotou. Kloubní postižení mívá charakter polyartralgií kolen, kotníků, loketních kloubů, zápěstí a drobných kloubů rukou a nohou, deformující artritida je velmi vzácná. Chronická myopatie se vyskytuje častěji u žen a bývá i jediným projevem onemocnění. Při cíleném bioptickém vyšetření lze prokázat granulomy v játrech ve více než 50 %, zatímco při fyzikálním vyšetření lze zjistit hepatomegalii pouze u méně než 20 % nemocných. Jaterní selhávání nebo zvýšení mortality v důsledku jaterní dysfunkce jsou zřídkavým jevem, rovněž se velmi vzácně vyskytuje portální hypertenze.
Sarkoidóza a změny metabolizmu
Porucha metabolizmu vápníku (hyperkalcemie a hyperkalciurie) se při sarkoidóze vyskytuje asi u 2–10 % pacientů a je podmíněna nekontrolovanou konverzí 25-cholekalciferolu na 1,25-dihydroxycholekalciferol (kalcitriol – aktivní vitamin D3) [3]. Ke konverzi dochází v epiteloidních buňkách granulomu, a proto se hladina vápníku normalizuje při terapii kortikosteroidy. Nezjištěná, perzistující hyperkalcemie a hyperkalciurie může být příčinou nefrokalcinózy, renálních kamenů a renálního selhání.
Sarkoidóza nervové soustavy
Granulomatózní proces může vzácně postihovat struktury centrální i periferní nervové soustavy. Běžnější je postižení hlavových nervů např. n. facialis, postižení mozku nebo míchy je většinou vážné a prognosticky nejisté [1]. Projevuje se jako leptomeningitida nebo pseudonádorové změny. S postižením centrální nervové soustavy souvisí i atrofie optického nervu s následnou možnou amaurózou nebo se při hypofyzární lokalizaci může vyskytnout diabetes insipidus. Popisuje se neuropatie malých vláken (small fibre neuropathy), která může být příčinou chronické únavy, ale také srdečních arytmií [4]. Celková slabost a únava jsou u některých nemocných těžko řešitelným problémem. Periferní neuropatie se může kombinovat se svalovým postižením. Ze zobrazovacích metod se při postižení centrální nervové soustavy uplatňuje magnetická rezonance (MR), elektromyografie (EMG) a vyšetření evokovaných potenciálů, které mohou potvrdit diagnózu neurosarkoidózy. Přínosné může být i vyšetření cerebrospinálního likvoru, ve kterém se zjišťuje zvýšená buněčnost podmíněná lymfocyty. Při imunofenotypizaci lymfocytů z likvoru je charakteristické zvýšení imunoregulačního indexu, v likvoru bývají i vyšší hladiny lyzozymu a enzymu konvertujícícho angiotenzin.
Sarkoidóza srdce
Nejčastějším projevem jsou arytmie od benigních extrasystol přes atrioventrikulární blokády vyššího stupně až po náhlé úmrtí [18]. Jednorázové EKG vyšetření je často normální, proto je doporučováno 24hodinové monitorování EKG podle Holtera. Z dalších vyšetřovacích metod je přínosné echokardiografické vyšetření (zjištění diastolické dysfunkce, postižení chlopní). Granulomatózní infiltrace myokardu se zobrazí při vyšetření pozitronovou emisní scintigrafií – PET/CT [18]. Podezření na sarkoidózu myokardu lze podpořit magnetickou rezonancí. Jistou diagnózu sarkoidózy srdce potvrdí endomyokardiální biopsie s průkazem granulomů.
Velmi vzácné projevy sarkoidózy
Mezi vysloveně vzácné projevy nemoci patří sarkoidóza gastrointestinálního traktu s postižením žaludku, jícnu, apendixu, rekta a pankreatu [4], stejně tak sarkoidóza žláz s vnitřní sekrecí (hypotalamus, hypofýza, štítná žláza, pankreas a příštítná tělíska) nebo sarkoidóza močového ústrojí, která jen zřídka vyústí v intersticiální nefritidu. Mnohem častěji vzniká nefrolitiáza, která se u těchto pacientů vzhledem k hyperkalcemii a hyperkalciurii vyskytuje asi 10krát častěji než v běžné populaci. K renálnímu selhání může dojít v rámci nefrokalcinózy. Postižení močového měchýře nebylo popsáno. Sarkoidóza pohlavního ústrojí postihuje hlavně dělohu [19]. Mužské pohlavní ústrojí nebývá běžně postiženo, pokud je přítomno, obvykle imituje testikulární malignitu. Unilaterální nebo bilaterální parotitida se projeví otokem a bolestivým zduřením. Kombinace teploty, zvětšení příušní žlázy, obrny tváře a přední uveitidy tvoří tzv. Heerfordtův syndrom (febris uveoparotidea) [2].
Plicní hypertenze (PH) u sarkoidózy je komplikace, které se v poslední době věnuje více pozornosti [17]. Jde o vážný stav, při němž dominuje dušnost, kašel, bolesti na hrudníku a únava. Mohou se dostavit anginózní bolesti, kolaps nebo synkopa, ev. hemoptýza. Výskyt je vyšší u rozvinutých forem s fibrózou, k PH dochází jen vzácně u pacientů bez evidentních radiologických známek fibrózy. Většina pacientů zařazených k transplantaci plic má plicní hypertenzi.
Diagnostika
Diagnostika sarkoidózy je mozaikou klinických příznaků, radiologických nálezů a imunologických vyšetření, optimálně by měla být podpořena histologickým nálezem nekazeifikujícího epiteloidního granulomu [2]. Za biomarkery s omezenou diagnostickou i monitorovací cenou se považují SACE, sIL2-R, neopterin, IL5, IL7 a CRP [17,20]. Charakteristickými nálezy jsou hyperkalciurie nebo hyperkalcinemie, anémie, lymfocytopenie, hypergamaglobulinemie, negativní tuberkulinový test, sarkoid v jizvě, radiologicky nalezený „útěk do plic“ a vysoký CD4/CD8 index v bronchoalveolární tekutině [3]. Při diagnostice nitrohrudní sarkoidózy je zásadní nález na skiagramu hrudníku (obr. 3), podle něhož se hodnotí stadia nemoci [1,17]. Stadium 0 – bez viditelného plicního postižení, stadium I – většinou symetrická hilová lymfadenopatie, stadium II – postižení uzlin i plicního parenchymu především ve středních a horních polích, stadium III – postižení pouze plicního parenchymu, stadium IV – fibrotické změny [3]. Nitrohrudní postižení lze podrobněji charakterizovat pomocí výpočetní tomografie s vysokou rozlišovací schopností (HRCT), tento nález ale neovlivňuje zařazení do stadia [17]. Biopsie je v diagnostice vždy přínosná. Diskutuje se o tom, zda se musí provádět u jednoznačných nálezů ve stadiu I, přesvědčivého nálezu na HRCT nebo nálezu granulomu v jiné něž nitrohrudní lokalizaci. Sarkoidózu nitrohrudních uzlin lze biopticky ověřit pomocí bronchoskopie s endobronchiální ultrasonografií (EBUS) a punkcí s vyhodnocením cytobloku. Sarkoidóza plic se ověřuje také bronchoskopicky pomocí klasické klíšťkové transbronchiální biopsie nebo kryobiopsie [17]. Chirurgické metody jsou dnes spíše výjimečným řešením (mediastinoskopie, videoasistovaná torakoskopie). Pro diagnostiku mimoplicní sarkoidózy je vhodné použít PET/CT [21]. Funkční vyšetření plic prokáže u některých nemocných snížení vitální kapacity, ale také bývá přítomna obstrukční plicní porucha [2]. Nejčasněji se projeví porucha plicní difuze (diffusing capacity of the lung for carbon monoxide – DLCO). Pro zhodnocení funkčního postižení je optimální 6minutový test chůze a průběžné hodnocení FEV1 [17]. Hodnota DLCO je léčbou málo ovlivnitelná. Bronchoalveolární laváž a vyšetření bronchoalveolární tekutiny pomáhá v diagnostice charakteristickým nálezem lymfocytární alveolitidy a indexem CD4/CD8 vyšším než 3 [3]. Jde také o významný zdroj informací o patofyziologii nemoci.
Obr. 3. Skiagram hrudníku u sarkoidózy stadia I 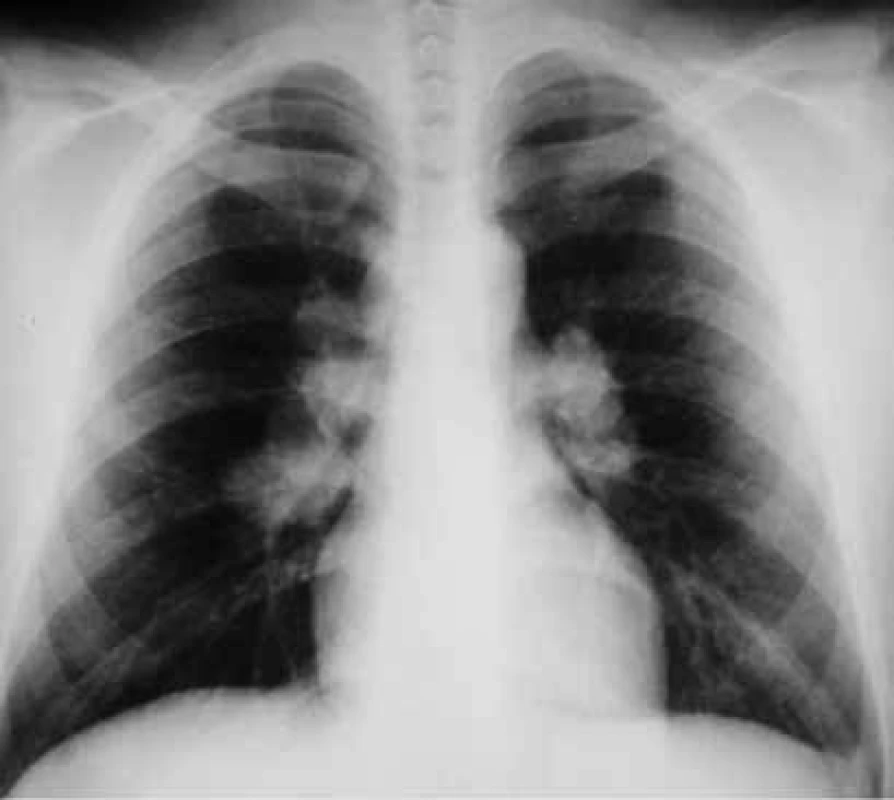
Diferenciální diagnostika
Diferenciálně diagnosticky se často uvažuje o lymfomu, který může i koincidovat [22]. Jinak je třeba především vyloučit tuberkulózu nebo netuberkulózní mykobakteriózu a také jiné granulomatózy, jako granulomatózu s polyangiitidou, eozinofilní granulomatózu s polynagiitidou, bronchocentrickou granulomatózu apod [1]. Velmi podobné projevy má nekrotizující sarkoidní granulomatóza, kterou někteří považují za variantu sarkoidózy. Granulomy se jinak vyskytují u celé řady jiných nemocí (exogenní alergická alveolitida, granulomatóza z Langerhansových buněk atd) [23].
Léčba
Léčba sarkoidózy vychází ze dvou důležitých faktů. Jedním je skutečnost, že etiologie nemoci zůstává nepoznána, druhým je empirická zkušenost, že nemoc často ustupuje spontánně (schéma) [17,20,29]. Rozhodnutí o léčbě vyžaduje často multidisciplinární přístup a dlouhodobější zkušenosti. V praxi je léčeno asi 40–60 % nemocných, reálná potřeba léčby je zřejmě menší [17,24]. Ke spontánní remisi dochází zpravidla během prvních 6 měsíců, ale až 3 let [17]. Je to u 60–90 % pacientů stadia I, u 40–70 % ve stadiu II a u 10–20 % ve stadiu III [2]. Včas nepoznaná nebo nevhodně léčená sarkoidóza může u 20–30 % nemocných přejít do chronického stadia a směřovat k závažným poruchám zdraví nebo předčasné smrti [24]. Nelze však tvrdit, že intenzivně léčená nemoc se dá vždy zastavit, protože doposud není známa efektivní antifibrotická léčba. K recidivám dochází asi u 5 % nemocných během 1. roku, používá se také pojem exacerbace [17].
Schéma. Léčebné schéma sarkoidózy. 
NSA – nesteroidní antiflogistika Upraveno podle [2,29] Kortikosteroidy
Lékem první volby jsou perorální kortikosteroidy používané již přes 50 let jako protizánětlivá léčba [25,26]. Před zahájením léčby kortikosteroidy je vždy nutné individuální posouzení rozsahu nemoci a celkového stavu pacienta. Indikace i dávky se v poslední době spíše omezují a také se zvažuje přínos u přítomných symptomů nad známými vedlejší účinky [1,20,24,27]. Podle většiny doporučení jsou léčeni symptomatičtí pacienti (především pro dušnost, dále i pro kašel nebo bolesti na hrudníku) s postižením plicních funkcí a všichni pacienti s těžkou poruchou plicních funkcí. Iniciální dávka kortikoidů byla ve starších doporučeních obvykle 0,5 mg/kg tělesné hmotnosti prednisonu nebo 0,4 mg/kg metylprednisolonu [1,2,28]. Dle Standardu České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně (ČPFS) (tab. 1) se nedoporučuje dávka > 40 mg a v některých doporučeních se objevuje pouze 20 mg [17,20,28]. Efekt léčby se vyhodnocuje obvykle po 3 měsících. Při pozitivní léčebné odezvě se pomalu snižuje dávka prednisonu na 5–10 mg denně a pokračujeme do celkové doby podávání 6–12 měsíců [28]. Určení aktivity a nutnosti podávání kortikosteroidů je poměrně obtížné, mohou pomoci biomarkery (SACE, IL2R, neopterin), rozhodující jsou ale symptomy (hlavně dušnost) a funkční vyšetření [17]. Podíl zánětlivých a fibrózních změn lze hodnotit i dle HRCT a PET/CT.
Tab. 1. Léčba plicní formy sarkoidózy. Doporučený postup ČPFS. 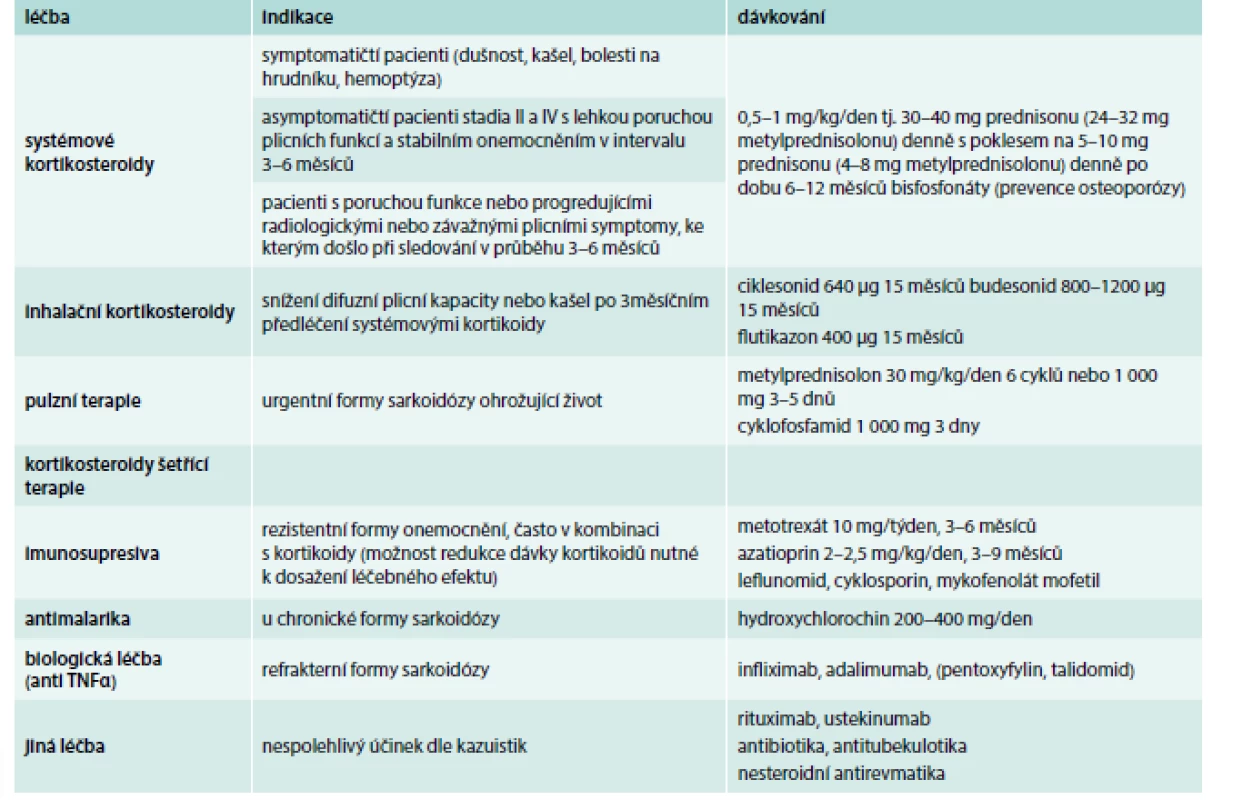
Upraveno podle [28] Při recidivě (exacerbaci) nemoci se doporučuje navýšit dávku kortikosteroidů na 20 mg prednisonu [20]. Pokud se nedostaví pozitivní efekt kortikoterapie po 3–6 měsících léčby a nemoc progreduje, může být označena jako kortikorefrakterní se závěrem, že se jedná se o onemocnění s významným podílem fibrózy [17]. Pak je možné zkusit přidat jiné léky nebo léčbu ukončit. Je však obtížné prohlásit, že všechny změny jsou ireverzibilní, a i u stadia IV přetrvává dle PET/CT zánětlivá aktivita, což může být výzvou k léčbě [20]. U nemocných, u nichž nebyla léčba podána ihned, je pacient sledován v intervalu 3 měsíců a léčba se zahajuje při progresi funkční poruchy a radiologických změn nebo pro nové symptomy během sledování. Indikace kortikoterapie je nesporná při závažných orgánových lézích, jako jsou neurosarkoidóza, sarkoidóza srdce, zadní uveitida nebo torpidní kožní léze. U hyperkalcemie ev. hyperkalciurie ověřené měřením odpadu kalcia je vyšší riziko nefrolitiázy a kortikoterapie se zvažuje individuálně [20,29]. Z důvodů steroidy indukované osteoporózy je možné u starších pacientů preventivně podávat bisfosfonáty. Rozvinutý nodózní erytém se léčí nesteroidními antiflogistiky, ev. lokálně kortikoidy. Výjimečně lze krátkodobě podat systémové kortikoidy (na dobu 3 měsíců) [2]. Lokální terapie kortikoidy je indikována u kožní formy (lupus pernio, nodózní erytém), přední a zadní uveitidy a neuritidy optiku (zde společně se systémovými kortikoidy) nebo při postižení dýchacích cest. Terapii inhalačními kortikoidy je možné jako alternativu indikovat pouze při plicním postižení s izolovaným snížením difuzní plicní kapacity nebo při kašli, a to vždy po 3měsíčním předléčení systémovými kortikoidy [17,29]. Pulzní podávání kortikosteroidů je potřebné u neurosarkoidózy nebo jiných rychle progredujících forem (tab. 2) [28].
Tab. 2. Léčba mimoplicní formy sarkoidózy. 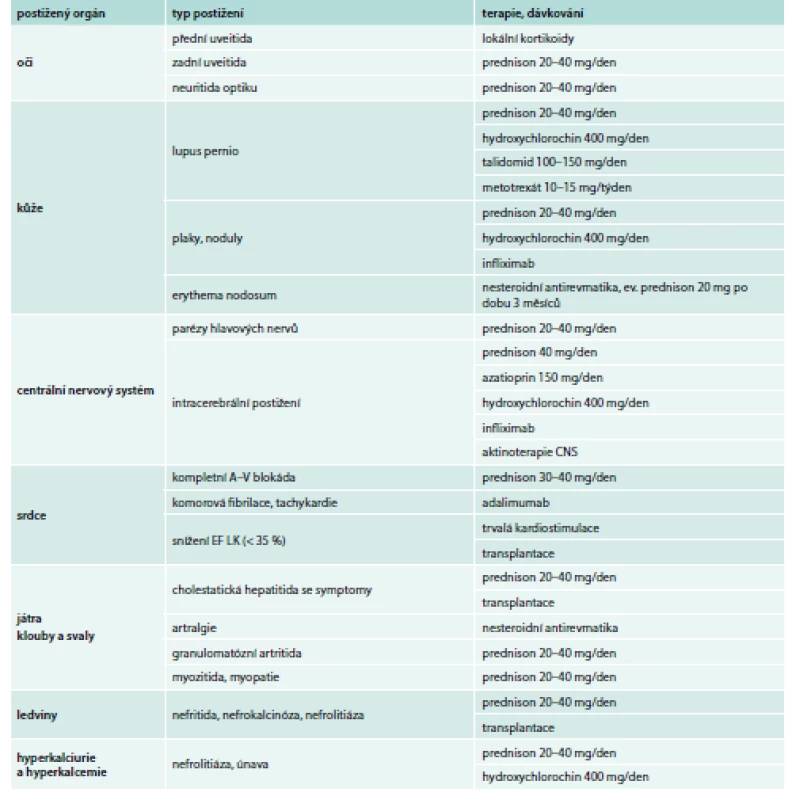
Doporučený postup ČPFS. Upraveno podle [28] Kortikosteroidy šetřící léky – druhá linie léčby
Při neúspěchu kortikoterapie se přidávají léky, které potencují účinek léčby a umožní snížit dávku kortikosteroidů. Jsou nazývány také modifikující antisarkoidové léky [17]. V monoterapii se podávají při intoleranci kortikosteroidů. Lékem volby je v těchto indikacích je metotrexát (MTX), který Je podáván týdně v dávce 10–15 mg současně s podáváním kyseliny listové [30]. Dále se MTX s efektem užívá u kožní a oční formy postižení. Dalším lékem je antimalarikum hydroxychlorochin, a to zvláště u pacientů s hyperkalcemií, kožním a neurologickým postižením [17,20]. Z imunosupresiv se v případě chronických a multiorgánových forem onemocnění používá azatioprin, mnohem méně leflunomid, cyklosporin a mykofenolát mofetil. Cyklofosfamid lze použít pulzním způsobem v léčbě neurosarkoidózy [17,31]. Vedlejší účinky léčby druhé linie jsou větší než u kortikoterapie, např. u MTX jsou jaterní či plicní toxicity pozorovány v 5 % případů[30].
Biologická léčba – třetí linie léčby
V etiopatogenezi sarkoidózy hraje významnou roli TNFα a v léčbě se používají látky inhibující tento cytokin a působící útlum zánětu. Jako první lék byl užit talidomid, zejména při léčně kožní formy sarkoidózy – lupus pernio [17]. Spíše sporný význam má pentoxyfylin, a to pro zabránění recidiv [17]. U refrakterních forem sarkoidózy včetně neurosarkoidózy byly mezi specifickými blokátory TNFα ověřovány adalimumab, golimumab a etanercept, nejvíce se prosadil infliximab [17,32]. S ním bylo publikováno mnoho kazuistik a byly provedeny 2 dvojitě slepé randomizované studie. Byl prokázán výrazný klinický efekt při léčbě lupus pernio a zlepšení plicních funkcí a infliximab se zařadil mezi reálně používané léky sarkoidózy [32,33]. Adalimumab vykázal příznivý efekt u sarkoidózy myokardu [21]. U golimumabu byl zjištěn jen minimální efekt na kožní formy a studie s etanecerptem byly negativní [34]. Bohužel i léčba blokátory TNFα s sebou nese výrazné nežádoucí účinky a v některých případech může být neefektivní.
Jiná léčba
Rituximab je monoklonální protilátka proti CD20+ B-lymfocytům. Její účinnost byla ověřena v kazuistických studiích a malé studii fáze I/II [35]. Zkoušen byl i ustekinumab – specifický inhibitor IL12/IL23 byl zkoušen ve dvojitě zaslepené studii u kožní a chronické sarkoidózy [34]. Výsledek ale nebyl přesvědčivý. Probíhají studie s podáváním 4kombinace antimykobakteriálních látek (levofloxacin, etambutol, azitromycin a rifampicin) s dlouhodobě působícím adrenokortikotropním hormonem nebo atorvastatinem [24]. Účinek kombinace minocyklinu a olmesartanu s omezením vitaminu D nebyl doložen [28]. V pokročilých fázích refrakterního plicního postižení se indikuje dlouhodobá domácí oxygenoterapie a případně transplantace plic. Transplantace se provádí i u sarkoidózy jater, ledvin a srdce [4,17]. Postižení mozku lze řešit radioterapií CNS, postižení srdce se řeší trvalou kardiostimulací. Problémem posuzování úspěšnosti terapie je velké procento spontánních remisí a značná fenotypová různorodost nemoci. Z těchto důvodů FDA schválila jako léčebný postup pouze podávání kortikosteroidů [17]. Z uvedeného vyplývá, že léčba je velmi individuální a každý návrh léčebného schématu je limitován nedostatkem větších randomizovaných studií u různých fenotypů onemocnění. Přesto lze očekávat, že se u sarkoidózy bude v léčbě stále více prosazovat racionální personalizace.
Závěr
Sarkoidóza je nadále jedním z nevyřešených problémů současné medicíny. Postupně se vyčleňují další stavy se známou příčinou tvorby granulomu, ale sarkoidóza sama má nadále etiologii neznámou. V diagnostice je důležitým trendem snížení invazivity při průkazu granulomu v tkáni. Léčba je nutná u méně než poloviny nemocných, může mít několik linií a začíná se personalizovat.
prof. MUDr. Vítězslav Kolek, DrSc.
vitezstav.kolek@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a
FN Olomouc
www.fnol.cz
Doručeno do redakce 16. 8. 2017
Přijato po recenzi 26. 9. 2017
Zdroje
1. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med 1999; 160(2): 736755. Dostupné z DOI: <http://dx.doi.org/10.1164/ajrccm.160.2.ats4–99>.
2. Kolek V et al. Sarkoidóza. Známé a neznámé. Grada: Praha 1998. ISBN 80–7169–468–1.
3. Kolek V. Sarkoidóza – dosud nepoznaná (1). Interní Med 2007; 9(6): 276279.
4. Kolek V. Sarkoidóza – dosud nepoznaná (2). Interní Med 2007; 9(7–8): 310313.
5. Ramstein J, Broos CE, Simpson LJ et al. IFN-γ-Producing T-Helper 17.1 Cells Are Increased in Sarcoidosis and Are More Prevalent than T-Helper Type 1 Cells. Am J Respir Crit Care Med 2016; 193(11): 1281–1291. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201507–1499OC>.
6. Kriegova E, Fillerova R, Tomankova T et al. T-helper cell type-1 transcription factor T-bet is upregulated in pulmonary sarcoidosis. Eur Respir J 2011; 38(5): 1136–1144. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00089910>.
7. Petřek M, Drábek J, Kolek V et al. CC Chemokine Receptor Gene Polymorphisms In Czech Patients With Pulmonary Sarcoidosis. Am J Respir Crit Care Med 2000; 162(3 Pt 1): 1000–1003.
8. Esteves T, Apaicio G, Garcia-Patos V. Is there any association between Sarcoidosis and infectious agents?: a systematic review and meta-analysis. BMC Pulm Med 2016; 16(1):165. Dostupné z DOI: <http://dx.doi.org/10.1186/s12890–016–0332-z>.
9. Moller DR, Koth LL, Maier LA et al. Rationale and Design of the Genomic Research in Alpha-1 Antitrypsin Deficiency and Sarcoidosis (GRADS) Study. Sarcoidosis Protocol. Ann Am Thorac Soc 2015; 12(10): 1561–1571. Dostupné z DOI: <http://dx.doi.org/10.1513/AnnalsATS.201503–172OT>.
10. Izbicki G, Chavko R, Banauch GI et al. World Trade Center “Sarcoid-Like” Granulomatous Pulmonary Disease in New York City Fire Department Rescue Workers. Chest 2007; 131(5): 1414–1423.
11. Metyas SK, Tadros RM, Arkfel DG. Adalimumab-induced noncaseating granuloma in the bone marrow of a patient being treated for rheumatoid arthritis. Rheumatol Int 2009; 29(4): 437–439. Dostupné z DOI: <http://dx.doi.org/10.1007/s00296–008–0691–8>.
12. Wahlström J, Dengjel J, Winqvist O et al. Autoimmune T cell responses to antigenic peptides presented by bronchoalveolar lavage cell HLA-DR molecules in sarcoidosis. Clin Immunol 2009; 133(3): 353–363. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clim.2009.08.008>.
13. Martinetti M, Tinelli C, Kolek V et al: “The sarcoidosis map”: A joint survey of clinical and immuno-genetic findings in two european countries. Am J Resp Crit Care Med 1995; 152(2): 557–564.
14. Berlin A, Fogdell-Hahn A, Olerup O et al. HLA-DR Predicts the Prognosis in Scandinavian Patients with Pulmonary Sarcoidosis. Am J Respir Crit Care Med 1997; 156(5): 1601–1605.
15. Zhou T, Zhang W, Sweiss NJ et al. Peripheral blood genes expression as a novel genomic biomarker incomplicted sarcoidosis. PloS One 2012; 7: e44818. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0044818>.
16. Fingerlin TE, Hamzeh N, Maier LA. Genetics of Sarcoidosis. Clin Chest Med 2015; 36(4): 569–584. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ccm.2015.08.002>.
17. Korsten P, Strohmayer K, Baughman et al. Refractory pulmonary sarcoidosis: Proposal of a definition and Recommendation for the Diagnostic and threapeutic appoach. Clin Pulm Med 2016; 23(2): 67–75.
18. Baughman R, Teirstein A, Judson M et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164(10 Pt 1): 1885–1889.
19. Zurkova M, Turkova M Tichy T et al: Sarcoidosis of female reproductive organs in a postmenopausal woman: a case report and review of the literature: is there a potential for hormone therapy? Menopause 2015; 22(5): 549–553. Dostupné z DOI: <http://dx.doi.org/10.1097/GME.0000000000000347>.
20. Amin EN, Closser DR, Crouser ED. Current best practice in the management of pulmonary and systemic sarcoidosis. Ther Adv Respir Dis 2014; 8(4): 111–132.
21. Miller CT, Sweiss NJ, Lu Y. FDG PET/CT evidence of effective treatment of cardiac sarcoidosis with adalimumab. Clin Nucl Med 2016; 41(5): 417–418. Dostupné z DOI: <http://dx.doi.org/10.1097/RLU.0000000000001124>.
22. Kolek V, Žurková M, Loštáková V et al. Syndrom koincidence sarkoidózy a lymfomu. Stud Pneumol Phthiseol 2011; 71(3): 120–128.
23. Kolek V. Granulomatózy – současný pohled na etiopatogenezi a klinický význam. Stud Pneumol Phthiseol 2006; 66(4): 147–148.
24. Baughman RB, Grutters JC. New treatment strategies for pulmonary sarcoidosis: antimetabolites, biological drugs, and other treatment approaches. Lancet Resp Med 2015; 3(10): 813–822. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–2600(15)00199-X>.
25. Brun J, Kofman J, Faivre JM. Le traitement corticonique de le sarcoidose médiastinopulmonaire: necessité d´un traitement précoce et place de I’A.C.T.H. terapie (d’apreś un bilan de 75 observations). Poumon Coeur 1972; 28(7): 321–331.
26. Hoyle C, Dawson J, Mather G. Treatment of pulmonary sarcoidosis with streptomycin and cortisone. Lancet 1955; 268(6865): 638–643.
27. Young RL, Harkleroad LE, Lordon RE et al. Pulmonary sarcoidosis: a prospective evaluation of glucocorticoid therapy. Ann Intern Med 1970; 73(2): 207–212.
28. Loštáková V, Kolek V, Vašáková M. Sarkoidóza – doporučený postup diagnostiky, terapie a sledování vývoje onemocnění. Doporučené postupy ČPFS. 2. vyd. 2016 : 270–290. Dostupné z WWW: <http://www.pneumologie.cz/guidelines/>.
29. Baughman RP, Nunes H, Sweiss N et al. Established and experimental medical therapy of pulmonary sarcoidosis. Eur Respir J 2013; 41(6): 1424–1438. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00060612>.
30. Baughman RP, Winget DB, Lower EE. Methotrexate is steroid sparing in acute sarcoidosis: results of a double blind, randomized trial. Sarcoidosis Vasc Diffuse Lung Dis 2000; 17(1): 60–66.
31. Baughman RP, Lower EE. Leflunomide for chronic sarcoidosis. Sarc Vasc Diff Lung Dis 2004; 21(1): 43–48.
32. Baughman RP, Judson MA, Costabel U et al. Randomised, double blind, placebo controlled trial of infliximab in patients with chronic pulmonary sarcoidosis. Chest 2005; 128(4 Suppl): S202. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.128.2.1062>.
33. Baughman RP, Shipley R, Desai S et al. Changes in chest rentgenogram of sarcoidosis patients during a clinical trial of infliximab therapy: comparison of different methods of evaluation. Chest 2006; 136(2): 526–535. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.08–1876>.
34. Judson MA, Baughman RP, Costabel U et al. Safety and efficacy of ustekinumab or golimumab in patients with chronic sarcoidosis. Eur Respir J 2014; 44(5): 1296–1307. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00000914>.
35. Sweiss NJ, Lower EE, Mirsaeidi M et al. Rituximab in the treatment of refractory pulmonary sarcoidosis. Eur Respir J 2014; 43(5): 1525–1528. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00224513>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Současná náplň pneumologieČlánek Nozokomiální pneumonieČlánek Cystická fibróza dospělýchČlánek Nemalobuněčný karcinom plicČlánek Neinvazivní ventilace
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Současná náplň pneumologie
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy