-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Antitrombocytová tromboprofylaxia artériových vaskulárnych chorôb a orgánovaskulárnych ischemických chorôb
Antiplatelet thromboprophylaxis of arterial vascular diseases and organovascular ischemic diseases
Antiplatelet therapy by acetylsalicylic acid (ASA, aspirin) provided pivotal advances in the prevention and treatment of organovascular (angiovascular, cardiovascular, cerebrovascular, extremitovascular, renovascular, genitovascular, mesenteriointestinokolonovascular, bronchopulmovascular, oculovascular, otovascular and other) arterial ischemic diseases. Currently available antiplatelet drugs have some limitations which might be overcomed by improved dosing regimens, use of combination of agents affecting different platelet functions and, in particular, by the new antiplatelet drugs (new arterial antithrombotics) with distinct pharmacodynamic properties offering new advantages, including faster onset of action, greater potency, and reversibility of effects.
Key words:
arteriothromboprophylaxis – arterial thrombosis – classic antiplatelet drugs – new antiplatelet agents – organovascular arterial diseases
Autori: Peter Gavorník 1; Andrej Dukát 1,2; Ľudovít Gašpar 1,3; Eva Gavorníková 1,4; Naďa Hučková 1,5; Anna Petrášová 6; Gabriela Gubo 1; Iveta Gašparová 1,7; Lujza Sabolová 8
Pôsobisko autorov: Angiologická sekcia Slovenskej lekárskej komory, Bratislava, Slovenská republika 1; V. interná klinika LF UK a UNB, Bratislava, Slovenská republika 2; I. interná klinika LF UK a UNB, Bratislava, Slovenská republika 3; Ambulancia všeobecného lekárstva pre dospelých, Poliklinika Ružinov, Bratislava, Slovenská republika 4; III. interná klinika LFUK a UNB, Bratislava, Slovenská republika 5; Lekáreň Salvator, Prosalute, Modra, Slovenská republika 6; Ústav lekárskej biológie, genetiky a klinickej genetiky LF UK, Bratislava, Slovenská republika 7; Onkologický ústav svätej Alžbety, Bratislava, Slovenská republika 8
Vyšlo v časopise: Vnitř Lék 2017; 63(2): 124-132
Kategória: Doporučené postupy
Súhrn
Antitrombocytová liečba kyselinou acetylsalicylovou (ASA, aspirínom) viedla k zásadným pokrokom v prevencii a liečbe orgánovaskulárnych (angiovaskulárnych, kardiovaskulárnych, cerebrovaskulárnych, extremitovaskulárnych, renovaskulárnych, genitovaskulárnych, mezentériointestinokolonovaskulárnych, bronchopulmovaskulárnych, okulovaskulárnych, otovaskulárnych a ďalších) artériových ischemických chorôb. V súčasnosti dostupné antitrombocytové lieky (artériotromboprofylaktiká) však majú určité limitácie, ktoré by mohlo prekonať zlepšenie dávkovacích režimov, použitie kombinácií liekov s pôsobením na rôzne funkcie trombocytov a predovšetkým nové antitrombocytové lieky (nové artériové antitrombotiká) so zreteľnými farmakodynamickými účinkami, ktoré ponúkajú výhody rýchlejšieho nástupu, silnejšieho účinku, prípadne reverzibilného pôsobenia na trombocyty.
Kľúčové slová:
artériotromboprofylaxia – artériová trombóza – klasické antitrombocytové lieky – nové antitrombocytové lieky – orgánovaskulárne artériové chorobyÚvod
Hlavné orgánovaskulárne artériové ischemické choroby (OVAICH) – angiovaskulárne, kardiovaskulárne, cerebrovaskulárne, extremitovaskulárne, renovaskulárne; genitovaskulárne, splanchnikovaskulárne, bronchopulmovaskulárne, osteoartromuskulovaskulárne, okulovaskulárne, otovaskulárne, stomatovaskulárne a ďalšie orgánovaskulárne artériové ischemické choroby (tab. 1) sú dôležitou manifestáciou nielen systémovej aterosklerózy/aterotrombózy, ale aj iných základných artériových cievnych chorôb – arterioloskleróza; diabetická makroangiopatia; diabetická mikroangiopatia; Mönckebergova medioskleróza/mediokalcinóza; arteritídy – vaskulitídy; kompresívne artériové syndrómy; fibromuskulárna dysplázia artérií; cystická degenerácia adventície artérií; artériová trombóza; artériová embólia/tromboembólia; traumatické a posttraumatické arteriopatie; fyzikálne arteriopatie; chemické a toxické arteriopatie; iatrogénne oklúzie artérií; disekcia artérií; anomálie priebehu artérií; komplikovaná artériová aneuryzma; artériovo-vénová fistula a ďalšie zriedkavejšie cievne choroby (tab. 2) [1,2]. V Európe sa choroba považuje za zriedkavú (rare disease; orphan disease), ak postihuje menej ako 500 osôb na 1 milión resp. menej ako 5 osôb z každých 10 000, resp. menej ako 1 na 2 000 [1]. Európsky program ORPHANET buduje a prevádzkuje informačnú databázu o možnostiach diagnostiky a liečby zriedkavých chorôb. Stránka ORPHANET (www.orpha.net, resp. www.orphanet.sk) zahŕňa expertmi pripravenú encyklopédiu a tiež adresár kliník a klinických laboratórií, ktoré sú expertmi pre jednotlivé zriedkavé choroby. Prevalencia Fabryho choroby je napr. 1–5 na 10 000, ak sa berú do úvahy aj ľahšie a neskoršie sa manifestujúce varianty. V Slovenskej republike teda máme odhadom 500–2 500 nediagnostikovaných pacientov s Fabryho chorobou [1].
Tab. 1. Hlavné orgánovaskulárne artériové ischemické choroby – OVAICH; organovascular artery diseases – OVAD (morbus principalis) [1,2,10,17,26,35,41] ![Hlavné orgánovaskulárne artériové ischemické choroby – OVAICH; organovascular artery diseases – OVAD (morbus principalis) [1,2,10,17,26,35,41]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ea35cd140e964ba940c8ef8bd162c6e0.png)
Tab. 2. Etiológia orgánovaskulárnych ischemických chorôb (základná, kauzálna cievna artériová choroba – morbus fundamentalis; elementaris; causalis) [1,2,10,17,26,35,41] ![Etiológia orgánovaskulárnych ischemických chorôb (základná, kauzálna cievna artériová choroba – morbus fundamentalis; elementaris; causalis) [1,2,10,17,26,35,41]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/249f4372df59fcaaf73055ce5fd233e1.png)
MELAS – myopatia; encefalopatia; laktátová acidóza; stroke like epizódy CADASIL – cerebrálna autozómovo dominantná arteriopatia so subkortikálnymi infarktmi a s leukoencefalopatiou CARASIL – cerebrálna autozómovo recesívna arteriopatia so subkortikálnymi infarktmi a s leukoencefalopatiou CRV/HERNS – cerebroretinálna vaskulopatia a hereditárna endotelopatia s retinopatiou, nefropatiou a ischemickými mozgovými príhodami Angiológia/vaskulárna medicína je samostatná špecializácia internej medicíny, ktorá sa zaoberá všetkými medicínskymi aspektmi ciev a cievnych chorôb. Arteriológia sa venuje najmä chorobám artériového cievneho systému, mikrovaskulárna medicína sa zaoberá chorobami mikrociev (malých artérií, arteriol, kapilár, venúl, malých vén), flebológia rieši choroby vénového cievneho systému, lymfológia sa venuje chorobám lymfových ciev [1]. Sú to 4 hlavné angiologické subšpecializácie a bohužiaľ sú tendencie k ďalšej superšpecializácii.
Trombóza je intravitálne zrážanie krvi v cievach (intravaskulárna trombóza; angiotrombóza), tab. 2 alebo v dutinách srdca (intrakardiálna trombóza). Angiotrombóza, ktorá vzniká v artériách je artériová trombóza (E9), pri uvoľnení trombu a jeho pohybe do distálnejších častí tepnového systému ide o artériovú tromboembóliu (ATE; E10); artériovú tromboembolickú chorobu (ATECH). Angiotrombóza, ktorá vzniká v malých cievach sa presnejšie označuje ako mikrovaskulárna trombóza; mikroangiopatická trombóza [1–41]. Akútne trombotické a tromboembolické orgánovaskulárne komplikácie patria k hlavným príčinám súčasnej vysokej vaskulárnej morbidity a mortality – angiopandémia 3. milénia [1,2,10,17,26,27,35,41]. Na rozdiel od vénovej trombózy – flebotrombózy [1,4,27] sa v etiopatogenéze artériovej tromboembólie zúčastňujú predovšetkým trombocyty a dysfunkcia endotelu [1,2,4,5,26,35]. Treba zdôrazniť, že dysfunkcia endotelu a aktivácia trombocytov (angiohemostáza/angiotrombogenéza) majú ústredný význam aj pri vzniku a progresii všetkých stenotizujúco-obliterujúcich artériových cievnych chorôb, vrátane/nielen aterosklerózy/aterotrombózy (tab. 2). Artériová trombóza a vazospazmus (vazokonstrikcia) sú dva hlavné dynamické faktory akútnej instabilnej artériovej stenózy (obštrukcie) a príslušných akútnych instabilných orgánovaskulárnych ischemických chorôb (syndrómov) [1,2,10,17,26]. Z toho vyplýva, že antitrombocytové lieky (nazývané nesprávne aj ako antiagreganciá) by mali mať nielen antitrombogénne, ale aj angioprotektívne (vaskuloprotektívne) účinky [1–41].
Komplexné angiocentrum/komplexné vaskulárne centrum
Pacienti s akútnymi instabilnými orgánovaskulárnymi chorobami by mali byť čo najrýchlejšie transportovaní do komplexného angiocentra (ktorého súčasťou by mala byť angiovaskulárna jednotka, cerebrovaskulárna jednotka, kardiovaskulárna jednotka, končatinovocievna jednotka, splanchnikovaskulárna jednotka a prípadne ďalšie orgánovaskulárne jednotky) s okamžitou možnosťou komplexnej neinvazívnej a invazívnej cievnej a orgánovaskulárnej diagnostiky a urgentnej/emergentnej, kauzálnej, neinvazívnej aj invazívnej angiologickej (klasickej angiochirurgickej a/alebo endovaskulárnej) liečby. Je objektívne potrebné, aby sa v klinickej praxi efektívne využívali všetky možnosti dynamicky sa vyvíjajúcej angiológie/vaskulárnej medicíny a materiálno-technicky a personálne budovali moderné komplexné vaskulárne centrá, schopné neodkladne a efektívne riešiť akútne cievne príhody nielen v kardiovaskulárnej a cerebrovaskulárnej oblasti, ale v každej cievnej i v každej orgánovaskulárnej oblasti. Výber najvhodnejšieho terapeutického postupu a indikácie k invazívnej liečbe v angiocentrách by nemali byť výsadou jednotlivca. Je výsledkom vzájomnej diskusie referujúceho (ošetrujúceho) lekára, internistu-angiológa, angiochirurga a intervenčného vaskulárneho rádiológa („angiotrio“; „vascular team“), kardiológa, neurológa, všeobecného internistu, anesteziológa-intenzivistu a podľa potreby ďalších orgánových špecialistov (vaskulárny indikačný seminár – VIS). Na jej konci by malo byť odporúčanie pre pacienta, ako súčasť vaskulárneho indikačného protokolu (VIP) [1,2,10,17,35].
K prvej línii prevencie a liečby vaskulárnych a orgánovaskulárnych artériových chorôb patrí antitrombotická terapia, pod ktorou rozumieme všetky liečebné opatrenia, ktoré majú zabrániť vzniku trombózy, zamedziť progresii trombu a jeho embolizácii, a ktoré majú zlikvidovať už vzniknutý trombus. Rozdeľuje sa na 5 skupín: antitrombocytovú, fibrinolytickú (trombolytickú), antikoagulačnú, substitučnú a kombinovanú antitrombotickú liečbu [1,2,4,5,17,26,35].
Antitrombocytové antitrombotiká
Antitrombocytové (protidoštičkové) lieky; artériové antitrombotiká; artériotromboprofylaktiká sú samostatnou skupinou antitrombotík, ktoré sa používajú v primárnej a sekundárnej prevencii/liečbe artériovej a mikrovaskulárnej trombózy pri všetkých vaskulárnych artériových chorobách (tab. 2) a pri všetkých orgánovaskulárnych ischemických chorobách (tab. 1), pričom neustále narastá aj počet pacientov, ktorí sú po revaskularizačnej intervencii [1,26,29–41]. Sú to jednak pacienti po klasickej angiochirurgickej liečbe, najčastejšie pomocou bajpasu, napr. aorto-koronárneho bajpasu (coronary artery bypass graft – CABS, aorto-femorálneho bajpasu a i.) a jednak pacienti po perkutánnej transluminálnej endovaskulárnej angioplastike s implantáciou stentu. Dnes už len ojedinele sa intervenčný výkon skončí obyčajnou balónikovou angioplastikou bez stentu (plane old baloon angioplasty – POBA). Pri racionálnej antitrombocytovej antitrombotickej terapii musí lekár u každého pacienta individuálne hľadať optimálnu kompromisnú rovnováhu medzi rizikom retromboticko-ischemických komplikácií (vyššie dávkovanie a predlžovanie liečby) a medzi rizikom hemoragických komplikácií (nižšie dávkovanie a skracovanie liečby) [35,36]. Osobitnou, zvlášť náročnou problematikou, je optimalizácia antitrombocytovej antitrombotickej liečby pred kardiochirurgickou, či nekardiochirurgickou operáciou [36]. Antitrombocytové antitrombotiká sa delia na 2 základné skupiny: klasické a nové protidoštičkové lieky [1–5,10,35,36].
1. Klasické antitrombocytové lieky (klasické artériové antitrombotiká)
Podľa mechanizmov účinku sa klasické antitrombocytové lieky obvykle delia na 4 podskupiny (tab. 3).
Tab. 3. Klasické artériové antitrombotiká (klasické antitrombocytové lieky) [1,2,4,10,17,35] ![Klasické artériové antitrombotiká (klasické antitrombocytové lieky) [1,2,4,10,17,35]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/55581cc87f6d4098e9686059608a45fd.png)
1.1. Inhibítory cyklooxygenázy
Inhibítory cyklooxygenázy sú lieky, ktorí inhibujú enzým cyklooxygenázu (COX1), a tým tvorbu tromboxanu A2 (TXA2). Acetylsalicylová kyselina – ASA (Anopyrin, Aspirin protect, Cardioral, Preventax, Stadapyrin, Vasopirin) je najpoužívanejším antitrombocytovým liekom v klinickej medicíne. Účinok ASA je ireverzibilný a kompletný, už pri pomerne malej dávke (30 mg) zasiahne celú populáciu cirkulujúcich trombocytov a účinok trvá počas celého ich života (7–10 dní). Pri dlhotrvajúcej liečbe je účinná dávka 75–160 (325) mg denne. Pri tejto dávke nie je ovplyvnená cyklooxygenéza (COX2) v monocytoch a makrofágoch, nedochádza k potlačeniu tvorby prostacyklínu v endotelových bunkách, navyše pri vyšších dávkach stúpa aj riziko nežiaducich účinkov, predovšetkým gastrointestinálnych erózií a krvácania [4,5,15,28,29]. Veľký počet štúdií (prehľad 332 prác je uvedený v ostatnom vydaní konferencie ACCP) [4,5] potvrdil asi 25% redukciu relatívneho rizika vaskulárneho úmrtia, čo viedlo k zavedeniu ASA ako štandardného lieku pri primárnej i sekundárnej prevencii artériových stenotizujúco-obliterujúcich chorôb a orgánovaskulárnych ischemických chorôb. ASA je najčastejšou súčasťou kombinovanej antitrombotickej liečby a je súčasťou aj „polypill“, napr. s betablokátorom bisoprololom (Betapres 5 mg/75 mg tbl). V súčasnosti nie je ASA v primárnej prevencii bez dôkazu orgánovaskulárnej choroby a jej ekvivalentu odporúčaná [4,5,15,35].
Dlho diskutovaným problémom je zlyhávanie antitrombocytovej antitrombotickej liečby (všeobecne alebo ASA), ktorý môže byť dôsledkom nonkompliancie (nonadherencie) pacienta k antitrombotickej liečbe a/alebo prejavom aspirínovovej rezistencie – fenomén klinickej neúčinnosti (zlyhania ASA v prevencii vzniku a recidívy artériovej trombózy, napr. vo forme akútnej kardiovaskulárnej choroby – akútneho koronárneho syndrómu – AKS, reoklúzie v oblasti implantovaného stentu a pod.) a/alebo fenomén laboratórnej neúčinnosti ASA (neschopnosť laboratórne dokázať inhibíciu trombocytových funkcií). V individuálnej odpovedi na liečbu ASA pravdepodobne majú význam prinajmenšom 3 gény, ktoré zatiaľ nie sú dostatočne prebádané. Prevalencia rezistencie pri liečbe ASA je 1–5 %, na základe stanovenia hladiny tromboxanu B2. Vysoká reaktivita trombocytov po perkutánnej koronárnej intervencii (PKI) dosahuje takmer 20 % [1–5,8,18,21,29–37]. V skutočnosti sa za fenoménom zlyhania prevencie vaskulárnej trombózy skrýva s veľkou pravdepodobnosťou aj komplexný problém endotelovej dysfunkcie, ktorú zatiaľ ani kvantitatívne, ani kvalitatívne štandardne neurčujeme.
Medzi lieky, ktoré reverzibilne inhibujú cyklooxygenázu (COX1), a tým aj tvorbu tromboxanu TXA2 (pri ukončení liečby sa obnovuje funkcia trombocytov do 24 hod) patrí indobufen (Ibustrin) 200 mg tbl a sulfinpyrazón (Anturan), ktorý má naviac aj urikozurický efekt (nie je u nás registrovaný) [35].
1.2. Antagonisty receptorov P2Y12 (tienopyridíny)
Tienopyridínové deriváty selektívne inhibujú trombocytový ADP receptor P2Y12, kľúčový pre signálnu aktiváciu, adhéziu a agregáciu trombocytov. Patrí sem tiklopidín (Aclotin, Ticlopidin) 250 mg tbl; a jeho 6krát účinnejší následník klopidogrel (Clopidogrel, Clopigamma, Egitromb, Trombex, Zyllt) 75 mg tbl, zároveň s menším rizikom nežiaducich účinkov, najmä neutropénie a trombotickej trombocytopenickej purpury (TTP). Inhibícia trombocytov závisí od dávky, pričom účinné potlačenie funkcií sa dosiahne po 2–3 dňoch užívania 500 mg tiklopidínu alebo 75 mg klopidogrelu. Blokáda je ireverzibilná, nie je ovplyvniteľná trombocytovým koncentrátom, funkcia sa upravuje 7 dní po vynechaní klopidogrelu. Postupy pre použitie klopidogrelu sa neustále prehodnocujú a inovujú, keďže ostatné štúdie prinášajú nové výsledky i prekvapenia pri duálnej antitrombocytovej liečbe – APDT; DAPT (kombinácia kyselina acetylsalicylová a klopidogrel) i pri tripletnej antitrombocytovej liečbe – APTT; TAPT (naviac aj cilostazol alebo antagonista GPIIb/IIIa receptorov) a tiež pri tripletnej kombinovanej antitrombotickej liečbe (okrem ASA a klopidogrelu buď warfarín alebo nové non-VKA antikoagulačné lieky – NOAC; direct oral anticoagulants – DOAC) [1–5,18–23,35,36].
Klopidogrelová rezistencia sa popisuje u 10–33 % pacientov. Na variabilite odpovede na liečbu klopidogrelom sa zúčastňujú genetické i environmentálne faktory, ktoré ovplyvňujú najmä absorpciu a/alebo rozsah metabolizmu klopidogrelu. K hlavným faktorom, ktoré ovplyvňujú farmakodynamickú odpoveď na klopidogrel, patrí: znížená absorpcia, napr. u nositeľov mutácie génu ABCB1 (ATP-binding cassette subfamily B member 1), kódujúceho P-glykoproteín; polymorfizmy cytochrómu P-450 (CYP2C19 a iné CYP izoformy), ktoré spôsobujú variabilnú dostupnosť aktívneho metabolitu klopidogrelu; interakcia s inými liekmi, vrátane niektorých inhibítorov protónovej pumpy (napr. omeprazol), lipofilných statínov, blokátorov kalciových kanálov a iných liekov; vopred existujúca variabilita v odpovedi na adenozíndifosfát (ADP); vyšší vek [38]; nadhmotnosť až obezita; diabetes mellitus, chronická obličková choroba (CKD); multifaktoriálna patogenéza artériovej endotelovej dysfunkcie a artériovej tromboembólie, hypersenzitivita a ďalšie [1–5,8,35,36,39]. Jednou z možností používaných pri antitrombocytovej duálnej liečbe (APDT; DAPT) na dosiahnutie optimálnej inhibície reaktivity trombocytov je zvýšenie dávky klopidogrelu. Inou možnosťou efektívnejšej antitrombocytovej antitrombotickej liečby u osôb s nízkou odpoveďou na liečbu je použitie nových antitrombocytových liekov a prípadne individualizovaná (personalizovaná) liečba „šitá na mieru“ s výmenou medzi jednotlivými antitrombocytovými liekmi („switching“ – „svičovanie“), čo prináša do klinickej praxe nové zložité problémy, najmä pre zatiaľ nedostatočnú medicínu dôkazov (EBM) [34–36,40].
1.3. Antagonisty receptorov GPIIb/IIIa (αIIbβ3); blokátory trombocytových fibrinogénových receptorov
Antagonisty receptorov GPIIb/IIIa (tzv. skutočné antiagreganciá) sú treťou skupinou klasických antitrombocytových liekov, ktorej vývoj bol inšpirovaný Glanzmanovou trombasténiou, pri ktorej tento receptor chýba [4,5]. V súčasnosti sa používajú 3 lieky na parenterálne intravénové použitie. Abciximab (ReoPro) je Fab fragment monoklonálnych myších protilátok proti humánnemu glykoproteínu IIb/IIIa. Eptifibatid (Integrilin 0,75 mg; 2 mg/ml amp) je cyklický heptapeptid, obsahujúci sekvenciu Lys-Gly-Asp. Tirofiban (Aggrastad) je nepeptidický tyrozínový derivát s nízkou molekulovou hmotnosťou, ktorého štruktúra napodobňuje sekvenciu Arg-Gly-Asp na molekule fibrinogénu, ktorá zodpovedá za jeho väzbu na receptor GPIIb/IIIa. Spolu s nárazovou liečbou klopidogrelom majú svoje miesto v neivazívnej liečbe akútnych cievnych trombotických príhod, najmä v koronárnej oblasti cirkulácie u vysokorizikových osôb. K hlavným nežiaducim účinkom patrí krvácanie a trombocytopénia. V predklinickom sledovaní je Z4A5 [35].
1.4. Inhibítory fosfodiesterázy (PDE3) a akcelerátory zvyšovania cAMP v trombocytoch blokádou konverzie cAMP na neaktívny AMP
Ide o 4. skupinu klasických artériových antitrombotík.
Dipyridamol nemá samotne podávaný lepšie výsledky ako ASA a klopidogrel. Dvojkombinovaný liek dipyridamol 200 mg + 25 mg acetylsalicylovej kyseliny (Aggrenox 200/25 mg tbl) sa uprednostňuje pri sekundárnej prevencii NCMP [12,24].
Cilostazol (Cilostazol, Cilozek, Noclaud, Pladizol) je chinolínový derivát, inhibujúci fosfodiesterázu (PDE3) a pôsobiaci ako vazodilatátor, má aj účinok na plazmatické lipidy (znižuje triacylglyceroly a zvyšuje HDL-cholesterol). Je schválený americkým FDA už od roku 1999 pre liečbu končatinovocievnej artériovej choroby. Porovnávacia štúdia cilostazolu a pentoxifylínu, ktoré sú v USA schválené na liečbu končatinovocievnej artériovej choroby, preukázala vyššiu účinnosť cilostazolu [25]. V súčasnosti je cilostazol súčasťou tripletnej antitrombocytovej liečby aj v iných orgánovaskulárnych oblastiach [2,16].
Triflusal (Disgren) má napriek štruktúrnej i funkčnej podobnosti s acetylsalicylovou kyselinou, vrátane ireverzibilnej blokády cyklooxygenázy (preferenčne COX2), viacero odlišností. Jeho hlavný metabolit – kyselina hydroxytrifluormetylbenzoová (HTB) inhibuje fosfodiesterázu a zvyšuje obsah cAMP v trombocytoch [1–5]. U nás bol deregistrovaný.
Slabšie antitrombocytové antitrombotické účinky majú aj niektoré vazoaktívne lieky, napr. naftidrofuryl (Enelbin 100 ret tbl) blokuje serotonínové receptory typu 5-HT2; molsidomín (Corvaton, Corvaton forte, Corvaton retard tbl) zvyšuje cGMP v trombocytoch, obdobne ako niektoré vazodilatačné prostanoidy – alprostadil (Prostavasin 20 μg amp pro inf.; Alprostan 0,1 mg amp pro inf [1–5,35].
2. Nové antitrombocytové lieky (nové artériové antitrombotiká)
Vývoj nových protidoštičkových liekov dnes smeruje ku komplexnejšiemu potlačeniu funkcií trombocytov. Podľa mechanizmu účinku sa rozdeľujú do minimálne 6 podskupín [1–5] (tab. 4).
Tab. 4. Nové artériové antitrombotiká (nové antitrombocytové lieky) [1,2,4,10,17,35] ![Nové artériové antitrombotiká (nové antitrombocytové lieky) [1,2,4,10,17,35]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2dbdec8bad45563afd3c134ce5c736ed.png)
2.1. Inhibítory adhézie trombocytov
sa zatiaľ v klinickej praxi nepoužívajú. Možno ich rozdeliť na 3 špecifické podskupiny: antagonisty von Willebrandovho faktora (vWF) sú väčšinou v II. fáze klinického skúšania (AJW200; ARC1779; ALX-0081; ALX-0681), v predklinickom skúšaní je ARC15105; a 82D6 A3. Antagonisty receptoru GPVI nedávno úspešne ukončili I. fázu klinického skúšania. Do tejto podskupiny patrí PR-15 (revacept) a DZ-697b. Antagonisty receptoru GPIb, napr. h6B4-Fab; GPGP-290; SZ2 sú v predklinickom sledovaní.
2.2. Inhibítory TP (tromboxán A2/prostaglandín H2) receptorov
Klinické skúšanie vapiprostu sa zastavilo pre neúčinnosť v prevencii artériovej restenózy, novší terutroban je derivát 2-aminotetralínu s prolongovaným účinkom, ktorý v predklinických skúškach ukázal trojaký (antitrombotický, vazodilatačný a antisklerotický) účinok. V súčasnosti prebieha už III. fáza klinického skúšania v sekundárnej prevencii artériovej trombózy. V I. fáze je Z-335, v predklinickom sledovaní je BM-573.
2.3. Kombinované inhibítory tromboxán-syntetázy a TP receptorov
Takúto kombinovanú inhibíciu spôsobujú 3 prípravky. Terbogrel je orálne účinná látka, ktorej klinické skúšanie bolo zastavené v II. fáze pre nežiaduce účinky (bolesti v dolných končatinách). Ridogrel je aminooxypentanová kyselina, používaná aj v liečbe zápalových črevných chorôb. Pikotamid znižoval kardiovaskulárnu mortalitu u diabetikov s končatinovocievnou artériovou chorobou. V ostatných ACCP odporúčaniach nie sú uvedené [4].
2.4. Inhibítory trombínových (PAR-1, PAR-4) receptorov
Okrem inhibície „proteázami aktivovaných receptorov“ a následnej inhibície agregácie trombocytov potláčajú aj uvoľnenie a expresiu zápalových mediátorov, čím blokujú účasť zápalu na aterogenéze. SCH 530348 (Voraparax) – syntetický analóg himbacínu, mal zastavený vývoj v III. fáze klinického skúšania pre vysoký výskyt intrakraniálneho krvácania. E5555 (Atoparax) je v II. fáze. V predklinickom sledovaní sa ďalšie dve látky tejto skupiny: SCH 205831, SCH 602539.
2.5. Nové antagonisty receptorov P2Y12
Nové antagonisty receptorov P2Y12 (tab. 5) sú snáď najviac v súčasnosti sledovanou skupinou antitrombocytových liekov [1–23,35,36,40].
Tab. 5. Základné vlastnosti antagonistov P2Y12 receptorov. 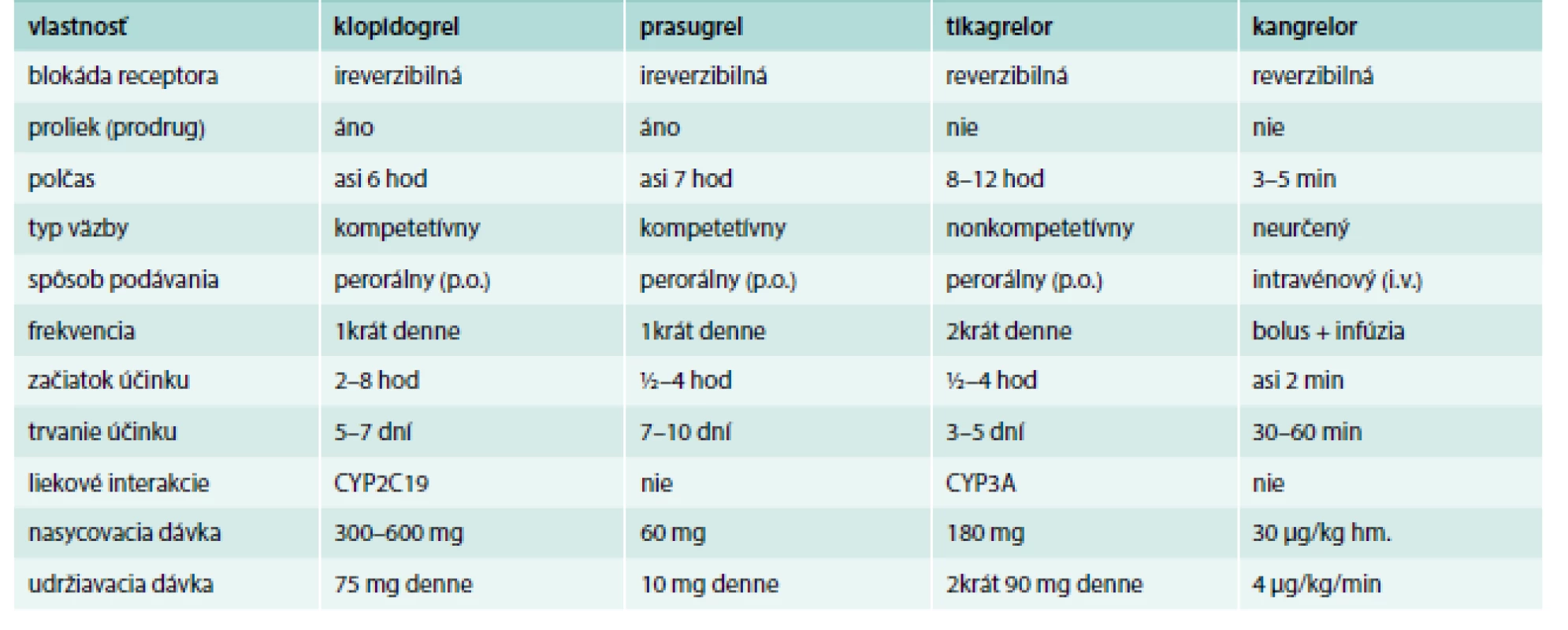
Upravené podľa [36,40] Tikagrelor (Brilique) 90 mg tbl, je reverzibilný inhibítor, indikovaný pri akútnych koronárnych syndrómoch. Liečba sa má začať iniciálnou dávkou 180 mg (2 tbl) a potom sa má pokračovať v dávke 2krát 1 tbl denne. Súčasne sa podáva ASA [5,36,40]. Prasugrel (Efient 5 mg; 10 mg tbl) je ireverzibilný tienopyridínový derivát, účinnejší než klopidogrel, ktorý je indikovaný pri akútnych koronárnych syndrómoch, pri primárnej perkutánnej koronárnej intervencii (p-PCI). Liečba sa zahajuje obvykle jednorazovou nárazovou dávkou 60 mg užitou nalačno a potom sa pokračuje v dávke 1 tbl (10 mg) 1krát denne. Pacienti užívajúci tento liek majú tiež denne užívať ASA v dávke 75 mg až 325 mg [5,36,40]. Kangrelor (Kengrexal 50 mg pro inf) je nedávno (23. 3. 2015) registrovaný selektívny priamy a reverzibilný inhibítor P2Y12 receptora na intravénovú aplikáciu s rýchlym nástupom účinku a biologickým polčasom 3–5 min. Účinok trvá asi 30–60 min, čo môže byť výhodou pri perkutánnych koronárnych intervenciách (PCI) vyžadujúcich urgentný chirurgický výkon [1,2,5,13,14,18–23,36,40]. Klopidogrel a prasugrel možno podať až po skončení infúzie s kangrelorom, zatiaľ čo tikagrelor možno podať pred, počas i po infúzii s kangrelorom [40]. V klinickom skúšaní sú aj ďalšie, napr. elinogrel (na intravénové i perorálne podanie).
2.6. Nové perorálne inhibítory GPIIb/IIIa (αIIbβ3) receptorov
Na rozdiel od vysokoúčinných intravénových antagonistov GPIIb/IIIa, štúdie s perorálnymi prípravkami (xemilofiban, orbofiban, sibrafiban, lotrafiban), ktoré zahŕňali asi 40 000 pacientov, neukázali vyššiu účinnosť oproti ASK, ani v kombinácii s ASK nemali vyššiu účinnosť ako placebo. Celkovo sa pozoroval aj vyšší výskyt krvácania [1–5,21,35].
Stratifikácia retrombózy a akútnych orgánovaskulárnych ischemických chorôb vs stratifikácia rizika hemoragických komplikácií
Treba zdôrazniť, že vždy v rámci rozhodovania o začatí antitrombotickej liečby, antitrombocytovej duálnej terapii (APDT; DAPT) a jej zmene a výmeny medzi jednotlivými antitrombocytovými liekmi („switching“ – „svičovanie“) je potrebné urobiť u pacienta s akútnymi orgánovaskulárnymi chorobami, vrátane akútnych koronárnych syndrómov (AKS) a náhlych cievnych mozgových príhod (NCMP), stratifikáciu rizika trombotických ischemických komplikácií, vrátane rizika trombózy stentu napr. MACCE (Major Adverse Coronary/Cerebral Events) oproti riziku krvácavých komplikácií (KRK) – malé, veľké, život ohrozujúce, smrteľné krvácania z APDT (DAPT). V bežnej klinickej praxi sú pre túto stratifikáciu dostupné a dobre známe skórovacie algoritmy (napr. GRACE, TIMI vs CRUSADE, HAS-BLED a pod). Začatie, zmena – výmena jednotlivých liekov už nastavenej antitrombotickej liečby (svičovanie) a trvanie antitrombotickej terapie je najmä klinickým rozhodnutím (ale aj umením), ktoré sa odvíja od znalostí mechanizmu účinku APDT/DAPT (tab. 5), hlavnej orgánovaskulárnej ischemickej choroby (tab. 1) i základnej (kauzálnej) artériovej cievnej choroby (tab. 2), konzervatívneho alebo intervenčného manažmentu a jeho charakteru, stentov, prognózy, kontraindikácií každého chorého individuálne, s dôležitou rozhodovacou časťou, ktorou je stratifikácia rizika retrombózy a KRK a v niektorých komplikovaných prípadoch i s pomocou testovania trombocytovej reaktivity, genotypu chorého a ďalších vyšetrení [4,36,40,42,43,46,47]. Stenty sa v ostatných rokoch búrlivo technicky i klinicky vyvíjajú a stávajú sa nenahraditeľnou súčasťou endovaskulárnej intervencie. Pôvodné jednoduché kovové stenty (bare metal stent – BMS) zostali v súčasnosti vyhradené pre chorých s vysokým rizikom krvácania, keď skrátenie DAPT na jeden mesiac významne znižuje krvácavé komplikácie. Väčšinou sa dnes používajú liekové stenty (drug eluting stent – DES) s ročným trvaním DAPT a následným prechodom na monoterapiu aspirínom [26–40]. V ostatnom čase biodegradabilné stenty (bioresorbable vascular scaffolds – BVS) a ďalšie [44].
Záver
V súčasnosti najpoužívanejšie klasické antitrombocytové antitrombotiká patria medzi esenciálne lieky v primárnej i sekundárnej prevencii prakticky všetkých vaskulárnych artériových chorôb i orgánovaskulárnych ischemických chorôb. Majú však aj určité limitácie, dané najmä rizikom krvácania a fenoménom rezistencie s recidívami akútnych instabilných ischemických vaskulárnych príhod v rôznych orgánových oblastiach. Pamätajme, že orgánovaskulárne artériové ischemické choroby (OVAICH) patria medzi najvariabilnejšie choroby v internej medicíne a v klinickej medicíne vôbec. Väčšinou majú dlhú latentnú a asymptomatickú fázu, aj preto sú to choroby mimoriadne zákerné.
Čím rozsiahlejšie („monosite“ vs „multisite“), čím hlbšie v cievnej stene („endothelial“: 1. stupeň vs „intimomedial“: 2.–3. stupeň) a čím distálnejšie („proximal“ vs „distal“) je vaskulárne poškodenie („vascular monoinjury“ vs „vascular polyinjury“), čím viac ciev daného orgánu je postihnutých („monovessel“ = „monoarterial“ vs „multivessel“ – „polyvessel“ = „multiarterial“), čím väčším počtom základných, kauzálnych cievnych chorôb („monovascular disease“ vs „multivascular“ – „polyvascular disease“), čím viac orgánov a tkanív je ischemicky štruktúrne poškodených a funkčne postihnutých („monoorganovascular“ vs „multiorganovascular“ – „polyorganovascular disease“), tým väčšia je multivariabilita orgánovaskulárnych artériových ischemických chorôb a tým horšia je spravidla prognóza. Klinická mnohotvárnosť je umocnená naviac aj rôznym klinickým priebehom akútnych a chronických foriem a rôznou časovou postupnosťou vývinu orgánovaskulárnych artériových ischemických chorôb, vrátane toho, že letálna komplikácia môže byť prvou manifestáciou každej artériovej cievnej choroby. Bohužiaľ sémantická interpretácia medicínskych termínov, je u niektorých autorov nepochopiteľne problematická. To, čo označujú niektorí kardiológovia ako „polyvaskulárna choroba“ [45] je v skutočnosti multiorgánomonovaskulárna choroba („aterosklerotické lézie v dvoch a viacerých cievnych teritóriách“).
Základným predpokladom efektívnej kauzálnej racionálnej liečby je včasná a správna klinická, etiologická, anatomická a patofyziologická (CEAP) diagnóza. Na dôsledky porušenia tohto základného klinického postulátu dopláca predovšetkým pacient a treba ich vnímať aj v širších negatívnych súvislostiach.
Minimálnymi cieľmi orgánovaskuloprotektívnej terapie okrem optimálnej antitrombocytovej angiohemostázy sú normotenzia, normolipidémia, euglykémia a normohmotnosť. Výsledky viacerých v súčasnosti prebiehajúcich kontrolovaných klinických štúdií s novými antitrombocytovými liekmi pri rôznych liečebných postupoch očakávame s nádejou, že v budúcnosti budeme mať k dispozícii ešte účinnejšie a bezpečnejšie artériové antitrombotiká, ako aj presné návody pri začatí i svičovaní jednotlivých antitrombotík a o trvaní antitrombotickej liečby.
doc. MUDr. Peter Gavorník, PhD.
gavornik.peter@gmail.com
Angiologická sekcia Slovenskej lekárskej komory,
Bratislava,
Slovenská republika
www.lekom.sk
Doručeno do redakce 29. 1. 2017
Zdroje
1. Gavorník P. Angiológia pre všeobecných praktických lekárov. 2. Arteriológia. Dr. Josef Raabe: Bratislava 2014. ISBN 978–80–8140–168–8.
2. Gavorník P, Dukát A, Gašpar Ľ. Súčasnosť a budúcnosť farmako-artériotromboprofylaxie v klinickej praxi. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory. Vnitř Lék 2013; 59(12): 1081–1087.
3. Poredoš P, Jezovnik MK, Kalodiki E et al. Medical management of patients with peripheral arterial disease. Int Angiol 2015; 34(1): 75–93.
4. Guyatt GH, Norris SL, Schulman S et al. [American College of Chest Physicians]. Methodology for the development of antithrombotic therapy and prevention of thrombosis guidelines: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl): 53S-70S.
5. Eikelboom JW, Hirsh J, Spencer FA et al. Antiplatelet drugs. In: Antithrombotic therapy and prevention of thrombosis, 9th ed.: American College of Chest Physicians (ACCP) evidence-based clinical practice guidelines. Chest 2012; 141(2 Suppl): e89S-e119S. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.11–2293>.
6. Tanriover MD, Rigby S, van Hulstejin LH et al. [Working Group on Professional Issues, European Federation of Internal Medicine (EFIM)]. What is the role of general internists in the tertiary or academic setting? Eur J Int Med 2015; 26(1): 9–11. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejim.2014.11.004>.
7. Sorita A, Ahmed A, Starr SR et al. Off-hour presentation and outcomes in patients with acute ischemic stroke: A systematic review and meta-analysis. Eur J Int Med 2014; 25(4): 394–400. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejim.2014.03.012>.
8. Kriška M, Gajdošík J, Dukát A et al (eds). Zlyhanie farmakoterapie. Možnosti prevencie. Slovak Academic Press: Bratislava 2015. ISBN 978–80–8960733–4.
9. Birns J, Qureshi S, CHen R et al. Endovascular stroke therapy. Eur J Int Med 2014; 25(7): 584–591. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejim.2014.06.025>.
10. Gavorník P, Dukát A, Gašpar Ľ et al. Cerebrovaskulárna aterosklerotická choroba ako jedna z mnohých orgánovaskulárnych chorôb systémovej aterosklerózy. Ateroskleróza 2015; 19(1–2): 700–709.
11. Gašpar Ľ, Gašparová I. Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca. Forum Diab 2015; 4(1): 45–49.
12. Jauch EC, Saver JL, Adams HP et al. [American Heart Association Stroke Council, Council on Cardiovascular Nursing, Council on Peripheral Vascular Disease, and Council on Clinical Cardiology]. Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke 2013; 44(3): 870–947. Dostupné z DOI: <http://dx.doi.org/10.1161/STR.0b013e318284056a>.
13. Roffi M, Patrono C, Collet JP et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016; 37(3): 267–315. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv320>.
14. Steg G, James SK, Atar D et al. [Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC)]. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20): 2569–2619. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehs215>.
15. Parekh PJ, Oldfield EC, Johnson DH. Current Strategies to Reduce Gastrointestinal Bleeding Risk Associated with Antiplatelet Agents. Drugs 2015; 75(14): 1613–1625. Dostupné z DOI: <http://dx.doi.org/10.1007/s40265–015–0455–1>.
16. Rogers KC, Oliphant CS, Finks SW. Clinical Efficacy and Safety of Cilostazol: Critical Revue of the Literature. Drugs 2015; 75(4): 377–395. Dostupné z DOI: <http://dx.doi.org/10.1007/s40265–015–0364–3>.
17. Gavorník P, Dukát A, Gašpar Ľ et al. Choroby aorty – diagnostika, klasifikácia a princípy manažmentu. Kardiol Rev Int Med 2014; 16(6): 493–500.
18. Remková A, Remko M. Antitrombotiká v klinickej praxi. Samedi: Bratislava 2014. ISBN 978–80–970825–8-1.
19. Ntalas IV, Milionis HJ, Kei AA et al. Antiplatelet Treatment in the Secondary Prevention of Coronary and Cerebrovascular Disease. Is There any Place for Novel Agents? Angiology 2014; 65(6): 473–490. Dostupné z DOI: <http://dx.doi.org/10.1177/0003319713499609>.
20. Raparelli V, Proietti M, Napoleone L et al. Asymptomatic peripheral artery disease and antiplatelet management. VASA 2014; 43(5): 309–325. Dostupné z DOI: <http://dx.doi.org/10.1024/0301–1526/a000369>.
21. Andreotti F, Rocca B, Husted S et al. [ESC Thrombosis Working Group]. Antithrombotic therapy in the elderly: expert position paper of the European Society of CardiologyWorking Group on Thrombosis. Eur Heart J 2015; 36(46): 3238–3249. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv304>.
22. Byrne RA, Joner M, Kastrati A. Stent thrombosis and restenosis: what have we learned and where are we going? The Andreas Grüntzig Lecture ESC 2014. Eur Heart J 2015; 36(47): 3320–3331. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv511>.
23. Camici GG, Savarese G, Akhmedov A et al. Molecular mechanism of endothelial and vascular aging: implications for cardiovascular disease. Eur Heart J 2015; 36(48): 3392–3403. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv587>.
24. Diener HC, Cunha L, Forbes C et al. European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143(1–2): 1–13.
25. Dawson DL, Cutler BS, Hiatt WR et al. A comparison of cilostazol and pentoxyfylline for treating intermittent claudication. Am J Med 2000; 109(7): 523–530.
26. Gavorník P. Ateroskleróza a iné choroby tepien. Univerzita Komenského Bratislava: 1999. ISBN 80–223–1422–6.
27. Gavorník P. Angiológia 1 pre všeobecných praktických lekárov. Flebológia. Dr. Josef Raabe: Bratislava 2013. ISBN 978–80–8140–083–4.
28. Fortuna LA, Pawlovski PA, Parker ED et al. Proton pump inhibitor use by aspirin-treated coronary artery disease patients is not associated with increased risk of cardiovascular events. Eur Heart J Cardiovasc Pharmacother 2016; 2(1): 13–19. Dostupné z DOI: <http://dx.doi.org/10.1093/ehjcvp/pvv036>.
29. Myles PS, Smith JA, Forbes A et al. [ATACAS Investigators of the ANZCA Clinical Trials Network]. Stopping vs. Continuing Aspirin before Coronary Artery Surgery. N Engl J Med 2016; 374(8): 728–737. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1507688>.
30. Lüscher TF. Coronary and peripheral interventions: an update. Eur Heart J 2016; 37(14): 1085–1087. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw107>.
31. Cortese B, Granada JF, Scheller B et al. Drug-coated balloon treatment for lower extremity vascular disease intervention: an international positioning document. Eur Heart J 2016; 37(14): 1096–1103. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv204>.
32. Jolly SS, Natarajan MK. Vascular access and antiplatelet therapies: does one influence the other? Eur Heart J 2016; 37(14): 1131–1132. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv570>.
33. Riegger J, Byrne RA, Joner M et al. [Prevention of Late Stent Thrombosis by an Interdisciplinary Global European Effort (PRESTIGE) Investigators]. Histopathological evaluation of thrombus in patients presenting with stent thrombosis. A multicenter European study: a report of the prevention of late stent thrombosis by an interdisciplinary global European effort consortium. Eur Heart J 2016; 37(19): 1538–1549. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv419>.
34. Hricák V. Akútne koronárne syndrómy. Treba zmeniť klasickú protidoštičkovú liečbu na novú? Benefit, riziko a ako? Cardiology Lett 2016; 25(5): 389–391.
35. Gavorník P, Fialová V. Antitrombocytová antitrombotická prevencia a liečba vaskulárnych a orgánovovaskulárnych artériových chorôb. Interná Med 2016; 16(1): 27–31.
36. Levine GN, Bates ER, Bittl JA et al. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines: An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention, 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery, 2012 ACC/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease, 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction, 2014 AHA/ACC Guideline for the Management of Patients With Non–ST-Elevation Acute Coronary Syndromes, and 2014 ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery. Circulation 2016; 134: e123-e155. Dostupné z DOI: <http://dx.doi.org/10.1161/CIR.0000000000000404>.
37. Foley TR, Waldo SW, Armstrong EJ. Antithrombotic therapy in peripheral artery disease. Vasc Med 2016; 21(2): 156–169. Dostupné z DOI: <http://dx.doi.org/10.1177/1358863X15622987>.
38. Xhelili E, Eichelberger B, Kopp CW et al. The Antiplatelet Effect of Clopidogrel Decreases With Patient Age. Angiology 2016; 67(10): 902–908.Dostupné z DOI: <http://dx.doi.org/10.1177/0003319716631249>.
39. Beavers CJ, Carris NW, Ruf KM. Management Strategies for Clopidogrel Hypersensitivity. Drugs 2015; 75(9): 999–1007. Dostupné z DOI: <http://dx.doi.org/10.1007/s40265–015–0414-x>.
40. Rollini F, Franchi F, Angiolillo DJ. Switching P2Y12-receptor inhibitors in patients with coronary artery disease. Nat Rev Cardiol 2016; 13(1): 11–27. Dostupné z DOI: <http://dx.doi.org/10.1038/nrcardio.2015.113>.
41. Gavorník P, Dukát A, Gašpar Ľ et al. Erektilná dysfunkcia ako prvý znak systémových cievnych chorôb a orgánovaskulárnych artériových ischemických chorôb. Odporúčania a výzva Angiologickej sekcie Slovenskej lekárskej komory (2015). Vnitř Lék 2015; 61(7–8): 660–669.
42. Germain DP, Hughes DA, Nicholls K et al. Treatment of Fabry’s Disease with the Pharmacologic Chaperone Migalastat. N Engl J Med 2016; 375(6): 545–555. Dostupné z DOI:<http://dx.doi.org/10.1056/NEJMoa1510198>.
43. Hollak CEM, Biegstraaten M, Levi M et al. Post-authorisation assessment of orphan drugs. Lancet 2015; 386(10007): 1940–1941. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)00827–2>.
44. Palmerini T, Benedetto U, Bacchi-Reggiani L et al. Mortality in patients treated with extended duration dual antiplatelet therapy after drug-eluting stent implantation: a pairwise and Bayesian network meta-analysis of randomised trials. Lancet 2015; 385(9985): 2371–2382. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)60263-X>.
45. Tendera M, Aboyans V, Bartelink ML et al. [European Stroke Organisation]. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011; 32(22): 2851–2906. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr211>.
46. Halvorsen S, Storey RF, Rocca B et al on behalf of the ESC Working Group on Thrombosis. Management of antithrombotic therapy after bleeding in patients with coronary artery disease and/or atrial fibrillation: Expert consensus paper of the European Society of Cardiology Working Group on Thrombosis. Eur Heart J 2016; 0 : 1 – 11. doi:10.1093/eurheartj/ehw454. First published online: October 27, 2016.
47. Hiatt WR, Fowkes FGR, Heizer G et al. for the EUCLID Trial Steering Committee and Investigators. Ticagrelor versus clopidogrel in symptomatic peripheral artery disease. N Engl J Med 2017; 376 (1): 32 – 40.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Vyhodnocení kinetiky VO2 v zotavovací fázi spiroergometrického vyšetření u kardiologicky nemocných – význam a klasifikace
- Funkční význam hERG: od fyziologické role po cíl protinádorové terapie
- Antitrombocytová tromboprofylaxia artériových vaskulárnych chorôb a orgánovaskulárnych ischemických chorôb
- Konzervativní terapie pozdní infekce aortální protézy
- Karcinóm prištítneho telieska
- Spomienka na MUDr. Pavla Langera, DrSc., vedeckého pracovníka UEE v Bratislave
- Vzpomínka na pana profesora MUDr. Ivo Krče, DrSc.
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Nové perspektivy starého kanálu – editorial
- Terapie infekce aortální cévní protézy – editorial
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Autoprotilátky u systémových onemocnění pojiva a ANCA asociovaných vaskulitid, jejich vztah k intersticiálním plicním procesům a prognóze
- Karcinóm prištítneho telieska
- Dlouhodobě působící inzuliny v léčbě diabetu 2. typu a jejich postavení v rámci současného léčebného algoritmu
- Akútne obličkové poškodenie: aktuálny komplexný prehľad
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



