-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
Witholding dialysis in elderly patients with chronic kidney disease
Elderly patients with advanced chronic kidney disease have high symptom burden, despite the progress in renal replacement therapy. Dialysis is not a good option especially for frail elderly patients with higher comorbidity rate. Integration of palliative and supportive care to conservative management improves quality of life and prolongs survival of these patients. Conservative management of symptoms, prognostication, communication of advance care plans and shared-decision making should be a part of physician‘s skills. There are some recommended prognostication systems in nephrology, which can help to facilitate the physician-patient communication about therapeutic goals of care. Ethical and jural aspects of the process are also very important.
Keywords:
advanced care plan – conservative management – frailty – chronic kidney disease – palliative/supportive care – prognostication
Autori: Zuzana Křemenová 1; Barbora Szonowská 2; Barbora Vráblová 3
Pôsobisko autorov: I. interní klinika 3. LF UK a FN Královské Vinohrady Praha 1; Interní oddělení Strahov VFN Praha 2; Advokátní kancelář Mgr. MUDr. Dagmar Záleská, Praha 3
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 53-60
Kategória:
Súhrn
Geriatričtí pacienti s pokročilým onemocněním ledvin mají i přes pokroky v dialyzační léčbě vysokou zátěž nepříjemnými symptomy. Pro tyto pacienty, zejména je‑li přítomen syndrom geriatrické křehkosti a vyšší počet komorbidit, nemusí být dialyzační léčba optimální léčenou metodou. Konzervativní management s integrací paliativní podpůrné péče u křehkých geriatrických pacientů zlepšuje kvalitu života a má potenciál jejich život prodloužit. Konzervativní management symptomů pokročilého onemocnění ledvin, odhad prognózy, komunikace pokročilého plánu péče a proces sdíleného rozhodování by měly patřit mezi základní dovednosti lékařů, kteří s těmito pacienty přicházejí do kontaktu. K prognózování jsou v nefrologii doporučené skórovací systémy, které slouží jako pomocný nástroj k facilitaci rozhovorů o cílech léčby s pacientem a jeho blízkými. Nezbytný je etický a právní rámec, do kterého je celý proces zasazen.
Klíčová slova:
geriatrická křehkost – chronické onemocnění ledvin – konzervativní management – paliativní/podpůrná péče – plánování budoucí péče – prognózování
Stárnutí populace a syndrom geriatrické křehkosti u pacientů s CKD (chronickým onemocněním ledvin – CKD – chronic kidney disease)
Stárnutí všeobecné populace v ekonomicky rozvinuté části světa je obecným demografickým jevem. V České republice dle údajů Českého statistického úřadu vzrostl počet obyvatel starších 65 let od roku 1950 do roku 2015 více než dvojnásobně (Obr. 1).
Obr. 1. Demografický vývoj obyvatelstva (https://www.czso.cz/csu/czso/ podil-obyvatel-ve-vekove-skupine-0-14-a-65-a-vice-let-v-letech-1950-2016) 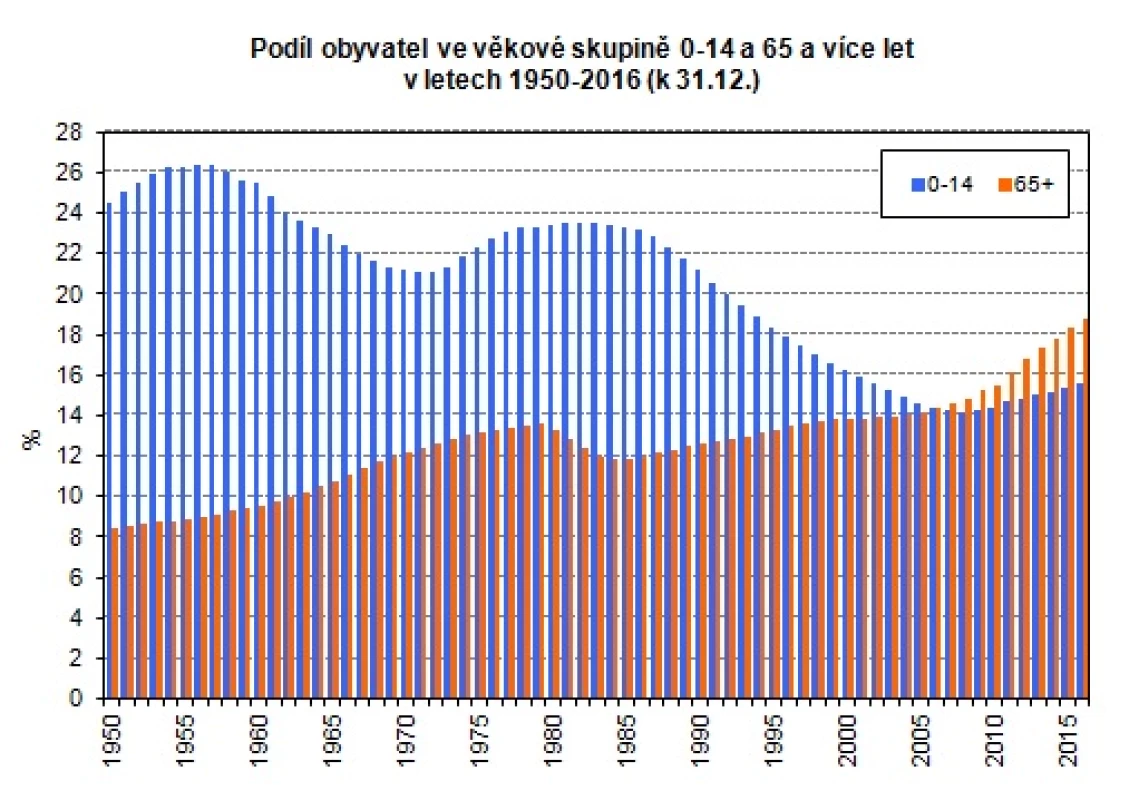
Prevalence pokročilých stadií chronického onemocnění ledvin CKD 3–5 výrazně stoupá s věkem.
Ve skupině pacientů ve věku 20–29 let jsou to desetiny procent, ve skupině pacientů nad 70 let je to až 20–25 %.
Rozhodování o možnostech léčby CKD u geriatrických pacientů je proto velmi aktuální a týká se nejen nefrologů, ale celé řady dalších odborností, které s těmito pacienty přicházejí do kontaktu.
Nefrologové mají při rozhodování o léčbě CKD u geriatrických pacientů tu výhodu, že sledují pacienta dlouhodobě. V optimálním případě pacient, popř. s blízkými, společně s nefrologem dospějí k co nejlepšímu možnému rozhodnutí v rámci sdíleného rozhodování.
Odlišná situace nastává v prostředí akutní nemocniční péče. Pacient s preexistujícím pokročilým CKD přichází s interkurentním onemocněním (např. infektem), při kterém často dochází ke zhoršení renálních funkcí. O zahájení dialýzy rozhoduje tým zdravotníků, který zná pacienta krátce a ve zhoršeném stavu. Jde o velmi obtížné rozhodování v situaci, kdy funkční stav křehkého geriatrického pacienta je výrazně ovlivněn probíhající interní či infekční komplikací.
Jaké faktory se podílejí na tom, zda pacient bude ze zahájení dialyzační léčby profitovat? Jsou to věk, komorbidity, stav nutrice, funkční stav a zásadním faktorem je přítomnost syndromu geriatrické křehkosti (frailty).
Definice frailty popisuje postupné věkem podmíněné zhoršování fyziologických systémů, pokles potenciálu zdraví, zdatnosti, odolnosti a adaptability lidského organismu na zevní nepříznivé vlivy. Fenotyp geriatrické křehkosti dle Friedové zahrnuje 5 faktorů: neúmyslnou ztrátu hmotnosti o více než 5 kg v posledním roce, vyčerpanost, slabost, pomalou rychlost chůze a nízkou fyzickou aktivitu (1). Srovnáme‑li prevalenci frailty u geriatrické populace se stejně starými dialyzovanými pacienty, zjistíme, že výskyt geriatrické křehkosti výrazně stoupá s věkem i se závažností CKD (1, 2) (Tab. 1). Je nezávislým rizikovým faktorem zhoršujícím mortalitu pacientů, významnějším než jiné tradiční rizikové faktory (3). Geriatrická křehkost zvyšuje riziko hospitalizace, umístění pacienta do zařízení sociální péče i riziko pádu, se všemi komplikacemi, které ho provázejí.
Tab. 1. Prevalence geriatrické křehkosti v běžné populaci a ve skupině dialyzovaných pacientů 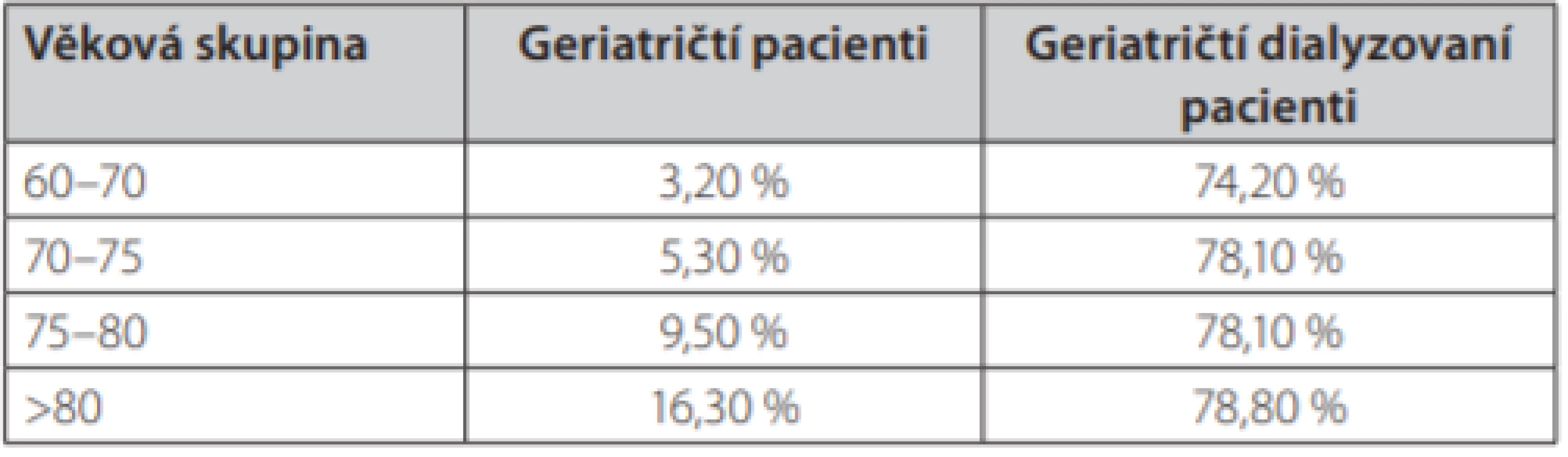
Zastoupení geriatrických pacientů v pokročilých stadiích CKD a v dialyzované populaci
V důsledku stárnutí populace přibývá pacientů vysokého věku s pokročilým stupněm CKD a s přidruženými komorbiditami, kteří vstupují do dialyzační léčby (Obr. 2). Stoupá počet polymorbidních pacientů s věkem nad 75 let s omezenou funkční zdatností, pro které může být dialýza velmi zatěžující léčebnou metodou, která u nich nepřináší ve srovnání s konzervativním managementem zlepšení či udržení kvality života, ani prodloužení délky života. Diskuze na téma nezahájení dialýzy a volby konzervativní nefrologické léčby nejsou běžnou součástí nefrologické péče. Příčinou smrti u těchto pacientů bývá jiná závažná komorbidita než selhání ledvin, pacienti bývají v posledních měsících života opakovaně hospitalizováni, včetně pobytu na jednotkách intenzivní péče, bez plánu péče pro závěr života.
Obr. 2. Dialyzační statistika 2016 (http://www.nefrol.cz/odbornici/dialyzacni-statistika) 
Obr. 3. Riziko úmrtí a progrese do ESRD v závislosti na věku a eGFR 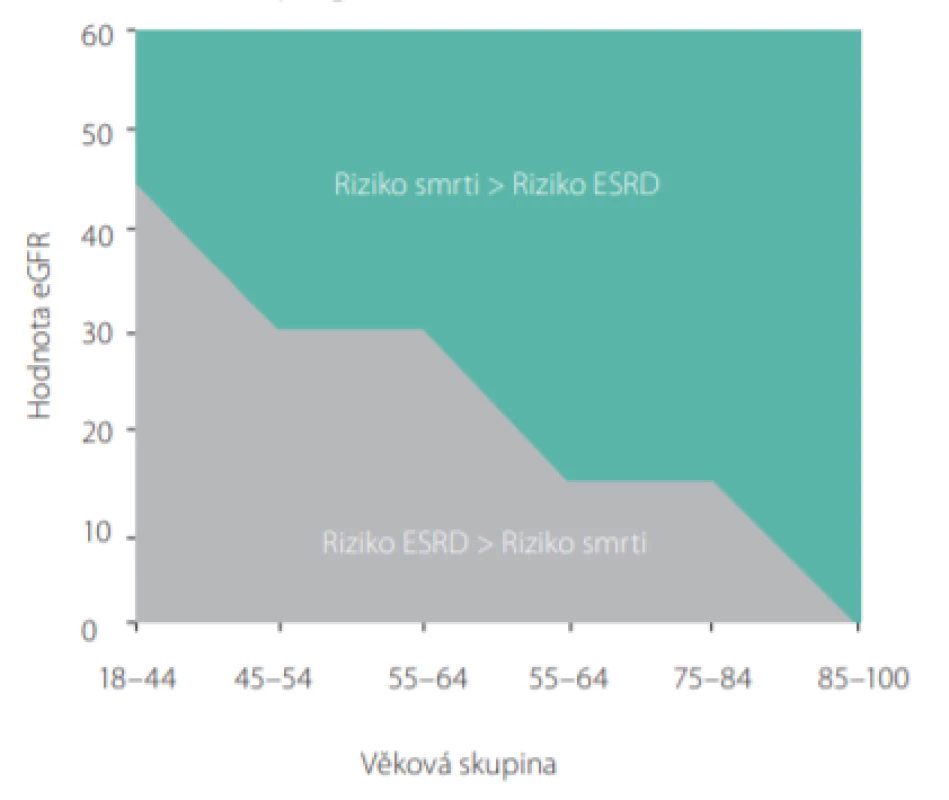
Obr. 4. Vývoj funkční zdatnosti v čase 
Jean L. Holley CJASN 2012; 7: 1033–1038 Proces rozhodování o zahájení/nezahájení dialýzy a vliv dialýzy na funkční stav a kvalitu života geriatrického pacienta
Sdílené rozhodování je nezbytnou podmínkou eticky obtížných rozhodování v medicíně. Pacient, popř. jeho blízcí, jsou partnery zdravotnického týmu. Při rozhodování o léčebných a vyšetřovacích postupech je rozhodující přání dobře edukovaného pacienta. Rozhovory o možnostech, realistických cílech léčby a preferencích pacienta je třeba zahájit včas.
Obecně existují tyto možnosti léčby chronického selhání ledvin:
- transplantace ledvin,
- dialyzační léčba (peritonální dialýza a hemodialýza),
- konzervativní management s integrací podpůrné nefrologické péče
Pacient by měl být srozumitelně seznámen/edukován ohledně možností léčby, ohledně výhod i rizik jednotlivých léčebných postupů.
Proces sdíleného rozhodování by měl probíhat v rámci multidisciplinárního týmu, kdy má pacient a jeho rodina možnost hovořit s nefrologem, psychologem, nutričním specialistou, sociálně zdravotním pracovníkem a ev. dalšími.
Důležité je stanovit si společně s pacientem realistické cíle. Velmi důležitá je schopnost ošetřujícího nefrologa předjímat průběh renálního onemocnění bez náhrady funkce ledvin, znát evidenci týkající se rizika zahájení dialyzační léčby ve skupině velmi starých pacientů. Nezbytná je znalost psychosociální situace pacienta. Management symptomů pokročilého CKD by měl patřit do odborného portfolia každého nefrologa. Patří sem nejen standardní nefrologická péče (maximální nefroprotekce, management anémie, metabolických poruch a minerálové dysbalance), ale s progredujícím CKD zejména chronická bolest, únava, nechutenství, svědění, syndrom neklidných nohou, úzkost, deprese a poruchy výživy. Při konzervativním řešení je důraz kladen na udržení kvality života a důsledný, poučený management obtěžujících symptomů.
Při rozhodování o léčebném postupu u pacientů s pokročilým CKD je zásadní srovnání rizika úmrtí na jiné příčiny, než je selhání ledvin a rychlosti progrese pacientova onemocnění do terminální fáze selhání ledvin (ESRD – end stage renal disease).
U geriatrických pacientů s chronickým onemocněním ledvin, kteří mají závažnou komorbiditu (jako např. srdeční selhání, diabetes mellitus, ischemická choroba dolních končetin a podobně), může riziko úmrtí na nerenální příčiny výrazně převážit riziko progrese jejich chronického renálního onemocnění do ESRD (5).
Dialyzační léčba obecně prodlužuje život v porovnání s konzervativním postupem, tato výhoda však mizí u geriatrických pacientů se závažnými komorbiditami, kteří mají přibližně stejné dožití při volbě konzervativního postupu jako jejich dialyzovaní vrstevníci (6).
Přibývá evidence, že při integraci paliativní péče do standardní nefrologické péče, žijí tito pacienti déle a s lepší kvalitou života. Funkční stav pacienta s pokročilým CKD s konzervativním managementem je dlouho stabilní nebo pozvolna se zhoršující, se zhoršením v posledních týdnech života. Naproti tomu u křehkých geriatrických pacientů po zahájení dialýzy významným způsobem klesá funkční zdatnost a samostatnost v aktivitách denního života a vzrůstá závislost na pomoci jiných (7). Křivka funkční zdatnosti pacienta dialyzovaného je podobná tomu, co vídáme u pokročilých orgánových selhání, funkční zdatnost se progresivně zhoršuje při každé interní či infekční komplikaci.
Jsou známy četné faktory specifické pro dialýzu, které zhoršují starším pacientům kvalitu života, především nutnost dodržování režimových opatření dialyzační léčby, jako např. restrikce tekutin, stres spojený s dopravou do dialyzačního střediska, ztráta nezávislosti a významné ovlivnění psychosociálních aspektů života.
Tyto aspekty je nutné společně s pacientem opakovaně diskutovat a v procesu sdíleného rozhodování pak společně dospět k závěru o volbě nejvhodnějšího postupu pro konkrétního pacienta. Individuální přístup vede k dosažení cílů, které jsou pro pacienta relevantní, za cenu, která je pro pacienta přijatelná. Ze zkušenosti z rozhovorů se staršími polymorbidními pacienty vyplývá, že cílem často nebývá prodloužení života z každou cenu, ale jeho kvalita se zachováním důstojnosti.
Prognózování jako pomocný nástroj při rozhodování
Z celkového počtu pacientů s CKD jenom jednotky procent dospějí v průběhu svého života až k selhání ledvin. Odhad pravděpodobnosti toho, zda právě tento pacient dospěje k selhání ledvin, je důležitý pro plánování budoucí péče a terapie.
V současné době je k dispozici již několik skórovacích nástrojů určených pro pacienty s CKD.
Patří sem KFRE kalkulátor (http://kidneyfailurerisk.com), pomocí kterého můžeme odhadnout pravděpodobnost progrese renálního onemocnění do selhání ledvin v horizontu 2 a 5 let u pacienta s pokročilým chronickým onemocněním ledvin CKD 3–5. Do výpočtu pomocí online kalkulátoru zadáváme věk pacienta, pohlaví, GFR (glomerular filtration rate – hodnota glomerulární filtrace) a ACR v moči (albumin/ creatinin ratio – poměr albumin/kreatinin v ranní porci moče).
U pacientů s nízkým rizikem progrese je adekvátním přístupem maximální nefroprotekce. Patří sem kontrola hypertenze, kontrola glykemie, řešení anémie či proteinurie, klademe důraz na řešení symptomů, dostatečnou výživu, preventivní fyzickou aktivitu k udržení funkční zdatnosti.
U pacientů s vysokým rizikem progrese do ESRD je na místě podrobně s pacientem probrat možnosti náhrady funkce ledvin s ohledem na priority pacienta. U křehkých polymorbidních geriatrických pacientů je namístě zvážit konzervativní management bez zahájení dialyzační léčby, který v této skupině pacientů neznamená zkrácení života, naopak může pomoci v delším udržení funkční zdatnosti a nezávislosti.
Druhý důležitý prognostický parametr je riziko úmrtí pacienta z jiné příčiny, než je selhání ledvin. U geriatrických pacientů s pokročilým onemocněním ledvin CKD 3–5 je nejvhodnějším prognostickým nástrojem Bansal skóre, které predikuje pravděpodobnost úmrtí v nejbližších 5 letech (8). Pacienti s nízkým rizikem úmrtí v Bansal skóre, u kterých je ale přítomná geriatrická křehkost, mají být automaticky považováni za pacienty s vysokým rizikem.
V Bansal skóre přidělujeme body rizikovým faktorům, které zvyšují mortalitu pacientů. Rizikovými faktory jsou věk, pohlaví, rasa, eGFR, ACR, přítomnost diabetes mellitus, kouření, srdečního selhání a iktu. U nejméně rizikových pacientů s dosaženým skóre 0 je pravděpodobnost úmrtí v nejbližších 5 letech 3,87 %, u nejrizikovějších pacientů s dosaženým skóre nad 10 je to 93,7 % (9).
Další důležitý prognostický parametr je REIN skóre, které predikuje pravděpodobnost úmrtí v nejbližších 3 měsících po zahájení dialýzy.
V REIN skóre přidělujeme body rizikovým faktorům, které zvyšují mortalitu pacientů. Rizikovými faktory jsou věk, pohlaví, diabetes mellitus, srdeční selhání, ischemická choroba srdeční, ischemická choroba dolních končetin, ischemie mozku, dysrytmie, chronické respirační onemocnění, jaterní cirhóza, přítomnost nádorového onemocnění, přítomnost poruch chování, přítomnost poruch mobility a albuminemie. U nejméně rizikových pacientů s dosaženým skóre 0 je pravděpodobnost úmrtí v nejbližších 3 měsících po zahájení dialýzy 1,6 %, u nejrizikovějších pacientů se skóre nad 22 je to 83,5 % (9).
U geriatrických pacientů, kde riziko úmrtí v Bansal skóre je výrazně vyšší než riziko progrese do ESRD v KFRE skóre, by se terapeutické intervence měly zaměřit na maximální nefroprotekci, na zlepšení kvality života, zmírnění obtěžujících symptomů pokročilého renálního onemocnění a na plánování budoucí péče, tj. zjištění preferencí pacienta ohledně péče na konci života (kardiopulmonální resuscitace, intubace, přístrojové podpory, invazivních léčebných metod včetně dialýzy, hospitalizací, léčby na jednotce intenzivní péče a jejich případného odmítnutí).
U pacientů, kde riziko progrese do ESRD je výrazně vyšší, než riziko úmrtí z jiné příčiny, bychom měli naše rozhovory cílit na terapeutické možnosti chronického selhání ledvin. Edukace ohledně možností léčby by měla být přátelská vůči pacientovi.
Tady je velmi důležité prezentovat nestranně všechny metody volby bez ohledu na naše preference, s poctivým odhadem výhod a nevýhod u našeho konkrétního pacienta. Konzervativní nefrologická léčba by neměla být prezentována jako druhořadá možnost, ale jako relevantní alternativa k dialyzační léčbě. Individualizace péče a individualizace rizik je obzvlášť důležitá u geriatrických pacientů s přítomnou křehkostí (frailty) a s vyšším počtem komorbidit.
U pacientů v predialýze je doporučeno využít k odhadu rizika časného úmrtí po zahájení dialýzy REIN skóre nebo online aplikace HD mortality predictor (http://www.touchcalc.com/calculators/sq).
Skórovací systémy jsou vždy pouze pomůckou, která nám umožňuje facilitovat rozhovory o cílech léčby s pacientem a jeho blízkými. Nezbytný je etický rámec, do kterého je celý proces zasazen.
Klinický, etický a právní rámec pro rozhodování o nezahájení dialýzy (10)
Při rozhodování o zahájení či nezahájení dialýzy je zásadní vztah pacient/lékař, vzájemná důvěra a dobrá komunikace. Základním pilířem je proces sdíleného rozhodování. Jedná se o proces, nikoliv jednorázový rozhovor. Edukace má být přátelská k pacientovi, citlivě a srozumitelně ho seznámit s výhodami a nevýhodami léčebných možností a s jejich dopady na jeho každodenní život a sociální situaci.
Velmi důležitá je identifikace pacientů, kteří nebudou profitovat ze zahájení dialýzy (vysoký věk, přítomnost frailty, vysoký počet komorbidit, špatná funkční zdatnost). Velký význam má také naše schopnost odhadnout a domluvit se na časovém rámci daném odhadovanou prognózou pacienta. V případě, že pacient zvolí konzervativní management, je nutné mít plán péče s managementem symptomů jak fyzických, tak psychosociálních. Je nutné, aby fungovala také logistika plánu. Nefrolog by měl být schopen předvídat možné komplikace a pacient, popř. rodina, by měli vědět, jak mají postupovat, na koho se mohou v případě potřeby obrátit.
Nefrolog by se měl vzdělávat stran managementu symptomů, případně zajistit pacientovi přístup ke specializované paliativní péči.
Je‑li pacient rozhodnut, že nechce v budoucnu zahájit dialyzační léčbu, je namístě jeho rozhodnutí právně podpořit sepsáním dříve vysloveného přání (DVP). Je důležité pacienta ujistit, že rozhodnutí může změnit a průběžně ověřovat, že dané rozhodnutí stále platí.
V případě, že pacient váhá, zda zahájit či nezahájit dialýzu, je možné se společně dohodnout na tzv. „dialýze na zkoušku“, obvykle na dobu 4–6 týdnů. Na konci tohoto intervalu společně s pacientem zhodnotíme výhody a nevýhody, které dialýza pacientovi přinesla a pacient se rozhodne, jak chce dál pokračovat.
V kontextu nezahájení dialýzy hovoříme o několika skupinách pacientů.
- Pacienti se zachovalou rozhodovací schopností, kteří dialyzační léčbu odmítli v souladu s § 34, odst. 3 zákona o zdravotních službách.
- Pacienti, kteří nemají zachovalou rozhodovací schopnost, ale v období, kdy je měli, dialyzační léčbu prokazatelně odmítli, nebo mají sepsané dříve vyslovené přání (DVP) dle § 36 zákona o zdravotních službách.
- Pacienti, kteří nemají zachovalou rozhodovací schopnost, za které rozhoduje tým ošetřujících zdravotníků s hlavním zřetelem na pacientův nejlepší zájem. V rámci předchozí péče měli zdravotníci možnost seznámit se s pacientovými preferencemi a jednají v souladu s nimi. Namístě je opakovaně komunikovat a vysvětlovat situaci rodině a konzultovat rozhodnutí týmu s rodinným příslušníkem, který byl pacientem k tomu určen, příp. i další blízké osoby v souladu s § 33, odst. 1 a § 34, odst. 7 zákona o zdravotních službách.
- U pacienta je přítomno terminální onemocnění z nerenálních příčin.
- Pacient nedokáže při dialýze spolupracovat a předpokládají se technické komplikace po zahájení dialýzy u takového pacienta (např. těžký kognitivní deficit s psychomotorickém neklidem).
Právní rámec rozhodování o nezahájení dialýzy zcela koresponduje s právním rámcem rozhodování o poskytování jakýchkoliv jiných zdravotních služeb. Zákon o zdravotních službách stanoví, že poskytovatel zdravotních služeb je povinen poskytovat zdravotní služby na náležité odborné úrovni (tzv. de lege artis). Náležitá odborná úroveň je definována v § 4, odst. 5 zákona o zdravotních službách jako postup podle pravidel vědy a uznávaných medicínských postupů, při respektování individuality pacienta, s ohledem na konkrétní podmínky a objektivní možnosti. Zákonná definice postupu lege artis tedy výslovně odkazuje na „pravidla vědy a uznávané medicínské postupy“. V kontextu rozhodování o nezahájení nebo nepokračování léčby představuje tento uznávaný medicínský postup mimo jiné konsenzuální stanovisko České společnosti anesteziologie, resuscitace a intenzivní medicíny České lékařské společnosti J. E. Purkyně a České společnosti intenzivní medicíny k poskytování paliativní péče u nemocných s nezvratným orgánovým selháním (schválen představenstvem ČLK jako doporučení č. 1/2010 k postupu při rozhodování o změně léčby intenzivní na léčbu paliativní u pacientů v terminálním stavu, kteří nejsou schopni vyjádřit svou vůli).
Konsenzuální stanovisko říká, že každý pacient má právo na poskytnutí léčby, která odpovídá jeho zdravotnímu stavu. V intenzivní medicíně je cílem zachování života a zdraví pacienta – tj. odstranění příčiny, která působí zhoršení zdravotního stavu a poskytování orgánové podpory nebo orgánové náhrady u pacientů se zvratným orgánovým selháním, nebo s cílem zlepšení jejich klinického stavu. V okamžiku, kdy není možné tyto cíle naplnit, je třeba pacientovi poskytnout péči spočívající v tišení bolesti, dyskomfortu a strádání a uspokojování jeho fyzických, psychických, sociálních a duchovních potřeb.
Stanovisko zdůrazňuje, že u jakékoliv léčby musí lékař vždy zvažovat její reálný klinický přínos. Léčbu, u níž není předpoklad, že povede k záchraně života pacienta, nebo zlepšení jeho klinického stavu a kde rizika komplikací převažují nad přínosem pro pacienta, je nutno považovat za léčbu marnou a neúčelnou. Taková léčba nemá být lékařem indikována a prováděna. Lékař nemá povinnost zahajovat marnou a neúčelnou léčbu nebo v ní pokračovat. Zahájení nebo pokračování marné a neúčelné léčby je postupem non lege artis stejně jako nezahájení nebo nepokračování léčby, která je indikována a měla by být poskytnuta.
Koncept marné a neúčelné léčby nicméně není mezi odbornou veřejností přijímán bez výhrad. Je totiž otázkou, do jaké míry je možné jednoznačně označit určitou léčbu za marnou a neúčelnou jednostranně z pozice lékaře, pouze na základě objektivních parametrů dané léčby. Hodnocení léčby jako marné, tj. takové, která pacienta zatěžuje zbytečným strádáním nebo rizikem komplikací, vyžaduje totiž zohlednění pacientových preferencí a jeho názoru na to, jaká pravděpodobnost úspěšnosti léčby, v kombinaci s jakými riziky, je pro něj přijatelná a jaká už ne.
Jak již bylo uvedeno, v situaci rozhodování o zahájení nebo nezahájení léčby je třeba vedle požadavku na poskytování zdravotních služeb na náležité odborné úrovni zohlednit také požadavek na poskytování zdravotních služeb na základě souhlasu uděleného pacientem. Pacient má být lékaři partnerem v procesu rozhodování. Má právo, aby mu byla poskytnuta informace o jeho zdravotním stavu a navrhovaném léčebném postupu, na základě které se následně může rozhodnout, zda s léčbou vysloví nebo nevysloví souhlas, příp. zda již udělený souhlas odvolá. V případě, kdy si pacient léčbu nepřeje, lékař je povinen takové přání pacienta respektovat a léčbu nezahájit. V případě, kdy pacient souhlas vyslovil, ale své přání přehodnotí a pokračování léčby odmítá, je lékař povinen i toto odvolání souhlasu respektovat. Takový přístup plně koresponduje se stanoviskem Ústavního soudu vyjádřeného v nálezu Ústavního soudu sp. zn. IV. ÚS 639/2000 z roku 2001, kde Ústavní soud říká, že „diagnóza není víc než právo, a tedy právo pacienta nebýt léčen je silnější než povinnost lékaře léčit“. Obdobně je lékař povinen respektovat přání pacienta vyslovené předem pro případ, že pacient s ohledem na svůj zdravotní stav nebude schopen souhlas nebo nesouhlas vyslovit (tzv. dříve vyslovené přání), pokud jej má lékař k dispozici a nastala pacientem předvídaná situace.
V případě, že pacient s ohledem na svůj zdravotní stav nemůže rozhodovat, vyžaduje se tzv. zástupný souhlas. Zástupný souhlas může udělit osoba určená pacientem při přijetí do péče nebo v průběhu hospitalizace ve smyslu § 33, odst. 1 zákona o zdravotních službách. Pokud pacient žádnou osobu oprávněnou k udělení souhlasu neurčil, vyžaduje se souhlas manžela nebo registrovaného partnera, pokud není nebo není k zastižení, vyžaduje se souhlas rodiče, pokud není nebo není k zastižení, vyžaduje se souhlas jiné svéprávné osoby blízké (v tomto pořadí) dle § 34, odst. 7 zákona o zdravotních službách.
S ohledem na uvedené jsou základní východiska a doporučení pro praxi následující:
- závěr lékaře o marnosti a neúčelnosti léčby má být činěn na základě jeho odborného úsudku, pro praxi lze doporučit, aby vždy, kdy je to možné, byl tento závěr činěn v rámci diskuze v lékařském konziliu,
- je třeba si připustit, že posouzení marnosti a neúčelnosti léčby je téměř vždy zatíženo určitou mírou prognostické nejistoty, proto je třeba do rozhodovacího procesu zahrnout pacienta, aby ten mohl vyjádřit, jakou zátěž, kterou léčba a její alternativy s sebou nesou, považuje za přijatelnou a jakou již nikoliv,
- závěr o marnosti a neúčelnosti léčby by měl být vždy, kdy je to možné, výsledkem procesu vyhodnocování činěného kontinuálně,
- rozvaha o indikaci další léčby nebo naopak nezahájení nebo nepokračování marné a neúčelné léčby by měla být podrobně zaznamenána do zdravotnické dokumentace,
- poskytování marné a neúčelné léčby stejně jako neposkytování léčby účelné lze vyhodnotit jako postup non lege artis, léčbu non lege artis lékař nejenže není povinen, ale nesmí poskytovat.
Management nejčastějších symptomů ESRD (14–16)
Symptomová zátěž a kvalita života pacientů s ESRD je velmi podobná pacientům v terminální fázi onkologického onemocnění (11). Pacienti s ESRD trpí průměrně 9 obtěžujícími symptomy, z nich až polovina symptomů není řešena (12, 13). Pacienti se o svých symptomech spontánně většinou nezmíní, proto je nutno se jich na ně cíleně ptát. Pravidelné a rutinní hodnocení symptomů by mělo být součástí standardní nefrologické péče. K monitorování vývoje symptomů v čase je vhodné používat dotazníky, validované pro pacienty s onemocně ‑ ním ledvin, např. POS‑renal (Patient Outcome Scale) nebo ESAS‑renal (Edmonton Symptom Assessment Scale).
Bolest je častý symptom, příčinou jsou většinou muskuloskeletární abnormality, ale také může souviset s neuropatií, ischemickou chorobou končetin, nebo přímo s renálním onemocněním (bolest břicha u polycystické choroby ledvin, kostní bolesti u sekundární hyperparatyreózy, vaskulární kalcifikace a kožní defekty). Nejčastějším lékem pro mírnou bolest, který můžeme u těchto pacientů použít bez nutnosti redukce dávky, je paracetamol. Lékům ze skupiny NSAID (nesteroidní antirevmatika – nonsteroid antiinflamatory drugs) bychom se měli vyhnout, jednak pro nutnost udržet co nejdéle reziduální funkci ledvin, jednak pro vyšší riziko krvácivých a gastrointestinálních komplikací u pacientů s ESRD.
Na střední a silnou bolest můžeme použít tramadol, nebo tramadol v kombinaci s paracetamolem, ale musíme redukovat dávku a prodloužit časový interval pro podávání, neměli bychom překročit dávku 50–100 mg tramadolu maximálně 2× denně.
Pro pacienty se silnou bolestí a nutností podávání opioidů používáme přednostně buprenorfin, který má predominantí vylučování pomocí žlučových cest, a není u něj nutno redukovat dávku. Bezpečně můžeme také použít fentanyl, kde iniciální dávku je potřeba redukovat o 50 % až při GFR pod 10 ml/min. Použití morfinu se u pacientů s ESRD nedoporučuje, nebo jen s velkou opatrností a pečlivým monitorováním nežádoucích účinků.
Z koanalgetik, gabapentin a pregabalin se vylučují nezměněny ledvinami, proto je nutno jejich dávku snížit podle glomerulární filtrace, u pacientů s CKD 5 je doporučeno podávání 100–150 mg gabapentinu 1× denně, nebo 300 mg gabapentinu ob den, u pregabalinu 25–75 mg/ den. Praxe ukazuje, že zejména u gabapentinu je nutné dávky individuálně redukovat ještě více (např. 100 mg/48–72 hod.).
Únava je velmi obtěžující, velmi frekventní a opomíjený symptom, který zásadním způsobem snižuje pacientům kvalitu života. V první řadě je potřeba odstranit faktory, které mohou k únavě přispívat: poruchy spánku, deficit vitaminu D, metabolickou acidózu, anémii, hyperparatyreózu, hypotyreózu, malnutrici, úzkost a depresi. Je vhodné pacienta podporovat v pravidelném aerobním cvičení a hlídat dostatečnou výživu, spolupracovat s nutričním poradcem.
Poruchy spánku jsou u pacientů s CKD také velmi časté, v první řadě je potřeba odstranit ovlivnitelné faktory: svědění, bolest, dušnost, úzkost, deprese, syndrom neklidných nohou a revidovat medikaci, která může k nespavosti přispívat. Z nefarmakologických postupů je důležitá spánková hygiena, vyhnout se stimulantům, jako je kofein, alkohol, nikotin ve večerních hodinách a omezit denní pospávání. Pomoci může také pravidelné cvičení. Z farmakologických postupů je možné u pacientů s CKD použít běžná Z‑hypnotika či krátkodobě benzodiazepiny, z antidepresiv je možné využít sedativní efekt nízkých dávek mirtazapinu.
Syndrom neklidných nohou (RLS – restless leg syndrom) – etiologie není zcela jasná. Mezi možné faktory zhoršující RLS patří: anémie, deficit železa, hyperfosfatemie, antidepresiva (ze skupin SSRI, SNRI, TCA), kalciové blokátory či opioidy. Z nefarmakologických postupů může pomoci pravidelné cvičení, z farmakologických nízké dávky gabapentinu, pregabalinu (v redukovaných dávkách), agonisté dopaminu, i.v. železo.
Pruritus – etiologie není jasná. Spolupodílející se faktory mohou být anémie, deficit železa, hyperfosfatemie, hyperkalcemie, suchost kůže, alergie či léková hypersenzitivita. Důležité jsou nefarmakologické postupy, dobrá péče o kůži, promazávání kůže neparfemovanými krémy, vyhýbání se horkým koupelím, vyhýbání se mýdlu, které může kůži vysušovat a svědění zhoršovat. Vhodné je používat volné bavlněné oblečení, na noc chladivé krémy s obsahem mentolu. Z farmakologických postupů jsou lékem první volby gabapentinoidy – gabapentin 50–100 mg/den, dále pupalkový olej, antihistaminika (ale pozor, 90 % uremického pruritu není histamin senzitivní) nebo UVB fototerapie.
Nauzea a zvracení bývají přítomny u pacientů s ESRD často, prvním krokem je nefarmakologické řešení: dobrá péče o dutinu ústní, podávání jídel v menších porcích vícekrát denně, minimalizace intenzivních vůní jídla, volné oblečení kolem krku. Nauzea a zvracení mohou být způsobeny u pacientů s ESRD parézou žaludku, diabetickou enteropatií, gastroezofageálním refluxem či zácpou, zde je lékem první volby metoclopramid 10 mg 3× denně, léky další volby jsou haloperidol 0,5–5 mg/den či domperidon 10 mg 1–2× denně. Je‑li příčinou urémie, minerálová dysbalance či nežádoucí účinky léčiv (hlavně opiátů), je lékem první volby haloperidol 0,5–5 mg den, lékem další volby je levomepromazin 12,5–25 mg 1× denně. Při rezistentním zvracení je možnost použít olanzapin 2,5 mg 1–6× denně nebo ondansetron 4 mg 3× denně. CAVE haloperidol může zhoršit syndrom neklidných nohou!
Úzkost a deprese jsou u pacientů s ESRD asociovány se zvýšenou mortalitou, zvýšenou frekvencí hospitalizací a zvýšenou morbiditou. K nefarmakologickým postupům řešení úzkosti a deprese patří:
empatický přístup a dobrá komunikace, blízkost příbuzných a sociální podpora, pravidelné cvičení, řešení reverzibilních příčin, jako jsou bolest, nespavost, pruritus. U úzkostných pacientů s CKD lze použít krátkodobě jakýkoliv benzodiazepin (nejčastěji oxazepam, alprazolam, bromazepam) s titrací dávky dle efektu, u rezistentní úzkosti lze použít antipsychotika (haloperidol, olanzapin, risperidol nebo tiapridal). Z antidepresiv jsou nejčastěji u pacientů s CKD používány zástupci skupiny SSRI (blokátory zpětného vychytávání serotoninu), např. citalopram, escitalpram, sertralin, fluoxetin a také mirtazapin.
Tab. 2. Body spojené s rizikovými faktory v rovnici mortality u CKD dle Cardiovascular Health Study 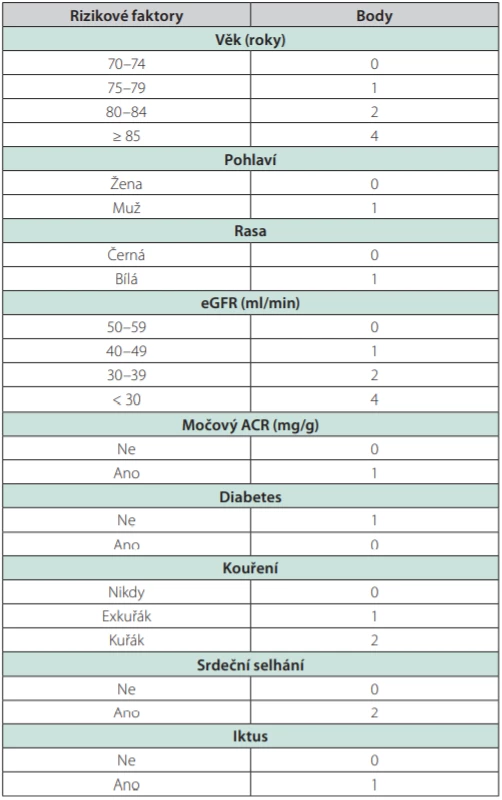
Tab. 3. Riziko 5leté mortality spojené s celkovým počtem bodů 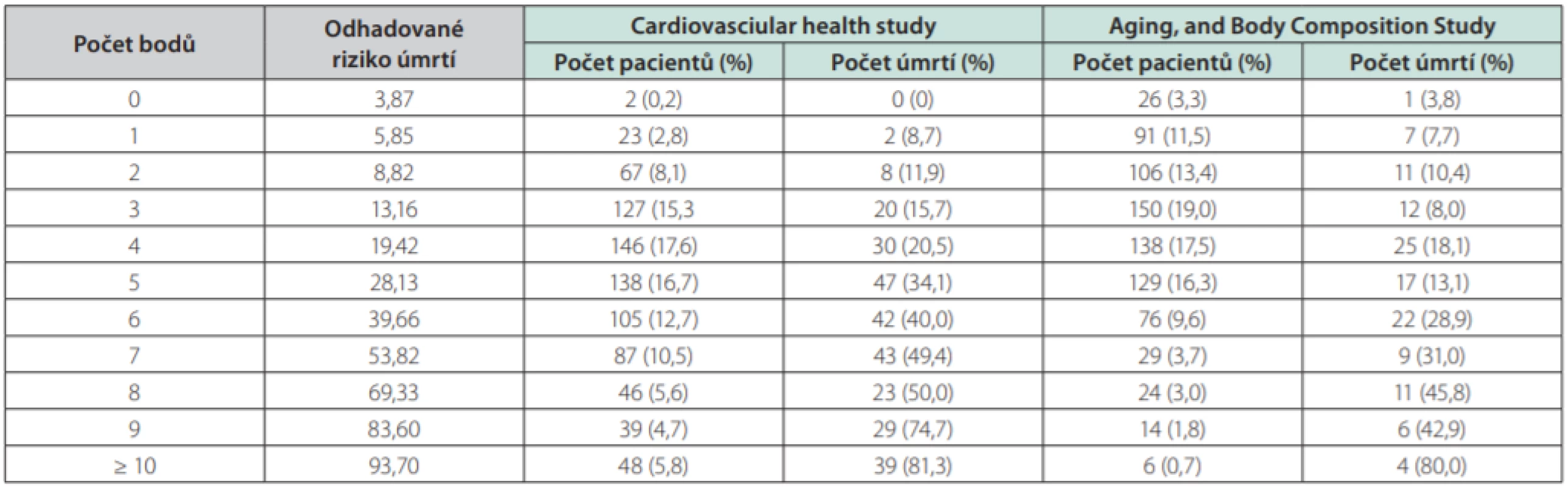
Včasné plánování budoucí péče jako vhodný nástroj k zajištění důstojného konce života dle přání pacienta
Pětileté přežití u pacientů s CKD 5 je 38 %, u pacientů s CKD 5 starších 65 let je to jenom 18 % (17).
Při takto vysoké mortalitě je otázka plánování budoucí péče na konci života zásadní a měli by se jí zabývat nejen nefrologové, ale také praktičtí lékaři, kteří mají tyto pacienty v péči.
Kardiopulmonální resuscitace (KPR) je vnímána pacienty jako život zachraňující postup, který by určitě podstoupili, kdyby u nich došlo k srdeční zástavě. Málokterý pacient ale ví, že ve skupině pacientů s ESRD je pravděpodobnost, že po úspěšné KPR bude propuštěn z nemocnice a přežije nejbližších 6 měsíců, nižší než 10 % (18). Také se může stát, že neurologický stav pacienta po KPR je výrazně zhoršen, nebo že je dokonce po KPR závislý na trvalé ventilační podpoře. Tato stránka KPR by se měla s pacienty s ESRD probrat, aby měli možnost se kvalifikovaně a včas rozhodnout, jestli o takovou péči stojí.
Kanadská studie ukázala, že 61 % dialyzovaných pacientů litovalo, že se pro dialýzu rozhodli, a jenom 10 % pacientů s ESRD si vybavilo diskuzi se svým ošetřujícím lékařem o preferencích v závěru života (19).
I když prognóza pacientů s ESRD i jejich symptomová zátěž je podobná jako u pacientů s pokročilým onkologickým onemocněním, jen málokterému pacientovi s terminálním selháním ledvin se dostane paliativní nebo hospicové péče. Většina z nich umírá v nemocnici, často v poslední fázi života podstupují léčbu na jednotkách intenzivní péče, i když většina z nich by si přála zemřít doma, v hospici nebo na standardním lůžku.
Včasné plánování budoucí péče a plán ohledně podstupování invazivních léčebných strategií jim může umožnit prožít závěr života v souladu s jejich preferencemi (20). Tyto rozhovory jsou časově náročné, ale podpoří pacienty v komunikaci o těchto tématech i s jejich blízkými, kteří často v případě akutního zhoršení pacientova stavu rozhodují o směřování pacienta (volají rychlou záchrannou službu, vezou pacienta do nemocnice apod.). Poučení o možnosti sepsat DVP ohledně preferencí v závěru života umožní pacientům prožít závěr života dle jejich představ a s respektem k jejich integritě a důstojnosti.
Individualizace péče u křehkých geriatrických pacientů s pokročilým onemocněním ledvin, pečlivá komunikace a společné rozhodování jsou cestou, jak integrovat paliativní postupy do standardní nefrologické praxe a umožnit tím důstojný závěr života těchto pacientů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Zuzana Křemenová,
I. interní klinika 3. LF UK a FN Královské Vinohrady,
Šrobárova 50,
100 34 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(2): e28–e35
Článek přijat redakcí: 16. 5. 2018
Článek přijat k publikaci: 15. 11. 2019
Zdroje
1. Fried LP, Tangen CM, Walston J, et al. Frailty in Older Adults: Evidence for a Phenotype. Journals Gerontol Ser A Biol Sci Med Sci 2001; 56: M146-M157.
2. Johansen KL, Chertow GM, Jin C, et al. Significance of Frailty among Dialysis Patients. J Am Soc Nephrol 2007; 18 : 2960–2967.
3. Rockwood K, Song X, Mac Knight C, et al. A global clinical measure of fitness and frailty in elderly people. CMAJ 2005; 173 : 489–495.
4. Weisbord SD, Fried LF, Arnold RM, et al. Prevalence, Severity, and Importance of Physical and Emotional Symptoms in Chronic Hemodialysis Patients. J Am Soc Nephrol 2005; 16 : 2487–2494.
5. O’Hare AM, Choi AI, Bertenthal D, et al. Age affects outcomes in chronic kidney disease. J Am Soc Nephrol 2007; 18 : 2758–2765.
6. Chandna SM, Da Silva‑Gane M, Marshall C, et al. Survival of elderly patients with stage 5 CKD: Comparison of conservative management and renal replacement therapy. Nephrol Dial Transplant 2011; 26 : 1608–1614.
7. Kurella Tamura M., Covinsky KE, Chertow GM, et al. Functional status of elderly adults before and after initiation of dialysis. N Engl J Med 2009; 361 : 1539–1547.
8. Bansal N, Katz R, De Boer IH, et al. Development and validation of a model to predict 5-year risk of death without ESRD among older adults with CKD. Clin J Am Soc Nephrol 2015; 10 : 363–371.
9. Couchoud CG, Beuscart JBR, Aldigier JC, et al. Development of a risk stratification algorithm to improve patient‑centered care and decision making for incident elderly patients with end‑stage renal disease. Kidney Int 2015; 88 : 1178–1186.
10. Galla JH, Albert R, Brewer E, et al. Clinical Practice Guideline on Shared Decision‑Making in the Appropriate Initiation of and Withdrawal from Dialysis. J Am Soc Nephrol 2000; 11 : 1340–1342.
11. Saini T, Murtagh FEM, Dupont PJ, et al. Comparative pilot study of symptoms and quality of life in cancer patients and patients with end stage renal disease. Palliat Med 2006; 20 : 631–636.
12. Yong DSP, Kwok AOL, Wong DML, et al. Symptom burden and quality of life in end‑stage renal disease: A study of 179 patients on dialysis and palliative care. Palliat Med 2009; 23 : 111–119.
13. Claxton RN, Blackhall L, Weisbord SD, et al. Undertreatment of Symptoms in Patients on Maintenance Hemodialysis. J Pain Symptom Manage 2010; 39 : 211–218.
14. O’Connor NR, Corcoran AM. End‑stage renal disease: symptom management and advance care planning. Am Fam Physician 2012; 85 : 705–710.
15. Davison SN, Jassal SV. Supportive care: Integration of patient‑centered kidney care to manage symptoms and geriatric syndromes. Clin J Am Soc Nephrol 2016; 11 : 1882–1891.
16. Davison SN, Levin A, Moss AH, et al. Executive summary of the KDIGO Controversies Conference on Supportive Care in Chronic Kidney Disease: Developing a roadmap to improving quality care. Kidney International 2015; 88 : 447–459.
17. D. of K. U. & H. D. National Institutes of Health, National Institutes of Diabetes & Digestive & Kidney Disease USRDS 2011 Annual Data Report: Atlas of Chronic Kidney Disease and End‑Stage Renal Disease in the United States. Natl Institutes Heal Natl Inst Diabetes Dig Kidney Dis 2011, 1–26.
18. Moss AH, Holley JL, Upton MB. Outcomes of cardiopulmonary resuscitation in dialysis patients. J Am Soc Nephrol 1992; 3 : 1238–1243.
19. Davison SN. End‑of‑life care preferences and needs: Perceptions of patients with chronic kidney disease. Clin J Am Soc Nephrol 2010; 5 : 195–204. 20. Szonowská B Paliativní péče v nefrologii. Čas Lék Čes 2018; 157 : 25–29.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Hyperurikemie z perspektivy nefrologického pacienta
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



