-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Věkem podmíněná remodelace myokardu: mýtus nebo realita?
Age‑related myocardial remodeling: myth or reality?
Age-related myocardial remodeling is a long-term process that involves a wide range of pathogenetic mechanisms. The result is structural and functional changes of the myocardium, which lead to a change in the functional myocardium itself (changes in the geometry of the heart compartments, myocardial contractility, myocardial reserves). These changes can lead to the development of heart failure, reduce the quality of life and thus increase the morbidity and mortality of patients. It is a process that can be negatively affected by risk factors for cardiovascular disease, many comorbidities, on the contrary, this process can be significantly positively influenced by lifestyle changes, early detection of risk factors and consistent treatment of all comorbidities.
Keywords:
aging – myocardial remodeling – Senescence – heart failure
Autori: Radek Pudil
Pôsobisko autorov: 1. interní kardiongiologická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Vnitř Lék 2020; 66(8): 507-511
Kategória:
Súhrn
Věkem podmíněná remodelace myokardu je dlouhodobý proces, který zahrnuje široké spektrum patogenetických mechanismů. Výsledkem jsou strukturální a funkční změny myokardu, které vedou ke změně funkčních vlastností myokardu (změny geometrie srdečních oddílů, kontraktility myokardu, myokardiální rezervy). Tyto změny mohou ústit v rozvoj srdečního selhání, snižují kvalitu života a mohou tak zvyšovat morbiditu i mortalitu pacientů. Jde o proces, který mohou negativně ovlivnit rizikové faktory kardiovaskulárních onemocnění, řada komorbidit, naopak tento proces lze významně pozitivně ovlivnit změnou životního stylu, včasnou detekcí rizikových faktorů a důslednou léčbou všech komorbidit.
Klíčová slova:
stárnutí – remodelace myokardu – Senescence – srdeční selhání.
Srdeční selhání má poměrně přesně definované příčiny a patogenetické mechanismy, které vedou k poškození srdeční svaloviny a k následnému rozvoji srdečního selhání. Ukazuje se však, že dalším významným faktorem, který velmi často určuje výsledný klinický obraz, je funkční stav myokardu v době jeho vzniku, tedy v konkrétní době působení vyvolávající příčiny. Je známo, že v souvislosti s narůstajícím věkem a stárnutím dochází k patofyziologickým změnám struktury a funkce kardiovaskulárního systému. Tyto změny jsou označovány jako stárnutí kardiovaskulárního systému (cardiovascular aging) a zahrnují jak stárnutí cévního systému (vascular aging), tak i stárnutí myokardu. Nepřímo to dokládá zvýšený výskyt srdečního selhání v souvislosti s věkem. Podle některých rozsáhlých epidemiologických dat je prevalence srdečního selhání v běžné populaci asi 2,2 %, přičemž ve věkové skupině 45–54 let je to pouze 0,7 %, avšak po 60. roce věku významně narůstá, ve věku nad 75 let dosahuje prevalence manifestního srdečního selhání až 8,4 % (1, 2). Vzhledem k tomu, že ve vyšších věkových skupinách narůstá počet nemocných se srdečním selháním, se obrací pozornost také na patofyziologické změny myokardu, ke kterým v souvislosti s narůstajícím věkem dochází.
Hlavním cílem tohoto stručného přehledu je podat základní souhrn patogenetických procesů, ke kterým dochází v souvislosti se stárnutím a které se uplatňují při rozvoji srdečního selhání, sekundárním cílem je upozornit na možnosti, jak je příznivě ovlivnit.
Změny morfologie myokardu v souvislosti s věkem
S narůstajícím věkem dochází ke změně velikosti a funkce srdečních oddílů. Podle dosavadních zkušeností dochází k základním morfologickým změnám myokardu, které zahrnují změny velikosti a funkce srdečních komor. Tento proces se nazývá věkem podmíněná remodelace myokardu (age‑related myocardial remodelling) a zahrnuje změny velikosti a funkce srdečních oddílů.
Věkem podmíněná remodelace myokardu. Věkem podmíněná remodelace myokardu zahrnuje morfologické a funkční změny srdečních komor a síní.
Věkem podmíněná remodelace levé komory je základním procesem, který je dán dvěma faktory: stacionárním množstvím až pozvolným úbytkem masy myokardu levé komory a relativně rychlejším poklesem end‑diastolického a end‑systolického objemu levé komory. Výsledkem je zvýšení poměru masa/objem (LV mass/volume ratio). Tento trend v minulosti naznačovaly echokardiografické studie, v současnosti byl potvrzen rozsáhlými studiemi využívajícími magnetickou rezonanci k hodnocení masy myokardu levé komory a jejich objemových para ‑ metrů. Za připomínku stojí rozsáhlá studie Susan Chengové a kol., kteří provedli rozsáhlou analýzu MR vyšetření srdce v souboru 5004 pacientů bez přítomnosti kardiovaskulárního onemocnění různých věkových skupin (3). Za základě podrobné analýzy dospěli k závěru, že ročně dochází k úbytku svaloviny levé komory o 0,3 g a ke zmenšení end‑diastolického objemu levé komory o 0,8 ml (p < 0,0001). Disproporce mezi rychlostí úbytku svaloviny levé komory a jejího objemu vede k průměrnému nárůstu 5 mg/ml a rok (p < 0,0001). Vzhledem multietnicitě sledovaného souboru bylo možné prokázat, že etnicita nemá žádný podstatnější vliv na tento proces. Tato studie přinesla data o rizikovosti zvýšeného poměru masa/objem pro vznik kardiovaskulárních příhod, ve věku nad 65 let je zvýšený index asociovaný s více než trojnásobným zvýšením jejich výskytu (HR 3,69, 95% CI: 1,34–10,10). Novější studie potvrdily podobný trend. Např. Fiechter M et al. na základě analýzy MR vyšetření srdce prokázali poměrně silný pokles end‑systolického a end‑diastolického objemu levé komory v závislosti na věku, masa levé komory a její index byly stacionární, resp. se s věkem snižovaly (4).
Při hodnocení systolické funkce levé komory obě studie přinesly data o mírném zvýšení ejekční frakce levé komory v souvislosti s věkem, které je dané disproporcí poklesu objemů levé komory (významnější pokles end‑diastolického objemu levé komory při porovnání s end‑systolickým objemem levé komory). Relativní zachování systolické funkce levé komory hodnocení pomocí parametru ejekční frakce může být ovlivněno i dalšími faktory (například častější přítomnosti mitrální insuficience).
Změny struktury a geometrie levé komory vedou ke snížení její diastolické funkce. Tato oblast byla již velmi dobře dokumentována a promítla se do současných doporučení pro hodnocení diastolické funkce levé komory. Podobně je dokumentována závislost věku a vzestupu poměru E/e’ (5, 6). Předpokládá se, že diastolickou funkci levé komory ve vyšším věku významně ovlivňuje zvýšená tuhost stěny levé komory a snížená schopnost relaxace. Při echokardiografickém hodnocení diastolické funkce levé komory je třeba mít tyto faktory na paměti.
Věkem podmíněná remodelace myokardu zahrnuje také změny geometrie levé síně, ke kterým v průběhu stárnutí dochází. Jde především o dilataci levé síně, která se projeví zvýšeným end‑systolickým i end‑diastolickým objemem. Příčinou může být zvýšení tuhosti stěny levé komory a porucha její poddajnosti, která ztěžuje plnění levé komory v průběhu diastoly, dále pak mitrální regurgitace, která vzniká v důsledku degenerativních změn listů a závěsného aparátu chlopně. Morfologické změny levé síně jsou provázeny i změnami funkce levé síně. Na základě dat ze studií hodnotících funkci levé síně echokardiograficky či s využitím magnetické rezonance byl prokázány abnormality všech fází práce levé síně (rezervoárové, průtokové i kontraktilní) (7, 8). Je zřejmé, že tyto změny mají význam pro rozvoj fibrilace síní.
Věkem podmíněná remodelace pravé komory. Fiechterova studie přinesla data o změnách geometrie pravé komory a vývoji její ejekční frakce. Podobně jako u levé komory, i u pravé komory dochází k poklesu jejích objemových charakteristik (end‑diastolický i end‑systolický objem), s ohledem na významnější pokles end‑diastolického objemu dochází k mírnému nárůstu ejekční frakce. Tyto poznatky potvrdily i další studie při hodnocení dalších ukazatelů systolické funkce pravé komory (např. TAPSE či vlny s’ pw‑dopplerovského pohybu laterální části anulu trikuspidální chlopně) (9).
S věkem dochází také k remodelaci pravé síně, tj. zvětšování objemu pravé síně a jejího indexu. Podrobné morfologické studie prokázaly také změnu geometrie vústění horní a dolní duté žíly v závislosti na věku (posun osy horní a dolní duté žíly, které vedou k narušení fyziologického plnění pravé síně) (9).
Pohlavní rozdíly v procesu věkem podmíněné remodelace levé komory jsou významné. V porovnání se ženami přetrvává u mužů i v průběhu věku většinou větší absolutní masa levé komory a větší objemy srdečních oddílů, u žen dochází s věkem k významnějšímu poklesu objemu srdečních dutin. Výsledkem je stav, kdy ve vyšším věku u žen dominuje proces koncentrické remodelace (zvýšený poměr masy/ objemu levé komory), který je velmi pravděpodobně hlavní příčinou častějšího výskytu srdečního selhání se zachovalou funkcí levé komory, zatímco u mužů převažuje pokles systolické funkce levé komory (10).
Funkční změny myokardu v souvislosti s věkem
Jak bylo uvedeno výše, u zdravých jedinců je klidová systolická funkce obou komor dlouhodobě zachovaná, podle některých studií se může mírně zvýšit (např. v důsledku mitrální, resp. trikuspidální insuficience vzniklé na podkladě degenerativních změn chlopenního aparátu). Diastolická funkce levé komory klesá v důsledku narůstání tuhosti a snižování poddajnosti stěny levé komory. K funkčním změnám dochází také u obou síní.
Významným faktorem, který se uplatňuje při zabezpečení srdečního výdeje při fyzické námaze, je snížení maximální tepové frekvence. Dochází k ní s věkem a jejími příčinami jsou: (1) pokles tvorby vzruchů v sinusovém uzlu (orientačně lze maximální tepovou frekvenci odvodit ze vztahu 220 – věk), (2) dále pokles chronotropní odpovědi na betaadrenergní stimuly (11).
Hemodynamická vyšetření prokázala, že při fyzické námaze dochází ke změně řady parametrů a že jejich změna je závislá nejenom na stupni zátěže, ale také na věku.
V důsledku fyzické zátěže dochází ke vzestupu systémového a středního krevního tlaku, přičemž v závislosti na věku je jeho vzestup u starších vyšší, podobně dochází ke zvýšení systémové vaskulární rezistence. Opačně se chová srdeční výdej, srdeční index a tepový objem, které se v důsledku zvýšení fyzické aktivity zvyšují, ale tento vzestup se s narůstajícím věkem snižuje.
Při hodnocení hemodynamických poměrů v plicním řečišti bylo prokázáno, že zátěž vede ke vzestupu řady hemodynamických parametrů (tlak v pravé síni, střední tlak v pliním řečišti, tlak v zaklínění, plicní cévní rezistence), ašak s věkem je tento vzestup vyšší. Tato situace vede ke zvýšená nároků a funkci pravostranných oddílů při fyzické zátěži (12).
Vliv věku na odpověď kardiovaskulárního systému na zátěž v běžné praxi velmi dobře dokumentuje kompozitní ukazatel maximální spotřeby kyslíku při fyzické zátěži (VO2max), který s věkem i u zdravých jedinců významně klesá.
Základní mechanismy věkem podmíněné remodelace myokardu
Základem věkem podmíněné remodelace myokardu jsou procesy, které postihují dvě základní komponenty myokardu: buněčnou složku (především srdeční myocyty) a extracelulární matrix. Podle současných znalostí se v průběhu věku uplatňuje řada procesů, které vedou k poruše funkce kardiomyocytů. Mezi nimi mají významnou roli: oxidativní stres (zvýšená produkce kyslíkových radikálů), perzistence zánětu o nízké intenzitě a snížená funkce mitochondrií. Mezi ostatní procesy patří poruchy funkce sarkoplazmatického retikula, dále zkracování telomer, buněčná senescence, nestabilita genomu, epigenetické změny, snížená odolnost na působení zevních stresorů, porucha tvorby a reparace sarkolemálních proteinů a poruchy regulace energetických procesů myocytu. Řada abnormalit funkce srdečních myocytů zvyšuje jejich senzitivitu pro působení zevních patogenetických činitelů (hypoxie, kyslíkové radikály aj.), což vede k indukci apoptotických procesů v myokardu.
V posledních letech přibyly důkazy o snižování schopnosti regenerace myokardu, která narůstá s věkem. V poslední dekádě se objevily práce prokazující schopnost regenerace myokardu (přibližně 0,5–2 % nových buněk/rok) (13–15). V důsledku stárnutí, především genetických a epigenetických faktorů, je tato schopnost významně narušena (16).
V průběhu věku dochází také k významným změnám extracelulární matrix, které zahrnují změnu struktury kolagenních vláken (pokles zastoupení kolagenu III a zvýšené zastoupení kolagenu I), zvýšenou tvorbu příčných spojení (cross‑linking) mezi vlákny kolagenu. Ke zvýšené tvorbě příčných můstků přispívá také zvýšená koncentrace konečných produktů pokročilé glykace (advanced glycation end products, AGEs), které vedou ke zvýšené tvorbě vazeb mezi různými složkami extracelulární matrix (kolagenem, lamininem a elastinem) (17). Následkem je zvýšení tuhosti stěny myokardu. Významnou roli v produkci a degradaci složek extrace ‑ lulární matrix mají metaloproteinázy a jejich tkáňové inhibitory. S věkem dochází k poruše funkce řady metaloproteináz (např. MMP 9, 12, 28) a jejich tkáňových inhibitorů (TIMP-1, 2, 3) (18). Věk ovlivňuje také funkci srdečních fibroblastů, které produkují jednotlivé typy kolagenu, fibronektinu a dalších molekul včetně některých metaloproteináz a jejich tkáňových inhibitorů. V průběhu věku dochází také ke změně funkce makrofágů, které jsou přítomny také v myokardu a mají řadu regulačních funkcí (lokální produkce cytokinů, ovlivnění funkce matrixmetaloproteináz a podobně) (16).
Další mechanismy. S věkem dochází také ke zvýšenému ukládání amyloidu do myokardu (tzv. „wild‑type“ transthyretinová amyloidóza, ATTRwt, dříve označovaná jako senilní amyloidóza). Ke zvýšenému ukládání tohoto typu amyloidu dochází u některých pacientů po 60. roce, podle sekčních nálezů je možné nalézt tento typ amyloidózy až u 25 % pacientů ve věku nad 80 let (19).
Mozaiku patogenetických procesů podílejících se na změně funkce myokardu doplňují také cévní změny (vascular aging), ke kterým dochází v průběhu stárnutí (20). Stav je provázen snadnějším ukládáním lipidových částic do stěny cévní. V jejich důsledku se prohlubuje dysfunkce endotelu, dochází k poruchám mikrocirkulace. Tyto změny také přispívají k poklesu funkce myokardu.
Tab. 1. Charakteristika věkem podmíněné remodelace myokardu 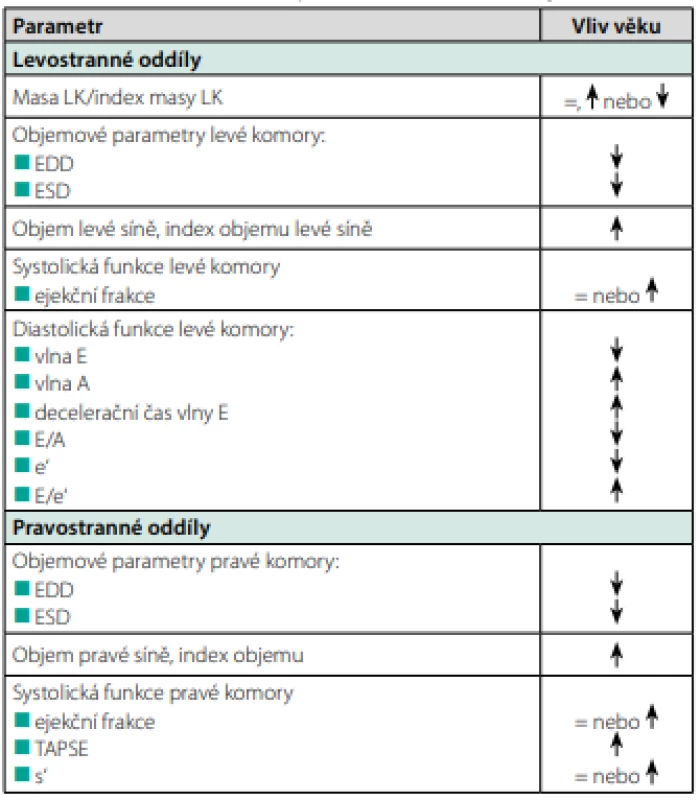
Role komorbidit a životního stylu
Výše uvedené věkem podmíněné změny struktury a funkce myokardu jsou velmi intenzivně ovlivňovány působením řady komorbidit a životním stylem.
Mezi komorbidity, které velmi významně ovlivňují funkci myokardu ve vyšším věku, patří především: arteriální hypertenze, ischemická choroba srdeční, hypercholesterolemie, diabetes mellitus, onemocnění ledvin, chronická anémie a řada dalších.
U arteriální hypertenze dochází k rozvoji některých patogenetických mechanismů, které jsou aditivním faktorem v procesu remodelace myokardu: hypertrofie myokardu (koncentrická v iniciálních stadiích, excentrická ve velmi pokročilých stadiích), zvýšení tuhosti stěny myokardu. Tyto procesy vznikají na základě z části podobných strukturálních změn myokardu a jejich následkem je časný vznik srdečního selhání (se zachovalou, následně se sníženou systolickou funkcí levé komory) (21, 22).
Podobně ischemická choroba srdeční a hyperlipidemie může vést k řadě vaskulárních změn v myokardu (dysfunkce endotelu, progrese aterosklerotických změn s postižením většiny typů cév). Následkem je porucha mikrocirkulace v myokardu a snížení kontraktility. Jindy dochází přímo k vyřazení významné části myokardu (infarkt myokardu). V těchto situacích pak významně závisí na aktuálním funkčním stavu myokardu v době vzniku akutní léze (23).
Diabetes mellitus je velmi častou komorbiditou u starších pacientů. I v jeho patogenezi jsou některé mechanismy vedoucí k rozvoji srdečního selhání shodné s těmi, které se uplatňují v patogenezi věkem podmíněné remodelace myokardu (zvýšená tvorba pokročilých produktů glykace proteinů, fibróza, dysfunkce mitochondrií, oxidativní stres, perzistující zánět, zvýšená utilizace mastných kyselin, poruchy metabolismu kalcia, epigenetické vlivy a řada dalších) (24).
Obezita a selhání ledvin jsou provázeny řadou hemodynamických i endokrinních změn, které mohou významně ovlivňovat remodelaci srdce (izolovaně vedou spíše k hypervolemii a excentrickému typu remodelace, to však může být ovlivněno jejich častou kombinací s hypertenzí.
Životní styl má významnou (možná nedoceněnou) roli v rozvoji věkem podmíněné remodelace myokardu. Je prokázáno, že nedostatek aerobní fyzické aktivity, vysoký energetický příjem, nevhodná skladba potravy, kouření, nadbytek stresu jsou negativními faktory, které urychlují proces stárnutí myokardu (16, 25). Obr. 1. ukazuje schematické znázornění vztahu mezi věkem podmíněnými procesy myokardu, komorbiditami a možnosti terapeutického zásahu.
Obr. 1. Vztah mezi věkem podmíněnými procesy myokardu, komorbiditami a možnostmi terapeutického zásahu. Upraveno podle (26) 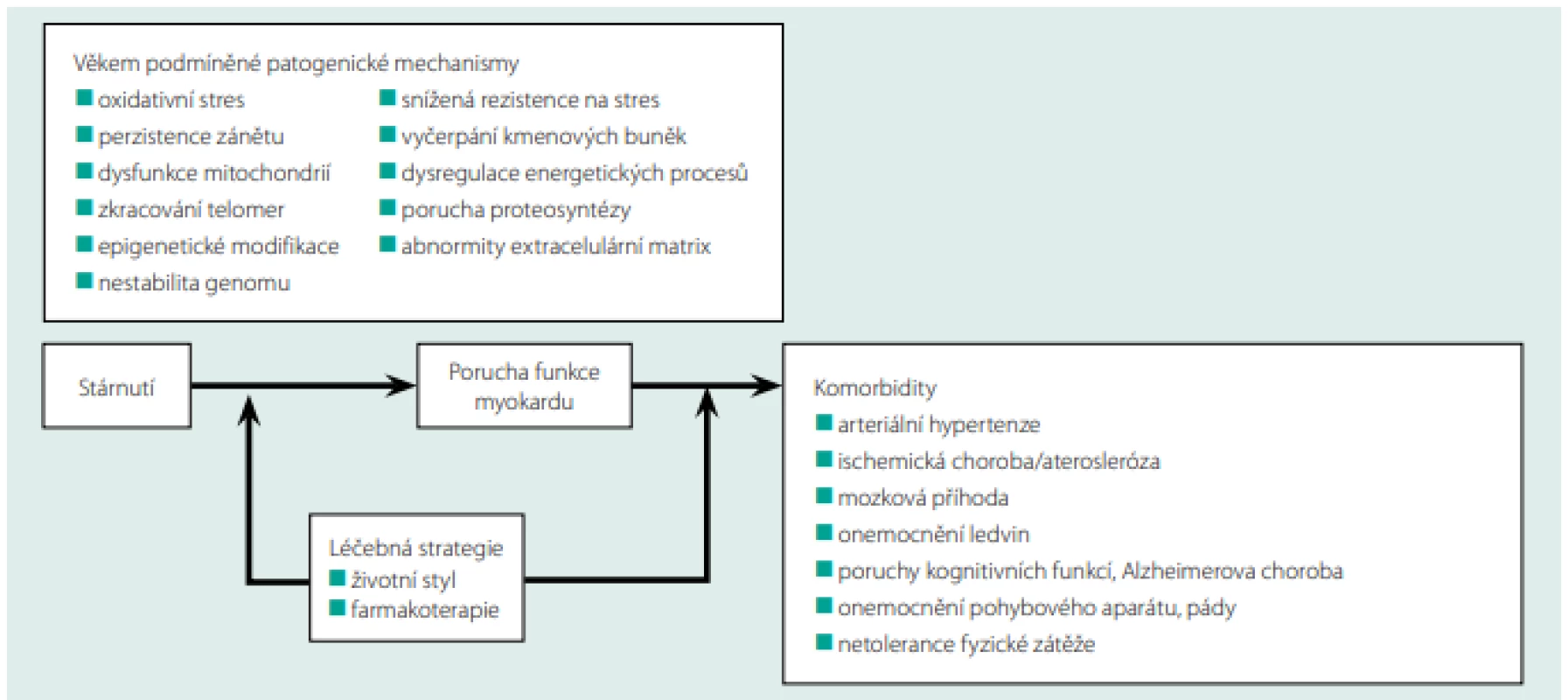
Genetická predispozice má významnou roli jak v procesu stárnutí cév, tak i v procesu věkem podmíněné remodelace myokardu.
Možnosti ovlivnění věkem podmíněné remodelace myokardu
V posledních letech se objevuje řada publikací, které se věnují možnostem ovlivnění věkem podmíněné remodelace myokardu, respektive navržení strategie optimalizace procesu stárnutí myokardu. Tato strategie má tyto základní směry:
- zdravý životní styl s dostatkem fyzické aktivity, optimálního energetického příjmu, vhodnou skladbou přijímané potravy, eliminací nadměrného působení stresujících vlivů, eliminací působení toxických vlivů (kouření, nadměrného požívání alkoholických nápojů)
- důsledná léčba komorbidit (arteriální hypertenze, hyperlipidemie, ischemické choroby srdeční, diabetu, obezity, renálního selhávání, depresivních stavů a podobně)
Při hodnocení vlivu jednotlivých složek zdravého životního stylu se ukazuje, že jedním z nejvýznamnějších, který má přímý vliv na proces věkem podmíněné remodelace myokardu, je dostatek fyzické aktivity, respektive aerobní trénink. Je prokázáno, že pravidelná fyzická aktivita dostatečné intenzity i ve vyšším věku dokáže významně zlepšit funkční stav (vzestup maximální spotřeby kyslíku při zátěži) (27), optimalizovat proces remodelace (normalizace poměru hypertrofie/objem levé komory) (28, 29). Pravidelná fyzická aktivita příznivě ovlivňuje i mechanismy, které podporují nežádoucí remodelaci myokardu (dysfunkce mitochondrií, produkce kyslíkových radikálů, fibróza myokardu, genetické a epigenetické změny, snížené reparační a regenerační schopnosti myokardu) (30–33).
Další zásadní význam, který se promítá do prevence stárnutí celého kardiovaskulárního systému, má včasná identifikace a eliminace (léčba) rizi ‑ kových faktorů. Studie z poslední doby ukazují, že negativním významným prvkem, který přispívá k nežádoucí remodelaci myokardu a sekundárně ke vzniku komplikací, je délka působení rizikových faktorů. Zde je nutné zmínit studii Briana Ference a kol., kteří se věnovali problematice vztahu genetických variant asociovaných s hladinami LDL‑cholesterolu a systolic ‑ kého krevního tlaku a celoživotního rizika kardiovaskulárních onemocnění. Cílem studie bylo zhodnotit vliv celoživotní expozice základním rizikovým faktorům (zvýšený LDL cholesterol a arteriální hypertenze), jako podklad pro analýzu sloužila genetická analýza variant genů asociovaných se zvýšenou hladinou LDL cholesterolu (bylo analyzováno 100 variant) a vyššího krevního tlaku (61 variant) (34). Studie zahrnovala analýzu dat 438952 pacientů zařazených do registru UK Biobank. Bez ohledu na aktuální hodnoty LDL cholesterolu a výši krevního tlaku byli pacienti rozděleni do 4 skupin podle genetického rizika: skupina 1 s nízkým rizikem LDL hypercholesterolemie a nízkým rizikem vyššího krevního tlaku, skupina 2 zahrnujícími geny podmiňující nízké hladiny LDL cholesterolu, skupina 3 zahrnující pacienty s geny podmiňujícími nižší krevní tlak a skupina 4 zahrnovala ostatní pacienty a současně sloužila jako referenční skupina. Následně byli pacienti sledováni po dobu 8–12 let. Hlavní sledovaný ukazatel (kardiovaskulární úmrtí, nefatální infarkt myokardu a koronární revaskularizace) se vyskytl u 24980 pacientů. Studie ukázala, že pacienti s genetickými vlohami pro nižší LDL cholesterol a nižší TK současně měli nejnižší výskyt sledovaných ukazatelů (OR 0,61, 95% CI, 0,59–0,64; p < 0,001), druhý nejnižší výskyt sledovaných ukazatelů měli pacienti s vlohami pro nižší LDL cholesterol (OR 0,73, 95% CI: 0,70–0,75; p < 0,001), pak následovali pacienti s vlohami pouze pro nižší krevní tlak (OR 0,82, 95% CI: 0,79–0,85, p < 0,001). Studie prokázala význam délky expozice rizikovým faktorům na osud nemocných a význam aktivního pátrání po rizikovém profilu nemocných (například na základě tabulek SCORE) a včasné korekce (35, 36).
Závěr
Věkem podmíněná remodelace myokardu je dlouhodobý proces, který zahrnuje široké spektrum patogenetických mechanismů. Výsledkem jsou strukturální a funkční změny, které mohou ústit v rozvoj srdečního selhání, snižovat kvalitu života a zvyšovat tak morbiditu i mortalitu pacientů. Jde o proces, který mohou negativně ovlivnit rizikové faktory kardiovaskulárních onemocnění, řada komorbidit, naopak tento proces lze významně pozitivně ovlivnit změnou životního stylu, včasnou detekcí rizikových faktorů a důslednou léčbou komorbidit.
Podpořeno grantem AZV MZ ČR NV19-02-00297 a institucionální podporou Lékařské fakulty Univerzity Karlovy v Hradci Králové Progres Q 40/03.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Radek Pudil, Ph.D.,
1. interní kardiongiologická klinika LF UK a FN Hradec Králové,
Sokolská 581,
500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2020; 66(8): 507–511
Článek přijat redakcí: 13. 10. 2020
Článek přijat po recenzích: 28. 10. 2020
Zdroje
1. Magnussen C, Niiranen TJ, Ojeda FM, Gianfagna F, Blankenberg S, Vartiainen E, Sans S, Pasterkamp G, Hughes M, Costanzo S, Donati MB, Jousilahti P, Linneberg A, Palosaari T, de Gaetano G, Bobak M, den Ruijter HM, Jorgensen T, Soderberg S, Kuulasmaa K, Zeller T, Iacoviello L, Salomaa V, Schnabel RB, BiomarCa REC. Sex‑Specific Epidemiology of Heart Failure Risk and Mortality in Europe: Results From the BiomarCaRE Consortium. JACC Heart Fail. 2019; 7(3): 204–213.
2. Redfield MM, Jacobsen SJ, Burnett JC, Jr., Mahoney DW, Bailey KR, Rodeheffer RJ. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA. 2003; 289(2): 194–202.
3. Cheng S, Fernandes VR, Bluemke DA, McClelland RL, Kronmal RA, Lima JA. Age‑related left ventricular remodeling and associated risk for cardiovascular outcomes: the Multi‑Ethnic Study of Atherosclerosis. Circ Cardiovasc Imaging. 2009; (3): 191–198.
4. Fiechter M, Fuchs TA, Gebhard C, Stehli J, Klaeser B, Stahli BE, Manka R, Manes C, Tanner FC, Gaemperli O, Kaufmann PA. Age‑related normal structural and functional ventricular values in cardiac function assessed by magnetic resonance. BMC Med Imaging. 2013; 13 : 6.
5. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, Falk V, Gonzalez‑Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GMC, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P, Group ESCSD. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016; 37(27): 2129–2200.
6. Nagueh SF, Smiseth OA, Appleton CP, Byrd BF, 3rd, Dokainish H, Edvardsen T, Flachskampf FA, Gillebert TC, Klein AL, Lancellotti P, Marino P, Oh JK, Alexandru Popescu B, Waggoner AD, Houston T, Oslo N, Phoenix A, Nashville T, Hamilton OC, Uppsala S, Ghent, Liege B, Cleveland O, Novara I, Rochester M, Bucharest R, St. Louis M. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovas ‑ cular Imaging. Eur Heart J Cardiovasc Imaging. 2016; 17(12): 1321–1360.
7. Evin M, Redheuil A, Soulat G, Perdrix L, Ashrafpoor G, Giron A, Lamy J, Defrance C, Roux C, Hatem SN, Diebold B, Mousseaux E, Kachenoura N. Left atrial aging: a cardiac magnetic resonance feature‑tracking study. Am J Physiol Heart Circ Physiol. 2016; 310(5): H542–549.
8. Jalife J, Kaur K. Atrial remodeling, fibrosis, and atrial fibrillation. Trends Cardiovasc Med. 2015; 25(6): 475–484.
9. Wehrum T, Lodemann T, Hagenlocher P, Stuplich J, Ngo BTT, Grundmann S, Hennemuth A, Hennig J, Harloff A. Age‑related changes of right atrial morphology and inflow pattern assessed using 4D flow cardiovascular magnetic resonance: results of a population‑based study. J Cardiovasc Magn Reson. 2018; 20(1): 38.
10. Merz AA, Cheng S. Sex differences in cardiovascular ageing. Heart. 2016; 102(11): 825–831.
11. Christou DD, Seals Dr. Decreased maximal heart rate with aging is related to reduced {beta}-adrenergic responsiveness but is largely explained by a reduction in intrinsic he ‑ art rate. J Appl Physiol (1985). 2008; 105(1): 24–29.
12. Wolsk E, Bakkestrom R, Thomsen JH, Balling L, Andersen MJ, Dahl JS, Hassager C, Moller JE, Gustafsson F. The Influence of Age on Hemodynamic Parameters During Rest and Exercise in Healthy Individuals. JACC Heart Fail. 2017; 5(5): 337–346.
13. Senyo SE, Steinhauser ML, Pizzimenti CL, Yang VK, Cai L, Wang M, Wu TD, Guerquin‑Kern JL, Lechene CP, Lee RT. Mammalian heart renewal by pre‑existing cardiomyocytes. Nature. 2013 Jan; 493(7432): 433–436.
14. Bergmann O, Bhardwaj RD, Bernard S, Zdunek S, Barnabe‑Heider F, Walsh S, Zupicich J, Alkass K, Buchholz BA, Druid H, Jovinge S, Frisen J. Evidence for cardiomyocyte renewal in humans. Science. 2009; 324(5923): 98–102.
15. Bergmann O, Zdunek S, Felker A, Salehpour M, Alkass K, Bernard S, Sjostrom SL, Szewczykowska M, Jackowska T, Dos Remedios C, Malm T, Andra M, Jashari R, Nyengaard JR, Po ‑ ssnert G, Jovinge S, Druid H, Frisen J. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 2015; 161(7): 1566–1575.
16. Li H, Hastings MH, Rhee J, Trager LE, Roh JD, Rosenzweig A. Targeting Age‑Related Pathways in Heart Failure. Circ Res. 2020; 126(4): 533–551.
17. Lindsey ML, Goshorn DK, Squires CE, Escobar GP, Hendrick JW, Mingoia JT, Sweterlitsch SE, Spinale FG. Age‑dependent changes in myocardial matrix metalloproteinase/tissue inhibitor of metalloproteinase profiles and fibroblast function. Cardiovasc Res. 2005; 66(2): 410–419.
18. Triposkiadis F, Xanthopoulos A, Parissis J, Butler J, Farmakis D. Pathogenesis of chronic heart failure: cardiovascular aging, risk factors, comorbidities, and disease modifiers. Heart Fail Rev. 2020 Jun 10.
19. Gonzalez‑Lopez E, Gallego‑Delgado M, Guzzo‑Merello G, de Haro‑Del Moral FJ, Cobo‑Marcos M, Robles C, Bornstein B, Salas C, Lara‑Pezzi E, Alonso‑Pulpon L, Garcia‑Pavia P. Wild‑type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J. 2015; 36(38): 2585–2594.
20. Vaclavik J. Blood vessel ageing and vascular memory. Vnitr Lek. 2020; 66(2): 104–110.
21. Messerli FH, Rimoldi SF, Bangalore S. The Transition From Hypertension to Heart Failure: Contemporary Update. JACC Heart Fail. 2017; 5(8): 543–551.
22. López‑Sainz A dH‑DMJ, Dominguez F, Restrepo‑Cordoba A, Amor‑Salamanca A, Hernandez‑Hernandez A, Ruiz‑Guerrero L, Krsnik I, Cobo‑Marcos M. Prevalence of cardi ‑ ac amyloidosis among elderly patients with systolic heart failure or conduction disorde ‑ rs. Amyloid. 2019; 26 : 156–136.
23. Triposkiadis F, Xanthopoulos A, Butler J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. J Am Coll Cardiol. 2019; 74(6): 804–813.
24. Tousoulis D, Oikonomou E, Siasos G, Stefanadis C. Diabetes Mellitus and Heart Failure. Eur Cardiol. 2014; 9(1): 37–42.
25. Seals DR, Brunt VE, Rossman MJ. Keynote lecture: strategies for optimal cardiovascular aging. Am J Physiol Heart Circ Physiol. 2018; 315(2): H183–H188.
26. Seals DR, Brunt VE, Rossman MJ. Keynote lecture: strategies for optimal cardiovascu ‑ lar aging. 2018; 315(2): H183–H188.
27. Woo JS, Derleth C, Stratton JR, Levy WC. The influence of age, gender, and training on exercise efficiency. J Am Coll Cardiol. 2006; 47(5): 1049–1057.
28. Roh J, Rhee J, Chaudhari V, Rosenzweig A. The Role of Exercise in Cardiac Aging: From Physiology to Molecular Mechanisms. Circ Res. 2016; 118(2): 279–295.
29. Fujimoto N, Prasad A, Hastings JL, Arbab‑Zadeh A, Bhella PS, Shibata S, Palmer D, Levine BD. Cardiovascular effects of 1 year of progressive and vigorous exercise training in previously sedentary individuals older than 65 years of age. Circulation. 2010; 122(18): 1797–1805.
30. Werner C, Hanhoun M, Widmann T, Kazakov A, Semenov A, Poss J, Bauersachs J, Thum T, Pfreundschuh M, Muller P, Haendeler J, Bohm M, Laufs U. Effects of physical exercise on myocardial telomere‑regulating proteins, survival pathways, and apoptosis. J Am Coll Cardiol. 2008; 52(6): 470–482.
31. Werner C, Furster T, Widmann T, Poss J, Roggia C, Hanhoun M, Scharhag J, Buchner N, Meyer T, Kindermann W, Haendeler J, Bohm M, Laufs U. Physical exercise prevents cellular senescence in circulating leukocytes and in the vessel wall. Circulation. 2009; 120(24): 2438–2447.
32. Liao PH, Hsieh DJ, Kuo CH, Day CH, Shen CY, Lai CH, Chen RJ, Padma VV, Kuo WW, Huang CY. Moderate exercise training attenuates aging‑induced cardiac inflammation, hypertrophy and fibrosis injuries of rat hearts. Oncotarget. 2015; 6(34): 35383–35394.
33. Vujic A, Lerchenmuller C, Wu TD, Guillermier C, Rabolli CP, Gonzalez E, Senyo SE, Liu X, Guerquin‑Kern JL, Steinhauser ML, Lee RT, Rosenzweig A. Exercise induces new cardiomyocyte generation in the adult mammalian heart. Nat Commun. 2018; 9(1): 1659.
34. Ference BA, Bhatt DL, Catapano AL, Packard CJ, Graham I, Kaptoge S, Ference TB, Guo Q, Laufs U, Ruff CT, Cupido A, Hovingh GK, Danesh J, Holmes MV, Smith GD, Ray KK, Ni ‑ cholls SJ, Sabatine MS. Association of Genetic Variants Related to Combined Exposure to Lower Low‑Density Lipoproteins and Lower Systolic Blood Pressure With Lifetime Risk of Cardiovascular Disease. JAMA. 2019; 322 : 1381–1391.
35. Ray KK, Laufs U, Cosentino F, Lobo MD, Landmesser U. The year in cardiology: cardiovascular prevention. Eur Heart J. 2020; 41(11): 1157–1163.
36. Lim GB. Reductions in LDL‑cholesterol and blood‑pressure levels have cumulative benefits. Nat Rev Cardiol. 2019; 16(11): 650.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 8- Nová klasifikace vnímání rizikových faktorů a etiologie kardiovaskulárních onemocnění
- Zástava srdce u pacienta se střelnými ranami – kazuistika
- Genetický výzkum potvrdil asociaci mezi autismem a střevními obtížemi
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Prof. Jiří Šonka a obezitologie
- Změny farmakokinetiky léčiv u obézních pacientů
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Fixní kombinace rosuvastatinu s ezetimibem
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- The role of metabolic syndrome in the induction of chronic pancreatitis after a first attack of acute pancreatitis – multicenter trial
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



