-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Obrovskobuněčná arteriitida: kontroverzní otázky
Giant cell arteritis: controversial issues
Giant cell arteritis is the most common vasculitis in adults. The author presents the latest findings in diagnostics and treatment emphasising the growing importance of non-invasive examination methods where a biopsy of the temporal artery is no longer considered the only possible examination that confirms the diagnosis. He emphasises the importance of early diagnosis and initiation of treatment and also points out difficulties in treatment, especially frequent relapses. In addition to glucocorticoids, modern drugs influencing the decisive factors in the pathogenesis of inflammation are beginning to gain ground in treatment. Despite of new findings, there is a number of controversial issues remaining that the author addresses in more details: from terminology and epidemiology to diagnosis and treatment.
Keywords:
giant cell arteritis – temporal artery biopsy – non-invasive diagnostics – glucocorticoids – tocilizumab
Autori: Štefan Alušík
Pôsobisko autorov: Katedra vnitřního lékařství, Institut postgraduálního vzdělávání ve zdravotnictví, Praha
Vyšlo v časopise: Vnitř Lék 2021; 67(4): 224-229
Kategória:
Súhrn
Obrovskobuněčná arteriitida je nejčastěji se vyskytující vaskulitida u dospělých. Autor uvádí nejnovější poznatky v diagnostice i léčbě, zdůrazňuje rostoucí význam neinvazivních vyšetřovacích metod, kdy biopsie temporální arterie se již nepokládá za jediné možné vyšetření potvrzující diagnózu. Zdůrazňuje důležitost včasné diagnostiky i zahájení léčby. Upozorňuje na úskalí v léčbě, zejména časté relapsy. Kromě glukokortikoidů se v léčbě začínají prosazovat moderní přípravky, které ovlivňují rozhodující faktory v patogeneze zánětu. Přes nové poznatky zůstává nadále mnoho kontroverzních otázek, kterým se autor blíže věnuje, a to od terminologie a epidemiologie až po diagnostiku a léčbu.
Klíčová slova:
obrovskobuněčná arteriitida – biopsie temporální tepny – neinvazivní diagnostika – glukokortikoidy – tocilizumab
Úvod
Obrovskobuněčná arteriitida (OBA) je nejčastěji se vyskytující vaskulitidou u dospělých. Její diagnostika, zejména u chybění kraniální manifestace, je velice obtížná. Vzhledem k častým relapsům totéž platí i pro léčbu. Přitom novější poznatky o této nemoci v širší lékařské veřejnosti jsou malé. Ke správné diagnóze i léčbě dochází opožděně a často již s nevratným poškozením pacienta. Podle poslední klasifikace vaskulitid patří OBA do první skupiny vaskulitid, postihující cévy velkého kalibru (1).
Kontroverze v terminologii
V moderní historii onemocnění popsal poprvé v roce 1890 Hutchinson jako trombotickou arteritidu u starých jedinců. V tabulce 1 (2–10) jsou uvedeny historické názvy navrhované pro toto onemocnění. V současnosti se používá upravený název podle Gilmoura na základě charakteristického nálezu obrovských buněk při histologickém vyšetření postižených tepen. V roce 1963 Alestig a Borr (11) zjistili, že pacienti s revmatickou polymyalgií mají také pozitivní histologický nález z biopsie temporální tepny. Podobný nález zjistil i Hamrin (10) o rok později a pro tento klinický stav navrhl termín „polymyalgia arteritica“. V následujících letech začala diskuze o tom, zda by se mohlo jednat o jednu nemoc, i když s mnoha otazníky (12). Postupně přibývalo důkazů, že obrov - skobuněčná arteriitida a revmatická polymyalgie by mohla být jedna nemoc. Zejména nové vyšetřovací metody jako pozitronová emisní tomografie kombinovaná s výpočetní tomografií s 18-fluoro-deoxy-glukózou (18 FDG-PET/CT), případně kombinovaná s angiografií-PET/CTA, zcela změnily náhled na toto onemocnění. Většina odborníků se dnes domnívá, že jde o spektrum projevů jedné nemoci – obrovskobuněčné arteriitidy. Posledních 10 let se také diskutuje, zda OBA a Takayasuova arteriitida (TA) je jedna nemoc. TA podobně jako OBA postihuje aortu a velké tepny a má stejný histologický nález. V současnosti však převažuje názor, že jde o dvě samostatné jednotky (13).
Tab. 1. Navrhované názvy jednotlivými autory v minulosti pro obrovskobuněčnou arteriitidu. Upraveno podle Hundera (2) 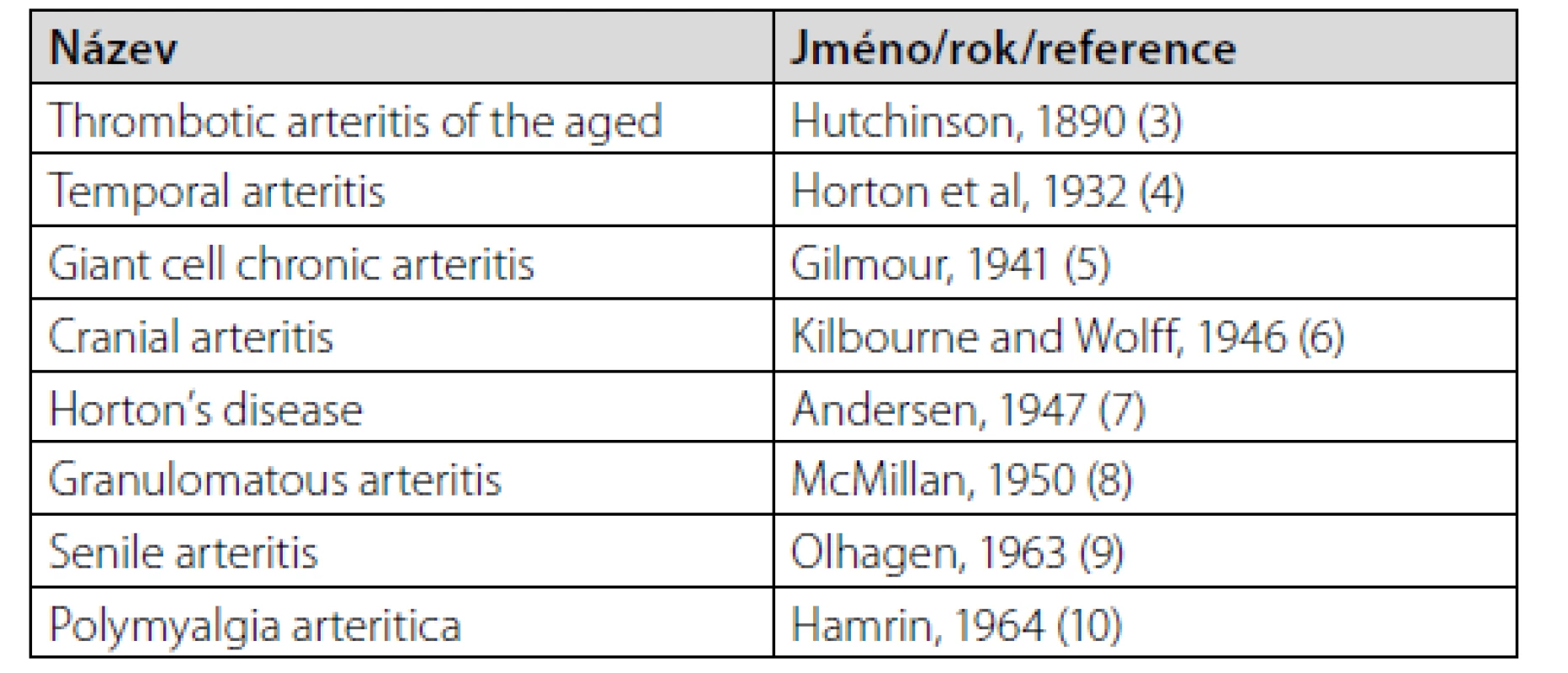
Proč byl starý název „temporální arteritida“ zaměněn za nový – OBA? Nový název měl odstranit asociaci nemoci jako lokálního postižení temporální tepny (TT). Kromě toho temporální arterie u této nemoci vůbec nemusí být postižena, a naopak může být (vzácně) postižena i u jiných vaskulitid, např. u granulomatózy s polyangitidou. Nový název OBA byl přijat po mezinárodním konsenzu v r 1994. Do té doby se nejčastěji používal název temporální arteriitida, OBA, nebo obojí současně, méně často kraniální arteriitida. Ukázalo se však, že obrovské buňky nejsou přítomny u poloviny vyšetřovaných bioptických vzorků a také jejich přítomnost není nutná pro stanovení patologicko-anatomické diagnózy. A nakonec ani nález obrovských buněk a granulomatózní zánět není charakteristický jen pro toto onemocnění. Také zařazení mezi vaskulitidy postihující velké tepny je trochu nepřesné. I když u OBA jsou postiženy hlavně aorta a velké tepny, postiženy jsou i střední a malé tepny (temporální a její větve nebo např. malé ciliární tepničky, o kterých se zmiňujeme níže a které patří k nejčastěji postiženým).
Výskyt: V Evropě se OBA nejčastěji vyskytuje ve Skandinávii, kde se incidence onemocnění pohybuje v průměru kolem 20/100 000 obyvatel (nad 50 let, dále*) /rok. Nejvyšší je na Islandu (43,8/100 000*/rok) a směrem na jih klesá (Španělsko 10/100 000*/rok a Itálie 5,8/100 000*/rok) (14). Výjimku ze skandinávských zemí tvoří Finsko (jiné původní osídlení) s incidencí 7,2/100 000*/rok, což je hodnota podobná jako v jižních zemích Evropy.
Podobně vysoký výskyt onemocnění jako na severu Evropy byl zaznamenán v USA (Olmsted county). V tomto okrese (ale i v celém státě Minnesota) tvoří velkou část obyvatelstva potomci přistěhovalců ze Skandinávie. Prevalence OBA je 204/100 000* obyvatel (15).
Incidence onemocnění, které se manifestuje pod obrazem revmatické polymyalgie, je 3krát vyšší než u klinické manifestace OBA a jeho prevalence je také nejvyšší v Norsku – 701/100 000*, v Itálii je téměř desetinásobně nižší.
OBA se častěji vyskytuje u žen, a to v poměru k mužům 2,5–3 : 1. I když OBA je onemocnění postihující seniory, bylo zaznamenáno i v mladém věku jako „juvenilní temporální arteriitida“. Doposud bylo popsáno 32 kazuistických pozorování.
Příčina onemocnění je nejasná. Podobně jako u jiných autoimunitních onemocnění se předpokládá environmentální spouštěcí faktor u geneticky predisponovaného jedince. U nemocných byla zvýšená incidence antigenu HLA-DR4 a zejména alel HLA-DRB1*04 (16). Již dlouho se předpokládalo, že jako spouštěč imunitních zánětlivých reakcí organismu mohou být infekce – bakteriální i virové (Chlamydia pneumonia, Burkholderia, cytomegalovirus, erytrovirus B19, herpes simplex, parainfluenza 1 a další), ale příčinný vztah mezi nimi a vaskulitidou nebyl dosud prokázán. Také úloha viru herpes zoster v patogeneze onemocnění, o které se dlouhé roky spekulovalo, byla nedávno zpochybněna (17).
V patogeneze zánětu se přičítá důležitá role věkem podmíněným změnám ve stěně tepen jak biochemických, tak i strukturálních, což vede k poklesu tolerance vlastních tkání. Zánět začíná v adventicii tepny. Za klíčové se pokládá aktivace dendritických buněk, které začnou produkovat celou řadu interleukinů, chemotaktických pro T lymfocyty, včetně Th1, Th17 a Th 19 buněk. Th1 buňky se přes IL-12 podílejí na syntéze interferonu gama, Th17 produkují IL-17. Glukokortikoidy inhibují Th17 buňky, ale Th1 ne a ty mají důležitou roli v udržování chronického zánětu u OBA. Interferonem indukované hladké svalové buňky produkují chemokiny. Ty ovlivňují monocyty, které tvoří obrovské vícejaderné buňky. Monocyty se mění na makrofágy ve stěně tepny a produkují IL-6, IL-1beta a TNF-alfa, který je zodpovědný za systémovou zánětlivou odpověď. Hladké svalové buňky mají prozánětlivé vlastnosti a produkují několik růstových faktorů, zejména vaskulární endoteliální růstový faktor (VEGF) a růstový faktor z destiček (PDGF), které způsobují intimální hyperplazii a cévní okluzi. V podrobnostech odkazujeme na Watanabe a kol. (18).
Klinické projevy: Klinický obraz může být zpočátku nenápadný a závisí na rozsahu postižení jednotlivých tepen.
Kraniální příznaky
Bolest hlavy
Bolest hlavy je nejčastějším příznakem (až 75 % pacientů) a obvykle nereaguje na analgetickou léčbu. Jde o stálou bolest, intermitentní nebo jiný typ bolesti je popisován zřídka. Nejčastěji je lokalizována ve spánkové oblasti hlavy, zde může být přítomna vinutá, zduřelá a palpačně citlivá temporální arterie, často s nehmatnou pulzací. Bolesti hlavy mohou být i difuzní, často je citlivý celý skalp. Pacienti nesnášejí česání vlasů, nošení klobouků a jiných pokrývek hlavy, brýlí apod. V japonské studii 63 % pacientů s OBA mělo bolesti v temporální oblasti, 11 % okcipitálně, 11 % frontálně a 5 % difuzní bolesti hlavy. Zbývajících 11 % žádné bolesti hlavy nemělo (19). U každé nově vzniklé a perzistující bolesti hlavy u pacienta nad 60 let vždy diferenciálně diagnosticky zvažujeme i diagnózu OBA (20).
Poruchy zraku
V minulosti se částečná nebo celková ztráta zraku u OBA vyskytovala mnohem častěji, a to v rozmezí 30–60 % (21, 22). V současnosti vzhledem k lepší a časnější diagnostice a léčbě je to kolem 15–25 % pacientů, z toho k ireverzibilní slepotě dojde od 1–15 %. Ve studii Patila et al. (23) byli pacienti s podezřením na OBA urychleně odesíláni na specializované pracoviště s včasným nasazením glukokortikoidů. Ireverzibilní poškození zraku v souboru včasně vyšetřených a léčených pacientů kleslo na 9 %, přičemž v historickém souboru pacientů (2009–2011) to bylo až 37 %. K poškození zraku včetně slepoty dochází náhle a bezbolestně, většinou při vzniku onemocnění. Převažujícím mechanismem očního poškození je ischemie n. opticus. Ten je zásobován ze dvou částí: krátkou přední část zásobují zadní ciliární tepny (větve oftalmické tepny) a zadní část optiku je zásobována z vícero zdrojů (orbitální tepny a anastomózy z retinální tepny). Až 90 % všech zrakových poškození je způsobeno ischemií přední části optického nervu v důsledku poškození zadních ciliárních tepen. Méně často dochází k poškození zraku v důsledku okluze retinální tepny nebo její větve, vzácně při chorioidálním infarktu, nebo při poškození zrakového centra v okcipitální oblasti mozku při ischemii ve vertebrobazilárním povodí (24). Pokud se objeví amaurosis fugax, je varovnou známkou a představuje zvýšené riziko pro trvalou ztrátu zraku. Slepota je většinou trvalá. U malého počtu pacientů může dojít ke slepotě i v prvních dnech po zahájení léčby a naopak, u části nemocných může dojít ke zlepšení zraku.
Diplopie se vyskytuje asi u 3–8 % neselektovaných pacientů s OBA. Objevuje se při ischemii svalů nebo nervů okohybných svalů, vzácně při ischemii mozkového kmene. Taktéž diplopie představuje zvýšené riziko pro trvalou ztrátu zraku. Při postižení jednoho oka je vysoká pravděpodobnost postižení také druhého a při váhání s léčbou hrozí pacientovi kompletní slepota. Až 20 % pacientů s trvalým poškozením zraku nemělo žádné systémové projevy onemocnění (25).
Vzhledem k hrozbě slepoty a také mozkovým cévním příhodám je OBA řazena mezi urgentní medicínské situace!
Jiné kraniální příznaky
Mezi časté příznaky patří bolesti maseterových svalů a také ischemické bolesti jazyka, někdy až se vznikem nekrózy. Klaudikační bolesti maseterových svalů, které se vyskytují až u 45 % pacientů, se pokládají za druhý nejčastější příznak. Zatímco bolesti hlavy jsou nejčastějším projevem OBA, bolesti žvýkacích svalů jsou nejspecifičtějším příznakem korelujícím s pozitivitou biopsie temporální arterie (26).
Ischemické mozkové cévní příhody se vyskytují asi u 10–15 % pacientů při postižení karotických a vertebrálních tepen, častěji jsou postihovány vertebrální a bazilární tepny (27). Klinická manifestace probíhá jako tranzitorní nebo permanentní ischemická ataka, ale také pod obrazem neuropsychiatrických symptomů – 3 % (demence, změna nálad, psychóza), vzácně i pod obrazem audiovestibulární dysfunkce se ztrátou sluchu.
Extrakraniální příznaky
Ischemické projevy na končetinách
Vzhledem k tomu, že OBA postihuje hlavně aortu a z ní odstupující tepny, u postižených cév a aorty dochází ke vzniku stenóz a aneurysmat s odpovídajícím klinickým obrazem. Do této skupiny patří zejména klaudikace na horních i dolních končetinách, asymetrie pulzu a krevního tlaku. Dále sem patří šelesty na periferních tepnách a distální nekrózy nebo gangrény. V souboru pacientů s OBA mělo 26 % postižené subklaviální a axilární tepny a 18 % femoropopliteální tepny. Amputace na horních nebo dolních končetinách mělo 12,5 % pacientů (28).
Aneurysma aorty
Z dlouhodobého hlediska v důsledku zánětu dochází u pacientů ke vzniku aneurysmatu aorty, což je hlavní příčinou morbidity a mortality onemocnění. Ve výše citovaném souboru zemřelo 18 pacientů, z toho 6 na rupturu aorty, u dalších 6 došlo k disekci aorty, u 3 ke vzniku cévní mozkové příhody a u dalších 3 k srdečnímu infarktu. Riziko vzniku aneurysmatu hrudní aorty u pacientů s OBA bylo 17,3x vyšší a břišní aorty 2,4x vyšší v porovnání s běžnou populací (29). Aneurysma se obvykle diagnostikuje za 6 let od počáteční diagnózy OBA. Proto při stanovení diagnózy OBA doporučují někteří autoři rutinní provedení 18-FDG PET/CT, které ukáže metabolický hypersignál v aortě a rozsah jejího poškození. CT vyšetření umožňuje zjistit ztluštění stěny (více než 3 mm) nebo aneurysmatické rozšíření aorty. Zejména v oblasti břišní aorty je možné použít i ultrasonografické vyšetření, které prokáže hypoechogenní haló efekt, ztluštění stěny aorty, případně aneurysma. Pokud jsou tyto změny zachyceny při stanovení diagnózy, zdá se, že korelují s relapsy a snad i s dlouhodobou mortalitou.
Srdeční infarkt
K srdečnímu infarktu v souvislosti s OBA dochází zřídka, v nedávno provedené studii to bylo jenom 2,4 % (30).
Celkové nespecifické projevy
Mezi celkové projevy patří teplota, váhový úbytek, únava/malátnost, tyto projevy jsou časté (42, 50 a 40 %). Do této skupiny se řadí i nevysvětlitelná anémie, která se vyskytuje méně často. V případě, že u pacienta chybí kraniální manifestace, je diagnóza velice obtížná. V některých případech se onemocnění může manifestovat jenom febriliemi, které splňují kritéria pro horečku nejasného původu. Ve vyspělých zemích je OBA nejčastější příčinou horečky nejasného původu u starších pacientů (u mladších jedinců je to Stillova choroba v dospělosti) (31).
Revmatická polymyalgie (PMR) je nejčastější extrakraniální manifestací OBA a také nejčastějším projevem relapsu léčené OBA. Klinicky se projevuje bolestmi v oblasti pletenců ramen a pánve, ranní ztuhlostí a nápadným zlepšením po nízkých dávkách glukokortikoidů. Projevy PMR má asi 50 % pacientů s OBA, ale jen 20 % pacientů s PMR má klinické projevy OBA. U pacientů s PMR, u kterých perzistují vysoké hodnoty zánětlivých markerů, případně nereagují dostatečně na nízké dávky glukokortikoidů, může další vyšetření ukázat oligosymptomatickou formu OBA, která vyžaduje mnohem agresivnější léčbu. Někteří autoři doporučují u PMR standardně provádět 18-FDG-PET/CT vyšetření, které odhalí rozsah cévního postižení. Nízké dávky glukokortikoidů potlačí revmatickou symptomatologii, ale jsou nedostatečné pro léčbu postižených cév. K manifestaci kraniální symptomatologie může dojít náhle i po mnoha měsících léčby nízkými dávkami glukokortikoidů (32). Přehled klinických projevů uvádí tabulka 2.
Tab. 2. Nejčastější klinické projevy u obrovskobuněčné arteriitidy 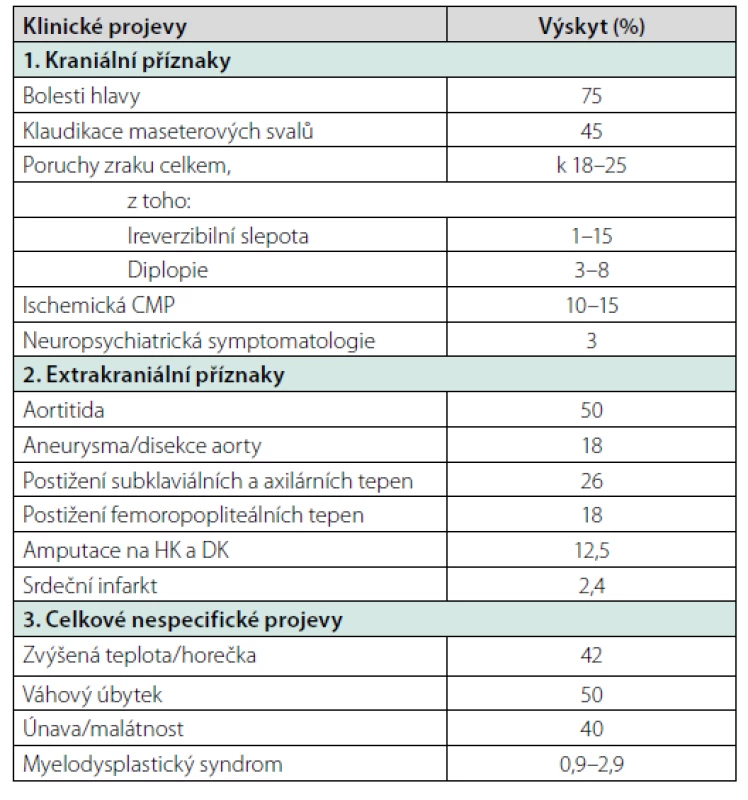
Diagnostika
Diagnostika onemocnění je obtížná, zejména pokud není přítomna kraniální symptomatologie. Stanovení správné diagnózy trvalo od vzniku prvních příznaků u pacientů s přítomnými kraniálními symptomy 7,7 týdne, u pacientů bez kraniální symptomatologie to trvalo 17,6 týdne (33).
I když máme diagnostická kritéria, tabulka 3 (34), nejsou však již dnes všemi akceptována. Téměř 26 % pacientů s pozitivní biopsií TT nesplňovalo uvedená kritéria a naopak, 28 % pacientů, kteří splňovali kritéria ACR, nemělo pozitivní bioptický nález (35).
Tab. 3. Klasifikační kritéria pro obrovskobuněčnou arteriitidu z roku 1990 podle Koleje amerických revmatologů (ACR) (34) 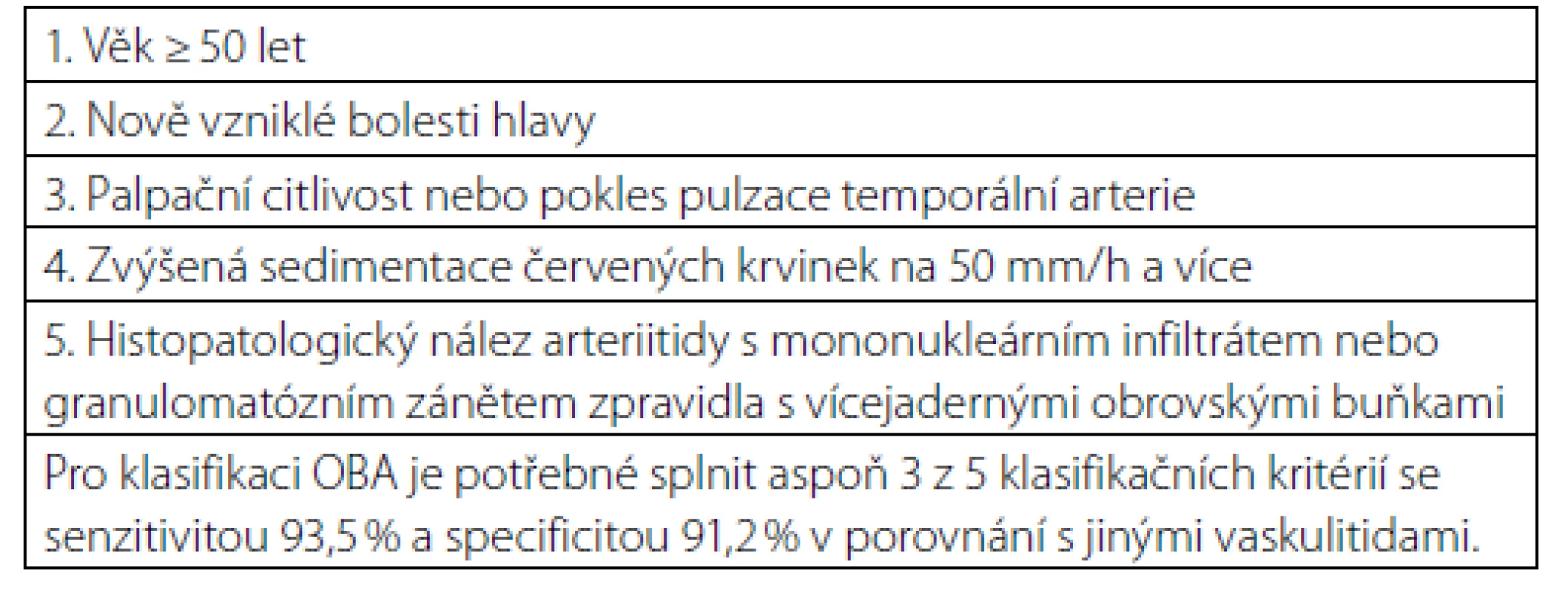
Diagnostika vyžaduje podrobnou anamnézu a fyzikální vyšetření a podle nálezu volíme nejvhodnější diagnostická vyšetření. Z laboratorních vyšetření nemáme žádný specifický marker. Obvykle zjišťujeme zvýšenou sedimentaci erytrocytů, C-reaktivního proteinu, interleukin 6 (IL-6) a zvýšený počet krevních destiček (jako nespecifický marker zánětů). Někdy bývají zvýšené hodnoty jaterních enzymů. Jako slibné a více specifické markery se jeví BAFF (B-buňky aktivující faktor) a CXCL-9 ze skupiny chemokinů. BAFF je důležitý regulátor reakce B-buněk a je vázán na vznik mnohých autoimunitních onemocnění (36). Oba markery se však zatím nevyšetřují rutinně.
Velikost bioptického vzorku
Biopsie temporální tepny s histologickým vyšetřením je většinou stále pokládána za zlatý standard. Senzitivita vyšetření se pohybuje v širokém rozmezí 32–85 %. Vzhledem k tomu, že u postižené tepny se střídají úseky postižené se zdravými, v minulosti se odebíral větší úsek tepny-2-5 cm, aby se zvýšila pravděpodobnost zachycení patologických změn. V současnosti je tendence odebírat kratší úsek, evropské i britské doporučené postupy požadují jednotně odběr aspoň 1cm délky tepny (37, 38). Nedávno provedená retrospektivní analýza ukázala, že optimální velikost odběru je 1,5–2 cm (39) a delší úsek již významně nezvyšuje pravděpodobnost diagnózy. Negativní bioptický nález nevylučuje diagnózu OBA. Proto pokud máme silné klinické a laboratorní indicie svědčící pro OBA, pokračujeme dále v léčbě, i přes negativitu bioptického nálezu (40). V diferenciální diagnostice vždy zvažujeme i paraneoplastický syndrom, zejména u pacientů s klinickou manifestací revmatické polymyalgie.
Také stanovení patologicko-anatomické diagnózy může být obtížné (41). Jde o granulomatózní zánět, který postihuje celou stěnu tepny (zánět začíná od adventicie a postupuje směrem dovnitř). Maximum zánětu je v oblasti lamina elastica interna, která je často destruovaná a v její blízkosti se nejčastěji vyskytují obrovské vícejaderné buňky (fuzované makrofágy). V jejich cytoplazmě se mohou nacházet zbytky elastické laminy. Výrazná intimální hyperplazie může dále zmenšovat cévní průsvit. Pro diagnózu není nutná přítomnost obrovských buněk, ale zánětlivé změny postihující všechny 3 vrstvy tepny.
Pro stanovení diagnózy již není nutná biopsie TT
Poslední doporučení EULARu (42) konstatují, že v případě podezření má být diagnóza potvrzena zobrazovacími metodami nebo biopsií temporální arterie. V prvním sledu doporučují použít ultrazvuk nebo MRI, alternativně CT nebo PET. CT a PET nejsou vhodné pro vyšetřování kraniálních tepen. Ve specializovaných centrech doporučují upřednostnit vyšetření zobrazovacími metodami před biopsií TT, protože jsou neinvazivní, přinášejí informaci o rozsahu postižení velkých tepen a snižují riziko falešně negativních výsledků. Všechny tyto vyšetřovací metody mají být provedeny co nejdříve, nejlépe do 1 týdne po zahájení léčby glukokortikoidy, protože senzitivita vyšetření pak prudce klesá (42). Platí to i pro ultrazvukové vyšetření, kdy např. tzv. „haló efekt“ (charakteristický hypoechogenní nález na stěně edematózně změněné tepny při vyšetření pomocí barevné duplexní ultrasonografie) vymizel již po několika dnech léčby glukokortikoidy (43). Zcela nový pohled na OBA umožnilo 18 - FDG-PET/CT. Toto vyšetření ukázalo, které tepny jsou nejčastěji postižené, i rozsah jejich postižení. Mezi nejčastěji postižené tepny patří aorta (50 %) a tepny odstupující z oblouku aorty a jejich větve. Také temporální arterie patří mezi často postižené. Na otázku, které tepny onemocnění postihuje, lze odpovědět, že postižené mohou být kterékoliv tepny v organismu, např. ovariální (44). PET/CT také ukázalo, že nemoc může být lokalizována jen na postižení aorty a např. na postižení subklaviálních tepen, a o to těžší bývá stanovení správné diagnózy. Proto někteří autoři nepokládají biopsii temporální tepny již za zlatý standard, ale obě metody za rovnocenné a komplementární (45).
Léčba
Léčbu zahajujeme vysokými dávkami glukokortikoidů. Léčba by se měla zahájit co nejdříve, abychom zabránili případným komplikacím choroby. Pokud máme silné klinické podezření, případně doplněné další vyšetřovací metodou, nečekáme na provedení biopsie TT. Na základě dřívějších prací (46–48) se tradoval názor, že biopsii lze provést ještě 2–6 týdnů po zahájení léčby, kdy ještě může být histologický nález pozitivní. V současnosti se doporučuje provést biopsii do týdne od zahájení léčby.
Léčbu zahajujeme vysokými dávkami glukokortikoidů – 40–60 mg prednizonu (nebo jeho ekvivalentu) /denně. V případě oční symptomatologie podáváme pulzy metylprednizolonu (500–1 000 mg/denně po dobu tří dnů), potom pokračujeme v perorální léčbě. Klinický důkaz, že pulzní léčba metylprednizolonem je účinnější v porovnání s perorální, však chybí.
Vysoké dávky prednizonu obvykle nepodáváme déle než 4 týdny. Pokud je onemocnění dobře kontrolované, doporučuje EULAR postupné snižování dávek prednizonu na dávku 15–20 mg/d během 2–3 měsíců. Potom snižujeme postupně dávku tak, abychom během jednoho roku dosáhli dávky 5mg a méně prednizonu za den (49). Tuto dávku pokládá EULAR za relativně bezpečnou (50). Potom se pokusíme o redukci dávky o 1mg prednizonu za 1–2 měsíce.
Při snižování dávek hrozí relapsy onemocnění, ke kterým dochází až u 50 % pacientů. Samotné zvýšení CRP bez klinické manifestace lze pokládat za relaps jen v případě vyloučení jiných příčin zvýšení CRP.
Při relapsu se vracíme na původní vyšší dávku. Ke zvládnutí relapsu obvykle stačí zvýšení dávky o 5–10 mg (např. u bolestí hlavy). V případě, že se u pacienta objeví oční, cerebrovaskulární příznaky nebo klaudikace maseterů, vracíme se až na úvodní dávku (0,75–1 mg/kg) prednizonu. (51). Relapsy zvláště hrozí při dávce 20 mg prednizonu a nižší. Proto dávku snižujeme opatrně. Někteří autoři doporučují snižování posledních 10 mg rychlostí 1 mg/měsíc. Průměrná doba léčby je 2–3 roky. Při opakovaném relapsu kombinujeme léčbu s methotrexátem nebo tocilizumabem.
Glukokortikoidy mají známé nežádoucí účinky. Ve snaze snížit dávku steroidů byla vyzkoušena celá řada dalších přípravků v kombinaci s glukokortikoidy. Kombinace s azatioprinem, cyklofosfamidem a mykofenolát mofetilem nebyly úspěšné. Naproti tomu kombinace s metotrexátem (v dávce 7,5–15 mg 1× týdně) se osvědčila. Tato kombinace snižovala riziko relapsu téměř dvojnásobně v porovnání se skupinou bez metotrexátu (52) a snižovala i celkovou kumulativní dávku glukokortikoidů (53).
Z modernějších léčiv se uplatnil tocilizumab (monoklonální humanizovaná protilátka proti receptoru IL-6). Jeho účinnost v léčbě OBA byla potvrzena v několika klinických studiích, z nich největší byla studie GiACTA, která zahrnovala 251 pacientů (54). Jeho dobrý léčebný efekt trochu kazí častější výskyt nežádoucích účinků (podobně jako u léčby revmatoidní artritidy), tj. infekční komplikace, neutropenie, trombocytopenie, zvýšení jaterních enzymů atd. Také není jasné, jak dlouho se má tocilizumab podávat a z praktického hlediska je též nevýhodou, že při této léčbě nelze hodnotit vznik relapsu podle markerů zánětu (sedimentace erytrocytů, CRP).
Výsledky léčby s ustekinumabem (humánní monoklonální protilátka proti IL-12 a IL-23) nebyly přesvědčivé a americký FDA ho zatím pro léčbu OBA nepovolil. V klinickém zkoušení jsou další přípravky, např. abatacept (blokuje kostimulační systém aktivace T lymfocytů CD28-CD80/86) (55).
Glukokortikoidy zůstávají zlatým standardem pro navození remise u OBA. U pacientů s relapsem je často kombinujeme s metotrexátem nebo velice úspěšným tocilizumabem, což má za cíl udržet remisi a snížit kumulativní dávku glukokortikoidů. Nedávná práce japonských autorů ukázala, že pacienti s postižením velkých tepen (aorty a jejích větví) mají mnohem menší odezvu na klasickou léčbu a domnívají se, že tito pacienti od začátku vyžadují mnohem intenzivnější léčbu (56). Také opakované biopsie temporální tepny v průběhu léčby ukázaly, že zatímco klinické projevy po léčbě glukokortikoidy poměrně rychle ustoupí, zánětlivé změny v tepnách přetrvávají mnohem déle. Lymfocytární infiltráty v cévách přetrvávaly ještě 12 měsíců po léčbě glukokortikoidy (57).
V minulosti se standardně podávala protidestičková léčba (malé dávky kyseliny acetylsalicylové). Dnes se rutinně nepodává, jenom v případě indikace z jiných příčin nebo za zvláštních okolností (např. cévní ischemické komplikace, vysoké kardiovaskulární riziko atd.), po individuálním posouzení pacienta (37). Nedávná práce z Izraele ukázala, že 100 mg aspirinu denně snižovalo mortalitu ve sledovaném dvouletém intervalu a přežití pacientů se zvýšilo ze 66 na 90 % (58). Proto ji někteří autoři nadále doporučují, pokud pacient nemá kontraindikace (59). V tomto duchu je dokonce součástí doporučených postupů ve Švédsku (60).
Prognóza: Výsledky klinických studií zabývajících se touto problematikou jsou často diskrepantní. Medián přežití u pacientů s OBA byl 3,7 let, u kontrolní skupiny bez OBA – 8,34 let. Pětileté přežití u kontrolní skupiny bylo 67 %, u pacientů s OBA jenom 35 % (61). Na druhé straně nedávná meta-analýza klinických studií nezjistila rozdíl v dlouhodobé mortalitě u pacientů s OBA a ostatní populací (62). Práce z jižního Švédska prokázala významně vyšší krátkodobou mortalitu u nemocných s OBA, ale dlouhodobá mortalita se nelišila od kontrolní skupiny (63).
Závěr
OBA je onemocnění vyžadující rychlou diagnostiku a léčbu. Při podezření na diagnózu OBA se dnes prosazuje rychlé odeslání pacienta do specializovaného centra. V našich podmínkách to budou dobře vybavené okresní a krajské nemocnice, případně specializovaná pracoviště ve fakultních nemocnicích, která zaručují dostupnost potřebných i konziliárních vyšetření jiných oborů (revmatolog, oftalmolog, neurolog a další odbornosti podle potřeby). Tam by měl pacient dorazit nejlépe ještě v ten samý den, kdy kontaktoval svého praktického lékaře. V centru by měl absolvovat důležitá diagnostická vyšetření do tří dnů. I když v léčbě stále dominují glukokortikoidy, úspěch tocilizumabu nastínil další směr léčby, kdy se budou postupně prosazovat cíleně podávané biologické přípravky proti jednotlivým cytokinům, důležitým v patogeneze granulomatózního zánětu.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Štefan Alušík, CSc.
Katedra vnitřního lékařství, Institut postgraduálního vzdělávání ve zdravotnictví
Ruská 85, 100 05 Praha 10
Článek přijat redakcí: 9. 3. 2021
Článek přijat po recenzích: 21. 5. 2021
Zdroje
1. Jennette JC, Falk RJ, Bacon PA et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 66(1): 1–11.
2. Hunder GG.The Early History of Giant Cell Arteritis and Polymyalgia Rheumatica: First Descriptions to 1970. Mayo Clin Proc. 2006; 81(8): 1071–108.
3. Hutchinson J. Diseases of the arteries. Arch Surg (London) 1889/90; 1 : 323–329.
4. Horton BT, Magath TB, Brown GE. An undescribed form of arteritis of the temporal vessels. Proc Staff Meet Mayo Clin. 1932; 7 : 700–701.
5. Gilmour JR. Giant-cell chronic arteritis. J Pathol Bacteriol. 1941; 53 : 263–277.
6. Kilbourne ED, Wolff HG. Cranial arteritis: A critical evaluation of the syndrome of „temporal arteritis“ with report of a case. Ann Intern Med 1946; 24(1): 1–10.
7. Andersen T. Arteritis temporalis (Horton): a survey and a case with glaucoma. Acta Med Scand. 1947; 128 : 151–178.
8. McMillan GC. Diffuse granulomatous aortitis with giant cells associated with partial rupture and dissection of the aorta. AMA Arch Pathol. 1950; 49(1): 63–69.
9. Olhagen B. Polymyalgia rheumatica: a form of senile arteritis? Acta Rheumatol Scand. 1963; 9 : 157–164.
10. Hamrin B, Jonsson N, Landberg T. Arteritis in “polymyalgia rheumatica.” Lancet 1964; 1 : 397–401.
11. Alestig K, Barr J.Giant-cell arteritis. A biopsy study of polymyalgia rheumatica, including one case of Takayasu‘s disease. Lancet. 1963; 1(7293): 1228–1230.
12. Cantini F, Niccoli L, Storri L et al. Are Polymyalgia Rheumatica and Giant Cell Arteritis the Same Disease? Semin Arthritis Rheum 2004; 33(5): 294–301.
13. Kermani TA. Takayasu arteritis and giant cell arteritis: are they a spectrum of the same disease? Int J Rheum Dis 2019; 22 : 41–48.
14. Sharma A, Mohammad AJ, Turesson C. Incidence and prevalence of giant cell arteritis and polymyalgia rheumatica: A systematic literature review. Semin Arthritis Rheum. 2020; 50(5): 1040–1048.
15. Crowson CS, Matteson EL. Contemporary prevalence estimates for giant cell arteritis and polymyalgia rheumatica, 2015. Semin Arthritis Rheum. 2017; 47(2): 253–256.
16. Mackie SL, Taylor JC, Haroon-Rashid L et al. Association of HLA-DRB1 amino acid residues with giant cell arteritis: genetic association study, meta-analysis and geo-epidemiological investigation. Arthritis Res Ther. 2015; 17(1): 195.
17. Verdijk RM, Ouwendijk WJD, Kuijpers RWAM, Verjans GMGM. No Evidence of Varicella - Zoster Virus Infection in Temporal Artery Biopsies of Anterior Ischemic Optic Neuropathy Patients With and Without Giant Cell Arteritis. J Infect Dis. 2021; 4; 223(1): 109–112.
18. Watanabe R, Goronzy JJ, Berry G, Liao YJ, Weyand CM. Giant Cell Arteritis: From Pathogenesis to Therapeutic Management. Curr Treatm Opt Rheumatol. 2016; 2(2): 126–137.
19. Imai N, Kuroda R, Konishi T, Serizawa M, Kobari M. Giant cell arteritis: clinical features of patients visiting a headache clinic in Japan. Intern Med 2011; 50(16): 1679–1682.
20. Mollan SP, Paemeleire K, Versijpt J et al. European Headache Federation recommendations for neurologists managing giant cell arteritis. J Headache Pain 2020; 21, 28.
21. Birkhead NC, Wagener HP, Shick RM. Treatment of temporal arteritis with adrenal corticosteroids: Results in 55 cases in which the lesion was proved at biopsy. J Am Med Assoc. 1957; 163(10): 821–827.
22. Singh AG, Kermani TA, Crowson CS et al. Visual manifestations in giant cell arteritis: trend over 5 decades in a population-based cohort. J Rheumatol 2015; 42 : 309–315.
23. Patil P, Williams M, Maw WW et al. Fast track pathway reduces sight loss in giant cell arteritis: results of a longitudinal observational cohort study. Clin Exp Rheumatol. 2015; 33 (2 Suppl 89): S-103-6.
24. Vodopivec J, Rizzo, III.JF. Ophthalmic manifestations of giant cell arteritis, Rheumatology 2018; 57: ii63–ii72.
25. Chen JJ, Leavitt JA, Fang C et al. Evaluating the Incidence of Arteritic Ischemic Optic Neuropathy and Other Causes of Vision Loss from Giant Cell Arteritis. Ophthalmology 2016; 123(9): 1999–2003.
26. Peral-Cagigal B, Pérez-Villar Á, Redondo-González LM et al. Temporal headache and jaw claudication may be the key for the diagnosis of giant cell arteritis. Med Oral Patol Oral Cir Bucal. 2018;23(3): e290–e294.
27. Larivière, Delphine et al. Extra-and intracranial cerebral vasculitis in giant cell arteritis: an observational study. Medicine 2014; 93(28): e265.
28. Lie JT. Aortic and extracranial large vessel giant cell arteritis: a review of 72 cases with histopathologic documentation. Semin Arthritis Rheum. 1995; 24(6): 422–431.
29. Nuenninghoff DM, Hunder GG, Christianson TJ et al. Mortality of large-artery complication (aortic aneurysm, aortic dissection, and/or large-artery stenosis) in patients with giant cell arteritis: a population-based study over 50 years. Arthritis Rheum 2003; 48 : 3532–3537.
30. Greigert H, Zeller M, Putot A et al. Myocardial infarction during giant cell arteritis: A cohort study. Eur. J. Intern Med 2021; 17: S0953-6205(21)00038-8.
31. Zenone T. Fever of unknown origin in rheumatic diseases. Infect Dis Clin North Am. 2007; 21(4): 1115–1135, x–xi.
32. Milchert M, Brzosko M. Tunnel Vision in a Patient with Polymyalgia Rheumatica. J Rheumatol. 2020; 47(1): 155–156.
33. Prior JA, Ranjbar H, Belcher J et al. Diagnostic delay for giant cell arteritis – a systematic review and meta-analysis. BMC Med 2017; 15 : 120.
34. Hunder GG, Bloch DA, Michel BA, Stevens MB, Arend WP, Calabrese LH et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum. 1990; 33 : 1122–1128.
35. Murchison AP, Gilbert ME, Bilyk JR et al. Validity of the American College of Rheumatology criteria for the diagnosis of giant cell arteritis. Am J Ophthalmol. 2012; 154(4): 722–729.
36. van der Geest KSM, Wayel H, Abdulahad WV et al. Serum markers associated with disease activity in giant cell arteritis and polymyalgia rheumatica, Rheumatology 2015; 54(8): 1397–1402.
37. Hellmich B, Agueda A, Monti S et al. 2018 Update of the EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2020; 79 (1): 19–30.
38. Mackie SL, Dejaco C, Appenzeller S et al. British Society for Rheumatology guideline on diagnosis and treatment of giant cell arteritis, Rheumatology 2020; 59(3): e1–e23.
39. Chu R, Foster C, Ali M et al. Optimal length and usefulness of temporal artery biopsies in the diagnosis of giant cell arteritis: a 10 - year retrospective review of medical records. Lancet Rheumatol 2020; 2(12): E 744–E 778.
40. Dasgupta B. Giant Cell Arteritis Guideline Development Group. Concise guidance: diagnosis and management of giant cell arteritis. Clin Med (Lond). 2010; 10(4): 381–386.
41. Stacy RC, Rizzo JF, Dean M, Cestari DM. Subtleties in the Histopathology of Giant Cell Arteritis. Seminars in Ophthalmology 2011; 26 : 4–5, 342–348.
42. Dejaco C, Ramiro S, Duftner C et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice Ann Rheum Dis2018; 77(5): 636–643.
43. Luqmani R, Lee E, Singh S et al. The Role of Ultrasound Compared to Biopsy of Temporal Arteries in the Diagnosis and Treatment of Giant Cell Arteritis (TABUL): a diagnostic accuracy and cost-effectiveness study. Health Technol Assess. 2016; 20(90): 1–238.
44. Theunissen P, Kliffen M, Dees A. Giant-cell Arteritis of the Ovarian Arteries: A Rare Manifestation of a Common Disease. Eur J Case Rep Intern Med. 2018; 5(5): 000779.
45. Blockmans, D. Use of FDG-PET Scan for the Assessment of Large Vessel Vasculitis. Curr Treat Options in Rheum 2016; 2 : 153–160.
46. Ray-Chaudhuri N, Kiné DA, Tijani SO et al. Effect of prior steroid treatment on temporal artery biopsy findings in giant cell arteritis. Br J Ophthalmol. 2002; 86(5): 530–532.
47. Achkar AA, Lie JT, Hunder GG, O‘Fallon WM, Gabriel SE. How does previous corticosteroid treatment affect the biopsy findings in giant cell (temporal) arteritis? Ann Intern Med. 1994; 120(12): 987–992.
48. Narváez B, Bernad D, Roig-Vilaseca C et al. Influence of previous corticosteroid therapy on temporal artery biopsy yield in giant cell arteritis. Semin Arthritis Rheum 2007; 37 : 13–19.
49. Hellmich B, Águeda AF, Monti S et al. Treatment of Giant Cell Arteritis and Takayasu Arteritis — Current and Future. Curr Rheumatol Rep 2020; 22, 84.
50. Strehl C, Bijlsma JWJ, de Wit M et al. Defining conditions where long-term glucocorticoid treatment has an acceptably low level of harm to facilitate implementation of existing recommendations: viewpoints from an EULAR task force. Ann Rheum Dis. 2016; 75(6): 952–957.
51. Ponte C, Rodrigues AF, O’Neill L, Luqmani RA. Giant cell arteritis: Current treatment and management. World J Clin Cases 2015; 3(6): 484–494.
52. Koster MJ, Yeruva K, Crowson CS, Muratore F, Labarca C, Warrington KJ. Efficacy of Methotrexate in Real-world Management of Giant Cell Arteritis: A Case-control Study. J Rheumatol. 2019; 46(5): 501–508.
53. Mahr AD, Jover JA, Spiera RF et al. Adjunctive Methotrexate for Treatment of Giant Cell Arteritis. An Individual Patient Data Meta-Analysis.Arth Rheum 2007; 56(8): 2789–2797.
54. Stone JH, Tuckwell K, Dimonaco S et al. Trial of Tocilizumab in Giant-Cell Arteritis. N Engl J Med. 2017; 27; 377(4): 317–328.
55. Harrington R, Al Nokhatha SA, Conway R. Biologic Therapies for Giant Cell Arteritis. Biologics. 2021; 15 : 17–29.
56. Sugihara T, Hasegawa H, Uchida HA et al. Associated factors of poor treatment outcomes in patients with giant cell arteritis: clinical implication of large vessel lesions. Arthritis Res Ther 2020; 22(72): 1–12.
57. Maleszewski JJ, Younge BR, Fritzlen JT et al. Clinical and pathological evolution of giant cell arteritis: a prospective study of follow-up temporal artery biopsies in 40 treated patients. Mod Pathol. 2017; 30(6): 788–796.
58. Nesher G, Poltorak V, Hindi I et al. Survival of patient with giant cell arteritis: Impact of vision loss and treatment with aspirin. Autoimmun Rev. 2019; 18(8): 831–834.
59. Dinkin M, Johnson E. One Giant Step for Giant Cell Arteritis: Updates in Diagnosis and Treatment. Curr Treat Options Neurol 2021; 23 : 6.
60. Turesson C, Börjesson O, Larsson K, Mohammad AJ, Knight A. Swedish Society of Rheumatology 2018 guidelines for investigation, treatment, and follow-up of giant cell arteritis. Scand J Rheumatol. 2019; 48(4): 259–265.
61. Crow RW, Katz BJ, Warner JE et al. Giant cell arteritis and mortality. J Gerontol A Biol Sci Med Sci. 2009; 64(3): 365–369.
62. Hill CL, Black RJ, Nossent JC, Ruediger C, Nguyen L, Ninan JV et al. Risk of mortality in patients with giant cell arteritis: A systematic review and meta-analysis. Semin Arthritis Rheum 2017; 46 : 513–519.
63. Mohammad AJ, Nilsson JA, Jacobsson LT, Merkel PA, Turesson C. Incidence and mortality rates of biopsy-proven giant cell arteritis in southern Sweden. Ann Rheum Dis 2015; 74 : 993–997.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Použití léků vyvinutých pro jiné indikace v léčbě infekce covid-19
- Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění
- Léčba střevních zánětů ve 21. století – individualizovaná terapie a telemedicína
- Biologická léčba dyslipidemií
- Sledování dynamiky klinických a laboratorních markerů chronického srdečního selhání při 12měsíční léčbě sacubitril/valsartanem
- Význam a úspěšnost léčby hypertenze nejen u pacientů s diabetes mellitus 2. typu
- Obrovskobuněčná arteriitida: kontroverzní otázky
- Chronická obstrukční plicní nemoc – diagnóza a léčba stabilní fáze onemocnění; personalizovaný přístup k léčbě s využitím fenotypických rysů nemoci Souhrn pozičního dokumentu České pneumologické a ftizeologické společnosti 2020–2021
- Thymom – onemocnění mnoha tváří
- Efektivní komunikace lékař – pacient při časné intervenci hypertenze a dyslipidemie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronická obstrukční plicní nemoc – diagnóza a léčba stabilní fáze onemocnění; personalizovaný přístup k léčbě s využitím fenotypických rysů nemoci Souhrn pozičního dokumentu České pneumologické a ftizeologické společnosti 2020–2021
- Thymom – onemocnění mnoha tváří
- Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění
- Biologická léčba dyslipidemií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



